Власна концентрація кремнію. Знаєш як
Процесор? Пісок? А які у вас із цим словом асоціації? А може, Кремнієва долина?
Як би там не було, з кремнієм ми стикаємося щодня і якщо вам цікаво дізнатися, що таке Si і з чим його їдять, прошу під кат.
Вступ
Будучи студентом одного з московських вузів зі спеціальністю «Наноматеріали», я хотів познайомити тебе, дорогий читачу, з найважливішими хімічними елементами нашої планети. Я довго вибирав з чого почати, вуглець або кремній, і все-таки вирішив зупинитися саме на Si, тому що серце будь-якого сучасного гаджета засноване саме на ньому, якщо можна так сказати звичайно. Викладати думки постараюся гранично просто і доступно, написавши цей матеріал я розраховував, в основному на новачків, але й більш просунуті люди зможуть почерпнути щось цікаве, так само хотілося б сказати, що стаття написана виключно для розширення інтересів, що зацікавилися. І так приступимо.
Silicium
Кремній (лат. Silicium), Si, хімічний елемент IV групи періодичної системи Менделєєва; атомний номер 14, атомна маса 28,086.
У природі елемент представлений трьома стабільними ізотопами: 28Si (92,27%), 29Si (4,68%) та 30Si (3,05%).
Щільність (за н.у.) 2,33 г/см?
Температура плавлення 1688 К

Порошковий Si
Історична довідка
Сполуки Кремнія, поширені землі, були відомі людині з кам'яного віку. Використання кам'яних знарядь праці та полювання тривало кілька тисячоліть. Застосування сполук Кремнію, пов'язане з їх переробкою, – виготовлення скла – почалося близько 3000 років до н. е. (Давньому Єгипті). Раніше відоме з'єднання Кремнію - оксид SiO2 (кремнезем). У 18 столітті кремнезем вважали простим тілом і відносили до «землям» (що й відбито у його назві). Складність складу кремнезему встановив І. Я. Берцеліус. Він же вперше, в 1825, отримав елементарний кремній із фтористого кремнію SiF4, відновлюючи останній металевим калієм. Новому елементу було названо «силіцій» (від латів. silex - кремінь). Російську назву ввів Г. І. Гесс у 1834 році.

Кремній дуже поширений у природі у складі звичайного піску
Поширення Кремнію у природі
За поширеністю в земній корі Кремній – другий (після кисню) елемент, його середній вміст у літосфері 29,5% (за масою). У земній корі Кремній грає таку ж першорядну роль, як вуглець у тваринному та рослинному світі. Для геохімії Кремнію важливим є виключно міцний зв'язок його з киснем. Близько 12% літосфери становить кремнезем SiO2 у формі мінералу кварцу та його різновидів. 75% літосфери складають різні силікати та алюмосилікати (польові шпати, слюди, амфіболи тощо). Загальна кількість мінералів, що містять кремнезем, перевищує 400.
Фізичні властивості Кремнію
Думаю тут зупинятись особливо не варто, все Фізичні властивостіє у вільному доступі, а я ж перелічу найголовніші.
Температура кипіння 2600 °С
Кремній прозорий для довгохвильових ІЧ-променів
Діелектрична проникність 11,7
Твердість Кремнію за Моосом 7,0
Хотілося б сказати, що кремній тендітний матеріал, помітна пластична деформація починається за температури вище 800°С.
Кремній – напівпровідник, саме тому він знаходитиме велике застосування. Електричні властивості кремнію дуже залежить від домішок.
Хімічні властивості.
Тут багато, звичайно, можна сказати, але зупинюся на найцікавішому. У сполуках Si (аналогічно вуглецю) 4-валентний.
На повітрі кремній завдяки утворенню оксидної захисної плівки стійкий навіть при підвищених температурах. У кисні окислюється починаючи з 400 °С, утворюючи оксид кремнію (IV) SiO2.
Кремній стійкий до кислот і розчиняється лише у суміші азотної та фтористоводневої кислот, легко розчиняється у гарячих розчинах лугів із виділенням водню.
Кремній утворює 2 групи кисневмісних силанів - силоксани та силоксени. З азотом Кремній реагує при температурі вище 1000 °С. його цінним матеріалом для хімічної промисловості, а також для виробництва вогнетривів. Високою твердістю, а також термічною та хімічною стійкістю відрізняються сполуки Кремнію з вуглецем (карбід кремнію SiC) та з бором (SiB3, SiB6, SiB12).
Отримання Кремнію
Я думаю це найцікавіша частина, тут зупинимося докладніше.
Залежно від призначення розрізняють:
1.
Кремній електронної якості(т.з. електронний кремній») - найбільш якісний кремній із вмістом кремнію понад 99,999 % за вагою, питомий електричний опір кремнію електронної якості може перебувати в інтервалі приблизно від 0,001 до 150 Ом см, але при цьому величина опору повинна бути забезпечена виключно заданою домішкою, тобто потрапляння в кристал інших домішок, хоча й які забезпечують заданий питомий електричний опір, зазвичай, неприпустимо.
2.
Кремній сонячної якості(т.з. «сонячний кремній») - кремній із вмістом кремнію понад 99,99% за вагою, що використовується для виробництва фотоелектричних перетворювачів (сонячних батарей).

3.
Технічний кремній- блоки кремнію полікристалічної структури, отриманого методом карботермічного відновлення з чистого кварцового піску; містить 98% кремнію, основна домішка - вуглець, відрізняється високим вмістом легуючих елементів - бору, фосфору, алюмінію; в основному використовується для одержання полікристалічного кремнію.
Кремній технічної чистоти (95-98%) одержують електричної дузі відновленням кремнезему SiO2 між графітовими електродами. У зв'язку з розвитком напівпровідникової техніки розроблено методи одержання чистого та особливо чистого кремнію. Це вимагає попереднього синтезу чистих вихідних сполук кремнію, з яких витягають кремній шляхом відновлення або термічного розкладання.
Полікристалічний кремній («полікремній») - найбільш чиста форма кремнію, що промислово виробляється, - напівфабрикат, що отримується очищенням технічного кремнію хлоридними і фторидними методами і використовується для виробництва моно- і мультикристалічного кремнію.
Традиційно полікристалічний кремній отримують з технічного кремнію шляхом переведення його в леткі силани (моносилан, хлорсилани, фторсилани) з наступними поділом силанів, що утворюються, ректифікаційним очищенням обраного силану і відновленням силану до металевого кремнію.
Чистий напівпровідниковий кремній одержують у двох видах: полікристалічний(відновленням SiCl4 або SiHCl3 цинком або воднем, термічним розкладанням SiI4 та SiH4) та монокристалічний(Бестигельною зонною плавкою та «витягуванням» монокристалу з розплавленого кремнію - метод Чохральського).

Тут можна побачити процес вирощування кремнію методом Чохральського.
Метод Чохральського- метод вирощування кристалів шляхом витягування їх вгору від вільної поверхні великого обсягу розплаву з ініціацією початку кристалізації шляхом приведення затравального кристала (або кількох кристалів) заданої структури та кристалографічної орієнтації в контакт із вільною поверхнею розплаву.
Застосування Кремнію
Спеціально легований кремній широко застосовується як матеріал для виготовлення напівпровідникових приладів (транзистори, термістори, силові випрямлячі струму, тиристори; сонячні фотоелементи, що використовуються в космічних кораблях, а також багато всякої всячини).
Оскільки кремній прозорий для променів із довжиною хвилі від 1 до 9 мкм, його застосовують в інфрачервоній оптиці.
Кремній має різноманітні і всі області застосування, що розширюються. У металургії Si
використовується для видалення розчиненого у розплавлених металах кисню (розкислення).
Кремній є складовоювеликої кількості сплавів заліза та кольорових металів.
Зазвичай Кремній надає сплавам підвищеної стійкості до корозії, покращує їх ливарні властивості та підвищує механічну міцність; проте при більшому змісті Кремній може викликати крихкість.
Найбільше значення мають залізні, мідні та алюмінієві сплави, що містять ремінний.
Кремнезем переробляються скляною, цементною, керамічною, електротехнічною та іншими галузями промисловості.
Надчистий кремній переважно використовується для виробництва одиночних електронних приладів (наприклад, процесор твого комп'ютера) та однокристальних мікросхем.
Чистий кремній, відходи надчистого кремнію, очищений металургійний кремній як кристалічного кремнію є основним сировинним матеріалом для сонячної енергетики.
Монокристалічний кремній - крім електроніки та сонячної енергетики використовується для виготовлення дзеркал газових лазерів.

Надчистий кремній та продукт його виробництва
Кремній в організмі
Кремній в організмі знаходиться у вигляді різних сполук, що беруть участь головним чином у освіті твердих скелетних частин і тканин. Особливо багато кремнію можуть накопичувати деякі морські рослини (наприклад, діатомові водорості) та тварини (наприклад, кремнерогові губки, радіолярії), що утворюють при відмиранні на дні океану потужні відкладення оксиду кремнію (IV). У холодних морях та озерах переважають біогенні мули, збагачені кремнієм, у тропічних морях – вапняні мули з низьким вмістом кремнію. Серед наземних рослин багато кремнію накопичують злаки, осоки, пальми, хвощі. У хребетних тварин вміст оксиду кремнію (IV) у зольних речовин 0,1-0,5%. У найбільших кількостях кремній виявлений у щільній сполучної тканини, нирках, підшлунковій залозі. У добовому раціоні людини міститься до 1 г кремнію. При високому вмісті в повітрі пилу оксиду кремнію (IV) вона потрапляє у легені людини та викликає захворювання – силікоз.
Висновок
Ну от і все, якщо ви дочитали до кінця і трохи вникли, то ви на крок ближче до успіху. Сподіваюся, писав я не дарма і піст сподобався хоч комусь. Дякую за увагу.
КРЕМНІЙ. (Silicium), Si – хім. елемент IV групи періодичної системи елементів; ат. н. 14, ат. м. 28,086. Кристалічний кремній-темно-сіра речовина зі смолистим блиском. У більшості сполук виявляє ступеня окиснення - 4, +2 та +4. Природний кремній складається із стабільних ізотопів 28Si (92,28%), 29Si (4,67%) та 30Si (3,05%). Отримані радіоактивні ізотопи 27Si, 31Si та 32Si з періодами напіврозпаду відповідно 4,5 сек, 2,62 год та 700 років. вперше виділено в 1811 франц. хіміком та фізиком Ж. Л. Гей-Люссаком та франц. хіміком Л. Ж. Тенаром, але ідентифікований лише у 1823 р. швед, хіміком та мінералогом Й. Я. Берцеліусом.
За поширеністю в земній корі (27,6%) кремній-другий (після кисню) елемент. Знаходиться переважно. у формі кремнезему Si02 та ін кисневмісних речовин (силікатів, алюмосилікатів і т. д.). За звичайних умов утворюється стабільна напівпровідникова модифікація До., що відрізняється гранецентрованою кубічною структурою типу алмазу, з періодом а = 5,4307 А. Міжтомна відстань 2,35 А. Щільність 2,328 гсм. При високому тиску (120-150 кбар) переходить у більш щільні напівпровідникові та металеву модифікації. Металева модифікація-надпровідник з т-рою переходу 6,7 К. Зі зростанням тиску точка плавлення знижується з 1415 ± 3 ° С при тиску 1 бар до 810 ° С при тиску 15 104 бар (потрійна точка співіснування напівпровідникового, металевого та рідкого). ). При плавленні відбуваються збільшення координаційного числа та металізація міжатомних зв'язків. Аморфний кремній характером ближнього порядку, що відповідає сильно спотвореної об'ємноцентрованої кубічної структури, близький до рідкого. Дебаївська т-ра близька до 645 К. Коеф. температурного лінійного розширення змінюється зі зміною т-ри за екстремальним законом, нижче т-ри 100 До він стає негативним, досягаючи мінімуму (-0,77 · 10 -6) град -1 при т-рі 80 К; при т-рі 310 К він дорівнює 2,33 · 10-6 град-1, а при т-рі 1273 К-4,8 · 10 град-1. Теплота плавлення 11,9 ккал/г-атом; tкіп.3520 К.
Теплота сублімації та випаровування при т-рі плавлення відповідно 110 і 98,1 ккал/г-атом. Теплопровідність та електропровідність кремнію залежать від чистоти та досконалості кристалів. Зі зростанням т-ри коеф. теплопровідності чистого К. спочатку збільшується (до 8,4 кал/см X X сек · град при т-рі 35 К), а потім зменшується, досягаючи 0,36 і 0,06 кал/см · сек · град при т-рі відповідно 300 і 1200 К. Ентальпія, ентропія та теплоємність К. у стандартних умовах рівні відповідно 770 кал/г-атом, 4,51 та 4,83 кал/г-атом - град. Кремній діамагнітний, магнітна сприйнятливість твердого (-1,1 · 10 -7 е.м.е./г) та рідкого (-0,8 · 10 -7 е.м.е./г). Кремній слабо залежить від т-ри. Поверхнева енергія, щільність та кінематична в'язкість рідкого К. при т-рі плавлення становлять 737 ерг/см2, 2,55 г/см3 та 3 · 10 м2/сек. Кристалічний кремнію типовий напівпровідник з шириною забороненої зони 1,15 ев при т-рі 0 До і 1,08 ев - при т-рі 300 К. При кімнатній т-рі концентрація власних носіїв зарядів близька до 1,4 · 10 10 см - 3, ефективна рухливість електронів і дірок - відповідно 1450 і 480 см 2 /в · сек, а питомий електричний опір - 2,5 · 105 ом · см. Зі зростанням т-ри вони змінюються за експоненційним законом.
Електро властивості кремнію залежать від природи та концентрації домішок, а також від досконалості кристала. Зазвичай для отримання напівпровідникового До. з провідністю р- і n-типу його легують елементами IIIв (бором, алюмінієм, галієм) і Vв (фосфором, миш'яком, сурмою, вісмутом) підгруп, що створюють сукупність відповідно до акцепторних і донорних рівнів, розташованих поблизу кордонів зон . Для легування використовують та інші елементи (напр., ), формують т. в. глибокі рівні, які обумовлюють захоплення і рекомбінацію носіїв зарядів. Це дозволяє отримувати матеріали з високим електро. опором (1010 ом · см при т-рі 80 К) та невеликою тривалістю існування неосновних носіїв зарядів, що важливо для збільшення швидкодії різних пристроїв. Коеф. термоедс кремнію істотно залежить від т-ри і вмісту домішок, збільшуючись зі зростанням електроопору (при р = 0,6 ом - см, а = 103 мкв / град). Діелектрична проникність кремнію (від 11 до 15) слабо залежить від складу та досконалості монокристалів. Закономірності оптичного поглинання кремнію сильно змінюються із зміною його чистоти, концентрації та характеру дефектів будови, а також довжини хвилі.
Кордон непрямого поглинання електромагнітних коливань близька до 1,09 ев, прямого поглинання - до 3,3 ев. У видимій області спектра параметри комплексного показника заломлення (n - ik) дуже істотно залежить від стану поверхні та наявності домішок. Для особливо чистого До. (приλ = 5461 А і т-ре 293 К) n = 4,056 і к = 0,028. Робота виходу електронів близька до 48 ев. Кремній тендітний. Його твердість (т-ра 300 К) за Моосом - 7; НВ = 240; HV щ = 103; І = 1250 кгс/мм2; модуль норм, пружності (полікристалу) 10890 кгс/мм2. Межа міцності залежить від досконалості кристала: на вигин від 7 до 14, на стиск від 49 до 56 кгс/мм2; коеф. стисливості 0,325 1066 см2/кг.
При кімнатній т-рі кремній практично не взаємодіє з газоподібними (виключаючи) і твердими реагентами, крім лугів. При підвищеній т-рі активно взаємодіє з металами та неметалами. Зокрема, утворює карбід SiC (при т-рі вище 1600 К), нітрид Si3N4 (при т-рі вище 1300 К), фосфід SiP (при т-рі вище 1200 К) і арсеніди Si As, SiAS2 (при т-рі вище 1000 К). З киснем реагує при т-рі вище 700 К, утворюючи двоокис Si02, з галогенами - фторид SiF4 (при т-рі вище 300 К), хлорид SiCl4 (при т-рі вище 500 К), бромід SiBr4 (при т-ре 700 К) і нодид SiI4 (при т-рі 1000). Інтенсивно реагує зі мн. металами, утворюючи тверді розчини заміщення у них чи хім. сполуки – силіциди. Концентраційні області гомогенності твердих розчинів залежать від природи розчинника (напр., Німеччині від 0 до 100%, в залозі до 15%, в альфа-цирконії менше 0,1%).
Розчинність металів і неметалів у твердому кремні значно менша і зазвичай ретроградна. При цьому граничні вмісту домішок, що створюють у До. неглибокі рівні, досягають максимуму ( 2 · 10 18 , 10 19 , 2 · 10 19 , 1021, 2 · 10 21 см) області т-рвід 1400 до 1600 К. Домішки з глибокими рівнями відрізняються помітно меншою розчинністю (від 1015 для селену та 5 · 10 16 для заліза до 7 · 10 17 для нікелю та 10 18 см-3 для міді). У рідкому стані кремній необмежено поєднується з усіма металами, часто з дуже великим виділенням тепла. Чистий кремній готують з технічного продукту 99% Si і - 0,03% Fe, Аl і Со), одержуваного відновленням кварцу вуглецем в електро печах. Спочатку з нього відмивають до-там (сумішою соляної та сірчаної, а потім фтористоводневої та сірчаної) домішки, після чого отриманий продукт (99,98%) обробляють хлором. Синтезовані очищають дистиляцією.
Напівпровідниковий кремній одержують відновленням хлориду SiCl4 (або SiHCl3) воднем або термічним розкладанням SiH4 гідриду. Остаточне очищення та вирощування монокристалів здійснюють безтигельною зонною плавною або за методом Чохральського, отримуючи особливо чисті зливки (вміст домішок до 1010-1013 см-3) ср > 10 3 ом · см. Залежно від призначення К. в процесі приготування хлоридів монокристалів у яких вводять дозовані кількості необхідних домішок. Так готують циліндричні зливки діаметром 2-4 і довжиною 3-10 см. Для спец. цілей випускають і більші монокристали. Технічний кремній і особливо його сплави із залізом використовують як розкислювачі сталі та відновників, а також легуючих присадок. Особливо чисті зразки монокристалічного К., легованого різними елементами, знаходять застосування як основу різноманітних слаботочних (зокрема, термоелектричних, радіо-, світло-і фототехнічних) і сильноточних (випрямлячі, перетворювачі) пристроїв.
Силіцій чи кремній
Кремній відноситься до неметалів, його атоми на зовнішньому енергетичному рівні мають 4 електрони. Він може віддавати їх, виявляючи ступінь окислення + 4 і приєднувати електрони, виявляючи ступінь окислення - 4 . Однак здатність приєднувати електрони у кремнію значно менша, ніж у вуглецю. Атоми кремнію мають більший радіус, ніж атоми вуглецю.
Знаходження кремнію у природі .
Кремній дуже поширений у природі. на її частку припадає понад 26% маси земної кори. За поширеністю він посідає друге місце (після кисню). На відміну від вуглецю C у вільному стані у природі не зустрічається. Він входить до складу різних хімічних сполук, в основному різних модифікацій оксиду кремнію (IV) та солей кремнієвих кислот (силікатів).
Одержання кремнію .
У промисловості кремній технічної чистоти (95 - 98%) одержують, відновлюючи SiO 2 коксом в електричних печах при прожарюванні:
SiO 2 + 2C = Si + 2CO
SiO 2 + 2Mg = Si + 2MgO
У такий спосіб отримують аморфний з домішками порошок кремнію бурого кольору. Перекристалізація з розплавлених металів (Zn, Al) його можна перевести в кристалічний стан.
Для напівпровідникової техніки кремній дуже високої чистоти одержують, відновленням при 1000°C тетрахлорид кремнію SiCl 4 парами цинку:
SiCl 4 + 2Zn = Si + 2ZnCl 2
та очищаючи його після цього спеціальними методами.
Фізичні та Хімічні властивостікремнію.
Чистий кристалічний кремній - тендітний і твердий, дряпає скло. Подібно до алмазу, він має кубічну кристалічну решітку з ковалентним типом зв'язку. Температура його плавлення 1423 °C. За звичайних умов кремній малоактивний елемент, що з'єднується тільки з фтором, але при нагріванні вступає у різні хімічні реакції.
Його використовують як цінний матеріал у напівпровідниковій техніці. Порівняно з іншими напівпровідниками він відрізняється значною стійкістю проти дії кислот і здатністю зберігати великий електричний опір до 300°C. Технічний кремній та феросиліцій використовують також у металургії для жаростійких, кислотостійких та інструментальних сталей, чавунів та багатьох інших сплавів.
З металами кремній утворює хімічні сполуки, Звані силіцидами, при нагріванні з магнієм утворюється силіцид магнію:
Si + 2Mg = Mg 2 Si
Силициди металів за структурою та властивостями нагадують карбіди, так металоподібні силіциди, так само як і металоподібні карбіди, відрізняються великою твердістю, високою температурою плавлення, гарною електропровідністю.
При прожарюванні суміші піску з коксом в електричних печах утворюється сполуки кремнію з вуглецем - карбід кремнію, або карборунд:
SiO 2 + 3C = SiC + 2CO
Карборунд - тугоплавка безбарвна тверда речовина, цінний абразивним і жаростійким матеріалом. Карборунд, як і , має атомні кристалічні грати. У чистому стані це ізолятор, але в присутності домішок стає напівпровідником.
Кремній як і , утворює два оксиди: оксид кремнію (II) SiO та оксид кремнію (IV) SiO 2 . Оксид кремнію (IV) - тверда тугоплавка речовина, широко поширена в природі у вільному стані. Це хімічно стійка речовина, що взаємодіє тільки з фтором і газоподібним фтористим воднем або плавиковою кислотою:
SiO 2 + 2F 2 = SiF 4 + O 2
SiO 2 + 4HF = SiF 4 + 2H 2 O
Наведений напрямок реакцій пояснюється тим, що кремній має велику спорідненість до фтору. Крім того, тетрафторид кремнію - летюча речовина.
У техніці прозорий SiO 2 використовують для виготовлення стійкого тугоплавкого кварцового скла, яке добре пропускає ультрофіалетові промені, має великий коефіцієнт розширення, тому витримує значні миттєві зміни температури. Аморфна модифікація оксиду кремнію (II) трепел має велику пористість. Його використовують як тепло і звукоізолятор для виробництва динаміту (носій вибухової речовини) і так далі. Оксид кремнію (IV) у вигляді звичайного піску – один з основних будівельних матеріалів. Його використовують у виробництві вогнестійких та кислотостійких матеріалів, скла, як флюс у металургії і так далі.
Порівнюючи молекулярні формули, хімічні та фізичні властивості оксиду вуглецю (IV) та оксиду кремнію (IV) легко побачити, що властивості цих подібних по хімічного складуз'єднань різні. Це пояснюється тим, що оксид кремнію (IV) складається не просто з молекул SiO 2 , та якщо з їх асоціатів, у яких атоми кремнію з'єднуються між собою атомами кисню. Оксиду кремнію (IV) (SiO 2 )n. Зображення її на площині таке:
Другий представник елементів головної підгрупи IV групи (IVА групи) Періодичної системи Д. І. Менделєєва – кремній Si.
У природі кремній – другий за поширеністю після кисню хімічний елемент. Земна кора більш ніж чверть складається з його сполук. Найбільш поширеною сполукою кремнію є оксид кремнію (IV) SiO 2 , інша його назва - кремнезем. У природі він утворює мінерал кварц (мал. 158), багато різновидів якого - гірський кришталь та його знаменита лілова форма - аметист, а також агат, опал, яшма, халцедон, сердолік, відомі як виробні та напівдорогоцінні камені. З оксиду кремнію (IV) складаються також звичайний та кварцовий пісок.

Мал. 158.
Кристали кварцу, вкраплені в доломіт
З різновидів мінералів на основі оксиду кремнію (IV) (кремню, халцедону та ін.) первісні людивиготовляли знаряддя праці. Саме кремінь, цей непоказний і не дуже міцний камінь, поклав початок кам'яному віці - віці крем'яних знарядь праці (рис. 159). Причин цьому дві: поширеність і доступність кременю, а також його здатність утворювати при сколі гострі ріжучі краї.

Мал. 159.
Знаряддя кам'яного віку
Другий тип природних сполук кремнію – це силікати. Серед них найбільш поширені алюмосилікати (зрозуміло, що ці силікати містять хімічний елемент алюміній). До алюмосилікатів відносять граніт, різні видиглин, слюди. Силікатом, що не містить алюмінію, є, наприклад, азбест, з якого виготовляють вогнетривкі тканини.
Оксид кремнію (IV) SiO 2 необхідний життя рослин і тварин. Він надає міцності стеблам рослин та захисним покривам тварин (рис. 160). Завдяки йому очерети, очерети і хвощі стоять міцно, як багнети, гостре листя осоки ріжуть, як ножі, стерня на скошеному полі коле, як голки, а стебла злаків настільки міцні, що не дозволяють ниві на полях лягати від дощу та вітру. Луска риб, панцирі комах, крила метеликів, пір'я птахів і шерсть тварин міцні, оскільки містять кремнезем.

Мал. 160.
Оксид кремнію (IV) надає міцності стеблам рослин та захисним покривам тварин
З'єднання кремнію надають гладкість і міцність волоссю та нігтям людини.
Кремній входить і до складу нижчих живих організмів - діатомових водоростей і радіолярій, найніжніших грудочок живої матерії, які створюють свої неперевершені за красою скелети з кремнезему (рис. 161).
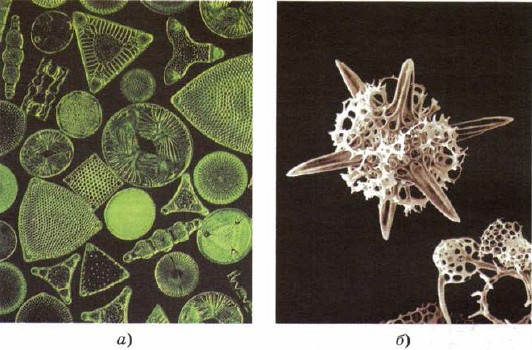
Мал. 161.
Скелети діатомових водоростей (а) та радіолярій (б) складаються з кремнезему
Властивості кремнію. Ви користуєтеся мікрокалькулятором із сонячною батареєю і тому маєте уявлення про кристалічний кремній. Це напівпровідник. На відміну від металів, із підвищенням температури його електропровідність збільшується. На супутниках, космічних кораблях, станціях та дахах будинків (мал. 162) встановлюють сонячні батареї, що перетворюють сонячну енергію на електричну. Вони працюють кристали напівпровідників, й у першу чергу кремнію. Кремнієві фотоелементи можуть перетворити на електричну до 10% поглиненої сонячної енергії.

Мал. 162.
Сонячна батарея на даху будинку
Кремній горить у кисні, утворюючи відомий вам оксид кремнію (IV):
![]()
Будучи неметал, при нагріванні кремній з'єднується з металами з утворенням силіцидів, наприклад:
![]()
Силициди легко розкладаються водою або кислотами, при цьому виділяється газоподібна воднева сполука кремнію - силан:
На відміну від вуглеводнів, силан на повітрі самозаймається і згоряє з утворенням оксиду кремнію (IV) та води:
Підвищена реакційна здатність силану порівняно з метаном СН 4 пояснюється тим, що розмір атома кремнію більший, ніж у вуглецю, тому хімічні зв'язки Si-Н менш міцні, ніж зв'язки С-Н.
Кремній взаємодіє з концентрованими водними розчинами лугів, утворюючи силікати та водень:
Кремній одержують, відновлюючи його з оксиду кремнію (IV) магнієм або вуглецем:
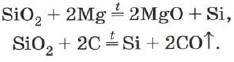
Оксид кремнію (IV), або діоксид кремнію, або кремнезем SiO 2 як і СО 2 є кислотним оксидом. Однак на відміну від С02 має молекулярну, а атомну кристалічну решітку. Тому SiO 2 тверда і тугоплавка речовина. Він не розчиняється у воді та кислотах, крім плавикової, але взаємодіє при високих температурах з лугами з утворенням солей кремнієвої кислоти - силікатів:
Силікати можна отримати також сплавленням оксиду кремнію (IV) з оксидами металів або з карбонатами:
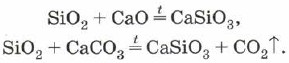
Силікати натрію та калію називають розчинним склом. Їх водні розчини- Це добре відомий силікатний клей.
З розчинів силікатів дією на них сильніших кислот - соляної, сірчаної, оцтової і навіть вугільної виходить кремнієва кислота H 2 SiO 3 (рис. 163):
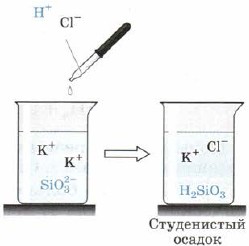
Мал. 163. Якісна реакція на силікат-іон
Отже, H2SiO3 дуже слабка кислота. Вона нерозчинна у воді і випадає з реакційної суміші у вигляді драглистого осаду, що іноді заповнює компактно весь об'єм розчину, перетворюючи його на напівтверду масу, схожу на холодець, желе. При висиханні цієї маси утворюється високопоріста речовина - силікагель, що широко застосовується як адсорбент - поглинач інших речовин.
Лабораторний досвід №40
Одержання кремнієвої кислоти та вивчення її властивостей
Застосування кремнію. Ви вже знаєте, що кремній застосовують для отримання напівпровідникових матеріалів, а також кислототривких сплавів. При сплавленні кварцового піску з вугіллям при високих температурах утворюється карбід кремнію SiC, який поступається тільки алмазу. Тому його використовують для заточування різців металорізальних верстатів та шліфування дорогоцінного каміння.
З розплавленого кварцу виготовляють різний хімічний кварцовий посуд, який може витримувати високу температуру і не тріскається при різкому охолодженні.
З'єднання кремнію є основою для виробництва скла та цементу.
Звичайне шибка має склад, який можна виразити формулою Na 2 O СаО 6SiO 2 . Його одержують у спеціальних скловарних печах сплавленням суміші соди, вапняку та піску.
Відмінна риса скла - здатність розм'якшуватися і в розплавленому стані набувати будь-якої форми, яка зберігається при застиганні скла. На цьому ґрунтується виробництво посуду та інших виробів зі скла.
Додаткові якості склу надають різні добавки. Так, введенням оксиду свинцю отримують кришталеве скло, оксид хрому забарвлює скло в зелений колір, оксид кобальту - синій і т. д. (рис. 164).

Мал. 164.
Вироби із кольорового скла
Скло - один із найдавніших винаходів людства. Вже 3-4 тис. років тому виробництво скла було розвинене в Єгипті, Сирії, Фінікії та Причорномор'ї.
Скло – це матеріал не лише ремісників, а й художників. Висока досконалість досягла майстра Стародавнього Риму, які вміли отримувати кольорове скло і робити з їх шматочків мозаїки.

Мал. 165.
Кольорове скло у вітражах собору Нотр-Дам, Шартр
Твори мистецтва зі скла є обов'язковими атрибутами будь-якого великого музею, і кольорові вітражі церков, мозаїчні панно - яскраві приклади цього (рис. 165). В одному з приміщень Санкт-Петербурзького відділення Російської академії наук знаходиться мозаїчний портрет Петра I, виконаний М. В. Ломоносовим (рис. 166).

Мал. 166.
Мозаїчний портрет Петра I
Області застосування скла дуже великі. Це віконне, пляшкове, лампове, дзеркальне скло; скло оптичне - від окулярів до стекол фотокамер; лінзи незліченних оптичних приладів – від мікроскопів до телескопів.
Інший важливий матеріал, одержуваний на основі сполуки кремнію, цемент. Його отримують спіканням глини і вапняку в спеціальних печах, що обертаються.
Якщо порошок цементу змішати з водою, то утворюється цементне тісто, або, як його називають будівельники, цементний розчин, який поступово твердне. При додаванні до цементу піску або щебеню як наповнювач отримують бетон. Міцність бетону зростає, якщо в нього вводиться залізний каркас - виходить залізобетон, з якого виготовляють стінові панелі, блоки перекриттів, ферми мостів і т.д.
Виробництвом скла та цементу займається силікатна промисловість. Вона також випускає силікатну кераміку - цеглу, фарфор (мал. 167), фаянс та вироби з них.

Мал. 167.
Порцелянові вироби
Відкриття кремнію. Хоча вже в давнину люди широко використовували в побуті сполуки кремнію, сам кремній був вперше отриманий в 1824 шведським хіміком Й. Я. Берцеліусом. Однак за 12 років до нього кремній отримали Ж. Гей-Люссак та Л. Тенар, але він був дуже забруднений домішками.
Латинська назва силіціум бере свій початок від латинського слова силекс-кремінь. Російська назва «кремній» походить від грецького кремносу – «скеля, скеля».
Нові слова та поняття
- Природні сполуки кремнію: кремнезем, кварц та його різновиди, силікати, алюмосилікати, азбест.
- Біологічне значення кремнію.
- Властивості кремнію: напівпровідникові, взаємодія з киснем, металами, лугами.
- Силан.
- Оксид кремнію (ІV). Його будова та властивості: взаємодія з лугами, основними оксидами, карбонатами та магнієм.
- Кремнієва кислота та її солі. Розчинне скло.
- Застосування кремнію та його сполук.
- Скло.
- Цемент.
походження назви
Найчастіше в природі кремній зустрічається у вигляді кремнезему - сполук на основі діоксиду кремнію (IV) SiO 2 (близько 12% маси земної кори). Основні мінерали і гірські породи, що утворюються діоксидом кремнію, - це пісок (річковий і кварцовий), кварц і кварцити, кремінь, польові шпати. Другу за поширеністю в природі групу сполук кремнію складають силікати та алюмосилікати.
Відзначено поодинокі факти знаходження чистого кремнію в самородному вигляді.
Отримання
Вільний кремній виходить при прожарюванні дрібного білого піску (діоксиду кремнію) з магнієм:
S i O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \rightarrow \ 2MgO+Si)))При цьому утворюється аморфний кремній , що має вигляд бурого порошку.
У промисловості кремній технічної чистоти одержують, відновлюючи розплав SiO 2 коксом при температурі близько 1800 °C у руднотермічних печах шахтного типу. Чистота отриманого таким чином кремнію може досягати 99,9% (основні домішки – вуглець, метали).
Можливе подальше очищення кремнію від домішок.
- Очищення в лабораторних умовах може бути проведене шляхом попереднього одержання силіциду магнію Mg 2 Si. Далі з силіциду магнію за допомогою соляної або оцтової кислот отримують газоподібний моносилан SiH 4 . Моносилан очищають ректифікацією, сорбційними та ін методами, а потім розкладають на кремній і водень при температурі близько 1000 °C.
- Очищення кремнію у промислових масштабах здійснюється шляхом безпосереднього хлорування кремнію. При цьому утворюються сполуки складу SiCl 4 , SiHCl 3 і SiH 2 Cl 2 . Їх у різний спосібочищають від домішок (як правило, перегонкою та диспропорціюванням) і на заключному етапі відновлюють чистим воднем при температурах від 900 до 1100 °C.
- Розробляються дешевші, чистіші та ефективніші промислові технології очищення кремнію. На 2010 р. до них можна віднести технології очищення кремнію з використанням фтору (замість хлору); технології, що передбачають дистиляцію монооксиду кремнію; технології, засновані на витравленні домішок, що концентруються на міжкристалітних межах.
Вміст домішок у доочищеному кремнії може бути знижений до 10 -8 -10 -6 % за масою. Більш докладно питання отримання надчистого кремнію розглянуті у статті Полікристалічний кремній.
Спосіб одержання кремнію в чистому вигляді розроблений Миколою, Миколайовичем Бекетовим.
Фізичні властивості
Кристалічна решітка кремнію кубічна гранецентрована типу алмазу, параметр а = 0,54307 нм (при високих тискахотримані інші поліморфні модифікації кремнію), але через більшу довжину зв'язку між атомами Si-Si в порівнянні з довжиною зв'язку С-Ствердість кремнію значно менше, ніж алмазу. Кремній крихкий, тільки при нагріванні вище 800 ° C він стає пластичною речовиною. Він прозорий для інфрачервоного випромінювання починаючи з довжини хвилі 1,1 мкм. Власна концентрація носіїв заряду - 5,81·10 15 м-3 (для температури 300 K).
Електрофізичні властивості
Елементарний кремній у монокристалічній формі є непрямозонним напівпровідником. Ширина забороненої зони при кімнатній температуріскладає 1,12 еВ, а при Т = 0 К - 1,21 еВ. Концентрація власних носіїв заряду в кремнії за нормальних умов становить близько 1,5·10 10 см −3 .
На електрофізичні властивості кристалічного кремнію великий вплив мають домішки, що містяться в ньому. Для отримання кристалів кремнію з дірковою провідністю в кремній вводять атоми елементів III групи, таких, як бор, алюміній, галій, індій. Для отримання кристалів кремнію з електронною провідністю до кремнію вводять атоми елементів V-їгрупи, таких, як фосфор, миш'як, сурма.
При створенні електронних приладів на основі кремнію задіюється переважно приповерхневий шар матеріалу (до десятків мікрон), тому якість поверхні кристала може істотно впливати на електрофізичні властивості кремнію і, відповідно, на властивості готового приладу. При створенні деяких приладів використовуються прийоми, пов'язані з модифікацією поверхні, наприклад обробка поверхні кремнію різними хімічними агентами та її опромінення.
Хімічні властивості
Подібно до атомів вуглецю, для атомів кремнію є характерним стан sp 3 -гібридизації орбіталей. У зв'язку з гібридизацією чистий кристалічний кремній утворює алмазоподібні грати, в яких кремній чотиривалентний. У з'єднаннях кремній зазвичай також проявляє себе як чотиривалентний елемент зі ступенем окислення +4 або −4. Зустрічаються двовалентні сполуки кремнію, наприклад, оксид кремнію (II) - SiO.
За нормальних умов кремній хімічно малоактивний і активно реагує лише з газоподібним фтором, при цьому утворюється летючий тетрафторид кремнію SiF4. Така «неактивність» кремнію пов'язана з пасивацією поверхні нанорозмірним шаром діоксиду кремнію, що негайно утворюється в присутності кисню, повітря або води (водяної пари).
киснем з утворенням діоксиду SiO 2 процес супроводжується збільшенням товщини шару діоксиду на поверхні, швидкість процесу окислення лімітується дифузією атомарного кисню крізь плівку діоксиду.
При нагріванні до температури понад 400-500 °C кремній реагує з хлором, бромом та йодом - з утворенням відповідних легко летких тетрагалогенідів SiHal 4 і, можливо, галогенідів складнішого складу.
З воднем кремній безпосередньо не реагує, з'єднання кремнію з воднем - силани із загальною формулою Si n H 2n+2 - одержують непрямим шляхом. Моносилан SiH 4 (його часто називають просто силаном) виділяється при взаємодії силіцидів металів з розчинами кислот, наприклад:
C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \rightarrow \ 2CaCl_(2)+SiH_(4)\) uparrow)))Силан SiH 4 , що утворюється в цій реакції, містить домішок і інших силанів, зокрема, дисилану Si 2 H 6 і трисилану Si 3 H 8 , в яких є ланцюжок з атомів кремнію, пов'язаних між собою одинарними зв'язками (-Si-Si-Si-) .
З азотом і бором кремній реагує при температурі близько 1000 °C, утворюючи відповідно нітрид Si 3 N 4 і термічно і хімічно стійкі бориди SiB 3 , SiB 6 і SiB 12 .
При температурах понад 1000 °C можна отримати з'єднання кремнію та його найближчого аналога за таблицею Менделєєва - вуглецю - карбід-кремнію SiC (карборунд), який характеризується високою твердістю та низькою хімічною активністю. Карборунд широко використовується як абразивний матеріал. При цьому, що цікаво, розплав кремнію (1415 °C) може тривалий час контактувати з вуглецем у вигляді великих шматків щільноспеченого дрібнозернистого графіту ізостатичного пресування, практично не розчиняючи і ніяк не взаємодіючи з останнім.
Нижчі елементи 4-ї групи (Ge, Sn, Pb) необмежено розчинні в кремнії, як і більшість інших металів. При нагріванні кремнію з металами можуть утворюватися їх сполуки – силіциди. Силициди можна підрозділити на дві групи: іонно-ковалентні (силіциди лужних, лужноземельних металів та магнію типу Ca 2 Si, Mg 2 Si та ін) та металоподібні (силіциди перехідних металів). Силициди активних металів розкладаються під дією кислот, силіциди перехідних металів хімічно стійкі і під дією кислот не розкладаються. Металоподібні силіциди мають високу температуру плавлення (до 2000 °C). Найчастіше утворюються металоподібні силіциди складів Me Si, Me 3 Si 2 , Me 2 Si 3 , Me 5 Si 3 і Me Si 2 . Металоподібні силіциди хімічно інертні, стійкі до дії кисню навіть за високих температур.
Особливо слід зазначити, що із залізом кремній утворює евтектичну суміш, що дозволяє спікати (сплавляти) ці матеріали для утворення феросиліцієвої кераміки при температурах, помітно менших, ніж температури плавлення заліза та кремнію.
При відновленні SiO 2 кремнієм при температурах понад 1200 °C утворюється оксид кремнію (II) - SiO. Цей процес постійно спостерігається при виробництві кристалів кремнію методами
Кремній у вільному вигляді був виділений у 1811 р. Ж.Гей-Люссаком та Л.Тенаром при пропусканні парів фториду кремнію над металевим калієм, проте він не був описаний ними як елемент. Шведський хімік Й.Берцеліус у 1823 р. дав опис кремнію, отриманого ним при обробці калієвої солі K 2 SiF 6 металевим калієм при високій температурі. Новому елементу було названо " силіцій " (від латів. silex - кремінь). Російську назву "кремній" запроваджено у 1834 році російським хіміком Германом Івановичем Гессом. У перекладі з др.-грец. krhmnoz- "Кут, гора".
Знаходження в природі, отримання:
У природі кремній знаходиться у вигляді діоксиду та силікатів різного складу. Природний діоксид кремнію зустрічається переважно у формі кварцу, хоча існують інші мінерали - кристобаліт, тридиміт, кітіт, коусит. Аморфний кремнезем зустрічається в діатомових відкладеннях на дні морів і океанів - ці відкладення утворилися з SiO 2 входив до складу діатомових водоростей і деяких інфузорій.
Вільний кремній може бути отриманий прожарюванням з магнієм дрібного білого піску, який за хімічним складом є майже чистим оксидом кремнію SiO 2 +2Mg=2MgO+Si. У промисловості кремній технічної чистоти одержують, відновлюючи розплав SiO 2 коксом при температурі близько 1800°C дугових печах. Чистота одержаного таким чином кремнію може досягати 99,9% (основні домішки - вуглець, метали).
Фізичні властивості:
Аморфний кремній має вигляд бурого порошку, густина якого дорівнює 2.0г/см 3 . Кристалічний кремній - темно-сіра, блискуча кристалічна речовина, крихка і дуже тверда, кристалізується в ґратах алмазу. Це типовий напівпровідник (проводить електрику краще, ніж ізолятор типу каучуку, і гірше за провідника - мідь). Кремній крихкий, тільки при нагріванні вище 800 ° C він стає пластичною речовиною. Цікаво, що кремній прозорий до інфрачервоного випромінювання, починаючи з довжини хвилі 1.1 мкм.
Хімічні властивості:
Хімічно кремній малоактивний. При кімнатній температурі реагує тільки з газоподібним фтором, утворюється при цьому летючий тетрафторид кремнію SiF 4 . При нагріванні до температури 400-500 °C кремній реагує з киснем з утворенням діоксиду, з хлором, бромом та йодом - з утворенням відповідних легко летких тетрагалогенідів SiHal 4 . При температурі близько 1000°C кремній реагує з азотом утворюючи нітрид Si 3 N 4 з бором - термічно і хімічно стійкі бориди SiB 3 , SiB 6 і SiB 12 . З воднем кремній безпосередньо не реагує.
Для травлення кремнію найбільш широко використовують суміш плавикової та азотної кислот.
Ставлення до лугів.
Для кремнію характерні сполуки зі ступенем окиснення +4 або -4.
Найважливіші сполуки:
Діоксид кремнію, SiO 2- (Кремнієвий ангідрид) ...
...
Кремнієві кислоти- слабкі, нерозчинні, утворюються при додаванні кислоти до розчину силікату у вигляді гелю (желатиноподібна речовина). H 4 SiO 4 (ортокремнієва) і H 2 SiO 3 (метакремнієва, або кремнієва) існують тільки в розчині і незворотно перетворюються на SiO 2 при нагріванні та висушуванні. Твердий пористий продукт, що виходить - силікагельмає розвинену поверхню і використовується як адсорбент газів, осушувач, каталізатор і носій каталізаторів.
Силікати- солі кремнієвих кислот здебільшого (крім силікатів натрію та калію) нерозчинні у воді. Властивості.
Водневі сполуки- аналоги вуглеводнів, силани, сполуки, в яких атоми кремнію з'єднані одинарним зв'язком, силениякщо атоми кремнію з'єднані подвійним зв'язком. Подібно до вуглеводнів ці сполуки утворюють ланцюги і кільця. Всі силани можуть самозайматися, утворюють вибухові суміші з повітрям та легко реагують з водою.
Застосування:
Найбільше застосування кремній знаходить у виробництві сплавів для надання міцності алюмінію, міді та магнію та для отримання феросиліцидів, що мають важливе значення у виробництві сталей та напівпровідникової техніки. Кристали кремнію застосовують у сонячних батареяхта напівпровідникових пристроях - транзисторах та діодах. Кремній служить також сировиною для виробництва кремнійорганічних сполук, або силоксанів, одержуваних у вигляді олій, мастил, пластмас та синтетичних каучуків. Неорганічні сполукикремнію використовують у технології кераміки та скла, як ізоляційний матеріал та п'єзокристали
Для деяких організмів кремній є важливим біогенним елементом. Він входить до складу опорних утворень у рослин та скелетних – у тварин. У великих кількостях кремній концентрують морські організми – діатомові водорості, радіолярії, губки. Великі кількостікремнію концентрують хвощі та злаки, в першу чергу – підродини Бамбуків та Рисовидних, у тому числі – рис посівний. М'язова тканина людини містить (1-2) 10 -2 % кремнію, кісткова тканина - 17 10 -4 %, кров - 3,9 мг/л. З їжею в організм людини щодня надходить до 1 г кремнію.
Антонов С.М., Томілін К.Г.
ХФ ТюмГУ, 571 група.
