Фізичні властивості sio2. З'єднання з киснем. Оксид кремнію (II) SiO
Оксид кремнію (II) SiO. У природі він не зустрічається, але може бути отриманий за реакцією:
SiO 2 + Si → 2 SiO.
Під звичайним тиском сублімація монооксиду кремнію починається близько 1200 ° С (коли самі вихідні речовини ще практично не випаровуються). У парах SiO є індивідуальним з'єднанням. Енергія дисоціації на елементи 789 кДж / моль. Переклад його в твердий стан може бути здійснений тільки швидким охолодженням ( "загартуванням") газової фази. В іншому випадку встигає пройти дисмутації за рівнянням:
2 SiO = SiO 2 + Si.
Монооксид кремнію повільно окислюється киснем повітря і легко розчиняється в лугах з утворенням солей кремнієвої кислоти і виділенням водню. Він легко електризується від тертя, набуваючи сильний негативний заряд.
Оксид кремнію (IV) SiO 2.Оксид кремнію (IV) називають також кремнеземом. Це тверде тугоплавка речовина (Температура плавлення 1700 ° С), Широко поширене в природі в двох видах: 1) кристалічний кремнезем - у вигляді мінералу кварцу і його різновидів (гірський кришталь, халцедон, агат, яшма, кремінь); кварц становить основу кварцових пісків, широко використовуваних в будівництві і в силікатної промисловості; 2) аморфний кремнезем - у вигляді мінералу опала складу SiO 2 ∙ пH 2 O; землистими формами аморфного кремнезему є діатоміт, трепел (інфузорна земля); прикладом штучного аморфного безводного кремнезему може служити силікагель, який виходить з метасилікат натрію:
Силікагель має розвинену поверхню, а тому добре адсорбує вологу.
При 1710 ° кварц плавиться. При швидкому охолодженні розплавленої массиобразуется кварцове скло. Воно має дуже малий коефіцієнт розширення, завдяки чому розпечене кварцове скло не тріскається при швидкому охолодженні водою. З кварцового скла виготовляють лабораторний посуд і прилади для наукових досліджень.
Структуру SiO 2 в площинному зображенні можна змалювати таку картину:
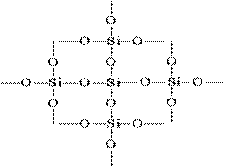
Кожен атом кремнію укладений в тетраедр з 4 атомів кисню. При цьому атом кремнію знаходиться в центрі, а по вершинах тетраедра розташовані атоми кисню. Весь шматок кремнезему можна розглядати як кристал, формула якого (SiO 2) n. Така будова оксиду кремнію (IV) обумовлює його високу твердість і тугоплавкость.
За хімічними властивостями оксид кремнію (IV) SiO 2 відноситься до кислотних оксидів. При сплаві його з твердими лугами, основними оксидами і карбонатами утворюються солі кремнієвої кислоти:
З оксидом кремнію (IV) взаємодіє тільки плавикова кислота (травлення скла):
SiO 2 + HF → SiF 4 + H 2 O
У воді оксид кремнію (IV) розчиняється і з нею хімічно не взаємодіє. Тому кремнієву кислоту отримують непрямим шляхом, наприклад, гідролізом:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 ортокремнієвої кислота.
H 4 SiO 4 розчинна, при нагріванні або стоянні йде процес полімеризації:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 діортокремніевая кислота.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 тетраортокремніевая кислота.
Вона замикається в кільце:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 тетраметакремніевая кислота.
При цьому кремнієва кислота (в залежності від концентрації вихідних розчинів солі і кислоти) може бути отримана як у вигляді студнеобразной маси, що містить воду, так і у вигляді колоїдного розчину (золю). Склад отриманих кремнієвих кислот залежить від вихідних речовин і умов отримання. Все кремнієві кислоти дуже слабкі (слабше вугільної).
Якщо в розчині вугільна кислота виділяє кремінну з її солей, то при прожаренні йде зворотна реакція. Перша обумовлена меншою силою (ступенем дисоціації) кремнієвої кислоти, друга - її меншою летючість при нагріванні.
При нагріванні полікремнієвих кислот і поступовому їх зневодненні можна отримати тонкодисперсний SiO 2, який називають силікагелем . Він добре поглинає воду, його розміщую в прилади для запобігання окислення дорогих елементів.
підгрупа германію
Ge (+4) Sn (+2, +4) Pb(+2) - стійкі ступені окислення
Германій був передбачений Д. І. Менделєєвим в 1871 р, а відкритий в 1886 р Олово і свинець належать до найбільш давно відомим людству елементів: єгиптяни уміли виплавляти їх з руд більш ніж за 3000 років до н. е. В Індії свинець став відомий близько 2500 років, а олово 1500 років до н. е. Виплавка олова проводилася і в стародавньому Китаї.
Отримання.Природні сполуки германію переводять в GeO 2 і відновлюють воднем:
GeO 2 + H 2 t → Ge + H 2 O при температурах близько 1000 ° С.
Олово отримують з природного мінералу касситерита(SnO 2):
SnO 2 + С → Sn + CO.
Найпростіша схема промислового відновлення свинцю грунтується на двох послідовних реакціях:
PbS + O 2 → SO 2 + PbO галенит(PbS) обпалюють, а потім відновлюють вугіллям:
PbO + С → СO + Pb.
Застосування.Всі три елементи дуже важливі для сучасної техніки. Значне застосування знаходять також деякі сполуки олова і свинцю. Похідні свинцю сильно отруйні.
Германій є типовим напівпровідником (N-типу з шириною забороненої зони 0,75 еВ) і знаходить різноманітне використання в електротехніці. Найбільш широко він застосовується для виготовлення випрямлячів змінного струму. Застосування це засноване на уніполярної провідності, що виникає при контакті між чистим германием і сплавом германію з індієм. Струм (потік електронів) проходить в такій установці практично тільки від германію до сплаву, але не навпаки. Германієві випрямлячі характеризуються надзвичайно високим (близько 98%) коефіцієнтом корисної дії і дуже великим (при правильній експлуатації) терміном служби. Основним недоліком таких випрямлячів є їх чутливість до нагрівання - вище 70 ° С їх ефективність швидко падає.
Важливою сферою використання германію є інфрачервона оптика, так як промені з довжиною хвилі більше 2 мк він практично не затримує. Навпаки, в світловому і близьких до нього діапазонах (0,2? 2 мк) германій інтенсивно поглинає енергію. Якщо блискучу металеву поверхню (яка добре зберігає тепло, але погано нагрівається) покрити плівкою германію, то поверхня нагрівається набагато сильніше, ніж без плівки. Повідомлялося, що в підготовленій таким чином бочці під дією сонячного світла можна отримати окріп.
Олово використовується головним чином для лудіння заліза з метою запобігання його від іржавіння (Біла жерсть для консервної промисловості). Товщина таких олов'яних покриттів дуже мала - близько мікронів. У вигляді тонких листків (т. Н. Станніоля) олово споживається для виготовлення конденсаторів в електротехнічної промисловості . Свинець застосовується для виготовлення акумуляторних пластин, обкладок електричних кабелів, куль і дробу, для захисту від рентгенівського випромінювання і g-променів, а також у хімічній промисловості (трубопроводи і т. Д.). Дуже великі кількості олова і свинцю витрачаються на виготовлення ряду технічно важливих сплавів.
Найважливішими з них є різні бронзи (сплави Cu і Sn), сплави для підшипників (бабіти, що виготовляються зазвичай на основі Pb або Sn і містять так само Sb і Cu), друкарські сплави (5-30% Sn, 10-20% Sb, інше Pb) і звичайний "м'який" припій (30-70% Sn, 70-30% Pb). Його замінником часто може служити більш дешевий сплав складу 90% Pb, 6% Sn, 4% Sb. Велике значення мають сплави для підшипників приблизного складу 98% Pb, 1% Ca, 1% Na.
Діоксид кремнію (silica, Silicon dioxide, кремнезем) - речовина, що складається з безбарвних кристалів, що володіють високою міцністю, твердістю і тугоплавкостью. Діоксид кремнію стійкий до впливу кислот і не взаємодіє з водою. При підвищенні температури реакції речовина взаємодіє з лугами, розчиняється в плавикової кислоті, є прекрасним діелектриком.
У природі діоксид кремнію поширений досить широко: кристалічний оксид кремнію представлений такими мінералами як яшма, агат (мелкокристаллические з'єднання двоокису кремнію), гірський кришталь (великі кристали речовини), кварц (вільна двоокис кремнію), халцедон, аметист, морион, топаз (забарвлені кристали діоксиду кремнію).
У звичайних умовах (при природній температурі навколишнього середовища і тиску) існують три кристалічних модифікації діоксиду кремнію - тридимит, кварц і кристобалит. При підвищенні температури діоксид кремнію спочатку перетворюється в коесит, а потім - в стишовит (мінерал, виявлений в 1962 році в метеоритний кратер). Згідно з дослідженнями, саме стишовит - похідне речовина діоксиду кремнію - вистилає значну частину мантії Землі.
Хімічна формула речовини - SiO 2
Отримання діоксиду кремнію
Діоксид кремнію промисловим способом виходить на кварцових заводах, які виробляють чистий кварцовий концентрат, який потім використовується в хімічній і електронній промисловості, у виробництві оптики, наповнювачів для гумових і лакофарбових виробів, виготовленні ювелірних прикрас і т.д. Природний діоксид кремнію, інакше званий кремнеземом, широко застосовується в будівництві (бетон, пісок, звуко-і теплоізоляційні матеріали).
Отримання діоксиду кремнію синтетичним способом здійснюється за допомогою впливу кислот на силікат натрію, в деяких випадках - на інші розчинні силікати або методом коагуляції колоїдного кремнезему під впливом іонів. Крім того, діоксид кремнію отримують шляхом окислення кремнію киснем при температурі близько 500 градусів Цельсія.
Застосування діоксиду кремнію
Кремнійсодержащіе матеріали знайшли широке застосування як в області високих технологій, так і в повсякденному житті. Діоксид кремнію використовується у виробництві скла, кераміки, виробів з бетону, абразивних матеріалів, а також в радіотехніці, ультразвукових установках, запальничках і т.д. У поєднанні з рядом інгредієнтів діоксид кремнію застосовується у виготовленні волоконно-оптичних кабелів.
Непористий аморфний діоксид кремнію використовується також в харчовій промисловості в якості добавки, зареєстрованої під номером Е551, перешкоджає злежуванню і злежування основного продукту. діоксид  кремнію харчової використовується у фармацевтичній промисловості в якості лікарського препарату-ентеросорбенту, у виробництві зубних паст. Речовина зустрічається в складі чіпсів, сухариків, кукурудзяних паличок, розчинної кави і т.д.
кремнію харчової використовується у фармацевтичній промисловості в якості лікарського препарату-ентеросорбенту, у виробництві зубних паст. Речовина зустрічається в складі чіпсів, сухариків, кукурудзяних паличок, розчинної кави і т.д.
Шкода діоксиду кремнію
Офіційно підтверджено, що речовина діоксиду кремнію проходить через шлунково-кишковий тракт незмінним, після чого повністю виводиться з організму. Згідно 15-річним дослідженням французьких фахівців вживання питної води з високим вмістом харчового діоксиду кремнію знижує ризики розвитку хвороби Альцгеймера на 10%.
Таким чином, інформація про шкоду діоксиду кремнію, що є хімічно інертною речовиною, помилкова: харчова добавка Е551, вживана всередину пероральним шляхом, повністю безпечна для здоров'я.
Оксид кремнію SiO 2 - тверде, дуже тугоплавка речовина (температура плавлення понад 1700 ° С), широко поширене в природі, де воно зустрічається головним чином у вигляді мінералу кварцу, а також кристобалита і трідіміта.
При звичайних температурах стійкою модифікацією є кварц, з ростом температури спостерігаються поліморфні перетворення:
Кремнезем всіх модифікацій у вигляді мономера не існує; він завжди полімерів і «побудований» з тетраедрів, що утворюють дуже міцну атомну решітку
Кожен атом кремнію в кристалах (SiO 2) n Тетраедрично оточений чотирма атомами кисню, кожен з яких є мостикову. Через загальний атом кисню тетраєдри під різними кутами зв'язуються один з одним, утворюючи безперервну тривимірну грати; взаємне розташування тетраедрів в просторі визначає ту чи іншу модифікацію кремнезему.
У різних модифікаціях кремнезему міцність зв'язків неоднакова. Це впливає на величину кутів Si-О-Si і відстаней Si-О, наприклад кут зв'язку Si-О-Si в різних модифікаціях кремнезему змінюється від 120 до 180 °. Переходи кварц-тридимит-кристобалит супроводжуються розривом і перетворенням зв'язків, що може відбуватися тільки при високих температурах.
Кварц. Нерідко зустрічається в природі у формі надзвичайно добре освічених кристалів, іноді значної величини. Кристали утворені з тетраедрів, розташованих гвинтоподібно навколо центральної осі, у вигляді спіралі. В одному і тому ж кристалі напрямок спіралі може бути протилежним. Такі кристали є оптичними ізомерами. Вони обертають площину поляризації світла, причому можуть бути як право-, так і левовращающімі. Ті та інші кристали відрізняються як предмет від свого дзеркального зображення.
Кварц використовується в різних областях науки і техніки, і його кристали часто вирощуються штучно. Деякі різновиди кварцу носять особливі назви. Прозорі безбарвні кристали називають гірським кришталем. Зустрічаються і пофарбовані різновиди кварцу: рожевий кварц, фіолетовий (аметист), темно-коричневий (димчастий топаз), зелений (хризопраз) і ін. Дрібнокристалічна модифікація кварцу з домішками інших речовин називається халцедоном. Різновидами халцедону є агат, яшма та ін. Гірський кришталь і пофарбовані різновиди кварцу використовують як дорогоцінні й напівкоштовні камені.
Трідіміт зустрічається у вулканічних породах, проте в дуже невеликих кількостях. Відомий тридимит і метеоритного походження.
Кристобалит в природі іноді зустрічається у вигляді дрібних кристалів, включених в лаву, подібно трідіміта. Трідіміт і кристобалит володіють більш «пухкою» структурою, ніж кварц. Так, щільність кристобалита, трідіміта і кварцу дорівнює 2,32; 2,26 і 2,65 г / см 3 відповідно.
Розплав кремнезему при повільному охолодженні легко утворює аморфне кварцове скло. Кремнезем у вигляді скла зустрічається і в природі. Щільність аморфного скла дорівнює 2,20 г / см 3 - нижче, ніж у всіх кристалічних модифікацій. Кварцові скло має незначний температурний коефіцієнт розширення, тому з нього готують лабораторний посуд, стійку до різких змін температури.
Всі модифікації кремнезему у воді практично нерозчинні (при температурі 25 ° С розчинність кварцу становить 7, кристобалита - 12, трідіміта - 16, кварцового скла - 83 мг / л). Тому при звичайних умовах на них діють лише розчини лугів і плавикова кислота:
SiO 2 + 2КОН = К 2 SiO 3 + Н 2 О, (1)
SiO 2 + 4НF = SiF 4 + 2Н 2 О. (2)
Остання реакція використовується при «травленні» скла.
Приставленого діоксид кремнію реагує з основними оксидами, лугами (реакція (1)) і карбонатами з утворенням силікатів:
SiO 2 + СаО = Сasio 3, (3)
SiO 2 + Na 2 СО 3 = N а 2 SiO 3 + СО 2. (4)
Реакції (3) і (4) лежать в основі промислового отримання різних стекол, а також цементу. Так, склад звичайного скла (наприклад, віконного, для виготовлення посуду) виражається формулою Na 2 О. СаО. 6SiO 2. Таке скло отримують сплавом суміші соди, піску і вапняку. Процес проводять при температурі ~ 1400 ° С до повного видалення газів:
Na 2 СО 3 + СаСО 3 + 6SiO 2 = N а 2 О. СаО. 6SiO 2 + 2СО 2.
Для отримання спеціальних сортів скла - вогнетривкої, «не б'ється» - при варінні додають оксиди барію, свинцю, бору. Для отримання кольорового скла вносять також різні добавки, наприклад добавка оксиду кобальту Со 2 О 3 дає синій колір, оксиду хрому Сr 2 О 3 - зелений, двооксиду марганцю МnО 2 - рожевий.
Оксид SiO 2 є ангідридом ряду кремнієвих кислот, склад яких можна виразити загальною формулою хSiO 2 ∙ Yн 2 O, де х і у - цілі числа: 1) х = 1, у = 1: SiO 2. Н 2 О, тобто Н 2 SiO 3 - метакремнієва кислота; 1) х = 1, y = 2: SiO 2. 2Н 2 О, тобто ортокремнієвої кислота; 1) x = 2, у = 1: 2SiO 2. Н 2 О, тобто Н 2 Si 2 O 5 - двуметакремніевая кислота.
Кислоти, молекули яких містять більше однієї молекули SiO 2, відносяться до полікремнієвих.
Найпростіша з кремнієвих кислот - Н 2 SiO 3, яку часто називають просто кремнієвої, а її солі - силікатами. З силікатів у воді розчинні тільки силікати натрію і калію, інші силікати - тугоплавкі, нерозчинні у воді речовини.
Розчини силікатів мутніють при стоянні на повітрі, так як знаходиться в ньому СО2 витісняє кремнієву кислоту з її солей (Н 2 SiO 3 слабкіше вугільної кислоти; константа дисоціації Н 2 SiO 3 по першій ступені дорівнює До 1 = 2,2. 10 -10 ).
Н 2 SiO 3 практично нерозчинні в воді - це властивість використовують як якісну реакцію для виявлення силікат-іонів:
Na 2 SiO 3 + СО 2 + Н 2 О = N а 2 СО 3 + Н 2 SiO 3 ↓.
Отримують силікати сплавом SiO 2 з лугами або карбонатами.
Концентровані розчини силікатів натрію і калію називають рідким склом, вони мають сильнолужну реакцію внаслідок того, що сильно гідроліз:
До 2 SiO 3 + Н 2 О 2КОН + Н 2 SiO 3 ↓.
Рідке скло використовують, наприклад, для виготовлення клею, водонепроникних тканин.
Цемент дуже широко використовується в будівництві як в'яжучий матеріал, який при змішуванні з водою твердне. Зазвичай цемент отримують у великих обертових печах, де виробляють випал і помел різних силікатів (при температурі -1000 ° С).
Розрізняють декілька типів цементів, проте умовно можна виділити два типи цементів за принципом їх «згортання» - звичайний цемент і портландский цемент. Процес «схоплювання» звичайного цементу, що складається з силікату кальцію, відбувається внаслідок освіти карбонату кальцію за рахунок вуглекислого газу повітря:
СаО. SiO 2 + СО 2 + Н 2 О = СаСО 3 ↓ + Н 2 SiO 3 ↓.
При схоплюванні портландского цементу вуглекислота не бере участі в процесі, а відбувається гідроліз силікатів з наступним утворенням нерозчинних кристаллогидратов:
Са 3 SiO 5 + Н 2 О = Са 2 SiO 4 + Са (ОН) 2,
Са 2 SiO 4 + 4Н 2 О = Са 2 SiO 4. 4Н 2 O ↓.
· Карбіди і силіциди
· З'єднання вуглецю і кремнію з металами - карбіди і силіциди, крім розглянутих реакцій отримують також взаємодією кремнію з гідридами металів, наприклад:
· 2СаН 2 + Si = Са 2 Si + 2Н 2.
· Будь-хто ці реакції протікають при високих температурах. Серед карбідів виділяють так звані «метаніди» і «ацетиленіди». Перші розглядають як похідні метану, що містять вуглець в ступені окислення -4 (Ве 2 З, Аl 4 С 3), другі - як похідні ацетилену зі ступенем окислення вуглецю -1 (Li 2 З 2, Аg 2 З 2, Сu 2 З 2 , Сас 2). Ацетиленіди срібла і міді (I) можуть бути легко отримані при пропущенні ацетилену через аміачний розчин оксиду срібла або хлориду міді (I). Більшість метанідов і ацетіленід активно реагують з водою (тим більше з кислотами), виділяючи відповідні вуглеводні:
· Сас 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Аg 2 З 2 + 2НСl = 2АgСl ↓ + С 2 Н 2.
· На відміну від карбідів, з водою і кислотами взаємодіють лише силіциди лужних або лужноземельних металів, виділяючи найпростіше водневе з'єднання кремніямоносілан, яке найчастіше називають просто силан SiН 4:
· Са 2 Si + 4НСl = 2СаСl 2 + SiН 4.
· Сілан - безбарвний газ, має запах цвілі, мимовільно запалюється на повітрі, згораючи до SiO 2 і води:
· SiН 4 + 2О 2 = SiO 2 + 2Н 2 О.
· Луги дуже легко розкладають силан з рівняння:
· SiН 4 + 2КОН + Н 2 О = К 2 SiO 3 + 4Н 2,
· Вода також гідролізує силан, але значно повільніше:
· SiН 4 + 2Н 2 О = SiO 2 + 4Н 2.
· При нагріванні вище 400 ° С без доступу повітря силан розпадається на кремній і водень (один із способів отримання кремнію):
· SiН 4 = Si + 2Н 2.
· Крім моносілана, відомі також дисилан Si 2 Н 6, трісілан Si 3 Н 8, тетрасілан Si 4 Н 10 і т.д. В індивідуальному стані виділено з'єднання лише до Si 6 Н 14 включно. Всі ці сполуки відносяться до гомологічного ряду силанов, яким відповідає загальна формула Si n Н 2 n +2. Подібно алканів, силани безбарвні, перші члени гомологічного ряду при звичайних умовах газоподібні, такі - рідини. Хімічна активність силанов і вуглеводнів різна: на противагу досить інертним алканів, сіланивесьма реакционноспособни. Це пояснюється меншим у порівнянні з вуглецем спорідненістю кремнію до водню і дуже великим спорідненістю кремнію до кисню. До того ж связіSi-Si менш міцні, ніж зв'язку С-С. На відміну від зв'язку С-Н зв'язок Si-Н має більш іонний характер.
· Енергії зв'язків Si-Е і С-Е.
· Малої міцністю зв'язку Si-Si обумовлена обмеженість гомологічного ряду силанов.
· Серед карбідів і силіцидів особливе місце займає карборунд SiC, який можна назвати як карбідом кремнію, так і силіцидом вуглецю. Карборунд має високу температуру плавлення, завдяки алмазоподобной структурі; його твердість близька до твердості алмазу. Хімічно SiC дуже стійкий.
· Поняття про колоїдних розчинах
У природі і техніці часто зустрічаються дисперсні системи, в яких одна речовина рівномірно розподілено у вигляді частинок усередині іншої речовини.
У дисперсних системах розрізняють дисперсну фазу - мелкораздробленного речовина і дисперсійне середовище - однорідна речовина, в якому розподілена дисперсна фаза. До дисперсним систем відносяться звичайні (справжні) розчини, колоїдні розчини, а також суспензії та емульсії. Вони відрізняються один від одного перш за все розмірами частинок, т. Е. Ступенем дисперсності (роздробленості).
Системи з розміром частинок менше 1 нм представляють собою справжні розчини, що складаються з молекул або іонів розчиненої речовини. Їх слід розглядати як однофазну систему. Системи з розмірами частинок більше 100 нм - це Грубодисперсні системи - суспензії і емульсії.
Суспензії - це дисперсні системи, в яких дисперсною фазою є тверда речовина, а дисперсійним середовищем - рідина, причому тверда речовина практично нерозчинні в рідини.
Емульсії - це дисперсні системи, в яких і дисперсна фаза і дисперсійне середовище є рідинами, взаємно змішуються. Прикладом емульсії є молоко, в якому дрібні кульки жиру плавають у рідині.
Суспензії і емульсії - двофазні системи.
Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні розміри частинок останньої лежать в межах від 1 до 100 нм. Як видно, колоїдні розчини за розмірами частинок є проміжними між істинними розчинами і суспензіями і емульсіями. Колоїдні частинки звичайно складаються з великого числа молекул або іонів.
Колоїдні розчини інакше називають золями. Їх отримують дисперсійними і кондесаціоннимі методами. Диспергирование найчастіше роблять за допомогою особливих «колоїдних млинів». При конденсаційному методі колоїдні частинки утворюються за рахунок об'єднання атомів або молекул в агрегати. При протіканні багатьох хімічних реакцій проісходітконденсація і утворюються високодисперсні системи (випадання опадів, протікання гідролізу, окислювально-відновні реакції і т.д.).
1 нм - нанометр (1 нм = 10 -9 м).
На відміну від істинних розчинів для золів характерний ефект Тиндаля, т. Е. Розсіювання світла колоїдними частинками. При пропущенні через золь пучка світла з'являється світлий конус, видимий в затемненому приміщенні 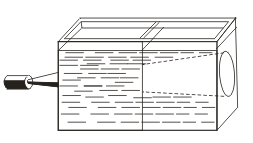 . Так можна розпізнати, є даний розчин колоїдних або істинним.
. Так можна розпізнати, є даний розчин колоїдних або істинним.
Одним з важливих властивостей золів є те, що їх частки мають електричні заряди одного знака. Завдяки цьому вони не з'єднуються в більші частки і не осідають. При цьому частки одних золів, наприклад металів, сульфідів, кремнієвої та олов'яної кислот, мають негативний заряд, інших, наприклад гідроксидів, оксидів металів, - позитивний заряд. Виникнення заряду пояснюється адсорбцією колоїдними частинками іонів з розчину.
Для осадження золю необхідно, щоб його частинки з'єдналися в більші агрегати. З'єднання часток в більш великі агрегати називається коагуляцією, а осадження їх під впливом сили тяжіння - седиментацією.
Зазвичай коагуляція відбувається при додаванні до золю: 1) електроліту, 2) іншого золю, частки якого мають протилежний заряд, і 3) при нагріванні.
