Сірка. Сірководень і сульфіди
4.doc
240Сірка. Сірководень, сульфіди, гідросульфіди. Оксиди сірки (IV) і (VI). Сірчиста і сірчана кислоти і їх солі. Ефіри сірчаної кислоти. тіосульфат натрію
4.1. сірка
Сірка - один з небагатьох хімічних елементів, якими вже кілька тисячоліть користується людина. Вона широко поширена в природі і зустрічається як у вільному стані (самородна сірка), так а в з'єднаннях. Мінерали, що містять сірку, можна розділити на дві групи - сульфіди (колчедани, блиски, обманки) і сульфати. Самородна сірка в великих кількостях зустрічається в Італії (острів Сицилія) і США. У СНД родовища самородної сірки є в Поволжі, в державах Середньої Азії, в Криму та інших районах.
До мінералів першої групи відносяться свинцевий блиск PbS, мідний блиск Cu 2 S, срібний блиск - Ag 2 S, цинкова обманка - ZnS, кадмієва обманка - CdS, пірит або залізний колчедан - FeS 2, халькопірит - CuFeS 2, кіновар - HgS.
До мінералів другої групи можна віднести гіпс CaSO 4 2Н 2 О, мирабилит (глауберової сіль) - Na 2 SO 4 10Н 2 O, кізерит - MgSO 4 Н 2 О.
Сірка міститься в організмах тварин і рослин, тому що входить до складу білкових молекул. Органічні сполуки сірки містяться в нафті.
отримання
1. При отриманні сірки з природних сполук, наприклад з сірчаного колчедану, його нагрівають до високих температур. Сірчаний колчедан розкладається з утворенням сульфіду заліза (II) і сірки:
2. Сірку можна отримати окисленням сірководню нестачею кисню по реакції:
2H 2 S O 2 = 2S 2Н 2 O
3. В даний час поширене отримання сірки відновленням вуглецем діоксиду сірки SO 2 - побічний продукт при виплавці металів з сірчистих руд:
SO 2 С = СО 2 S
4. Відходять гази металургійних і коксових печей містять суміш діоксиду сірки і сірководню. Цю суміш пропускають при високій температурі над каталізатором:
H 2 S SO 2 = 2H 2 O 3S
^ Фізичні властивості
Сірка являє собою тверде крихке речовина лимонно-жовтого кольору. У воді практично нерозчинні, але добре розчинна в сероуглероде CS 2 аніліні і деяких інших розчинниках.
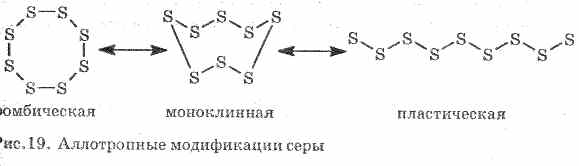
Погано проводить тепло і електричний струм. Сірка утворює кілька аллотропних модифікацій:
1 . ^ ромбическая сірка (Найбільш стійка), кристали мають вигляд октаедрів.
При нагріванні сірки змінюються її колір і в'язкість: спочатку утворюється світло-жовта, а потім у міру підвищення температури вона темніє і робиться настільки вузький, що не випливає з пробірки, при подальшому нагріванні в'язкість знову падає, а при 444, 6 ° С сірка закипає .
2. ^ моноклінна сірка - модифікація у вигляді темно-жовтих голчастих кристалів, виходить при повільному охолодженні розплавленої сірки.
3. Пластична сіркаутворюється, якщо нагріту до кипіння сірку вилити в холодну воду. Легко розтягується подібно гумі (див. Рис. 19).
Природна сірка складається з суміші чотирьох стійких ізотопів: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Хімічні властивості
Атом сірки, маючи незавершений зовнішній енергетичний рівень, може приєднувати два електрони і проявляти ступінь
Окислення -2. Таку ступінь окислення сірка виявляє в сполуках з металами і воднем (Na 2 S, H 2 S). При віддачі або зволіканні електронів до атома більш електронегативного елемента ступінь окислення сірки може бути 2, 4, 6.
На холоду сірка порівняно інертна, але з підвищенням температури її реакційна здатність підвищується. 1. З металами сірка виявляє окисні властивості. При цих реакціях утворюються сульфіди (з золотом, платиною і іридію не реагує): Fe S = FeS
2. З воднем при нормальних умовах сірка не взаємодіє, а при 150-200 ° С протікає оборотна реакція:
3. У реакціях з металами і з воднем сірка поводиться як типовий окислювач, а в присутності сильних окислювачів проявляє відновні властивості.
S 3F 2 = SF 6 (з йодом не реагує)
4. Горіння сірки в кисні протікає при 280 ° С, а на повітрі при 360 ° С. При цьому утворюється суміш SO 2 і SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. При нагріванні без доступу повітря сірка безпосередньо з'єднується з фосфором, вуглецем, проявляючи окисні властивості:
2Р 3S = P 2 S 3 2S С = CS 2
6. При взаємодії зі складними речовинами сірка поводиться в основному як відновник:
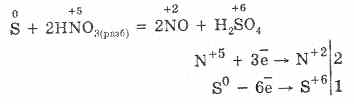
7. Сірка здатна до реакцій диспропорціонування. Так, при кип'ятінні порошку сірки з лугами утворюються сульфіти і сульфіди:
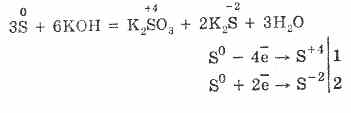
застосування
Сірку широко застосовують в промисловості і сільському господарстві. Близько половини її видобутку витрачається для отримання сірчаної кислоти. Використовують сірку для вулканізації каучуку: при цьому каучук перетворюється в гуму.
У вигляді сірчаного кольору (тонкого порошку) сірку застосовують для боротьби з хворобами виноградника і бавовнику. Її вживають для отримання пороху, сірників, що світяться складів. У медицині готують сірчані мазі для лікування шкірних захворювань.
4.2. Сірководень, сульфіди, гідросульфіди
Сірководень є аналогом води. Його електронна формула
Показує, що в утворенні зв'язків Н-S-H беруть участь два р-електрона зовнішнього рівня атома сірки. Молекула H 2 S має кутову форму, тому вона полярна.
^ Знаходження в природі
Сірководень зустрічається в природі в вулканічних газах і в водах деяких мінеральних джерел, наприклад П'ятигорська, Мацеста. Він утворюється при гнитті сірковмісних органічних речовин різних тварин і рослинних залишків. Цим пояснюється характерний неприємний запах стічних вод, вигрібних ям і звалищ сміття.
отримання
1. Сірководень може бути отриманий безпосереднім з'єднанням сірки з воднем при нагріванні:
2. Але зазвичай його отримують дією розведеної соляної або сірчаної кислоти на сульфід заліза (III):
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Цю реакцію часто проводять в апараті кіп.
^ Фізичні властивості
У звичайних умовах сірководень - безбарвний газ з сильним характерним запахом тухлих яєць. Дуже отруйний, при вдиханні зв'язується з гемоглобіном, викликаючи параліч, що неред-
До призводить до смертельного результату. У малих концентраціях менш небезпечний. Працювати з ним треба в витяжних шафах або з герметично закриваються приладами. Допустимий вміст H 2 S в виробничих приміщеннях становить 0,01 мг в 1 л повітря.
Сірководень порівняно добре розчинний у воді (при 20 ° С в 1 об'ємі води розчиняється 2,5 об'єму сірководню).
Розчин сірководню у воді називається сірководневою водою або сірководневої кислотою (вона виявляє властивості слабкої кислоти).
^ Хімічні властивості
1, якщо сильно нагріються сірководень майже повністю розкладається з утворенням сірки і водню.
2. Газоподібний сірководень горить на повітрі блакитним полум'ям з утворенням оксиду сірки (IV) і води:
2H 2 S 3O 2 = 2SO 2 2Н 2 Про
При нестачі кисню утворюється сірка і вода: 2H 2 S О 2 = 2S 2Н 2 O
3. Сірководень - досить сильний відновник. Це його важливе хімічне властивість можна пояснити так. У розчині H 2 S порівняно легко віддає електрони молекулам кисню повітря:
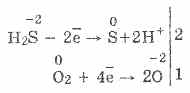
При цьому кисень повітря окисляє сірководень до сірки, яка робить сірководневу воду каламутною:
2H 2 S O 2 = 2S 2H 2 O
Цим пояснюється і те, що сірководень не накопичується в дуже великих кількостях в природі при гнитті органічних речовин - кисень повітря окисляє його в вільну сірку.
4, Сірководень енергійно реагує з розчинами галогенів, наприклад:
H 2 S I 2 = 2HI S Відбувається виділення сірки і знебарвлення розчину йоду.
5. Різні окислювачі енергійно реагують з сірководнем: при дії азотної кислоти утворюється вільна сірка.
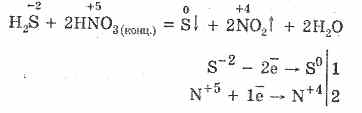
6. Розчин сірководню має кислу реакцію через дисоціацій:
H 2 SН HS - HS - H S -2
Зазвичай переважає перший ступінь. Він є дуже слабкою кислотою: слабкіше вугільної, яка зазвичай витісняє H 2 S з сульфідів.
Сульфіди і гідросульфіди
Сірководнева кислота, як двухосновная, утворює два ряди солей:
Середні - сульфіди (Na 2 S);
Кислі - гідросульфіди (NaHS).
Ці солі можуть бути отримані: - взаємодією гідроксидів з сірководнем: 2NaOH H 2 S = Na 2 S 2Н 2 Про
Безпосереднім взаємодією сірки з металами:
Обмінної реакцією солей з H 2 S або між солями:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Гідросульфіди майже все добре розчинні у воді.
Сульфіди лужних і лужноземельних металів також легко розчиняються у воді, безбарвні.
Сульфіди важких металів практично нерозчинні або малорозчинні у воді (FeS, MnS, ZnS); деякі з них не розчиняються і в розбавлених кислотах (CuS, PbS, HgS).
Як солі слабкої кислоти, сульфіди в водних розчинах сильно гідроліз. Наприклад, сульфіди лужних металів при розчиненні в воді мають лужну реакцію:
Na 2 S НОНNaHS NaOH
Всі сульфіди, як і сам сірководень, є енергійними відновниками:
3PbS -2 8HN 5 O 3 (разб.) = 3PbS 6 O 4 4Н 2 O 8N 2 O
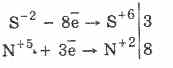
Деякі сульфіди мають характерну забарвлення: CuS і PbS - чорну, CdS - жовту, ZnS - білу, MnS - рожеву, SnS - коричневу, Al 2 S 3 - помаранчеву. На різній розчинності сульфідів і різної забарвленням багатьох з них грунтується якісний аналіз катіонів.
^ 4.3. Оксид сірки (IV) і сірчиста кислота
Оксид сірки (IV), або сірчистий газ, при звичайних умовах безбарвний газ з різким задушливим запахом. При охолодженні до -10 ° С зріджується в безбарвну рідину.
отримання
1. У лабораторних умовах оксид сірки (IV) отримують з солей сірчистої кислоти дією на них сильними кислотами:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2SO 2 2H 2 O
2. Також сірчистий газ утворюється при взаємодії концентрованої сірчаної кислоти при нагріванні з малоактивними металами:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2Н 2 Про
Cu 4Н 2SO 2 4 = Cu 2 SO 2 4 SO 2 2H 2 O
3. Оксид сірки (IV) утворюється також при спалюванні сірки в повітрі або кисні:
4. У промислових умовах SO 2 отримують при випалюванні піриту FeS 2 або сірчистих руд кольорових металів (цинкової обманки ZnS, свинцевого блиску PbS і ін.):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Структурна формула молекули SO 2:
В утворенні зв'язків в молекулі SO 2 беруть участь чотири електрона сірки і чотири електрона від двох атомів кисню. Взаємне відштовхування зв'язують електронних пар і неподіленої електронної пари сірки надає молекулі кутову форму.
Хімічні властивості
1. Оксид сірки (IV) проявляє всі властивості кислотних оксидів:
Взаємодія з водою,
Взаємодія з лугами,
Взаємодія з основними оксидами.
2. Для оксиду сірки (IV) характерні відновні властивості:
S 4 O 2 O 0 2 2S 6 O -2 3 (в присутності каталізатора, при нагріванні)
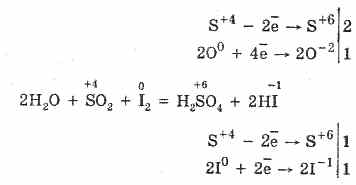
Але в присутності сильних відновників SO 2 поводиться як окислювач:
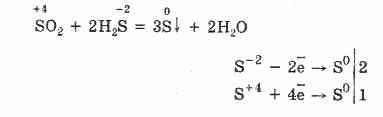
Окислювально-відновна двоїстість оксиду сірки (IV) пояснюється тим, що сірка має в ньому ступінь окислення 4, і тому вона може, віддаючи 2 електрона, окислюватися до S 6, а приймаючи 4 електрона, відновлюватися до S °. Прояв цих або інших властивостей залежить від природи реагує компонента.
Оксид сірки (IV) добре розчинний у воді (в 1 об'ємі при 20 ° С розчиняється 40 об'ємів SO 2). При цьому утворюється існуюча тільки у водному розчині сірчиста кислота:
SO 2 Н 2 ОH 2 SO 3
Реакція оборотна. У водному розчині оксид сірки (IV) і сірчиста кислота знаходяться в хімічному рівновазі, яке можна зміщувати. При зв'язуванні H 2 SO 3 (нейтралізація кисло
Ти) реакція протікає в бік утворення сірчистої кислоти; при видаленні SO 2 (продування через розчин азоту або нагрівання) реакція протікає в бік вихідних речовин. У розчині сірчистої кислоти завжди є оксид сірки (IV), який надає йому різкий запах.
Сірчиста кислота має всі властивості кислот. У розчині дисоціює ступінчасто:
H 2 SO 3 Н HSO - 3 HSO - 3 Н SO 2 3
Термічно нестійка, летюча. Сірчиста кислота, як двухосновная, утворює два типи солей:
Середні - сульфіти (Na 2 SO 3);
Кислі - гідросульфіти (NaHSO 3).
Сульфіти утворюються при повній нейтралізації кислоти лугом:
H 2 SO 3 2NaOH = Na 2 SO 3 2Н 2 Про
Гідросульфіти виходять при недостатній кількості лугу:
H 2 SO 3 NaOH = NaHSO 3 Н 2 О
Сірчиста кислота і її солі мають як окисними, так і відновні властивості, що визначається природою партнера по реакції.
1. Так, під дією кисню сульфіти окислюються до сульфатів:
2Na 2 S 4 O 3 Про 0 2 = 2Na 2 S 6 O -2 4
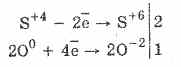
Ще легше протікає окислення сірчистої кислоти бромом і перманганатом калію:
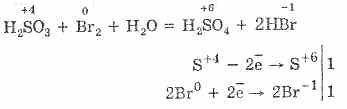
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3Н 2 O
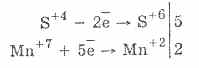
2. У присутності ж більш енергійних відновників сульфіти проявляють окисні властивості:
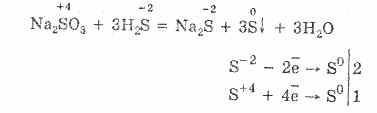
З солей сірчистої кислоти розчиняються майже всі гідросульфіти і сульфіти лужних металів.
3. Оскільки H 2 SO 3 є слабкою кислотою, при дії кислот на сульфіти і гідросульфіти відбувається виділення SO 2. Цей метод зазвичай використовують при отриманні SO 2 в лабораторних умовах:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. Розчинні у воді сульфіти легко піддаються гідролізу, внаслідок чого в розчині збільшується концентрація OH - іонів:
Na 2 SO 3 НОНNaHSO 3 NaOH
застосування
Оксид сірки (IV) і сірчиста кислота обесцвечивают багато барвники, утворюючи з ними безбарвні з'єднання. Останні можуть знову розкладатися при нагріванні або на світлі, в результаті чого забарвлення відновлюється. Отже, Бєляєв дію SO 2 і H 2 SO 3 відрізняється від Бєляєв дії хлору. Зазвичай рксідом сірки (IV) білять шерсть, шовк і солому.
Оксид сірки (IV) вбиває багато мікроорганізмів. Тому для знищення цвілевих грибків їм обкурюють сирі підвали, льохи, винні бочки та ін. Використовується також при перевезенні та зберіганні фруктів і ягід. У великих кількостях оксид сірки IV) застосовується для отримання сірчаної кислоти.
Важливе застосування знаходить розчин гідросульфіту кальцію CaHSO 3 (сульфітно луг), яким обробляють деревину і паперову масу.
^ 4.4. Оксид сірки (VI). Сірчана кислота
Оксид сірки (VI) (див. Табл. 20) - безбарвна рідина, що твердіє при температурі 16,8 ° С в тверду кристалічну масу. Він дуже сильно поглинає вологу, утворюючи сірчану кислоту: SO 3 Н 2 O = H 2 SO 4
Таблиця 20. Властивості оксидів сірки
Розчинення оксиди сірки (VI) в воді супроводжується виділенням значної кількості теплоти.
Оксид сірки (VI) дуже добре розчинний в концентрованої сірчаної кислоти. Розчин SO 3 в безводної кислоті називається олеумом. ОЛЕУМ можуть містити до 70% SO 3.
отримання
1. Оксид сірки (VI) отримують окисленням сірчистого газу киснем повітря в присутності каталізаторів при температурі 450 ° С (див. Отримання сірчаної кислоти):
2SO 2 O 2 = 2SO 3
2. Іншим способом окислення SO 2 до SO 3 є використання в якості окислювача оксиду азоту (IV):
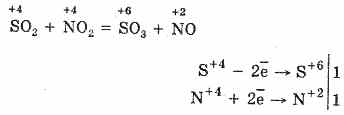
Утворений оксид азоту (II) при взаємодії з киснем повітря легко і швидко перетворюється в оксид азоту (IV): 2NO О2 = 2NO 2
Який знову може використовуватися в окисленні SO 2. Отже, NO 2 виконує роль переносника кисню. Цей спосіб окислення SO 2 до SO 3 називається нітрозним. Молекула SO 3 має форму трикутника, в центрі якого
Знаходиться атом сірки:
Така будова обумовлено взаємним відштовхуванням що пов'язують електронних пар. На їх освіту атом сірки надав шість зовнішніх електронів.
Хімічні властивості
1. SO 3 - типовий кислотний оксид.
2. Оксид сірки (VI) має властивості сильного окислювача.
застосування
Оксид сірки (VI) використовують для виробництва сірчаної кислоти. Найбільше значення має контактний спосіб отримання
Сірчаної кислоти. За цим способом можна отримати H 2 SO 4 будь-якої концентрації, а також олеум. Процес складається з трьох стадій: отримання SO 2; окислення SO 2 в SO 3; отримання H 2 SO 4.
SO 2 отримують випалюванням піриту FeS 2 в спеціальних печах: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Для прискорення випалювання пірит попередньо подрібнюють, а для більш повного вигоряння сірки вводять значно більше повітря (кисню), ніж потрібно за реакції. Газ, що виходить з печі випалу, складається з оксиду сірки (IV), кисню, азоту, сполук миш'яку (з домішок в колчедане) і водяної пари. Він називається випалювальних газом.
Випалювальних газ піддається ретельному очищенню, так як навіть невеликий вміст сполук миш'яку, а також пилу і вологи отруює каталізатор. Від сполук миш'яку і від пилу газ очищають, пропускаючи його через спеціальні електрофільтри і промивну вежу; волога поглинається концентрованої сірчаної кислотою в сушильній башті. Очищений газ, що містить кисень, нагрівається в теплообміннику до 450 ° C і надходить в контактний апарат. Усередині контактного апарату є гратчасті полиці, заповнені каталізатором.
Раніше в якості каталізатора використовували мелкораздробленного металеву платину. Згодом вона була замінена сполуками ванадію - оксидом ванадію (V) V 2 O 5 або сульфатом ванадила VOSO 4, які дешевше платини і повільніше отруюються.
Реакція окислення SO 2 в SO 3 оборотна:
2SO 2 О 2 2SO 3
Збільшення вмісту кисню в випалювальному газі підвищує вихід оксиду сірки (VI): при температурі 450 ° С він зазвичай досягає 95% і вище.
Утворився оксид сірки (VI) далі подають методом протитоку в поглинальну вежу, де він поглинається концентрованої сірчаної кислотою. У міру насичення спочатку утворюється безводна сірчана кислота, а потім олеум. Надалі олеум розбавляють до 98% -ної сірчаної кислоти і поставляють споживачам.
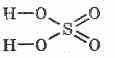
Структурна формула сірчаної кислоти:
^ Фізичні властивості
Сірчана кислота - важка безбарвна масляниста рідина, кристалізується при 10,4 ° С, майже вдвічі ( = 1,83 г / см 3) важча за воду, не має запаху, нелеткі. Вкрай гігроскопічна. Поглинає вологу з виділенням великої кількості теплоти, тому не можна воду доливати до концентрованої сірчаної кислоти - відбудеться розбризкування кислоти. для роз-
Додану треба сірчану кислоту доливати невеликими порціями до води.
Безвода сірчана кислота розчиняє до 70% оксиду сірки (VI). При нагріванні відщеплює SO 3 до тих пір, поки не утвориться розчин з масовою часткою H 2 SO 4 98,3%. Безвода H 2 SO 4 майже не проводить електричний струм.
^ Хімічні властивості
1. З водою змішується в будь-яких співвідношеннях і утворює гідрати різного складу:
H 2 SO 4 Н 2 О, H 2 SO 4 2Н 2 О, H 2 SO 4 3Н 2 O, H 2 SO 4 4Н 2 О, H 2 SO 4 6,5Н 2 O
2. Концентрована сірчана кислота обугливает органічні речовини - цукор, папір, дерево, волокно, віднімаючи від них елементи води:
З 12 Н 22 Про 11 H 2 SO 4 = 12С H 2 SO 4 11Н 2 O
Утворився вугілля частково вступає у взаємодію з кислотою:
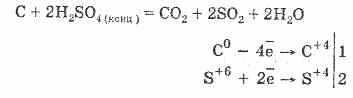
На поглинанні води сірчаною кислотою заснована осушення газів.
Як сильна нелетка кислота H 2 SO 4 витісняє інші кислоти з сухих солей:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Однак якщо додавати, H 2 SO 4 до розчинів солей, то витіснення кислот не відбувається.
H 2 SO 4 - сильна двухосновная кислота: H 2 SO 4 Н HSO - 4 HSO - 4 H SO 2 4
Має всі властивості нелетких сильних кислот.
Розбавлена сірчана кислота характеризується усіма властивостями кислот-неокислителях. А саме: взаємодіє з металами, які стоять в електрохімічному ряді напруг металів до водню:
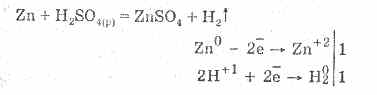
Взаємодія з металами йде за рахунок відновлення іонів водню.
6. Концентрована сірчана кислота є енергійним окислювачем. При нагріванні окисляє більшість металів, в тому числі і стоять в електрохімічному ряді напруг після водню, Не реагує тільки з платиною і золотом. Залежно від активності металу в якості продуктів відновлення можуть бути S -2, S ° і S 4.
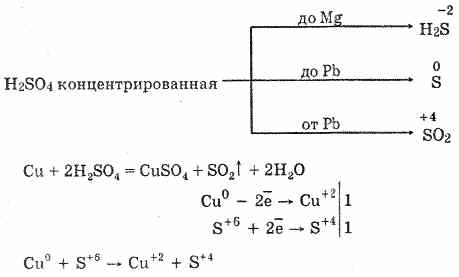
На холоду концентрована сірчана кислота не взаємодіє з такими сильними металами, як алюміній, залізо, хром. Це пояснюється пасивацією металів. Дану особливість широко використовують при її транспортуванні в залізній тарі.
Однак при нагріванні:
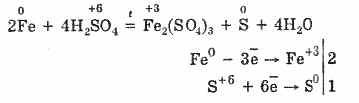
Таким чином, концентрована сірчана кислота взаємодіє з металами за рахунок відновлення атомів кислотоутворювачами.
Якісною реакцією на сульфат-іон SO 2 4 є утворення білого кристалічного осаду BaSO 4, нерозчинного у воді і кислотах:
SO 2 4 Ba 2 BaSO 4
застосування
Сірчана кислота є найважливішим продуктом основної хімічної промисловості, що займається виробництвом не-
Органічних кислот, лугів, солей, мінеральних добрив і хлору.
За різноманітністю застосування сірчана кислота займає перше місце серед кислот. Найбільша кількість її витрачається для отримання фосфорних і азотних добрив. Будучи нелетучей, сірчана кислота використовується для отримання інших кислот - соляної, фтороводородной, фосфорної і оцтової.
Багато її йде для очищення нафтопродуктів - бензину, гасу, мастильних масел - від шкідливих домішок. У машинобудуванні сірчаною кислотою очищають поверхню металу від оксидів перед покриттям (никелированием, хромуванням і ін.). Сірчану кислоту застосовують у виробництві вибухових речовин, штучних волокон, барвників, пластмас і багатьох інших. Її вживають для заливки акумуляторів.
Важливе значення мають солі сірчаної кислоти.
^ Сульфат натріюNa 2 SO 4 кристалізується з водних розчинів у вигляді гідрату Na 2 SO 4 10Н 2 О, який називається глауберовой сіллю. Застосовується в медицині як проносний. Безводний сульфат натрію застосовують у виробництві соди і скла.
^ Сульфат амонію(NH 4) 2 SO 4 - азотне добриво.
сульфат каліюK 2 SO 4 - калійне добриво.
сульфат кальцію СаSО 4 зустрічається в природі у вигляді мінералу гіпсу CaSO 4 2Н 2 О. При нагріванні до 150 ° С він втрачає частину води і переходить в гідрат складу 2CaSO 4 H 2 O, званий паленим гіпсом, або алебастром. Алебастр при замішуванні з водою в тістоподібну масу через деякий час знову твердне, перетворюючись в CaSO 4 2Н 2 О. Гіпс широко застосовується в будівельній справі (штукатурка).
^ Сульфат магніюMgSO 4 міститься в морській воді, обумовлюючи її гіркий смак. Кристалогідрат, званий гіркою сіллю, застосовують як проносне.
купоросу- технічна назва кристалогідратів сульфатів металів Fe, Cu, Zn, Ni, Co (зневоднені солі купоросу не є). Мідний купоросCuSO 4 5Н 2 О - отруйна речовина синього кольору. Його розведеним розчином обприскують рослини і протруюють насіння перед посівом. Залізний купоросFeSO 4 7Н 2 О - світло-зелена речовина. Застосовують для боротьби з шкідниками рослин, приготування чорнила, мінеральних фарб і т.д. цинковий купоросZnSO 4 7Н 2 O використовують у виробництві мінеральних фарб, в ситцедрукуванні, медицині.
^ 4.5. Ефіри сірчаної кислоти. тіосульфат натрію
До ефірів сірчаної кислоти відносяться діалкілсульфати (RO 2) SO 2. Це висококиплячі рідини; нижчі розчинні у воді; в присутності лугів утворюють спирт і солі сірчаної кислоти. Нижчі діалкілсульфати - алкілуючі агенти.
діетилсульфат(C 2 H 5) 2 SO 4. Температура плавлення -26 ° С, температура кипіння 210 ° С, розчинний в спиртах, не розчиняється у воді. Отримано взаємодією сірчаної кислоти з етанолом. Є етілірующім агентом в органічному синтезі. Проникає через шкіру.
диметилсульфат(CH 3) 2 SO 4. Температура плавлення -26,8 ° С, температура кипіння 188,5 ° С. Розчинний в спиртах, погано - у воді. Реагує з аміаком під час відсутності розчинника (з вибухом); сульфируют деякі ароматичні сполуки, наприклад ефіри фенолів. Отримують взаємодією 60% -ного олеума з метанолом при 150 ° С, Є метіліруется агентом в органічному синтезі. Канцероген, вражає очі, шкіру, органи дихання.
^ тіосульфат натрію Na 2 S 2 O 3
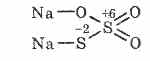
Сіль тіосерной кислоти, в якій два атоми сірки мають різні ступені окислення: 6 і -2. Кристалічна речовина, добре розчиняється у воді. Випускається у вигляді кристалогідрату Na 2 S 2 O 3 5Н 2 O, в побуті званий гипосульфитом. Отримують взаємодією сульфіту натрію з сіркою при кип'ятінні:
Na 2 SO 3 S = Na 2 S 2 O 3
Як і тіосерная кислота, є сильним відновником, Легко окислюється хлором до сірчаної кислоти:
Na 2 S 2 O 3 4Сl 2 5Н 2 О = 2H 2 SO 4 2NaCl 6НСl
На цій реакції було засновано застосування тіосульфату натрію для поглинання хлору (в перших протигазах).
Дещо по-іншому відбувається окислення тіосульфату натрію слабкими окислювачами. При цьому утворюються солі тетратіоновой кислоти, наприклад:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Тіосульфат натрію є побічним продуктом у виробництві NaHSO 3, сірчистих барвників, при очищенні промислових газів від сірки. Застосовується для видалення слідів хлору після відбілювання тканин, Для вилучення срібла з руд; є фіксажем в фотографії, реактивом в иодометрии, протиотрутою при отруєнні сполуками миш'яку, ртуті, протизапальним засобом.
Хімічний елемент сірка розташований в VIа-групі, 3 періоді ПСХЕ. На зовнішньому електронному шарі атома сірки знаходиться 6 електронів. Виявляючи властивості окислювача при утворенні речовин з металами і воднем, сірка набуває ступінь окислення -2 (приймає 2 електрона).
У складі кисневмісних сполук сірка виявляє ступеня окислення +4 і +6. Таким чином, для сірки характерні ступені окислення -2; 0; +4; +6.
У природі сірка зустрічається в самородному стані і в складі мінералів. Наприклад, сірку містять свинцевий блиск (основний компонент - сульфід свинцю PbS) і мідний блиск (основний компонент - сульфід міді Cu 2 S).
Сірка утворює кілька простих речовин - аллотропних модифікацій. Найбільш стійка при кімнатній температурі ромбическая сірка (рис. 1). Ця речовина складається з молекул S 8. Ромбическая сірка жовтого кольору і плавиться при температурі + 112,8 ° С.
Мал. 1. Ромбическая модифікація сірки
При нагріванні ромбическая сірка поступово перетворюється на в'язку темно-коричневу масу. Це ще одна аллотропная модифікація сірки - пластична сірка. Пластична сірка складається з лінійних молекул сірки S n.
Сірка в хімічних реакціях з металами і воднем грає роль окислювача. Її ступінь окислення знижується від 0 до -2. В реакції з киснем сірка виступає в ролі відновника, підвищуючи свою ступінь окислення від 0 до +4.
Розглянемо приклади взаємодій за участю сірки.
При взаємодії сірки з воднем утворюється сірководень:
При взаємодії цинку з сіркою утворюється сульфід цинку:
Сірка згорає в кисні з утворенням оксиду сірки (IV) (рис. 2):

Мал. 2. Горіння сірки в кисні
Розглянемо властивості сполук сірки зі ступенем окислення «-2». До таких сполук відноситься сірководень і сульфіди - солі сірководневої кислоти.
Сірководень - це газ із запахом тухлих яєць. Він горить на повітрі. Причому при нестачі і надлишку кисню горіння протікає по-різному.
В надлишку кисню сірководень згоряє з утворенням оксиду сірки (IV) і води:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
При нестачі кисню відбувається неповне згоряння сірководню з виділенням сірки: 2H 2 S + O 2 = 2S + 2H 2 O.
Сірководень добре розчиняється в воді. Добутий розчин є слабкою сірководневою кислотою. Солі сірководневої кислоти називаються сульфідами. Сірководнева кислота і розчинні у воді сульфіди вступають в реакції обміну.
При взаємодії сірководневої кислоти і хлориду міді (II) утворюється нерозчинний сульфід міді (II) і соляна кислота: H 2 S + CuCl 2 = CuS + 2HCl.
При взаємодії сульфіду калію з нітратом цинку в осад випадає сульфід цинку і утворюється нітрат калію: K 2 S + Zn (NO 3) 2 = ZnS + 2KNO 3.
Список літератури
- Оржековскій П.А. Збірник завдань і вправ з хімії: 9-й кл .: до підручника П.А. Оржековского і ін. «Хімія. 9 клас »/ П.А. Оржековскій, Н.А. Титов, Ф.Ф. Гегеля. - М .: АСТ: Астрель, 2007. (с. 91-97)
- Оржековскій П.А. Хімія: 9-й клас: навч. для общеобразов. уста. / П.А. Оржековскій, Л.М. Мещерякова, Л.С. Понтак. - М .: АСТ: Астрель, 2007. (§ 34)
- Оржековскій П.А. Хімія: 9-ий клас: навч для загальноосвітніх. уста. / П.А. Оржековскій, Л.М. Мещерякова, М.М. Шалашова. - М .: Астрель, 2013. (§§ 20, 21)
- Рудзитис Г.Є. Хімія: неоргані. хімія. Орган. хімія: навч. для 9 кл. / Г.Є. Рудзитис, Ф.Г. Фельдман. - М .: Просвещение, ВАТ «Московські підручники», 2009.
- Хомченко І.Д. Збірник завдань і вправ з хімії для середньої школи. - М .: РІА «Нова хвиля»: Видавець Умеренков, 2008.
- Енциклопедія для дітей. Том 17. Хімія / Глав. ред. В.А. Володін, вед. науч. ред. І. Леенсон. - М .: Аванта +, 2003.
- Єдина колекція цифрових освітніх ресурсів (відеоопити по темі) ().
- Електронна версія журналу «Хімія і життя» ().
Домашнє завдання
- с. 136 № 3; с.140 №№ 2-4 з підручника П.А. Оржековского «Хімія: 9-ий клас» / П.А. Оржековскій, Л.М. Мещерякова, М.М. Шалашова. - М .: Астрель, 2013.
сульфіди (Від лат. Sulphur, sulfur - сірка)
сполуки сірки з більш електропозитивні елементами; можуть розглядатися як солі сірководневої кислоти (Див. сірководнева кислота) H 2 S. Є два ряди С .: середні (нормальні) загальної формули M 2 S і кислі (гідросульфіди) загальної формули MHS, де М - одновалентних метал. С. лужних металів безбарвні, добре розчинні у воді. Їх водні розчини сильно гідроліз і мають лужну реакцію. При дії розбавлених кислот виділяють H 2 S. С. лужноземельних металів безбарвні, у воді малорозчинні. У вологому повітрі виділяють H 2 S. По інших властивостях подібні С. лужних металів. І ті й інші С. легко окислюються до сульфатів. С. важких металів практично нерозчинні в воді. Майже всі вони чорного або чорно-бурого кольору (за винятком білого ZnS, рожевого MnS, жовтого CdS, оранжево-червоного Sb 2 S 3, жовтого SnS 2). Неоднакове ставлення С. до кислот і С. амонію використовується в хімічному аналізі. І. К. Малина.
Велика Радянська Енциклопедія. - М .: Радянська енциклопедія. 1969-1978 .
Дивитися що таке "Сульфіди" в інших словниках:
Сполуки сірки з металами і деякими неметалами. Сульфіди металів солі сірководневої кислоти Н2S: середні (напр., Na2S) і кислі, або гідросульфіди (NaHS). Випалюванням природних сульфідів отримують кольорові метали і SO2. Сульфіди люмінофори і ... ... Великий Енциклопедичний словник
сучасна енциклопедія
сульфіди - сульфід, сульфіди сполуки сірки з металами і деякими неметалами. Входять до складу сульфідних руд; використовуються як люмінофори (наприклад, CdS, ZnS). Сульфіди молібдену, титану тверді мастильні матеріали. Сульфіди фосфору ... ... Ілюстрований енциклопедичний словник
- (ново лат., Від лат. Sulfur сірка). З'єднання якого-небудь тіла з сіркою, відповідні окисами або кислот. Словник іншомовних слів, які увійшли до складу російської мови. Чудінов А.Н., 1910. сульфід новолатинської., Від лат. sulfur, сірка. З'єднання ... ... Словник іншомовних слів російської мови
1. Природні сірчисті з'єднання металів і деяких неметалів. У хім. відношенні розглядаються як солі сірководневої кислоти H2S. Ряд елементів утворює з сірої полісульфіди, є солями полісерністой кислоти H2Sx. Найголовніші ... ... геологічна енциклопедія
сульфіди - - сполуки сірки з металами і деякими неметалами; сульфіди металів солі сірководневої кислоти H2S. [Термінологічний словник з бетону і залізобетону. ФГУП «НДЦ« Будівництво »НДІЗБ і м. А. А. Гвоздьова, Москва, 2007 р 110 стор.] ... ... Енциклопедія термінів, визначень і пояснень будівельних матеріалів
Сульфід, ов, од. сульфід, а, чоловік. (Спец.). Хімічні сполуки сірки з металами і недо римі неметаллами. Органічні с. Природні с. | дод. сульфідні, а, е. Тлумачний словник Ожегова. С.І. Ожегов, Н.Ю. Шведова. 1949 1992 ... Тлумачний словник Ожегова
Сульфіди, R2S (R ароматичний радикал), найлегше виходять пріпрібавленіі по краплях розчину діазосолей до нагрітого до 60 70 ... Енциклопедія Брокгауза і Ефрона
сульфід - (1) в неорганічної хімії такі сполуки елементів з сіркою, в яких атоми сірки мають ступінь окислення, рівну 2. У хім. відношенні розглядаються як солі слабкою сірководневою кислоти (водний розчин H2S). Багато С. є природними ... ... Велика політехнічна енциклопедія
Ов; мн. (Од. Сульфід, а; м.). [Від лат. sulphur сірка] Хім. Сполуки сірки з металами і деякими неметалами. С. титану. Органічні с. Природні с. (Клас мінералів). ◁ сульфідних, а, е. З перші суміші. З перші руди. * * * Сульфіди сполуки сірки ... енциклопедичний словник
- (від лат. Sulphur сірка) клас хімічних сполук, що представляють собою з'єднання металів (а також ряду неметалів У, Si, Р, As) з сіркою (S), де вона має ступінь окислення -2. Можуть розглядатися як солі сірководневої ... ... Вікіпедія
книги
- Родовища урану типу незгоди в фанерозое, Андрій Борисович Халезов. Розглянуто особливості родовищ урану в структурах річкових палеодолин на поверхнях структурного і стратиграфічного незгоди на прикладі трьох районовУральского регіону з різною ...
сірка - елемент 3-го періоду і VIA-групи Періодичної системи, порядковий номер 16, відноситься до халькогенам. Електронна формула атома [10 Ne] 3s 2 3p 4, характерні ступені окислення 0, -II, + IV і + VI, стан S VI вважається стійким.
Шкала ступенів окислення сірки:
Електронегативність сірки дорівнює 2,60, для неї характерні неметалеві властивості. У водневих і кисневих з'єднаннях знаходиться в складі різних аніонів, утворює кисень кислоти і їх солі, бінарні сполуки.
В природі - п'ятнадцятий по хімічній поширеності елемент (сьомий серед неметалів). Зустрічається у вільному (самородному) і пов'язаному вигляді. Життєво важливий елемент для вищих організмів.
Сірка S. Проста речовина. Жовта кристалічна (α-ромбічна і β-моноклінна,
при 95,5 ° C) або аморфна (пластична). У вузлах кристалічної решітки знаходяться молекули S 8 (неплоскі цикли типу «корона»), аморфна сірка складається з ланцюгів S n. Низькоплавких речовина, в'язкість рідини проходить через максимум при 200 ° C (розрив молекул S 8, переплетення ланцюгів S n). У парі - молекули S 8, S 6, S 4, S 2. При 1500 ° C з'являється одноатомна сірка (в хімічних рівняннях для простоти будь-яка сірка зображується як S).
Сірка не розчиняється у воді і при звичайних умовах не реагує з нею, добре розчинна в сероуглероде CS 2.
Сірка, особливо порошкоподібна, має високу активність при нагріванні. Реагує як окислювач з металами і неметалами:
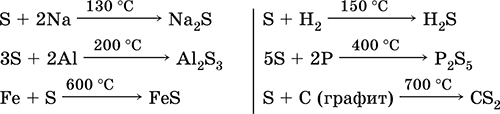
а як відновник - з фтором, киснем і кислотами (при кип'ятінні):
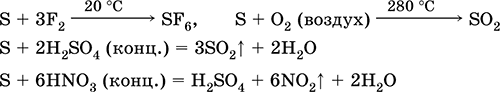
Сірка піддається дисмутації в розчинах лугів:
3S 0 + 6КОН (конц.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
При високій температурі (400 ° C) сірка витісняє йод з иодоводорода:
S + 2НI (г) = I 2 + H 2 S,
але в розчині реакція йде у зворотний бік:
I 2 + H 2 S (p) = 2 HI + S ↓
отримання: в промисловості виплавляється з природних покладів самородної сірки (за допомогою водяної пари), виділяється при десульфурації продуктів газифікації вугілля.
Сірка застосовується для синтезу сірковуглецю, сірчаної кислоти, сірчистих (кубових) барвників, при вулканізації каучуку, як засіб захисту рослин від борошнистої роси, для лікування шкірних захворювань.
Сірководень H 2 S. Безкиснева кислота. Безбарвний газ з задушливим запахом, важчий за повітря. Молекула має будову двічі незавершеного тетраедра [:: S (H) 2]
(Sp 3-гібридизація, валетний кут Н - S-Н далекий від тетраедричного). Нестійкий при нагріванні вище 400 ° C. Малорастворим в воді (2,6 л / 1 л Н 2 O при 20 ° C), насичений розчин децімолярний (0,1, «сірководнева вода»). Дуже слабка кислота в розчині, практично не дисоціює за другий стадії до іонів S 2- (максимальна концентрація S 2 рівна 1 10 -13 моль / л). При стоянні на повітрі розчин мутніє (інгібітор - сахароза). Нейтралізується лугами, в повному обсязі - гидратом аміаку. Сильний відновник. Вступає в реакції іонного обміну. Сульфидирующих агент, тримає в облозі з розчину разноокрашенние сульфіди з дуже малою розчинністю.
якісні реакції - осадження сульфідів, а також неповне згоряння H 2 S з утворенням жовтого нальоту сірки на внесеному в полум'я холодному предметі (фарфоровий шпатель). Побічний продукт очищення нафти, природного і коксового газу.
Застосовується у виробництві сірки, неорганічних і органічних сірковмісних сполук як аналітичний реагент. Надзвичайно отруйний. Рівняння найважливіших реакцій:
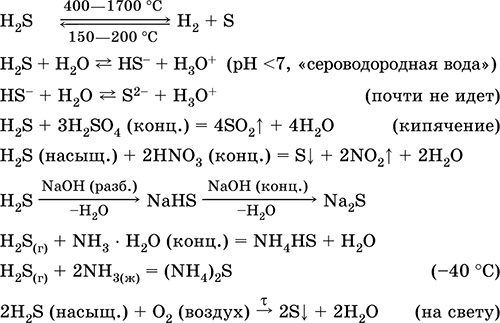

отримання: в промисловості - прямим синтезом:
Н 2 + S = H 2 S(150-200 ° C)
або при нагріванні сірки з парафіном;
в лабораторії - витісненням з сульфідів сильними кислотами
FeS + 2НCl (конц.) = FeCl 2 + H 2 S
або повним гідролізом бінарних сполук:
Al 2 S 3 + 6Н 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Сульфід натрію Na 2 S. Безкиснева сіль. Білий, дуже гігроскопічний. Плавиться без розкладання, термічно стійкий. Добре розчинний у воді, гідролізується за аніоном, створює в розчині сильнолужну середу. При стоянні на повітрі розчин мутніє (колоїдна сірка) і жовтіє (забарвлення полісульфіду). Типовий відновник. Приєднує сірку. Вступає в реакції іонного обміну.
якісні реакції на іон S 2- - осадження разноокрашенних сульфідів металів, з яких MnS, FeS, ZnS розкладаються в НCl (разб.).
Застосовується у виробництві сірчистих барвників і целюлози, для видалення волосяного покриву шкір під час дублення шкір, як реагент в аналітичній хімії.
Рівняння найважливіших реакцій:
Na 2 S + 2НCl (разб.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (конц.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (до 50 ° C)
Na 2 S + 4HNO 3 (конц.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (насичений.) = 2NaHS
Na 2 S (т) + 2O 2 = Na 2 SO 4 (вище 400 ° C)
Na 2 S + 4H 2 O 2 (конц.) = Na 2 SO 4 + 4H 2 O
S 2+ M 2+ = MnS (тілесні.) ↓; FeS (черн.) ↓; ZnS (біл.) ↓
S 2 + 2Ag + = Ag 2 S (черн.) ↓
S 2+ M 2+ = СdS (жовтий.) ↓; PbS, CuS, HgS (чорні) ↓
3S 2 + 2Bi 3+ = Bi 2 S 3 (кор. - черн.) ↓
3S 2 + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
отримання в промисловості - прожарювання мінералу мирабилит Na 2 SO 4 10Н 2 O в присутності відновників:
Na 2 SO 4 + 4Н 2 = Na 2 S + 4Н 2 O (500 ° C, кат. Fe 2 O 3)
Na 2 SO 4 + 4С (кокс) = Na 2 S + 4СО (800-1000 ° C)
Na 2 SO 4 + 4СО = Na 2 S + 4СO 2 (600-700 ° C)
Сульфід алюмінію Al 2 S 3. Безкиснева сіль. Білий, зв'язок Al - S переважно ковалентний. Плавиться без розкладання під надлишковим тиском N 2, легко переганяється. Окислюється на повітрі при прожаренні. Повністю гідролізується водою, не осідає з розчину. Розкладається сильними кислотами. Застосовується як твердий джерело чистого сірководню. Рівняння найважливіших реакцій:
Al 2 S 3 + 6Н 2 O = 2Al (OH) 3 ↓ + 3H 2 S (чистий)
Al 2 S 3 + 6НCl (разб.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (конц.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (повітря) = 2Al 2 O 3 + 6SO 2 (700-800 ° C)
отримання: Взаємодія алюмінію з розплавленої сірої під час відсутності кисню і вологи:
2Al + 3S = AL 2 S 3(150-200 ° C)
Сульфід заліза (II) FeS. Безкиснева сіль. Чорно-сірий з зеленим відтінком, тугоплавкий, розкладається при нагріванні в вакуумі. У вологому стані чутливий до кисню повітря. Не розчиняється в воді. Чи не випадає в осад при насиченні розчинів солей заліза (II) сірководнем. Розкладається кислотами. Застосовується як сировина у виробництві чавуну, твердий джерело сірководню.
З'єднання заліза (III) складу Fe 2 S 3 невідомо (ніхто не почув).
Рівняння найважливіших реакцій:
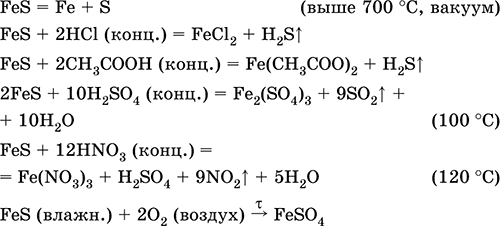
отримання:
Fe + S = FeS (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 FeS + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (хат.) = FeS ↓ + 2NH 4 Cl + H 2 S
Дисульфід заліза FeS 2. Бінарна сполука. Має іонну будову Fe 2+ (-S - S-) 2. Темно-жовтий, термічно стійкий, при прожарюванні розкладається. Не розчиняється в воді, не реагує з розведеними кислотами, лугами. Розкладається кислотами-окислювачами, піддається випалу на повітрі. Застосовується як сировина у виробництві чавуну, сірки і сірчаної кислоти, каталізатор в органічному синтезі. У природі - рудні мінерали пірит і марказіт.
Рівняння найважливіших реакцій:
FeS 2 = FeS + S (вище 1170 ° C, вакуум)
2FeS 2 + 14H 2 SO 4 (конц., Гір.) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (конц.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (повітря) = 8SO 2 + 2Fe 2 O 3 (800 ° C, випал)
Гідросульфід амонію NH 4 HS. Безкиснева кисла сіль. Білий, плавиться під надлишковим тиском. Вельми летючий, термічно нестійкий. На повітрі окислюється. Добре розчинний у воді, гідролізується по катіону і аніону (переважає), створює лужне середовище. Розчин жовтіє на повітрі. Розкладається кислотами, в насиченому розчині приєднує сірку. Лугами НЕ нейтралізується, середня сіль (NH 4) 2 S не існує в розчині (умови отримання середньої солі см. В рубриці «H 2 S»). Застосовується в якості компонента фотопроявітелей, як аналітичний реагент (осадитель сульфідів).
Рівняння найважливіших реакцій:
NH 4 HS = NH 3 + H 2 S (вище 20 ° C)
NH 4 HS + НCl (разб.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (конц.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (насичений. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
отримання: Насичення концентрованого розчину NH 3 сірководнем:
NH 3 Н 2 O (конц.) + H 2 S (г) = NH 4 HS + Н 2 O
В аналітичній хімії розчин, що містить рівні кількості NH 4 HS і NH 3 Н 2 O, умовно вважають розчином (NH 4) 2 S і використовують формулу середньої солі в запису рівнянь реакцій, хоча сульфід амонію повністю гідролізується у воді до NH 4 HS і NH 3 Н 2 O.
Діоксид сірки. сульфіти
Діоксид сірки SO 2. Кислотний оксид. Безбарвний газ з різким запахом. Молекула має будову незавершеного трикутника [: S (O) 2] (sр 2-гібридизація), містить σ, π-зв'язку S = O. Легко зріджується, термічно стійкий. Добре розчинний у воді (~ 40 л / 1 л Н 2 O при 20 ° C). Утворює полігідрат, що володіє властивостями слабкої кислоти, продукти дисоціації - іони HSO 3 - і SO 3 2-. Іон HSO 3 - має дві таутомерні форми - симетричну (Некіслотние) з будовою тетраедра (sр 3-гібридизація), яка переважає в суміші, і несиметричну (Кислотну) з будовою незавершеного тетраедра [: S (O) 2 (OH)] (sр 3-гібридизація). Іон SO 3 2- також тетраедричних [: S (O) 3].
Реагує з лугами, гідратом аміаку. Типовий відновник, слабкий окислювач.
якісна реакція - знебарвлення жовто-коричневої «йодної води». Проміжний продукт у виробництві сульфітів і сірчаної кислоти.
Застосовується для відбілювання вовни, шовку і соломи, консервування та зберігання фруктів, як дезінфікуючий засіб, антиоксидант, холодоагент. Отруйний.
З'єднання складу H 2 SO 3 (сірчиста кислота) невідомо (не існує).
Рівняння найважливіших реакцій:
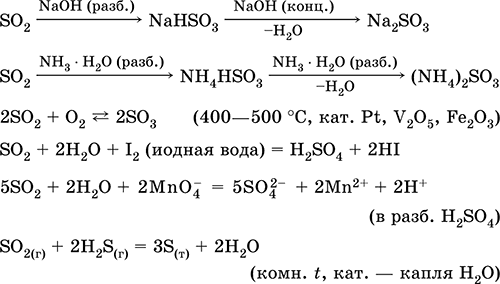
Розчинення у воді і кислотні властивості:
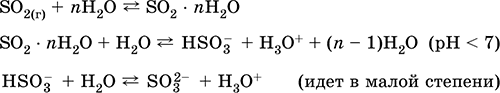
отримання: В промисловості - спалювання сірки в повітрі, збагаченому киснем, і, в меншій мірі, випал сульфідних руд (SO 2 - попутний газ при випалюванні піриту):
S + O 2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, випал)
в лабораторії - витіснення сірчаною кислотою з сульфітів:
BaSO 3 (т) + H 2 SO 4 (конц.) = BaSO 4 ↓ + SO 2 + Н 2 O
Сульфіт натрію Na 2 SO 3. Оксосоль. Білий. При нагріванні на повітрі розкладається без плавлення, плавиться під надлишковим тиском аргону. У вологому стані і в розчині чутливий до кисню повітря. Добре розчинний у воді, гідролізується за аніоном. Розкладається кислотами. Типовий відновник.
якісна реакція на іон SO 3 2- - утворення білого осаду сульфіту барію, який переводиться в розчин сильними кислотами (НCl, HNO 3).
Застосовується як реактив в аналітичної хімії, компонент фотографічних розчинів, нейтралізатор хлору при відбілюванні тканин.
Рівняння найважливіших реакцій:
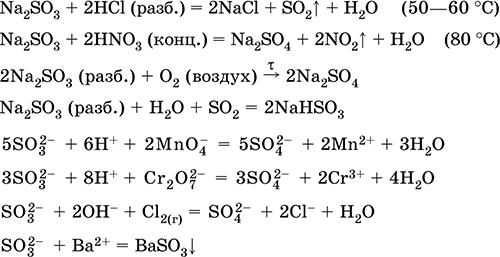
отримання:
Na 2 CO 3 (конц.) + SO 2 = Na 2 SO 3 + CO 2
Сірчана кислота. сульфати
Сірчана кислота H 2 SO 4. Оксокислот. Безбарвна рідина, дуже в'язка (маслоподібними), вельми гігроскопічна. Молекула має спотворено-тетраедричну будова (sр 3-гібридизація), містить ковалентні σ-зв'язку S - ОН і σπ-зв'язку S = O. Іон SO 4 2- має правильно-тетраедричну будова. Володіє широким температурним інтервалом рідкого стану (~ 300 градусів). При нагріванні вище 296 ° C частково розкладається. Переганяється у вигляді азеотропної суміші з водою (масова частка кислоти 98,3%, температура кипіння 296-340 ° C), при більш сильному нагріванні розкладається повністю. Необмежено змішується з водою (з сильним екзо-ефекту). Сильна кислота в розчині, нейтралізується лугами і гидратом аміаку. Перекладає метали в сульфати (при надлишку концентрованої кислоти в звичайних умовах утворюються розчинні гидросульфати), але метали Be, Bi, З, Fe, Mg і Nb пасивуються в концентрованій кислоті і не реагують з нею. Реагує з основними оксидами і гідроксидами, розкладає солі слабких кислот. Слабкий окислювач в розбавленому розчині (за рахунок Н I), сильний - в концентрованому розчині (за рахунок S VI). Добре розчиняє SO 3 і реагує з ним (утворюється важка маслоподібними рідина - олеум, містить H 2 S 2 O 7).
якісна реакція на іон SO 4 2- - осадження білого сульфату барію BaSO 4 (осад не переводиться в розчин соляної і азотної кислотами, на відміну від білого осаду BaSO 3).
Застосовується у виробництві сульфатів та інших сполук сірки, мінеральних добрив, вибухових речовин, барвників і лікарських препаратів, в органічному синтезі, для «розтину» (першого етапу переробки) промислово важливих руд і мінералів, при очищенні нафтопродуктів, електролізі води, як електроліт свинцевих акумуляторів . Отруйна, викликає опіки шкіри. Рівняння найважливіших реакцій:
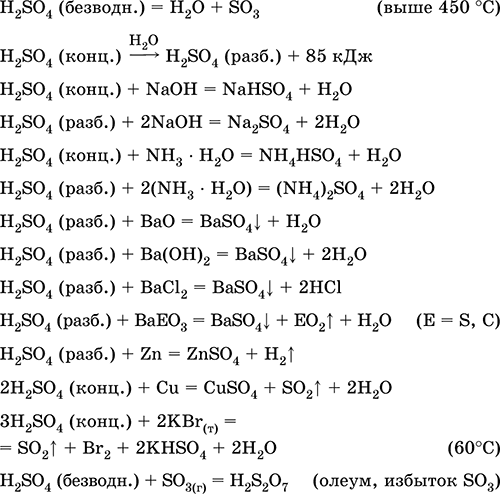
отримання в промисловості:
а) синтез SO 2 з сірки, сульфідних руд, сірководню і сульфатних руд:
S + O 2 (повітря) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (повітря) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, випал)
2H 2 S + 3O 2 (хат.) = 2 SO 2 +2 Н 2 O (250-300 ° C)
CaSO 4 + С (кокс) = СаО + SO 2 + СО (1300-1500 ° C)
б) конверсія SO 2 в SO 3 в контактному апараті:
в) синтез концентрованої і безводної сірчаної кислоти:
Н 2 O (разб. H 2 SO 4) + SO 3 = H 2 SO 4(Конц., Безводний.)
(Поглинання SO 3 чистою водою з отриманням H 2 SO 4 не проводиться через сильний розігрівання суміші і зворотного розкладання H 2 SO 4, див. Вище);
г) синтез олеума - суміші безводної H 2 SO 4, дісерной кислоти H 2 S 2 O 7 і надлишкового SO 3. Розчинений SO 3 гарантує безводний олеума (при попаданні води тут же утворюється H 2 SO 4), що дозволяє безпечно перевозити його в сталевих цистернах.
Сульфат натрію Na 2 SO 4. Оксосоль. Білий, гігроскопічний. Плавиться і кипить без розкладання. Утворює кристаллогидрат (мінерал мирабилит), легко втрачає воду; технічна назва глауберової сіль. Добре розчинний у воді, не гідролізується. Реагує з H 2 SO 4 (конц.), SO 3. Відновлюється воднем, коксом при нагріванні. Вступає в реакції іонного обміну.
Застосовується у виробництві скла, целюлози і мінеральних фарб, як лікарський засіб. Міститься в ропі соляних озер, зокрема в затоці Кара-Богаз-Гол Каспійського моря.
Рівняння найважливіших реакцій:
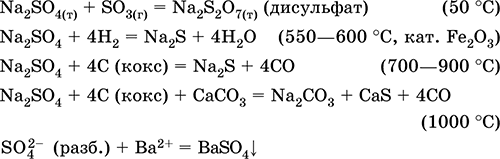
Гідросульфат калію KHSO 4. Кисла оксосоль. Білий, гігроскопічний, але кристаллогидратов не утворює. При нагріванні плавиться і розкладається. Добре розчинний у воді, в розчині аніон піддається дисоціації, середа розчину сильнокислотную. Нейтралізується лугами.
Застосовується як компонент флюсів в металургії, складова частина мінеральних добрив.
Рівняння найважливіших реакцій:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (до 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + Н 2 O (320-340 ° C)
KHSO 4 (разб.) + КОН (конц.) = K 2 SO 4 + Н 2 O KHSO 4 + КCl = K 2 SO 4 + НCl (450-700 ° C)
6KHSO 4 + М 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° C, M = Al, Cr)
отримання: Обробка сульфату калію концентрованої (більш ніж 6O% -ної) сірчаної кислотою на холоду:
K 2 SO 4 + H 2 SO 4 (конц.) = 2 KHSO 4
Сульфат кальцію CaSO 4. Оксосоль. Білий, вельми гігроскопічний, тугоплавкий, при прожаренні розкладається. Природний CaSO 4 зустрічається у вигляді дуже поширеного мінералу гіпс CaSO 4 2Н 2 O. При 130 ° C гіпс втрачає частину води і переходить в палений (штукатурний) гіпс2CaSO 4 Н 2 O (технічна назва алебастр). Повністю зневоднений (200 ° C) гіпс відповідає мінералу ангідритCaSO 4. Малорастворим в воді (0,206 г / 100 г Н 2 O при 20 ° C), розчинність зменшується при нагріванні. Реагує з H 2 SO 4 (конц.). Відновлюється коксом при сплаву. Визначає більшу частину «постійної» жорсткості прісної води (докладніше див. 9.2).
Рівняння найважливіших реакцій: 100-128 ° C
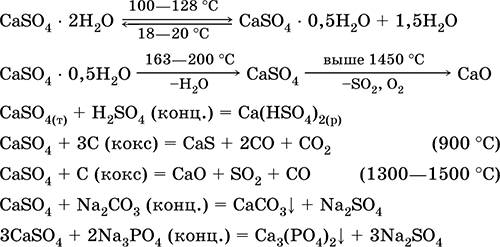
Застосовується як сировина у виробництві SO 2, H 2 SO 4 і (NH 4) 2 SO 4, як флюс в металургії, наповнювач паперу. Приготований з паленого гіпсу терпкий будівельний розчин «схоплюється» швидше, ніж суміш на основі Са (ОН) 2. Затвердіння забезпечується зв'язуванням води, утворенням гіпсу у вигляді кам'яної маси. Використовується палений гіпс для виготовлення гіпсових зліпків, архітектурно-декоративних форм і виробів, перегородкових плит і панелей, кам'яних підлог.
Сульфат алюмінію-калію KAl (SO 4) 2. Подвійна оксосоль. Білий, гігроскопічний. При сильному нагріванні розкладається. Утворює кристаллогидрат - алюжокаліевие галун. Помірно розчинний у воді, гідролізується по катіону алюмінію. Реагує з лугами, гідратом аміаку.
Застосовується як протрава при фарбуванні тканин, дубитель шкір, коагулянт при очищенні прісної води, компонент складів для проклеювання паперу, зовнішнє кровоспинний засіб в медицині і косметології. Утворюється при спільній кристалізації сульфатів алюмінію і калію.
Рівняння найважливіших реакцій:
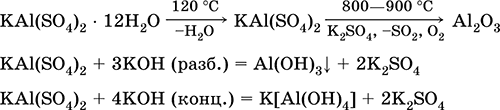
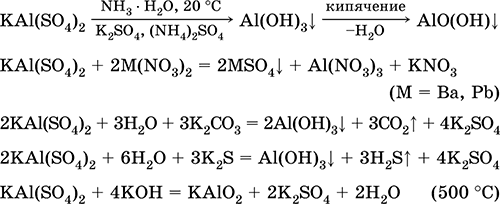
Сульфат хрому (III) - калію KCr (SO 4) 2. Подвійна оксосоль. Червоний (гідрат темно-фіолетовий, технічна назва хрожокаліевие галун). При нагріванні розкладається без плавлення. Добре розчинний у воді (сіро-синє забарвлення розчину відповідає Аквакомплекс 3+), гідролізується по катіону хрому (III). Реагує з лугами, гідратом аміаку. Слабкий окислювач і відновник. Вступає в реакції іонного обміну.
якісні реакції на іон Cr 3+ - відновлення до Cr 2+ або окислення до жовтого CrO 4 2.
Застосовується як дубитель шкір, протрава при фарбуванні тканин, реактив в фотографії. Утворюється при спільній кристалізації сульфатів хрому (III) і калію. Рівняння найважливіших реакцій:
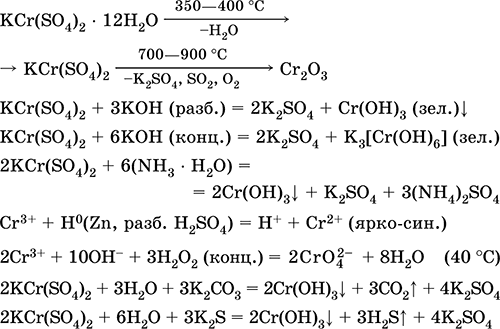
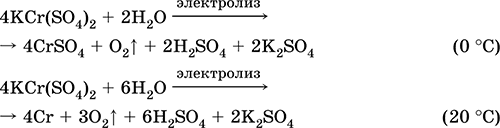
Сульфат марганцю (II) MnSO 4. Оксосоль. Білий, при прожаренні плавиться і розкладається. Кристалогідрат MnSO 4 5Н 2 O - червоно-рожевий, технічна назва марганцевий купорос. Добре розчинний у воді, світло-рожева (майже безбарвна) забарвлення розчину відповідає Аквакомплекс 2+; гідролізується по катіону. Реагує з лугами, гідратом аміаку. Слабкий відновник, реагує з типовими (сильними) окислювачами.
якісні реакції на іон Mn 2+ - конмутація з іоном MnO 4 і зникнення фіолетового забарвлення останнього, окислення Mn 2+ до MnO 4 і поява фіолетового забарвлення.
Застосовується для отримання Mn, MnO 2 та інших сполук марганцю, як мікродобриво і аналітичний реагент.
Рівняння найважливіших реакцій:
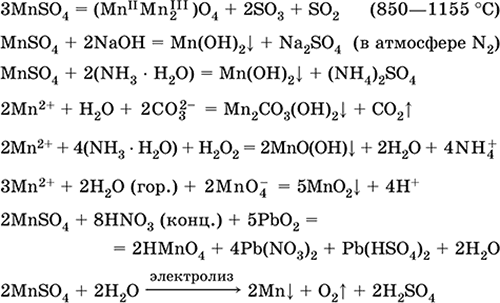
отримання:
2MnO 2 + 2H 2 SO 4 (конц.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Сульфат заліза (II) FeSO 4. Оксосоль. Білий (гідрат світло-зелений, технічна назва залізний купорос),гігроскопічний. Розкладається при нагріванні. Добре розчинний у воді, в малому ступені гідролізується по катіону. Швидко окислюється в розчині киснем повітря (розчин жовтіє і мутніє). Реагує з кислотами-окислювачами, лугами, гідратом аміаку. Типовий відновник.
Застосовується як компонент мінеральних фарб, електролітів в гальванотехнике, консервант деревини, фунгіцид, лікарський засіб проти анемії. У лабораторії частіше береться у вигляді подвійної солі Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( сіль Мора), більш стійкою до дії повітря.
Рівняння найважливіших реакцій:
![]()
отримання:
Fe + H 2 SO 4 (разб.) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (разб.) = FeSO 4 + CO 2 + H 2 O
7.4. Неметали VA-групи
Азот. аміак
азот - елемент 2-го періоду і VA-групи Періодичної системи, порядковий номер 7. Електронна формула атома [2 He] 2s 2 2p 3, характерні ступені окислення 0, -III, + III і + V, рідше + II, + IV і ін .; стан N v вважається відносно стійким.
Шкала ступенів окислення азоту:
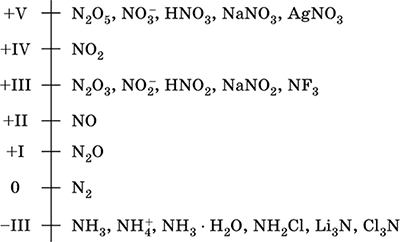
Азот має високу електронегативність (3,07), третій після F і О. Виявляє типові неметалеві (кислотні) властивості. Утворює різні кислородсодержащие кислоти, солі і бінарні сполуки, а також катіон амонію NH 4 + і його солі.
В природі - сімнадцятий по хімічній поширеності елемент (дев'ятий серед неметалів). Життєво важливий елемент для всіх організмів.
Азот N 2. Проста речовина. Складається з неполярних молекул з дуже стійкою σππ-зв'язком N ≡ N, цим пояснюється хімічна інертність азоту при звичайних умовах. Безбарвний газ без смаку і запаху, конденсується в безбарвну рідину (на відміну від O 2).
Головна складова частина повітря: 78,09% за обсягом, 75,52% по масі. З рідкого повітря азот википає раніше кисню O 2. Малорастворим в воді (15,4 мл / 1 л Н 2 O при 20 ° C), розчинність азоту менше, ніж у кисню.
При кімнатній температурі N 2 реагує тільки з літієм (у вологому атмосфері), утворюючи нітрид літію Li 3 N, нітриди інших елементів синтезують при сильному нагріванні:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
В електричному розряді N 2 реагує з фтором і в дуже малому ступені - з киснем:
Оборотна реакція отримання аміаку протікає при 500 ° C, під тиском до 350 атм і обов'язково в присутності каталізатора (Fe / F 2 O 3 / FeO, в лабораторії Pt):
Відповідно до принципу Ле-Шательє збільшення виходу аміаку має відбуватися при підвищенні тиску і зниженні температури. Однак швидкість реакції при низьких температурах дуже мала, тому процес ведуть при 450-500 ° C, досягаючи 15% -ного виходу аміаку. Прореагували N 2 і Н 2 повертають в реактор і тим самим збільшують ступінь протікання реакції.
Азот хімічно пасивний по відношенню до кислот і лугів, не підтримує горіння.
отримання в промисловості - фракційна дистиляція рідкого повітря або видалення з повітря кисню хімічним шляхом, наприклад по реакції 2С (кокс) + O 2 = 2СО при нагріванні. У цих випадках отримують азот, який містить також домішки благородних газів (головним чином аргон).
В лабораторії невеликі кількості хімічно чистого азоту можна отримати по реакції конмутаціі при помірному нагріванні:
N -III H 4 N III O 2 (т) = N 2 0 + 2H 2 O (60-70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
Застосовується для синтезу аміаку, азотної кислоти та інших азотовмісних продуктів, як інертна середу проведення хімічних і металургійних процесів та зберігання вогненебезпечних речовин.
Аміак NH 3. Бінарна сполука, ступінь окислення азоту дорівнює - III. Безбарвний газ з різким характерним запахом. Молекула має будову незавершеного тетраедра [: N (H) 3)] (sр 3-гібридизація). Наявність у азоту в молекулі NH 3 донорной пари електронів на sр 3 -гібрідной орбіталі обумовлює характерну реакцію приєднання катіона водню, при цьому утворюється катіон амонію NH 4 +. Зріджується під надлишковим тиском при кімнатній температурі. У рідкому стані асоційований за рахунок водневих зв'язків. Термічно нестійкий. Добре розчинний у воді (більше 700 л / 1 л Н 2 O при 20 ° C); частка в насиченому розчині дорівнює = 34% по масі і = 99% за обсягом, рН = 11,8.
Вельми реакційноздатні, схильний до реакцій приєднання. Crорает в кисні, реагує з кислотами. Виявляє відбудовні (за рахунок N -III) і окисні (за рахунок Н I) властивості. Осушується тільки оксидом кальцію.
якісні реакції - утворення білого «диму» при контакті з газоподібним НCl, почорніння папірці, змоченою розчином Hg 2 (NO 3) 2.
Проміжний продукт при синтезі HNO 3 і солей амонію. Застосовується у виробництві соди, азотних добрив, барвників, вибухових речовин; рідкий аміак - холодоагент. Отруйний.
Рівняння найважливіших реакцій:
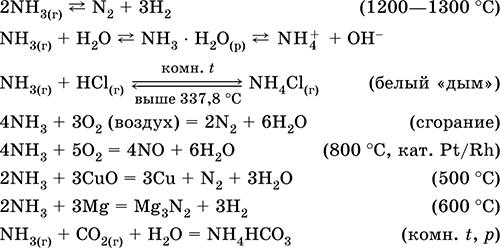
отримання: в лабораторії - витіснення аміаку з солей амонію при нагріванні з натронной вапном (NaOH + СаО):
або кип'ятіння водного розчину аміаку з подальшим осушенням газу.
В промисловості аміак синтезують з азоту (див.) з воднем. Випускається промисловістю або в зрідженому вигляді, або у вигляді концентрованого водного розчину під технічною назвою аміачна вода.
Гідроксид амонію NH 3 Н 2 O. Міжмолекулярна з'єднання. Білий, в кристалічній решітці - молекули NH 3 і Н 2 O, пов'язані слабкою водневої зв'язком H 3 N ... НОН. Присутній у водному розчині аміаку, слабка основа (продукти дисоціації - катіон NH 4 - і аніон ВІН -). Катіон амонію має правильно-тетраедричну будова (sp 3-гібридизація). Термічно нестійкий, повністю розкладається при кип'ятінні розчину. Нейтралізується сильними кислотами. Виявляє відбудовні властивості (за рахунок N III) в концентрованому розчині. Вступає в реакції іонного обміну і комплексоутворення.
якісна реакція - утворення білого «диму» при контакті з газоподібним НCl.
Застосовується для створення слабощелочной середовища в розчині, при осадженні амфотерних гідроксидів.
У 1М розчині аміаку міститься в основному гідрат NH 3 Н 2 O і лише 0,4% іонів NH 4 + і ОН - (за рахунок дисоціації гідрату); таким чином, іонний «гідроксид амонію NH 4 OH» практично не міститься в розчині, немає такого з'єднання і в твердому гідраті. Рівняння найважливіших реакцій:
NH 3 Н 2 O (конц.) = NH 3 + Н 2 O (кип'ятіння з NaOH)
NH 3 Н 2 O + НCl (разб.) = NH 4 Cl + Н 2 O
3 (NH 3 Н 2 O) (конц.) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 Н 2 O) (конц.) + ЗBr 2 (р) = N 2 + 6NH 4 Br + 8Н 2 O (40-50 ° C)
2 (NH 3 Н 2 O) (конц.) + 2КMnO 4 = N 2 + 2MnO 2 ↓ + 4Н 2 O + 2КОН
4 (NH 3 Н 2 O) (конц.) + Ag 2 O = 2OH + 3H 2 O
4 (NH 3 Н 2 O) (конц.) + Cu (OH) 2 + (OH) 2 + 4Н 2 O
6 (NH 3 Н 2 O) (конц.) + NiCl 2 = Cl 2 + 6Н 2 O
Розведений розчин аміаку (3-10% -ний) часто називають нашатирним спиртом (Назва придумано алхіміками), а концентрований розчин (18,5-25% -ний) - аміачною водою (Випускається промисловістю).
