Генетичний ряд неметалів приклади. Генетичний зв'язок між класами речовин - Гіпермаркет знань
Між простими речовинами, оксидами, основами, кислотами та солями існує генетичний зв'язок, а саме - можливість їх взаємного переходу (перетворення).
Наприклад, проста речовина - кальцій в результаті взаємодії з киснем перетворюється в оксид: 2Ca + O 2 = 2CaO.
Оксид кальцію при взаємодії з водою утворює гідроксид кальцію CaO + H 2 O = Ca (OH) 2, а останній при взаємодії з кислотою перетворюється в сіль: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
Ці перетворення можна представити схемою:
Ca → CaO → Ca (OH) 2 → CaSO 4
Подібну схему можна записати і для неметалла, наприклад, сірки:
S → SO 3 → H 2 SO 4 → CaSO 4
Отже, різними шляхами отримана одна і та ж сіль.
Можливий і зворотний перехід від солі до інших класів неорганічних сполук і простих речовин:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOН = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 О
CuO + H 2 = Cu + H 2 O (відновлення міді)
Подібна зв'язок між класами неорганічних сполук, заснована на отриманні речовин одного класу з речовин іншого, називається генетичної.
Властивості складних з'єднань відображає генетична схема основних класів неорганічних сполук (див. Малюнок). Вона відображає ступені розвитку неорганічної речовини за двома основними лініями - від типових металів до типових неметалів, що володіють протилежними властивостями.
Метали, хімічною властивістю атома яких є здатність віддавати електрони, і неметали, головним хімічним властивістю яких є здатність їх атомів приєднувати електрони, протилежні одна одній за властивостями. При ускладненні складу речовин ці протилежні тенденції продовжують виявлятися.
Типові метали і перехідні елементи в нижчого ступеня окислення утворюють основні оксиди, а типові неметали і перехідні елементи у високому ступені окислення утворюють протилежні за властивостями кислотні оксиди.
прості речовини
амфотерні
Неметали
Основні оксиди
амфотерні
кислотні
Підстави
амфотерні
гідроксиди
Генетична схема основних класів неорганічних сполук
При подальшому ускладненні складу речовин утворюються гідроксиди, причому основним оксидам відповідають підстави, а кислотних оксидів відповідають кислоти. Протилежні за властивостями підстави і кислоти активно реагують між собою, утворюючи солі. Взаємодія протилежностей є рушійною силою реакції. Тому основний і кислотний оксиди, підстави і кислоти активно взаємодіють один з одним, а два кислотних оксиду або два основних оксиду не взаємодіють, так як властивості у них близькі.
Таким чином, властивості складної сполуки визначаються на основі властивостей утворює його елементів. Основні закономірності зміни цих властивостей узагальнені в наступних програмах (табл. 6).
1. В періодах зі збільшенням порядкового номера властивості елементів змінюються від металевих до неметалічних. Збільшується число електронів на зовнішньому рівні, зростає ступінь окислення елемента, зменшується радіус атома і іона, збільшується енергія іонізації і спорідненість до електрону. Відповідно до цього зменшуються основні і збільшуються кислотні властивості оксидів і гідроксидів.
2. У головних підгрупах зі збільшенням порядкового номера елемента збільшуються основні властивості оксидів і гідроксидів. Для елементів побічних підгруп зі збільшенням порядкового номера характерно більш складне зміна властивостей. Спочатку металеві властивості посилюються, а потім зменшуються.
3. Активним металів відповідають оксиди і гідроксиди з сильно вираженими основними властивостями. Найактивніші метали - лужні і лужноземельні. Вони утворюють розчинні у воді оксиди і сильні розчинні підстави - лугу.
4. Малоактивні метали (все, крім лужних і лужно-земельних) утворюють слабкі підстави, важко розчинні у воді:
Cu (OH) 2, Fe (OH) 3.
5. Активним неметаллам відповідають оксиди і гідроксиди з сильно вираженими кислотними властивостями.
6. Амфотерні метали утворюють амфотерні оксиди і гідроксиди.
7. Якщо елемент виявляє різні ступені окислення, то йому відповідають оксиди і гідроксиди з різними властивостями.
Тема: ГЕНЕТИЧНА ЗВ'ЯЗОК МІЖ металами і неметалами і їх з'єднань. 9 клас.
Цілі: освітні: закріпити поняття «генетичний ряд», «генетичний зв'язок»; навчити складати генетичні ряди елементів (металів і неметалів), складати рівняння реакцій, відповідних генетичному ряду; перевірити, як засвоєні знання про хімічних властивостях оксидів, кислот, солей, підстав; розвиваючі: розвивати вміння аналізувати, порівнювати, узагальнювати і робити висновки, складати рівняння хімічних реакцій; виховні: сприяти формуванню наукового світогляду.
Забезпечення заняття: таблиці «Періодична система», «Таблиця розчинності», «Ряд активності металів», інструкції для студентів, завдання для перевірки знань.
Хід роботи: 1) Орг. момент
2) Перевірка д / з
3) Вивчення нового матеріалу
4) Закріплення
5) Д / З
1) Орг. момент. Привітання.
2) Перевірка д / з.
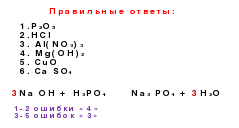
Генетичні зв'язки - це зв'язки між різними класами, засновані на їх взаимопревращениях.
Знаючи класи неорганічних речовин, можна скласти генетичні ряди металів і неметалів. В основу цих рядів покладено один і той же елемент.
Серед металів можна виділити два різновиди рядів:
1
. Генетичний ряд, в якому в якості підстави виступає луг. Цей ряд можна представити за допомогою наступних перетворень:метал → основний оксид → луг → сіль
Наприклад, K → K
2 O → KOH → KCl2
. Генетичний ряд, де в якості підстави виступає нерозчинна основа, тоді ряд можна представити ланцюжком перетворень:метал → основний оксид → сіль → нерозчинна основа →
→основний оксид → метал
Наприклад, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Генетичний ряд неметалів, де в якості ланки ряду виступає розчинна кислота. Ланцюжок перетворень можна представити в наступному вигляді:неметалл → кислотний оксид → розчинна кислота → сіль
Наприклад, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Генетичний ряд неметалів, де в якості ланки ряду виступає нерозчинна кислота:неметалл → кислотний оксид → сіль → кислота →
→кислотний оксид → неметалл
наприклад,
Si→ SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si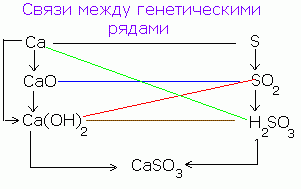
Фронтальна бесіда з питань:
Що таке генетичний зв'язок? Генетичні зв'язки - це зв'язки між різними класами, засновані на їх взаімопревращеніях.Что таке генетичний ряд?
Генетичний ряд - ряд речовин - представників різних класів, які є сполуками одного хімічного елемента, пов'язаних взаємоперетворення і відображають перетворення даних речовин. В основу цих рядів покладено один і той же елемент.
Які види генетичних рядів прийнято виділяти? Серед металів можна виділити два різновиди рядів:
а) Генетичний ряд, в якому в якості підстави виступає луг. Цей ряд можна представити за допомогою наступних перетворень:
метал → основний оксид → луг → сіль
наприклад, генетичний ряд калію K → K
2 O → KOH → KClб) Генетичний ряд, де в якості підстави виступає нерозчинна основа, тоді ряд можна представити ланцюжком перетворень:
метал → основний оксид → сіль → нерозчинна основа → основний оксид → метал
наприклад: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuСеред неметалів також можна виділити два різновиди рядів:
а) Генетичний ряд неметалів, де в якості ланки ряду виступає розчинна кислота. Ланцюжок перетворень можна представити в наступному вигляді: неметалл → кислотний оксид → розчинна кислота → сіль.
Наприклад: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4б) Генетичний ряд неметалів, де в якості ланки ряду виступає нерозчинна кислота: неметалл → кислотний оксид → сіль → кислота → кислотний оксид → неметалл
Наприклад: Si → SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → SiВиконання завдань за варіантами:
1. Виберіть у вашому варіанті формули оксидів, поясніть свій вибір, спираючись на знання ознак складу даного класу сполук. Назвіть їх.
2. У стовпці формул вашого варіанту знайдіть формули кислот і поясніть свій вибір на підставі аналізу складу цих сполук.
3. Визначте валентності кислотних залишків у складі кислот.
4. Виберіть формули солей і назвіть їх.
5. Складіть формули солей, які можуть бути утворені магнієм і кислотами вашого варіанту. Запишіть їх, назвіть.
6. У стовпці формул вашого варіанту знайдіть формули підстав і поясніть свій вибір на підставі аналізу складу цих сполук.
7. У вашому варіанті виберіть формули речовин, з якими може реагувати розчин ортофосфорної кислоти (соляної, сірчаної). Складіть відповідні рівняння реакцій.
9. Серед формул свого варіанту виберіть формули речовин, здатних взаємодіяти між собою. Складіть відповідні рівняння реакцій.
10. Складіть ланцюжок генетичних зв'язків неорганічних сполук, до складу якої увійде речовина, формула якого дана в вашому варіанті під номером один.
Варіант 1
Варіант 2
CaO
HNO
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbO
LiOH
Ag
3 PO 4P
2 O 5NaOH
ZnO
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4CuSO
4З даних речовин складіть генетичний ряд, використовуючи всі формули. Напишіть рівняння реакцій, за допомогою яких можна здійснити цей ланцюжок перетворень:
I варіант: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II варіант:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Закрепленіе1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24.Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Домашнє завдання:
складіть схему поступового переходу від кальцію до карбонату кальцію і підготуйте повідомлення про використання в медицині будь солі (використовуючи додаткову літературу).

Серед металів можна виділити два різновиди рядів: 1.Генетіческій ряд, в якому в якості підстави виступає луг. Цей ряд можна представити за допомогою следуюший перетворень: металл-- основний оксид - луг - сіль, наприклад генетичний ряд калію K - K 2 O - KOH - KCl.

2. Генетичний ряд, де в якості підстави виступає нерозчинна основа, тоді ряд можна представити ланцюжком перетворень: метал - основний оксид - сіль - нерозчинна основа - основний оксид - метал. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu генетичний ряд міді "\u003e Cu генетичний ряд міді"\u003e "title =" (! LANG: 2. Генетичний ряд, де в якості підстави виступає нерозчинна основа, тоді ряд можна представити ланцюжком перетворень: метал - основний оксид - сіль - нерозчинний основаніе-- основний оксид - метал. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. Генетичний ряд, де в якості підстави виступає нерозчинна основа, тоді ряд можна представити ланцюжком перетворень: метал - основний оксид - сіль - нерозчинна основа - основний оксид - метал. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Серед неметалів також можна виділити два різновиди рядів: 1. Генетичний ряд неметалів, де в якості ланки ряду виступає розчинна кислота. Ланцюжок перетворень можна представити в наступному вигляді: неметалл - кислотний оксид - розчинна кислота -Сіль. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. генетичний ряд фосфору

Між класами неорганічних сполук існує генетичний зв'язок. З простих речовин можна отримати складні і навпаки. З сполук одного класу можна отримати сполуки іншого класу.
Спрощено генетичний зв'язок між класами неорганічних сполук можна представити наступною схемою:
Послідовність таких перетворень для неметалів можна зобразити наступною схемою: CaНРО 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Саона) 3 РО 4
Для типових металів можна здійснити наступний ланцюжок перетворень:
Ba → BaO → Ba (OH) 2 → BaSO 4
Для металів, оксиди і гідроксиди яких амфотерни (полуметаллов) можна здійснити наступні перетворення:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → → Al (OH) 3 → Al 2 O 3.
Зв'язки між класами:
1. Метали, неметали→ солі.
При безпосередній взаємодії металів і неметалів утворюються солі безкисневих кислот (нітрати, сульфіди):
2Na + С1 2 = 2NaCl
Ці сполуки стійкі і при нагріванні, як правило, не розкладаються.
2. Основні оксиди, кислотні оксиди→ солі.
СаО + СО2 = СаСO 3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Підстави, кислоти→ солі.
Здійснюється за допомогою реакції нейтралізації:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
ВІН - + Н + → Н 2 O;
Mg (OH) 2 + 2НС1 = MgCl 2 + 2Н 2 O,
Mg (OH) 2 + 2Н + → Mg 2+ + 2Н 2 O.
4. Метали→ основні оксиди.
Більшість металів взаємодіють з киснем, утворюючи оксиди:
2Са + О 2 = 2СаО;
4А1 + 3O 2 = 2А1 2 O 3.
Чи не взаємодіють з киснем золото, срібло, платина та інші благородні метали, оксиди таких металів отримують непрямим шляхом.
5. Неметали→ кислотні оксиди.
Неметали (за винятком галогенів і благородних газів) взаємодіють з киснем, утворюючи оксиди:
4Р + 5O 2 = 2Р 2 O 5;
S + O 2 = SO 2.
6. Основні оксиди→ підстави.
Безпосередньою взаємодією з водою можуть бути отримані тільки гідроксиди лужних і лужноземельних металів (луга):
Na 2 O + Н 2 O = 2NaOH;
СаО + Н 2 O = Са (ОН) 2.
Решта підстави отримують непрямим шляхом.
7. Кислотні оксиди→ кислоти.
Кислотні оксиди взаємодіють з водою, утворюючи відповідні кислоти:
SO 3 + Н 2 O = H 2 SO 4;
Р 2 O 5 + 3Н 2 O = 2Н 3 РO 4.
Виняток SiO 2, який з водою не реагує.
8. Підстави, кислотні оксиди→ солі.
Луги взаємодіють з кислотними оксидами, утворюючи солі:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OН - + SO 3 = SO 4 2- + Н 2 O;
Ca (OH) 2 + СО2 = CaCO 3 ↓ + Н 2 O,
Са 2+ + 2OН - + СО2 → СаСО 3 ↓ + Н 2 О.
9. Кислоти, основні оксиди→ солі.
Оксиди металів розчиняються в кислотах, утворюючи солі:
CuO + H 2 SO 4 = CuSO 4 + Н 2 O,
CuO + 2Н + = Cu 2+ + Н 2 O;
Na 2 O + 2НС1 = 2NaCl + Н 2 O,
Na 2 O + 2H + = 2Na + + Н 2 O.
10. Підстави→ основні оксиди.
Нерозчинні підстави і LiOH при нагріванні розкладаються:
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H 2 O.
11. Кислоти→ кислотні оксиди.
Нестійкі кислородсодержащие кислоти розкладаються при нагріванні (H 2 SiO 3) і навіть без нагрівання (Н 2 СО 3, НСlO). У той же час ряд кислот стійкий до нагрівання (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = Н 2 O + SiO 2;
Н 2 СО 3 = Н 2 O + СО2.
12. Оксиди металів→ метали.
Деякі оксиди важких металів можуть розкладатися на метал і кисень:
2HgO = 2Hg + O 2.
Також метали отримують з відповідних оксидів за допомогою відновників:
3МnO 2 + 4Al = 3Мn + 2Аl 2 O 3;
Fe 2 O 3 + 3H 2 = 2Fe + 3Н 2 O.
13. Кислотні оксиди→ неметали.
Більшість оксидів неметалів при нагріванні не розкладаються. На неметалл і кисень розкладаються тільки деякі нестійкі оксиди (оксиди галогенів).
Деякі неметали отримують при відновленні з відповідних оксидів:
SiO 2 + 2Mg = 2MgO + Si.
14. Солі, підстави → підстави.
Нерозчинні підстави отримують дією лугів на розчини відповідних кислот:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Солі, кислоти → кислоти.
Розчинні солі взаємодіють з кислотами (відповідно до витіснювальний поруч), якщо в результаті утворюється слабша або летюча кислота:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (тв.) + H 2 SO 4 (к) = NaHSO 4 + HCl.
16. Солі→ основні оксиди, кислотні оксиди.
Солі деяких кисневмісних кислот (нітрати, карбонати) при нагріванні розкладаються:
СаСО 3 = СаО + СО2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
Вправи для самостійної роботи ПО ТЕМІ «ГЕНЕТИЧНА зв'язки між класами НЕОРГАНІЧНИХ СОЕДИНЕНИЙ»
1. Назвіть перераховані нижче речовини, розподіліть їх за класами неорганічних сполук: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2.Із яких перерахованих нижче речовин можна в одну стадію отримати гідроксид (кислоту або підстава): мідь, оксид заліза (П), оксид барію, оксид азоту (П), оксид азоту (V), оксид кремнію, сульфат міді, хлорид калію , калій, карбонат магнію.
3. З наведеного переліку випишіть формули речовин, що відносяться до: 1) оксидів; 2) підставах; 3) кислот; 4) солям:
СО2, NaOH, HCl, SO 3, CuSO 4, NaNO 3, КСl, H 2 SO 4, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3.
4. Назвіть речовини: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, КОН, (АlOН) 3 (РO 4) 2, Ba (MnO 4 ) 2, CO, HI. Вкажіть, до якого классуотносітся кожна речовина.
5. Напишіть молекулярні формули наступних речовин і вкажіть, до якого класу належить кожне речовина:
1) гідроксокарбонат міді (II);
2) оксид азоту (V);
3) гідроксид нікелю (II);
4) гідрофосфат барію;
5) хлорне кислота;
6) гідроксид хрому (III);
7) хлорат калію;
8) сірководнева кислота;
9) цинкат натрію.
6. Наведіть приклади реакцій з'єднання між:
1) простими речовинами-неметалами;
2) простим речовиною і оксидом;
3) оксидами;
4) складними речовинами, які не є оксидами;
5) металом і неметаллом;
6) трьома речовинами.
7. З якими з наведених нижче речовин може вступати в реакцію:
1) оксид вуглецю (IV): HCl, O 2, NO 2, КОН, Н 2 O;
2) оксид магнію: Ва (ОН) 2, HCl, CO 2, O 2, HNO 3;
3) гідроксид заліза (II): KCl, HC1, КОН, O 2, Н 2 O, HNO 3;
4) хлороводень: Zn, MgO, ZnCl 2, HNO 3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Чи можливо взаємодія між наступними речовинами:
1) оксид вуглецю (IV) і гідроксид калію;
2) гидросульфат калію і гідроксид кальцію;
3) фосфат кальцію і сірчана кислота;
4) гідроксид кальцію і оксид сірки (IV);
5) сірчана кислота і гідроксид калію;
6) гідрокарбонат кальцію і фосфорна кислота;
7) оксид кремнію і сірчана кислота;
8) оксид цинку і оксид фосфору (V).
Напишіть рівняння можливих реакцій, вкажіть умови, в яких вони протікають. Якщо реакції можуть призводити до різних речовин, то вкажіть, в чому полягає відмінність в умовах їх проведення.
9. Наведіть рівняння реакцій одержання наступних речовин: ортофосфат натрію (4 способи), сульфат калію (7 способів), гідроксид цинку.
10. Один із способів отримання соди (карбонату натрію) полягає в дії води і оксиду вуглецю (IV) на алюмінат натрію. Складіть рівняння реакцій.
11. He змінюючи коефіцієнтів, напишіть продукти реакцій:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Аl (ОН) 3 →
4) Р 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12.Составьте рівняння реакцій для отримання різних типів солей:
1) SO 2 + Ва (ОН) 2 → (середня і кисла солі),
2) А1 2 O 3 + Н 2 O + HNO 3 → (середня сіль, основні солі),
3) Na 2 O + H 2 S → (середня і кисла солі),
4) SO 3 + Са (ОН) 2 → (середня і основна солі),
5) СаО + Н 2 O + P 2 O 5 → (основна сіль, кислі солі).
13. Закінчите рівняння реакцій:
СаО + А1 2 O 3 → СаНРO 4 + Са (ОН) 2 →
Сг 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → СаСО 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (недостатньо.) →
AlCl 3 + NaОН (недостатньо.) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + Н 2 SO 4 (надлишок) →
AlC1 3 + NaOH (надлишок.) → Ca (AlO 2) 2 + НС1 (надлишок) →
14. Запишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
1) Сu → СuО → CuSO 4 → Сu (ОН) 2 → СuС1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РO 4 → До 3 РO 4 → Са 3 (РO 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Сг (ОН) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) До → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Сu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) сульфат алюмінію → хлорид алюмінію → нітрат алюмінію → оксид алюмінію → алюмінат калію → гідроксид алюмінію → гидроксохлоріда алюмінію → хлорид алюмінію.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) барій → гідроксид барію → гідрокарбонат барію → хлорид барію → карбонат барію → хлорид барію → гідроксид барію
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) З → СО 2 → NaHCО 3 → Na 2 CО 3 → СО 2
52) S → SО 2 → K 2 SО 3 → KHSO 3 → K 2 SО 3
53) Сu → Сu (ОН) 2 → Cu (NO 3) 2 → CuO → Сu
54) Р 2 O 5 → Н 3 РO 4 → СаНРO 4 → Са (Н 2 РO 4) 2 → Са 3 (РO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) До → КОН → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Сu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Сu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) КС1 → K 2 SO 4 → КОН → K 2 CO 3 → КОН
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) З → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → КС1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 О 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
ЕКСПЕРИМЕНТАЛЬНІ ДОСВІДИ ПО ТЕМІ «ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СОЕДИНЕНИЙ»
ДОСВІД 1.Реакції нейтралізації.
а) Взаємодія сильної кислоти і сильної основи.
Налити в порцелянову чашку 5 мл 2 н розчину соляної кислоти і додавати до нього по краплях 2 н розчин гідроксиду натрію. Розчин перемішувати скляною паличкою і випробувати його дію на лакмус, переносячи краплю розчину на лакмусовий папірець. Потрібно домогтися нейтральної реакції (синя і червона лакмусовий папірець не змінює забарвлення). Отриманий розчин випарити насухо. Що утворилося? Написати молекулярні та іонні рівняння реакцій.
б) Взаємодія слабкої кислоти і сильної основи.
Налити в пробірку 2 мл 2 н розчину лугу і додати розчин оцтової кислоти до нейтральної реакції розчину. Написати молекулярні та іонні рівняння реакцій. Пояснити, чому рівновагу іонної реакції, в якій бере участь слабкий електроліт (оцтова кислота), зсувається в бік утворення молекул води.
ДОСВІД 2. Амфотерность гідроксидів.
З наявних в лабораторії реактивів отримати осад гідроксиду цинку. Збовтати отриманий осад і відлити невеликі кількості його в 2 пробірки. В одну з пробірок додати розчин соляної кислоти, в іншу - розчин гідроксиду натрію (надлишок). Що спостерігається? Написати рівняння відповідних реакцій в молекулярній та іонній формі.
ДОСВІД 3.Хімічні властивості солей.
а) Взаємодія розчинів солей з утворенням труднорастворимого речовини.
Налити в пробірку 2 мл розчину карбонату натрію і додати розчин хлориду барію до випадання білого осаду. Написати рівняння хімічної реакції в іонному і молекулярному вигляді. Отриманий осад розділити на дві частини. В одну з пробірок налити розчин сірчаної кислоти, в іншу - гідроксиду натрію. Зробити висновок про розчинність осаду в кислотах і лугах.
б) Взаємодія розчину солі з кислотами з утворенням летючого з'єднання.
Налити в пробірку 2 мл розчину карбонату натрію і долити невеликий обсяг розчину соляної кислоти. Що спостерігається? Написати рівняння хімічної реакції в іонному і молекулярному вигляді.
в) Взаємодія розчинів солей з лугами з утворенням летючого з'єднання.
У пробірку налити трохи розчину який-небудь солі амонію, додати 1-2 мл розчину гідроксиду натрію і нагріти до кипіння. У пробірку з реакційною сумішшю внести вологу червону лакмусовий папірець. Що спостерігається? Дати пояснення. Написати рівняння реакцій.
г ) Взаімодействіерастворов солей з більш активними металами, ніж метал, що входить до складу солі.
Залізний (сталевий) цвях очистити тонкої наждачним папером. Потім опустити його в розчин сульфату міді. Через деякий час спостерігати виділення міді на поверхні цвяха. Записати відповідне рівняння реакції в іонному і молекулярному вигляді.
ДОСВІД 4.Отримання основних та кислих солей.
а) Отримання гідроксокарбоната свинцю.
До розчину ацетату свинцю (II) додати трохи оксиду свинцю (II) і кип'ятити суміш протягом декількох хвилин. Остиглий розчин злити з осаду і пропустити через нього струм вуглекислого газу. Що спостерігається? Осад відфільтрувати і висушити між листочками фільтрувального паперу. Відзначити колір і характер отриманого осаду гідроксокарбоната свинцю. Написати рівняння реакцій. Скласти графічну формулу отриманої солі.
б) Отримання гідрокарбонату магнію.
До дуже сильно розбавленому розчину який-небудь солі магнію додати трохи розчину карбонату натрію. Яка речовина випадає в осад? Розчин з осадом наситити вуглекислим газом. Спостерігати поступове розчинення осаду. Чому це відбувається? Написати рівняння реакцій.
ДОСВІД 5.Отримання комплексних солей.
а) Освіта з'єднань з комплексним катіоном.
У пробірку з 2-3 мл розчину хлориду міді (II) додавати по краплях розчин аміаку до утворення осаду гідроксиду міді (II), а потім долити надлишок розчину аміаку до розчинення осаду. Порівняти забарвлення іонів Сu 2+ з забарвленням отриманого розчину. Присутність яких іонів обумовлюють забарвлення розчину? Написати рівняння реакції отримання комплексної сполуки.
б) Освіта з'єднань з комплексним аніоном.
До 1-2 мл розчину нітрату ртуті (II) додавати по краплях розбавлений розчин йодиду калію до утворення осаду HgI 2. Потім долити надлишок розчину йодиду калію до розчинення осаду. Написати рівняння реакцій одержання комплексної солі.
ДОСВІД 6.Отримання подвійних солей (алюмокалієвих квасцов).
Зважити 7,5 г Al 2 (SO 4) 3 ∙ 18H 2 O і розчинити в 50 мл води, взявши для цієї мети досить велику порцелянову чашку. Розрахувати за рівнянням реакції і зважити необхідну для реакції масу сульфату калію. Приготувати гарячий насичений розчин сульфату калію і влити його при помішуванні в порцелянову чашку з розчином сульфату алюмінію. Спостерігати через деякий час випадання кристалів алюмокалієвих квасцов. За охолодженні і закінчення кристалізації злити матковий розчин, висушити кристали квасцов між листами фільтрувального паперу і зважити отримані кристали. Обчислити відсоток виходу.
РОЗРАХУНКОВІ ЗАВДАННЯ
1. При пропущенні надлишку сірководню через 16 г розчину сульфату міді (II) отримано 1,92 г осаду. Знайдіть масову частку сульфату міді в використаному розчині і обсяг витраченого сірководню.
2. Для повного осадження міді у вигляді сульфіду з 291 см 3 розчину сульфату міді (II) c масовою часткою 10% був використаний газ, отриманий взаємодією 17,6 г сульфіду заліза (II) з надлишком соляної кислоти. Знайдіть щільність вихідного розчину сульфату міді.
3. Газ, виділений при взаємодії розчину К 2 S з розбавленою сірчаною кислотою, пропущений через надлишок розчину нітрату свинцю (II). Отриманий осад має масу 71,7 г. Знайдіть обсяг прореагировавшего розчину сірчаної кислоти, якщо його щільність 1,176 г / см 3, а масова частка 25%.
4. До розчину, що містить 8 г сульфату міді (II), додали розчин, що містить 4,68 г сульфіду натрію. Осад відфільтрували, фільтрат випарили. Визначте маси речовин у фільтраті після випарювання і масу осаду сульфіду міді.
5. Деяку масу сульфіду заліза (II) обробили надлишком соляної кислоти. Отриманий газ в реакції з 12,5 см 3 розчину NaOH з масовою часткою 25% і щільністю 1,28 г / см 3 утворив кислу сіль. Знайдіть масу вихідного сульфіду заліза.
6. Сульфид заліза (II) масою 176 г обробили надлишком соляної кислоти, а отриманий газ спалили в надлишку повітря. Який об'єм розчину КОН з масовою часткою 40% і щільністю 1,4 г / см 3 потрібен для повної нейтралізації отриманого при спалюванні газу?
7. При випалюванні 100 г технічного піриту отримали газ, яким повністю нейтралізували 400 см 3 розчину NaOH з масовою часткою 25% і щільністю 1,28 г / см 3. Визначте масову частку домішок в піриті.
8. До 2 г суміші заліза, оксиду заліза (II) і оксиду заліза (III) додали 16 см 3 розчину НС1 з масовою часткою 20% і щільністю 1,09 г / см 3. Для нейтралізації надлишку кислоти знадобилося 10,8 см 3 розчину NaOH з масовою часткою 10% щільністю 1,05 г / см 3. Знайдіть маси речовин в суміші, якщо обсяг виділився водню дорівнює 224 см 3 (н.у.).
9. Є суміш Са (ОН) 2, СаСO 3 і BaSO 4 масою 10,5 г. При обробці суміші надлишком соляної кислоти виділилося 672 см 3 (н.у.) газу, а в реакцію вступило 71,2 г кислоти з масовою часткою 10%. Визначте маси речовин в суміші.
10. Є суміш хлориду барію, карбонату кальцію і бікарбонату натрію. При розчиненні 10 г цієї суміші у воді нерозчинний залишок дорівнює 3,5 м При прожаренні 20 г вихідної суміші маса її зменшується на 5,2 м Знайдіть масові частки речовин у вихідній суміші.
11. Є розчин, що містить одночасно сірчану і азотну кислоти. Для повної нейтралізації 10 г цього розчину витрачається 12,5 см 3 розчину КОН з масовою часткою 19% і щільністю 1,18 г / см 3. При додаванні до 20 г цієї ж суміші розчину кислот надлишку хлориду барію випадає 4,66 г осаду. Знайдіть масові частки кислот в суміші.
12. Весь хлороводород, отриманий з 100 г суміші КС1 і KNO 3, розчинили в 71,8 см 3 води. При прожаренні 100 г цієї ж суміші солей залишається 93,6 г твердого залишку. Знайдіть масову частку хлороводню у воді.
13. При пропущенні 2 м 3 повітря (н.у.) через розчин Са (ОН) 2 отримано 3 г осаду солі вугільної кислоти. Знайдіть об'ємну і масову частки СО2 в повітрі.
14. Вуглекислий газ пропускають через суспензію, яка містить 50 г СаСO 3. У реакцію вступило 8,96 дм 3 газу (н.у.). Яка маса СаСO 3 залишилася в твердій фазі?
15. При додаванні води до СаО його маса зросла на 30%. Яка частина СаО (в% по масі) була погашена?
16. Оксид свинцю (II) масою 18,47 г нагріли в струмі водню. Після реакції маса отриманого свинцю і не прореагував оксиду склала 18,07 м Яка маса оксиду свинцю не вступила в реакцію?
17. Чадний газ пропущений через оксид заліза (III) при нагріванні. Маса твердого залишку після реакції на 2 г менше початкової маси оксиду заліза. Який обсяг СО вступив в реакцію (оксид відновлюється повністю)?
18. Є 8,96 дм 3 (н.у.) суміші N 2, CO 2 і SO 2 з відносною щільністю за воднем 25. Після її пропускання через надлишок розчину КОН обсяг суміші зменшився в 4 рази. Знайдіть обсяги газів у вихідній суміші.
19. У двох склянках знаходиться по 100 г розчину НС1 з масовою часткою 2,5%. В один стакан додали 10 г СаСO 3, в іншій - 8,4 г MgCO 3. Як буде відрізнятися маса склянок після реакції?
20. Який об'єм (н.у.) сірчистого газу треба пропустити через 200 см 3 розчину з масовою часткою NaOH 0,1% і щільністю 1 г / см 3, щоб отримати кислу сіль?
21. Який максимальний обсяг (н.у.) вуглекислого газу може поглинути 25 см 3 розчину з масовою часткою NaOH 25% і щільністю 1,1 г / см 3?
22. Яким мінімальним обсягом розчину з масовою часткою KOH 20% і густиною 1,19 г / см 3 можна поглинути весь вуглекислий газ, отриманий при повному відновленні 23,2 г магнетиту чадним газом?
23. Яка мінімальна маса КОН повинна прореагувати з 24,5 г ортофосфорної кислоти, щоб продуктом був тільки дигидрофосфат калію?
24. Яку мінімальну масу Са (ОН) 2 треба додати до 16 г розчину бікарбонату кальцію з масовою часткою солі 5% для отримання середньої солі?
25. Яку масу гидрофосфата калію треба додати в розчин, що містить 12,25 г Н 3 РO 4, щоб після цього розчин містив тільки дигидрофосфат калію?
26. У розчині у вигляді суспензії містилося 56,1 г суміші карбонатів кальцію і магнію. Для перетворення їх у гідрокарбонати витратили весь вуглекислий газ, отриманий спалюванням 7 дм 3 (н.у.) етану. Знайдіть масу карбонату кальцію в вихідної суміші.
27. Щоб перевести в середню сіль 9,5 г суміші гідро- і дигідрофосфату натрію, необхідно 10 см 3 розчину з масовою часткою NaOH 27,7% і щільністю 1,3 г / см 3. Знайдіть масу гидрофосфата в суміші.
28. При пропущенні вуглекислого газу через розчин, що містить 6 г NaOH, отримали 9,5 г суміші кислої і середньої солей. Знайдіть об'єм витраченої вуглекислого газу.
29. Після пропускання 11,2 дм 3 (н.у.) СО2 через розчин КОН отримали 57,6 г суміші кислої і середньої солей. Знайдіть масу середньої солі.
30. Яку масу ортофосфорної кислоти треба нейтралізувати, щоб отримати 1,2 г дигідро і 4,26 г гидрофосфата натрію?
31. До розчину сірчаної кислоти додали NaOH і отримали 3,6 г гідросульфату і 2,84 г сульфату натрію. Визначте хімічні кількості кислоти і луги, що вступили в реакцію.
32. Після пропускання хлороводню через 200 см 3 розчину NaOH з масовою часткою 10% і щільністю 1,1 г / см 3 масова частка NaOH в отриманому розчині знизилася вдвічі. Визначте масову частку NaCl в нинішньому розчині.
33. На розчинення 14,4 г суміші міді і її оксиду (II) витрачено 48,5 г розчину з масовою часткою HNO 3 80%. Знайдіть масові частки міді і оксиду у вихідній суміші.
34. Оксид натрію масою 6,2 г розчинили в 100 см 3 води і отримали розчин № 1. Потім до цього розчину додавали соляну кислоту з масовою часткою 10% до тих пір, поки середовище не стала нейтральною, і отримали розчин № 2. Визначте :
1) масові частки речовин в розчинах № 1, 2;
2) масу розчину НС1, що пішли на нейтралізацію розчину № 1.
35. взаємодіють 3 г цинку з 18,69 см 3 розчину НС1 з масовою долей14,6% і щільністю 1,07 г / см 3. Отриманий газ при нагріванні пропускають над розпеченим СuО масою 4 р Яка маса міді при цьому виходить?
36. Газ, що виділився після обробки гідриду кальцію надлишком води, пропустили над FeO. В результаті маса оксиду зменшилася на 8 м Знайдіть масу СаН 2, оброблену водою.
37. При прожаренні зразка СаСO 3 його маса зменшилася на 35,2%. Тверді продукти реакції розчинили в надлишку соляної кислоти і отримали 0,112 дм 3 (н.у.) газу. Визначте масу вихідного зразка карбонату кальцію.
38. Розклали нітрат міді, а отриманий оксид міді (II) повністю відновили воднем. Отримані при цьому продукти пропустили через трубку з Р 2 O 5, причому маса трубки після цього зросла на 3,6 м Який мінімальний обсяг сірчаної кислоти з масовою часткою 88% і щільністю 1,87 г / см 3 потрібен для розчинення отриманої в досвіді міді і яка маса розклалася солі?
39. При поглинанні оксиду азоту (IV) надлишком розчину КОН на холоді в відсутності кисню отримано 40,4 г KNO 3. Яка речовина ще утворилося і яка його маса?
40. Для нейтралізації 400 г розчину, що містить соляну і сірчану кислоти, Витрачено 287 см 3 розчину гідроксиду натрію з масовою часткою 10% і щільністю 1,115 г / см 3. Якщо до 100 г вихідного розчину долити надлишок розчину хлориду барію, то випаде 5,825 г осаду. Визначте масові частки кислот у вихідному розчині.
41. Після пропускання вуглекислого газу через розчин гідроксиду натрію отримали 13,7 г суміші середньої і кислої солей. Для перетворення їх в хлорид натрію потрібно 75 г соляної кислоти з масовою часткою HCl 10%. Знайдіть об'єм поглиненого вуглекислого газу.
42. Суміш соляної і сірчаної кислот із загальною масою розчину 600 г з однаковими масовими частками кислот обробили надлишком бікарбонату натрію і отримали 32,1 дм 3 газу (н. У.). Знайдіть масові частки кислот у вихідній суміші.
43. Для нейтралізації 1 дм 3 розчину NaOH витрачено 66,66 см 3 розчину HNO 3 з масовою часткою 63% і щільністю 1,5 г / см 3. Який об'єм розчину сірчаної кислоти з масовою часткою 24,5% і густиною 1,2 г / см 3 потрібен був би для нейтралізації того ж кількості лугу?
44. У якому об'ємному співвідношенні слід взяти розчин сірчаної кислоти з масовою часткою 5% і щільністю 1,03 г / см 3 і розчин гідроксиду барію з масовою часткою 5% і щільністю 1,1 г / см 3 для повної нейтралізації? Відповідь подайте як частка від ділення обсягу розчину лугу на розчин кислоти.
45. Розрахуйте мінімальний обсяг розчину аміаку з щільністю 0,9 г / см 3 і масовою часткою 25%, який необхідний для повного поглинання вуглекислого газу, отриманого при розкладанні 0,5 кг природного вапняку з масовою часткою карбонату кальцію, що дорівнює 92%.
46. Для повного перетворення 2,92 г суміші гідроксиду і карбонату натрію в хлорид необхідно 1,344 дм 3 хлороводню (н.у.). Знайдіть масу карбонату натрію в суміші.
47. До 25 г розчину сульфату міді (II) з масовою долей16% додали кілька розчину гідроксиду натрію з масовою долей16%. Осад відфільтрували, після чого фільтрат мав лужну реакцію. Для повної нейтралізації фільтрату потрібно 25 см 3 розчину сірчаної кислоти з молярною концентрацією 0,1 моль / дм 3 розчину. Обчисліть масу доданого розчину гідроксиду натрію.
48. Речовина, отримане при повному відновленні СuО масою 15,8 г воднем об'ємом 11,2 дм 3 (н.у), розчинили при нагріванні в концентрованої сірчаної кислоти. Який обсяг газу (н.у.) виділився в результаті реакції?
49. Для повної нейтралізації 50 см 3 соляної кислоти з масовою часткою HCl 20% і щільністю 1,10 г / см 3 був використаний розчин гідроксиду калію з масовою часткою KOH 20%. Яке хімічне кількість води міститься в отриманому розчині?
50. Газ, отриманий при пропущенні надлишку СО 2 над 0,84 г розпеченого вугілля, спрямований в реакцію з 14,0 г нагрітого оксиду міді (II). Який об'єм розчину азотної кислоти з масовою часткою 63% і щільністю 1,4 г / см 3 потрібен для повного розчинення отриманого в останній реакції речовини?
51. При прожаренні до постійної маси нітрату міді (II) маса солі зменшилася на 6,5 м Яка маса солі піддалася розкладанню?
52. При дії надлишку соляної кислоти на суміш алюмінію з невідомим одновалентним металом виділилося 6,72 дм 3 (н.у.) газу, і маса суміші зменшилася вдвічі. При обробці залишку розведеною азотною кислотою виділилося 0,373 дм 3 (н.у.) NO. Визначте невідомий метал.
53. Маса зразка крейди дорівнює 105 г, а хімічне кількість елемента кисню в його складі дорівнює 1 моль. Визначте масову частку СаСO 3 в зразку крейди (кисень входить тільки до складу карбонату кальцію).
54. При взаємодії оксиду сірки (VI) з водою отримали розчин з масовою часткою сірчаної кислоти 25%. При додаванні до цього розчину надлишку Ва (ОН) 2 випав осад масою 29,13 м Які маси SO 3 і Н 2 O були витрачені на освіту розчину кислоти?
55. При пропущенні SO 2 через 200 г розчину з масовою часткою NaOH 16% утворилася суміш солей, в тому числі 41,6 г кислої солі. Яка маса сірки, що містить 4,5% домішок по масі, використовувалася для отримання SО 2? Яка маса середньої солі?
56. На взаємодію з 80 г розчину Ca (NО 3) 2 знадобилося 50 г розчину Na 2 CО 3. Випав осад відокремили, при обробці його надлишком соляної кислоти виділилося 2,24 дм 3 (н.у.) газу. Які масові частки солей у вихідних розчинах? Яка масова частка нітрату натрію в розчині після відділення осаду?
57. При взаємодії цинку з сірчаною кислотою утворилося 10 дм 3 (н.у.) суміші SО 2 і H 2 S з відносною щільністю по аргону 1,51. Яке хімічне кількість цинку розчинили? Яка масова частка SО 2 в суміші газів?
58. Зразок суміші цинкових і алюмінієвих тирси загальною масою 11 г розчинили в надлишку розчину лугу. Визначте обсяг (н.у.) газу, що виділився, якщо масова частка цинку в суміші дорівнює 30%.
59. Гідроксид натрію масою 4,0 г сплавили з гідроксидом алюмінію масою 9,8 г. Розрахуйте масу отриманого метаалюміната натрію.
60. При обробці 10 г суміші міді і алюмінію концентрованою азотною кислотою при кімнатній температурі виділилося 2,24 дм 3 газу (н.у.). Який обсяг (н.у.) газу виділиться при обробці такої ж маси суміші надлишком розчину КОН?
61. Сплав міді і алюмінію масою 20 г обробили надлишком лугу, не розчиняється залишок розчинили в концентрованій азотній кислоті. Отриману при цьому сіль виділили, прожарили до постійної маси і отримали 8 г твердого залишку. Визначте обсяг витраченого розчину NaOH з масовою часткою 40% і щільністю 1,4 г / см 3).
62. Суміш алюмінію і оксиду металу (II) (оксид НЕ амфотерен) масою 39 г обробили надлишком розчину КОН, що виділився газ спалили і отримали 27 г води. Не розчиняється залишок повністю розчинили в 25,2 см 3 розчину з масовою часткою НС1 36,5% і густиною 1,19 г / см 3). Визначте оксид.
63. Суміш стружок цинку і міді обробили надлишком розчину КОН, при цьому виділився газ об'ємом 2,24 дм 3 (н.у.). Для повного хлорування такого ж зразка металів потрібен хлор об'ємом 8,96 дм 3 (н.у). Розрахуйте масову частку цинку в зразку.
64. Суміш тирси заліза, алюмінію і магнію масою 49 г обробили надлишком розбавленої H 2 SO 4, отримавши при цьому 1,95 моль газу. Іншу порцію того самого місива масою 4,9 г обробили надлишком розчину лугу, отримали 1,68 дм 3 (н.у.) газу. Знайдіть маси металів в суміші.
65. Яка маса осаду утворюється при зливанні розчинів, що містять 10 г NaOH і 13,6 г ZnCl 2?
66. Є дві однакові по мольному складу порції суміші Al, Mg, Fe, Zn, кожна масою 7,4 г. Одну порцію розчинили в соляній кислоті і отримали 3,584 дм 3 газу (н.у.), іншу - в розчині лугу і отримали 2,016 дм 3 газу (н.у.). Відомо, що в обох сумішах на один атом А1 доводиться 3 атома Zn. Знайдіть маси металів в суміші.
67. Суміш міді, магнію і алюмінію масою 1 г обробили надлишком соляної кислоти. Розчин відфільтрували, до фільтрату додали надлишок розчину NaOH. Отриманий осад відокремили і прожарили до постійної маси, що дорівнює 0,2 м не розчиняється після обробки соляною кислотою залишок прожарили на повітрі і отримали 0,8 г речовини чорного кольору. Знайдіть масову частку алюмінію в суміші.
68. При нагріванні в струмі кисню сплаву цинку, магнію і міді маса суміші зросла на 9,6 м Продукт частково розчиняється в луги, причому для розчинення потрібно 40 см 3 розчину з масовою часткою КОН 40% і щільністю 1,4 г / см 3. Для реакції з такою ж порцією сплаву потрібно 0,7 моль НС1. Знайдіть хімічні кількості металів в сплаві.
69. Сплав міді з цинком масою 5 г обробили надлишком розчину NaOH. Потім твердий залишок відокремили і обробили концентрованою HNO 3, отриману при цьому сіль виділили, прожарили до постійної маси і отримали 2,5 г твердого залишку. Визначте маси металів в сплаві.
70. Сплав міді і алюмінію масою 12,8 г обробили надлишком соляної кислоти. Не розчиняється залишок розчинили в концентрованій азотній кислоті, отриманий розчин упарити, сухий залишок прожарили до постійної маси і отримали 4 г твердого речовини. Визначте масову частку міді в сплаві.
71. У якому співвідношенні мас слід взяти дві порції А1, щоб при внесенні однієї в розчин лугу, а інший - в соляну кислоту виділилися рівні об'єми водню?
72. При обробці суміші алюмінію та оксиду міді (II) надлишком розчину КОН виділилося 6,72 дм 3 (н.у.) газу, а при розчиненні такої ж порції суміші в концентрованій HNO 3 при кімнатній температурі отримали 75,2 г солі. Знайдіть масу вихідної суміші речовин.
73. Яку масу оксиду міді (II) можна відновити воднем, отриманим при взаємодії надлишку алюмінію з 139,87 см 3 розчину з масовою часткою NaOH 40% і щільністю 1,43 г / см 3?
74. При повному окисленні 7,83 г сплаву двох металів утворилося 14,23 г оксидів, при обробці яких надлишком лугу залишилося нерозчинених 4,03 г осаду. Визначте якісний склад металів, що утворюють сплав, якщо їх катіони мають ступінь окислення +2 і +3, а мольное співвідношення оксидів 1: 1 (вважайте, що оксид металу зі ступенем окислення +3 має амфотерні властивості).
75. Дві порції алюмінію, що мають однакові маси, розчинили: одну в розчині гідроксиду калію, іншу - в соляній кислоті. Як відносяться між собою обсяги виділилися газів (н.у.)?
76. Сплав міді з алюмінієм масою 1,000 г обробили надлишком розчину лугу, не розчиняється осад розчинили в азотній кислоті, потім розчин випарили, залишок прожарили до постійної маси. Маса нового залишку дорівнює 0,398 м Які маси металів в сплаві?
77. Сплав цинку і міді масою 20 г обробили надлишком розчину NaOH з масовою часткою 30% і щільністю 1,33 г / см 3. Твердий залишок виділили і обробили надлишком концентрованого розчину HNO 3. Утворену при цьому сіль виділили і прожарили до постійної маси. Маса твердого залишку склала 10,016 м Обчисліть масові частки металів у сплаві і витрачений об'єм розчину лугу.
78. Сплав міді і алюмінію масою 2 г обробили надлишком розчину лугу. Залишок відфільтрували, промили, розчинили в HNО 3, розчин випарили і прожарили до постійної маси. Маса залишку після прожарювання становила 0,736 г. Розрахуйте масові частки металів у сплаві.
79. На хлорування суміші заліза, міді і алюмінію необхідно 8,96 дм 3 хлору (н.у.), а на взаємодію такий же навішування з хлороводородом його потрібно 5,6 дм 3 (н.у.). При взаємодії такої ж маси суміші металів з лугом виділяється 1,68 дм 3 (н.у.) газу. Знайдіть хімічні кількості металів в суміші.
80. Гідриди калію масою 5,0 г розчинили у воді об'ємом 80 см 3 і в отриманий розчин внесли алюміній масою 0,81 м Знайдіть масові частки речовин в отриманому розчині з точністю до тисячних часток відсотка.
СПИСОК ЛІТЕРАТУРИ
1. Баранник, В.П. Сучасна російська номенклатура неорганічних сполук / В.П. Баранник // Журнал Всесоюзного хімічного товариства ім. Д.І. Менделєєва. - 1983. - т. XXVIII. - С. 9-16.
2. Врублевський, А.І. Тренажер з хімії / А.І. Врублевський. - 2-е изд., Перераб. і доп. - Мінськ: Красиков-Принт, 2007. - 624 с.
3. Глінка, Н.Л. Завдання і вправи з загальної хімії: навч. посібник для вузів / Під ред. В.А. Рабиновича і Х.М. Рубіної. - М.: Інтеграл-Пресс, 2004. - 240 с.
4. Лидин, Р.А. Завдання із загальної та неорганічної хімії: навч. посібник для студентів вищ. навч. закладів / Р.А. Лидин, В.А. Молочко, Л.Л. Андрєєва; під ред. Р.А. Лідіна. - М.: ВЛАДОС, 2004. - 383 с.
5. Лидин, Р.А. Основи номенклатури неорганічних речовин / Р.А. Лидин [и др.]; під ред. Б.Д. Стьопіна. - М .: Хімія, 1983. - 112 с.
6. Степін, Б.Д. Застосування правил ІЮПАК по номенклатурі неорганічних сполук російською мовою / Б.Д. Стьопін, Р.А. Лидин // Журнал Всесоюзного хімічного товариства ім. Д.І. Менделєєва. - 1983. - т. XXVIII. - С. 17-20.
| Введение ........................................................................ Загальні правила номенклатури неорганічних речовин ............ .. Оксиди ....................................... .................................... Основні оксиди ............................................................ ... Кислотні оксиди ................................. ............................ Амфотерні оксиди ......................................................... .. Отримання оксидів ............................................................ Вправи для самостійної роботи по темі «Оксиди» ............................................................. Кислоти ......................................................................... Вправи для самостійної роботи по темі «Кислоти» ............................................................ Підстави ............................................................ ......... .. Вправи для самостійної роботи по темі «Основи» .......................................................... Солі ............................................................................... Вправи для самостійної роботи по темі «Солі» ............................................................... ... Генетичний зв'язок між класами неорганічних сполук ................................. ............... .. Вправи для самостійної роботи по темі «Генетичний зв'язок між класами неорганічних сполук» ................................................ Експериментальні досліди темі «осноних класи неорганічних сполук ............... ......... .. Розрахункові завдання ............................................................... Список літератури ............................................................ |
освітні: закріпити поняття «генетичний ряд», «генетичний зв'язок»; навчити складати генетичні ряди елементів (металів і неметалів), складати рівняння реакцій, відповідних генетичному ряду; перевірити, як засвоєні знання про хімічні властивості оксидів, кислот, солей, підстав;
розвиваючі: розвивати вміння аналізувати, порівнювати, узагальнювати і робити висновки, складати рівняння хімічних реакцій;
виховні : сприяти формуванню наукового світогляду.
2. Забезпечення заняття: таблиці «Періодична система», «Таблиця розчинності», «Ряд активності металів», інструкції для студентів, завдання для перевірки знань.
3. Порядок виконання:
3.1. Фронтальне опитування.
3.2. Рішення завдань.
3.3. Виконання перевірочної роботи за варіантами.
4. Схема звіту:
4.1. Записати тему і цілі практичного заняття.
4.2. Записати рішення задач.
4.3. Вирішити свій варіант самостійної роботи, рішення записати в зошит і здати на перевірку викладачеві.
Хід роботи
1. Фронтальна бесіда з питань:
Що таке генетичний зв'язок?
генетичні зв'язку - це зв'язки між різними класами, засновані на їх взаимопревращениях.
Що таке генетичний ряд?
генетичний ряд - ряд речовин - представників різних класів, які є сполуками одного хімічного елемента, пов'язаних взаємоперетворення і відображають перетворення даних речовин. В основу цих рядів покладено один і той же елемент.
Які види генетичних рядів прийнято виділяти?
Серед металів можна виділити два різновиди рядів:
а) Генетичний ряд, в якому в якості підстави виступає луг. Цей ряд можна представити за допомогою наступних перетворень:
метал → основний оксид → луг → сіль
наприклад, генетичний ряд калію K → K 2 O → KOH → KCl
б) Генетичний ряд, де в якості підстави виступає нерозчинна основа, тоді ряд можна представити ланцюжком перетворень:
метал → основний оксид → сіль → нерозчинна основа → основний оксид → метал
наприклад: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Серед неметалів також можна виділити два різновиди рядів:
а) Генетичний ряд неметалів, де в якості ланки ряду виступає розчинна кислота. Ланцюжок перетворень можна представити в наступному вигляді: неметалл → кислотний оксид → розчинна кислота → сіль.
Наприклад: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
б) Генетичний ряд неметалів, де в якості ланки ряду виступає нерозчинна кислота: неметалл → кислотний оксид → сіль → кислота → кислотний оксид → неметалл
Наприклад: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Виконання завдань за варіантами:
| Варіант 1 | Варіант 2 |
|
I варіант: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
II варіант: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Домашнє завдання: складіть схему поступового переходу від кальцію до карбонату кальцію і підготуйте повідомлення про використання в медицині будь солі (використовуючи додаткову літературу).
Інструкція до практичного заняття
Генетичний зв'язок між основними класами неорганічних речовин.
цілі: закріпити поняття «генетичний ряд», «генетичний зв'язок»; навчитися складати генетичні ряди елементів (металів і неметалів), складати рівняння реакцій, відповідних генетичному ряду; повторити властивості оксидів, кислот, солей, підстав.
Хід роботи
Запишіть визначення понять:
генетичний зв'язок - __________________________________________
Генетичний ряд - ___________________________________________
Генетичний ряд металів, в якому в якості підстави виступає луг можна представити в загальному вигляді: метал → основний оксид → луг → сіль. Складіть даний ряд, використовуючи калій. Напишіть рівняння реакцій, за допомогою яких можна здійснити цей ланцюжок перетворень.
Генетичний ряд неметалів, де в якості ланки ряду виступає розчинна кислота можна представити в наступному вигляді: неметалл → кислотний оксид → розчинна кислота → сіль. Складіть даний ряд, використовуючи фосфор. Напишіть рівняння реакцій, за допомогою яких можна здійснити цей ланцюжок перетворень.
Генетичний ряд, де в якості підстави виступає нерозчинна основа можна уявити ланцюжком перетворень: метал → основний оксид → сіль → нерозчинна основа → основний оксид → метал. Складіть даний ряд, використовуючи мідь. Напишіть рівняння реакцій, за допомогою яких можна здійснити цей ланцюжок перетворень.
Генетичний ряд неметалів, де в якості ланки ряду виступає нерозчинна кислота можна уявити ланцюжком перетворень: неметалл → кислотний оксид → сіль → кислота → кислотний оксид → неметалл. Складіть даний ряд, використовуючи кремній. Напишіть рівняння реакцій, за допомогою яких можна здійснити цей ланцюжок перетворень.
Виконайте завдання за варіантами:
| Варіант 1 | Варіант 2 |
|
1. Виберіть у вашому варіанті формули оксидів, поясніть свій вибір, спираючись на знання ознак складу даного класу сполук. Назвіть їх.
2. У стовпці формул вашого варіанту знайдіть формули кислот і поясніть свій вибір на підставі аналізу складу цих сполук.
3. Визначте валентності кислотних залишків у складі кислот.
4. Виберіть формули солей і назвіть їх.
5. Складіть формули солей, які можуть бути утворені магнієм і кислотами вашого варіанту. Запишіть їх, назвіть.
6. У стовпці формул вашого варіанту знайдіть формули підстав і поясніть свій вибір на підставі аналізу складу цих сполук.
7. У вашому варіанті виберіть формули речовин, з якими може реагувати розчин ортофосфорної кислоти (соляної, сірчаної). Складіть відповідні рівняння реакцій.
9. Серед формул свого варіанту виберіть формули речовин, здатних взаємодіяти між собою. Складіть відповідні рівняння реакцій.
10. Складіть ланцюжок генетичних зв'язків неорганічних сполук, до складу якої увійде речовина, формула якого дана в вашому варіанті під номером один.
З даних речовин складіть генетичний ряд, використовуючи всі формули. Напишіть рівняння реакцій, за допомогою яких можна здійснити цей ланцюжок перетворень:
I варіант: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIваріант: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Домашнє завдання: складіть схему поступового переходу від кальцію до карбонату кальцію і підготуйте повідомлення про використання в медицині будь солі (використовуючи додаткову літературу).
