Хімічна формула сірчаної кислоти. Сірчиста кислота: хімічні властивості, одержання
H2SO3, слабка двухосновная кислота. У вільному вигляді не виділена, існує у водних розчинах. Солі сірчистої кислоти сульфіти ... Великий Енциклопедичний словник
сірчистої кислоти - (H2SO3) слабка двухосновная кислота. Існує лише у водних розчинах. Солі С. к. Сульфіти. Застосовують в целюлозно паперовій і харчовій промисловості. Див. Також Кислоти та ангідриди ... Російська енциклопедія з охорони праці
сірчиста кислота - - [А.С.Гольдберг. Англо російський енергетичний словник. 2006 г.] Тематики енергетика в цілому EN sulfurous acid ... Довідник технічного перекладача
Н2SO3, слабка двухосновная кислота. У вільному вигляді не виділена, існує у водних розчинах. Солі сірчаної кислоти сульфіти. * * * Сірчистої кислоти сірчистої кислоти, H2SO3, слабка двухосновная кислота. У вільному вигляді не виділена, ... ... енциклопедичний словник
сірчиста кислота - sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: angl. sulfurous acid rus. сірчиста кислота ryšiai: sinonimas - vandenilio trioksosulfatas (2) ... Chemijos terminų aiškinamasis žodynas
H2SO3, слабка двухосновная кислота, що відповідає ступеню окислення сірки +4. Відома тільки в розбавлених водних розчинах. Константи дисоціації: K1 = 1,6 × 10 2, K2 = 1,0 х 10 7 (18 ° C). Дає два ряди солей: нормальні Сульфіти і кислі ... ... Велика Радянська Енциклопедія
H2SO3, слабка двухосновная кислота. У вільному вигляді не виділена, існує в вод. р рах. Солі С. к. Сульфіти ... Природознавство. енциклопедичний словник
Див. Сірка ... Енциклопедичний словник Ф.А. Брокгауза і І.А. Ефрона
Діоксид (двоокис) сірки утворюється при спалюванні сірки в повітрі або кисні. Він виходить також при прожаренні на повітрі ( «обпаленні») сульфідів металів, наприклад залізного колчедану:
З цієї реакції діоксид сірки отримують зазвичай в промисловості (про інших промислових способах отримання см, 9 § 131).
Діоксид сірки - безбарвний газ ( «сірчистий газ») з різким еапахом гарячої сірки. Він досить легко конденсується в безбарвну рідину, що кипить при. При випаровуванні рідкого відбувається сильне зниження температури (до).
Діоксид сірки добре розчиняється в воді (близько 40 обсягів в 1 об'ємі води за наявності); при цьому частково відбувається реакція з водою і утворюється сірчиста кислота:
Таким чином, діоксид сірки є ангідридом сірчистої кислоти. При нагріванні розчинність зменшується і рівновагу зміщується вліво; поступово весь діоксид сірки знову виділяється з розчину.
Молекула побудована аналогічно молекулі озону. Ядра складових її атомів утворюють трикутник:
Тут атом сірки, як і центральний атом кисню в молекулі озону, знаходиться в стані гібридизації і кут близький до. Орієнтована перпендикулярно до площини молекули орбіталь атома сірки не бере участі в гібридизації. За рахунок цієї орбіталі і аналогічно орієнтованих -орбіталей атомів кисню утворюється трехцентровая-зв'язок; що здійснює її пара електронів належить всім трьом атомам молекули.
Діоксид сірки застосовують для отримання сірчаної кислоти, а також (в значно менших кількостях) для вибілювання соломи, вовни, шовку і як дезінфікуючий засіб (для знищення цвілевих грибків в підвалах, льохах, винних бочках, бродильних чанах).
Сірчиста кислота - дуже нетривке з'єднання. Вона відома тільки у водних розчинах. При спробах виділити сірчистийкислоту вона розпадається на і воду. Наприклад, при дії концентрованої сірчаної кислоти на сульфіт натрію замість сірчистої кислоти виділяється діоксид сірки:
Розчин сірчистої кислоти необхідно оберігати від доступу повітря, інакше вона, поглинаючи з повітря кисень, повільно окислюється в сірчану кислоту:
Сірчиста кислота - хороший відновник. Наприклад, вільні галогени відновлюються нею в галогеноводороди:
![]()
Однак при взаємодії з сильними відновниками сірчиста кислота може грати роль окислювача. Так, реакція її з сірководнем в основному протікає відповідно до рівняння:
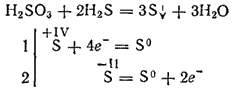
Будучи двухосновной, сірчиста кислота утворює два ряди солей. Середні її солі називаються сульфітами, кислі - гідросульфітом.
Як і кислота, сульфіти і гідросульфіти є відновниками. При їх окисленні виходять солі сірчаної кислоти.
Сульфіти найбільш активних металів при прожаренні розкладаються з утворенням сульфідів і сульфатів (реакція самоокисления - самовідновлення):
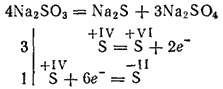
Сульфіти калію і натрію застосовуються для відбілювання деяких матеріалів, в текстильній промисловості при фарбуванні тканин, в фотографії. Розчин (ця сіль існує тільки в розчині) застосовується для переробки деревини в так звану сульфітну целюлозу, з якої потім отримують папір.
Сірчиста кислота здатна реагувати з киснем. При цьому утворюється сірчана кислота. Така реакція протікає дуже довго і можлива тільки при порушенні правил зберігання. Сірчиста кислота володіє як окисними, так і відновні властивості. З її допомогою можна отримувати галогенні кислоти. Водний розчин при реакції з хлором утворює соляну і сірчану кислоту.
При реакції з сильними відновниками сірчиста кислота відіграє роль окислювача. Одним з таких речовин є сірководень, газ з дуже неприємним запахом. Взаємодіючи з водним розчином сірчаної кислоти, він утворює сірку і воду. Солі сірчистої кислоти також мають відновні властивості. Вони діляться на сульфіти і гідросульфіти. При реакціях окислення цих солей утворюється сірчана кислота.
Отримання сірчистої кислоти
Сірчиста кислота утворюється тільки при взаємодії сірчистого газу і води. Потрібно отримати сірчистий газ. Це можна зробити за допомогою міді і сірчаної кислоти. Обережно налийте концентровану сірчану кислоту в пробірку і киньте туди шматочок міді. Нагрійте пробірку за допомогою спиртівки.
В результаті нагрівання утворюється мідний купорос (сульфат міді), вода і сірчистий газ, який за допомогою спеціальної трубочки потрібно підвести до колбочці з чистою водою. Таким чином можна отримати сірчистийкислоту.
Пам'ятайте, що сірчистий газ шкідливий для людини. Він викликає ураження дихальних шляхів, втрату апетиту і головний біль. Тривале вдихання може викликати непритомний стан. При роботі з ним потрібна обережність.
Застосування сірчистої кислоти
Сірчиста кислота має антисептичні властивості. Її застосовують при знезараженні поверхонь, ферментації зерна. З її допомогою можна відбілити деякі речовини, які при взаємодії з сильними окислювачами (наприклад, хлором) розкладаються. До таких речовин відноситься шерсть, шовк, папір і деякі інші. Її антибактеріальні властивості використовуються для запобігання бродіння вина в бочках. Таким чином благородний напій може зберігатися дуже довго, набуваючи благородний смак і неповторний аромат.
Сірчистийкислоту використовують при виробництві паперу. Додавання цієї кислоти входить в технологію отримання сульфітної целюлози. Потім її обробляють розчином гідросульфіту кальцію, щоб зв'язати волокна воєдино.
