Схема будови кремнію. Будова електронної оболонки
Будова атома Положення в ПС: період III; група IV, главеая; Заряд ядра: +14 Si; Відносна атомна маса: Ar (Si) = 28 Будова атома: p = 14, e = 14, n = = 14 Електронна формула: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2Неметалл;
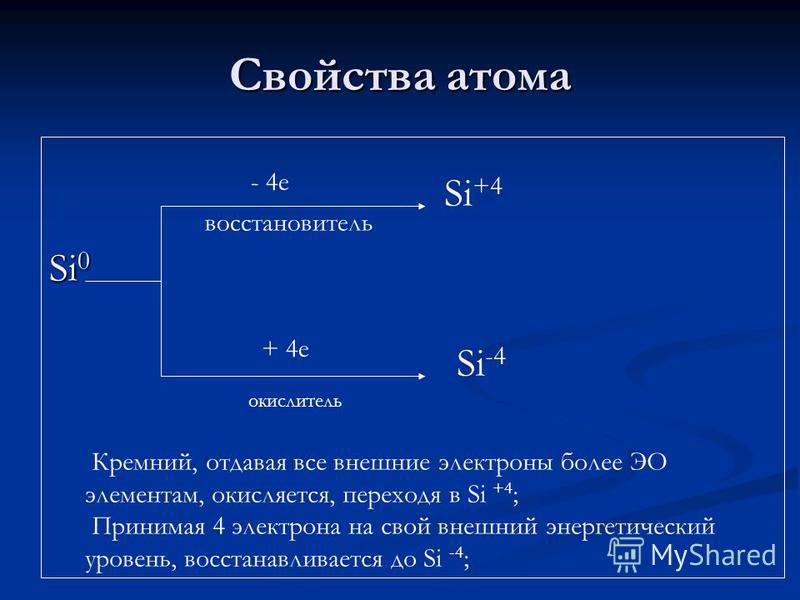
Властивості атома Si е відновник + 4 е окислювач Si +4 Si -4 Кремній, віддаючи все зовнішні електрони більш ЕО елементам, окислюється, переходячи в Si +4; Беручи 4 електрона на свій зовнішній енергетичний рівень, відновлюється до Si -4;

Фізичні властивості кремнію Кремній - неметалл, існує в кристалічному і аморфному стані. Кристалічний кремній - речовина сірувато - сталевого кольору з металевим блиском, вельми тверде, але крихке. Аморфний кремній - бурий порошок. р = 2,33 г / см 3; t пл. = С; t кип. = С;

Кристалічна структура кремнію кристалічна решітка кремнію кубічна гранецентрированная типу алмазу. Але через більшої довжини зв'язку між Si - Si, твердість кремнію значно менше, ніж алмазу. Кремній крихкий, тільки при нагріванні вище С.

Електрофізичні властивості Елементарний кремній Елементарний кремній типовий напівпровідник. типовий напівпровідник. На електрофізичні властивості кристалічного кремнію великий вплив мають містяться в ньому микропримеси. Для отримання монокристалів кремнію з доречнийпровідністю в кремній вводять добавки елементів III-ї групи бор, алюмінію, галію і індію, з електронною провідністю добавки елементів V-ї групи фосфору, миш'яку або сурма.


Кремень Кремень, саме цей Кремень, саме цей непоказний і дуже непоказний і дуже міцний камінь, міцний камінь, поклав поклав початок кам'яного початок кам'яного віку - віку століття - століття крем'яних знарядь праці. крем'яних знарядь праці. Причин дві: - поширеність і доступність кремнію; - поширеність і доступність кремнію; - здатність утворювати при сколе гострі ріжучі краю; - здатність утворювати при сколе гострі ріжучі краю;




Чи знаєте ви, що .. Спосіб отримання кремнію в чистому вигляді розроблений Миколою Миколайовичем Бекетовим. Кремній в Росії проводиться на заводах: м Каменськ - Уральський (Свердловська область) м Каменськ - Уральський (Свердловська область) м Шелех (Іркутська область). м Шелех (Іркутська область).

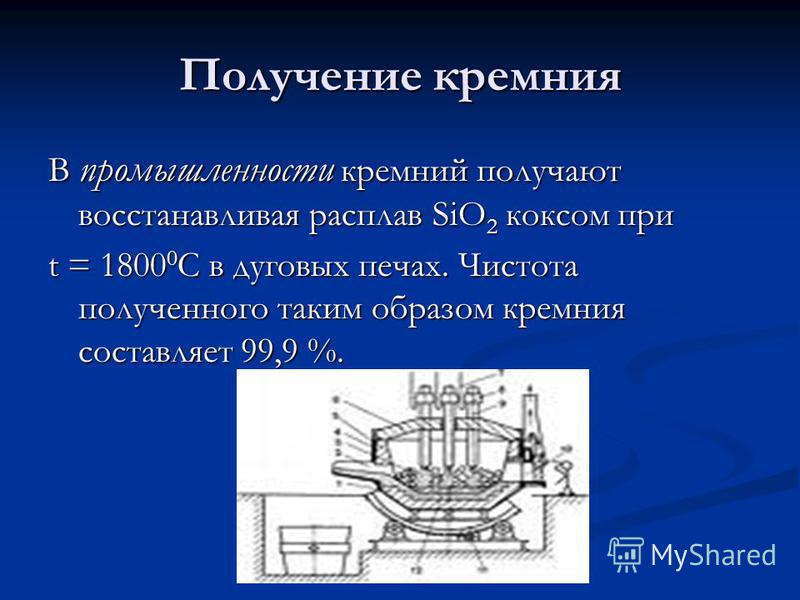
Отримання кремнію У промисловості кремній отримують відновлюючи розплав SiO 2 коксом при t = C в дугових печах. Чистота отриманого таким чином кремнію становить 99,9%.
Отримання кремнію Лабораторний спосіб отримання: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Хімічні властивості кремнію При нагріванні до 400 - З кремній реагує з киснем з утворенням діоксиду кремнію: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
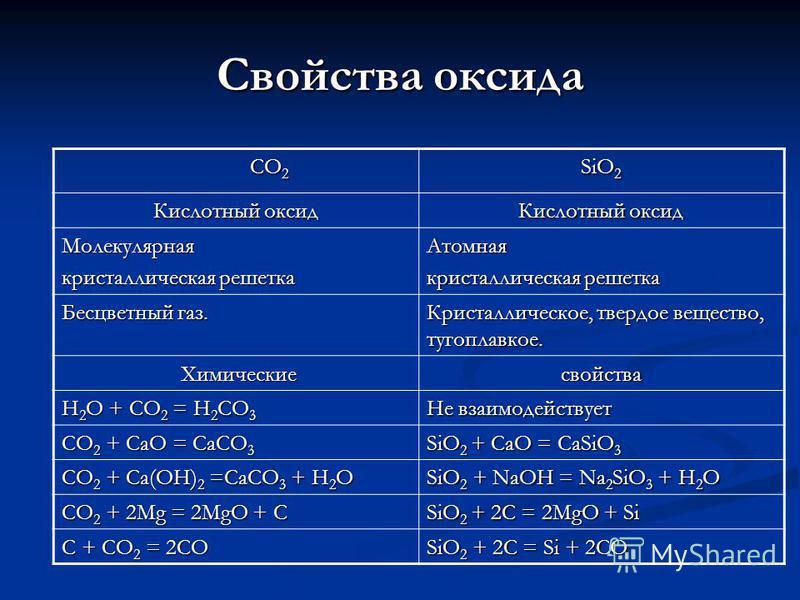
Властивості оксиду СО 2 СО 2 SiO 2 Кислотний оксид Молекулярна кристалічна решітка Атомна Безбарвний газ. Кристалічна, тверда речовина, тугоплавкое. Хімічні Хіміческіесвойства H 2 O + CO 2 = H 2 CO 3 Чи не взаємодіє CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Властивості кислот H 2 CO 3 H 2 SiO 3 двохосновні, кисневмісна, слабка, тендітна, тому що летюча. Двоосновна, кисневмісна, слабка, нерозчинна у воді. Отримання: СО 2 + Н 2 О = Н 2 СО 3 Отримання: SiO 2 + H 2 O = не можна Нестійка, нетривка, при стоянні або нагріванні розкладається: Н 2 СО 3 = СО 2 + Н 2 О Виділити в чистому вигляді не можна, тому при нагріванні розкладається: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Незначне виділення газу __________

Солі Вугільної кислоти Кремнієвої кислоти - карбонати; - гідрокарбонати; - силікати; - силікати; Карбонати мають всі властивості солей, є сильними електролітами, повністю дисоціюють на іони (розчинних у воді). Розчинними є тільки солі лужних металів, інші утворюють нерозчинні або взагалі не утворюють солей (Al +3, Cr +3, Ag +).
![]()



Біологічна роль Найважливіше з'єднання кремнію - SiO 2 необхідний для життя рослин і тварин. Завдяки йому очерети, очерети Завдяки йому очерети, очерети і хвощі стоять міцно, як багнети. і хвощі стоять міцно, як багнети. Гострі листя осоки ріжуть, як гострі листя осоки ріжуть, як ножі, стерня на скошеному полі ножі, стерня на скошеному полі коле, як голки, а стебла злаків коле, як голки, а стебла злаків настільки міцні, що не дозволяють настільки міцні, що не дозволяють ниві на полях лягати від дощу і вітру ниві на полях лягати від дощу і вітру


Кремній - мікроелемент, постійно міститься в організмі людини. Найбільша його кількість міститься в лімфовузлах, сполучної тканини аорти, трахеї, в волоссі і шкірі. Кремній необхідний для побудови епітеліальних клітин. Кремній - мікроелемент, постійно міститься в організмі людини. Найбільша його кількість міститься в лімфовузлах, сполучної тканини аорти, трахеї, в волоссі і шкірі. Кремній необхідний для побудови епітеліальних клітин. Кремній відіграє важливу роль в процесі мінералізації кісткової тканини; необхідний для підтримки еластичності стінки артерій, робить позитивний вплив на імунітет і сповільнює процеси старіння в тканинах організму людини. Середній вміст кремнію в крові становить 8,25 мг / добу. З віком його рівень в організмі знижується, тому у людей похилого віку потреба в кремнії, як правило, підвищується. Покращують засвоєння кремнію організмом наявність кальцію, магнію, марганцю і калію. Кремній відіграє важливу роль в процесі мінералізації кісткової тканини; необхідний для підтримки еластичності стінки артерій, робить позитивний вплив на імунітет і сповільнює процеси старіння в тканинах організму людини. Середній вміст кремнію в крові становить 8,25 мг / добу. З віком його рівень в організмі знижується, тому у людей похилого віку потреба в кремнії, як правило, підвищується. Покращують засвоєння кремнію організмом наявність кальцію, магнію, марганцю і калію.

Біологічна роль Кремній входить і до складу нижчих живих організмів - діатомових водоростей і радіолярій, - найніжніших грудочок живої матерії, які створюють свої неперевершені за красою скелети з кремнезему. Кремній входить і до складу нижчих живих організмів - діатомових водоростей і радіолярій, - найніжніших грудочок живої матерії, які створюють свої неперевершені за красою скелети з кремнезему. Діатомові водорості Радіолярії Самоконтроль 1. Яке місце займає кремній в періодичній системі: а) 2 період, 4 гр.побоч. б) 3 період, 3 гр. чолі. в) 3 період, 4 гр. глава) 2 період, 4 гр.побоч. б) 3 період, 3 гр. чолі. в) 3 період, 4 гр. чолі. 2. Кристалічні ґрати кремнію: а) іонна; б) атомна; в) молекулярна; а) іонна; б) атомна; в) молекулярна; 3. За поширеністю в природі кремній .... елемент: а) перший; б) другий; в) третій; а) перший; б) другий; в) третій; 4. Кремній вступає в реакцію з: а) металами, воднем, галогенами; а) металами, воднем, галогенами; б) металами, галогенами, легко розчиняється в лугах; б) металами, галогенами, легко розчиняється в лугах; в) оксидами, кислотами, неметалами. в) оксидами, кислотами, неметалами. 5. Солі кремнієвої кислоти: а) силіциди; б) гідросилікати; в) силікати; а) силіциди; б) гідросилікати; в) силікати;

Кремній.
кремній - елемент головної підгрупи IV групи 3-го періоду періодичної системи хімічних елементів Д. І. Менделєєва, з атомним номером 14, атомною масою: 28,0855. У з'єднаннях зазвичай проявляє ступінь окислення +4 (валентність IV) і дуже рідко +3, +2 і +1 (валентності відповідно III, II і I). У періодичної системі Менделєєва кремній розташований в групі IVA (А-позначає, що це головна підгрупа) (В групі вуглецю), в третьому періоді. неметалл . позначається символом Si(лат. Silicium). У вільному вигляді - коричневий порошок або світло-сірий компактний матеріал з металевим блиском. Структура решітки: кубічна, алмазна.
Основний стан: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-елемент.
2. Фізичні властивості.
Кристалічний кремній - речовина темно-сірого кольору зі сталевим блиском. Структура кремнію аналогічна структурі алмазу. У його кристалі кожен атом оточений Тетраедрично чотирма іншими і пов'язаний з ними ковалентним зв'язком, яка значно слабкіше, ніж між атомами вуглецю в алмазі. У кристалі кремнію навіть при звичайних умовах частина ковалентних зв'язків руйнується. Тому в ньому є вільні електрони, які обумовлюють невелику електричну провідність. При висвітленні і нагріванні збільшується число об'єктів, що руйнуються зв'язків, а значить, збільшується число вільних електронів і зростає електрична провідність. Так слід пояснювати напівпровідникові властивості кремнію.
Кремній дуже крихкий, його щільність 2,33 г / см3. Як і вугілля, відноситься до тугоплавким речовин.
Кремній складається з трьох стабільних ізотопів: 2814Si (92,27%), 2914Si (4,68%) і 3014Si (3,05%).
3. Знаходження в природі.
Найчастіше в природі кремній зустрічається у вигляді кремнезему - з'єднань на основі діоксиду кремнію (IV) SiO2 (близько 12% маси земної кори). Основні мінерали і гірські породи, утворені діоксидом кремнію - це пісок (річковий і кварцовий), кварц і кварцити, кремінь, польові шпати. Природні силікати мають складний склад і будова. Ось склад деяких природних силікатів:
ü польовий шпат К 2 О × Аl 2 O 3 × 6SiO 2,
ü азбест 3MgО × 2SiO 2 × 2H 2 O,
ü cлюда К 2 О × 3Аl 2 O 3 × 6SiO 2 × 2H 2 O,
ü каолинит 3Аl 2 O 3 × 2SiO 2 × 2H 2 O.
Другу за поширеністю в природі групу сполук кремнію становлять силікати і алюмосилікати.
Відзначено поодинокі факти знаходження чистого кремнію в самородному вигляді.
4. Хімічні властивості кремнію і його сполук.
За хімічними властивостями кремній, як і вуглець, є неметаллом, але його неметаллічность виражена слабше, так як він має більший атомний радіус. Оскільки у атомів кремнію на зовнішньому енергетичному рівні знаходиться 4 електрона, то для кремнію характерна ступінь окислення як -4, так і +4 (відомо з'єднання кремнію, де його ступінь окислення дорівнює +2).
Кремній при звичайних умовах досить інертний, що слід пояснити міцністю його кристалічної решітки. Безпосередньо він взаємодіє тільки з фтором:
кислоти (Крім суміші плавикової HF і азотної HNO 3)на кремній не діють. Однак він розчиняється в гідроксиди лужних металів, утворюючи силікат і водень:
З двох аллотропних модифікацій кремнію - кристалічної і аморфної - хімічно більш активним є аморфний кремній. Він реагує з киснем при нагріванні, утворюючи SiO 2:
а також з усіма галогенами, Наприклад:
![]()
При високій температурі кремній з'єднується з вуглецем, Утворюючи карборунд SiC:
Карборунд має алмазоподобную кристалічну решітку, в якій кожен атом кремнію оточений чотирма атомами вуглецю і навпаки, а ковалентні зв'язки дуже міцні, як в алмазі. Тому по твердості він близький до алмазу. З карбіду кремнію виготовляють точильні камені та шліфувальні круги.
Силіцид магнію. У реакціях з активними металами, що протікають з утворенням силіцидів, кремній виступає в ролі окислювача:
При високих температурах кремній відновлює багато метали з їх оксидів. (!!!)
Сілан. При дії на силіциди соляної кислоти отримують найпростіше водневе з'єднання кремнію силан SiH 4:
Сілан - отруйний газ з неприємним запахом, самозаймається на повітрі (!!!):
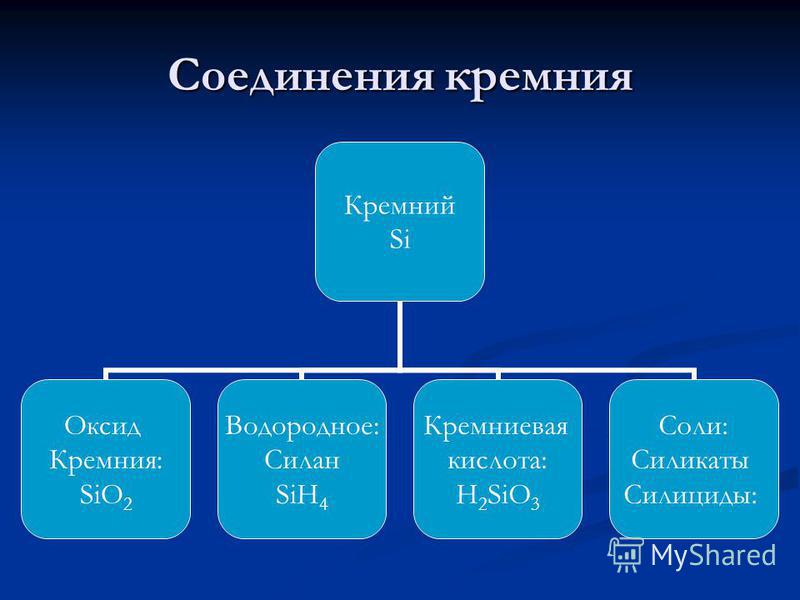
Оксид кремнію (IV).Оксид кремнію (IV) називають також кремнеземом. Це тверде тугоплавка речовина (Температура плавлення 1700 ° С) , Широко поширене в природі в двох видах:
1) кристалічний кремнезем - у вигляді мінералу кварцу і його різновидів (гірський кришталь, халцедон, агат, яшма, кремінь); кварц становить основу кварцових пісків, широко використовуваних в будівництві і в силікатної промисловості;
2) аморфний кремнезем - у вигляді мінералу опала складу SiO 2 × п H 2 O; землистими формами аморфного кремнезему є діатоміт, трепел (інфузорна земля); прикладом штучного аморфного безводного кремнезему може служити силікагель, який виходить з метасилікат натрію:
Силікагель має розвинену поверхню, а тому добре адсорбує вологу .
При 1710 ° кварц плавиться. При швидкому охолодженні розплавленої массиобразуется кварцове скло . Воно має дуже малий коефіцієнт розширення, завдяки чому розпечене кварцове скло не тріскається при швидкому охолодженні водою. З кварцового скла виготовляють лабораторний посуд і прилади для наукових досліджень.
Найпростіша формула оксиду кремнію (IV) SO 2 аналогічна формулі оксиду вуглецю (IV) СО2. Тим часом фізичні властивості їх різко відрізняються (SiO 2 - тверда речовина, CO 2 - газ). Ця різниця пояснюється будовою кристалічних решіток. С0 2 кристалізується в молекулярної решітці, SiO 2 - в атомній. Структуру SiO 2 в площинному зображенні можна змалювати таку картину:
Координаційне число атома вуглецю в твердому СО2 дорівнює 2, а кремнію в SiO 2 дорівнює 4. Кожен атом кремнію укладений в тетраедр з 4 атомів кисню. При цьому атом кремнію знаходиться в центрі, а по вершинах тетраедра розташовані атоми кисню . Весь шматок кремнезему можна розглядати як кристал, формула якого (SiO 2) n. Така будова оксиду кремнію (IV) обумовлює його високу твердість і тугоплавкость .
За хімічними властивостями оксид кремнію (IV) SiO 2 відноситься до кислотних оксидів. При сплаві його з твердими лугами, основними оксидами і карбонатами утворюються солі кремнієвої кислоти:
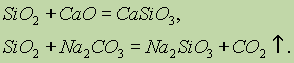
З оксидом кремнію (IV) взаємодіє тільки плавикова кислота:
За допомогою цієї реакції виробляється травлення скла .
У воді оксид кремнію (IV) розчиняється і з нею хімічно не взаємодіє. (!!!) Тому кремнієву кислоту отримують непрямим шляхом, діючи кислотою на розчин силікату калію або натрію:
При цьому кремнієва кислота (в залежності від концентрації вихідних розчинів солі і кислоти) може бути отримана як у вигляді студнеобразной маси, що містить воду, так і у вигляді колоїдного розчину (золю).
Кремнієві кислоти. SiO 2 є ангідридом ряду кремнієвих кислот, склад яких можна виразити загальною формулою: xSiO 2 × yH 2 O, де х і у - цілі числа:
1) х = 1, у = 1: SiO 2 × H 2 O, т. Е. H 2 SiO 3 - метакремнієва кислота;
2) х = 1, у = 2: SiO 2 × 2H 2 O, т. Е. H 4 SiO 4 - ортокремнієвої кислота;
3) х = 2, у = 1: 2SiO 2 × H 2 O, т. Е. H 2 Si 2 O 5 - двуметакремніевая кислота.
Кремнієва кислота побудована з тетраедричних структурних ланок (в кожному такому ланці атом кремнію знаходиться в центрі тетраедра, а по вершинах розташовані атоми кисню). Структурні ланки, об'єднуючись в ланцюзі, утворюють більш стійкі полікремнієві кислоти:
Склад такого з'єднання можна виразити формулою (H 2 SiO 3) n. Однак зазвичай кремнієву кислоту зображують формулою H 2 SiO 3. H 2 SiO 3 - кислота дуже слабка, в воді мало розчинна. При нагріванні легко розпадається аналогічно вугільної кислоти:
Все кремнієві кислоти дуже слабкі (слабше вугільної).
Силікати. Солі всіх кремнієвих кислот називаютьсиликатами, Хоча, як правило, в навчальній літературі під силикатами увазі солі метакремнієвої кислоти. Їх склад зазвичай зображують формулою у вигляді сполук оксидів елементів. Наприклад, силікат кальцію CaSiO 3 можна висловити так: СаО × SiO 2.
Силікати складу R 2 О × nSiO 2, де R 2 O - оксиди натрію або калію , називаються розчинним склом , а їх концентровані водні розчини - рідким склом . Найбільше значення має натриевое розчинне скло.
При стоянні на повітрі розчини силікатів мутніють, так як знаходиться в повітрі оксид вуглецю (IV) витісняє кремнієву кислоту з її солей:
Кремнієва кислота практично нерозчинні в воді - це властивість використовують як якісну реакцію на іон SiO 3 2-.
Силікати отримують сплавом оксиду кремнію з лугами або карбонатами:
5. Відкриття іона SiO 3 2-. (Не можу знайти нічого ...)
6. Роль сполук кремнію в грунтоутворенні і лісовому господарстві.
Магматичні породи за своїм складом досить стабільні і містять головним чином з'єднання кремнію, алюмінію, заліза, лугів, магнію і кальцію. За змістом Si0 2 магматичні породи поділяються на чотири групи: кислі (\u003e 65%), середні (52 - 65%), основні (40-52%) і ультраосновних (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Кислі магматичні породи- граніти, пегматити, ріоліти, дацит і інші - зазвичай мають світлу і бурувате забарвлення з вираженими кристалами кварцу, польового шпату, слюди. Зміст SiО 2 в них висока (понад 65%) при помітній кількості калію і натрію. У той же час заліза трохи, а кальцію і магнію мізерно мало. Грунти на кислих магматичних породах, наприклад на гранітах, відрізняються на ранніх стадіях вивітрювання рихлістю, гравійним характером вихідного матеріалу. При вивітрюванні в гумідних умовах вони легко втрачають лужноземельні елементи, внаслідок чого грунту на таких виветрелих субстратах (елювії порід) надзвичайно бідні, малородючі.
Основні магматичні породи -базальт, габро та ін., як правило, мають темну (до чорної) забарвлення. Для них характерно більш низьке в порівнянні з кислими породами зміст SiO 2. Основні магматичні породи відносно багаті сполуками заліза, марганцю, хрому, кобальту, цинку, титану, нікелю, міді. Продукти їх вивітрювання досить швидко набувають глинистий характер, які тривалий час зберігають лужну і нейтральну реакцію, відрізняються підвищеним вмістом гумусу і глинистих мінералів. Грунти на таких породах більш родючі.
Крім кислих і основних порід нерідко зустрічаються магматичні породи перехідного типу(Середні) - інтрузивні породи групи диорита і їх еффузівние аналоги - андезити. Відповідно і грунту на цих породах набувають рис, подібні до грунтами, приуроченим до кислих або основних порід. Значно рідше поширені ультраосновних породи:перідотіти і покрутив, у яких вміст Si0 2 найнижче.
Метаморфічні породи -перехідні між масивно-кристалічними і осадовими породами. Стародавні осадові породи при зануренні, високому тиску і температурах метаморфизируют, утворюючи гнейси, серпентинітів, мармур, кварцити, глинисті сланці. Гнейси за своїм складом особливо близькі до гранітів. Грунти, що формуються на таких породах, мають подібні риси з грунтами на власне кислих магматичних породах.
Хлор.
1. Положення алюмінію в таблиці Д. І. Менделєєва. Будова атома, притаманні ступеня окислення.
хлор - елемент головної підгрупи VII групи, 3-го періоду, з атомним номером 17. Позначається символом Cl (лат. Chlorum). хімічно активний неметалл . Входить в групу галогенів .
Проста речовина хлор при нормальних умовах - отруйний газ жовтувато-зеленого кольору важчий за повітря, з різким запахом . Молекула хлору двухатомная (формула Cl 2).
Основний стан: +17 Cl 17е1s 2 2s 2 2p 6 3s 2 3p 5, р-елемент. Ст.ок .: -1 +1 +3 +5 +7.
Будова електронної оболонки.
На валентном рівні атома хлору міститься 1 неспарених електронів : 1s 2 2s 2 2p 6 3s 2 3p 5, тому валентність рівна 1 для атома хлору дуже стабільна. За рахунок присутності в атомі хлору незайнятої орбіталі d-підрівні, атом хлору може проявляти і інші ступені окислення. Схема освіти збуджених станів атома:
Також відомі сполуки хлору, в яких атом хлору формально проявляє валентність 4 і 6, наприклад ClO 2 і Cl 2 O 6. Однак, ці сполуки є радикалами, тобто у них є один неспарених електронів.
2. Фізичні властивості.
При нормальних умовах хлор - жовто-зелений газ з задушливим запахом. Деякі його фізичні властивості представлені нижче.
Щільність: 3,214 г / л, жід.- при -35 0 С - 1,557, тв. при -105 0 С 1,9 г / см 3.
Температура плавлення: 172,2 До
Температура кипіння: 238,6 До
Теплота плавлення: 6,41 кДж / моль
Теплота випаровування: 20,41 кДж / моль.
Газоподібний хлор відносно легко зріджується. Починаючи з тиску в 0,8 МПа (8 атмосфер), хлор буде рідким вже при кімнатній температурі. При охолодженні до температури в -34 ° C хлор теж стає рідким при нормальному атмосферному тиску. Рідкий хлор - жовто-зелена рідина, що володіє дуже високим корозійну дію (за рахунок високої концентрації молекул). Підвищуючи тиск, можна домогтися існування рідкого хлору аж до температури в +144 ° C (критичної температури) при критичному тиску в 7,6 МПа. За електропровідності рідкий хлор займає місце серед найсильніших ізоляторів: він проводить струм майже в мільярд разів гірше, ніж дистильована вода, і в 10 22 разів гірше срібла. Швидкість звуку в хлорі приблизно в півтора рази менше, ніж в повітрі.
3. Знаходження в природі.
У природі зустрічаються два ізотопу хлору 35 Cl і 37 Cl. У земній корі хлор найпоширеніший галоген . Хлор дуже активний - він безпосередньо з'єднується майже з усіма елементами періодичної системи. Тому в природі він зустрічається тільки у вигляді сполук в складі мінералів:
ü Галіт NaCl,
ü Сільвіна KCl,
ü сильвініту KCl · NaCl,
ü бішофіту MgCl 2 · 6Н 2 О,
ü карналлита KCl · MgCl 2 · 6Н 2 O,
ü каинита KCl · MgSO 4 · 3Н 2 О.
Найбільші запаси хлору містяться в складі солей, вод, морів і океанів (вміст в морській воді 19 г / л). На частку хлору доводиться 0,024% від загального числа атомів земної кори; кларки елементів (Числа, що виражають середній вміст хімічних елементів в земній корі, гідросфері, Землі, космічних тілах, геохімічних або космохіміческіх системах і ін., По відношенню до загальної маси цієї системи. Виражається в% або г / кг.) хлору - 0,017%. Людський організм містить 0,25% іонів хлору по масі. В організмі людини і тварин хлор міститься в основному в міжклітинних рідинах (в тому числі в крові) і грає важливу роль в регуляції осмотичних процесів, а також в процесах, пов'язаних з роботою нервових клітин.
4. Хімічні властивості хлору і його сполук. Отримання хлору.
Будова атома кремнію. Si. +14. Збуджений стан. Е. 3d. 3p. 3s. Е. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Картинка 3 з презентації «Кремній» до уроків хімії на тему «Кремній»Розміри: 960 х 720 пікселів, формат: jpg. Щоб безкоштовно завантажити картинку для уроку хімії, клацніть по зображенню правою кнопкою мишки і натисніть «Зберегти зображення як ...». Для показу картинок на уроці Ви також можете безкоштовно скачати презентацію «Кремній.ppt» цілком з усіма картинками в zip-архіві. Розмір архіву - 562 КБ.
завантажити презентаціюкремній
«Кремній та його сполуки» - Будова і властивості атомів. Напівпровідник. Tплав (Si) = 1415? C, Tплав (алмаз) = 3730? C. Отримання кремнію. Відкриття кремнію. Входить також до складу рослин і тварин. Фізичні властивості кремнію. Значить, і цегла - кераміка, і кахель, і осколки давньогрецької амфори - теж кераміка. Мета уроку: Хімічні властивості кремнію.
«З'єднання кремнію» - Кремній та його сполуки. Хімічні властивості SiO2. Сілан. Отримання кремнієвої кислоти. Властивості кремнію. Оксид кремнію. Природні силікати. Ступінь окислення. Горний кришталь. Топаз. Отримання кремнію в лабораторії. Знаходження в природі. Кристалічні решітки. Відкриття кремнію. Аметист. Отримання кремнію.
«Ізотопи кремнію» - Поділ ізотопів кремнію. Отримання полікрісталлічес-кого кремнію. Перспективи застосування моноізотопному кремнію. Ізотопне розбавлення при вирощуванні монокристалів з кварцового тигля. Виготовлення монокристаллической затравки. Залежність положення максимуму смуги комбінаційного розсіювання від атомної маси.
«Урок Кремній» - Який з хімічних елементів найважливіший в живій і не живій природі? Оксиди вуглецю і кремнію. Речовина прозоре. Про прояві неметалевих і металевих властивостей. Підведення підсумків рефлексія. Підсумкове тестування. Оксиди, гідроксиди вуглецю і кремнію? Агрегатний стан: а) рідина, б) газ, в) тверда речовина.
«Кремній» - Кремній - проста речовина. Фізичні властивості. Оксид кремнію (IV). Силіциди. Значення для живих організмів. Взаємодія з металами. Взаємодія з неметалами. Карбід кремнію. Кремній в природі. Кремній. Продукція силікатної промисловості. Один з типів природних сполук кремнію - силікати.
«Вуглець і кремній» - Оксид кремнію (IV). Елементи IV групи головної підгрупи. Токсичність. 7. Цікаве про вуглець. Силікати. Слизький на дотик. Алмаз - найтвердіша природна речовина. Хімічні властивості. Більше 99% вуглецю в атмосфері міститься у вигляді вуглекислого газу. Карбіди. 6. Застосування. Одне з найбільш м'яких серед твердих речовин.
Всього в темі 6 презентацій
