Висока концентрация на силиций. Ти знаеш как
Процесор? Писок? И какви асоциации имате с думата? Или може би Силиконовата долина?
Сякаш не беше там, със силиций се придържаме днес и ако трябва да знаете какво е Си и защо ядете, питам за котка.
Вход
Като студент в един от московските университети по специалността "Наноматериали", искам да ви запозная, скъпи читателю, с най-важните химични елементи на нашата планета. Дълго време избирах нещо, въглен или силиций, но все пак реших да използвам Si, така че сърцето на всяка съвременна джаджа да се основава на него, така че можете да кажете така прекрасно. Ще се опитам да направя мислите си изключително прости и достъпни, след като написах този материал, го запазих, главно на начинаещи, но все повече хора могат да го получат от cicave, така че бих искал да кажа, че статията е написана изключително за разширяване на интересите, какво се заби. И така, нека да започнем.
Силиций
Силиций (лат. Silicium), Si, химичен елемент от IV група на периодичната система на Менделиев; атомно число 14, атомно тегло 28,086.
В природата елементът е представен от три стабилни изотопа: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%).
Дебелина (n.s.) 2,33 g/cm?
Точка на топене 1688 К

Прах Si
Историческо доказателство
Хълмове от силиций, широки земи, булеварди на хора от каменната ера. Имаше хиляди цаца от камък и поливане на камъка. Zastosuvannya spoluk Silicon, свързан с тяхната обработка, - подготовката на склад - започва около 3000 г. пр.н.е. д. (Стария Египет). По-рано в къщата се използва силиций - оксид SiO2 (силициев диоксид). През 18 век силициевият диоксид е инжектиран с просто тяло и пренесен в „земите“ (което се използва в името му). Skladnіst до склад на силициев диоксид с инсталиран І. И. Берцелиус. В същото време, през 1825 г., премахвайки елементарен силиций от силициев флуорид SiF4, заменяйки останалия метален калий. Новият елемент е наречен "силиций" (лат. silex - кремък). Руско име vvív G. I. Хес през 1834 г.

Силиконова дъга от удължители в природата в склада на звуковия звук
Разширяване на силиций в природата
За ширината в земната кора, силицият е друг (след киселия) елемент, средното му съдържание в литосферата е 29,5% (зад масата). Кората на земята, Силиконово сиво, има същата основна роля, като въгленът на земната светлина на създанието. За геохимията на силиция е важна, по-специално, магнитната връзка на його с киселото. Близо 12% от литосферата се превръща в силициев диоксид SiO2 под формата на минерала кварц и различни разновидности. 75% от литосферата е съставена от различни силикати и алумосиликати (полова, слюда, амфиболово тощо). Общият брой на минералите, които могат да бъдат заменени със силициев диоксид, надхвърля 400.
Физическа сила на силиция
Мисля, че особено не е varto, това е всичко Физическа силаИмам свободен достъп, но ще изброя най-лошите.
Точка на кипене 2600 °C
Силициев прозорец за dovgokhvilovyh ІCh-promenіv
Диелектрично проникване 11.7
Твърдост на силиция по Моос 7.0
Бих искал да кажа, че силициевият tenditny материал, възпоменателна пластична деформация започва при температури по-високи от 800°C.
Силицият е проводник, същото вино, което знаем много за застосуване. Електрическата мощност на силиция може да лежи в къщата.
Химическа сила.
Тук е богато, невероятно е, може да се каже, но се натъквам на най-известния. В рафтовете на Si (подобен на въглерод) 4-валентен.
На повърхността на силициевия завдяк топенето на оксид е устойчиво на вятър при повишени температури. В киселина той се окислява при 400 °C, разтваряйки силициев оксид (IV) SiO2.
Силицият е устойчив на киселини и е по-малко вероятно да се смеси с азотна и флуороводородна киселина, лесно се разграничава в горещите ливади от водата.
Силицият прави 2 групи киселинни силани - силоксан и силоксен. Силицият реагира с азот при температури над 1000 °C. той е ценен материал за химическата промишленост, както и за производството на пожарогасители. Висока твърдост, както и термична и химическа устойчивост, са обработени със силициев карбид (силициев карбид SiC) и бор (SiB3, SiB6, SiB12) подове.
Otrimanya Silicon
Мисля, че tse naytsіkavіsha част, ето доклада.
Видът разпознаване на угар се разделя на:
1.
Силиконова електронна мощност(т.з. електронен силиций"") - най-силиконовият силиций от силиконовата мъгла над 99,999% зад стената, електрическата поддръжка на силициевото електронно качество може да се променя в интервала от приблизително 0,001 до 150 ома cm, но с което стойността на подкрепата е виновен buti е снабден с ол инклузив къща, така че можете да влезете в кристала на друга къща, искайки да се погрижите за задачите на детската стая на електрическия opir, звъни, неприемливо.
2.
Силиконов Sony качество(t.z. "sonyachny silicon") - силиций от смесен силиций над 99,99% на влакно, който се използва за производството на фотоелектрически преобразуващи устройства (звукови батерии).

3.
Технически силиций- блокове от силициева поликристална структура, взети по метода на карботермично обновяване от чист кварцово скърцане; покритие от 98% силиций, основната сграда е въглища, проветрява се с високо количество леки елементи - бор, фосфор, алуминий; основно се използва заместващо за притежание на поликристален силиций.
Силицият с техническа чистота (95-98%) притежава електрически взривове от вдъхновен силициев диоксид SiO2 между графитните електроди. Във връзка с развитието на nap_v_dnikovoї tehníko razrobleno метод за получаване на чист и особено чист силиций. В името на предния синтез на чист vih_dnih spoluk силиций, z yakikh vityagyat silіkí vídnovlennya vídnovlennya abo termіchnogo razkladannya.
Поликристален силиций ("полисилиций") - най-чистата форма на силиций, която е търговски жизнеспособна - продукт, който се използва за пречистване на технически силиций чрез хлоридни и флуоридни методи и е печеливш за производството на моно- и мултикристален силиций.
Традиционно, поликристалният силиций се отстранява от технически силиций с път на прехвърляне на йога в кранове от силан (моносилан, хлоросилан, флуоросилан) с обидно дъно от силани, които се утаяват, пречистено пречистване на преобразувания силан и възстановяване на силан до метален силиций .
Проводниците от чист силиций се получават в два вида: поликристален(подсилване на SiCl4 или SiHCl3 с цинк или вода, термично разширение на SiI4 и SiH4) и монокристален(Зонно топене без тигел и "навиване" на монокристал от разтопен силиций - методът на Чохралски).

Тук можете да използвате метода на Чохралски за вибриране на силиций.
Метод на Чохралски- методът на вибриране на кристалите с път на навиване нагоре по хълма във въздуха на повърхността на голямото задължение да се стопи с инициирането на кочана на кристализация с пътя на привеждане на семенния кристал (или голям брой кристали ) с дадена структура и кристалографска ориентация в контакт със свободна повърхностна стопилка.
Използване на силиций
Специално легираният силиций се използва широко като материал за изготвяне на електрически проводници (транзистори, термистори, силови вибратори, тиристори; фотоклетки на Sony, които се използват в космически кораби, както и много всякакви неща).
Парчета от силиконови просории за смяна на дълги косми с размер от 1 до 9 микрона, може да се постави в инфрачервена оптика.
Силицият може да бъде различен и всички области на използване, които се разширяват. В металургията Si
vikoristovuetsya за отстраняване на киселини (дезоксидация) от разтопени метали.
Силиций складголям брой сплави на хола и цветни метали.
Здрави силициеви сплави за повишаване на устойчивостта на корозия, подобряване на тяхната мощност и увеличаване на механичната якост; prote с по-голямо zmistі Силиконът може да viklikati kryhkіst.
Най-важните са сплави, медни и алуминиеви сплави, които могат да се използват за отмъщение за колани.
Силицият се обработва със стъклени, циментови, керамични, електрически и други промишлени галузи.
Почистването на силиций е важно за производството на единични електронни устройства (например процесора на вашия компютър) и едночипови микросхеми.
Чист силиций, използван за чист силиций, пречистване на металургичен силиций, тъй като кристалният силиций е основната суровина за sony energy.
Монокристален силиций - каймакът на електрониката и sony power engineering се използва за направата на огледала на газови лазери.

Почистващ силикон и продукт на йога
Силиций в тялото
Силицият в тялото се намира в очите на различни сполуки, които играят водеща роля в осветяването на твърдите скелетни части и тъкани. Особено богати на силиций могат да натрупват остатъци от морски водорасли (например диатомични водорасли) и същества (например силициево-рогови гъби, радиолария), които по време на океана на дъното на океана са втвърдени от отлагания на силициев оксид (IV). В студените морета и езера по-важни са биогенните мулета, богати на силиций, в тропическите морета - вапинг мулетата с ниско съдържание на силиций. Тревите, остриците, палмовите дървета и хвощовете натрупват много силиций в средата на земните израстъци. В гръбначните същества, вместо силициев (IV) оксид, в пепелните реки 0,1-0,5%. В най-голям брой силициеви прояви в алк щастлив плат, nirkah, pidshlunkovy свод. При допълнителна диета хората имат до 1 g силиций. При висок прием на силициев (IV) оксид във въздуха, той се консумира в легенията на човек, което причинява заболяване - силикоза.
Висновок
Е, от всичко, ако сте прочели до края и сте навлезли малко, значи сте малко по-близо до успеха. Сподивам се, пиша не напразно и се удостоявам с hoch komu. За уважение.
СИЛИКИЙ. (Силиций), Si - хим. елемент IV от групата на периодичната система от елементи; при. н. 14, при. м. 28.086. Кристална силиконова тъмносива реч със смолист блясък. В повечето случаи се разкрива степента на окисление - 4, +2 и +4. Естественият силиций се състои от стабилни изотопи 28Si (92,28%), 29Si (4,67%) и 30Si (3,05%). Оттегляне на радиоактивни изотопи 27Si, 31Si и 32Si с периоди на обратно разпадане 4,5 секунди, 2,62 години и 700 години. за първи път видян през 1811 г. френски. химик и физик Ж. Л. Гей-Люсак и фр. химик L. J. Tenar, но има по-малко идентификации през 1823 г Швед, химик и минералог Й. Я. Берцелиус.
За ширината в земната кора (27,6%), силиций-друг (след киселия) елемент. Знанието е важно. под формата на силициев диоксид Si02 и други кисели речи (силикати, алумосиликати и др.). За най-добрите умове е установена стабилна модификация на салфетка, която има лицево-центрирана кубична структура като диамант, с период a = 5.4307 A. Прекъснатото проникване е 2.35 A. Ширината е 2.328 gcm. С високо налягане (120-150 kbar) отидете на по-големи проводници и метални модификации. Метална модификация-свръхпроводник с температура на преход от 6,7 K. С увеличаване на налягането точката на топене намалява от 1415 ± 3 ° C при налягане от 1 bar до 810 ° C при налягане от 15,104 bar (рядко). ). При стопяване се наблюдава увеличаване на координационното число и метализация на междуатомните връзки. Аморфен силициев характер от порядъка на къси разстояния, който показва силно създадена обемно-центрирана кубична структура, близка до рядката. Дебиевската т-ра е близо до 645 К. Коеф. температурата на линейното разширение се променя с промяна на t-ri по екстремния закон, по-ниска от t-ri 100 To wine става отрицателна, достигайки минимума (-0,77 10 -6) deg -1 при t-ri 80 K; при t-rі 310 K виното е 2,33 10-6 deg-1, а при t-rі 1273 K-4,8 10 deg-1. Топлина на топене 11,9 kcal/g-atom; tkíp.3520 K.
Топлината на сублимация и изпарение при температура на топене е 110 и 98,1 kcal/g-atom. Топлинната проводимост и електрическата проводимост на силиция се крият в чистотата и пълнотата на кристалите. Zі rostannyam t-ri coef. топлопроводимостта на чист К. постепенно се увеличава (до 8,4 cal / cm X X sec deg при t-ri 35 K), след което се променя, достигайки 0,36 и 0,06 cal / cm sec deg при t-ri vídpovidno 300 и 1200 K. Енталпия, ентропия и топлинен капацитет К. в стандартните умове той е равен на 770 кал/g-атом, 4,51 и 4,83 кал/g-атом - град. Силициев диамагнетик, магнитна чувствителност на твърдо вещество (-1,1 10 -7 mu/g) и рядък (-0,8 10 -7 mu/g). Силицият е слабо отложен в т-ри. Повърхностната енергия, дебелината и кинематичният вискозитет на редки К. при температура на топене стават 737 erg/cm2, 2,55 g/cm3 и 3 10 m2/sec. Типичен кристален силициев проводник с ширина на оградената зона от 1,15 ev при t-p 0 до 1,08 u - при t-p 300 K. При стайна температура концентрацията на мокри заряди е близо до 1,4 10 10 cm - 3;
Силата на силиция да пада се дължи на природата и концентрацията на къщите, както и на съвършенството на кристала. Пръстен за otrimannya napіvprovіdnikovogo Do. с провеждането на r- и n-тип йога, те се комбинират с елементи IIIb (бор, алуминий, галий) и Vb (фосфор, мишяк, антимон, бисмут) подгрупа, които създават sukupnіst vіdpovіdno към акцептор и донор rіvnі в , roztashovannyh в близост до кордоните на зони. За легирането на використ тези други елементи (например) са оформени така. glybokí rivní, yakí obumovlyuyut погребване и рекомбинация на nosesіїv такси. Tse ви позволява да вземете материали с високо електро. опора (1010 ohm cm при t-rі 80 K) тази малка тривалност на основата на незначителни такси за износване, което е важно за увеличаването на броя на различните стопански постройки. Коефициент термоелектрическа енергия със силиций е просто да се депозира в t-ri и на мястото на къщата, zbílshyuyuchi zі zrostannym elektroopor (при p = 0,6 ohm - cm, a = 103 микроволта / градушка). Диелектричното проникване на силиция (от 11 до 15) е слабо отложено в склада и пълнотата на монокристалите. Законите на оптичното глиниране на силиция се променят значително поради промяната в чистотата, концентрацията и естеството на дефектите в живота, както и дълголетието.
Кордонът на индиректното глиниране на електромагнитен коливан е близо 1,09 евро, директното глинене - до 3,3 евро. Във видимата област на спектъра на параметрите на комплексния индикатор за счупване (n - ik) вече е възможно да лежи на повърхността на къщата. За особено чист Do. (приλ \u003d 5461 A и t-re 293 K) n \u003d 4,056 и k \u003d 0,028. Роботизираната продукция на електрониката е близо 48 евро. Силиконова тенденция. Yogo твърдост (t-ra 300 K) за Moos - 7; HB = 240; HV y \u003d 103; I = 1250 kgf/mm2; модул на нормите, еластичност (поликристал) 10890 kgf / mm2. Между минералите да лежат в дълбочината на кристала: на вигината дълбочината е от 7 до 14; коеф. Коравина 0,325 1066 cm2/kg.
При стайна температура силицийът практически не взаимодейства с газоподобни (включително) и твърди реагенти, krím lív. При движение на т-ри има активно взаимодействие с метали и неметали. Zocrema, който разтваря SiC карбид (при температура 1600 K), Si3N4 нитрид (при температура 1300 K), фосфид SiP (при температура 1200 K) и арсенид Si As, SiAS2 (при температура 1000 K). С кисела реакция при температура 700 K, охлаждане на Si02 диоксид, с халогени - SiF4 флуорид (при температура над 300 K), SiCl4 хлорид (при температура над 500 K), SiBr4 бромид (при температура от 700 К) във възел SiI4 (при т.т. 1000). Интензивно реагира с много други. метали, установявайки солидни разлики в заместването им с хихим. на половината - силициди. Концентрационните зони на хомогенност на масивните рози възникват в зависимост от естеството на розетката (например Nimechchin от 0 до 100%, през есента до 15%, в алфа цирконий по-малко от 0,1%).
Разликата между металите и неметалите в твърдия силиций е значително по-малка и звучи ретроградно. С какви граници, вместо къща, какво се прави на До. не много дълбоко, достигнете максимума ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 cm) площ т-рот 1400 до 1600 К. Къщи с дълбоки нива се отдръпват малко по-малки rozchinnіstyu (от 1015 за селен и 5 10 16 за zalіza до 7 10 17 за никел и 10 18 cm-3 за midi). При рядка стомана, силицийът не е заобиколен от обикновени метали, често със страхотни визии на топлина. Чистият силиций се получава от технически продукт 99% Si і - 0,03% Fe, Al і Co), закален с кварц и въглища в електрически пещи. Започнете с нов дъх до там (sum_shy солна и sirchanoy, а след това флуорид-вода и sirchanoy) къщи, след което продуктът (99,98%) се отнема, третира се с хлор. Синтезите се пречистват чрез дестилация.
Силициевият проводник се използва в комбинация с SiCl4 хлорид (или SiHCl3) във вода или термично разширение на SiH4 хидрид. Остатъчното пречистване и смилане на монокристали се извършва с гладък метод без тигелна зона или по метода на Чохралски, като се вземе предвид особено чистият сос (в къщата до 1010-1013 cm-3) cf\u003e 10 3 ohm cm iv при които да въведете дозиране на броя на необходимите къщи. Така се приготвят цилиндрични кремове с диаметър 2-4 и дължина 3-10 см. За спец. Целта е да се произведат още повече монокристали. Технически силиций и особено його сплави от викориозни соли като киселинни стомани и сплави, както и леки добавки. Известно е, че особено чистите zrazki монокристални K., легирани с различни елементи, се използват като основа на различни слаботокови (zocrema, термоелектрически, радио, светлинни и фототехнически) и силнотокови (вибриращи, преобразуващи) приспособления.
Силиций и силиций
Силицият се довежда до неметали и 4 електрона могат да бъдат на едно и също енергийно ниво. Vín може да ги отдава, показвайки етапа на окисление + 4 и добавяйки електрони, показвайки етапа на окисление - 4. Въпреки това способността за добавяне на електрони към силиция е значително по-малка, по-ниска от въглерода. Силициевите атоми могат да имат по-голям радиус, по-ниски въглеродни атоми.
Познанието на природата за силиция .
Силиконова арка от екстеншъни в природата. на нейната част от падащия пон над 26% от масата земна шарка. За ширината на вината седнете на друго място (след киселото). На vіdmіnu vіd vіd uglec C vіlny stіnі vіrіdі не zustrichaetsya. Той влиза в склада на различни химически състави, главно различни модификации на силициев оксид (IV) и соли на силициеви киселини (силикати).
Мания по силиций .
Промишлен силиций с техническа чистота (95 - 98%) е доминиран от SiO 2 кокс в електрически пещи по време на печене:
SiO 2 + 2C \u003d Si + 2CO
SiO 2 + 2Mg \u003d Si + 2MgO
По този начин от къщите се взема аморфен силициев прах с кафяв цвят. Прекристализацията от топене на метали (Zn, Al) може да се прехвърли в кристална мелница.
Силициев тетрахлорид, дори с висока чистота, се използва при 1000°C за силициев тетрахлорид SiCl 4 чифта цинк:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
че прочистване його след специални методи.
Физически Химическа силасилиций.
Чист кристален силиций - тендитен и твърд, отпуснат наклон. Подобно на диамант, той има кубична кристална решетка с ковалентен тип връзка. Yogo точка на топене 1423 °C. За най-големите умове силициев неактивен елемент, който реагира само с флуор, но при нагряване влиза в различни химични реакции.
Yogo vikoristovuyut като ценен материал за napіvprovіdnikovіy tehnіtsі. В комбинация с други проводници на вино, той се отличава със значителна устойчивост срещу разредени киселини и голяма електрическа устойчивост до 300 ° C. Техническият силиций и феросилиций се използват и в металургията за топлоустойчиви, киселинноустойчиви и инструментални стомани, чавуни и други богати сплави.
Със силициеви метали химии, Наречени силициди, при нагряване с магнезий, магнезиевият силицид се разтваря:
Si + 2Mg = Mg 2 Si
Силицидите на металите зад структурата на това господство предсказват карбиди, така че металоподобните силициди, точно като металоподобните карбиди, се отличават с голяма твърдост, висока точка на топене, гореща електрическа проводимост.
При пържене на сумиш писку с кокс в електрически пещи, силициевият карбид и въглеродът се смесват със силициев карбид или карборунд:
SiO2 + 3C = SiC + 2CO
Карборундът е огнеупорна твърда реч без пръти, ценен абразивен и топлинен материал. Карборунд, както и, има атомно кристално безплатно. На чистата станция има изолатор, но при наличието на къщата, той става проводник.
Силициев як i , разтваря два оксида: силициев оксид (II) SiO и силициев оксид (IV) SiO 2 . Силициевият оксид (IV) е твърд огнеупорен материал, широко разпространен в природата в свободната страна. Това е химически стабилна реч, която взаимодейства само с флуор и газоподобен флуор във вода или флуороводородна киселина:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Посочването директно към реакциите се обяснява с факта, че силицият може да има голяма споридност към флуора. В допълнение, силициевият тетрафлуорид е летяща реч.
В tehnіtsі prozoriya SiO 2 vykorovuyut за приготвяне на стабилна огнеупорна кварцова плоча, тъй като любезно пропуска ултравиолетовата промяна, може да има голям коефициент на разширение, което показва значителните промени в температурата. Аморфната модификация на силициев оксид (II) tripoli има голяма порьозност. Yogo vikoristovuyut като топло- и звукоизолатор за вибриращ динамит (нос vibukhovo реч) и така нататък. Силициевият (IV) оксид във вибриращ звук е един от основните ежедневни материали. Той е жизненоспособен при производството на огнеустойчиви и киселинноустойчиви материали, стомана, като флюс в металургията и др.
Според молекулните формули химичната и физическата мощност на въглеродния оксид (IV) и силициевия оксид (IV) е лесна за съпоставяне, мощността им е сходна в химически складз'еднан разни. Защо се обяснява, че силициевият оксид (IV) се образува не само от SiO молекули 2 , като например техните сътрудници, в някои от тях атомите на силиция са свързани заедно с атомите на киселия. Силициев (IV) оксид (SiO 2 )н. Изображението й на площада:
Друг представител на елементите на главната подгрупа на IV група (IVA група) на периодичната система на D.I. Менделиев - силиций Si.
В природата силицият е друг химичен елемент за ширината на киселината. Земната кора е все по-четвъртно нагъната от yogo spoluk. Най-разпространеният силиций е силициевият оксид (IV) SiO 2, другото име е силициев диоксид. В природата вината се правят с минерала кварц (малък 158), богато разнообразие от такива - гирски кристал, а също и известната люлякова форма - аметист, както и ахат, опал, яспис, халцедон, карнеол, под формата на виробни и опияняващи камъни. Силициевият (IV) оксид също се състои от забележителен и кварцов пясък.

мал. 158.
Кварцови кристали, разпръснати в доломит
Три различни минерала на базата на силициев оксид (IV) (кремък, халцедон и други) първи хораприготвена znaryaddya pracі. Същият кремък, който е незабележим и не по-тесен от камък, полагайки кочана на камък vіtsі - vіtsі kremіnyh znaryad pratsі (фиг. 159). Има две причини за това: широчината и наличието на кремък, както и изграждането на сгради с колко остри са ръбовете.

мал. 159.
Znaryaddya камък víku
Друг вид естествен материал за силиция е силикатът. Сред тях са най-големите ширини на алумосиликатите (разбра се, че тези силикати могат да заменят алуминиевия химически елемент). Гранитът се добавя към алумосиликатите, виж различниглина, слюда. Силикат, който не отмъщава на алуминия, например азбест, който се използва за производство на фойерверки.
Силициевият оксид (IV) SiO 2 е необходим за живота на производителите и животните. Вината дават стъблата на roslin и zahisnymi воали на същества (фиг. 160). Zavdyaki yomu опашки, опашки и хвощ стоят mitzno, като bagnets, gostre листни острици, нарязани, като ножове, стърнища на наклонено поле, като глава, и стъбла от зърнени култури на пода на mitzna, които не позволяват царевични ниви в нивите да легна в дъска и вятър . Luska ребро, черупки от кома, крил meteliks, pir'ya ptahiv и вълна от същества на mіtsnі, oskílki smite силициев диоксид.

мал. 160.
Силициевият (IV) оксид придава минералност на стъблата на розлина и на задушаващите извивки на създанията
Z'ednannya силиций придава гладкост и мекота на косата и ноктите на човек.
Силицият да влезе и в склада на по-низшите живи организми - диатомеи и радиоларии, най-долните гърди на живата материя, сякаш създавайки своите несъвършенства зад красотата на скелета със силициев диоксид (фиг. 161).
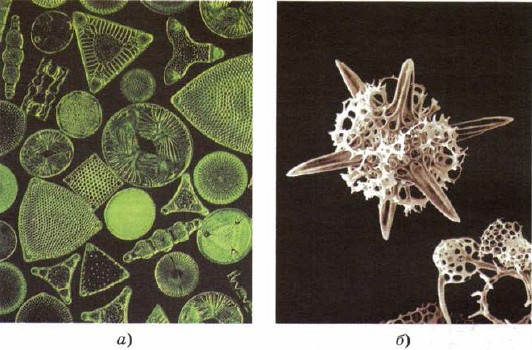
мал. 161.
Скелетите на диатомеите (a) и радиоларите (b) са съставени от силициев диоксид
Доминирането на силиций. Използвате микрокалкулатор с батерия sony и затова има бележка за кристален силиций. Tse napіvprovіdnik. На vіdmіnu vіd metalіv, іz pіdvishennyam температура yogo elektroprovіdnіst zbіshuêtsya. На сателити, космически кораби, станции и dahah budinkiv (малък 162) те инсталират батерии на sony, които преобразуват енергията на sony в електричество. Вонята работи кристали на napіvprovіdnikіv, и при първия черен кремък. Силиконовите фотоклетки могат да се преобразуват в електричество до 10% от глинената енергия на Sony.

мал. 162.
Sleepy батерия за кабина dahu
Силиций за изгаряне при киселинност, задоволявайки ви със силициев оксид (IV):
![]()
Като неметал, при нагряване силицият се слива с метали със силицидни разтвори, например:
![]()
Силицидите се разнасят лесно с вода или киселини, когато видите подобен на вода силиций - силан:
На повърхността на въглехидратите силанът на повърхността се самозацепва и изгаря с разтворен силициев оксид (IV) и вода:
Повишената реакция между силан и метан CH 4 се обяснява с факта, че разширяването на силициевия атом е по-голямо, по-ниско при въглерода, така че химическите връзки Si-H са по-малки, C-H връзките са по-ниски.
Взаимодействието на силиция с концентрирана промяна на водата на ливадите, което прави силикат и вода:
Силицият се притежава, подобно на силициевия оксид (IV) магнезий или въглерод:
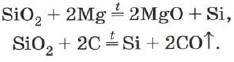
Силициев оксид (IV), или силициев диоксид, или силициев диоксид SiO 2 yak и CO 2 е киселинен оксид. На повърхността на CO2 обаче има молекулярна, но атомна кристална решетка. За това SiO 2 е твърда и огнеупорна реч. Вината не се различават във водни киселини, флуороводородна сметана и алое при високи температури с ливади с разтворени соли на силициева киселина - силикати:
Силициевият диоксид може също да се използва за легиране на силициев оксид (IV) с метални оксиди или карбонати:
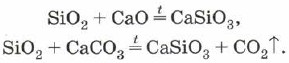
Натриевите силикати и калиевите силикати се наричат плочи за продажба на дребно. їх водоснабдяване- Добре е да използвате силикатно лепило.
Силициева киселина H 2 SiO 3 (фиг. 163):
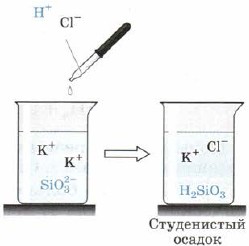
мал. 163. Киселинна реакция към силикат-йон
Освен това H2SiO3 също е слаба киселина. Непостоянен е във водата и пада от реакционния смут при гледане на утайката от обсадата, която понякога компресира целия обем на разликата, превръщайки я в твърда маса, отивам към желето, желето. При окачване на маси се установява силно пореста реч - силикагел, който се използва широко като адсорбент - глина на други речи.
Лабораторен сертификат №40
Притежаването на силициева киселина и това доказване на властта
Силициева инжекция. Вече знаете, че силицийът се използва за производството на проводими материали, както и за киселинноустойчиви сплави. Когато кварцовият пясък се слее с вълна при високи температури, силициевият карбид SiC се разтваря, който е достъпен само за диаманта. Ето защо е необходимо да се vicorate за заточване rіztsіv metalorízalnyh verstatіv і полиране на скъп камък.
От разтопен кварц се приготвят различни химически кварцови съдове, които издържат на високи температури и не се напукват при студено.
Z'ednannya силиций е основата за изкривяване на склада към цимент.
Zvichayne грешка може да бъде склад, която може да бъде изразена с формулата Na 2 O CaO 6SiO 2. Йогото се пече на специални пещи с топени сумиш сода, вапняк и писка.
Vіdmіnna ориз skla - zdatnіst rozm'yakshuvatisya и в разтопената стомана набъбва дали е форма, тъй като се запазва, когато складът е уловен. На базата на които се изработват съдовете и другите изделия.
Dodatkovі yakosti sklu дават различни добавки. И така, въвеждането на оловен оксид се намалява до кристално чист цвят, хромовият оксид става зелен, кобалтовият оксид е син и т.н. (фиг. 164).

мал. 164.
Продукти от цветен склад
Sklo е един от най-старите винопроизводители на народа. Вече 3-4 тис. Поради тази причина войната избухна в Египет, Сирия, Финики и Черно море.
Sklo - същият материал е не по-малко от remіsnikіv, но и художници. Майсторът достигна най-високото ниво на съвършенство Древен Рим, сякаш са успели да отнемат цветния наклон и работата на своите мозайки.

мал. 165.
Цветно стъкло на витражите на катедралата Нотр Дам, Шартр
Създаване на произведения на изкуството от склада с obov'yazkovymi атрибути на голям музей, и цветни витражи на църквата, мозаечни панели - ярки задници на това (фиг. 165). В едно от помещенията на петербургския клон на Руската академия на науките има мозаечен портрет на Петър I, победител М. В. Ломоносов (фиг. 166).

мал. 166.
Мозаечен портрет на Петър I
Зоните на задръстванията са доста големи. Tse vikonne, plyashkove, lampov, dzerkalne sklo; оптичен наклон - от окуляри до стъкла на камера; лещи на неразличими оптични устройства - от микроскопи до телескопи.
Вторият по важност материал, покритията на базата на силиций, е циментът. Його се използва за изпичане на глина и вейп в специални пещи, които се опаковат.
Ако прахът от цимент се смеси с вода, тогава циментът не е здраво установен, в противен случай, както се нарича будилник, циментът се разгражда, което е стъпка по стъпка по-трудно. Когато добавяте бетон към цимент или натрошен камък, бетонът трябва да се отстрани като горно покритие. Материалността на бетона нараства, така че в новия се вкарва нова рамка - излиза отлятият бетон, от който са направени стените на панела, блокове от припокривания, ферми мостове и др.
Складът се занимава с производство на цимент силикатна индустрия. Вон произвежда и силикатна керамика - цеглу, порцелан (малък 167), фаянс и изделия от тях.

мал. 167.
Порцеланови сортове
Открит силиций. Въпреки че в древни времена хората са били широко печеливши в използването на силиций, самият силиций е бил отнет за първи път през 1824 г. от шведския химик Й. Я. Берцелиус. Въпреки това, 12 години преди новия кремък, J. Gay-Lussac и L. Tenard бяха отнети, ale vin duzhe zabrudneniy къщи.
Латинското наименование silicum произлиза от латинската дума silex-кремък. Руското наименование "силиций" наподобява ореховия кремнос - "скел, скел".
Нови думи, които разбират
- Естествени източници на силиций: силициев диоксид, кварц и други разновидности, силициев диоксид, алумосиликат, азбест.
- Биологично значение на силиция.
- Доминирането на силиций: napіvprovіdnikovі, взаимодействие с кисело, метали, ливади.
- Силан.
- Силициев (IV) оксид. Йога Будова и сила: взаимодействие с ливади, основни оксиди, карбонати и магнезий.
- Силициева киселина и нейните соли. Розчинне сло.
- Zastosuvannya силиций и yogo половина.
- Sklo.
- Цимент.
име на деня
Най-често в природата силицият се среща във вид на силициев диоксид - основа на базата на силициев диоксид (IV) SiO 2 (около 12% от земната морбилна маса). Основните минерали и скали, които се охлаждат от силициев диоксид, са верига (богат и кварц), кварц и кварцит, кремък, polov_spar. Силициевият диоксид и алумосиликатът са сгънати в друг за ширината в природата.
Отбелязва се един по един фактът за значението на чистия силиций в естествения му вид.
Отриманя
Силиконът ще излезе при пържене на хрупкава бяла писку (силициев диоксид) с магнезий:
S i O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \rightarrow \ 2MgO+Si)))На какво се установявате аморфен силиций , какво може да изглежда като кафяв прах.
В промишлеността техническата чистота на силиция се получава чрез топене на SiO 2 с кокс при температура около 1800 ° C в рудно-термични пещи от шахтов тип. Чистотата на силиция, отстранена от такъв клас, може да достигне 99,9% (основните къщи са въглища, метал).
Можете да се отдалечите от пречистването на силиций от къщите.
- Пречистването в лабораторни тоалетни може да се извърши чрез път на предно притежание на магнезиев силицид Mg 2 Si. Дадохме магнезиев силицид за допълнителна солна или октова киселина за отстраняване на газоподобния моносилан SiH 4 . Монозиланът се пречиства чрез ректификация, сорбция и други методи и след това се поставя върху силиций и вода при температура около 1000 °C.
- Пречистването на силиций в промишлен мащаб се извършва по пътя на немеждинно хлориране на силиций. С това се разтварят половинките на склада SiCl 4, SiHCl 3 и SiH 2 Cl 2. їх по различен начинпочистете къщата (като правило чрез дестилация и диспропорциониране) и на последния етап добавете чиста вода при температури от 900 до 1100 °C.
- Разработват се по-евтини, по-чисти и по-ефективни индустриални технологии за пречистване на силиций. За 2010г преди тях е възможно да се въведат технологии за пречистване на силиций с заместващ флуор (заместващ хлора); технологии, които прехвърлят дестилация до силициев моноксид; технологии, базирани на витражи, които се фокусират върху междукристалните граници.
Vmіst domіshok при финализирания силиций може да бъде намален до 10 -8 -10 -6% на маса. Повече доклади за храненето на чистия силиций са разгледани в статията Поликристален силиций.
Методът за получаване на силиций в чиста форма на фрагментация от Микола, Миколайович Бекетов.
Физическа сила
Силициевата кристална решетка е кубична лицево центрирана като диамант, параметър a = 0,54307 nm (при високо менгемепремахване на други полиморфни модификации на силиций), но чрез по-голяма връзка между Si-Si атоми във връзка с връзка зв'азку С-Ствърдостта на силиция е значително по-малка от тази на диаманта. Силициевият пукащ, само когато се нагрява при 800 ° C, става пластмасова реч. Vín prozory за инфрачервено випроминюване с дожини khvili 1,1 микрона. Мократа концентрация на носа в заряда е 5,81 10 15 m-3 (за температура 300 K).
Електрофизична мощност
Елементарният силиций в монокристална форма е проводник с индиректна междина. Ширината на оградената площ при стайна температурасъхранение 1,12 eV, а при T \u003d 0 K - 1,21 eV. Концентрацията на мокри носители на заряд в силиций за нормални умове става близка до 1,5·10 10 cm −3.
Въз основа на електротрофната сила на кристалния силиций голям приток изгражда къщи, които бродят в тъмното. За да извлечете силициеви кристали с дълбока проводимост, въведете атоми на елементи от група III в силиций, като бор, алуминий, галий и индий. За да извлечете кристали от силиций с електронна проводимост към силиций, въведете атоми елементи V-ї groupi, като фосфор, миш'як, сурма.
Когато електронните устройства се сглобяват на базата на силиций, е важно повърхностната топка да се прикрепи към материала (до десетки микрони), така че качеството на повърхността на кристала може да се добави към електростатичната мощност на силиция и, очевидно, върху мощността на готовия инструмент. В хода на сглобяването на определени устройства се добавя викорус, приложен към модификацията на повърхността, например, повърхността е покрита със силиций с различни химически агенти и я опровергава.
Химическа сила
Подобно на въглеродните атоми, силициевите атоми се характеризират с sp 3 -хибридизация на орбиталите. Във връзка с хибридизацията чистият кристален силиций прави диамантени зърна, в които силицийът е хотливалентен. В същото време силициевият звук се проявява и като хотливалентен елемент със степен на окисление +4 или -4. Zustrichayutsya двувалентен половин силиций, например, силициев оксид (II) - SiO.
За нормалните умове силицият е химически неактивен и реагира активно само с газоподобен флуор, с който се разтваря летливият силициев тетрафлуорид SiF4. Такава „неактивност“ на силиция се дължи на пасивирането на повърхността на наноразмерната топка от силициев диоксид, който се утаява отрицателно в присъствието на кисела, отново и отново вода (водна пара).
подкисляване с разтворен SiO 2 диоксид, процесът е придружен от увеличаване на обема на диоксидната топка на повърхността, стабилността на процеса на окисление е ограничена от дифузията на атомна киселина и криоконсервиращ диоксид.
При нагряване до температура над 400-500 ° C силицият реагира с хлор, бром и йод - с приемането на лесно летливи тетрахалогениди SiHal 4 и, вероятно, халогениди в сгънат склад.
С вода силиций без среда не реагира, но с вода силиций - силани с формула Si n H 2n + 2 - притежават индиректен път. Монозилан SiH 4 (yogo често се нарича просто силан) се наблюдава при взаимодействието на метални силициди с киселини, например:
C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \rightarrow \ 2CaCl_(2)+SiH_(4)\ ) стрелка нагоре)))SiH 4 силан, който се разтваря в тази реакция, отмъщава на къщи и други силани, zokrem, Si 2 H 6 дисилан и Si 3 H 8 трисилан, в някои ланцети за силициеви атоми, свързани заедно с единични връзки (- Si -Si-Si- ) .
Силицият реагира с азот и бор при температури близки до 1000 °C, разтваряйки нитрид Si 3 N 4 и термично и химически стабилен борид SiB 3 , SiB 6 и SiB 12 .
При температури над 1000 ° C е възможно да се използва силиций, който е най-близкият аналог на периодичната таблица - въглерод - силициев карбид SiC (карборунд), който се характеризира с висока твърдост и ниска химическа активност. Карборундът се използва широко като абразивен материал. При това обаче топенето на силиций (1415 °C) може да се свърже в продължение на три часа с въглища с оглед на големите парчета синтерован финозърнест графит от изостатично пресоване, практически не се променя и не пречи на останалите.
Нисшите елементи от 4-та група (Ge, Sn, Pb) са без покритие от силиций, както и повечето други метали. При нагряване със силиций и метали могат да се образуват техните полуобвивки, силициди. Силицидите могат да се подразделят на две групи: йонно-ковалентни (силициди на локва, локва-земни метали и магнезий тип Ca 2 Si, Mg 2 Si и в) и металоподобни (силициди на преходни метали). Силицидите на активните метали се поставят при разреждане на киселини; Металоподобните силициди имат висока точка на топене (до 2000 °C). Най-често се използват металоподобни силицидни складове азси, аз 3Si2, аз 2 Si 3, аз 5 Si 3 i аз Si 2. Металоподобните силициди са химически инертни, устойчиви на вкисване при високи температури.
Особено важно е да се отбележи, че силиконът запечатва евтектичния сбор, което позволява залепването (сливането) на материали за запечатване на феросиликонова керамика при температури, които са значително по-ниски, по-ниски от температурата на топене на уплътнението и силиция.
При добавяне на SiO 2 към силиций при температури над 1200 ° C, силициевият оксид (II) - SiO се разтваря. Този процес непрекъснато се поддържа от производството на кристали по силициев метод
Силиконът в челните редици на визиите през 1811 г. J.Gay-Lussac и L.Tenar при преминаване на пари от силициев флуорид върху метален калий, протеините не се описват от тях като елемент. Шведският химик Я. Берцелиус през 1823г като дава описание на отстранения от него силиций по време на обработката на калиева сол K 2 SiF 6 с метален калий при висока температура. Новият елемент е наречен "силиций" (лат. silex - кремък). Руското наименование "силиций" е въведено през 1834 г. от руския химик Херман Иванович Хес. При превода на други гръцки. krhmnoz- Кут, планина.
Познание в природата, otrimannya:
В природата силицият се намира във вибриращ диоксид и силикати в различен склад. Естественият силициев диоксид е по-важен под формата на кварц, който иска да използва други минерали - кристобалит, тридимит, кит, кузит. Аморфният силициев диоксид се натрупва в отлагания на диатомеи на дъното на моретата и океаните - тези отлагания се утаяват със SiO 2, влизайки в склада на диатомеи и други реснички.
Силиконът Vilniy може да се използва за печене с магнезиева хрупкава бяла писку, която за химически склад може да се почисти със силициев оксид SiO 2 + 2Mg = 2MgO + Si. В промишлеността техническата чистота на силиция се получава чрез топене на SiO 2 с кокс при температура около 1800 ° C в дъгови пещи. Чистотата на силиция, получена от такъв ранг, може да достигне 99,9% (основните къщи са въглища, метал).
Физически сили:
Аморфният силиций може да изглежда като кафяв прах, чиято дебелина е по-плътна от 2,0 g / cm 3. Кристален силиций - тъмносив, блестящ кристален говор, кристализиран и твърд, кристализира в диаманти. Това е типичен проводник (по-добре е да провеждате електричество, по-нисък изолатор тип гума и по-висок за проводник - среден). Силициевият пукащ, само когато се нагрява при 800 ° C, става пластмасова реч. Cіkavo, scho силициев прозорий до infrachervony viprominyuvannya, започвайки с дълъг вятър 1,1 микрона.
Химическа сила:
Химически силиций слабо активен. При стайна температура реагира само с газоподобен флуор, летливият силициев тетрафлуорид SiF 4 се разтваря при тази температура. При нагряване до температура от 400-500 ° C силицият реагира с киселина с разтворен диоксид, с хлор, бром и йод - с разтворени лесно летливи тетрахалогениди SiHal 4 . При температури, близки до 1000 ° C, силицийът реагира с азот, за да разтвори нитрид Si 3 N 4 с бор - термично и химически стабилен борид SiB 3, SiB 6 и SiB 12. С вода силицият не реагира без посредник.
За ецване със силиций най-широко се използва сборът от флуороводородна и азотна киселина.
Настроен към ливадите.
Силицият се характеризира със степен на окисление от +4 или -4.
Най-важните полета:
Силициев диоксид, SiO2- (силициев анхидрид) ...
...
Силициеви киселини- слаб, неясен, utvoryuyuyutsya при добавяне на киселина към размера на силиката изглежда като гел (желатиноподобна реч). Известно е, че H 4 SiO 4 (орто-силиций) и H 2 SiO 3 (мета-силиций или силиций) варират и безвъзвратно се превръщат в SiO 2 при нагряване и изсушаване. Твърд порест продукт за въвеждане - силициев гелможе да се отвори на повърхността и да се използва като адсорбент на газове, изсушаващ агент, катализатор и катализатор на износване.
силикат- добрите соли на силициевите киселини (натриеви и калиеви силикати) не са разтворими във вода. мощност.
Водопади- аналози на въглехидрати, силани, полусърдечно, в някои атоми на силиций с единична връзка, сила yakscho атом силиций z'єdnаní podvіyny zv'yazkom. Копията и килцата се използват подобно на въглехидратите. Всички сили могат да бъдат самонаети, да създават вибрации на сумиш с повторение и лесно да реагират с вода.
Застосуване:
Най-значителното количество силиций е известно за избора на сплави за прилагане на алуминий, мед и магнезий, както и за избора на феросилициди, които могат да бъдат важни за избора на стомани и отоплително оборудване. Силициеви кристали zastosovuyut батерии на sonyи napіvprovіdnikovih стопански постройки - транзистори и диоди. Силицият също така служи като суровина за производството на органосилициеви плочи или силоксани, оцветени с масло, масло, пластмаси и синтетични каучуци. Неорганични охлювисилициевият використ се използва в технологията на керамиката и стоманата, като изолационен материал и п'езокристали
За някои организми силицият е важен биогенен елемент. Влезте в склада на поддържащите колиби при Рослин и скелетни - при съществата. Морските организми – диатомеи, водорасли, радиолария, гъби – са концентрирани в големи площи от силиций. Страхотни цифрихвощ и зърнени концентрат със силиций, в първия черен - бамбук и оризовидни пидродини, сред тях - засаждане на ориз. Мязова тъкан на човек за отмъщение (1-2) 10 -2% силиций, костна тъкан - 17 10 -4%, кръв - 3,9 mg / l. Въпреки това днес в тялото на човек може да попадне до 1 g силиций.
Антонов С.М., Томилин К.Г.
HF Тюменски държавен университет, 571 група.
