Генетични серии от неметални примери. Генетична връзка между класовете вещества - Хипермаркет на знанието
Съществува генетична връзка между простите вещества, оксиди, основи, киселини и соли, а именно възможността за взаимния им преход (трансформация).
Например, простото вещество - калций в резултат на взаимодействието с кислорода се превръща в оксид: 2Ca + O 2 = 2CaO.
Калциев оксид при взаимодействие с вода образува калциев хидроксид CaO + H 2 O = Ca (OH) 2, а последният, когато взаимодейства с киселина, се превръща в сол: Ca (OH) 2 + H2SO4 = CaSO4 + 2H2O.
Тези трансформации могат да бъдат представени чрез схемата:
Ca → CaO → Ca (OH) 2 → CaSO 4
Подобна схема може да бъде написана за неметални, например, сяра:
S → SO 3 → H 2 SO 4 → CaSO 4
Така че същата сол се получава по различни начини.
Възможен е обратен преход от сол към други класове неорганични съединения и прости вещества:
CuSO4 → Cu (OH) 2 → CuO → Cu
CuS04 + 2NaOH = Cu (OH) 2 + Na2S04
Си (ОН) 2 = CuO + H20
CuO + H 2 = Cu + H 2 O (редукция на мед)
Подобна връзка между класовете неорганични съединения, базирана на производството на вещества от един клас от веществата на друга, се нарича генетична.
Свойствата на комплексните съединения са отразени в генетичната схема на основните класове неорганични съединения (виж фигурата). Той отразява етапите на развитие на неорганични вещества по две основни линии, от типични метали до типични неметали с противоположни свойства.
Метали, чието химично свойство на атома е способността да се даряват електрони и неметали, основното химическо свойство на което е способността на техните атоми да прикрепят електрони, противоположни един на друг в свойствата. С усложнението на състава на веществата тези противоположни тенденции продължават да се появяват.
Типичните метали и преходни елементи в най-ниско окислително състояние образуват основните оксиди, а типичните неметали и преходни елементи във високото състояние на окисление образуват в свойствата си различни киселинни оксиди.
Обикновено вещества
амфотерни
Неметали
Основни оксиди
амфотерни
киселинна
основание
амфотерни
хидроксиди
Генетична схема на основните класове неорганични съединения
С по-нататъшното усложняване на състава на веществата се образуват хидроксиди, основните оксиди, съответстващи на основата, и киселинните оксиди, съответстващи на киселината. Противоположните основи на свойствата и киселините активно реагират помежду си, образувайки соли. Взаимодействието на противоположностите е движещата сила на реакцията. Следователно, основните и кисели оксиди, основи и киселини активно взаимодействат помежду си и два киселинни оксида или два основни оксида не взаимодействат, тъй като техните свойства са близки.
По този начин свойствата на комплексното съединение се определят въз основа на свойствата на съставните му елементи. Основните модели на промяна на тези свойства са обобщени в следните приложения (Таблица 6).
1. В периоди с увеличаване на серийния номер свойствата на елементите се променят от метален към неметален. Увеличава се броят на електроните на външното ниво, нараства степента на окисление на елемента, намалява радиусът на атома и йона, увеличава се йонизационната енергия и афинитета за електрона. В съответствие с това основното намаляване и киселинните свойства на оксидите и хидроксидите нарастват.
2. В основните подгрупи, с увеличаване на атомния номер на елемента, се увеличават основните свойства на оксидите и хидроксидите. За елементите на страничните групи с увеличаване на поредния номер е характерна по-сложна промяна в свойствата. Първо, металните свойства се повишават и след това намаляват.
3. Активните метали отговарят на оксиди и хидроксиди със силно изразени основни свойства. Най-активните метали са алкалните и алкалоземните. Те образуват водоразтворими оксиди и силно разтворими основи - алкали.
4. Нискоактивните метали (всички, освен алкални и алкалоземни) образуват слаби основи, които трудно се разтварят във вода:
Cu (OH) 2, Fe (OH) 3.
5. Оксидите и хидроксидите със силно изразени киселинни свойства съответстват на активни неметали.
6. Амфотерни метали образуват амфотерни оксиди и хидроксиди.
7. Ако елементът проявява различна степен на окисление, тогава оксиди и хидроксиди с различни свойства съответстват на него.
Тема: ГЕНЕТИЧНА СВЪРЗВАНЕ МЕЖДУ метали и неметали и техните съединения. 9 клас
Цели: образователна: да се консолидира концепцията за "генетична серия", "генетична връзка"; да се научат да правят генетични поредици от елементи (метали и неметали), да съставят уравненията на реакцията, съответстващи на генетичните серии; проверете как се усвояват знания химични свойства оксиди, киселини, соли, основи, разработване: развиване на способността да се анализират, сравняват, обобщават и правят изводи, съставляват уравненията на химичните реакции; образователна: да насърчава формирането на научен мироглед.
Предоставяне на занятия: таблици "Периодична система", "Таблица на разтворимостта", "Серия от метална дейност", инструкции за учениците, задачи за тестване на знания.
Напредък: 1) Org. момента
2) Проверете d / s
3) Проучване на нов материал
4) Закрепване
5) D / C
1) Org. момента. Добре дошли.
2) Проверете d / s.
Генетичните връзки са връзки между различните класове въз основа на техните взаимни обръщения.
Познавайки класовете неорганични вещества, е възможно да се съставят генетичните серии на метали и неметали. В основата на тези серии е същият елемент.
Сред металите има два вида редове:
1
, Генетична серия, в която алкалът действа като база. Тази серия може да бъде представена чрез следните трансформации:метал → основен оксид → алкали → сол
Например, K → K
2 O → KOH → KCl2
, Генетичната серия, където основата е неразтворима база, след това серията може да бъде представена като верига от трансформации:метал → основен оксид → сол → неразтворима база →
→основен оксид → метал
Например, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
, Генетичната серия от неметали, където разтворимата киселина действа като връзка в серията. Веригата от трансформации може да бъде представена, както следва:неметални → киселинен оксид → разтворима киселина → сол
Например P → P
2 О 5 → H 3 PO 4 → Na 3 PO 42
, Генетичната серия от неметали, при които неразтворимата киселина действа като връзка в серията:неметални → киселинен оксид → сол → киселина →
→киселинен оксид → неметални
Например
си→ SiO 2 → Na 2 SiO 3 → Н 2 SiO 3 → SiO 2 → си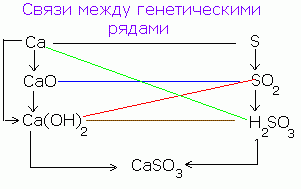
Фронтален разговор на:
Какво е генетична връзка? Генетичните връзки са връзки между различните класове, основани на техните взаимни обръщания.
Генетична серия - поредица от вещества - представители на различни класове, които са съединения на един химичен елемент, свързани с взаимни превръщания и отразяващи трансформациите на тези вещества. В основата на тези серии е същият елемент.
Какви типове генетични серии могат да бъдат разграничени Сред металите могат да се разграничат два вида серии:
а) Генетична серия, в която алкалите действат като основа. Тази серия може да бъде представена чрез следните трансформации:
метал → основен оксид → алкали → сол
например, генетичната серия калий K → K
2 O → KOH → KClб) Генетичната серия, където основата е неразтворима база, тогава сериите могат да бъдат представени като верига от трансформации:
метал → основен оксид → сол → неразтворима основа → основен оксид → метал
например: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuСред неметалите е възможно да се разграничат два вида редове:
а) Генетичната серия от неметали, където разтворимата киселина действа като връзка в серията. Веригата от трансформации може да бъде представена както следва: неметална → киселинен оксид → разтворима киселина → сол.
Например: P → P
2 О 5 → H 3 PO 4 → Na 3 PO 4б) Генетичен ред от неметали, където неразтворимата киселина: неметална → киселинен оксид → сол → киселина → киселинен оксид → неметални действа като връзка в серията
Например: Si → SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → SiИзпълнение на задачи за опции:
1. Изберете формулата на оксида във вашата версия, обяснете своя избор, въз основа на познанията за характеристиките на състава на този клас съединения. Обадете им се.
2. В колоната с формулите на версията си намерете киселинните формули и обяснете избора си въз основа на анализа на състава на тези съединения.
3. Определете валенциите на киселинните остатъци в киселинния състав.
4. Изберете солеви формули и ги назовете.
5. Съставете формулите на солите, които могат да се образуват с магнезий и киселини от вашия вариант. Запишете ги, назовете го.
6. В колоната с формулите на версията си намерете основните формули и обяснете избора си въз основа на анализа на състава на тези съединения.
7. В своя вариант изберете формулите на веществата, с които може да реагира разтворът на фосфорната киселина (солна, сярна). Направете подходящи уравнения на реакцията.
9. Сред формулите по ваш избор изберете формули от вещества, които могат да взаимодействат помежду си. Направете подходящи уравнения на реакцията.
10. Направете верига от генетични връзки на неорганични съединения, които ще включват вещество, формулата на която е дадена във вашата версия под номер едно.
Вариант 1
Вариант 2
CaO
HNO
3Fe (OH)
3N
2 ОZn (NO
3 ) 2Cr (OH)
3Н
2 SO 3Н
2 SPbO
LiOH
Ag
3 PO 4P
2 О 5NaOH
ZnO
CO
2ВаСЬ
2HCl
Н
2 CO 3Н
2 SO 4на меден
4Направете генетична линия, като използвате тези вещества, като използвате всички формули. Напишете уравненията на реакциите, с които можете да постигнете тази верига от трансформации:
I вариант: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II опция:Na 2 SO 4, NaOH, Na, Na 2 О 2 , Na 2 О4) Закрепване1.
Al→ Al 2 О 3 → АЮЬ 3 → Al( OH) 3 → Al 2 О 32.
P→ P 2 О 5 → Н 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 О 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Домашна работа:
начертайте постепенен преход от калций към калциев карбонат и изгответе доклад за използването на всяка сол в медицината (използвайки допълнителна литература).

Сред металите могат да се разграничат два вида редове: 1. Генетична серия, в която алкалът действа като основа. Тази серия може да бъде представена чрез следните трансформации: метал - основен оксид - алкално - сол, например генетичната серия на калий К - К 2 О - КОН - КС1.

2. Генетична серия, където неразтворима основа действа като основа, след това серията може да бъде представена като верига от трансформации: метал - основен оксид - сол неразтворима основа - основен оксид - метал. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu генетична серия на мед "\u003e Cu е генетична поредица от мед"\u003e "title =" (! LANG: 2. Генетична серия, където основата е неразтворима база, след това серията може да бъде представена като верига от трансформации: оксид метал - основа - неразтворима сол - основният оксид е метал Cu Cuo - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. Генетична серия, където неразтворима основа действа като основа, след това серията може да бъде представена като верига от трансформации: метал - основен оксид - сол неразтворима основа - основен оксид - метал. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Сред неметалите е възможно да се разграничат два вида редове: 1. Генетичната серия от неметали, където разтворимата киселина действа като връзка в серията. Веригата от трансформации може да бъде представена по следния начин: неметална - киселиноокисна разтворима киселина - -sol. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Фосфорен генетичен обхват

Съществува генетична връзка между класовете неорганични съединения. От прости вещества можете да получите комплекс и обратно. От съединения от един клас можете да получите съединения от друг клас.
Опростената генетична връзка между класовете неорганични съединения може да бъде представена чрез следната схема:
Последователността на такива трансформации за неметали може да бъде представена чрез следната схема: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
За типичните метали можете да направите следната верига от трансформации:
Ba → BaO → Ba (OH) 2 → BaSO 4
За метали, чиито оксиди и хидроксиди са амфотерни (полуметали), могат да се извършат следните трансформации:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
Връзки между класовете:
1. Метали, неметали→ сол.
При директно взаимодействие на метали и неметали се образуват соли на кислород без киселини (халогениди, сулфиди):
2Na + C1 2 = 2NaCl
Тези съединения са стабилни и не се разлагат при нагряване.
2. Основни оксиди, киселинни оксиди→ сол.
СаО + СОг = СаСОз;
Na2O + S03 = Na2S04.
3. Основи, киселини→ сол.
Извършва се чрез реакция на неутрализация:
2NaOH + H2SO4 = Na2S04 + 2H2O,
HE - + H + → H20;
Mg (ОН) 2 + 2HC1 = MgCl2 + 2H2O,
Mg (ОН) 2 + 2Н + → Mg2 + + 2Н20.
4. Метали→ основни оксиди.
Повечето метали взаимодействат с кислорода, за да образуват оксиди:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A1203.
Злато, сребро, платина и други благородни метали не взаимодействат с кислорода, оксидите на такива метали се получават непряко.
5. Неметали→ киселинни оксиди.
Неметалите (с изключение на халогените и благородните газове) взаимодействат с кислорода, образувайки оксиди:
4Р + 5О 2 = 2Р205;
S + O2 = S02.
6. Основни оксиди→ база.
Пряко взаимодействие с вода може да се получи само хидроксиди на алкални и алкалоземни метали (алкали):
Na2O + H20 = 2NaOH;
СаО + Н20 = Са (ОН) 2.
Останалите основания се получават непряко.
7. Киселинни оксиди→ киселина.
Киселинните оксиди реагират с вода, за да образуват съответните киселини:
S03 + H20 = H2SO4;
R2O5 + 3H2O = 2H3P04.
Изключение е SiO 2, който не реагира с водата.
8. Основи, киселинни оксиди→ сол.
Алкалите взаимодействат с кисели оксиди, за да образуват соли:
2NaOH + SO3 = Na2S04 + H20,
2OH - + SO3 = SO4 2- + H20;
Ca (OH) 2 + СО 2 = CaCO 3 ↓ + Н 2 О,
Са2 + + 2ОН - + СОг → СаСОз + Н20.
9. Киселини, основни оксиди→ сол.
Метални оксиди се разтварят в киселини, образувайки соли:
CuO + H2SO4 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na2O + 2HCl = 2NaCl + H20,
Na20 + 2H + = 2Na + + H20.
10. Основания→ основни оксиди.
Неразтворимите основи и LiOH се разлагат при нагряване:
2LiOH = Li2O + H20;
Си (ОН) 2 = CuO + H20.
11. Киселини→ киселинни оксиди.
Нестабилните кислородсъдържащи киселини се разлагат при нагряване (Н 2 SiO 3) и дори без нагряване (Н2СО3, НС1О). В същото време, редица киселини са устойчиви на топлина (H2SO4, H3P04).
H2Si03 = Н20 + Si02;
Н2СО3 = Н20 + СОг.
12. Метални оксиди→ метали.
Някои тежки метални оксиди могат да се разпаднат до метал и кислород:
2HgO = 2Hg + O2.
Също така, металите се получават от съответните оксиди с помощта на редуциращи агенти:
3MnO2 + 4Al = 3Mn + 2Al203;
Fe2O3 + 3H2 = 2Fe + 3H2O.
13. Киселинни оксиди→ неметали.
Повечето неметални оксиди не се разлагат при нагряване. Неметалните и кислородните разлагат само някои нестабилни оксиди (халогенни оксиди).
Някои неметали се получават чрез редукция от съответните оксиди:
Si02 + 2Mg = 2MgO + Si.
14. Соли, основи → бази.
Неразтворимите основи се получават чрез действието на основи върху разтвори на съответните киселини:
CuS04 + 2NaOH = Cu (OH) 2 '+ Na2SO4,
Cu 2+ + 2OH - → Cu (OH) 2 ';
FeCl2 + 2KOH = Fe (OH) 2 '+ 2KCl,
Fe2 + + 2OH - = Fe (OH) 2 '.
15. Соли, киселини → киселини.
Разтворимите соли реагират с киселини (в съответствие с сериите на налягане), ако резултатът е по-слаба или летлива киселина:
Na2Si03 + 2HCl = 2NaCl + H 2 SiO 3 ',
Si02 2 + 2H + → H 2 SiO 3;
NaCl (TV) + H2S04 (k) = NaHS04 + НС1.
16. Соли→ основни оксиди, киселинни оксиди.
Солите на някои кислородсъдържащи киселини (нитрати, карбонати) се разлагат при нагряване:
СаСОз = СаО + СОг;
2Cu (NO3) 2 = 2CuO + 4NO2 + O2.
УПРАЖНЕНИЯ ЗА НЕЗАВИСИМАТА РАБОТА ПО ТЕМАТА "ГЕНЕТИЧНА ВРЪЗКА МЕЖДУ КЛАСОВЕ НЕОРГАНИЧНИ СЪЕДИНЕНИЯ"
1. Назовете изброените по-долу вещества, разпределете ги в класовете неорганични съединения: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 О7, Fe (OH) 2, Р205, HF, MnO2.
2. От изброените по-долу вещества е възможно да се получи хидроксид (киселина или основа) на един етап: мед, железен оксид (P), бариев оксид, азотен оксид (P), азотен оксид (V), силициев оксид, меден сулфат, калиев хлорид. калий, магнезиев карбонат.
3. От горния списък се посочват формулите на веществата, свързани с: 1) оксиди; 2) основания; 3) киселини; 4) соли:
СОг, NaOH, НС1, S03, CuS04, NaN03, KCI, H2S04, Са (ОН) 2, Р2О5, HNO3, Al (OH) 3.
4. Назовете веществата: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4). ) 2, CO, HI. Посочете към коя класа принадлежи всяко вещество.
5. Напишете молекулните формули на следните вещества и посочете към кой клас принадлежи всяко вещество:
1) меден (II) хидроксикарбонат;
2) азотен оксид (V);
3) никелов (II) хидроксид;
4) бариев хидроген фосфат;
5) перхлорна киселина;
6) хром (III) хидроксид;
7) калиев хлорат;
8) хидрогенсулфидна киселина;
9) натриев цинкат.
6. Дайте примери за реакциите на връзката между:
1) прости вещества-неметали;
2) проста субстанция и оксид;
3) оксиди;
4) сложни вещества, които не са оксиди;
5) метални и неметални;
6) три вещества.
7. Кои от следните вещества могат да реагират:
1) въглероден моноксид (IV): НС1, О2, N02, КОН, Н20;
2) магнезиев оксид: Ва (ОН) 2, НС1, СОг, 02, HNO3;
3) железен (II) хидроксид: КС1, НС1, КОН, О2, Н20, HN03;
4) хлороводород: Zn, MgO, ZnCl2, HNO3, Са (ОН) 2, Си, (ZnOH) Cl.
8. Възможно ли е взаимодействието между следните вещества?
1) въглероден оксид (IV) и калиев хидроксид;
2) калиев хидросулфат и калциев хидроксид;
3) калциев фосфат и сярна киселина;
4) калциев хидроксид и серен оксид (IV);
5) сярна киселина и калиев хидроксид;
6) калциев бикарбонат и фосфорна киселина;
7) силициев диоксид и сярна киселина;
8) цинков оксид и фосфорен оксид (V).
Напишете уравненията на възможните реакции, посочете условията, в които те се появяват. Ако реакциите могат да доведат до различни вещества, посочете каква е разликата в условията на тяхното поведение.
9. Дайте уравненията на реакциите за получаване на следните вещества: натриев ортофосфат (4 начина), калиев сулфат (7 начина), цинков хидроксид.
10. Един от методите за производство на сода (натриев карбонат) е действието на вода и въглероден оксид (IV) върху натриев алуминат. Направете уравненията на реакцията.
11. Променяйки коефициентите, напишете продуктите на реакцията:
1) MgO + 2H2SO4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N2O5 + 2Al (OH) 3 →
4) Р2О5 + 4NaOH →
5) Р2О5 + 6NaOH →
6) Р2О5 + 2NaOH →
12. Направете уравнения на реакциите за получаване на различни видове соли:
1) SO 2 + Ba (OH) 2 → (средни и киселинни соли),
2) A1 2 O 3 + H 2 O + HNO 3 → (средна сол, основни соли),
3) Na 2 O + H 2 S → (средни и киселинни соли),
4) SO 3 + Sa (OH) 2 → (средни и основни соли),
5) CaO + H 2 O + P 2 O 5 → (основна сол, киселинни соли).
13. Попълнете уравненията на реакцията:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr2O3 + NaOH → СаСОз + СО2 + Н20 →
А1203 + НС04\u003e Са (НСО 3) 2 + НС1 →
Mn2O7 + КОН → ZnS + H2S →
NO2 + Ca (OH) 2 → CaSO4 + H2SO4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + НС1 →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H 2 SO 4 (недостатъчно) →
А1С13 + NaOH (дефицитен) → (FeOH) Cl + NaHS →
А1С1з + NaOH → Na2 ZnO2 + H 2 SO 4 (излишък) →
AlC1 3 + NaOH (излишък.) → Са (А1 2) 2 + НС1 (излишък) →
14. Напишете уравненията на реакцията, с помощта на които могат да се извършат следните трансформации:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 О 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgS04
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO2 → SO3 → NaHS04 → Na2S04 → BaS04
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na2 → Zn (NO3) 2
13) Ca → CaCl 2 → СаСОз → Са (НСО 3) 2 → Са (NO3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → СаСОз → Са (NO3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) алуминиев сулфат → алуминиев хлорид → алуминиев нитрат → алуминиев оксид → калиев алуминат → алуминиев хидроксид → алуминиев хидроксид → алуминиев хлорид.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) барий → бариев хидроксид → бариев бикарбонат → бариев хлорид → бариев карбонат → бариев хлорид → бариев хидроксид
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Са (НСО 3) 2 → СаСОз → СаС1 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) S02 → CaS03\u003e S02 → NaHS03 → S02
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO3 → CO 2
73) СаСОз → Са (НСО 3) 2 → CaCl2 → Са (NO3) 2 → O2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K2SO4 → KOH → K2CO3 → КОН
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na2S04 → NaCl → НС1 → CaCl2 → Са (NO3) 2
84) Na2S03 → S02 → H 2 SO 4 → НС1 → FeCl2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) НС1 → CuCl2 → CI2 → НС1 → Н2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH3 → NH4C1 → NH3H2O → NH4HC03 → NH3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2PO4 → (NH4) 2HPO4 → NH3 → NH4NO3
93) КОН → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) КОН → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO4 → CuCl2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl2 → NaCl → НС1 → CuCl2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Са 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Са 3 (PO 4) 2
111) CaCl2 → CaS03 → Ca (OH) 2 → CaCl2 → Са (NO3) 2
112) NaOH → Na2C03 → NaHS04 → NaN03 → NaHS04
113) Na2Si03\u003e Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO 3 → KHS04 → K2SO4 → KCl → Na2S04
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Са → Са (ОН) 2 → Са (НСО 3) 2 → СаО → CaCl 2
125) NH3H2O → NH4C1 → NH3 → NH4HC03 → (NH4) 2СО3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) S02 → Са (HSO3) 2 → CaCl2 → Са (ОН) 2 → Са (НСО 3) 2
128) NH 3 H 2 O → NH 4HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
ЕКСПЕРИМЕНТАЛНИ ОПИТИ ПО ТЕМАТА "ОСНОВНИ КЛАСОВЕ НА НЕОРГАНИЧНИ СЪЕДИНЕНИЯ"
ОПИТ 1.Реакции на неутрализация.
а) Взаимодействието на силна киселина и силна основа.
Изсипете 5 ml 2 N разтвор на солна киселина в порцеланова чиния и добавете към него 2 N разтвор на натриев хидроксид. Разтворът се разбърква със стъклена пръчка и се тества неговото действие върху лакмуса, като се прехвърля капка разтвор на лакмусния тест. Необходимо е да се постигне неутрална реакция (синя и червена лакмусова хартия не променя цвета). Полученият разтвор се изпарява до сухо. Какво се е образувало? Напишете уравнения за молекулярни и йонни реакции.
б) Взаимодействието на слаба киселина и силна основа.
Изсипете 2 ml алкален разтвор в епруветка и добавете разтвор на оцетна киселина, докато разтворът е неутрален. Напишете уравнения за молекулярни и йонни реакции. Обяснете защо равновесната йонна реакция, в която участва слаб електролит (оцетна киселина), се измества към образуването на водни молекули.
ОПИТ 2. Амфотерни хидроксиди.
От наличните в лабораторията реагенти се получава утайка от цинков хидроксид. Получената утайка се разклаща и се изсипват малки количества от нея в 2 епруветки. Към един разтвор се добавя разтвор на солна киселина, а към друг - разтвор на натриев хидроксид (излишък). Какво се наблюдава? Напишете уравненията на съответните реакции в молекулярна и йонна форма.
ОПИТ 3.Химични свойства на солите.
а) Взаимодействието на солеви разтвори с образуването на умерено разтворимо вещество.
Налейте в епруветката 2 ml разтвор на натриев карбонат и добавете разтвор на бариев хлорид, докато се образува бяла утайка. Напишете уравнението на химичната реакция в йонна и молекулярна форма. Утайката се разделя на две части. Изсипете разтвор на сярна киселина в една от епруветките и натриев хидроксид в другата. Направете заключение за разтворимостта на утайката в киселини и основи.
б) Взаимодействие на солевия разтвор с киселини за образуване на летливо съединение.
Налейте в епруветката 2 ml разтвор на натриев карбонат и добавете малък обем разтвор на солна киселина. Какво се наблюдава? Напишете уравненията на химичните реакции в йонна и молекулярна форма.
в) Взаимодействие на солни разтвори с основи с образуването на летливо съединение.
Налейте малко малко разтвор на амониева сол в епруветката, добавете 1-2 ml разтвор на натриев хидроксид и нагнете до кипене. В епруветка с реакционната смес се прави мокър червен лакмусов тест. Какво се наблюдава? Дайте обяснение. Напишете уравненията на реакцията.
г ) Взаимодействия на соли с по-активни метали, отколкото метала, който е част от солта.
Почистете железния (стоманен) пирон с фина шкурка. След това се потапя в разтвор на меден сулфат. След известно време наблюдавайте отделянето на мед върху повърхността на нокътя. Напишете съответното уравнение на реакцията в йонна и молекулярна форма.
ОПИТ 4.Получаване на основни и кисели соли.
а) Приготвяне на оловен хидроксикарбонат.
Добавя се малко оловен (II) оксид към разтвора на оловия (II) ацетат и се вари в продължение на няколко минути. Охладеният разтвор се оттича от седимента и през него преминава поток от въглероден диоксид. Какво се наблюдава? Утайката се филтрира и се суши между листовете филтърна хартия. Отбележете цвета и естеството на получената утайка от оловен хидроксикарбонат. Напишете уравненията на реакцията. Направете графична формула на получената сол.
б) Получаване на магнезиев бикарбонат.
Към много силно разреден разтвор на магнезиева сол се добавя малко разтвор на натриев карбонат. Какво вещество се утаява? Наситен разтвор с утайка с въглероден диоксид. Наблюдавайте постепенното разтваряне на утайката. Защо се случва това? Напишете уравненията на реакцията.
ОПИТ 5.Получаване на комплексни соли.
а) Образуване на съединения с комплексен катион.
Добавя се разтвор на амоняк на капки в епруветка с 2-3 ml разтвор на меден (II) хлорид, докато се образува утайка от меден (II) хидроксид, след което се добавя излишък от амонячен разтвор, докато утайката се разтвори. Сравнете цвета на йони si 2+ с цвета на получения разтвор. Наличието на които йони причиняват разтвора на цвета? Напишете уравнението на реакцията за получаване на комплексното съединение.
б) Образуване на съединения с комплексен анион.
Към 1-2 ml разтвор на живачен (II) нитрат се прибавя на капки разреден разтвор на калиев йодид, за да се образува утайка от HgI 2. След това се излива излишък от разтвор на калиев йодид, докато утайката се разтвори. Напишете реакциите за получаване на сложна сол.
ОПИТ 6.Приготвяне на двойни соли (калиев алум).
Претеглят се 7,5 g Al 2 (SO 4) 3 - 18 H 2 O и се разтварят в 50 ml вода, като се взема достатъчно голяма порцеланова чаша за тази цел. Изчислява се уравнението на реакцията и се претегля масата на калиев сулфат, необходима за реакцията. Приготвя се горещ наситен разтвор на калиев сулфат и се изсипва в порцеланова чиния с разтвор на алуминиев сулфат при разбъркване. Наблюдава се след известно време загубата на кристали от калиев алум. След охлаждане и кристализация, излива се матерната луга, изсушава се кварцовите кристали между листата на филтърната хартия и се претеглят получените кристали. Изчислете процента на добив.
ЗАДАЧИ ЗА УРЕЖДАНЕ
1. Чрез прекарване на излишък от сероводород през 16 g разтвор на меден (II) сулфат се получават 1.92 g утайка. Намерете масовата част на медния сулфат в използвания разтвор и обема на консумирания сероводород.
2. За пълното утаяване на мед под формата на сулфид от 291 cm 3 разтвор на меден (II) сулфат с масова фракция 10% се използва газ, получен чрез взаимодействие на 17,6 g желязо (II) сулфид с излишък от солна киселина. Намерете плътността на оригиналния разтвор на меден сулфат.
3. Освободеният газ при взаимодействието на разтвора K 2 S с разредена сярна киселина преминава през излишък от разтвор на оловен (II) нитрат. Полученият остатък има маса 71,7 гр. Намерете обема на реагиралия разтвор на сярна киселина, ако неговата плътност е 1,176 г / см 3, а масовата част е 25%.
4. Към разтвор, съдържащ 8 g меден (II) сулфат, се добавя разтвор, съдържащ 4.68 g натриев сулфид. Утайката се филтрува, филтратът се изпарява. След изпаряването се определя масата на веществата във филтрата и масата на утайката от меден сулфид.
5. Част от железния (II) сулфид се третира с излишък от солна киселина. Полученият газ в реакцията с 12,5 cm 3 разтвор на NaOH с масова фракция 25% и плътност 1,28 g / cm 3 образува кисела сол. Намерете масата на първоначалния железен сулфид.
6. Желязо (II) сулфид с тегло 176 g се третира с излишък от солна киселина и полученият газ се изгаря в излишък от въздух. Какъв обем разтвор на КОН с масова фракция от 40% и плътност от 1,4 g / cm 3 е необходим за пълното неутрализиране на газа, получен при горенето?
7. При изпичане на 100 g технически пирит те получават газ, който напълно неутрализира 400 cm 3 разтвор на NaOH с масова фракция от 25% и плътност 1,28 g / cm 3. Определя се масовата част на примесите в пирит.
8. Към 2 g смес от желязо, железен оксид (II) и железен оксид (III) се добавя 16 cm 3 разтвор на НС1 с масова фракция от 20% и плътност от 1,09 g / cm3. За да се неутрализира излишната киселина, се взима 10.8 cm 3 разтвор на NaOH с масова фракция от 10% плътност от 1.05 g / cm3. Намерете масите на веществата в сместа, ако обемът на освободения водород е 224 cm 3 (NU).
9. Има смес от Ca (OH) 2, CaCO 3 и BaSO 4 с маса 10,5 g. Когато сместа се обработва с излишък от солна киселина, се освобождава 672 cm 3 (IU) газ и 71,2 g от киселината реагират с маса дял от 10%. Определете масата на веществата в сместа.
10. Има смес от бариев хлорид, калциев карбонат и натриев бикарбонат. Когато 10 g от тази смес се разтварят във вода, неразтворимият остатък е равен на 3,5 g. При калциниране на 20 g от първоначалната смес масата му намалява с 5,2 g. Намерете масовите фракции на веществата в първоначалната смес.
11. Има разтвор, съдържащ както сярна, така и азотна киселина. За да се неутрализира напълно 10 g от този разтвор, 12,5 cm 3 разтвор на КОН се изразходва с масова част от 19% и плътност 1,18 g / cm 3. Когато към 20 g от същата смес от киселинен разтвор се добави излишък от бариев хлорид, отпадат 4,66 g утайка. Намерете масовите фракции на киселините в сместа.
12. Всички хлороводород, получен от 100 g смес от КС1 и KNO3, се разтварят в 71.8 cm 3 вода. При калциниране на 100 g от същата смес от соли остават 93.6 g твърд остатък. Намерете масовата част на хлороводород във водата.
13. Чрез преминаване на 2 m 3 въздух (NU) през разтвор на Са (ОН) 2 се получава 3 g утайка от въглеродна киселина. Намерете обема и масовата част на CO 2 във въздуха.
14. Въглероден диоксид се прекарва през суспензия, съдържаща 50 g СаСОз. Реакцията е 8.96 dm3 газ (NU). Каква е масата на CaCO 3, оставена в твърдата фаза?
15. Когато се добавя вода към CaO, неговата маса се увеличава с 30%. Каква част от CaO (в масови%) е погасена?
16. Оловен (II) оксид с тегло 18.47 g се загрява в поток от водород. След реакцията, масата на получения олово и нереагирал оксид е 18,07 г. Каква е масата на оловия оксид, която не реагира?
17. Въглероден моноксид се пропуска през железен (III) оксид при нагряване. Масата на твърдия остатък след реакцията е с 2 g по-малка от първоначалната маса на железен оксид. Какво е количеството на реагиралия СО (оксидът е напълно редуциран)?
18. Има 8.96 dm3 (NU) на смес от N2, СО2 и S02 с относителна плътност на водород 25. След като се премине през излишък от разтвор на КОН, обемът на сместа намалява 4 пъти. Намерете обемите на газовете в оригиналната смес.
19. В две чаши има 100 g разтвор на НС1 с масова част от 2,5%. В една чаша се прибавят 10 g СаСОз, а в другата - 8,4 g MgC03. Как ще се различава масата на чашите след реакцията?
20. Какъв обем (NU) серен диоксид трябва да се премине през 200 cm 3 разтвор с 0,1% масова фракция NaOH и плътност 1 g / cm 3, за да се получи кисела сол?
21. Какво е максималното количество (въглероден диоксид) на въглероден диоксид може да абсорбира 25 cm 3 от разтвор с 25% масова фракция на NaOH и плътност от 1,1 g / cm 3?
22. Какъв е минималният обем на разтвора с масова фракция от 20% КОН и плътност 1,19 g / cm 3, която може да абсорбира целия произведен въглероден диоксид с пълното намаляване на 23,2 g магнетит с въглероден оксид?
23. Каква е минималната маса на КОН, която трябва да реагира с 24,5 g ортофосфорна киселина, така че продуктът да е само калиев дихидроген фосфат?
24. Каква е минималната маса на Ca (OH) 2, за да се добави към 16 g разтвор на калциев бикарбонат с масова фракция от 5% сол, за да се получи средна сол?
25. Каква маса калиев хидрогенфосфат трябва да се добави към разтвор, съдържащ 12,25 g Н 3 PO 4, така че след това разтворът да съдържа само калиев дихидрофосфат?
26. Разтворът съдържа 56,1 g смес от калциев и магнезиев карбонат в суспензия. За да ги превърнат в хидрокарбонати, те изразходват целия въглероден диоксид, получен чрез изгаряне на 7 dm 3 (NU) етан. Намерете масата на калциевия карбонат в първоначалната смес.
27. За да се превърнат 9,5 g от смес от натриев хидро- и дихидроген фосфат до средна сол, е необходимо 10 cm 3 разтвор с масова фракция на NaOH 27,7% и плътност 1,3 g / cm3. Намерете масата на водородния фосфат в сместа.
28. Чрез преминаване на въглероден диоксид през разтвор, съдържащ 6 g NaOH, се получават 9,5 g смес от кисели и средни соли. Намерете обема на изразходвания въглероден диоксид.
29. След преминаване на 11,2 dm3 (NU) СО2 през разтвор на КОН се получават 57,6 g смес от кисели и средни соли. Намерете масата на средната сол.
30. Каква маса ортофосфорна киселина трябва да се неутрализира, за да се получат 1,2 g дихидро- и 4,26 g натриев хидроген фосфат?
Добавя се NaOH към разтвора на сярната киселина и се получават 3.6 g хидросулфат и 2.84 g натриев сулфат. Определете химичните количества на реагиралата киселина и алкали.
32. След прекарване на хлороводород през 200 cm 3 разтвор на NaOH с масова фракция от 10% и плътност от 1,1 g / cm 3, масовата фракция на NaOH в получения разтвор намалява наполовина. Определете масовата част на NaCl в получения разтвор.
33. Разтварянето на 14,4 g смес от мед и нейния оксид (II) консумира 48,5 g разтвор с масова част HNO 3 от 80%. Намерете масовите фракции на мед и оксид в първоначалната смес.
34. Натриев оксид с тегло 6,2 g се разтваря в 100 cm 3 вода и се получава разтвор № 1. След това към този разтвор се добавя солна киселина с масова фракция от 10%, докато средата стане неутрална и се получава разтвор 2. :
1) масови фракции на вещества в разтвори № 1, 2;
2) масата на разтвора НС1, която неутрализира разтвор 1.
35 g. 3 g цинк взаимодейства с 18,69 cm 3 разтвор на НС1 с масова фракция 14,6% и плътност 1,07 g / cm3. При нагряване полученият газ преминава през горещ CuO с тегло 4 гр. Каква е масата на получената мед?
36. Газът, освободен след обработката на калциев хидрид с излишък от вода, се прехвърля върху FeO. В резултат на това масата на оксида намалява с 8 г. Намерете масата на CaH 2, третирана с вода.
37. По време на калцинирането на пробата СаСО 3 масата му намалява с 35,2%. Твърдите реакционни продукти се разтварят в излишък от солна киселина до получаване на 0.112 dm3 (NU) газ. Определя се масата на първоначалната проба от калциев карбонат.
38. Медният нитрат се разлага и полученият меден (II) оксид се редуцира напълно с водород. Получените продукти преминават през тръба с P 2 O 5, а масата на тръбата след това се увеличава с 3,6 гр. Какъв е минималният обем на сярната киселина с масова част от 88% и плътност от 1,87 г / см 3, необходима за разтваряне, получено в експеримента. мед и каква е масата на разлагащата се сол?
39. При абсорбция на азотен оксид (IV) с излишък от разтвор на КОН в студа в отсъствие на кислород се получават 40.4 g KNO3. Каква субстанция все още се формира и каква е нейната маса?
40. За неутрализиране на 400 g разтвор, съдържащ сол и. \\ T сярна киселина, консумират се 287 cm 3 разтвор на натриев хидроксид с масова фракция от 10% и плътност от 1,115 g / cm3. Ако към 100 g от първоначалния разтвор се прибави излишък от разтвор на бариев хлорид, ще падне 5,825 g утайка. Определете масовите фракции на киселини в първоначалния разтвор.
41. След преминаване на въглероден диоксид през разтвор на натриев хидроксид се получават 13,7 g смес от средни и киселинни соли. За превръщането им в натриев хлорид са необходими 75 g солна киселина с масова фракция на HCl от 10%. Намерете обема на абсорбирания въглерод.
42. Смес от солна и сярна киселини с обща маса 600 g разтвор със същите масови фракции киселини се третира с излишък от натриев бикарбонат и се получава 32,1 dm 3 газ (N °.). Намерете масовата част на киселините в първоначалната смес.
43. За неутрализиране на 1 dm3 разтвор на NaOH, 66.66 cm 3 от разтвора HNO3 се консумира с масова фракция 63% и плътност от 1.5 g / cm3. Какъв обем разтвор на сярна киселина с масова фракция от 24.5% и плътност от 1.2 g / cm 3 би бил необходим за неутрализиране на същото количество алкали?
44. В какво обемно съотношение трябва да се вземе разтвор на сярна киселина с масова фракция 5% и плътност от 1,03 g / cm 3 и разтвор на бариев хидроксид с масова част от 5% и плътност от 1,1 g / cm 3 за пълна неутрализация? Представете си отговора като частно от обема на алкалния разтвор върху киселия разтвор.
45. Изчислява се минималният обем амонячен разтвор с плътност от 0,9 g / cm 3 и масова част от 25%, необходима за пълното усвояване на въглеродния диоксид, получен чрез разлагане на 0,5 kg естествен варовик с масова фракция на калциев карбонат, равна на 92%.
46. За пълното превръщане на 2,92 g смес от натриев хидроксид и натриев карбонат в хлорид се изисква 1,334 dm3 хлороводород (NU). Намерете масата на натриевия карбонат в сместа.
47. Към 25 g от разтвор на меден (II) сулфат с масова фракция от 16% се добавя количество разтвор на натриев хидроксид с масова част от 16%. Образуваната утайка се филтрува, след което филтратът е алкален. За да се неутрализира напълно филтрата, се изисква 25 cm 3 разтвор на сярна киселина с моларна концентрация от 0.1 mol / dm3 разтвор. Изчислява се масата на добавения разтвор на натриев хидроксид.
48. Веществото, получено с пълната редукция на CuO с маса от 15,8 g водород с обем 11,2 dm3 (NU) се разтваря чрез нагряване в концентрирана сярна киселина. Какъв обем газ (NU) е бил освободен в резултат на реакцията?
49. За пълна неутрализация на 50 cm 3 солна киселина с масова фракция на HCl 20% и плътност 1,10 g / cm 3 се използва разтвор на калиев хидроксид с масова фракция на КОН 20%. Какво е химичното количество на водата, съдържаща се в получения разтвор?
50. Газът, получен чрез прекарване на излишък от СО2 над 0,84 g горещи въглища, се изпраща в реакцията с 14,0 g нагрят меден (II) оксид. Какъв обем от разтвор на азотна киселина с масова фракция от 63% и плътност от 1,4 g / cm 3 е необходим за пълното разтваряне на веществото, получено при последната реакция?
51. Когато се калцинира до постоянна маса на меден (II) нитрат, масата на солта намалява с 6,5 г. Коя маса сол се разлага?
52. Когато се използва излишък от солна киселина, 6.72 dm3 (NW) газ се освобождава от смес от алуминий с неизвестен моновалентен метал и масата на сместа се намалява наполовина. При третиране на остатъка с разредена азотна киселина се освобождава 0.373 dm3 (NU) NO. Идентифицирайте неизвестния метал.
53. Масата на пробата от креда е 105 g, а химичното количество на кислородния елемент в състава му е 1 mol. Определете масовата фракция на CaCO 3 в пробата от креда (кислородът е включен само в състава на калциевия карбонат).
54. При взаимодействието на серен оксид (VI) с вода се получава разтвор с масова част на сярната киселина от 25%. Когато към този разтвор се прибави излишък от Ва (ОН) 2, се отлага утайка от 29,13 g. Какви маси S03 и Н20 се изразходват за образуване на киселинен разтвор?
55. При преминаване на S02 през 200 g разтвор с масова фракция на NaOH 16% се образува смес от соли, включваща 41,6 g кисела сол. Каква е масата на сярата, съдържаща тегловно 4,5% примеси, за да се получи SO 2? Каква е теглото на средната сол?
Използват се 50 g разтвор на Na2C03 за реакция с 80 g разтвор на Са (N03) 2. Утаяването се отделя, докато при преработката му с излишък от солна киселина се освобождава 2.24 dm3 (NU) газ. Какви са масовите фракции на соли в първоначалните разтвори? Каква е масата на натриевия нитрат в разтвора след отделяне на утайката?
57. Когато цинк взаимодейства със сярна киселина, се образува 10 dm 3 (NU) на смес от SO 2 и H 2 S с относителна плътност на аргон от 1,51. Какво е химичното количество на разтворения цинк? Каква е масата на SO 2 в газовата смес?
58. Проба от смес от цинкови и алуминиеви стърготини с обща маса 11 g се разтваря в излишък от алкален разтвор. Определете обема (NU) на освободения газ, ако масовата част на цинка в сместа е 30%.
59. Натриев хидроксид с тегло 4.0 g, легирани с алуминиев хидроксид с тегло 9.8 г. Изчислява се масата на получения натриев металуминат.
60. При преработка на 10 g смес от мед и алуминий с концентрирана азотна киселина при стайна температура освободен 2.24 dm 3 газ (nos). Какъв обем (NU) газ ще бъде освободен при обработка на същата маса от сместа с излишък от разтвор на КОН?
61. Сплав от мед и алуминий с тегло 20 g се третира с излишък от алкални, неразтвореният остатък се разтваря в концентрирана азотна киселина. Получената сол се изолира, калцинира до постоянно тегло и се получават 8 g твърд остатък. Обемът на разтвора на NaOH се определя с масова част 40% и плътност 1,4 g / cm 3).
62. Смес от алуминий и метален оксид (II) (не-амфотен оксид) с тегло 39 g се третира с излишък от разтвор на КОН, изпуснатият газ се изгаря за получаване на 27 g вода. Неразтвореният остатък се разтваря напълно в 25,2 cm 3 от разтвора с масова фракция НС1 от 36,5% и плътност 1,19 g / стз). Определя се оксидът.
63. Смес от цинкови и медни чипове се третира с излишък от разтвор на КОН, докато газ от 2.24 dm3 (NU) се освобождава. За пълно хлориране на същата проба от метали се изисква хлор с обем 8,96 dm 3 (NU). Изчислява се масовата част на цинка в пробата.
64. Смес от стърготини от желязо, алуминий и магнезий с маса 49 g се третира с излишък от разредена H 2 SO 4, като по този начин се получава 1,95 mol газ. Друга порция от същата смес, с тегло 4.9 g, се третира с излишък от алкален разтвор и се получава 1.68 dm3 (NU) газ. Намерете масата на металите в сместа.
65. Каква е масата на утайката, образувана при сливане на разтвори, съдържащи 10 g NaOH и 13.6 g ZnCl2?
66. Има две части от сместа от Al, Mg, Fe, Zn, еднакви в моларен състав, всеки тежащ 7,4 г. Една порция се разтваря в солна киселина и се получава 3,558 dm 3 газ (NU), а другият в алкален разтвор и Получава се 2.016 dm3 газ (nos). Известно е, че в двете смеси има 3 Zn атома за А1 атом. Намерете масата на металите в сместа.
67. Смес от мед, магнезий и алуминий с тегло 1 g се третира с излишък от солна киселина. Разтворът се филтрува, към филтрата се прибавя излишък от разтвор на NaOH. Получената утайка се отделя и се калцинира до постоянна маса от 0.2 g. Остатъкът, който не се разтваря след третиране със солна киселина се калцинира на въздух и се получават 0.8 g черна субстанция. Намерете масовата част на алуминия в сместа.
68. При нагряване в поток от кислород, сплав от цинк, магнезий и мед, масата на сместа се увеличава с 9,6 г. Продуктът, частично разтворен в алкали, и 40 cm 3 разтвор с масова фракция на КОН 40% и плътност 1,4 g / cm е необходим за разтваряне. 3. За реакцията със същата порция от сплавта е необходим 0,7 mol НС1. Намерете химически количества метали в сплавта.
69. Сплав от мед с цинк с тегло 5 g се третира с излишък от разтвор на NaOH. След това твърдият остатък се отделя и се обработва с концентрирана HN03, така получената сол се изолира, калцинира до постоянно тегло и се получават 2,5 g твърд остатък. Определете масата на металите в сплавта.
70. Сплав от мед и алуминий с тегло 12.8 g се третира с излишък от солна киселина. Неразтвореният остатък се разтваря в концентрирана азотна киселина, полученият разтвор се изпарява, сухият остатък се калцинира до постоянно тегло и се получават 4 g твърдо вещество. Определете масовата част на медта в сплавта.
71. В кое съотношение на масата трябва да се вземат две порции от А1, така че когато се добавя към разтвора на алкали, а другият - на равни количества водород, се освобождават в солната киселина?
72. Когато се обработва смес от алуминий и меден (II) оксид с излишък от разтвор на КОН, се освобождава 6.72 dm3 (NU) газ и чрез разтваряне на същата част от сместа в концентрирана HN03 при стайна температура се получават 75.2 g сол. Намерете масата на първоначалната смес от вещества.
73. Каква маса от меден (II) оксид може да се възстанови с водород, получен чрез взаимодействие на излишък от алуминий с 139,87 cm 3 разтвор с 40% масова фракция на NaOH и плътност 1,43 g / cm 3?
74. При пълното окисление на 7.83 g от сплавта от два метала се образуват 14.23 g оксиди, при обработката на които остатъкът от алкали остава неразтворен 4.03 g утайка. Определете качествения състав на металите, образуващи сплавта, ако техните катиони имат окислително състояние +2 и +3, а моларното съотношение на оксидите е 1: 1 (приемем, че метален оксид с окислително състояние +3 има амфотерни свойства).
75. Бяха разтворени две части алуминий със същата маса: единият в разтвор на калиев хидроксид, а другият в солна киселина. Как обемът на отделените газове се отнася един към друг?
76. Сплав от мед с алуминий с тегло 1000 g се третира с излишък от алкален разтвор, неразтворената утайка се разтваря в азотна киселина, след това разтворът се изпарява, остатъкът се калцинира до постоянно тегло. Масата на новия остатък е равна на 0,398 г. Каква е масата на металите в сплавта?
77. Сплав от цинк и мед с тегло 20 g се третира с излишък от разтвор на NaOH с масова фракция от 30% и плътност 1,33 g / cm3. Твърдият остатък се изолира и се третира с излишък от концентриран разтвор на HN03. Солта, образувана по време на този процес, се изолира и се калцинира до постоянна маса. Масата на твърдия остатък е 10.016 г. Изчислете масовите фракции на металите в сплавта и обема на използвания алкален разтвор.
78. Сплав от мед и алуминий с тегло 2 g се третира с излишък от алкален разтвор. Остатъкът се филтрува, промива се, разтваря се в HN03, разтворът се изпарява и се калцинира до постоянно тегло. Масата на остатъка след калциниране е 0.736 г. Изчислете масовите фракции на металите в сплавта.
79. Хлорирането на смес от желязо, мед и алуминий изисква 8,96 dm 3 хлор (NU), а взаимодействието на същата проба с хлороводород изисква 5,6 dm 3 (NU). При взаимодействие с една и съща маса на смес от метали с алкални вещества се отделят 1,68 dm 3 (NU) газ. Намерете химични количества метали в сместа.
80. Калиев хидрид с тегло 5.0 g се разтваря във вода с обем 80 cm 3 и в разтвора се вкарва алуминий с тегло 0.81 g. Намерете масовите фракции на веществата в получения разтвор с точност до хилядни от процента.
СПИСЪК НА ЛИТЕРАТУРА
1. Barannik, V.P. Съвременна руска номенклатура на неорганични съединения / V.P. Баранник // Списание на ВСН. DI Менделеев. - 1983. - том XXVIII. - стр. 9–16.
2. Wroblewski, A.I. Симулатор по химия / A.I. Wroblewski. - 2-ро издание, Перераб. и добавете. - Минск: Красико-Принт, 2007. - 624 с.
3. Glinka, N.L. Задачи и упражнения по обща химия: изследвания. ръководство за университети / изд. VA Rabinovich и H.M. Рубина. - М .: Интеграл-прес, 2004. - 240 с.
4. Lidin, R.A. Задачи в общата и неорганичната химия: изследвания. надбавка за студенти от по-високи. Proc. институции / R.A. Lidin, V.A. Milk, L.L. Андреев; от ed. RA Lidin. - М .: VLADOS, 2004. - 383 с.
5. Lidin, R.A. Основи на номенклатурата на неорганичните вещества / R.А. Lidin [et al.]; от ed. BD Stepin. - М .: Химия, 1983. - 112 р.
6. Stepin, B.D. Прилагане на правилата на IUPAC относно номенклатурата на неорганични съединения на руски език / B.D. Stepin, R.A. Лидин // Вестник на ВСН. DI Менделеев. - 1983. - том XXVIII. - стр. 17–20.
| Въведение …………………………………………………………………… Общи правила за гамата от неорганични вещества ………… .. Оксиди ………………………………… ……………………………… Основни оксиди ………………………………………………………… ... Киселинни оксиди ………………………………… ............................ Амфотерни оксиди ……………………………………………………… .. Получаване на оксиди ………………………………………………………… Упражнения за самостоятелна работа Темата “Оксиди” …………………………………………………………. Киселини ……………………………………………………………………. Упражнения за самостоятелна работа по темата “Киселини” ………………………………………………………… Основания …………………………………………………… ……… .. Упражнения за самостоятелна работа на тема “Основи” ………………………………………………………. Соли …………………………………………………………………………. Упражнения за самостоятелна работа по темата “Соли” …………………………………………………………… ... Генетична връзка между класовете неорганични съединения ………………………………… …………… .. Упражнения за самостоятелна работа на тема „Генетична връзка между класовете неорганични съединения” ……………………………………………… Експериментални експерименти на тема „Основни класове неорганични съединения …………… ……… .. Проектни задачи ………………………………………………………………………………………………………………………… |
образование: да се определи понятието "генетична серия", "генетична връзка"; да се научат да правят генетични поредици от елементи (метали и неметали), да съставят уравненията на реакцията, съответстващи на генетичната серия; да провери как се усвояват познанията за химичните свойства на оксиди, киселини, соли, основи;
разработване на: развиват способността да анализират, сравняват, обобщават и правят изводи, да съставят уравненията на химичните реакции;
образователен : насърчаване на формирането на научен мироглед.
2. Осигуряване на класове: таблици “Периодична система”, “Таблица на разтворимостта”, “Серия активности на металите”, инструкции за учениците, задачи за изпитване на знания.
3. Ред на изпълнение:
3.1. Фронтално проучване.
3.2. Решаване на задачи.
3.3. Извършване на проверка на опциите.
4. Оформление на отчета:
4.1. Напишете темата и целите на практическия урок.
4.2. Записвайте решаване на проблеми.
4.3. Решете своя собствена версия на независима работа, решението да напишете в тетрадка и да я предадете на учителя за преглед.
Напредък в работата
1. Фронтален разговор на:
Какво е генетична връзка?
Генетични връзки - това са връзки между различните класове, основани на техните взаимни обръщения.
Какво е генетична серия?
Генетичен ред - редица вещества - представители на различни класове, които са съединения от един химичен елемент, свързани с взаимни превръщания и отразяващи трансформациите на тези вещества. В основата на тези серии е същият елемент.
Какви видове генетични серии обикновено се разпределят?
Сред металите има два вида редове:
а) Генетична серия, в която алкалите действат като основа. Тази серия може да бъде представена чрез следните трансформации:
метал → основен оксид → алкали → сол
например, генетичната серия на калий K → K 2 O → KOH → KCl
б) Генетичната серия, където основата е неразтворима база, тогава сериите могат да бъдат представени като верига от трансформации:
метал → основен оксид → сол → неразтворима основа → основен оксид → метал
например: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Сред неметалите е възможно да се разграничат два вида редове:
а) Генетичната серия от неметали, където разтворимата киселина действа като връзка в серията. Веригата от трансформации може да бъде представена както следва: неметална → киселинен оксид → разтворима киселина → сол.
Например: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
б) Генетичен ред от неметали, където неразтворимата киселина: неметална → киселинен оксид → сол → киселина → киселинен оксид → неметални действа като връзка в серията
Например: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Изпълнение на задачи за опции:
| Вариант 1 | Вариант 2 |
|
I вариант: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
Вариант II: Na2S04, NaOH, Na, Na2O2, Na2O
Домашна работа: начертайте постепенен преход от калций към калциев карбонат и изгответе доклад за използването на всяка сол в медицината (използвайки допълнителна литература).
Инструкции за практически урок
Генетична връзка между основните класове неорганични вещества.
Цели: да се определи понятието "генетична серия", "генетична връзка"; да се научат как да се правят генетични серии от елементи (метали и неметали), да се съставят уравненията на реакциите, съответстващи на генетичната серия; повторете свойствата на оксиди, киселини, соли, основи.
Напредък в работата
Напишете дефинициите на понятията:
Генетична връзка - __________________________________________
Генетичен ред - ___________________________________________
Генетична поредица от метали, в които алкалите действат като основа. могат да бъдат представени най-общо: метал → основен оксид → алкали → сол. Направете тази серия, използвайки калий. Напишете уравненията на реакцията, с които можете да направите тази верига от трансформации.
Генетичната серия от неметали, където разтворимата киселина действа като връзка в серията могат да бъдат представени както следва: неметални → киселинен оксид → разтворима киселина → сол. Направете тази серия с фосфор. Напишете уравненията на реакцията, с които можете да направите тази верига от трансформации.
Генетичен ред, където основата е неразтворима основа може да бъде представена чрез верига от трансформации: метален → основен оксид → сол → неразтворима основа → основен оксид → метал. Направете тази серия, използвайки мед. Напишете уравненията на реакцията, с които можете да направите тази верига от трансформации.
Генетичната серия от неметали, където неразтворимата киселина действа като връзка в серията могат да бъдат представени чрез верига от трансформации: неметални → киселинен оксид → сол → киселина → киселинен оксид → неметални. Изградете тази серия, използвайки силиций. Напишете уравненията на реакцията, с които можете да направите тази верига от трансформации.
Изпълнете задачи за опции:
| Вариант 1 | Вариант 2 |
|
1. Изберете формулата на оксида във вашата версия, обяснете своя избор, въз основа на познанията за характеристиките на състава на този клас съединения. Обадете им се.
2. В колоната с формулите на версията си намерете киселинните формули и обяснете избора си въз основа на анализа на състава на тези съединения.
3. Определете валенциите на киселинните остатъци в киселинния състав.
4. Изберете солеви формули и ги назовете.
5. Съставете формулите на солите, които могат да се образуват с магнезий и киселини от вашия вариант. Запишете ги, назовете го.
6. В колоната с формулите на версията си намерете основните формули и обяснете избора си въз основа на анализа на състава на тези съединения.
7. В своя вариант изберете формулите на веществата, с които може да реагира разтворът на фосфорната киселина (солна, сярна). Направете подходящи уравнения на реакцията.
9. Сред формулите по ваш избор изберете формули от вещества, които могат да взаимодействат помежду си. Направете подходящи уравнения на реакцията.
10. Направете верига от генетични връзки на неорганични съединения, които ще включват вещество, формулата на която е дадена във вашата версия под номер едно.
Направете генетична линия, като използвате тези вещества, като използвате всички формули. Напишете уравненията на реакциите, с които можете да постигнете тази верига от трансформации:
аз опция: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
IIопция: Na2S04, NaOH, Na, Na2O2, Na2O
Домашна работа: начертайте постепенен преход от калций към калциев карбонат и изгответе доклад за използването на всяка сол в медицината (използвайки допълнителна литература).
