Химична формула на сярната киселина. Сярна киселина: химични свойства, препарат
H2SO3, слаба двуосновна киселина. В свободна форма тя не се разпределя, съществува във водни разтвори. Сулфити на сярна киселина ... Голям енциклопедичен речник
Сярна киселина - (H2SO3) слаба двуосновна киселина. Съществува само във водни разтвори. Соли С. до. Сулфити. Прилага се в целулозната и хранително-вкусовата промишленост. Виж също Киселини и анхидриди ... Руска енциклопедия за защита на труда
сярна киселина - - [A.S. Goldberg. Английски руски енергиен речник. 2006] Теми на енергията като цяло EN сулфидна киселина ... Ръководство за технически преводач
H2SO3, слаба двуосновна киселина. В свободна форма тя не се разпределя, съществува във водни разтвори. Сулфити на сярна киселина. * * * Сярна киселина, сярна киселина, H2SO3, слаба двуосновна киселина. Безплатно не е избрано, ... ... Енциклопедичен речник
сярна киселина - sulfito rūgštis statusas T sritis chemija formulė HSO₃ atitikmenys: angl. сярна киселина rus. сярна киселина ryšiai: sinonimas - vandenilio trioksosulfatas (2–) Хемиос терниш аишкинасос
H2SO3, слаба двуосновна киселина, съответстваща на степента на окисляване на сярата +4. Известно само в разредени водни разтвори. Константи на дисоциация: К1 = 1.6 · 10 2, К2 = 1.0 · 10 7 (18 ° С). Той дава два реда соли: нормални сулфити и кисели ... Велика съветска енциклопедия
H2SO3, слаба двуосновна киселина. В свободната форма не е подчертана, тя съществува във водите. p rah. Соли С. к. Сулфити ... Природни науки. Енциклопедичен речник
Вижте Сяра ... Енциклопедичен речник на ФА Brockhaus и I.A. Ефрон
Серен диоксид (диоксид) се образува чрез изгаряне на сяра във въздуха или кислорода. Също така се получава чрез калциниране във въздуха ("изгаряне") на сулфиди на метали, например железни пирити:
Съгласно тази реакция, серен диоксид обикновено се получава в промишлеността (за други промишлени методи за получаване на cm, 9 § 131).
Серен диоксид е безцветен газ ("серен диоксид") с остър епарх от гореща сяра. Тя се кондензира доста лесно в безцветна течност, която кипи. Когато течността се изпари, има силно понижение на температурата (преди).
Серен диоксид е силно разтворим във вода (около 40 обема в 1 обем вода при); в същото време се осъществява частична реакция с вода и се образува сярна киселина:
Така, серен диоксид е анхидрид на сярна киселина. Когато се нагрява, разтворимостта намалява и равновесието се измества наляво; постепенно целия серен диоксид се освобождава от разтвора отново.
Молекулата е изградена подобно на озоновата молекула. Ядрата на съставните му атоми образуват равнобедрен триъгълник:
Тук серният атом, подобно на централния кислороден атом в озоновата молекула, е в а-хибридизиращо състояние и ъгълът е близък до. Ориентирана перпендикулярно на равнината на молекулата, орбитата на серен атом не участва в хибридизацията. Благодарение на тези орбитали и, по подобен начин, орбиталите на кислородните атоми се образува трицентрова връзка; електронната двойка, която я носи, принадлежи на всичките три атома на молекулата.
Серен диоксид се използва за производство на сярна киселина, а също така (в много по-малки количества) за избелване на слама, вълна, коприна и като дезинфектант (за унищожаване на плесенни гъби в мазета, изби, винени бъчви, ферментационни резервоари).
Сярната киселина е много крехко съединение. Той е известен само във водни разтвори. Когато се опитвате да изолирате сярната киселина, тя се разпада във вода. Например, когато концентрираната сярна киселина действа върху натриевия сулфит, вместо серната киселина се освобождава серен диоксид:
Разтворът на сярна киселина трябва да бъде защитен от въздух, в противен случай той абсорбира кислорода от въздуха и бавно се окислява до сярна киселина:
Сярната киселина е добър редуциращ агент. Например, свободни халогени се възстановяват от него до водородни халогениди:
![]()
Въпреки това, при взаимодействие със силни редуциращи агенти сярната киселина може да играе ролята на окислител. Така реакцията му със сероводород протича главно по уравнението:
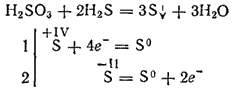
Като двуосновна, сярна киселина образува два реда соли. Средните му соли се наричат сулфити, киселинни соли - хидросулфити.
Подобно на киселина, сулфитите и хидросулфитите са редуциращи агенти. Когато се окисляват, се получават соли на сярната киселина.
Сулфитите от най-активните метали по време на калцинирането се разлагат с образуването на сулфиди и сулфати (самоокислителна реакция - саморедукция):
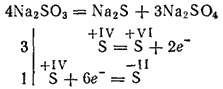
Калиеви и натриеви сулфити се използват за избелване на някои материали в текстилната промишленост за боядисване на тъкани, във фотографията. Разтворът (тази сол съществува само в разтвор) се използва за обработка на дървесина в така наречения сулфитен пулп, от който след това се получава хартия.
Серенната киселина може да реагира с кислорода. Това образува сярна киселина. Тази реакция отнема много дълго време и е възможна само ако са нарушени правилата за съхранение. Сярната киселина има както окислителни, така и редуциращи свойства. С негова помощ можете да получите халогенни киселини. Воден разтвор при взаимодействие с хлор образува солна и сярна киселина.
Когато реагира със силни редуциращи агенти, сярната киселина играе ролята на окислител. Едно от тези вещества е сероводород, газ с много неприятна миризма. Взаимодействайки с воден разтвор на сярна киселина, той образува сяра и вода. Солите на сярната киселина също имат редуциращи свойства. Те се разделят на сулфити и хидросулфити. Реакциите на окисляване на тези соли произвеждат сярна киселина.
Производство на сярна киселина
Сярната киселина се образува само чрез взаимодействието на серен диоксид и вода. Необходимо е да се получи кисел газ. Това може да се направи с мед и сярна киселина. Вливайте концентрираната сярна киселина в епруветката и хвърлете в нея парче мед. Тръбата се загрява със спиртна лампа.
В резултат на нагряване се образува меден сулфат (меден сулфат), вода и серен диоксид, които с помощта на специална тръба трябва да бъдат доведени до конуса с чиста вода, По този начин може да се получи сярна киселина.
Не забравяйте, че серен диоксид е вреден за хората. Той причинява увреждане на дихателните пътища, загуба на апетит и главоболие. Продължителното вдишване може да доведе до припадък. Когато работите с него, трябва да внимавате.
Използване на сярна киселина
Сярната киселина има антисептични свойства. Използва се за дезинфекция на повърхности, ферментация на зърно. Може да се използва за избелване на някои вещества, които се разлагат, когато реагират със силни окислители (например хлор). Такива вещества включват вълна, коприна, хартия и някои други. Неговите антибактериални свойства се използват за предотвратяване на ферментацията на вино в бъчви. Така една благородна напитка може да се съхранява за много дълго време, придобивайки благороден вкус и уникален аромат.
Сярна киселина се използва при производството на хартия. Добавянето на тази киселина е включено в технологията за производство на сулфитна целулоза. След това се третира с разтвор на калциев хидросулфит, за да се свържат влакната.
