При свързване на 28 g силиций с кислород. Силиконови кислородни съединения
Основна разлика от въглерода: липсата на р връзки в съединенията Силициди. Съединения с водород (силани), окисление и хидролиза .Тетрафлуорид и силициев тетрахлорид, хидролиза. Силикати, разтворимост и хидролиза, естествени силикати и алумосиликати, зеолити, силициеви съединения, силикони и силоксани, използване на силициеви съединения в медицината.
силиций (лат. силиций), Si, химичен елемент от група IV на Периодичната система; атомно число 14, атомна маса 28.086. Силиконът също така показва sp3 хибридизация на електронни
орбитали. На външния електронен слой на силиконовия атом има валентност 3d-
орбитали (Si: 3s23p23d0),
Силиконът, след като кислородът е най-често срещаният елемент в земната кора. За разлика от въглерода в свободно състояние, силиций не се среща в природата. Най-често срещаните съединения са силициеви оксиди (IV) SiO2 и соли на силициеви киселини, силикати. Те образуват черупката на земната кора. Силиконови съединения се намират в растенията и животните. По химични свойства, силицийът, подобно на въглерода, е неметален, но неговата неметаличност е по-слабо изразена, тъй като има по-голям атомен радиус.
Силиконовата. образува съединения с почти всички метали - с ilitsidy (не са открити съединения само с Bi, Tl, Pb, Hg). Получени са над 250 силициди, чийто състав (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si и др.) Обикновено не съответства на класическите валенти. Силицидите се различават по огнеупорност и твърдост; феросилиций (редуциращ агент при топене на специални сплави, виж Феросплави) и молибденов силицид MoSi2 (нагреватели на електрически пещи, лопатки на газови турбини и др.) имат най-голямо практическо значение.
Силан. Под действието на солна киселина върху силицидите най-простото водородно съединение на силиция е силанът SiH4:
Силанът е отровен газ с неприятна миризма, който се възпламенява спонтанно. въздуха
Те са реактивни и са силни редуциращи агенти.
реагират с вода при стайна температура:
SiH4 + 2H2O → SiO2 + 4H2,:
тетрафлуориден Силиконът се получава чрез флуориране на силициев диоксид с елементарен флуор.
Процесът на флуориране се провежда в два етапа в пламъчен реактор, насочвайки излишъка от елементарен флуор от 1-ви етап към 2-ри етап.
Техническият резултат е производството на силиций в непрекъснат режим с висок добив и качество на продукта.
Силициев тетрафлуорид SiF4 се образува от действието на флуороводородна (флуороводородна) киселина върху стъкло:
Na2Si03 + 6HF2NaF + SiF4 + 3H2O
Силиконови кислородни съединения
Най-важното кислородно съединение на силиция е силициевият диоксид SiO2 (силициев диоксид), който има няколко кристални модификации.
Нискотемпературната модификация (до 1143 К) се нарича кварц. Кварцът има пиезоелектрични свойства. Естествени сортове кварц: скален кристал, топаз, аметист. Сортовете от силициев диоксид са халцедон, опал, ахат. яспис, пясък.
Силициев диоксид е химически устойчив; повлиява се само от флуорни, флуороводороди и алкални разтвори. Лесно преминава в стъкловидно състояние (кварцово стъкло). Кварцовото стъкло е крехко, много химически и термично устойчиво. Съответната силициева киселина SiO2 няма специфичен състав. Обикновено, силициевата киселина се записва като xH20-ySiO2. Бяха избрани силициеви киселини: H2SiO3 (H2O-SiO2) - мета силиций (три-оксо-силиций), H4Si04 (2H20-Si02) - орто-силиций (тетра-оксо-силиций), H2Si2O5 (H2O * SiO2) - диметичен силиций.
Силициевите киселини са слабо разтворими вещества. В съответствие с по-малката металоидна природа на силиция в сравнение с въглерода, H2SiO3 като електролит е по-слаб от H2CO3.
Съответстващите на силициевите киселини соли-силикати във водата са неразтворими (с изключение на алкални метални силикати). Разтворимите силикати се хидролизират чрез уравнението
2SiO3 - + Н20 = Si2O52- + 20Н-.
Концентрираните разтвори на разтворими силикати се наричат течно стъкло. Обичайният прозоречен стъклен силикат от натрий и калций има състав от Na20-CaO-6Si02. Получава се чрез реакция
Известно е голямо разнообразие от силикати (по-точно, оксосиликати). В структурата на оксосиликати се наблюдава определена закономерност: всички те се състоят от Si04 тетраедри, които са свързани помежду си чрез кислороден атом. Най-често срещаните комбинации от тетраедри са (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), които, като структурни единици, могат да бъдат комбинирани в вериги, панделки, мрежи и скелети (Фиг. 4).
Най-важните природни силикати са например талк (3MgO * H20-4Si02) и азбест (SmgO * H2O * SiO2). Както при SiO2, стъкленото (аморфно) състояние е характерно за силикатите. С контролираната кристализация на стъклото е възможно да се получи фино кристално състояние (sitalls). Седалките се характеризират с повишена здравина.
Освен силикати, алуминосилиците са широко разпространени в природата. Алумосиликати - рамкови оксосиликати, в които част от силициевите атоми е заменена с тривалентна Al; например Na12 [(Si, Al) 04] 12.
За силициевата киселина е характерно колоидно състояние, когато солите на киселина H2SiO3 не се повлияват незабавно. Колоидни разтвори на силициева киселина (золи) при определени условия (например при нагряване) могат да бъдат превърнати в прозрачен, хомогенен гелообразен мас-гел на силициева киселина. Геловете са високомолекулни съединения с пространствена, много хлабава структура, образувана от молекули SiO2, чиито кухини са запълнени с молекули H2O. При дехидратиране на силикагел се получава силикагел - порест продукт с висока адсорбционна способност.
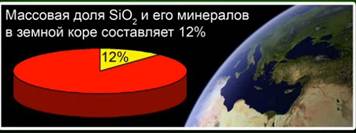
Силициев оксид (IV) (силициев диоксид) - най-често срещаното съединение в земната кора, съставляващо 12% от масата му под формата на различни минерали. Различават кристалния и аморфния силициев диоксид. Най-простата формула за силициев оксид (IV) е SiO2. Кристализира се в атомната решетка.
1) Кристален силициев диоксид - под формата на минерал от кварц и неговите разновидности (скален кристал, халцедон, ахат, яспис, кремък); Кварцът е в основата на кварцовите пясъци, широко използвани в строителството и в силикатната промишленост.
2) Аморфен силициев двуокис - под формата на минерален минерален състав SiO2 nH2O; земните форми на аморфен силициев диоксид са диатомит, Триполи (инфузорна земя); Пример за изкуствен аморфен безводен силициев диоксид е силикагел, който се получава от натриев метасиликат:
Na2Si03 + 2HCl = 2NaCl + H2SiO3
Силикагелът има развита повърхност, поради което добре абсорбира влагата.
Силикагел е сух гел, образуван от свръхнаситен разтвор на силициева киселина (nSiO2 · mH20) при рН\u003e 5-6. Твърд хидрофилен сорбент.
приемане
Получава се чрез подкисляване на разтвори на алкални метални силикати, последвано от промиване и изсушаване на образувания гел:
Силициева киселина. SiO2 е анхидридът на редица силициеви киселини
Силициевата киселина е изградена от тетраедрични структурни единици (във всяка такава единица силициевият атом е в центъра на тетраедъра, а кислородните атоми са разположени на върховете). Структурните връзки, обединяващи се във вериги, образуват по-стабилни полисиликонови киселини:
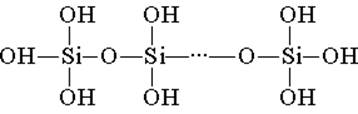
Съставът на такова съединение може да бъде изразен чрез формулата (H2SiO3) n. Въпреки това, силициевата киселина обикновено е представена с формулата H2SiO3. H2SiO3 - киселината е много слаба, слабо разтворима във вода. При нагряване лесно се разлага по същия начин като въглеродната киселина:
Всички силициеви киселини са много слаби (по-слаби от въглищата).
силикати, Солите на всички силициеви киселини се наричат силикати, въпреки че, като правило, в учебната литература, силикатите означават соли на метакристална киселина. Техният състав обикновено се представя с формулата под формата на съединения на оксиди на елементи. Например, калциевият силикат CaSi03 може да се изрази като: CaO х Si02.
Силикатите със състав R2O х nSiO2, където R2O е натриев или калиев оксид, се наричат разтворимо стъкло и техните концентрирани водни разтвори се наричат течно стъкло. Най-важното е разтворимото натрий стъкло.
Когато стоят във въздуха, разтворите на силикатите стават мътни, тъй като въглеродният диоксид (IV) във въздуха измества силициевата киселина от нейните соли:
Силициевата киселина е практически неразтворима във вода - това свойство се използва като качествена реакция към йона SiO32-.
Силикати се получават чрез стопяване на силициев диоксид с алкали или карбонати:
Разтворимост на силициева киселина и скоростта на разтварянето му зависи от няколко фактора, от които най-важни са модифицирането на взетия силициев диоксид, неговата степен на дисперсия и температура. При разклащане на силикагел с вода, равновесието на разтворимостта се установява за няколко часа, в случай на кварц са необходими много месеци и дори години.
ПРИРОДНИ СИЛИКАТИ (от латински. silex, род. случай на силицис - кремък * а. естествени силикати; N. naturliche Silikate; F. силикати природата; и. silicatos naturales) - клас минерали, соли на силициеви, изо- и хетерополикарминови киселини. Делът на естествените силикати представлява до 75% от масата на земната кора и около 25% от минералните видове. В природата са известни повече от 700 природни силикати, включително най-важните скално-образуващи минерали (фелдшпати, пироксини, амфиболи, слюди и др.)
алуминосиликати - група от естествени и синтетични силикати, чиито комплексни аниони съдържат силиций и алуминий. Примери за сложни аниони: -, -, 2 -. Na +, K +, Mg2 +, Са2 +, а понякога и Ba2 + и Li + действат като катиони.
Природните алуминосилати са най-често срещаните минерали, те представляват до 50% от масата на земната кора. Те включват фелдшпати (албит, ортоклаз, анортит), глинести минерали и слюда.
зеолити - Това са водни алумосиликати на калций, натрий, калий, барий и някои други елементи. Групата зеолити включва повече от четиридесет минерала, които се различават по състав (особено по броя на водните молекули в кристалния хидрат) и разбира се по физични и химични свойства. Но почти всички представители на тази група минерали имат обща характеристика - те са добри сорбенти, притежават йонно-обменни свойства, способни са да променят подвижността на отделните йони и да работят като молекулярни сита. И сравнително наскоро тези минерали са открили напълно неочаквана употреба - те започват да се използват в селското стопанство.
Органични силиконови съединения - съединения, в чиито молекули има връзка между атомите на силиций и въглерод. Органосиликоновите съединения понякога се наричат силикони, от латинското наименование "силиций". Органичните силиконови съединения се използват за производството на смазочни материали, полимери, каучуци, каучуци, силиконови течности и емулсии. Органични силиконови съединения се използват в козметиката, битовата химия, бои и лакове, детергентите. Отличителна черта на продуктите на основата на силициево-силициеви съединения от продукти на основата на обикновени органични съединения, като правило, са по-високи експлоатационни характеристики и характеристики, както и безопасността на човешката употреба. Силиконовите полимери могат да се използват за приготвяне на форми за готвене. Полимеризацията на крем-силициевите съединения и уплътнителите е безопасна за хората и не изисква екстракция.
силоксан - съединения, съдържащи променливи атоми на силиций и кислород в молекулата. Най-високите имат силоксани с високо молекулно тегло - полиорганосилоксани; виж Силиконови полимери.
силикони (полиорганосилоксани) - окислени високомолекулни органосиликонови съединения с химична формула п, където R = органична група (метил, етил или фенил). Сега тази дефиниция се прилага изключително рядко, а полиорганосилоксаните (например, силиконови масла тип PMS, водоотблъскващи средства тип NGL или SKTN каучуци с ниско молекулно тегло) и дори органосиликонови мономери (различни силани) също се комбинират в "силикони", изтривайки разликата между "силикони" и " силикон. "
Метален силиций  Кристален силиций
Кристален силиций
силиций (Si). Този химичен елемент е 1/4 от състава на земната кора. Кварц, скален кристал, пясък, глина, гранит, слюда, азбест - всичко това химични съединения на силиций
Силиконът е междинен елемент (амфотер) и може да показва както метални, така и неметални свойства. Той може да образува химически съединения, както с метали, така и с неметали.
Чист силиций - химически проста субстанция от сив цвят, твърда, огнеупорна и чуплива. Кристален силиций Той има метален блясък и се използва широко в производството на полупроводници (той е полупроводник).
Силиконът може да се разтегне като в кристално състояние ( кристален силиций), и в аморфно състояние ( аморфен силиций). Кристалният силиций се образува чрез охлаждане на разтвор на аморфен силиций в стопен метал. От своя страна кристалният силиций е много крехък материал и лесно се натрошава в аморфен прах. По този начин, аморфен силиций е фрагмент от кристали от кристален силиций.
В свободното състояние, силиций е доста трудно да се получи. Неговото промишлено производство е свързано с възстановяването на кварц, чиято химична формула е SiO2, редукционната реакция се произвежда от горещ кокс (въглерод).
Si02 + C → CO 2 + Si
В лабораторията чистият силиций се редуцира от кварцов пясък с метален магнезий, като се използва следната реакция:
SiO2 + 2Mg → Si + 2MgO.
По време на тази реакция се образува кафяв прах от аморфен силиций. При нагряване прахът може да реагира бавно с концентрирани разтвори на алкали (например натриев хидроксид NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - полученото комплексно вещество - наричано също течно стъкло.
Интересно е, че химичната активност на силиция зависи от размера на неговите кристали. Съкристалният силиций е по-малко химически активен от аморфния. Последният реагира лесно с флуор дори при обикновена температура и при температура от 400 - 600 ° С реагира с кислород, хлор, бром, сяра, за да образува съответните химични съединения. При много високи температури силицийът реагира с азот и въглерод, за да образува съответно нитрид и силициев карбид.
Ако се опитате да разтворите силиций в смес от флуороводородна HF (флуороводородна) и азотна HNO 3 киселини, реакцията няма да продължи. Но ако провеждате химична реакция с алкална, например, с калиев хидроксид, тогава реакцията ще се осъществи с образуването на сол на силициева киселина
Si + KOH → K2Si03 + Н2
Ако се калцинира в пещния силициев диоксид (пясък) с кокс, се оказва много твърдо кристално вещество. карборунд SiC
Si02 + 3C → SiC + 2СО
карборунд - много твърдо и огнеупорно вещество. В индустрията се произвежда в големи количества поради тези свойства. Интересно е, че кристалната решетка на карборунда е подобна на решетката на най-твърдата субстанция - диамант, но в нея отделните въглеродни атоми са равномерно заменени от силициеви атоми.
При високи температури, както и по време на химични реакции под действието на киселини върху метални съединения със силиций, силан SiH4.
Cilan - това е самовъзпламеняващ се безцветен газ. Може да се запали във въздуха, за да образува силициев диоксид и вода.
SiH4 + 20 2\u003e → Si02 + 2H2O
Ако силициевият оксид SiO 2 се загрява в присъствието на въглерод в поток от хлор, се получава химическа реакция с образуването на силициев хлорид.
Si02 + 2С + 2С1 2 → SiCl 4 + 2СО
Силициев хлорид - течност, температурата на кипене от която е само 54 0 С. Силициевият хлорид се разтваря лесно във вода с образуването на разтвор от две киселини: силициева и солна \\ t
SiCl4 + Н20 → Н2 SiO3 + НС1
Ако тази химическа реакция протича в атмосфера на влажен въздух, при образуването на две киселини ще се появи гъст дим.
Силициев флуорид SiF 4 - образува се в резултат на химическа реакция на флуороводородна киселина и силициев оксид
Si02 + 4HF → SiF4 + 2H2O
Силициевият флуорид е безцветен газ с "силна" миризма. Както и силициев хлорид, във водата този газ образува две киселини: силиций и флуороводородна. Но интересно е, че силициевият флуорид може да взаимодейства с флуороводородна киселина хексафлуоросилициева киселина чиято химична формула е Н2 SiF6. Солите и самата киселина са отровни.
силиций
Неблагородни метали и неметали
В този урок ще изучите темата „Силикон“. Обмислете информация за силиция: неговата електронна структура, където силицийът е в природата, изучават силиконовата алотропия, обясняват неговите физични и химични свойства. Научете къде се използва силиций в промишлеността и други области, как се произвежда. Ще се запознаете със силициевата киселина, силициевата киселина и нейните соли - силикати.
Тема: Неблагородни метали и неметали
Урок: Силикон. Благородни газове
Силиконът е един от най-често срещаните химически елементи в земната кора. Съдържанието му е почти 30%. В природата се среща главно под формата на различни форми на силициев диоксид, силикати и алуминосиликати.
Силиконът е четиривалентен в почти всичките му съединения. В този случай, атомите на силиция са в възбудено състояние. Фиг. 1.
За да влезе в това състояние, един от 3s електроните заема вакантно място на 3p орбиталите. В този случай вместо 2 несдвоени електрона в основното състояние, силициевият атом в възбуденото състояние ще има 4 несдвоени електрона. Той ще може да образува 4 ковалентни връзки чрез обменния механизъм.


Силиконовите атоми не са склонни към образуване на множествени връзки, а образуват съединения с единични връзки-Si-O-. Силиконът, за разлика от въглерода, не е типичен за алотропия.
Един от алотропната модификация е кристален силицийв която всеки силициев атом е в sp3 хибридизация. Фиг. 2, 3. Кристалният силиций е твърдо, огнеупорно и трайно кристално вещество от тъмно сиво с метален блясък. При нормални условия - полупроводник. Понякога аморфният силиций се излъчва и като друга алотропна модификация на силиция. Той е тъмно кафяв прах, по-химически активен от кристалния силиций. Дали това е алотропна модификация е спорна точка.
Химични свойства на силиций
1. Взаимодействие с халогени
Si + 2F2 → SiF4
2. При нагряване силиций изгаря в кислород, образува се силициев диоксид (IV).
Si + O2 → SiO2
3. При високи температури силиций взаимодейства с азот или въглерод.
3Si + 2N2 → Si3N4
4. Силиконът не реагира с водни разтвори на киселини. Но се разтваря в алкали.
Si + 2NaOH + Н20 → Na2Si03 + 2H2
5. При смесване на силиций с метали се образуват силициди.
Si + 2Mg → Mg 2 Si
6. Силиконът не взаимодейства директно с водорода, но водородните съединения на силиция могат да се получат чрез взаимодействие на силициди с вода.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (силан)
Силаните са сходни по структура с алканите, но са значително реактивни. Най-стабилният моносилан е запалим във въздуха.
SiH4 + 2O2 → Si02 + 2H2O
Получаване на силиций
Силиконът се получава чрез редукция от силициев оксид (IV)
SiO2 + 2Mg → Si + 2MgO
Една от задачите е да се получи силиций с висока чистота. За тази цел технически силикон се прехвърля в силициев тетрахлорид. Полученият тетрахлорид се редуцира до силан и силанът се разлага на силиций и водород при нагряване.
Силиконът може да образува два оксида: SiO2 - силициев оксид (IV) и SiO - силициев оксид (II).
сиО - силициев оксид (II) - това е аморфно тъмнокафяво вещество, което се образува от взаимодействието на силиций с силициев оксид (IV)
си + SiO 2 → 2 SiO.
Въпреки стабилността си, това вещество почти не се използва.
сиО2 - силициев оксид (IV)


Това вещество представлява 12% от земната кора. Фиг. 4. Представен е от минерали като скален кристал, кварц, аметист, цитрин, яспис, халцедон. Фиг. 5.
SiO2 - силициев оксид (IV) - вещество с немолекулна структура.
Нейната кристална решетка е атомна. Фиг. 6. Кристалите на SiO 2 имат формата на тетраедър, които са свързани помежду си с кислородни атоми. Формулата на молекулата (SiO2) n би била по-правилна. Тъй като SiO 2 образува вещество с атомна структура, а CO 2 - на молекулярна структура, разликата в техните свойства е очевидна. CO 2 е газ, а Si02 е твърдо прозрачно кристално вещество, неразтворимо във вода и огнеупорно.
Химични свойствасиОколо 2
1. Силициев оксид (IV) Si02 е киселинен оксид. Не реагира с водата. Силициевата киселина не може да бъде получена чрез хидратиране на SiO 2. Нейните соли, силикати могат да бъдат получени чрез взаимодействие на SiO2 с горещи алкални разтвори.
Si02 + 2NaOH Na2Si03 + Н20
2. Реагира с карбонати на алкални и алкалоземни метали.
СаС03 + Si02 CaSiO3 + СО2
3. Взаимодейства с метали.
SiO2 + 2Mg → Si + 2MgO
4. Реакция с флуороводородна киселина.
Si02 + 4HF → SiF4 + 2H2O
SiF4 + 2HF → Н2
Химични свойства на силициева киселина и силикати
Получаване на силициева киселина
Силициевата киселина се утаява като полимерно съединение. Формули на силициевата киселина -
H 2 SiO 3 (мета форма) и Н 4 SiO 4 (орто форма) - отразяват съотношението на елементите, но не и истинския състав. Обикновено в равнината съставът на силициевата киселина е изобразен като фиг. 7.
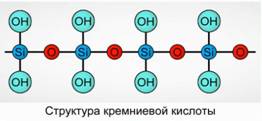
За силициева киселина винаги се използва формулата H 2 SiO 3.
1. Н 2 SiO 3 разлага при нагряване
H 2 SiO 3H 2 O + SiO 2 (силикагел)
2. Взаимодейства с алкални разтвори
H2Si03 + 2NaOH Na2Si03 + 2H2O
Соли на силициевата киселина - силикати - отнася се за йонни съединения. Това са твърди безцветни вещества. Само силикати на алкални метали, с изключение на литий, са разтворими във вода.
1. Разтворимите силикати се хидролизират от анион
Na2Si03 + H20O NaHSio 3 + NaOH
2. Разтворимите силикати взаимодействат със силни киселини.
Na2Si03 + 2HCl → H 2 SiO 3 + 2NaCl
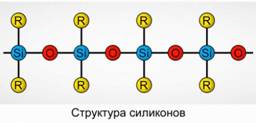
Полиорганосилоксани (силикони)
Полиорганосилоксани (силикони) са окислени, високомолекулни силициеви съединения.
R 2 [ SiO] п
R е органична група (метил, етил или фенил). Основата на структурата на силоксаните е верига от редуващи се силициеви атоми и кислород. Фигура 8. Чрез промяна на дължината на веригата и органичните групи могат да се получат силикони с различни свойства. Чрез промяна на условията на полимеризация, можете да получите молекули с различна дължина.


Полимерите с къса верига са течности, по-дългите са ценни смазочни материали. Фиг. 9, които запазват своите свойства в огромен температурен диапазон от
100 0 С до + 300 0 С. По-дългите молекули образуват гуми, които не губят своята еластичност при ниски температури. Притежават висока устойчивост на износване, са химически инертни. Фиг. 10. Той причинява различни варианти на тяхното приложение. Те могат да бъдат използвани за създаване на изкуствени сърдечни или бъбречни машини и могат да се използват като обувки за обувки. Силоксановите полимери се използват в медицината за създаване на различни импланти на меки тъкани, тъй като такива полимери са химически инертни и не се отхвърлят от организма. Те не се навлажняват с вода. Използва се в кремове. Когато се прилага този крем върху ръцете си, той ще замени гумените ръкавици.
Неорганична градина
В прозрачна чаша, напълнена с натриев силикат, потопете кристалите от оцветени соли, като меден сулфат. След известно време може да се види, че тънките кухи тръби са образувани от кристалите, които се състоят от неразтворими силикати. Фиг. 11.

Получаване на "глупаво" замазка
Равни обеми натриев силикат и медицински алкохол са смесени. Утайката се филтрира и се изцежда така, че да не се капе алкохол. Това е замазка. Фиг. 12. Нарича се така, защото е планирано да се използва като шпакловка за прозорци. Но се оказа, че той има такива свойства, че не може да се използва по предназначение. Ако хвърлите топката и я хвърлите на пода, тя ще се отскочи като гумена топка. Ако се постави на масата, тя ще се разпространи като течност. Ако ударите твърд предмет, той ще се разбие като твърдо тяло. След известно време, когато алкохолът изсъхне, тази шпакловка просто ще се разпадне.
![]()
Обобщаване на урока
В този урок сте изучавали темата „Силикон“. Разгледахме информация за силиций: неговата електронна структура, където силицийът се намира в природата, изучава алотропията на силиция, обяснява неговите физични и химични свойства. Те научиха къде се използва силиций в промишлеността и други области, как се произвежда. Срещали сте със силициев двуокис, силициева киселина и нейните соли - силикати.
Позоваването
1. Rudzitis G.E. Химия. Основи на общата химия. 11 клас: учебник за образователни институции: основно ниво / G.E. Rudzitis, F.G. Фелдман. - 14-то изд. - М .: Просвещение, 2012.
2. Popel P.P. Химия: 8 кл. Учебник за средни училища / ПП. Popel, L.S. - К .: ИЦ "Академия", 2008. - 240 с .: Ил.
3. Габриелян О.С. Химия. 11 клас. Основно ниво. 2nd ed., Sr. - М .: Дрофа, 2007. - 220 с.
домашна работа
1. №№2-4 (стр. 138) Рудзитис Г.Е. Химия. Основи на общата химия. 11 клас: учебник за образователни институции: основно ниво / G.E. Rudzitis, F.G. Фелдман. - 14-то изд. - М .: Просвещение, 2012.
2. Какви са приложенията на полиорганосилоксани.
3. Сравнете свойствата на алотропните модификации на силиция.
