Схема на структурата на силиция. Електронна черупка
Атомна структура Позиция в PS: Период III; група IV, водеща; Зареждане на ядрото: +14 Si; Относителна атомна маса: Ar (Si) = 28 Атомна структура: p = 14, e = 14, n = = 14 Електронна формула: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Неметал;
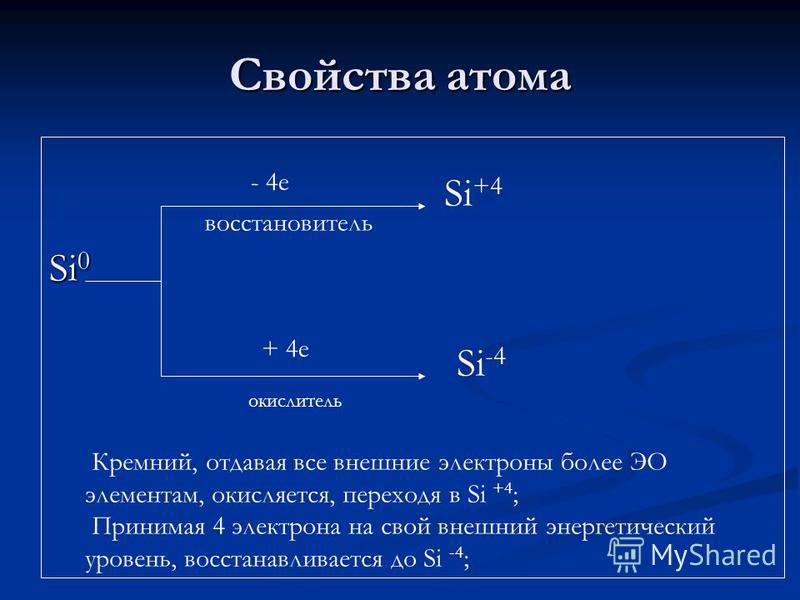
Атомни свойства Si e редуктор + 4 e окислител Si + 4 Si -4 Силиций, който дава на всички външни електрони повече ЕО елементи, се окислява, преминавайки в Si + 4; Приемайки 4 електрона до външното си енергийно ниво, той се свежда до Si-4;

Физични свойства на силиций Силиконът е неметален, съществува в кристално и аморфно състояние. Кристалният силиций е сиво-стоманена субстанция с метален блясък, много твърд, но крехък. Аморфен силиконово-кафяв прах. р = 2.33 g / стз; t pl. = С; t kip. = С;

Кристална структура на силиция Кристалната решетка от силиций е кубичен диамант с центрирано лице. Но поради по-дългата дължина на връзката между Si-Si, твърдостта на силиция е значително по-малка от тази на диаманта. Силиконът е крехък, само когато се нагрява над C.

Електрофизични свойства Елементарен силиций Елементарният силиций е типичен полупроводник. типичен полупроводник. Електрофизичните свойства на кристалния силиций се влияят силно от съдържащите се в него следи от примеси. За получаване на монокристали от силиций с дупка проводимост, в силиция се въвеждат добавки на елементи от 3-та група бор, алуминий, галий и индий, с електронна проводимост с добавяне на елементи от петата група фосфор, арсен или антимон.


Флинт Флинт, този Флинт, този грозен и много грозен и много издръжлив камък, издръжлив камък, положи основите за каменното начало на каменната ера - века - векът на кремъчните работни инструменти. кремъчни инструменти. Има две причини: - разпространението и наличието на силиций; - разпространението и наличието на силиций; - способността за оформяне на остри ръбове при рязане; - способността за оформяне на остри ръбове при рязане;




Знаете ли, че .. Методът за получаване на силиций в чист вид е разработен от Николай Николаевич Бекетов. Силиконът в Русия се произвежда във фабрики: Каменск - Уралски (Свердловска област), Каменск - Уралски (Свердловска област) Шелех (Иркутска област). Шелех (Иркутска област).

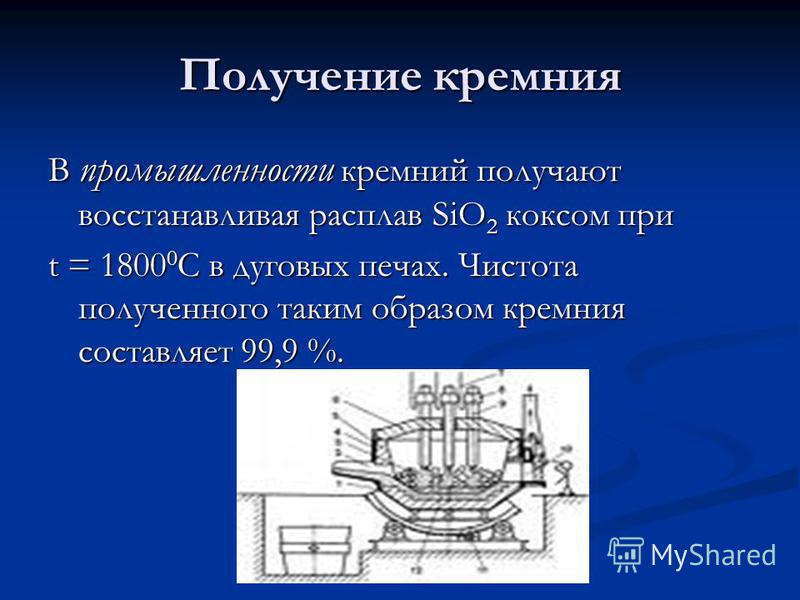
Производство на силиций В индустрията, силиций се получава чрез намаляване на стопилката на SiO 2 чрез кокс при t = C в дъгови пещи. Чистотата на така получения силикон е 99.9%.
Получаване на силиций Лабораторен метод на производство: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Химични свойства на силиций При нагряване до 400 ° C силицийът реагира с кислорода за образуване на силициев диоксид: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
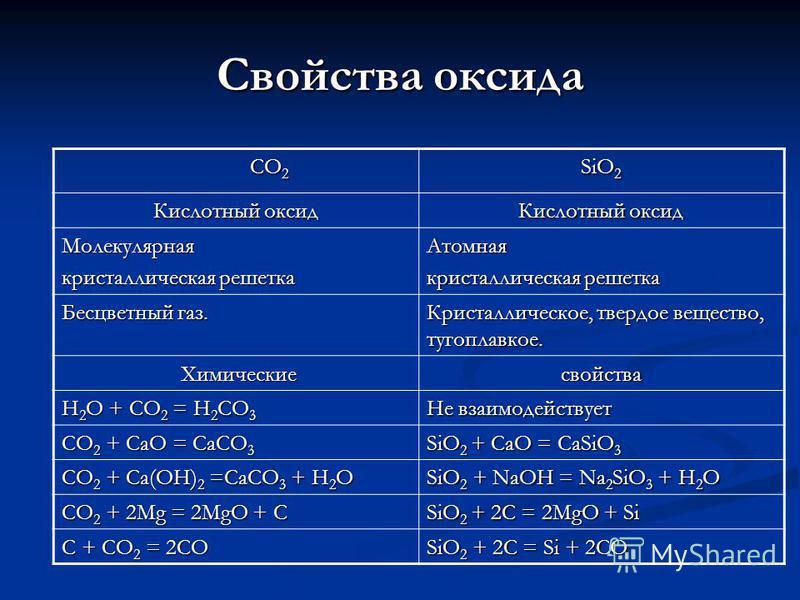
Свойства на CO 2 CO 2 SiO 2 оксид Киселинен оксид Молекулна кристална решетка Атомно безцветен газ. Кристални, твърди, огнеупорни. Химични химични свойства H 2 O + CO 2 = H 2 CO 3 Не реагира CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Свойства на киселини H 2 CO 3 H 2 SiO 3 двуосновни, съдържащи кислород, слаби, крехки, тъй като бухалка. Двуосновен, съдържащ кислород, слаб, неразтворим във вода. Получаване: CO 2 + H 2 O = H 2 CO 3 Получаване: SiO 2 + H 2 O = не може да бъде нестабилно, крехко, разлага се при стояне или нагряване: H 2 CO 3 = CO 2 + H 2 O Не може да се избере в чист вид, защото разлага се при нагряване: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Малка еволюция на газа __________

Въглеродни киселини от силициева киселина - карбонати; - въглеводороди; - силикати; - силикати; Карбонатите имат всички свойства на соли, са силни електролити, напълно дисоциират в йони (разтворими във вода). Само соли на алкални метали са разтворими, а останалите образуват неразтворими или не образуват соли изобщо (А1 + 3, Cr + 3, Ag +).
![]()



Биологична роля Най-важното силициево съединение SiO 2 е от съществено значение за растителния и животинския свят. Благодарение на него, тръстиката, тръстиката Благодарение на него, тръстиките, тръстиката и стършелите стоят твърдо като щикове. и стръкните стършели, като щипките. Остри листа от острица, нарязани като остри листа от острица, нарязани като ножове, стърнище на косени полеви ножове, стърнище на косени полеви убождания като игли, и стъбла на зърнени култури се придържат като игли, а стеблата на зърнените култури са толкова силни, че не позволяват толкова силно, че Не позволявай на нивата да падне от дъжда и полето на вятъра в полето, за да отиде от дъжда и вятъра


Силиконът е микроелемент, който постоянно се съдържа в човешкото тяло. Най-голямото количество се съдържа в лимфните възли, съединителната тъкан на аортата, трахеята, косата и кожата. Силиконът е необходим за изграждане на епителни клетки. Силиконът е микроелемент, който постоянно се съдържа в човешкото тяло. Най-голямото количество се съдържа в лимфните възли, съединителната тъкан на аортата, трахеята, косата и кожата. Силиконът е необходим за изграждане на епителни клетки. Силиконът играе важна роля в процеса на минерализация на костите; необходима за поддържане на еластичността на артериалната стена, има положителен ефект върху имунната система и забавя процеса на стареене в тъканите на човешкото тяло. Средното съдържание на силиций в кръвта е 8,25 mg / ден. С възрастта нивото му в тялото намалява, така че при възрастните хора нуждата от силиций има тенденция да се увеличава. Подобряване на абсорбцията на силиций от организма в присъствието на калций, магнезий, манган и калий. Силиконът играе важна роля в процеса на минерализация на костите; необходима за поддържане на еластичността на артериалната стена, има положителен ефект върху имунната система и забавя процеса на стареене в тъканите на човешкото тяло. Средното съдържание на силиций в кръвта е 8,25 mg / ден. С възрастта нивото му в тялото намалява, така че при възрастните хора нуждата от силиций има тенденция да се увеличава. Подобряване на абсорбцията на силиций от организма в присъствието на калций, магнезий, манган и калий.

Биологичната роля на силиция е включена и в състава на по-нисшите живи организми - диатомеи и радиоларии - най-деликатните бучки жива материя, които създават техните ненадминати красоти скелети, изработени от силициев диоксид. Силиконът също е част от по-ниските живи организми - диатомеи и радиоларии - най-деликатните бучки жива материя, които създават ненадминатата си красота на скелетите със силициев двуокис. Diatoms Radiolaria Самоконтрол 1. Какво е мястото на силиция в периодичната система: a) 2 период, 4 og. б) 3 период, 3 гр. глава. в) 3 период, 4 гр. глава) 2 период, 4 гр. б) 3 период, 3 гр. глава. в) 3 период, 4 гр. глава. 2. Силициева решетка: а) йонна; б) атомни; c) молекулярно; а) йонни; б) атомни; c) молекулярно; 3. Според разпространението в природата на силиций ... елемент: а) първи; б) втората; в) третата; а) първата; б) втората; в) третата; 4. Силиконът реагира с: а) метали, водород, халогени; а) метали, водород, халогени; б) метали, халогени, лесно разтворими в основи; б) метали, халогени, лесно разтворими в основи; в) оксиди, киселини, неметали. в) оксиди, киселини, неметали. 5. Соли на силициевата киселина: а) силициди; b) хидросиликати; в) силикати; а) силициди; b) хидросиликати; в) силикати;

Силиконовата.
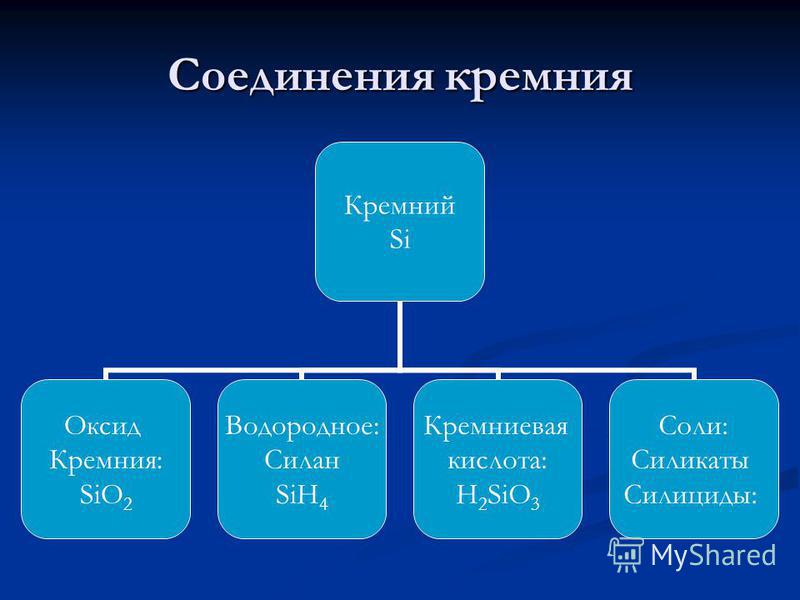
силиций - елемент от основната подгрупа IV от групата на третия период на периодичната система от химични елементи Д. И. Менделеев, с атомно число 14, атомна маса: 28.0855, В съединенията той обикновено проявява степен на окисление от +4 (валентност IV) и много рядко +3, +2 и +1 (валенции, съответно, III, II и I). В периодичната таблица, силиконът на Менделеев се намира в група IVA (А - показва, че това е основната подгрупа) (в въглеродната група), през третия период. неметал , Обозначен със символ си(шир. Силициевият). В свободна форма - кафяв прах или светлосив компактен материал с метален блясък. Решетъчна структура: кубичен, диамант.
Основно състояние: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-елемент.
2. Физични свойства.
Кристалният силиций е тъмно сиво вещество със стоманен блясък. Структурата на силиция е подобна на структурата на диаманта. В своя кристал всеки атом е заобиколен от четири тетраедрични и е свързан с тях чрез ковалентна връзка, която е много по-слаба, отколкото между въглеродните атоми в диаманта. В силициев кристал, дори при нормални условия, някои от ковалентните връзки се разрушават. Затова има свободни електрони, които причиняват малка електрическа проводимост. Когато осветлението и отоплението увеличават броя на счупените връзки, това означава, че броят на свободните електрони се увеличава и електрическата проводимост нараства. Така трябва да се обяснят полупроводниковите свойства на силиция.
Силиконът е много крехък, плътността му е 2,33 g / cm3. Подобно на въглищата, се отнася до огнеупорни вещества.
Силиконът се състои от три стабилни изотопа: 2814Si (92.27%), 2914Si (4.68%) и 3014Si (3.05%).
3. Да си в природата.
Най-често в природата се намира силиций във формата силициев двуокис - съединения на основата на силициев диоксид (IV) SiO2 (около 12% от масата на земната кора). Основните минерали и скали, образувани от силициев диоксид, са пясък (река и кварц), кварц и кварцит, кремък и фелдшпат. Естествените силикати имат сложен състав и структура. Ето състава на някои естествени силикати:
ü фелдшпат K 2 O × Al 2 O 3 × 6SiO 2,
Ь азбест 3MgO × 2SiO 2 × 2H2O,
m 2 K 2 O × 3Al 2O 3 × 6SiO 2 × 2H2O,
Ь каолинит 3Al2O3 × 2SiO2 × 2H2O.
Втората най-често срещана група от силициеви съединения е силикати и алумо-силикати.
Отбелязани са единични факти за намиране на чист силиций в естествената форма.
4. Химични свойства на силиций и неговите съединения.
По химични свойства силиконът, подобно на въглерода, е неметален, но неговата неметаличност е по-слабо изразена, тъй като има по-голям атомен радиус. Тъй като атомите на силиция имат 4 електрона на външното енергийно ниво, окислителното състояние на -4 и +4 е характерно за силиций (известно е силициево съединение, където степента на окисление е +2).
Силиконът при нормални условия е по-скоро инертен, което трябва да се обясни със силата на нейната кристална решетка. Тя пряко взаимодейства само с флуор:
киселини (с изключение на смес от флуороводородна HF и азотна HNO 3)силиций не действа. Въпреки това, той се разтваря в хидроксиди на алкални метали, образувайки силикат и водород:
От двете алотропни модификации на силиций, кристален и аморфен, аморфният силиций е по-химически активен. Той реагира с кислород при нагряване, образувайки SiO 2:
както и с всички халогенинапример:
![]()
При висока температура силиций свързва с въглеродформиране на карборунда SiC:
Carborundum има кристална решетка с диамант, в която всеки силиконов атом е заобиколен от четири въглеродни атома и обратно, а ковалентните връзки са много силни, както в диаманта. Следователно, в твърдостта е близо до диаманта. Шлифовъчните камъни и шлифовъчните дискове са направени от силициев карбид.
Магнезиев силицид. В реакции с активни метали, настъпващи с образуването на силицид Силиконът действа като окислител:
При високи температури силицийът възстановява много метали от техните оксиди (!!!)
Силан. Под действието на солна киселина върху силицидите най-простото водородно съединение на силиция е силан SiH 4:
Силанът е отровен газ с неприятна миризма, самовъзпламеняващ се във въздуха (!!!):
Силициев оксид (IV).Нарича се също силициев оксид (IV) силициев двуокис. Той е твърдо огнеупорно вещество. (точка на топене 1700 ° С) широко разпространен в природата в две форми:
1) кристален силициев диоксид - под формата на минерал от кварц и неговите разновидности (скален кристал, халцедон, ахат, яспис, кремък); кварцът е в основата на кварцовите пясъци, широко използвани в строителството и в силикатната промишленост;
2) аморфен силициев диоксид - под формата на минерален минерален състав SiO 2 × п Н20; земните форми на аморфен силициев диоксид са диатомит, триполи (инфузорна земя); пример за изкуствен аморфен безводен силициев диоксид е силикагел, който се получава от натриев метасиликат:
Силикагелът има развита повърхност и следователно абсорбира добре влагата. .
При 1710 ° кварц се топи, С бързото охлаждане на стопената маса се образува кварцово стъкло , Той има много нисък коефициент на разширение, така че горещото кварцово стъкло не се напуква, когато водата бързо се охлажда. Лабораторната стъклария и инструменти за научни изследвания са направени от кварцово стъкло.
Най-простата формула на силициев оксид (IV) S02 е подобна на формулата на въглероден оксид (IV) CO 2. В същото време физическите им свойства са много различни (SiO2 - твърдо, CO 2 - газ). Тази разлика се дължи на структурата на кристалните решетки. C0 2 кристализира в молекулната решетка, SiO 2 - в атома. Структурата на SiO 2 в плоско изображение може да бъде представена, както следва:
Координационният номер на въглероден атом в твърд СО 2 е 2, а силиций в SiO2 е 4. Всеки силициев атом е затворен в тетраедър от 4 кислородни атома. В същото време силициевият атом е в центъра, а кислородните атоми са разположени във върховете на тетраедъра , Цялото парче силициев диоксид може да се разглежда като кристал, чиято формула е (SiO2) n. Тази структура на силициевия оксид (IV) определя неговата висока твърдост и огнеустойчивост .
Химични свойства на силициев оксид (IV) SiO2 се отнася до кисели оксиди. При сливането с твърди основи, основни оксиди и карбонати се образуват соли на силициевата киселина:
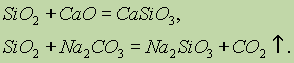
Само флуороводородна киселина взаимодейства със силициев оксид (IV):
Тази реакция се използва за ецване на стъкло. .
Силиконът (IV) не се разтваря във вода и не взаимодейства химически с него. (!!!) Следователно, силициевата киселина се получава индиректно чрез действие с киселина върху разтвор на калиев или натриев силикат:
В този случай, силициева киселина (в зависимост от концентрацията на първоначалните разтвори на сол и киселина) може да бъде получена както под формата на желатинова маса, съдържаща вода, така и под формата на колоиден разтвор (sol).
Силициева киселина. SiO2 е анхидридът на редица силициеви киселини, чийто състав може да бъде изразен чрез общата формула: xSiO 2 × yH 2 O, където x и y - числа:
1) х = 1, у = 1: Si02 х Н20, т.е. метасилициева киселина;
2) х = 1, у = 2: Si02 х 2Н2О, т.е. Н 4 SiO 4 - ортосилициева киселина;
3) х = 2, у = 1: 2SiO2 × H20, т.е. H 2 Si 2O 5 - биметакринова киселина.
Силициевата киселина е изградена от тетраедрични структурни единици (във всяка такава единица силициевият атом е в центъра на тетраедъра и има кислородни атоми в върховете). Структурните връзки, обединяващи се във вериги, образуват по-стабилни полисиликонови киселини:
Съставът на такива съединения може да бъде изразен чрез формулата (Н2 SiO3) n. Обикновено, силициевата киселина е представена с формула H2SiO3. H 2 SiO 3 - киселината е много слаба, слабо разтворима във вода. При нагряване лесно се разлага като въглена киселина:
Всички силициеви киселини са много слаби (по-слаби от въглищата).
Силикати. Призовават се солите на всички силициеви киселинисиликати, въпреки че, като правило, в образователната литература, силикати предполагат соли на метациловата киселина. Техният състав обикновено се представя с формулата под формата на съединения на оксиди на елементи. Например, калциев силикат CaSi03 може да се изрази като: СаО х Si02.
Силикатите от състава R 2 O × nSiO 2, където R 2 O - оксиди на натрий или калий , се наричат разтворимо стъкло , и техните концентрирани водни разтвори - течно стъкло . Най-важно е натриевото стъкло..
Когато стоят във въздуха, разтворите на силикатите стават мътни, тъй като въглеродният диоксид (IV) във въздуха измества силициевата киселина от нейните соли:
Силициевата киселина е практически неразтворима във вода - това свойство се използва като качествена реакция към йона SiO 3 2-.
Силикати се получават чрез стопяване на силициев двуокис с алкали или карбонати:
5. Откриване на йон SiO 3 2. (Не мога да намеря нищо ...)
6. Ролята на силиконовите съединения в почвообразуването и горското стопанство.
Магнитните скали са доста стабилни в състава си и съдържат предимно съединения от силиций, алуминий, желязо, алкали, магнезий и калций. Според съдържанието на Si0 2 магмените скали се разделят на четири групи: кисели (\u003e 65%), средни (52-65%), основни (40-52%) и ултрабазични (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Киселинни магмени скали- гранити, пегматити, риолити, дацит и други - обикновено имат лек и кафеникав цвят с изразени кристали на кварц, фелдшпат, слюда. Съдържанието на SiO 2 в тях е високо (повече от 65%) със значително количество калий и натрий. В същото време малкото желязо, калцийът и магнезият са незначителни. Почвите върху кисели магмени скали, например върху гранити, се различават в ранните етапи на изветряването чрез трошливост, чакълен характер на изходния материал. Когато са изветрели при влажни условия, те лесно губят алкалоземни елементи, в резултат на което почвата на такива изветрени субстрати (елувиум от скали) е изключително бедна, слабо плодородна.
Основни магмени скали -базалт, габро и др., като правило имат тъмен (до черен) цвят. Те се характеризират с по-ниско съдържание на SiO2 в сравнение с киселите скали. Основните магмени скали са относително богати на съединения от желязо, манган, хром, кобалт, цинк, титан, никел, мед. Продуктите на тяхното изветряване доста бързо придобиват глинен характер, дълго време запазват алкална и неутрална реакция и се отличават с повишено съдържание на хумусни и глинести минерали. Почвата върху такива скали е по-плодородна.
В допълнение към киселите и основните видове често се срещат магмени скали от преходен тип(средни) - интрузивни скали на диоритовата група и техните ефузивни аналози - андезити. Съответно, почвите на тези скали придобиват характеристики, подобни на тези, ограничени до киселинни или основни скали. Много по-рядко ултрабазични породи:перидотити и пикрити, които имат най-ниско съдържание на SiO2.
Метаморфни скали -преходни между масивни кристални и седиментни скали. Древните седиментни скали при гмуркане, високо налягане и температури са метаморфозирани, образувайки гнайси, серпентинити, мрамор, кварцити, шисти. Гнайси са особено сходни по състав с гранитите. Почвите, които се образуват на такива скали, имат сходни характеристики с почвите на самите киселинни магмени скали.
Хлор.
1. Положението на алуминия в таблицата Д. И. Менделеев. Структурата на атома, проявена степен на окисление.
хлор - елемент от основната подгрупа на VII групата, третия период, с атомно число 17. Той се обозначава със символа Cl (lat. Chlorum). Химически активна неметал . Включена в халогенната група .
Обикновено вещество хлор при нормални условия - отровният газ жълтеникаво-зелен цвят е по-тежък от въздуха, със силна миризма . Двуатомна хлорна молекула (формула Cl 2).
Основно състояние: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-елемент. Чл. -1 +1 +3 +5 +7.
Структурата на електронната обвивка.
При валентното ниво на хлорния атом се съдържа 1 несдвоен електрон : 1s 2 2s 2 2p 6 3s 2 3p 5, така че валентността от 1 за хлорен атом е много стабилна. Поради наличието в хлорния атом на незаетите орбитали на d-поднива, хлорният атом може да проявява и други степени на окисление. Схема на образуване на възбудени състояния на атома:
Известни са също хлорни съединения, в които хлорният атом формално показва валентност 4 и 6, например ClO2 и Cl206. Въпреки това, тези съединения са радикали, т.е. те имат един несдвоен електрон.
2. Физични свойства.
При нормални условия хлорът е жълтозелен газ със задушаваща миризма. Някои от физическите му свойства са представени по-долу.
Плътност: 3.214 g / l, течност - при -35 ° С - 1.557, ТВ. при -105 0 С - 1.9 g / cm 3.
Точка на топене: 172.2 К
Точка на кипене: 238.6 К
Топлина на сливане: 6.41 kJ / mol
Топлина на изпаряване: 20.41 kJ / mol.
Хлорният газ е сравнително лесен за втечняване. Започвайки с налягане от 0,8 МРа (8 атмосфери), хлорът вече ще бъде течен при стайна температура. Когато се охлади до температура -34 ° С, хлорът също става течен при нормално атмосферно налягане. Течният хлор е жълтозелена течност с много висок корозивен ефект (поради висока концентрация на молекули). Повишавайки налягането, можете да постигнете съществуването на течен хлор до температура от +144 ° C (критична температура) при критично налягане от 7.6 MPa. От гледна точка на електропроводимостта, течният хлор се среща сред най-силните изолатори: той провежда ток почти милиард пъти по-лошо от дестилираната вода и 10 22 пъти по-лошо от среброто. Скоростта на звука в хлора е около един и половина пъти по-малка, отколкото във въздуха.
3. Да си в природата.
В природата има два изотопа на хлор 35 Cl и 37 Cl. Хлорът е най-често срещаният халоген в земната кора. , Хлорът е много активен - директно се свързва с почти всички елементи на периодичната система. Ето защо, в природата, тя се среща само под формата на съединения в състава на минералите:
ü halite NaCl,
ü sylvina KCl,
ü силвинит KCl · NaCl,
бисфофит MgCl2 · 6H2O,
карнелит KCl · MgCl2 · 6H2O,
Кайнит KCI-MgS04 · 3H2O.
Най-големите запаси от хлор се съдържат в соли, води, морета и океани (съдържанието в морската вода е 19 г / л). Хлорът представлява 0,024% от общия брой атоми в земната кора; номер на кларк (числа, изразяващи средното съдържание на химичните елементи в земната кора, хидросферата, Земята, космическите тела, геохимичните или космохимичните системи и т.н., спрямо общата маса на тази система. Изразява се в% или g / kg.) хлор - 0.017%. Човешкото тяло съдържа 0,25% хлорни йони по тегло. При хората и животните хлорът се намира главно в междуклетъчните течности (включително кръвта) и играе важна роля в регулирането на осмотичните процеси, както и в процесите, свързани с работата на нервните клетки.
4. Химични свойства на хлора и неговите съединения. Получаване на хлор.
Структурата на силиконовия атом. Si. 14. Възбудено състояние. E. 3d. 3p. 3 мастни киселини. E. 3d. 3p. 3 мастни киселини. 1s 2s 2p 3s 3р. 2е 8е 4е. 2. 2. 6. 2. 2.
Снимка 3 от презентацията „Силикон“ на уроците по химия на тема "силиций"Размери: 960 x 720 пиксела, формат: jpg. За да свалите безплатно изображение за урок по химия, щракнете с десния бутон върху изображението и щракнете върху "Запазване на изображението като ...". За да покажете снимките в урока, можете също да изтеглите презентацията на “Silicon.ppt” безплатно с всички снимки в zip-архив. Размер на архива - 562 КБ.
Изтеглете презентациясилиций
"Силикон и неговите съединения" - Структурата и свойствата на атомите. Semiconductor. t стопилка (Si) = 1415 ° С, t стопилка (диамант) = 3730 ° С. Получаване на силиций. Откриването на силиций. Включени също в състава на растенията и животните. Физическите свойства на силиция. Следователно, тухлата е керамика, а плочките и фрагментите от древногръцката амфора също са керамика. Цели: Химичните свойства на силиция.
"Силиконови съединения" - Силикон и неговите съединения. Химични свойства на SiO2. Силан. Получаване на силициева киселина. Силиконови свойства. Силициев оксид. Естествени силикати. Състояние на окисляване Rhinestone. Topaz. Получаване на силиций в лабораторията. Да бъдеш в природата. Кристални решетки. Откриването на силиций. Аметист. Получаване на силиций.
"Изотопи на силиций" - Разделяне на изотопи на силиций. Производство на поликристален силиций. Перспективи за използване на моноизотопен силиций. Изотопно разреждане при отглеждане на един кристал от кварцов тигел. Производство на монокристални семена. Зависимост на положението на максимума на Раманската лента върху атомната маса.
"Силиконова урок" - Кои от най-важните химически елементи в живата и неживата природа? Въглеродни и силициеви оксиди. Веществото е прозрачно. На проявата на неметални и метални свойства. Обобщава отражението. Окончателно тестване. Оксиди на въглерод и силициев хидроксид? Агрегиращо състояние: а) течност, б) газ, в) твърдо вещество.
"Силикон" - Силиконът е просто вещество. Физични свойства. Силициев оксид (IV). Силициди. Значение за живите организми. Взаимодействие с метали. Взаимодействие с неметали. Силициев карбид. Силиконов в природата. Силиконовата. Продукти от силикатна промишленост. Един от видовете естествени силициеви съединения е силикатите.
"Въглерод и силиций" - силициев оксид (IV). Елементи от група IV на основната подгрупа. Токсичност. 7. Интересно за въглерода. Силикати. Приплъзване на допир. Диамантът е най-трудното естествено вещество. Химични свойства Повече от 99% въглерод в атмосферата е под формата на въглероден диоксид. Карбиди. 6. Приложение. Един от най-меките сред твърдите вещества.
Има общо 6 презентации.
