Физични свойства на sio2. Кислородни съединения. Силициев оксид (II) SiO
Силициев оксид (II) SiO. В природата това не се случва, но може да се получи чрез реакцията:
SiO2 + Si → 2 SiO.
При нормално налягане сублимацията на силициев монооксид започва при около 1200 ° С (когато самите изходни материали на практика все още не се изпаряват). По двойки SiO е индивидуално съединение. Дисоциационната енергия на елементите е 789 kJ / mol. Превръщането в твърдо състояние може да се осъществи само чрез бързо охлаждане ("охлаждане") на газовата фаза. В противен случай, разместването от уравнението има време да премине:
2 SiO = Si02 + Si.
Силициевият монооксид се окислява бавно от атмосферен кислород и лесно се разтваря в алкали, за да образува соли на силициева киселина и освобождаване на водород. Лесно се електрифицира чрез триене, придобивайки силен отрицателен заряд.
Силициев оксид (IV) Si02.Силициевият оксид (IV) се нарича също силициев диоксид. Той е твърдо огнеупорно вещество. (точка на топене 1700 ° С)широко разпространен в природата в две форми: 1) кристален силициев диоксид - под формата на минерал от кварц и неговите разновидности (скален кристал, халцедон, ахат, яспис, кремък); кварцът е в основата на кварцовите пясъци, широко използвани в строителството и в силикатната промишленост; 2) аморфен силициев диоксид - под формата на минерален опалов състав SiO 2 пН20; земните форми на аморфен силициев диоксид са диатомит, триполи (инфузорна земя); Пример за изкуствен аморфен безводен силициев диоксид е силикагел, който се получава от натриев метасиликат:
Силикагелът има развита повърхност и затова добре абсорбира влагата.
При 1710 ° кварц се топи. С бързо охлаждане на стопената маса се образува кварцово стъкло. Той има много нисък коефициент на разширение, така че горещото кварцово стъкло не се напуква, когато водата бързо се охлажда. Лабораторната стъклария и инструменти за научни изследвания са направени от кварцово стъкло.
Структурата на SiO 2 в плоско изображение може да бъде представена, както следва:
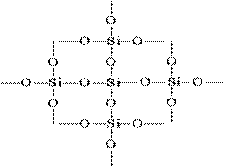
Всеки силициев атом е затворен в тетраедър от 4 кислородни атома. В този случай силициевият атом се намира в центъра, а кислородните атоми са разположени във върховете на тетраедъра. Цялото парче силициев диоксид може да се разглежда като кристал, чиято формула е (SiO2) n. Такава структура от силициев оксид (IV) определя неговата висока твърдост и огнеустойчивост.
Химични свойства на силициев оксид (IV) SiO2 се отнася до кисели оксиди. При сливането с твърди основи, основни оксиди и карбонати се образуват соли на силициевата киселина:
Само флуороводородна киселина взаимодейства със силициев оксид (IV) (стъклено ецване):
Si02 + HF → SiF4 + H20
Силициевият (IV) оксид не се разтваря във вода и не взаимодейства химически с него. Следователно, силициевата киселина се получава индиректно, например чрез хидролиза:
SiS2 + H20OH2S + H4SiO4 ортосиликонова киселина.
H 4 SiO 4 е разтворим, когато се нагрява или стои, в процес на полимеризация:
2 Н 4 SiO 4 → H 2 O + H 6 Si 2 O 7 диортокремниева киселина.
2H6Si207H2O + H10Si04O3 тетраоротремилова киселина.
Тя затваря пръстена:
Н 10 Si 4O 13 → Н20 + (Н2 SiO3) 4 тетраметацилова киселина.
В този случай, силициева киселина (в зависимост от концентрацията на първоначалните разтвори на сол и киселина) може да бъде получена както под формата на желатинова маса, съдържаща вода, така и под формата на колоиден разтвор (sol). Съставът на получената силициева киселина зависи от изходните материали и условията на приготвяне. Всички силициеви киселини са много слаби (по-слаби от въглищата).
Ако въглена киселина в разтвора отделя силициева киселина от нейните соли, тогава по време на калцинирането настъпва обратна реакция. Първият се дължи на по-ниската сила (степен на дисоциация) на силициева киселина, а втората - на по-ниската си летливост при нагряване.
При нагряване на полисилициеви киселини и тяхното постепенно обезводняване може да се получи фина SiO 2, която се нарича силикагел , Поглъща добре водата, поставям я в устройства за предотвратяване на окисляването на скъпи елементи.
Подгрупа на Германия
Ge (+4) Sn (+2, +4) Pb(+2) - устойчиви окислителни състояния
Германий е предсказан от Д. И. Менделеев през 1871 г. и открит през 1886 г. Калай и олово принадлежат към елементите, които са били най-известни на човечеството дълго време: египтяните са могли да ги миришат от руди повече от 3000 години преди новата ера. д. В Индия, олово стана известно за 2500 години, и калай 1500 години пр. Хр. д. Леене на калай, произведено в древен Китай.
Първи.Естествените съединения на германия се превръщат в GeO 2 и се редуцират с водород:
GeO2 + H2t → Ge + H20 при температури от около 1000 ° С.
Калай се получава от природен минерал каситерит(SnO 2):
SnO2 + C → Sn + CO.
Най-простата схема за промишлено намаляване на оловото се основава на две последователни реакции:
PbS + O2 → SO2 + PbO галенит(PbS) се изгаря и след това се намалява с въглища:
PbO + С → СО + Pb.
Заявление.И трите елемента са много важни за съвременните технологии. Някои съединения от калай и олово също се използват значително. Производните на олово са силно токсични.
Германий е типичен полупроводник (n-type с ширина на ширината на обхвата 0.75 eV) и намира различни приложения в електротехниката. Най-широко се използва за производството на AC токоизправители., Това приложение се основава на еднополюсна проводимост, произтичаща от контакта между чист германий и германиева сплав с индий. Токът (електронен поток) преминава в такава инсталация практически само от германий до сплавта, но не и обратно. Германиевите токоизправители се характеризират с изключително висока (около 98%) ефективност и много голям (с правилна работа) експлоатационен живот. Основният недостатък на такива токоизправители е тяхната чувствителност към нагряване - над 70 ° C, ефективността им бързо намалява.
Важна зона за употреба германия е инфрачервена оптика, тъй като лъчите с дължина на вълната повече от 2 микрона, той на практика не забавя. Напротив, в светлината и в близост до него варира (0.2? 2 микрона), германий интензивно поглъща енергията. Ако лъскава метална повърхност (която добре съхранява топлина, но не се нагрява добре) е покрита с германиев филм, тогава повърхността се нагрява много повече, отколкото без филм. Беше съобщено, че в барел, приготвен по този начин под действието на слънчева светлина, може да се получи вряща вода.
Калай се използва главно за лакиране на желязо, за да се предпази от ръждясване. (ламарина за консервната промишленост). Дебелината на такива покрития от калай е много малка - от порядъка на микрона. Под формата на тънки листа (т.нар. Stannioles) калай се консумира за производството на кондензатори в електротехническата промишленост , Оловото се използва за производство на акумулаторни плочи, плочи от електрически кабели, куршуми и изстрел, за защита срещу рентгенови лъчи и рентгенови лъчи, както и в химическата промишленост (тръбопроводи и др.). Много големи количества калай и олово се изразходват за производството на редица технически важни сплави.
Най-важните от тях са различни бронзи (сплави Cu и Sn), сплави за лагери (бабити, обикновено направени на базата на Pb или Sn, също съдържащи Sb и Cu), типографски сплави (5-30% Sn, 10-20% Sb, останалото е Pb) и обичайния "мек" спойка (30-70% Sn, 70-30% Pb). Той често може да бъде заменен с по-евтина сплав от 90% Pb, 6% Sn, 4% Sb. От голямо значение са сплавите за лагери с приблизителен състав 98% Pb, 1% Ca, 1% Na.
Силициев диоксид (силициев диоксид, силициев диоксид) е вещество, състоящо се от безцветни кристали с висока якост, твърдост и огнеустойчивост. Силициевият диоксид е устойчив на киселини и не взаимодейства с вода. При повишаване на температурата на реакцията, веществото взаимодейства с алкали, разтваря се в флуороводородна киселина, е отличен диелектрик.
В природата силициевият диоксид е широко разпространен: кристалният силициев оксид е представен от минерали като яспис, ахат (кристални силициеви диоксидни съединения), скален кристал (големи кристали на материята), кварц (свободен силициев диоксид), халцедон, аметист, морион, топаз (цветни кристали). силициев диоксид).
При нормални условия (при естествена околна температура и налягане) има три кристални модификации на силициев диоксид - тридимит, кварц и кристобалит. Когато температурата се повиши, силициевият диоксид първо се превръща в коесит, а след това в стишовит (минерал, намерен през 1962 г. в метеоритен кратер). Според проучванията, това е стишовит, производно на силициев диоксид, който очертава голяма част от мантията на Земята.
Химичната формула на веществото - SiO 2
Приготвяне на силициев диоксид
Силициевият диоксид се произвежда промишлено на кварцови инсталации, произвеждащи чист кварцов концентрат, който след това се използва в химическата и електронната промишленост, в производството на оптика, гумени и бояджийски пълнители, изработване на бижута и др. Природният силициев диоксид, наричан по друг начин силициев диоксид, се използва широко в строителството (бетон, пясък, звук и топлоизолационни материали).
Синтез на силициев диоксид по синтетичен метод се извършва чрез действието на киселини върху натриев силикат, в някои случаи и върху други разтворими силикати или чрез метод на коагулация на колоиден силициев диоксид под влиянието на йони. В допълнение, силициев диоксид се произвежда чрез окисляване на силиций с кислород при температура около 500 градуса по Целзий.
Прилагане на силициев диоксид
Силиконовите материали са широко използвани както в областта на високите технологии, така и в ежедневието. Силиконовият диоксид се използва в производството на стъкло, керамика, бетонови изделия, абразивни материали, както и в радиотехниката, ултразвуковите инсталации, запалките и др. В комбинация с редица съставки, силициев диоксид се използва в производството на оптични кабели.
Непорестият аморфен силициев диоксид се използва също и в хранителната промишленост като добавка, регистрирана под номер E551, предотвратяваща слепването и слепването на основния продукт. двуокис  силиконовата храна се използва във фармацевтичната промишленост като лекарство ентеросорбент, в производството на пасти за зъби. Веществото се намира в чипс, бисквити, царевични пръчици, разтворимо кафе и др.
силиконовата храна се използва във фармацевтичната промишленост като лекарство ентеросорбент, в производството на пасти за зъби. Веществото се намира в чипс, бисквити, царевични пръчици, разтворимо кафе и др.
Silica Harm
Официално се потвърждава, че веществото от силициев диоксид преминава през стомашно-чревния тракт непроменен, след което се отстранява напълно от тялото. Според 15-годишно проучване на френски експерти, пиенето на питейна вода с високо съдържание на алуминий намалява риска от развитие на болестта на Алцхаймер с 10%.
Така информацията за опасностите от силициев диоксид, която е химически инертна субстанция, е невярна: хранителната добавка E551, погълната орално, е напълно безопасна за здравето.
Силициевият оксид SiO 2 е твърдо, много огнеупорно вещество (точка на топене над 1700 ° C), широко разпространено в природата, където се намира главно под формата на кварцов минерал, както и на кристобалит и тридимит.
При обичайни температури кварцът е стабилна модификация, с повишаване на температурните полиморфни трансформации:
Силициев диоксид от всички модификации под формата на мономер не съществува; тя винаги е полимерна и „изградена” от тетраедри, образуващи много силна атомна решетка
Всеки силиконов атом в (Si02) n кристали е тетрахедрално заобиколен от четири кислородни атома, всеки от които е свързан с мост. Чрез общ кислороден атом тетраедрите при различни ъгли се свързват един с друг, образувайки непрекъсната триизмерна решетка; взаимното подреждане на тетраедрата в пространството определя една или друга модификация на силициевия диоксид.
При различни модификации на силициевата връзка силата на свързване варира. Това се отразява на величината на Si-O-Si ъглите и Si-O разстоянията, например ъгълът на свързване на Si-O-Si при различни модификации на силициев диоксид варира от 120 до 180 °. Преходите от кварц-тридимит-крибобалит са съпроводени от счупване и трансформация на връзки, които могат да се появят само при високи температури.
Quartz. Често се срещат в природата под формата на изключително добре оформени кристали, понякога със значителни размери. Кристалите са оформени от тетраедри, подредени в спирална форма около централната ос, под формата на спирала. В същия кристал посоката на спиралата може да бъде противоположна. Такива кристали са оптични изомери. Те въртят равнината на поляризация на светлината и могат да бъдат както на дясната, така и на лявата ръка. Тези и други кристали се различават като обект от техния огледален образ.
Кварцът се използва в различни области на науката и технологиите, а кристалите му често се отглеждат изкуствено. Някои видове кварц имат специални имена. Прозрачни безцветни кристали се наричат скални кристали. Има и цветни разновидности на кварца: розов кварц, виолетов (аметист), тъмнокафяв (опушен топаз), зелен (хризопраз) и др. Кристалната модификация на кварца с примеси на други вещества се нарича халцедон. Сортовете на халцедон са ахат, яспис и др. Скалните кристали и цветните сортове кварц се използват като скъпоценни и полускъпоценни камъни.
Тридимит се среща в вулканични скали, но в много малки количества. Известен тридимитен и метеоритен произход.
Кристобалит в природата понякога се намира под формата на малки кристали, вградени в лава, като тридимит. Тридимит и кристобалит имат по-"свободна" структура от кварца. Така плътността на кристобалита, тридимита и кварца е 2.32; 2,26 и 2,65 g / стз, съответно.
Стопилката от силициев двуокис с бавно охлаждане лесно образува аморфно кварцово стъкло. Силициев диоксид под формата на стъкло се среща и в природата. Плътността на аморфното стъкло е 2,20 g / cm 3 - по-ниска от тази на всички кристални модификации. Кварцовото стъкло има лек температурен коефициент на разширение, поради което се използва за приготвяне на лабораторна стъклария, устойчива на внезапни промени в температурата.
Всички модификации на силициев диоксид във водата са практически неразтворими (при температура 25 ° С, разтворимостта на кварца е 7, кристобалит - 12, тридимит - 16, кварцово стъкло - 83 mg / l). Следователно при нормални условия върху тях действат само алкални разтвори и флуороводородна киселина:
SiO2 + 2KO = K2SiO3 + Н2О, (1)
Si02 + 4HF = SiF4 + 2H2O. (2)
Последната реакция се използва при "ецване" на стъкло.
Добавеният силициев диоксид реагира с основни оксиди, основи (реакция (1)) и карбонати, за да образуват силикати:
SiO 2 + CaO = СаSiO 3, (3)
Si02 + Na2C03 = Na2Si03 + СОг. (4)
Реакциите (3) и (4) лежат в основата на промишленото производство на различни чаши, както и на цимент. По този начин съставът на обикновеното стъкло (например прозорец, за производството на съдове) се изразява с формулата Na2O.CaO. 6SiO 2. Такова стъкло се получава чрез сливане на смес от сода, пясък и варовик. Процесът се провежда при температура от ~ 1400 ° С до пълното отстраняване на газовете:
Na2C03 + СаСОз + 6SiO2 = Na2O.CaO. 6SiO2 + 2CO2.
За специални класове стъкло - огнеупорни, "нечупливи" - при готвене, добавете окиси от барий, олово, бор. За да се получат оцветени стъкла, се добавят и различни добавки, например добавянето на кобалтов оксид Co 2 O 3 дава син цвят, хромов оксид Cr 2 O 3 - зелен, манганов диоксид MnO 2 - розов.
SiO2 оксид е анхидрид на редица силициеви киселини, чийто състав може да бъде изразен чрез общата формула xSiO2 H yH2O, където х и у са цели числа: 1) х = 1, у = 1: Si02. Н2О, т.е. Н2 SiO3 - метасилициева киселина; 1) х = 1, у = 2: Si02. 2H2O, т.е. ортосилициева киселина; 1) х = 2, у = 1: 2SiO2. Н2О, т.е. H 2 Si 2 O 5 - бимета силициева киселина.
Киселини, чиито молекули съдържат повече от една SiO2 молекула, принадлежат към полисилиция.
Най-простият от силициевите киселини е H 2 SiO 3, който често се нарича просто силиций, а неговите соли са силикати. От силикати, само натриеви и калиеви силикати са разтворими във вода, останалите силикати са огнеупорни, неразтворими във вода вещества.
Разтворите на силикатите стават мътни, когато стоят във въздуха, тъй като съдържащият се в него СО 2 измества силициевата киселина от нейните соли (H 2 SiO 3 е по-слаба от въглеродна киселина; дисоциационната константа на H 2 SiO 3 в първия етап е равна на K 1 = 2.2. 10 -10 ).
H 2 SiO 3 е практически неразтворим във вода - това свойство се използва като качествена реакция за откриване на силикатни йони:
Na2Si03 + СОг + Н20 = Na2C03 + H2Si03.
Силикати се получават чрез сливане на SiO2 с алкали или карбонати.
Концентрираните разтвори на натриеви и калиеви силикати се наричат течно стъкло, те имат силно алкална реакция поради факта, че са силно хидролизирани:
K 2 SiO 3 + H 2O 2KON + H 2 SiO 3 '.
Течно стъкло се използва, например, за производството на лепило, водоустойчиви тъкани.
Циментът е много широко използван в строителството като свързващо вещество, което при смесване с вода се втвърдява. Обикновено циментът се произвежда в големи въртящи се пещи, където се пекат и смилат различни силикати (при температура -1000 ° C).
Има няколко вида цимент, но е възможно условно да се разграничат два вида цимент според принципа на тяхната „коагулация“ - обикновен цимент и портландцимент. Процесът на "поставяне" на конвенционален цимент, състоящ се от калциев силикат, възниква поради образуването на калциев карбонат поради въглеродния диоксид във въздуха:
CaO. SiO2 + СО2 + Н2О = СаСОз + Н2СиОз.
При определяне на портланд цимента въглеродният диоксид не участва в процеса, а хидролизата на силикатите се осъществява с последващо образуване на неразтворими кристални хидрати:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca2SiO4 + 4H2O = Ca2SiO4. 4H2O.
· Карбиди и силициди
• Въглеродните и силициевите съединения с метали - карбиди и силициди, в допълнение към разглежданите реакции, се получават и чрез взаимодействието на силиций с метални хидриди, например:
· 2CaH2 + Si = Ca2Si + 2H2.
· Всички тези реакции протичат при високи температури. Сред карбидите се отделят така наречените "метаниди" и "ацетилен". Първите се разглеждат като производни на метан, съдържащи въглерод в състояние на окисление -4 (Be 2 C, Al 4 C 3), а вторият - като производни на ацетилена със степен на окисление на въглерода -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2). , CAC 2). Ацетилидите от сребро и мед (I) могат лесно да бъдат получени чрез преминаване на ацетилен през амонячен разтвор на сребърен оксид или меден (I) хлорид. Повечето метаниди и ацетилиди реагират активно с вода (особено с киселини), освобождавайки съответните въглеводороди:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al4C3 + 12H2O = 4Al (OH) 3 + 3CH4,
· Ag2C2 + 2HCl = 2AgCl + C2H2.
· За разлика от карбидите, само силициди от алкални или алкалоземни метали взаимодействат с вода и киселини, произвеждайки най-простия водороден силициев моносилан, който често се нарича просто силан SiN 4:
· Ca2Si + 4HCl = 2CaCl2 + SiH4.
· Силанът е безцветен газ, който има миризма на плесен, спонтанно запалим във въздуха, изгарящ до SiO2 и вода:
· SiH4 + 2O2 = Si02 + 2H2O.
· Алкалите много лесно разлагат силана по уравнението:
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2,
· Водата също хидролизира силана, но много по-бавно:
· SiH4 + 2H2O = Si02 + 4H2.
· При нагряване над 400 ° C без достъп на въздух силанът се разлага на силиций и водород (един от методите за получаване на силиций):
SiH4 = Si + 2H2.
В допълнение към моносилана, също са известни дисиланови Si2H6, трисиланови Si3H8, тетрасилан Si4H10 и др. В индивидуалното състояние, съединенията се изолират само до Si6H14 включително. Всички тези съединения принадлежат към хомоложните серии на силани, на които съответства общата формула Si nH2n + 2. Подобно на алканите, силаните са безцветни, първите членове на хомоложните серии са газообразни при нормални условия, следните са течностите. Химичната активност на силани и въглеводороди е различна: за разлика от достатъчно инертни алкани, силанът е реактивен. Това се дължи на по-ниския афинитет на силиций за водород в сравнение с въглерода и много високия афинитет на силиций за кислород. Освен това Si-Si връзките са по-малко трайни от С-С връзките. За разлика от С-Н връзката, Si-H връзката има по-йонна характеристика.
· Енергията на Si-E и CE връзките.
Ниската якост на Si-Si връзката се дължи на ограничеността на хомоложните серии на силани.
• Сред карбидите и силицидите специално място заема карборундът SiC, който може да се нарече и силициев карбид и въглероден силицид. Карбурундът има висока точка на топене поради своята диамантова структура; твърдостта му е близка до тази на диаманта. Химически SiC е много стабилен.
· Концепцията за колоидни разтвори
В природата и технологията често се срещат разпръснати системи, при които едно вещество се разпределя равномерно като частици в друго вещество.
В диспергираните системи има дисперсна фаза - фино разделена субстанция и дисперсионна среда - хомогенна субстанция, в която диспергираната фаза се разпределя. Дисперсните системи включват обикновени (истински) разтвори, колоидни разтвори, както и суспензии и емулсии. Те се различават един от друг главно по големина на частиците, т.е. степента на дисперсия (фрагментация).
Системи с размер на частиците по-малък от 1 nm са истинските разтвори, състоящи се от молекули или йони на разтворените вещества. Те трябва да се разглеждат като еднофазна система. Системи с размери на частиците по-големи от 100 nm са грубодисперсни системи - суспензии и емулсии.
Суспензиите са диспергирани системи, в които диспергираната фаза е твърда и дисперсионната среда е течност и твърдото вещество е практически неразтворимо в течността.
Емулсиите са диспергирани системи, в които както диспергираната фаза, така и дисперсионната среда са течности, които не се смесват взаимно. Пример за емулсия е млякото, в което малките топки от мазнини плават в течност.
Суспензиите и емулсиите са двуфазни системи.
Колоидните разтвори са високо диспергирани двуфазни системи, състоящи се от дисперсионна среда и дисперсна фаза, а линейните размери на частиците на последните са в диапазона от 1 до 100 nm. Както може да се види, колоидни разтвори с размер на частиците са междинни между истинските разтвори и суспензии и емулсии. Колоидните частици обикновено се състоят от голям брой молекули или йони.
Колоидните разтвори се наричат също сол. Те се получават чрез дисперсионни и кондензационни методи. Най-често диспергирането се извършва с помощта на специални “колоидни мелници”. При кондензационния метод се образуват колоидни частици чрез комбиниране на атоми или молекули в агрегати. В хода на много химични реакции се появява кондензация и се образуват високо диспергирани системи (утаяване, хидролиза, окислително-редукционни реакции и др.).
1 nm - нанометър (1 nm = 10 -9 m).
За разлика от истинските разтвори, се характеризира с ефекта на Тиндал, т.е. разсейването на светлината от колоидни частици. Когато светлинен конус се появи през лъч светлина, той се появява в затъмнена стая. 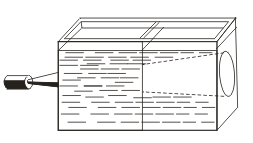 , Така можете да разпознаете дали това решение е колоидно или вярно.
, Така можете да разпознаете дали това решение е колоидно или вярно.
Едно от важните свойства на золите е, че техните частици имат електрически заряди със същия знак. Поради това те не се сливат в по-големи частици и не се утаяват. В същото време частиците на някои золи, например метали, сулфиди, силициеви и калаени киселини, имат отрицателен заряд, докато други, например хидроксиди, метални оксиди, имат положителен заряд. Появата на заряда се обяснява с адсорбцията на йони от разтвора чрез колоидни частици.
За да се утаи зол, е необходимо неговите частици да се слеят в по-големи агрегати. Комбинацията от частици в по-големи агрегати се нарича коагулация, а седиментацията им под влиянието на гравитацията се нарича седиментация.
Обикновено коагулацията настъпва при добавяне към золите: 1) електролит, 2) друг сол, чиито частици имат противоположен заряд, и 3) при нагряване.
