Серен. Сероводород и сулфиди
4.doc
240Серен. Сероводород, сулфиди, хидросулфиди. Серни оксиди (IV) и (VI). Сярна киселина и сярна киселина и техните соли. Естери на сярна киселина. Натриев тиосулфат
4.1. сяра
Сярата е един от малкото химически елементи, които хората са използвали в продължение на няколко хилядолетия. Той е широко разпространен в природата и се среща както в свободното състояние (естествена сяра), така и в съединенията. Минералите, съдържащи сяра, могат да бъдат разделени на две групи - сулфиди (пирити, блести, манекени) и сулфати. Местната сяра се намира в големи количества в Италия (остров Сицилия) и САЩ. В страните от ОНД местните серни находища се намират в Поволжието, в държавите от Централна Азия, в Крим и други райони.
Минералите от първата група включват оловен блясък PbS, меден блясък Cu 2 S, сребърен блясък - Ag 2 S, цинкова смес - ZnS, кадмиеви зъби - CdS, пирит или железен пирит - FeS 2, халкопирит - CuFeS 2, цинобър - HgS.
Минералите от втората група включват гипсовия CaSO 4 2H 2 O, мирабилита (сол на Glaube) - Na2S0410H2O и кизерит - MgS04H20.
Сярата се намира в животни и растения, като част от протеиновите молекули. Органични серни съединения се намират в нефт.
приемане
1. Когато сярата се получава от естествени съединения, например от пиритна сяра, тя се нагрява до високи температури. Серен пирит се разлага за образуване на железен (II) сулфид и сяра:
2. Сярата може да се получи чрез окисляване на сероводорода чрез липса на кислород в реакцията:
2H2SO2 = 2S2H20
3. Понастоящем оползотворяването на сярата чрез намаляване на въглеродния двуокис на серен двуокис SO 2 е общ страничен продукт при топенето на метали от серни руди:
S02C = CO2S
4. Отпадъчните газове на металургичните и коксовите пещи съдържат смес от серен диоксид и сероводород. Тази смес се прекарва при висока температура над катализатора:
H2S02 = 2H2O3S
^ Физични свойства
Сярата е твърд, крехък лимоненожълт цвят. Той е практически неразтворим във вода, но добре разтворим в CS 2 анилин в въглероден дисулфид и някои други разтворители.
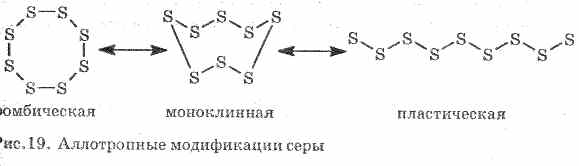
Лошото провежда топлина и електрически ток. Сярата образува няколко алотропни модификации:
1 . ^ Ромбична сяра (най-стабилни), кристалите имат формата на октаедри.
При загряване на сярата, цветът и вискозитетът му се променят: първо се образува светложълт цвят, след което при повишаване на температурата става по-тъмен и става толкова вискозен, че не изтича от тръбата, при допълнително нагряване вирусът отново пада, а при 444, 6 ° С се кипи ,
2. ^ Моноклинна сяра - модификация под формата на тъмно жълти игли, получени чрез бавно охлаждане на стопената сяра.
3. Пластична сяраобразувана, ако нагрятата до кипене сяра се излива в студена вода. Лесно се опъва като гума (виж фиг. 19).
Естествената сяра се състои от смес от четири стабилни изотопа: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Химични свойства
Атом на сяра, имащ непълно външно енергийно ниво, може да прикрепи два електрона и да покаже степен
Окисляване -2. Сярата показва такова окислително състояние в съединения с метали и водород (Na2S, H2S). При откат или изчерпване на електрони към атома на по-електроотрицателния елемент степента на окисляване на сярата може да бъде 2, 4, 6
Сярата е сравнително инертна в студа, но с повишаване на температурата реактивността му се увеличава. 1. С метали, сярата проявява окислителни свойства. Когато тези реакции образуват сулфиди (със злато, платина и иридий не реагират): Fe S = FeS
2. При нормални условия, сярата не реагира с водород, а при 150–200 ° С възниква обратима реакция:
3. В реакции с метали и с водород сярата действа като типичен окислител и в присъствието на силни оксидиращи агенти проявява редуциращи свойства.
S 3F 2 = SF 6 (не реагира с йод)
4. Изгарянето на сяра в кислород протича при 280 ° С, а във въздуха при 360 ° С. Това образува смес от SO 2 и SO 3:
S02 = S02S3O2 = 2SO3
5. Когато се нагрява без въздух, сярата директно се комбинира с фосфор, въглерод, показващ оксидиращи свойства:
2P 3S = P 2 S 3 2S C = CS 2
6. При взаимодействие със сложни вещества сярата се държи главно като редуциращ агент:
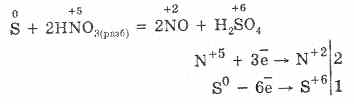
7. Сярата е способна на реакции на диспропорциониране. Така че, когато кипите сяра на прах с алкали, се образуват сулфити и сулфиди:
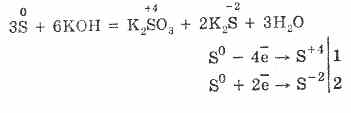
приложение
Сярата се използва широко в промишлеността и селското стопанство. Около половината от продукцията се консумира за производство на сярна киселина. Сярата се използва за вулканизация на каучук: в този случай каучукът се превръща в гума.
Под формата на сяра (фин прах) сяра се използва за борба с болестите на лозята и памука. Използва се за получаване на барут, кибрит, светлинен състав. В медицината се приготвя серен мехлем за лечение на кожни заболявания.
4.2. Сероводород, сулфиди, хидросулфиди
Сероводородът е аналог на водата. Електронната му формула
Това показва, че два p-електрона от външното ниво на серен атом участват в образуването на H-S-H връзки. H 2 S молекулата има ъглова форма, така че е полярна.
^ Да бъдеш в природата
Водородният сулфид се среща в природата във вулканични газове и във водите на някои минерални източници, като Пятигорск, Мацеста. Образува се чрез разпадане на съдържащи сяра органични вещества от различни животински и растителни остатъци. Това обяснява характерната неприятна миризма на канализация, помийни ями и сметища.
приемане
1. Сероводород може да се получи чрез директно свързване на сяра с водород чрез нагряване: \\ t
2. Но обикновено се получава чрез действие на разредена солна или сярна киселина върху железен (III) сулфид:
2HCl FeS = FeCl2H2S2H FeS = Fe2H2S Тази реакция често се провежда в апарата на Kipp.
^ Физични свойства
При нормални условия сероводородът е безцветен газ със силен характерен мирис на развалени яйца. Много отровна, инхалирането се свързва с хемоглобина, причинявайки парализа, която е нездравословна.
Ко води до смърт. В ниски концентрации, по-малко опасни. Необходимо е да се работи с него в изпускателни шкафове или с херметически затворени устройства. Допустимото съдържание на H 2 S в производствените помещения е 0,01 mg на 1 литър въздух.
Сероводородът е сравнително добре разтворим във вода (при 20 ° С 2,5 обема сероводород се разтварят в 1 обем вода).
Разтвор на сероводород във вода се нарича воден сероводород или сероводородна киселина (открива свойствата на слаба киселина).
^ Химични свойства
1, При силно нагряване, сероводородът почти напълно се разлага до образуване на сяра и водород.
2. Газообразен сероводород изгаря във въздуха със син пламък с образуване на серен оксид (IV) и вода: \\ t
2H2S302 = 2SO2 2H2O
При липса на кислород се образуват сяра и вода: 2H2SO2 = 2S2H2O
3. Сероводородът е доста силно редуциращо средство. Това важно химическо свойство може да бъде обяснено по следния начин. В разтвор на H2S е сравнително лесно да се даряват електрони на молекули кислород във въздуха:
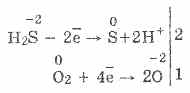
В същото време кислородът във въздуха окислява сероводорода до сяра, което прави мъглата на сероводородната вода:
2H2SO2 = 2S2H2O
Това обяснява факта, че сероводородът не се натрупва в много големи количества в природата, когато органичната материя се разпада - кислород от въздуха го окислява до свободна сяра.
4, Сероводородът реагира енергично с халогенни разтвори, например:
S2 е освободен и йодният разтвор става обезцветен.
5. Различни окислители реагират енергично с сероводород: под действието на азотна киселина се образува свободна сяра.
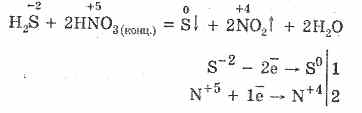
6. Разтвор на сероводород е кисел поради дисоциация: \\ t
H 2SHH HS - HS - SH S - 2
Първият етап обикновено преобладава. Това е много слаба киселина: по-слаба от въглищната киселина, която обикновено измества H 2 S от сулфиди.
Сулфиди и хидросулфиди
Хидрофлуорната киселина, като двуосновна, образува два реда соли:
Средни сулфиди (Na2S);
Кисело - хидросулфиди (NaHS).
Тези соли могат да бъдат получени чрез взаимодействието на хидроксиди със сероводород: 2NaOHH 2S = Na 2 S 2H 2 O
Пряко взаимодействие на сяра с метали:
Реакцията на обмен на соли с H2S или между соли:
Pb (NO3) 2Na2S = PbSi2NaNO3
CuS04H2S = CuS02H2S04Cu2H2S = CuS02H
Хидросулфидите са почти всички разтворими във вода.
Сулфидите на алкалните и алкалоземните метали също са лесно разтворими във вода, безцветни.
Сулфидите на тежките метали са практически неразтворими или слабо разтворими във вода (FeS, MnS, ZnS); Някои от тях не се разтварят в разредени киселини (CuS, PbS, HgS).
Като соли на слаба киселина, сулфидите във водни разтвори са силно хидролизирани. Например, алкални метални сулфиди, когато са разтворени във вода, имат алкална реакция:
Na 2 S НОНNaHS NaOH
Всички сулфиди, като самия сероводород, са енергични редуциращи агенти:
3PbS -2 8HN5O3 (пар.) = 3PbS6O4 4H2O8N2O2
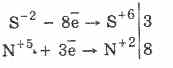
Някои сулфиди имат характерен цвят: CuS и PbS - черен, CdS - жълт, ZnS - бял, MnS - розов, SnS - кафяв, Al 2 S 3 - оранжев. Качественият анализ на катионите се основава на различните разтворимости на сулфидите и различните цветове на много от тях.
^ 4.3. Серен оксид (IV) и сярна киселина
Серният оксид (IV) или серен диоксид при нормални условия е безцветен газ с остра задушаваща миризма. Когато се охлади до -10 ° С, той се втечнява в безцветна течност.
приемане
1. В лабораторни условия серен оксид (IV) се получава от соли на сярна киселина чрез действието на силни киселини върху тях:
Na2S03H2S04 = Na2S04S02 2H2O2NaHSO3H2S04 = Na2S04 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. Също така серен диоксид се образува при взаимодействието на концентрирана сярна киселина при нагряване с ниско активни метали:
Cu2H2S04 = CuS04S02 2H2O
Cu 4H 2SO 2-4 = Cu2S02-4S02 2H2O
3. Серният оксид (IV) също се образува, когато сярата се изгаря във въздуха или кислорода: \\ t
4. В промишлени условия SO 2 се получава чрез изпичане на пирит с FeS 2 или серни руди на цветни метали (цинкова смес ZnS, оловен гланц PbS и др.): \\ T
4FeS 2 11O 2 = 2Fe2O3 8SO2
Структурната формула на молекулата SO 2:
Четири серни атома и четири електрона от два кислородни атома участват в образуването на връзки в молекулата SO 2. Взаимното отблъскване на свързващите електронни двойки и самостоятелната електронна двойка сяра придават на молекулата ъглова форма.
Химични свойства
1. Серният оксид (IV) притежава всички свойства на киселинните оксиди:
Водно взаимодействие
Взаимодействие с алкали,
Взаимодействие с основни оксиди.
2. Серният оксид (IV) се характеризира с редуциращи свойства:
S 4 O 2 O 0 2 S 2S 6 O -2 3 (в присъствието на катализатор, когато се нагрява)
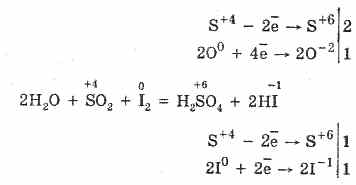
Но в присъствието на силни редуциращи агенти, SO 2 се държи като окислител:
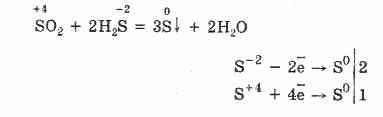
Окислително-редукционната двойственост на серен (IV) оксид се обяснява с факта, че сярата има окислително състояние 4 в него и следователно може, като се откаже от 2 електрона, да се окисли до S6, и като вземе 4 електрона, може да се намали до S °. Проявлението на тези или други свойства зависи от естеството на реактивната съставка.
Серният оксид (IV) е силно разтворим във вода (40 обема SO 2 се разтварят в 1 обем при 20 ° С). В този случай се образува сярна киселина, която съществува само във воден разтвор:
S02H2O2H2S03
Реакцията е обратима. Във воден разтвор, серен оксид (IV) и сярна киселина са в химично равновесие, което може да се измести. С свързването на H2S03 (неутрализация на киселина
Вие) реакцията протича в посока на образуване на сярна киселина; при отстраняване на S02 (продухване през разтвор на азот или нагряване), реакцията протича към изходните материали. Разтворът на сярна киселина винаги съдържа серен оксид (IV), което му придава остър мирис.
Сярната киселина притежава всички свойства на киселините. В разтвора се разпада на стъпки:
H2S03HHSO-3HSO-3 'HSO 2-3
Термично нестабилна, летлива. Сулфуровата киселина, като двуосновна, образува два вида соли:
Средни сулфити (Na2S03);
Кисело - хидросулфит (NaHSO 3).
Сулфитите се образуват, когато алкалите напълно се неутрализират от киселината:
H2S03 2NaOH = Na2S03 2H2O
Хидросулфитите се получават при липса на алкални вещества:
H2S03 NaOH = NaHS03H20
Сярната киселина и нейните соли притежават както окислителни, така и редуциращи свойства, което се определя от естеството на реакционния партньор.
1. Така че, под действието на кислород сулфити се окисляват до сулфати:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
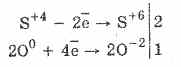
Окисляването на сероводородна киселина с бром и калиев перманганат протича още по-лесно:
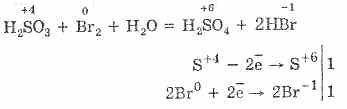
5H2S4O3 2KMn7O4 = 2H2S6O4MM2S6O4K2S6O4 3H2O
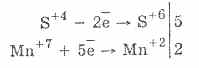
2. В присъствието на по-енергични редуциращи агенти сулфитите проявяват окислителни свойства:
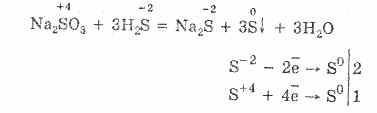
Почти всички хидросулфити и сулфити на алкални метали се разтварят от соли на сярна киселина.
3. Тъй като H 2 SO 3 е слаба киселина, действието на киселини върху сулфити и хидросулфити води до отделяне на SO2. Този метод обикновено се използва, когато се получава SO2 в лабораторни условия:
NaHS03H2S04 = Na2S04S02\u003e H20
4. Водоразтворимите сулфити лесно се подлагат на хидролиза, в резултат на което концентрацията на ОН-йони се увеличава в разтвора:
Na2S03 NON-NaHS03 NaOH
приложение
Сярният оксид (IV) и сулфидната киселина обезцветяват много багрила, образувайки с тях безцветни съединения. Последният може отново да се разложи при нагряване или на светлина, в резултат на което цветът се възстановява. Следователно, избелващият ефект на S02 и H2S03 е различен от избелващия ефект на хлора. Обикновено, сяра (IV) оцветява вълна, коприна и слама.
Серният оксид (IV) убива много микроорганизми. Ето защо, за да унищожат плесенните гъби, те опушват суровите изби, изби, винени бъчви и др. Използва се и при транспортирането и съхранението на плодове и плодове. В големи количества, серен оксид IV) се използва за производство на сярна киселина.
Важно приложение е разтворът на калциев хидросулфит CaHSO 3 (сулфитна течност), който се използва за обработка на дървесина и хартиена каша.
^ 4.4. Серен оксид (VI). Сярна киселина
Серният оксид (VI) (виж табл. 20) е безцветна течност, която се втвърдява при температура от 16,8 ° С до твърда кристална маса. Тя абсорбира много силно влагата, образувайки сярна киселина: SO3H2O = H2SO4
Таблица 20. Свойства на серни оксиди
Разтварянето на серни оксиди (VI) във вода се съпровожда от отделянето на значително количество топлина.
Серният оксид (VI) е много разтворим в концентрирана сярна киселина. Разтвор на SO3 в безводна киселина се нарича олеум. Олеумите могат да съдържат до 70% SO3.
приемане
1. Серният оксид (VI) се получава чрез окисляване на серен диоксид с кислород в присъствието на катализатори при температура от 450 ° С (вж. Производство на сярна киселина):
2SO 2O 2 = 2SO 3
2. Друг начин за окисляване на SO 2 до SO 3 е използването на азотен (IV) оксид като окислител:
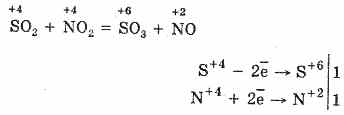
Полученият азотен оксид (II) при взаимодействие с атмосферен кислород лесно и бързо се превръща в азотен оксид (IV): 2NO O 2 = 2NO 2
Което може отново да се използва в окислението на SO2. Следователно, NO2 действа като кислороден носител. Този метод за окисляване на SO2 до SO3 се нарича азотен. Молекулата на SO 3 има формата на триъгълник, в центъра на който
Серният атом се намира:
Такава структура се дължи на взаимното отблъскване на свързващите електронни двойки. Атом на сяра е осигурил шест външни електрона за тяхното образуване.
Химични свойства
1. SO3 - типичен киселинен оксид.
2. Серният оксид (VI) има свойствата на силен окислител.
приложение
Серният оксид (VI) се използва за производство на сярна киселина. Най-важният е методът за получаване на контакт
Сярна киселина. Чрез този метод можете да получите H 2 SO 4 от всяка концентрация, както и олеум. Процесът се състои от три етапа: получаване на SO 2; окисление на S02 до SO3; получаване на H2S04.
SO 2 се получава чрез изгаряне на пирит FeS 2 в специални пещи: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
За да се ускори изпичането, пиритът се разтваря предварително, а за по-пълно изгаряне на сяра се инжектира значително повече въздух (кислород), отколкото се изисква от реакцията. Газът, излизащ от пещта, се състои от серен (IV) оксид, кислород, азот, арсенови съединения (от примеси в пирити) и водни пари. Нарича се газ за печене.
Газът за печене претърпява пълно почистване, тъй като дори малкото съдържание на арсенови съединения, както и прах и влага, отровят катализатора. Газът се почиства от арсенови съединения и прах, преминавайки през специални електростатични утаители и миеща кула; Влагата се абсорбира от концентрирана сярна киселина в сушилна кула. Пречистеният газ, съдържащ кислород, се нагрява в топлообменник до 450 ° С и влиза в контактния апарат. Вътре в контактния апарат са разположени решетъчни полици с катализатор.
Преди това като катализатор се използва фино смляна метална платина. Впоследствие, той е заменен с ванадиеви съединения - ванадиев оксид (V) V2O5 или ванадил сулфат VOSO 4, който е по-евтин от платина и по-бавно отровен.
Реакцията на окисление на SO 2 до SO 3 е обратима:
2SO 2O 2SO 3
Увеличаването на съдържанието на кислород в калциниращия газ увеличава добива на серен оксид (VI): при температура от 450 ° С обикновено достига 95% или повече.
Образуваният сярен оксид (VI) след това се подава чрез противотоков метод в абсорбираща кула, където се абсорбира от концентрирана сярна киселина. Тъй като се насища, първите форми на безводна сярна киселина и след това олеум. В бъдеще олеумът се разрежда до 98% сярна киселина и се доставя на потребителите.
Структурната формула на сярната киселина:
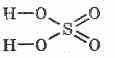
^ Физични свойства
Сярна киселина е тежка, безцветна, маслена течност, която кристализира при 10,4 ° С, почти двойно ( = 1,83 g / cm 3) е по-тежък от вода, без мирис, нелетлив. Изключително хигроскопичен. Влагата поглъща с отделянето на големи количества топлина, така че не можете да изливате вода в концентрираната сярна киселина - ще има пръскане на киселина. За
Сярната киселина трябва да се добавя към водата на малки порции.
Безводната сярна киселина разтваря до 70% серен оксид (VI). Когато се нагрява, той премахва SO3, докато се образува разтвор с масова фракция на H2SO4 от 98,3%. Безводният H 2 SO 4 почти не провежда електрически ток.
^ Химични свойства
1. Смесва се с вода във всякакви пропорции и образува хидрати с различен състав:
H2S04H20, H2S04 2H2O, H2S04HH2O, H2S04 4H2O, H2S04 6.5H2O
2. Концентрирана сярна киселина карбонизира органична материя - захар, хартия, дърво, фибри, отнемайки от тях елементите на водата:
C12H22O11H2S04 = 12CH2S0411H20
Образуваните въглища частично взаимодействат с киселината:
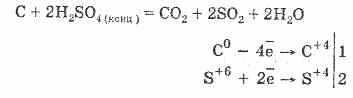
Дехидратацията на газ се основава на абсорбцията на вода от сярна киселина.
Като силна нелетлива киселина, H2SO4 измества други киселини от сухи соли:
NaN03H2S04 = NaHS04HNO3
Обаче, ако към солевите разтвори се добави H2S04, не се получава изместване на киселина.
H 2 SO 4 - силна двуосновна киселина: H 2 SO 4 HH HSO - 4 HSO - 4 SOH SO 2-4
Той притежава всички свойства на нелетливи силни киселини.
Разредената сярна киселина се характеризира с всички свойства на неокисляващите киселини. А именно: взаимодейства с метали, които са в електрохимичната серия на напрежението на метали до водород:
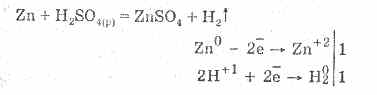
Взаимодействието с металите се дължи на редукцията на водородните йони.
6. Концентрирана сярна киселина е енергичен окислител. Когато се нагрява, окислява повечето метали, включително тези в електрохимичната серия от напрежения след водород, не реагира само с платина и злато. В зависимост от активността на метала, редукционните продукти могат да бъдат S-2, S ° и S4.
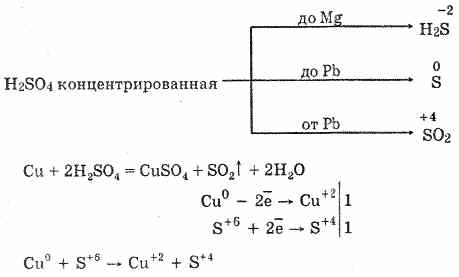
В студената, концентрирана сярна киселина не взаимодейства с такива силни метали като алуминий, желязо и хром. Това се дължи на пасивирането на метали. Тази характеристика се използва широко, когато се транспортира в железен контейнер.
При нагряване обаче:
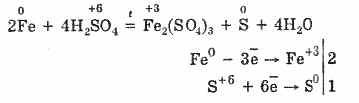
Така концентрираната сярна киселина взаимодейства с метали, поради редуцирането на киселинно образуващите атоми.
Качествена реакция към сулфатния йон SO 2-4 е образуването на бяла кристална утайка от BaSO 4, неразтворима във вода и киселини:
SO2-4Ba2 'BaSO4'
приложение
Сярната киселина е най-важният продукт от основната химическа промишленост, занимаваща се с производството на не-
Органични киселини, основи, соли, минерални торове и хлор.
За различни приложения сярната киселина е на първо място сред киселините. Най-голямо количество се консумира за получаване на фосфатни и азотни торове. Като нелетлива, сярната киселина се използва за производство на други киселини - солна, флуороводородна, фосфорна и оцетна.
Много от тях са за пречистване на петролни продукти - бензин, керосин, смазочни масла - от вредни примеси. В машиностроенето сярната киселина почиства металната повърхност от оксиди преди покриване (никелиране, хромиране и др.). Сярна киселина се използва при производството на експлозиви, изкуствени влакна, багрила, пластмаси и много други. Използва се за зареждане на батериите.
Солите на сярната киселина са важни.
Натриев сулфатNa2S04 кристализира от водни разтвори под формата на хидрат на Na2S0410H2O, който се нарича глауберова сол. Използва се в медицината като слабително средство. Безводният натриев сулфат се използва при производството на сода и стъкло.
^ Амониев сулфат(NH 4) 2 SO 4 - азотен тор.
Калиев сулфатK 2 SO 4 - поташ тор.
Калциев сулфат CaSO 4 се намира в природата под формата на гипсов минерал CaSO 4 2H 2 O. Когато се загрява до 150 ° С, той губи част от водата и отива в 2CaSO4H2O хидрат, наречен изгорен гипс, или алабастър. Когато се смеси с вода в пастообразна маса, алабастърът се втвърдява отново след известно време, превръщайки се в CaSO 4 2H 2 O. Гипсът се използва широко в строителството (мазилка).
Магнезиев сулфатMgSO 4 се намира в морската вода, което води до горчив вкус. Кристалният хидрат, наречен горчива сол, се използва като слабително средство.
язвителност- техническо наименование на кристалните хидрати на металните сулфати Fe, Cu, Zn, Ni, Co (дехидратираните соли не са жизнени вещества). Меден сулфатCuSO 4 5H 2 O е синьо токсично вещество. Растенията се напръскват с разреден разтвор и семената се засяват преди сеитбата. Желязо витриолFeSO 4 7H 2 O е светлозелено вещество. Използва се за контрол на вредители по растенията, мастилата, минералните бои и др. Цинков сулфатZnSO 4 7H 2 O се използва в производството на минерални мастила, в ситопречатания, медицина.
^ 4.5. Естери на сярна киселина. Натриев тиосулфат
Естерите на сярната киселина включват диалкил сулфати (RO2) S02. Това са висококипящи течности; по-ниско разтворимо във вода; в присъствието на алкали се образуват алкохол и соли на сярна киселина. Долните диалкилсулфати са алкилиращи средства.
Диетилов сулфат(C2H5) 2S04. Точка на топене -26 ° С, точка на кипене 210 ° С, разтворим в алкохоли, неразтворим във вода. Получава се чрез взаимодействие на сярна киселина с етанол. Е етилиращо средство в органичния синтез. Пронизва кожата.
Диметилсулфат(CH3) 2S04. Точка на топене -26,8 ° С, точка на кипене 188,5 ° С. Разтворим в алкохоли, лошо - във вода. Реагира с амоняк в отсъствието на разтворител (при експлозия); Сера някои ароматни съединения, като фенолни естери. Получава се чрез взаимодействие на 60% олеум с метанол при 150 ° С. Той е метилиращ агент в органичния синтез. Канцерогенно, засяга очите, кожата, дихателните органи.
^ Натриев тиосулфат Na2S2O3
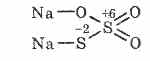
Сол от тиосулфатна киселина, в която два серни атома имат различни окислителни състояния: 6 и -2. Кристално вещество, добре разтворимо във вода. Предлага се под формата на кристален Na 2 S 2 O 3 5H 2 O, обикновено наричан хипосулфит. Получава се от взаимодействието на натриев сулфит със сяра по време на кипене:
Na2S03S = Na2S2O3
Подобно на тиосулфаната киселина, той е силно редуциращо средство, лесно се окислява от хлор до сярна киселина:
Na2S2O3 4Cl2 5H2O = 2H2S04 2NaCl 6HCl
Използването на натриев тиосулфат за абсорбция на хлор (в първите газови маски) се основава на тази реакция.
Леко различно окисляване настъпва със слабо окислителни агенти на натриев тиосулфат. Това образува соли на тетратионната киселина, например:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Натриевият тиосулфат е страничен продукт при производството на NaHSO 3, серни багрила, при пречистването на промишлени газове от сяра. Използва се за отстраняване на следи от хлор след избелване на тъкани, за извличане на сребро от руди; е фиксатор във фотографията, реагент в йодометрия, антидот за отравяне с арсенови съединения, живак, противовъзпалително средство.
Химичният елемент сяра се намира в VIА-групата, период 3 PSCE. На външния електронен слой на серния атом има 6 електрона. Показвайки свойствата на окислителя при образуването на вещества с метали и водород, сярата придобива окислително състояние -2 (отнема 2 електрона).
В състава на съдържащите кислород съединения сярата показва окислителни състояния +4 и +6. Така, сярата се характеризира с окислителни състояния -2; 0; 4; 6.
В природата сярата се намира в естественото си състояние и в състава на минералите. Например, сярата съдържа оловен блясък (основният компонент е оловен сулфид PbS) и меден блясък (основният компонент е меден сулфид Cu 2 S).
Сярата образува няколко прости вещества - алотропни модификации. Ромбичната сяра е най-стабилна при стайна температура (фиг. 1). Това вещество се състои от S8 молекули. Ромбичната сяра е жълта и се топи при температура от + 112,8 ° С.
Фиг. 1. Ромбична модификация на сярата
При нагряване ромбичната сяра постепенно се превръща в вискозна тъмнокафява маса. Това е друга алотропна модификация на сяра - пластмаса. Пластмасовата сяра се състои от линейни молекули на сяра S n.
Сярата в химични реакции с метали и водород играе ролята на окислител. Степента му на окисление намалява от 0 до -2. В реакцията с кислород сярата действа като редуциращ агент, повишавайки степента на неговото окисление от 0 до +4.
Обмислете примери за взаимодействия със сяра.
Когато сярата взаимодейства с водород, се образува сероводород:
Когато цинкът взаимодейства със сяра, се образува цинков сулфид:
Сярата изгаря в кислород с образуването на серен оксид (IV) (фиг. 2):

Фиг. 2. Изгаряне на сяра в кислород
Разгледайте свойствата на серните съединения с окислително състояние "-2". Такива съединения включват сероводород и сулфиди - соли на сероводородната киселина.
Сероводородът е газ с миризма на развалени яйца. Изгаря във въздуха. Освен това, при липса и излишък на кислород, горенето протича различно.
В излишък на кислород, сероводородът изгаря, за да образува серни оксиди (IV) и вода:
2H2S + 30 2 = 2SO 2 + 2H 2O.
При недостиг на кислород се получава непълно изгаряне на сероводорода с освобождаването на сяра: 2H2S + O2 = 2S + 2H2O.
Сероводородът е силно разтворим във вода. Полученият разтвор е слаба хидрогенсулфидна киселина. Водородсулфидните соли се наричат сулфиди. Хидрофлуорната киселина и водоразтворимите сулфиди влизат в обменни реакции.
Взаимодействието на сероводородната киселина и медния (II) хлорид образува неразтворим меден (II) сулфид и солна киселина: H 2 S + CuCl 2 = CuS + 2HCl.
При взаимодействие на калиев сулфид с цинков нитрат се утаява цинков сулфид и се образува калиев нитрат: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Позоваването
- Оржековски П.А. Събиране на задачи и упражнения по химия: 9 клас: към учебника П.А. Оржековски и др. “Химия. Степен 9 / П.А. Orzhekovsky, N.A. Титов, Ф.Ф. Хегел. - М .: AST: Astrel, 2007. (стр. 91-97)
- Оржековски П.А. Химия: 9 клас: изследвания. за общ образ. установени. / P.A. Orzhekovsky, L.M. Мещерякова, Л.С. Pontak. - М .: AST: Astrel, 2007. (§ 34)
- Оржековски П.А. Химия: 9 клас: проучвания за общо. установени. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - М .: Астрел, 2013. (§§ 20, 21)
- Rudzitis G.E. Химия: неорган. химия. Authority. Химия: изследвания. за 9 cl. / G.E. Rudzitis, F.G. Фелдман. - М .: Образование, ОАО "Московски учебници", 2009.
- Khomchenko I.D. Събиране на задачи и упражнения по химия за гимназията. - М .: РИА "Нова вълна": Издател Умеренков, 2008.
- Енциклопедия за деца. Том 17. Химия / Глава. Ед. VA Володин, Вед. научен. Ед. I. Leenson. - М .: Avanta +, 2003.
- Единична колекция от дигитални образователни ресурси (видео опит по темата) ().
- Електронна версия на списанието "Химия и живот" ().
домашна работа
- а. 136 No. 3; стр.140 №№ 2-4 от учебника П.А. Оржековски "Химия: 9 клас" / П.А. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - М .: Астрел, 2013.
сулфиди (от лат. сяра, сяра - сяра)
серни съединения с повече електропозитивни елементи; могат да се разглеждат като соли на сероводородната киселина (вж Сероводородната киселинаH 2 S. Има две серии C: средната (нормална) на общата формула M 2 S и киселината (хидросулфиди) с обща формула MHS, където М е едновалентен метал. С. алкалните метали са безцветни, разтворими във вода. Водните им разтвори са силно хидролизирани и алкални. Под действието на разредени киселини се отделя H 2 S. В. алкалоземните метали са безцветни, слабо разтворими във вода. H 2 S се излъчва във влажен въздух, а други свойства са сходни с тези на алкалните метали. И тези, и други S. лесно се окисляват до сулфати. В. Тежките метали са практически неразтворими във вода. Почти всички от тях са черни или черно-кафяви (с изключение на бяло ZnS, розово MnS, жълто CdS, оранжево-червено Sb 2 S 3, жълт SnS 2). Неравното съотношение на C. към киселини и C. ammonium се използва в химическия анализ. Малина.
Велика съветска енциклопедия. - М .: Съветска енциклопедия. 1969-1978 .
Вижте какво са "сулфиди" в други речници:
Съединения на сяра с метали и някои неметали. Метални сулфиди са соли на сероводородната киселина H2S: среда (например Na2S) и кисела, или хидросулфиди (NaHS). Чрез изгаряне на естествени сулфиди се получават цветни метали и SO2. Фосфорни сулфиди и ... ... Голям енциклопедичен речник
Съвременна енциклопедия
сулфиди - СУЛФИДИ, неорганични сулфиди на серни съединения с метали и някои неметали. Включени в сулфидни руди; използвани като фосфори (например, CdS, ZnS). Молибденов сулфид, титанови твърди смазочни материали. Фосфорни сулфиди ... Илюстриран енциклопедичен речник
- (нов лат., от латински. сяра сяра). Съединения на някое тяло със сяра, съответстващи на оксиди или киселини. Речник на чужди думи, включени в руския език. Чудинов, А.Н., 1910. СУЛФИДИ Новолатинск., От лат. сяра, сяра. Връзката ... ... Речник на чужди думи на руския език
1. Природни серни съединения на метали и някои неметали. В химичното вещество се считат за соли на сероводородната киселина H2S. Редица елементи образуват полисулфиди със сяра, които са соли на полисулфоновата киселина H2Sx. Основната ... ... Геологическа енциклопедия
сулфиди - - серни съединения с метали и някои неметали; метални сулфиди соли на водороден сулфид киселина H2S. Терминологичен речник за бетон и стоманобетон. ФГУП „КСО“ Строителство ”НИИЖБ и метростанция А. А. Гвоздева, Москва, 2007. 110 стр.] ...… Енциклопедия на термините, определенията и обясненията на строителните материали
SULPHES, s, u сулфид, съпруг (Spec.). Химични съединения на сярата с метали и някои неметали. Органично с Естествен s. | прил. сулфид, о, о. Речник Ожегова. SI Ожегов, Н.Ю. Шведова. 1949 г. ... Речник Ожегова
Сулфидите, R2S (R ароматен радикал), се получават най-лесно чрез прибавяне на капки разтвор на диазо соли до 60 ... Енциклопедия на Брокхаус и Ефрон
Сулфидите - (1) в неорганична химия, такива съединения на елементи със сяра, в които серните атоми имат състояние на окисление 2. се считат за соли на слабо сероводородната киселина (воден разтвор на H2S). Много S. са естествени ... ... Голяма политехническа енциклопедия
S; пл. (единици сулфид, и; м.). [от лат. сярна сяра] Chem. Съединения на сяра с метали и някои неметали. В. титан. Органично с Естествен s. (клас минерали). Ide Сулфид, о, о. С смесени смеси. От руда. * * * Сулфиди на серни съединения ... Енциклопедичен речник
- (от латинската сярна сяра) клас химични съединения, които са метални съединения (както и редица неметали B, Si, P, As) със сяра (S), където има окислително състояние −2. Може да се разглеждат като соли на сероводород ... ... Уикипедия
книги
- Уранови находища от вида на несъгласието във фанерозоя Андрей Борисович Халезов. Разгледани са особеностите на урановите находища в структурите на речната палео-долина по повърхностите на структурно и стратиграфско несъгласие на примера на три региона на Уралския регион с различни…
сяра - Елементът от третия период и VIA групата на Периодичната система, сериен номер 16, се отнасят до халогените. Електронната формула на атома [10 Ne] 3s 2 3p 4, характеристични окислителни състояния 0, -II, + IV и + VI, състоянието S VI се счита за стабилно.
Скала за окисляване на сярата:
Електроотрицателността на сярата е 2,60, характеризира се с неметални свойства. В водородните и кислородните съединения тя се съдържа в различни аниони, образува кислородсъдържащи киселини и техните соли, бинарни съединения.
В природата - петнадесети елемент на химическото разпространение (седмото сред неметалите). Той се намира в свободната (родна) и свързана форма. Важен елемент за висшите организми.
Sulphur S. Обикновено вещество. Кристално жълто (α-ромбично и β-моноклинно,
при 95.5 ° С) или аморфен (пластмаса). В решетъчните места има S8 молекули (не-равнинни "коронни" цикли), аморфната сяра се състои от S n вериги. Ниско топимо вещество, вискозитетът на течността преминава през максимум при 200 ° C (разликата между молекулите S 8, преплитането на веригите S n). В една двойка - молекули S8, S6, S4, S2. При 1500 ° С се появява моноатомна сяра (в химически уравнения за простота всяка сяра е представена като S).
Сярата не се разтваря във вода и при нормални условия не реагира с нея, тя е добре разтворима в въглероден дисулфид CS 2.
Сярата, особено на прах, има висока активност при нагряване. Реагира като окислител с метали и неметали:
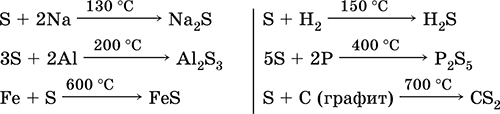
какво ще кажеш редуктор - с флуор, кислород и киселини (при кипене): \\ t
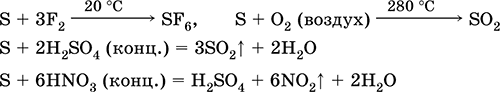
Сярата се подлага на амортизация в алкални разтвори:
3S 0 + 6KOH (конц.) = 2K 2 S-II + K 2 S IV O 3 + 3H 2 O
При високи температури (400 ° C) сярата измества йода от водородния йодид:
S + 2НI (g) = I 2 + H 2 S,
но в разтвора реакцията протича обратното:
I2 + H2S (p) = 2 HI + S '
приемане: in промишленост топено от естествени находища на естествена сяра (използвайки водна пара), отделяно при десулфуризация на продукти от газификация на въглища.
Сярата се използва за синтез на въглероден дисулфид, сярна киселина, серни (вани) багрила, в вулканизацията на каучука, като средство за защита на растенията от брашнеста мана и за лечение на кожни заболявания.
Сероводород H 2 S. Кислородна свободна киселина. Безцветен газ със задушаваща миризма, по-тежка от въздуха. Молекулата има структура на двойно непълна тетраедър [:: S (H) 2]
(sp3 - хибридизация, ъгълът на H - S - H е далеч от тетраедричната). Нестабилно при нагряване над 400 ° С. Той е слабо разтворим във вода (2.6 л / 1 л H 2 O при 20 ° C), наситен разтвор е децимоларен (0.1 М, „сероводородна вода“). Много слаба киселина в разтвора на практика не дисоциира във втората фаза на S 2 - йони (максималната концентрация на S 2 -1 е равна на 1 10 –13 mol / l). Когато стои във въздуха, разтворът става мътен (инхибитор - захароза). Неутрализира се чрез алкали, а не изцяло - с амонячен хидрат. Силно редуциращо средство. Той влиза в реакции на йонообмен. Сулфидиращ агент се утаява от разтвор на различно оцветени сулфиди с много ниска разтворимост.
Качествени реакции - утаяване на сулфиди, както и непълно изгаряне на H 2 S с образуване на жълто серен отлет върху студен обект, въведен в пламъка (порцеланова шпатула). Страничен продукт за рафиниране на нефт, природен и коксов газ.
Използва се в производството на сяра, неорганични и органични съединения, съдържащи сяра, като аналитичен реагент. Изключително отровни. Уравненията на най-важните реакции:
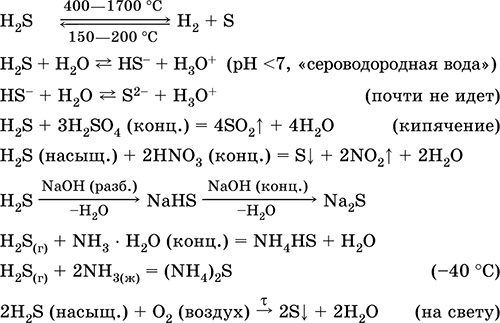

приемане: in промишленост - директен синтез:
Н2 + S = H2S(150–200 ° C)
или чрез нагряване на сяра с парафин;
в лаборатория - изместване на сулфидите от силни киселини
FeS + 2NCl (конц.) = FeCl2 + H2S
или пълна хидролиза на бинарни съединения:
Al2S3 + 6H2O = 2Al (OH) 3 + 3 H2S
Натриев сулфид Na 2 S. Сол без кислород. Бял, много хигроскопичен. Топя се без разлагане, термично стабилен. Той е добре разтворим във вода, хидролизира се от анион, създава силно алкална среда в разтвора. Когато стои във въздуха, разтворът става мътен (колоидна сяра) и пожълтява (полисулфидната боя). Типичен редуциращ агент. Прилага сяра. Той влиза в реакции на йонообмен.
Качествени реакции на йон S 2 - отлагане на различно оцветени метални сулфиди, от които MnS, FeS, ZnS се разлагат на HCl (s).
Той се използва в производството на серни бои и целулоза, за премахване на косата на кожите при дъбене на кожа, като реагент в аналитичната химия.
Уравненията на най-важните реакции:
Na2S + 2NCl (dec.) = 2NaCl + H 2 S
Na2S + 3H2S04 (конц.) = S02 + S + 2H2O + 2NaHSO4 (до 50 ° С)
Na2S + 4HNO3 (конц.) = 2NO + S + 2H2O + 2NaNO3 (60 ° С)
Na2S + H2S (наситен) = 2NaHS
Na2S (t) + 2O2 = Na2S04 (над 400 ° С)
Na2S + 4H2O2 (конц.) = Na2S04 + 4H20
S 2 - + M 2+ = MnS (телесен); FeS (черен) ↓; ZnS (бяло) ↓
S 2 - + 2Ag + = Ag 2 S (черен) ↓
S 2 - + M 2+ = CdS (жълт) ↓; PbS, CuS, HgS (черен) ↓
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (corr. - черен)
3S 2‑ + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
приемане в промишленост - калциниране на минерала мирабилит Na2S0410H20 в присъствието на редуциращи агенти:
Na2S04 + 4H2 = Na2S + 4H2O (500 ° С, кат. Fe2O3)
Na 2 SO 4 + 4 С (кокс) = Na2S + 4CO (800-1000 ° C)
Na2S04 + 4СО = Na2S + 4СО2 (600-700 ° С)
Алуминиев сулфид Al2S3. Сол без кислород. Бяла, А1-С връзката е предимно ковалентна. То се топи без разлагане при прекомерен натиск на N 2, лесно се сублимира. При калциниране се окислява във въздух. Напълно хидролизиран с вода, не се утаява от разтвора. Разлага се от силни киселини. Използва се като твърд източник на чист сероводород. Уравненията на най-важните реакции:
Al2S3 + 6H2O = 2Al (OH) 3 '+ 3H2S (чист)
Al2S3 + 6NCl (dec.) = 2AlCl3 + 3H2S
Al2S3 + 24HNO3 (конц.) = Al2 (SO4) 3 + 24NO2 + 12H2O (100 ° С)
2Al 2 S 3 + 9O 2 (въздух) = 2Al 2 O 3 + 6SO 2 (700–800 ° C)
приемане: взаимодействие на алуминий с разтопена сяра при липса на кислород и влага:
2Al + 3S = AL 2 S 3(150–200 ° C)
Желязо (II) сулфид FeS. Сол без кислород. Черно и сиво със зелен оттенък, огнеупорен, разлага се при нагряване във вакуум. В мокро състояние е чувствителен към кислород във въздуха. Неразтворим във вода. Не се утаява при насищане на разтвори на железни (II) соли с сероводород. Разлага се от киселини. Използва се като суровина при производството на желязо, твърд източник на сероводород.
Съединението на железен (III) състав на Fe2S3 не е известно (не е получено).
Уравненията на най-важните реакции:
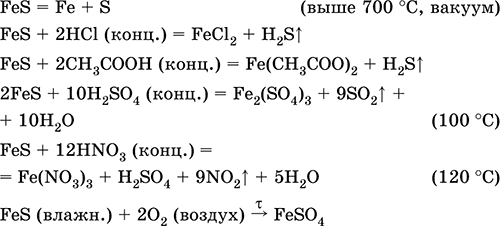
Получаване:
Fe + S = FeS (600 ° C)
Fe2O3 + H2 + 2H2S = 9 FeS + 3H2O (700-1000 ° С)
FeCl2 + 2NH4HS (g) = FeS + 2NH4Cl + H2S
Железен дисулфид FeS 2. Двоична връзка. Той има йонна структура Fe 2+ (–S-S–) 2-. Тъмно жълто, термично стабилно, разлага се при запалване. Неразтворим във вода, не реагира с разредени киселини, основи. Разлага се от киселинно-окислителни агенти, печени във въздуха. Използва се като суровина при производството на желязо, сяра и сярна киселина, катализатор в органичния синтез. В природата - рудни минерали пирит и марказит.
Уравненията на най-важните реакции:
FeS2 = FeS + S (над 1170 ° C, вакуум)
2FeS 2 + 14H 2 SO 4 (конц., Планини) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS2 + 18HNO3 (конц.) = Fe (NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
4FeS 2 + 11O 2 (въздух) = 8SO 2 + 2Fe 2 O 3 (800 ° C, печене)
Амониев хидросулфид NH 4 HS. Киселина, свободна от кислород. Бял, разтопен под налягане. Изключително летлив, термично нестабилен. Окислява се на въздух. Той е добре разтворим във вода, хидролизира се чрез катион и анион (преобладава), създава алкална среда. Разтворът става жълт във въздуха. Разлага се от киселини, в наситен разтвор добавя сяра. Алкалите не се неутрализират, средната сол (NH4) 2S не съществува в разтвора (за условията на получаване на средната сол, вижте заглавието "H2S"). Използва се като компонент на фотографски разработчици, като аналитичен реагент (сулфиден утаител).
Уравненията на най-важните реакции:
NH4SH = NH3 + H2S (над 20 ° С)
NH4SH + НС1 (разл.) = NH4C1 + H2S
NH4HS + 3HNO3 (конц.) = S '+ 2NO2 + NH4NO3 + 2H2O
2NH 4 HS (наситен Н 2 S) + 2 CuSO 4 = (NH 4) 2 SO 4 + H2SO4 + 2CuS.
приемане: насищане на концентриран разтвор на NH3 със сероводород:
NH3H20 (конц.) + H2S (g) = NH 4 HS + Н20
В аналитичната химия, разтвор, съдържащ равни количества NH 4 HS и NH 3 H 2 O, обикновено се счита за разтвор на (NH4) 2S, а средната формула на сол се използва при писането на реакционните уравнения, въпреки че амониевият сулфид е напълно хидролизиран във вода до NH 4 HS и NH 3H20.
Серен диоксид. сулфити
Серен диоксид SO2. Киселинен оксид. Безцветен газ с остър мирис. Молекулата има структура на непълния триъгълник [: S (O) 2] (sp 2 - хибридизация), съдържа σ, π - връзки S = O. Лесно втечнен, термично стабилен. Той е разтворим във вода (~ 40 l / 1 l H 2 O при 20 ° C). Образува полихидрат с свойствата на слаба киселина, продуктите на дисоциация - йони HSO 3 - и SO 3 2−. Йон HSO 3 - има две тавтомерни форми - симетричен (некисела) със структурата на тетраедъра (sp3 - хибридизация), която преобладава в сместа, и асиметрична (кисели) със структурата на непълен тетраедър [: S (0) 2 (OH)] (sp3 - хибридизация). Йонът SO 3 2 - също е тетраедричен [: S (0) 3].
Реагира с алкали, амонячен хидрат. Типичен редуктор, слабо окислително средство.
Качествена реакция - промяна на цвета на жълто-кафявата "йодна вода". Междинно съединение при производството на сулфити и сярна киселина.
Използва се за избелване на вълна, коприна и слама, съхраняване и съхраняване на плодове, като дезинфектант, антиоксидант, охлаждаща течност. Токсичен.
Съединението с H2SO3 (сярна киселина) не е известно (не съществува).
Уравненията на най-важните реакции:
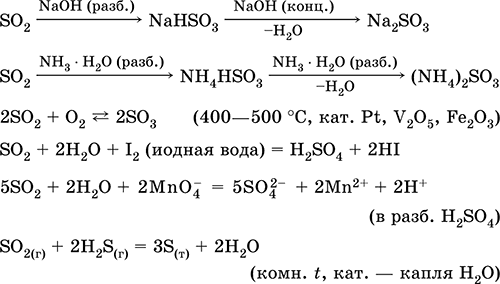
Разтваряне във вода и киселинни свойства:
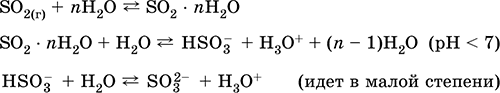
приемане: в промишлеността - изгаряне на сяра във въздуха, обогатен с кислород, и в по-малка степен - изпичане на сулфидни руди (SO 2 - свързан газ при печене на пирит):
S + O 2 = SO2(280–360 ° C)
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2(800 ° С, печене)
в лабораторията - заместване на сулфити със сярна киселина:
BaS03 (t) + H2SO4 (конц.) = BaS04 4 + S02 + H20
Натриев сулфит Na2S03. Oksosol. Бяла. При нагряване във въздуха той се разлага без топене, стопява се под налягане на аргон. В мокро състояние и в разтвор, чувствителен към кислород във въздуха. Той е разтворим във вода, хидролизира се от анион. Разлага се от киселини. Типичен редуциращ агент.
Качествена реакция на йон SO 3 2 - образуването на бяла утайка от бариев сулфит, която се прехвърля в разтвора със силни киселини (HCl, HNO 3).
Използва се като реагент в аналитичната химия, компонент на фотографски решения, неутрализатор на хлор при избелване на тъкани.
Уравненията на най-важните реакции:
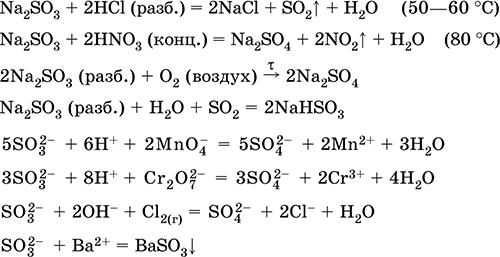
Получаване:
Na2C03 (конц.) + S02 = Na2S03 + CO 2
Сярна киселина. сулфати
Сярна киселина H2S04. Оксоилова киселина. Безцветна течност, много вискозна (маслена), много хигроскопична. Молекулата има изкривена тетраедрална структура (sp 3 гиб хибридизация), съдържа ковалентни σ - връзки S - OH и σπ - връзки S = O. Йонът SO 4 2- има правилно-тетраедрална структура. Той има широк температурен диапазон на течното състояние (~ 300 градуса). При нагряване над 296 ° C частично се разлага. Дестилира се като азеотропна смес с вода (масовата част на киселината е 98,3%, температурата на кипене е 296–340 ° C), напълно се разлага с по-силно нагряване. Неограничени смеси с вода (със силни екзо-effect). Силна киселина в разтвор, неутрализирана с алкални и амонячни хидрати. Конвертира метали в сулфати (при излишък на концентрирана киселина при нормални условия се образуват разтворими хидросулфати), но Be, Bi, Co, Fe, Mg и Nb метали се пасивират в концентрираната киселина и не реагират с него. Реагира с основни оксиди и хидроксиди, разлага соли на слаби киселини. Слаб окислител в разреден разтвор (поради H I), силен - в концентриран разтвор (поради S VI). Добре се разтваря SO 3 и реагира с него (образува се тежка мазна течност - олеум, съдържа Н2S2O7).
Качествена реакция върху SO 4 2 - йон - утаяване на бял бариев сулфат BaSO 4 (утайката не се превръща в разтвор на солна и азотна киселина, за разлика от бялата утайка BaSO 3).
Използва се в производството на сулфати и други серни съединения, минерални торове, взривни вещества, оцветители и лекарства, в органичен синтез, за “отваряне” (първи етап на преработка) на индустриално важни руди и минерали, в рафиниране на петролни продукти, електролиза на вода, като електролит на оловни батерии. , Отровни, причинява изгаряния на кожата. Уравненията на най-важните реакции:
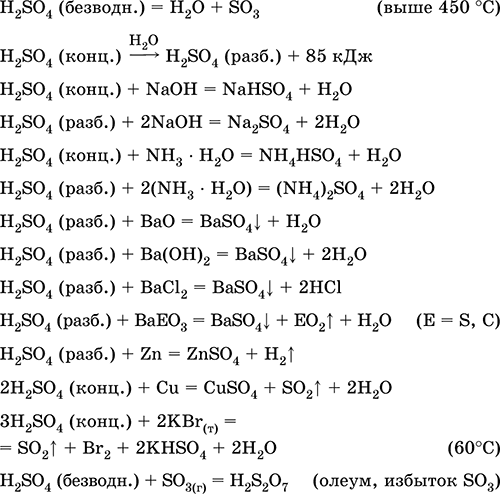
приемане в промишленост:
а) синтез на SO 2 от сяра, сулфидни руди, сероводородни и сулфатни руди:
S + O 2 (въздух) = SO2(280–360 ° C)
4FeS 2 + 11O 2 (въздух) = 8 SO2 + 2Fe 2 O 3 (800 ° С, печене)
2H2S + 30 2 (g) = 2 SO2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (кокс) = CaO + SO2 + CO (1300–1500 ° C)
b) превръщане на SO 2 в SO 3 в контактния апарат:
в) синтез на концентрирана и безводна сярна киселина:
Н20 (Coll. H2S04) + S03 = H2S04(конц., безводен)
(абсорбцията на SO3 чрез чиста вода с производството на H2S04 не се извършва поради силното нагряване на сместа и обратното разлагане на H2SO4, виж по-горе);
d) синтез олеум - смес от безводен H2SO4, дизаринова киселина H 2 S 2 O 7 и излишък на SO3. Разтвореният SO3 осигурява безводен олеум (H 2 SO 4 се образува веднага, когато водата попадне), което позволява безопасното му транспортиране в стоманени резервоари.
Натриев сулфат Na2S04. Oksosol. Бял, хигроскопичен. Разтопява се и кипи без разлагане. Образува кристален хидрат (минерал мирабилит) лесно губи вода; техническо име Глауберовата сол. Разтворим във вода, не хидролизиран. Реагира с H2S04 (конц.), S03. Възстановен от водород, кокс при нагряване. Той влиза в реакции на йонообмен.
Използва се при производството на стъкло, целулоза и минерални бои, като лекарство. Съдържа се в саламура на солените езера, по-специално в залива Кара-Богаз-Гол на Каспийско море.
Уравненията на най-важните реакции:
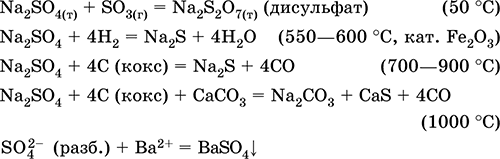
Калиев хидросулфат KHSO 4. Кисела оксолова сол. Бял, хигроскопичен, но не образува кристални хидрати. При нагряване се топи и се разлага. Той е добре разтворим във вода, анионът претърпява дисоциация в разтвор, средата на разтваряне е силно кисела. Неутрализира се с алкали.
Използва се като компонент на флюсовете в металургията, неразделна част от минерални торове.
Уравненията на най-важните реакции:
2KHSO4 = K2SO4 + H2SO4 (до 240 ° С)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO 4 (разреден) + КОН (конц.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450–700 ° C)
6KHSO 4 + M 2 O 3 = 2 KM (SO 4) 2 + 2 K 2 SO 4 + 3H 2 O (350–500 ° C, M = Al, Cr)
приемане: обработка на калиев сулфат в студената (с повече от 60%) сярна киселина
K2S04 + H2SO4 (конц.) = 2 KHSO 4
Калциев сулфат CaSO 4. Oksosol. Бяла, много хигроскопична, огнеупорна, разлага се при калциниране. Естественият CaSO 4 се намира под формата на много често срещан минерал гипс CaSO 4 2H 2 O. При 130 ° С гипсът губи част от водата и преминава в изгорена мазилка2CaSO4H2O (техническо име Алабастър). Напълно дехидратиран (200 ° С) гипс отговаря на минерала анхидритCaS04. Той е слабо разтворим във вода (0,206 g / 100 g H 2 O при 20 ° C), разтворимостта намалява при нагряване. Реагира с H2S04 (конц.). Възстановен чрез кокс по време на синтеза. Определя по-голямата част от "постоянната" твърдост на прясна вода (за повече подробности, виж 9.2).
Уравненията на най-важните реакции: 100–128 ° C
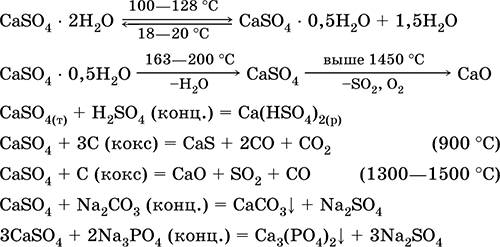
Използва се като суровина при производството на SO 2, H 2 SO 4 и (NH 4) 2 SO 4, като флюс в металургията, хартиени пълнители. Свързващият разтвор, приготвен от изгорял гипс, "се поставя" по-бързо от сместа на базата на Ca (OH) 2. Втвърдяването се осигурява от свързването на водата, образуването на гипс под формата на каменна маса. Изгореният гипс се използва за изработка на гипсови отливки, архитектурни и декоративни форми и изделия, преградни стени и панели и каменни подове.
Алуминиев калиев сулфат КА1 (SO4) 2. Двойна оксолова сол. Бял, хигроскопичен. При силна топлина се разлага. Образува кристален хидрат - двуалуминиев калиев алум. Умерено разтворим във вода, хидролизиран чрез алуминиев катион. Реагира с алкали, амонячен хидрат.
Използва се като разяждащо средство при боядисване на тъкани, дъбене на кожа, коагулант в пречистване на прясна вода, компонент от състави за оразмеряване на хартия и външен хемостатичен агент в медицината и козметологията. Образува се чрез ко-кристализация на алуминий и калиев сулфат.
Уравненията на най-важните реакции:
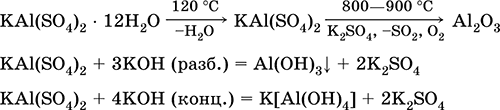
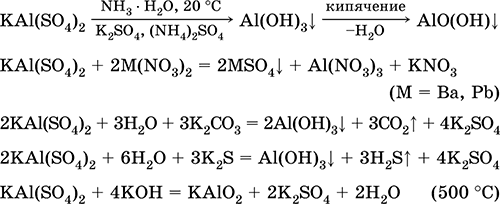
Хром (III) сулфат - калий KCr (SO 4) 2. Двойна оксолова сол. Червено (тъмно пурпурен хидрат, техническо име калиев алум). При нагряване се разлага без топене. Той е лесно разтворим във вода (сиво-синият цвят на разтвора съответства на аквакомплекс 3+), хидролизира се чрез хрома (III) катион. Реагира с алкали, амонячен хидрат. Слаб окислител и редуциращ агент. Той влиза в реакции на йонообмен.
Качествени реакции до Cr 3+ йон - редукция до Cr 2+ или окисление до жълто CrO 4 2-.
Той се използва като средство за придобиване на тен за кожа, разхлаждащо средство при боядисване на тъкани, реагент в снимка. Образува се чрез съкристализация на хром (III) и калиев сулфат. Уравненията на най-важните реакции:
Манганов (II) сулфат MnSO4. Oksosol. Бяло, когато се калцинира, се топи и разлага. Кристален хидрат MnSO 4 5H 2 O - червено - розово, техническо име манган. Разтворим във вода, светлорозов (почти безцветен) цвят на разтвора съответства на аквакомплекс 2+; хидролизира чрез катион. Реагира с алкали, амонячен хидрат. Слаб редуциращ агент реагира с типични (силни) окислителни агенти.
Качествени реакции към йон на Mn 2+ - проводимост с йон на MnO 4 и изчезване на виолетовия цвят на последния, окисление на Mn2 + до MnO4 и поява на виолетов цвят.
Използва се за получаване на Mn, MnO 2 и други съединения на мангана като микроелементи и аналитичен реагент.
Уравненията на най-важните реакции:
Получаване:
2MnO2 + 2H2S04 (конц.) = 2 MnS04 + O2 + 2H2O (100 ° С)
Железен (II) сулфат FeSO4. Oksosol. Бял (хидрат светло зелено, техническо име железен витрий),хигроскопичен. Разлага се при нагряване. Той е разтворим във вода, в малка степен хидролизиран чрез катион. Той се окислява бързо в разтвор от кислород във въздуха (разтворът става жълт и става облачно). Реагира с киселинно-окислителни агенти, основи, амонячен хидрат. Типичен редуциращ агент.
Използва се като компонент на минералните бои, електролитите в галваничното покритие, консервант за дърво, фунгицид, антианемично лекарство. В лабораторията по-често се приема като двойна сол Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( солна море) по-устойчиви на въздух.
Уравненията на най-важните реакции:
![]()
Получаване:
Fe + H2SO4 (dec.) = FeSO 4+ Н2
FeC03 + H2SO4 (пар.) = FeSO 4 + СОг + Н20
7.4. VA-група неметали
Азот. амоняк
азот - елемент от 2-ри период и VA-групата на Периодичната система, сериен номер 7. Атомна електронна формула [2 He] 2s 2 2p 3, характеристични окислителни състояния 0, –III, + III и + V, по-рядко + II, + IV и и др.; Състоянието на v се счита за относително стабилно.
Скала за окисление на азота:
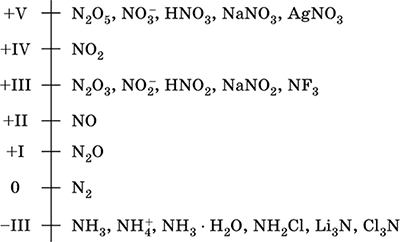
Азотът има висока електронегативност (3.07), третата след F и O. Показва типични неметални (киселинни) свойства. Образува различни кислородсъдържащи киселини, соли и бинарни съединения, както и амониевия катион NH 4 + и неговите соли.
В природата - седемнадесети химичен елемент на разпространението (девети сред неметалите). Важен елемент за всички организми.
Азот N2. Обикновено вещество. Състои се от неполярни молекули с много стабилна σππ - връзка N ≡ N, което обяснява химическата инертност на азота при нормални условия. Безцветен газ без мирис, който кондензира в безцветна течност (за разлика от O 2).
Основният компонент на въздуха: 78.09% обемни, 75.52% тегловни. От течен въздух азотът кипи над кислород О2. Той е слабо разтворим във вода (15,4 ml / 1 l H 2 O при 20 ° C), разтворимостта на азота е по-малка от тази на кислорода.
При стайна температура N 2 реагира само с литий (във влажна атмосфера), образувайки литиев нитрид Li 3 N, нитриди от други елементи се синтезират със силно нагряване:
N2 + 3Mg = Mg3N2 (800 ° С)
При електрически разряд N 2 реагира с флуор и в много малка степен с кислород:
Обратима реакция за производство на амоняк се осъществява при 500 ° C, под налягане до 350 atm и задължително в присъствието на катализатор (Fe / F 2 O 3 / FeO, в лабораторията Pt):
В съответствие с принципа на Ле Шателие, увеличаването на добива на амоняк трябва да настъпи с увеличаване на налягането и понижаване на температурата. Въпреки това, скоростта на реакцията при ниски температури е много ниска, така че процесът се извършва при 450-500 ° C, достигайки до 15% добив на амоняк. Нереагиралият N2 и Н2 се връщат в реактора и по този начин увеличават степента на реакция.
Азотът е химически пасивен по отношение на киселини и основи, не поддържа горенето.
приемане в промишленост - фракционна дестилация на течен въздух или отстраняване на кислорода от въздуха чрез химически средства, например чрез реакция 2C (кокс) + O 2 = 2CO чрез нагряване. В тези случаи се произвежда азот, който съдържа и примеси на благородни газове (главно аргон).
Най- лаборатория малки количества химически чист азот могат да се получат чрез комбинация с умерено нагряване:
N-III H 4 N III O 2 (t) = N 2 0 + 2 H 2 O (60–70 ° C)
NH4C1 (p) + KNO2 (p) = N2O + КС1 + 2Н20 (100 ° С)
Използва се за синтез на амоняк, азотна киселина и други азотсъдържащи продукти, като инертна среда за химични и металургични процеси и съхранение на запалими вещества.
Амоняк NH3. Бинарно съединение, степента на окисление на азота е - III. Безцветен газ с остър характерен мирис. Молекулата има структура на непълен тетраедър [: N (H) 3)] (sp 3 гиб-хибридизация). Наличието на азот в молекулата на NH 3 на електронна донорна двойка в sp 3 - хибридна орбиталност води до характерна реакция на добавяне на водородния катион, с образуването на катион. амоний NH4 +. Втечнен под налягане при стайна температура. В течно състояние е свързано поради водородни връзки. Термично нестабилна. Той е разтворим във вода (повече от 700 l / 1 l H 2 O при 20 ° C); делът в наситения разтвор е = 34% от масата и = 99% обемни, рН = 11.8.
Силно реактивен, склонен към реакции на прибавяне. Възниква в кислород, реагира с киселини. Притежава редуциращи (поради N-III) и окислителни (поради HI) свойства. Изсушава се само с калциев оксид.
Качествени реакции - образуването на бял "дим" в контакт с газообразен HCl, почерняването на хартията, навлажнена с разтвор на Hg 2 (NO 3) 2.
Междинно съединение в синтеза на HNO3 и амониеви соли. Използва се при производството на сода, азотни торове, багрила, експлозиви; течен амоняк е охладител. Токсичен.
Уравненията на най-важните реакции:
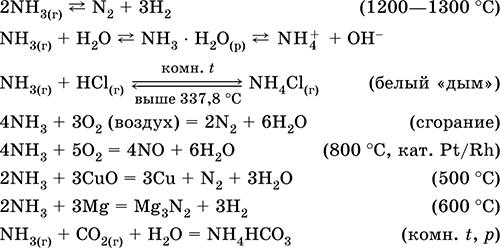
приемане: in лаборатория - изместване на амоняка от амониеви соли при нагряване с натриева вар (NaOH + CaO):
или кипене на воден разтвор на амоняк, последвано от сушене на газа.
Най- промишленост амонякът се синтезира от азот (виж) с водород. Произвежда се от промишлеността или в течно състояние, или под формата на концентриран воден разтвор под техническото име амонячна вода.
Амонячен хидрат NH3H20. Междумолекулно съединение. Бяла, в кристалната решетка са NH 3 и H 2 O молекули, свързани с слаба водородна връзка Н 3 N ... HON. Присъства във воден разтвор на амоняк, слаба основа (продуктите на дисоциация - катионът NH 4 - и анионът OH -). Амониевият катион има редовно π-тетраедрична структура (sp3 - хибридизация). Термично нестабилна, напълно разградена чрез кипене на разтвора. Неутрализирано от силни киселини. Показва редуциращи свойства (дължащи се на N III) в концентриран разтвор. Той влиза в реакцията на йонообмен и комплексообразуване.
Качествена реакция - образуването на бял "дим" в контакт с газообразен HCl.
Използва се за създаване на слаба алкална среда в разтвор, по време на утаяването на амфотерни хидроксиди.
Разтворът на 1М амоняк съдържа основно NH3H20 хидрат и само 0,4% NH4 + и OH - йони (поради дисоциацията на хидрата); по този начин, йонният "амониев хидроксид NH4OH" практически не се съдържа в разтвора, няма такова съединение в твърдия хидрат. Уравненията на най-важните реакции:
NH3H20 (конц.) = NH3 + Н20 (кипене с NaOH)
NH3H20 + НС1 (разл.) = NH4C1 + H20
3 (NH3H20) (конц.) + CrCl 3 = Cr (OH) 3 + 3NH 4 Cl
8 (NH3H2O) (конц.) + ЗБг 2 (р) = N2 + 6NH4Br + 8H2O (40-50 ° С)
2 (NH3H20) (конц.) + 2KMnO4 = N2 + 2MnO2 + 4H2O + 2KON
4 (NH3H20) (конц.) + Ag 2 O = 2OH + 3H20
4 (NH3H20) (конц.) + Cu (OH) 2 + (OH) 2 + 4H2O
6 (NH3H20) (конц.) + NiCl2 = CI2 + 6H2O
Често се нарича разреден разтвор на амоняк (3-10% -) течен амоняк (името е измислено от алхимиците) и концентрирания разтвор (18,5–25%) амонячна вода (произведени от промишлеността).
