На аморфен силициев диоксид. Силициев диоксид.
SILICON DIOXIDE (силициев диоксид) SiO2, bestsv. кристално, аморфно или стъклено вещество.
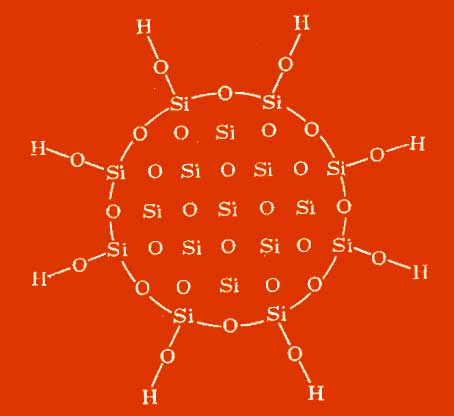
Структура. СИЛИКА ДИОКСИД d. Съществува в няколко полиморфни модификации (виж таблицата). Преходни температури при нормално налягане: a-кварц D b -квартц 575 ° C (DH 0 преход 0.41 kJ / mol), p-кварц D p-кристобалит 927 ° C (2.26 kJ / mol), p-кварц D g -тридимит 867 ° С (0.50 kJ / mol), a-тридмит D b -тридимит 115 ° С (0.27 kJ / mol), b-тридимит D g -тридимит 160 ° С (0.15 kJ) / мол), g-дитимит D b-кристобалит 1470 ° С (0.21 kJ / mol), а-кристобалит D b-кристобалит 270 ° С. Температурата на топене на р-кварц е 1610 ° С (D H 0 mp 8.53 kJ / mol), g-тридимит 1680 ° С, b -кристобалит 1723 ° С (D H 0 pl 9.6 kJ / mol). Полиморфните трансформирани кварц, тридимит и кристобалит са придружени от промяна в обема. Кристалните форми на SILICON DIOXIDE са конструирани от SiO 4 тетраедри, а а- и b-формите се отличават с леко изместване и въртене на тетраедрата. За нискотемпературните тридимити също са дадени данни за други кристални кристали. въпреки това, всички те съдържат b-тремитит като основна структурна единица, но са различно изкривени. Например, са описани триклинични и моноклинни тридимити. В природата също е намерен кубичен. SiO2 модификация - меланфлогит (а = 1.3402 nm, z = 48, пространствена група Pt3p). При високи налягания се образуват китове (80-130 МРа, 400-500 ° С), коесит (1.5-4 GPa, 300-1700 ° C), стишовит (16-18 GPa, 1200-1400 ° C). Stishovit е единствената модификация на SILICON DIOXIDE, изградена от SiO 6 октаедра. Стабилността на тридимита вероятно се определя от примесите на Na и Al. Нестабилната форма на силиций DIOXIDd. - ромбо-дипирамидален "влакнест силициев диоксид". В допълнение към кристалните кристали, SILICON DIOXIDE може да има и други форми на съществуване. Скрит кристал форми (халцедон) са сходни по структура с кварц. Когато се извличат катиони от определени силикати с киселина, се получава хидрат. кристален, силициев диоксид. Те наследяват текстурата на изходните минерали, образувайки влакнести, люспести (лепидоидни) и листообразни слоести структури. Известни са аморфни анизотропни и изотропни (опалови) образувания, фин естествен силициев диоксид (триполи, синтетичен колоиден силициев диоксид и силициеви прахове). Хидратирани. аморфен силициев диоксид, утаен от разтвори на Na силикат и др., полимеризирани към сферич. частици с диаметър по-малък от 100 nm, обикновено 2-3 nm. Получава се аморфен силициев диоксид под формата на листовки, ленти и влакна (виж Силикагел). При високи температури от газовата фаза се отделят фини прахове от пирогенен безводен силициев диоксид - Aerosil и други. За стъкловидното тяло, виж.
Properties. Налягането на парите на SILICON DIOXIDE, 13.3-133 Pa, близо до точката на топене. SILICA DIOXIDED. - диелектрик, r 10 12 Ohm * m (20 ° С), 9 * 10 - 1 Ohm * m (1600 ° C). А-кварцовите монокристали имат хирална структура, която определя тяхната оптична активност и пиезоелектриката. свойства. Кварцът е прозрачен за UV и частично инфрачервени лъчи.
Клиничната картина на остра силикоза се характеризира с недостиг на въздух, който се влошава бързо, кахексия, хронични признаци на белодробно сърце и хистологична алвеоларна протеиноза. При остра силикоза не се изисква белодробна фиброза. Рентгеновото изследване открива пълнене на въздушно пространство в различна степен, което прави изображението на "кондензация" или "матирано стъкло", което е подходящо за диференциалната диагноза на идиопатичната алвеоларна протеиноза, радиологичния, хеморагичния алвеолит, пневмонията, острия белодробен оток.
* Рефракционни индекси: N g - повече, N p - по-малко. ** А - и б - кварц имат две интервали. групи, както за двете форми, леви и десни оптични изомери са възможни. *** b -120 ° С.
Разтворимостта на α-кварц във вода е 10–3% тегловни (25 ° C), аморфните форми на силициевия диоксид са 0,007-0,015% (за водни разтвори на SiO 2, виж силициеви киселини). Разтворимостта на силициев диоксид в кисела и алкална среда се определя от естеството на разтворителя. СИЛИКА ДИОКСИД d) Неразтворим в повечето органични разтворители. Реагира с флуороводородна киселина, за да образува флуоросиликатна киселина. При 250-400 ° С взаимодействието с газообразен HF, F2 (даващ SiF4) при 200-250 ° С - с NH4HF2. В смес с въглища той реагира с Cl 2 при нагряване, образувайки SiCl4. Аморфният силициев диоксид се разтваря бавно във водни разтвори на алкали, Na2C03 (дава силикати) и NH4F (образувайки флуоросиликати), скоростта на разтваряне се увеличава с увеличаване на налягането и температурата. Когато смеси от прахообразен СИЛИКОН ДИОКСИД се загряват с различни оксиди, се образуват силикати, а когато са кондензирани с Na2C03 и Na2SO4, той е водоразтворим натриев силикат (виж също разтворимото стъкло).
Разпространение в природата. Съдържание на свободен силициев диоксид в земната кора 12%; тя също е включена в скалите под формата на различни силикати или под формата на смеси с други минерали (гранит). Кварцът е един от най-разпространените минерали: тридимит, кристобалит, лшателит (естествено кварцово стъкло), халцедон, опали са много по-рядко срещани. Малки кварцови кристали, с различна ориентация, образуват кварц "ганг". С разрушаването на скали възникват кварцови пясъци, уплътняването на които води до образуването на пясъчници и кварцити. Haib. чистият кварц е скален кристал, чиито кристали могат да достигнат до няколко метра и тежат десетки тонове. Монокристалите на кварца са прозрачни, безцветни (скален кристал) или оцветени с примеси във виолетови (аметист), черни (марион), жълти (цитринови), димни (rauch-topaz) цветове. Видове криптокристални. кварцови форми: розово-червен карнеол, синкав сапфирин, ябълково-зелена хризопраз, лентови ахати и оникси, фино оцветени яспири, силиций и хорфелси. Wiikalen аморфен "благороден" опал, състоящ се от хомогенни колоидни частици с диаметър 0,1-0,3 μm, плътно опаковани в подредени агломерати; водното му съдържание е по-малко от 1% от масата (за повечето обикновени опали 4–9%). На стр. отлагания от силициев двуокис също образуват триполи, диатомит и др. Черупките на диатомеи и скелети на някои гъби са изградени от силициев диоксид; Той укрепва стъблата на растенията - хвощ, бамбук, тръстика, се съдържа в сламата. SILICON DIOXIDE е отговорен за силицирането на формите на живите растителни организми. Концентрацията на силициев диоксид в човешка кръв и плазма е 0,001% тегловни.
Първи. Синтетичен. СИЛИКОН ДИОКСИД d) Получаване: действието на киселини (H2SO4, HCl, CO 2) върху Na силикат, по-рядко върху други разтворими силикати (основният начин на производство в капиталистическите страни); от колоиден силициев диоксид чрез коагулация под действието на йони Na +, NH4, F - или чрез замразяване; хидролиза на SiCl4, SiF4, (NH4) 2SiF6, (C2H5O) 4Si във водни, амонячно-водни разтвори (понякога с добавяне на етанол или органични основи) и в газова фаза. Аморфен силициев диоксид D. Получава се също от триполи и диатомит чрез изгаряне на оризови люспи и смилане на разтопен кварцов пясък. Безводните прахове от силициев диоксид с висока специфична повърхност се получават чрез химическо отлагане на пари чрез изгаряне на пари SiCl 4 в смес от Н 2 и О 2 (аеросил, в САЩ - Cabosil), окисляващи и хидролизиращи пари на естери на Si (пирогенен силициев диоксид), и също SiF4 (флуозил). Първоначално кондензираните частици SILICON DIOXIDE, диаметър 1 nm, са плътно опаковани във вторични конгломерати, комбинирани в свободна структура със специфична повърхност 200-400 m2 / g. Монокристалите А-кварц се отглеждат от алкални разтвори на СИЛИКОН ДИОКСИД в автоклави с високо налягане (35-120 МРа) при 300-420 ° С (виж Хидротермални процеси). При производството на материали, използвани в техниката на базата на SILICON DIOXIDE, се използват следните процеси:
- химическо отлагане от газовата фаза при високотемпературно изгаряне на SiCl 4, предварително пречистено чрез дестилация. Частици от силициев диоксид, образувани в кислород-водороден пламък или плазма, се утаяват като се получават масивни кварцови стъкла или слоеве от оптични влакна;
- повърхностно окисление на един кристал. Si с образуването на хетероструктури (при производството на интегрални схеми);
- синтероване на фин силициев диоксид в кварцова керамика (виж също керамика);
- зол-гел процес, включващ хидролиза на органично съединение Si, бавна дехидратация на образувания гел и умерено нагряване. Използва се за производство на кварцово и високо силициево стъкло;
- получаване на високочисти SILICON DIOXIDE и порести чаши (тип Vicore) чрез термодинамично третиране на водещото боросиликатно стъкло, промиване с киселина и промиване на силициевата рамка.
На стр. Силициевият двуокис се използва при производството на силикатни стъкла, порцеланови и керамични изделия, абразиви, бетон, силикатни тухли, динаси и керамика. Синтетичен. СИЛИКОН ДИОКСИД d. ("Бяла сажди") - пълнител при производството на каучук (до 70% от произведения SILICON DIOXIDE d.). Ние спечелихме. използва се утаен хидрат. силициев диоксид (съдържащ 85-95% SiO 2) със специфична повърхност 60-300 m 2 / g, в по-малка степен - безводен силициев диоксид аеросил тип. Аеросил е също така и адсорбент в хроматографията, сгъстител на лубриканти, лепила, бои, кварцовите монокристали се използват в радиотехниката (пиезоелектрични, честотни стабилизатори, филтри, резонатори и др.) спектрографи, монохроматори, лещи за UV оптика и др.), в бижута (прозрачни, красиво оцветени сортове - полускъпоценни камъни). Силикагелни гелове с ефективен диаметър на порите от 2-15 nm се използват като бала. сорбенти и носители на катализатор. Синтетичен. СИЛИКОН ДИОКСИД и скален кристал са суровина за производството на монокристали от кварц, кварцово стъкло, керамика и кварцови влакна. Кварцово стъкло и керамика -. материал в авиатите. индустрия (например за прозорци и прозорци на самолети), в оптика (за входни прозорци, оптични устройства от UV и IK диапазони), в електрониката (линии за закъснение) и др. Кварцов плат е топлоизолационен материал. Кварцовите влакна се използват за създаване на оптични (светловодни) комуникационни линии и системи за предаване на информация. Синтетично производство СИЛИКОНОВ ДИОКСИД d. страни 600-700 хиляди тона / година (1980). Когато SILICON DIOXIDE влезе в живата тъкан, грануломите се развиват бавно. Силициевият прах предизвиква дразнене отгоре. dyhat. начини и бронхи, заболяване на стомашно-чревния тракт, с продължително вдишване - сериозно заболяване - силикоза на белите дробове. MPC при съдържанието на SiO 2 в прах на St. 70% - 1 mg / m 3, 10-70% - 2 mg / m 3, 2-10% - 4 mg / m 3.
Белодробна функция: рестриктивна дисфункция, променен алвеолокапилярният трансфер. Направена е диференциална диагноза на остра силикоза: алвеоларна протеиноза, идиопатичен хеморагичен алвеолит, пневмония, белодробен оток. Връзката между силикозата и туберкулозата изисква активен туберкулозен процес.
Хронична обструктивна бронхопневмопатия. Най-често срещаната връзка между силикозата и ревматоидния артрит е асоциацията, която определя синдрома на Каплан. Синдромът на Еразъм е асоциация на силикоза-склеродерма. Лесно новообразувание. Силикозни усложнения усложнения от респираторни инфекции, хроничен бронхит, емфизем, пневмоторакс, дихателна недостатъчност, хронична белодробна болест на сърцето.
Физични и химични свойства на аеросил (силициев диоксид)
aeroforces (от латинската дума - Aerosilum), оксили (от латинската дума - Oxylum) силициев диоксид, Колоидален силициев анхидрид (Ph. Eur.), Колоиден силициев диоксид (USP), колоиден безводен силициев диоксид (BP), силициев двуокис (CAS № 7631-86-9) - безводен аморфен силициев диоксид, принадлежи към групата на синтетичните активни високодисперсни минерални пълнители. В фармацията Aerosil (силициев диоксид) се използва като помощно вещество, стабилизатор, желиращ агент, адсорбент, подобрява течливостта на таблетки, мехлем, гел и други смеси. Понякога се използва силициев диоксид като активна фармакологична съставка (притежава антибактериални свойства, детоксикатор, сорбент).
Рентгенографиите са стандарт за комитетите за белодробно свързване.Пневмокониозата е организирана в клиники за професионални заболявания. Симптоматично лечение: липсват клинични прояви в ранните стадии, така че симптоматичното лечение се прилага в края на началото, комплексно и включва лечение с антибиотици, бронходилататори, GCS, флуидизация и отхрачващо храчки, отхрачващо средство, антитуберкулоза, диуретици, инотропни средства и дигиталиси, блокери вазодилататори на калциев канал.
Профилактика на инфекциозни усложнения: хирургично лечение на остри респираторни инфекции; Химиопрофилактиката на туберкулозата е полезна за профилактика на туберкулоза и за предотвратяване на рецидиви при пациенти със силикоза на туберкулоза, грип и пневмококова полизахаридна имунизация.
получавам силициев диоксид чрез хидролиза на пари от силициев тетрахлорид в водороден пламък при температура\u003e 1000 ° С (1100-1400 ° С). Полученият продукт е бял, аморфен, непорест, безразличен прах, съдържащ 99,3% Si02; има висока дисперсия (диаметър на частиците 4-40 микрона, има сферична или почти сферична форма), специфичната адсорбционна повърхност е 50-450 m2 / g; обемният обем е около 50 g / l, плътност - 2.36 g / cm3; рН на водната суспензия е 4,0; индекс на пречупване n20D = 1.46. Аеросил не се разтваря във вода, киселини и разредени основи. При концентрация на аеросил във вода в количество от 10-12% се образува нисковискозна течна суспензия, при 17% - полутвърда маса при 20% - груба маса, която при триене се превръща в хомогенна мазна маса. Поради високия афинитет към водата, аеросилът се нарича хидрофилни вещества. Но силициев диоксид (аеросил) марка R972 има хидрофобни свойства.
Други благоприятни мерки са излекувани, не се препоръчва пушенето, намаляване на приема на сол, високо протеинова диета. Хънтър Вече, Букурещ. Тя е в твърдо състояние и е един от най-разпространените минерали на Земята, който е основният компонент на пясъка. Силициевият диоксид може да съществува в кристална или аморфна форма. Форми на силициев диоксид обикновено се разпространяват като вулканична лава. Кристалните форми на силициев двуокис със свиване с аморфни форми имат много по-ниска устойчивост на примеси.
Има няколко търговски марки на Aerosil (силициев диоксид)които се различават главно по специфичната повърхност, степента на хидрофилност или хидрофобност, както и присъствието на други пълнители. Според определението на комисията по номенклатурата аморфният силициев диоксид се нарича оксид. В Украйна химическо и металургично предприятие, лицензирано от Degussa, произвежда немодифициран стандартен аеросил от 175 марки; 300 380 с хидрофилна повърхност; Метил арозил АМ-1/175 и АМ-1/300, модифициран диметилдихлоросилан; етерни органосиликуми от марките ADEG-175 и ADEG-300, модифицирани с етилен гликол и диетилен гликол, и АМ-2, модифицирани с аминоалкохоли. В Съединените щати се произвежда модифициран аеросил - органосил и кебосил (Cabot), в Русия, бутозил, аеросил-К, който е комбинация от 85% силициев диоксид и 15% нишесте, COK-84 аеросил, който е коагулант от 85% силиций и 14% амониев оксид. В Германия компанията "Degussa" произвежда хидратирани марки аеросилсъдържащи свързана вода (durosil, vulkasin, sifloks, ultrasil и др.), които се различават по съдържание на SiO2, диаметър на частиците, плътност и свойства), аеросил под формата на суспензии (К-314, съдържа 14% А, К-328, съдържа 28% A.). В Япония микросилът се произвежда и носи, във Франция - Francil, в Англия - Manosil. За козметика може да се направи под формата на паста. Наскоро във фармакопеята на различни страни (Унгария, Дания, Австрия и др.) Беше въведена аеросил. В САЩ силициев диоксид (аеросил) също се допуска като добавка към хранителните продукти в размер на 2%.
Органичният и минералният силициев диоксид се появява в човешкото тяло в неговата естествена форма и се съдържа в различни количества в сурови зеленчуци, растения и зърнени култури. Има висока твърдост. Често: аморфната форма на силициевия диоксид се разтваря в алкали. Авантюрин - розиатик. Поради примеси: цитринът е жълт. Кристалната форма е много важен компонент на много голямо количество минерали и скъпоценни камъни. 9 - Защото има нисък коефициент на топлинно разширение. Той е чист и бял в прахообразна форма.
Той е много устойчив на температурни промени и може да се използва в части, които са изложени на топло и студено. В лабораториите от кварцово стъкло почти незаменими. Предмети на изкуството. И за всички кожни проблеми, това е правилното решение. Производство на детергенти. Или филтрирайте ултравиолетовото лъчение. Значение: Andy Синтетичният силициев диоксид се използва при производството на бои. Силициев диоксид действа върху всички възпалителни процеси. Като електрически изолатор.
aeroforces теорията за "чистите" вещества, които освобождават активните съставки без разходи за енергия. Електронно-микроскопските изследвания показват, че всяка основна частица аеросил се състои от четири отделни слоя (фигура). Ядрото на тази частица е триизмерен полимер на SiO2 елементите. При наличието на силиконови Si-OH и силоксанови Si-O-Si групи на повърхността на частиците, Aerosil е в състояние да създаде подобна на модел структура благодарение на водородните връзки, което позволява ограничаване на термичното разширение на желираната течност. Силоксановите и силановите групи в аеросил са функционални, а силиконово-кислородната връзка се характеризира с висока якост (достига 372,5 J / mol), което се обяснява с неговата полярност, поради която ковалентната връзка се доближава до йонната връзка.
Използва се и в козметичната индустрия. езеро. В металургията. Получаване на силициев силициев диоксид с различни редуциращи агенти. Така се получава нечист силиций. Реакцията е силно екзотермична. Използва електрическа пещ с графитни електроди. Така полученият силиций е рафиниран или силанов трихлор. Преработва се суров силиций или феросилиций. Полученият силиций се разтваря в излишък от стопен алуминий, замърсен с магнезиев силиций. Чрез този процес се събират примеси в единия край на силиконовата кора, която трябва да се третира.
Таблица - Основни свойства на силициев диоксид (Aerosil)
Фигура. Структурата на пространствената решетка на Aerosil в хидрогел
Силанолните групи са неравномерно разпределени. Има повърхностни силан групи, които могат да бъдат свободни или свързани с водородни мостове, и силанолни групи в молекулата, които също могат да бъдат свързани помежду си с водородни мостове. В резултат се създава разклонена насипна структура, в резултат на което аерозилът се нарича неорганичен полимер. Силоксановите групи имат хидрофобни свойства, те са стабилни (ОН силанолните групи се отделят при температура\u003e 300 ° С), предизвикват кисела реакция; имат хидроксилни групи както на повърхността, така и вътре Аеросил молекули, При равномерно разпределение всеки втори силиконов атом има хидроксилна група на повърхността.
Електролизата на водата се извършва чрез въвеждане на основата във водата. Инсталацията, използвана за електролиза, се нарича електрик Коулман. Завод за електролиза на вода се състои от: - електролиза, където се извършва електролиза. - графитни електролити, които имат специални наименования: аноден или положителен електрод и катоден или отрицателен електрод. След края на веригата тя е киселина или електролит или електролизер. - добро електропроводимо решение. Той не преминава през чиста вода, алкали или сол, но не участва в реакцията.
При производството на стъкло се използва силициев диоксид. На анода се получава дори кислород. Електролизата е свойство на някои вещества да се разлагат с помощта на електрически ток, който действа като катализатор. Но много преди появата. Изследователите успяха да възстановят данните. Откриването на кислород: кислород е открито от Карл Вилхелм Шеле и Джоузеф Пристли. Получаването на проби от първичен кислород може да помогне на изследователите да определят как небесните тела се развиват по различни начини. Кислород-17 и кислород - след като капсулата се разпадна в пустинята в Юта.
Това води до три вида аеросил взаимодействие: физическа адсорбция, химична адсорбция (образуване на водородни мостове от силанолни групи с вода, алкохоли, киселини и други вещества) и химични реакции на повърхността на молекулата. Така, силанолните групи взаимодействат с алкохоли, за да образуват етери.
Аеросил (силициев диоксид) има добри сорбционни свойства, абсорбира от 15 до 60% различни течности в зависимост от тяхната природа, без да променя вида и течливостта на праха. Първият слой вода се абсорбира от аеросил поради създаването на водородни мостове (химична адсорбция), а следващите слоеве се дължат на физическа адсорбция. Физически адсорбираната вода се отделя при температура 25-150 ° С, докато химически адсорбираната вода се отделя при 800 ° С.
Така думата "кислород" означава киселинен производител. Откритието е много важно за възстановяване на еволюцията на небесните тела в близост до Земята. Но причината за промените в различните части на слънчевата система е неизвестна. Бехер разкрива, че силициевият диоксид съдържа нова земя, а след това и силиций. Името, предложено от Лавуазие, произлиза от грешката на великия химик, който вярва, че всички киселини съдържат кислород. Антоан Лавуазие дава на пречистения въздух ново име. Той открил наличието на газ. Химични свойства: Рики 6 милиарда години.
През годината, независимо един от друг. H. смята, че е загубен. Събиране на проби от кислород от периферията на нашата слънчева система. Луната и метеоритите имат три различни изотопа. От самото начало на човешката цивилизация са използвани силикати в керамиката. Фокусиране със слънчева леща. Силициевият диоксид е практически неразтворим във вода или киселини, с изключение на реакцията на флуороводородна киселина, в която се освобождава силициев тетрафлуорид с формула. По-специално, аморфната форма на силициевия диоксид е разтворима в алкали.
Аеросилът, който се използва за производството на лекарства, трябва да има висока чистота. Таблица 1 показва химическия състав на различни търговски марки на Aerosil, които могат да имат определени примеси, образувани по време на производствените процеси, например, следи от солна киселина, което причинява рН от 4% водна суспензия на полимера (3.6-4.3). Така, Aerosil (силициев диоксид) се държи като слаба киселина.
Формира въздух само при изключително високи температури. Силиконът е покрит със защитен слой. При нормална температура силицийът не реагира с въздуха. Образуването на натриев силикат. Силикумът е в тревата. С други думи, да бъдете информирани, а не просто информирани.
Може би ще бъде по-лесно да се разбере, за да започнете, какъв вид строителни материали. Ето резултатите от изследванията тук. Нека ги намерим заедно. Ние сме в средата на лятото, така че искаме горещите дни да бъдат по-лесни за издържане. Лесно и свободно охлаждане с вътрешен въздух.
Таблица 1 - Химическият състав на различните видове аеросил (по отношение на сухото вещество, според М.М. Астраханов)
| Съдържание,% | Аеросил марки, състав,% | ||||
| 200; 300; 380 | 0 | SOK84 | R972 | комбиниран | |
| SiO2 | >99,87 | >99,8 | 82–86 | >98,3 | 85 |
| Al2O2 | 14–18 | – | |||
| Fe2O3 | – | ||||
| TiO2 | – | 0,03 | – | ||
| Na2O | – | – | – | – | |
| като | – | – | – | – | |
| В2О3 | – | – | – | – | |
| Bi2O3 | – | – | – | – | |
| P2O5 | – | – | – | – | |
| HCl | – | 0,05 | |||
| нишесте | – | – | – | – | – |
Таблица 2 показва най-важните физикохимични свойства на различните марки аеросилкоито се използват широко в производството на лекарства
Надяваме се, че цялата горепосочена информация ще бъде полезна, когато решите да построите къща, и ще бъдете в процес на избор на материали. Интересното в този случай е, че този дезинфекциращ ефект е причинен и дори дозиран от бактерии. Диаграмата показва самодезинфектиращия ефект на сребърните наночастици и калциевия фосфат, отлагани върху пластмасово фолио.
Поради тази причина богатите семейства използват сребърни прибори за сребро, които имат антибактериално действие, а по-бедният свят използва метод за въвеждане на сребърни монети в купа за мляко. В продължение на два века среброто се използва в медицината преди антибиотиците да заемат мястото си и дълго време се използват само в алтернативната медицина. От началото на ерата на нанотехнологиите този скъпоценен метал преживява истински ренесанс в медицината. Медицинско оборудване и протези, болнично обзавеждане или дори болнично обзавеждане са облечени, увити или обогатени с тях.
Таблица 2. Физични и химични свойства на различни марки аеросил
| индикатор | Печати на аеросил | |||||
| 200 | 300 | 380 | 0 | СОК-84 | R-972 | |
| Специфична повърхност, m2 / g | 200 ± 25 | 300 ± 30 | 380 ± 30 | 200 ± 25 | 170 ± 30 | 120 ± 30 |
| Загуби при запалване,% | 1 | 2 | 2,5 | 1 | 1 | 2 |
| Среден размер на частиците | 12 | 7 | 7 | 12 | – | 16 |
| Съдържание на влага,% (изсушено при 105 ° С) | – | 1,5 | 1,5 | 1,5 | 0,5 | 2,5 |
| Наситено тегло, g / l, стандартно (непресовано) пресовано | ≈60≈120 | |||||
| шупливост | порест | порьозни | ||||
| рН 4% водна дисперсия | 3,6–4,3 | – | – | 3,6–4,3 3.5–4.1 (в метанол) |
||
Най- производство на лекарства Аеросил Използва се като стабилизатор за суспензионно масло. Има висока способност за адсорбиране на различни течности. Добавянето на аеросил към състава на масло и водно-алкохолно-глицеролно суспензионно покритие подобрява седиментацията, агрегацията и агрегативната стабилност на тези системи, създавайки достатъчно силна пространствена структура, способна да задържа имобилизираната течна фаза с суспендирани частици на фармацевтични вещества в клетките. При водни и водно-алкохолни суспензии стабилизиращият ефект на аеросил се дължи главно на електростатични сили. Седиментацията на частици от твърдата фаза в стабилизирани водно-алкохолни суспензии се наблюдава 3 пъти по-бавно, отколкото в нестабилизирани системи. Стабилизиращият ефект на аерозил се увеличава в присъствието на малко количество повърхностноактивно вещество, например Tween-80. Наличието на аеросил (в концентрация 1.0–5.0%) в емулсии и суспензии повишава тяхната стабилност, способността да се фиксира по-добре върху кожата и ефективността на терапевтичното действие. С вода и алкохол силициев диоксид с концентрация 3% създава мътни суспензии, чиито акции имат отрицателен заряд.
Субстратът за захранване активира механизма. По време на тази научна комуникация беше невъзможно да се използва точен и дозиран благороден метал. Решаващият фактор е, че бактериите използват калций за подпомагане на техния метаболизъм. Частиците на калциев фосфат в диапазона от 20-50 нанометра се абсорбират от микроорганизмите като храна и по този начин се разлагат. В този процес се излъчват хиляди малки сребърни частици от 1 до 2 нанометра, които се прилагат от изследователи на базата на калциеви хранителни вещества.
Доколкото знаем, сребърните наночастици действат по различен начин върху бактериите: те предотвратяват прехвърлянето на хранителни вещества в клетката, атакуват клетъчната мембрана и разрушават клетъчното делене и, косвено, покълването. Тестовете с калциев фосфат и силициев диоксид, всеки от които е покрит със сребро, показват различни ефекти върху различни щамове бактерии в тестовете. Калциево-фосфатната поддръжка дава до 1000 пъти по-интензивна поддръжка от силициевия диоксид. Тъй като консумацията на калциев фосфат, според изследователите, също се хранят с бактерии - без да се увеличава количеството на среброто в рамките на 24 часа с фактор от хиляда - среброто трябва да се бори не само със съществуващите бактерии, но и с новообразувани. „Ето защо ефектът е още по-впечатляващ“, казва Уенделин Старк.
Едно от свойствата на Aerosil е неговата способност за сгъстяване (сгъстител) (Таблица 3).
Таблица 3. Сгъстяващ ефект на Aerosil-200
Това свойство се използва за получаване на аеросил-съдържащи гелове и бази за унгвенти, които включват аеросил. Като течна фаза за техните състави се използва течна полиетилсилоксан под името Esilon-5 или Esilon-4, рибено масло, PEG-400, рициново масло, мастни масла и други подобни. Esilon-5 удебелява 16% от Aerosil, известен като вазелин KV-E / 16, не дразни кожата и не пречи на абсорбцията на активни вещества. Като сгъстител се използва течна фаза аеросил (силициев диоксид) в размер на 8-16%. Получените гелове имат мека пластмасова консистенция, са добре разпределени и фиксирани върху кожата. Те имат добра колоидна стабилност при повишени температури (≥ 40 ° C), запазват необходимата консистенция, която не се променя дори при 100 ° C, и следователно аеросил-съдържащите гелове и мехлеми могат да се използват в тропически климат. Според структурните и механичните свойства на геловете, които включват аеросил, представляват тиксотропни пластмасови термостабилни системи и имат антимикробна резистентност. Количественото съдържание на аеросил в системата влияе върху реологичните и биофармацевтичните свойства на геловете. Увеличаването на силициевия диоксид в състава на геловете води до увеличаване на техния пластичен вискозитет и тиксотропни свойства, като същевременно забавя освобождаването на активната фармакологична съставка.
Благодарение на нов продукт, групата, оглавена от г-н Старк, успя да разработи ефективно лекарство срещу редица патогенни бактерии, които са активни в правилните и правилните дози, само ако има бактерия. Калциевият фосфат, който се окислява с калциев фосфат, ще бъде освободен само в подходящо количество, което бактерията консумира от калциев фосфат. Този метод спестява разходи, показва ефективност и е по-малко взискателен за човешкото тяло. Филмът може да се използва, например, в болници, в невиолетови точки от гледна точка на прехвърлянето на ембриона.
Използване на аеросил (силициев диоксид) в медицинската и ветеринарната фармацевтична промишленост
Аеросил се използва в производството на таблетки. в концентрация 0.1-0.5% като плъзгащо и разрохкващо (0.1-2.0%) вещество, което намалява времето на тяхното разпадане, улеснява процеса на гранулиране, подобрява течливостта на таблетната маса. Адсорбционните свойства на Aerosil се използват при производството на прахове, екстракти и други фармацевтични препарати.
Вратата, леглото или санитарните помещения, в които е прикрепен самозалепващ се филм, могат да помогнат на пациенти с ужасни и опасни патогенни микроби в болниците, което може да доведе до усложнения от намесата на оператора. Те трябва да се сменят на редовни интервали, тъй като бактериите консумират калций и следователно фолиото няма неограничен ефект.
Повечето инструменти за оценка на уязвимостта просто вземат настоящите си мрежови скенери и сочат към безжична инфраструктура. Този подход не ви дава уникална информация за безжичните мрежи. Освен това, докато традиционните скенери могат да изброяват уязвимостите на конкретна цел, те не могат да оценят дали контролът за омекотяване е инсталиран на целта или в околната среда.
Многобройни фармакологични, токсикологични и биофармацевтични изследвания са потвърдили, че когато се използва вътрешно, аеросилът е безразличен, добре понасян от пациентите, има лечебни свойства за заболявания на стомашно-чревния тракт и други възпалителни процеси и може да бъде източник на снабдяване с силиций в организма. Има доказателства, че аеросил (силициев диоксид) може да допринесе за намаляване на гладките мускули и кръвоносните съдове, както и да има антибактериални свойства.
Фармацевтичните системи, съдържащи аеросил, не проявяват дразнещи и токсични ефекти. Същите свойства са присъщи на мехлеми при използване на епсилон и аеросил като основа (състав на епсилон-5, сгъстен с 15% аеросил при производството на мехлеми с антибиотици и кортикостероиди). Мехлеми с аеросил (силициев диоксид) лесно изстискани от тръбите, добре фиксирани върху кожата, имат продължителен ефект.
литература
Жогол Ф., Возняк В., Попович В., Богдан Ж. Спомагателни вещества и тяхното използване в технологията на лекарствените форми. - Лвов, 1996; Персев И.М., Котенко А.М., Чуешов А.В., Халеева Е.Л. Фармацевтични и биологични аспекти на мехлемите: Монография. - H., 2003; Печковская К.А. Пълна каучук. В книгата: Енциклопедия на полимерите. В 3 т. - М., 1974.
