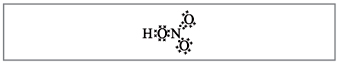
Рівняння реакцій, що характеризують властивості розведеної сірчаної кислоти. Список екзаменаційних питань з дисципліни
Почорніння поверхні старих картин, написаних олійними фарбами, до складу яких входять свинцеві білила (PbCO3 ), пов'язане з утворенням чорного сульфіду свинцю (II) через наявність сірководню в атмосфері. Якщо обробити почорнілі поверхні пероксидом водню, то відбувається реакція утворення сульфату свинцю (II) білого кольору:
PbS + 4H2 O2 = PbSO4 + 4H2 O.
У такий спосіб реставрують почорнілі старі картини, написані олійними фарбами.
Застосування кисню та сірки
Області застосування кисню представлені малюнку 61. Здатністьозону розкладатися з утворення атомарного кисню по-
дозволяє використовувати його для знезараження питної водита знешкодження промислових стічних вод; як дезінфікуючий засіб у медицині. Використовується озон і як відбілюючий засіб.
Сірку використовують для виробництва сірчаної кислоти, виготовлення сірників, бенгальських вогнів, боротьби з шкідниками сільського господарства, і навіть лікування деяких хвороб. Сірка знаходить застосування при виробництві гуми, барвників та пігментів, штучних волокон, люмінофорів та ін.
Мал. 61. Застосування кисню

Для кисню у сполуках коїться з іншими елементами найбільш характерна ступінь окислення –2, атоми сірки, селену і телуру виявляють ступеня окислення –2, +2, +4 і +6.
Окисні властивості кисню і сірки проявляються в їх реакціях з металами, воднем і деякими іншими неметалами.
Запитання та завдання
1. Складіть формули сполук кисню з калієм, кальцієм та алюмінієм. Вкажіть ступінь окислення кожного елемента та назвіть з'єднання.
2. Розрахуйте масову частку сірки у сульфіді алюмінію.
3. Назва «кисень» - oxygenium означає «що породжує кислоти». Запишіть хімічні формуливідомих вам кислот, до складу яких належить цей елемент. Назвіть кислоти.
4. Які алотропні модифікації кисню та сірки ви знаєте? Чим вони відрізняються одна від одної?
5. Кисень, що вдихається людиною, з'єднується з гемоглобіном крові. Відомо, що гемоглобін масою 1 г приєднує кисень об'ємом (н. у.) 1,35 см 3 . Вміст гемоглобіну у крові здорової людини 140 г/дм3. Загальний об'єм крові - 6 дм3. Розрахуйте хімічну кількість кисню, яка може опинитися у крові людини.
6. Визначте масову частку сірководневої кислоти в розчині, отриманому при розчиненні сірководню об'ємом (н. у.) 8,96 дм 3 у воді масою 500 г.
7. Розставте коефіцієнти в наступних схемахокисно-відновних реакцій:
а) H2 S + Cl2 + H2 O → H2 SO4 + HCl; б) H2 S + Br2 → S + HBr;
в) H2 S + O2 → S + H2 O.
У кожної реакції вкажіть окислювач та відновник.
§ 39. Кисневмісні сполуки сірки
У з'єднаннях з киснем сірка виявляє ступеня окислення+4 і +6.
Оксид сірки(IV). Сірчиста кислота
Оксид сірки(IV) - SO2 (сірчистий газ) - є безбарвним газом з різким характерним запахом, який виходить при горінні сірки:
S + O2 = t SO2.

Одне з найдавніших застосувань сірки пов'язане з обкурюванням сіркою житла, що горить. Як писав древній історик Пліній-старший у І столітті до зв. е., «запахи горіння сірки можуть оберігати від усяких чарів і прогнати всяку нечисту силу». Дезинфікуючі та бактерицидні властивості оксиду сірки (IV) використовуються і зараз. Сірчистий газ застосовують при обробці овочесховищ, плодів і фруктів для того, щоб запобігти їх загниванню.
Розчин сірчистого газу у воді (до 40 об'ємів SO2 на 1 об'єм води) - нестійка, двоосновна сірчиста кислотаяка існує тільки в розчині:
SO2 + H2 O H2 SO3.
Сірчиста кислота є слабкою кислотою, у водних розчинах вона дисоціює ступінчасто з утворенням гідросульфіт-і сульфіт-іонів:
H+ + HSO – , | – H+ + SO 2– . |
||||
Сірчиста кислота виявляє хімічні властивості, загальні для кислот: взаємодіє з основними оксидами, основами, вступає в реакції обміну із солями інших кислот, зокрема, витісняє із солей слабшу вугільну кислоту:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Оксид сірки(VI)
Оксид сірки(VI) одержують, окислюючи оксид сірки(IV) у присутності каталізатора при температурі близько 500 С:
t, кат.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
За звичайних умов оксид сірки (VI) SO3 - безбарвна їдка рідина, яка при температурі нижче 17°С перетворюється на білу кристалічну речовину. Це типовий кислотний оксид, який взаємодіє з водою, утворюючи сильну сірчану кислоту:
SO3 + H2 O = H2 SO4.
Сірчана кислота
Графічна формула та модель молекули сірчаної кислоти наведено на малюнку 62.
Мал. 62. Графічна формула та модель молекули сірчаної кислоти
У розведених розчинах сірчана кислотає сильним електролітом,
і її дисоціацію виражають так:
H2 SO4 → 2Н+ + SO4 2– .
Фізичні властивості сірчаної кислоти
Сірчана кислота - важка (щільність 1,83 г/см3), масляниста безбарвна рідина без запаху. Вона поєднується з водою в будь-яких відносинах.
Процес розчинення H2 SO4 хімічною кількістю 1 моль супроводжується виділенням 92 кДж теплоти, що можна порівняти з величинами теплових ефектів хімічних реакцій. Виділення великої кількості теплоти при взаємодії сірчаної кислоти з водою свідчить про утворення міцних сполук між цими двома речовинами гідратів типу H2 SO4 ·n H2 O.
Наприклад, H2 SO4 · H2 O; H2 SO4 · 2H2 O; H2 SO4 ·3H2 O і т. д. Здатність сер-
ної кислоти утворювати гідрати дозволяє використовувати її як сильний водовіднімний агент, наприклад для осушення газів.
Розігрівання суміші при розчиненні сірчаної кислоти у воді може супроводжуватися розбризкуванням. Пам'ятайте, що не можна приливати воду до кис-
лоті, слід при безперервному перемішуванні розчину вливати кислоту у воду.
Хімічні властивостісірчаної кислоти. Сульфати
Сульфати. Розведена сірчана кислота виявляє всі характерні для кислот властивості: взаємодіє з металами, що стоять серед активності до водню; з основними та амфотерними оксидами, з основами та солями. У цьому утворюються солі: середні -сульфати , наприклад K 2 SO 4 і кислі -
гідросульфати, наприклад KНSO4.
Більшість сульфатів і гідросульфатів добре розчиняються у воді, багато з них утворюють кристалогідрати. Деякі кристалогідрати солей сірчаної кислоти називаютьсякупоросами: мідний купорос CuSO4 ∙5H2 O, залізний купорос FeSO4 ∙7H2 O та ін.
Для якісного виявлення сірчаної кислоти та її солей у водних розчинах використовуються розчинні солі барію:
Ba(NO3)2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
Внаслідок реакції утворюється білий осад сульфату барію.
Лабораторний досвід 6
Дослідження хімічних властивостей розведеного розчину сірчаної кислоти
У видані п'ять пробірок помістіть: метал (цинк або інший метал на вибір вчителя), основний оксид, розчин гідроксиду натрію, розчин карбонату натрію, розчин хлориду барію. До розчину гідроксиду натрію додайте кілька крапель фенолфталеїну і відзначте зміну його забарвлення. У кожну пробірку прилийте по 1-2 см3 розведеної сірчаної кислоти. (Увага! Якщо реакція з основним оксидом протікає повільно, прискоріть її перебіг нагріванням на полум'ї спиртування.)
Що ви спостерігаєте? Які ознаки свідчать про перебіг хімічних реакцій? Складіть рівняння хімічних реакцій у молекулярному та іонному вигляді. Яка з проведених вами реакцій є окислювально-відновною? Зробіть висновок про хімічні властивості розведеної сірчаної кислоти.
Концентрована сірчана кислотає сильнішим окислювачем, ніж розбавлена. При взаємодії концентрованої сірчаної кислоти
з металами водень не виділяється.
З металами, що стоять у ряду активності після водню (крім золота та платини), реакція протікає з утворенням оксиду сірки(IV) SO 2 :
Cu + 2H2 SO4(конц) = t CuSO4 + SO2 + 2H2 O.
В реакції з металами, що знаходяться в ряду активності до водню, концентрована сірчана кислота може відновлюватися до оксиду сірки(IV) SO2 , сірки S або сірководню H2 S залежно від активності металу та умов протікання реакції. Наприклад:
4Zn + 5H2 SO4(кінець) = t 4ZnSO4 + H2 S+ 4H2 O.
Нагадаємо, що залізо, алюміній та деякі інші метали за звичайних умов пасивуються концентрованою сірчаною кислотою.
Концентрована сірчана кислота здатна взаємодіяти з простими речовинами неметалами, наприклад з сіркою:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Окислюючи багато складних органічні сполуки, сірчана кислота обгортає папір, тканину, деревину, одяг та шкіру. Тому поводитися з концентрованою сірчаною кислотою треба обережно.
Концентрована сірчана кислота здатна витісняти інші, летючі кислоти їх солей. Наприклад:
NaCl(тв) + H2 SO4(конц) = t NaНSO4 + HCl.
У Республіці Білорусь сірчана кислота виробляється ВАТ «Гомельський хімічний завод», ВАТ «Гродно Азот».
Області застосування сірчаної кислоти
Вони представлені малюнку 63.
Мал. 63. Застосування сірчаної кислоти
Сірчана кислота H2 SO4 – важка, безбарвна масляниста рідина без запаху.
Розведена сірчана кислота взаємодіє з металами, що стоять серед активності до водню; з оксидами металів; з основами; із солями.
При взаємодії концентрованої сірчаної кислоти з металами водень не виділяється.
Для якісного виявлення сірчаної кислоти та її солей у водних розчинах використовують розчинні солі барію.
Запитання та завдання
1. Запишіть формули відомих вам оксидів та кисневмісних кислот сірки. Вкажіть у них ступеня окиснення атомів сірки.
2. Визначте масу сірки, що згоріла в кисні, якщо при горінні виділилося 29,69 кДж теплоти. Яка хімічна кількість оксиду сірки(VI) утворилася при цьому? Тепловий ефект реакції горіння сірки становить 296,9 кДж/моль.
3. Користуючись таблицею розчинності солей, кислот та основ у воді, складіть 2 рівняння реакцій розведеної сірчаної кислоти з солями. Запишіть рівняння
в молекулярному та іонному вигляді.
4. Розрахуйте масу та хімічну кількість сульфату барію, який утворюється при дії розведеної сірчаною кислотою на розчин нітрату барію масою 200 г, масова частка Ba(NO 3 )2 у якому дорівнює 10%.
5. Випишіть із тексту параграфа рівняння реакцій, що характеризують хімічні властивості концентрованої сірчаної кислоти. Визначте ступені окислення атомів сірки у її сполуках. У кожній реакції вкажіть окислювач та відновник.
6. Який об'єм концентрованого розчину сірчаної кислоти (= 1,83 г/см 3 ) з масовою часткою H2 SO4 98 % необхідний розчинення міді масою 6,4 р?
7. Розставте коефіцієнти у схемах рівнянь наступних окислювально-відновних реакцій:
а) HBr + H2SO4 → Br2 + SO2 + H2O; б) CaSO4 → CaO + SO2 + O2;
в) K2 S + HClO → K2SO4 + HCl.
У кожній реакції вкажіть окислювач та відновник.
§ 40. Поняття про вихід продукту хімічної реакції
Хімічні рівняння, складені з урахуванням закону збереження маси речовин, дозволяють проводити розрахунки, зокрема обчислювати масу, обсяг чи хімічну кількість продукту реакції. На практиці багато реакцій протікають оборотно, частина речовини втрачається в результаті випаровування, розчинення або утворення побічних продуктів. Тому продукту реакції завжди утворюється менше, ніж мало б вийти відповідно до розрахунку рівняння реакції. Таким чином, якщо прийняти теоретично розраховані за рівнянням реакції масу, обсяг або хімічну кількість продукту за 100%, то в реальному процесі вихід продукту завжди буде менше 100%.
Позначається вихід продукту реакції літерою грецького алфавіту (ця ) і виявляється у частках одиниці чи відсотках.
Вихід продукту хімічної реакції - це величина, що дорівнює відношенню маси (об'єму, хімічної кількості) фактично отриманого продукту до маси (обсягу, хімічної кількості) продукту, обчисленої за рівнянням реакції:
У всіх цих випадках буде знайдено те саме значення виходу продукту хімічної реакції. Наприклад, якщо відомо, що для реакції окиснення оксиду сірки(IV) до оксиду сірки(VI)
2SO2 + O2 2SO3
вихід становить 80 % (або 0,8), це означає, що з оксиду сірки(IV) масою 64 г (об'ємом 22,4 дм3 , хімічною кількістю 1 моль) ми отримаємо оксид сірки(VI) масою не 80 г (об'ємом 22,4 дм3, хімічною кількістю 1 моль), а масою 80 г∙0,8 = 64 г (об'ємом 17,9 дм3, хімічною кількістю
З величини виходу товару у реальному виробничому процесі робиться висновок про повноті перетворення сировини, витратах енергії, необхідність введення додаткових операцій та ін.
Розглянемо кілька прикладів розрахунків із поняття «вихід продукту реакції».
приклад 1 . В результаті спалювання сірки масою 48 г отримано оксид сірки(IV) об'ємом (н. у.) 28,6 дм3. Визначте вихід продукту реакції.
m(S) = 48 г | 1. Визначимо хімічну кількість сірки, |
||||
V практ (SO2) = 28,6 дм3 | вступила в реакцію: | ||||
m (S) | |||||
(SO2) =? | n(S) | ||||
M(S) | 32 г/моль |
||||
2. Складемо рівняння реакції одержання оксиду сірки(IV): S + O2 = SO2 .
3. Знайдемо теоретичну кількість оксиду сірки (IV):
1 моль S - 1 моль SO2;
1,5 моль S-1,5 моль SO2.
Поняття про вихід продукту хімічної реакції |
4. Знайдемо теоретичний обсяг оксиду сірки(IV):
V теор (SO2) = n теор (SO2) · V m = 1,5 моль · 22,4 моль/дм3 = 33,6 дм3.
5. Розрахуємо вихід продукту реакції:
Відповідь: вихід препарату реакції дорівнює 85%.
Приклад 2. Визначте масу піриту FeS2 , який потрібно випалити для того, щоб отримати оксид сірки(IV) об'ємом (н. у.) 8,96 дм3 , якщо вихід продукту реакції становить 90 %.
V(SO2 ) = 8,96 дм3 | 1. Визначимо теоретичний обсяг оксиду сірки(IV): |
|||||||||||
(SO2) = 90% | V практ | V практ | ||||||||||
m (FeS2) =? | Звідки V теор = | |||||||||||
V теор | ||||||||||||
Vтеор (SO2) = | V практ(SO 2) | 8,96 дм 3 | 9,56 дм3. |
||||||||||
2. Знайдемо теоретичну хімічну кількість оксиду сірки(IV): |
||||||||||||
n теор(SO 2) | V теор(SO 2) | 9,56 дм3 | ||||||||||
22,4 дм3/моль |
||||||||||||
3. Складемо рівняння реакції одержання оксиду сірки(IV) та розрахуємо хімічну кількість піриту, який необхідно піддати випалу:
x моль 0,4 моль
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3 , 4 моль 8 моль
х = 0,2 моль.
3. Визначимо масу піриту, який необхідно піддати випалу: m (FeS2) = 0,2 моль · 120 г/моль = 24 г.
Відповідь: для одержання оксиду сірки(IV) потрібно пірит масою 24 г.

Вихід продукту хімічної реакції - це величина, що дорівнює відношенню маси (обсягу, хімічної кількості) фактично отриманого продукту до маси (обсягу, хімічної кількості) продукту, обчисленої за рівнянням реакції. Виражається у частках одиниці чи відсотках.
Запитання та завдання
1. Чому практичний вихід продукту реакції зазвичай менше, ніж розрахований теоретично за рівнянням реакції?
2. При реакції сірки з воднем хімічною кількістю 1 моль утворився сірководень хімічною кількістю 0,85 моль. Визначте вихід продукту реакції.
3. В результаті взаємодії хлориду барію масою 200 г із сірчаною кислотою випав осад сульфату барію масою 100 г. Розрахуйте вихід продукту реакції.
4. Визначте об'єм (н. у.) та хімічну кількість оксиду сірки(IV), що утворився при згорянні сірки масою 64 г, якщо вихід продукту реакції дорівнює 75 %.
5. Обчисліть масу спаленої сірки, якщо отримано оксид сірки(IV) об'ємом (н. у.) 89,6 дм 3 що становить 80 % від теоретично можливого.
6. Відомо, що вихід оксиду сірки(VI), отриманого при окисленні оксиду сірки(IV),
дорівнює 85%. Визначте масу, об'єм (н. у.) та хімічну кількість оксиду сірки(IV), що вступив у реакцію, якщо отриманий оксид сірки(VI) об'ємом (н. у.) 2,24 дм3 .
7. Визначте масову частку солі у розчині, отриманому при розчиненні міді масою 3,2 г у сірчаній кислоті масою 192 г, якщо вихід продукту реакції становить 85 %.
§ 41. Азот та фосфор
Азот N і фосфор P розташовані в групі VA періодичної системи. До цієї ж групи періодичної системи відносяться миш'як As, сурма Sb і вісмут Bi. Азот і фосфор є неметалами, миш'як та сурму відносять до напівметалів, а вісмут належить до металів.
Будова атомів та ступеня окислення
У атомів елементів групи VA на зовнішньому енергетичному рівні знаходиться по 5 електронів, електронна конфігурація їх зовнішнього енергетичного рівня ns 2 np 3 наприклад: азоту - 2s 2 2p 3 фосфору - 3s 2 3p 3 .
7 N↓ | 15P ↓ |
Завдання.
- Чим викликана така зміна забарвлення? На якій властивості дихромату ґрунтується вживання хромової суміші для миття посуду?
- Налити в пробірку 5-6 крапель дихромату калію та 3 краплі розчину сірчаної кислоти. Додати 2 краплі йодиду калію та розбавити вміст пробірки 10 краплями води. Перенести піпеткою в іншу пробірку частину вмісту та додати краплю крохмалю. Чи змінилося забарвлення крохмалю? Чому? Скласти рівняння ОВР та зрівняти електронно-іонним методом.
- Загальна характеристика елемента 15 Р. Властивості аллотропних модифікацій фосфору. Взаємодія фосфору з простими та складними речовинами.
· У фармації оксид ртуті (II) застосовується як ніжний антисептичний засіб для приготування очних мазей, яке одержують дією розведеного розчину гідроксиду натрію на розчинні солі ртуті Усі операції проводять у темряві.
Завдання.
1. Написати відповідну реакцію одержання оксиду ртуті (II). Пояснити, чому необхідно проводити операції у темряві?
3. Основні закони хімії.
Використання сполук цинку в медицині засноване на його терпкій, антисептичній дії. 0,25% розчин сульфату цинку використовується для виготовлення очних крапель разом з 2%-ною борною кислотою.
Завдання.
- Приготувати 0,25%-ний розчин сульфату цинку об'ємом 100мл (ρ = 1,02 г/мл).
- Здійснити перетворення
Zn→ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Ковалентний зв'язок, визначення, види, механізм освіти, властивості. Валентність. Ступінь окислення.
· Фармацевт проводить контроль якості препарату заліза методом перманганатометрії.
Завдання.
1. Написати рівняння відповідної реакції та зрівняти його електронно-іонним методом.
2. Обчислити, який об'єм 0,5% - ного (ρ = 1,004 г/мл) розчину гідроксиду натрію потрібно для реакції з 0,1 М розчином заліза хлориду (III) об'ємом 20мл.
3. Періодичний закон та періодична системау світлі вчення про будову атома.
· Залізо, відновлене, що застосовується внутрішньо як протианемічне засіб, має бути вільно від домішок сульфідів міді, вугілля, кремнієвої кислоти, миш'яку.
Завдання.
1. Запропонувати спосіб відокремлення заліза від домішок. Обґрунтувати відповідь.
3. Основні види хімічного зв'язку. Природа утвору хімічного зв'язку.
· Для організму перманганати є отрутами, їх знешкодження проводять з використанням 3% - го водного розчину Н 2 Про 2 підкисленою оцтовою кислотою.
Завдання.
1. Написати рівняння відповідної реакції. Зрівняти реакцію електронно-іонним методом
- Оксиди, визначення, класифікація, номенклатура, властивості та способи одержання.
· Кількісне визначення речовини в препараті заліза проводиться методом перманганатометрії, заснованим на здатності Fe2+ окислюватись до Fe3+. Спочатку навішування відновленого заліза розчиняють у сірчаній кислоті при нагріванні і після охолодження титрують 0,1 н розчином перманганату калію.
Завдання.
1. Написати рівняння реакцій, які у основі кількісного определения.
2. Приготувати 200 мл розчину 0,1 н KMnO 4 (фактор еквівалентності визначити за напівреакцією).
3. Кислоти, визначення, класифікація, номенклатура, властивості, способи одержання.
· Фармакопейний препарат нітрату срібла отримують наступним чином: розчиняють мідно-срібний сплав у розведеній азотній кислоті, для того, щоб очистити отриманий нітрат від домішок, осаджують його хлороводневою кислотою. Осад, що вийшов, відновлюють цинком в кислому середовищі, і срібло, звільнене від домішок, знову розчиняють в азотній кислоті.
Завдання.
- Написати рівняння відповідних реакцій.
- Виконати якісні реакції на Cl-, Br-, J аніони з розчином нітрату срібла, що лежать в основі підтвердження справжності препаратів хлоридів, йодидів, бромідів калію.
- Підстави, визначення, класифікація, номенклатура, властивості, способи одержання.
· 9. Нітрат срібла застосовується зовнішньо при ерозіях, виразках, гострому кон'юнктивіті у вигляді 2,5 та 10% водних розчинів.
Завдання.
- Приготувати 2% розчин AgNO 3 об'ємом 50 мл (ρ= 1,015 г/мл). Яких умов зберігання даного розчину необхідно дотримуватись?
- Здійснити перетворення
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Солі, визначення, класифікація, номенклатура, властивості, способи одержання.
· Фармацевту належить провести ідентифікацію фармакопейного препарату сульфату барію.
Завдання.
1. З якою метою використовують сульфат барію в медицині? Чому сульфат барію перед проведенням реакцій ідентифікації сплавляють із карбонатом натрію? Відповідь підтвердити рівняннями реакцій.
2. Виконати реакції ідентифікації солей BaSO4, CaSO4, Na2SO4.
3. Комплексні сполуки, визначення, будова за А. Вернером, природа хімічного зв'язку, класифікація, номенклатура, дисоціація. Застосування комплексних сполук у медицині та хімічному аналізі.
· Фармацевт при роботі з концентрованим розчином аміаку допустив грубе порушення техніки безпеки – проводив роботи у витяжній шафі без увімкненої тяги.
Завдання.
- Які наслідки можуть бути при роботі з концентрованим розчином аміаку без дотримання техніки безпеки? Яку першу медичну допомогу необхідно надати при отруєнні парами аміаку.
- Здійснити такі перетворення.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Написати рівняння реакцій у молекулярному та іонному вигляді, а для ОВР – зрівняти методом електронного балансу.
- Хімічна кінетика. Швидкість хімічної реакції. Вплив різноманітних факторів на швидкість хімічної реакції.
· Зі сполук азоту в медицині застосовуються розчин аміаку у воді, солі амонію, оксид діазоту і нітрит натрію.
Завдання.
- З якою метою використовуються дані сполуки азоту? Написати формули даних речовин та рівняння реакцій, що характеризують основні їх властивості.
- Написати рівняння реакції взаємодії нітрату натрію з перманганатом калію у кислому середовищі. Зрівняти реакцію методом напівреакцій
- Необоротні та оборотні хімічні реакції. Хімічна рівновага. Закон мас для рівноважних систем. Константа рівноваги. Принцип Ле Шательє.
· Фармацевту належить провести ідентифікацію солей сульфату натрію, хлориду натрію, гідрокарбонату натрію.
Завдання.
- Виконати якісні реакції на іони SO 4 2-, Cl-, HCO 3-.
- Розрахувати, скільки грамів кристалогідрату Na 2 SO 4 ·10H 2 O необхідно фармацевту розчинити у воді масою 500г, щоб отримати 5% - ний розчин Na 2 SO 4 ?
- Окисно-відновні реакції. Основні положення електронної теорії окиснювально-відновних реакцій. Найважливіші окислювачі та відновники. Зрівняння окисно-відновних реакцій методом електронного балансу та іонно-електронним методом.
· Калієва сіль сірчаної кислоти пов'язує багато чужорідних для організму препаратів (ксенобіотики) - лікувальні препаратита їх метаболіти з утворенням щодо нешкідливих речовин – кон'югатів, які легко виводяться з організму.
Завдання.
- Отримати калієву сіль сірчаної кислоти у різний спосіб, використовуючи наявні на столі реактиви. Написати рівняння відповідних реакцій.
- Скласти молекулярні рівняння реакцій, що виражаються такими скороченими іонними рівняннями:
S 2- + Н 2 S→ 2НS –
S 2- + 2Н + → Н 2 S
НS – + OH - → S 2– + H 2 O
· Дисперсні системи, визначення, класифікація. Суспензії, аерозолі, емульсії. Використання грубодисперсних систем у медицині та фармації.
Фармацевту необхідно отримати 5%-ний розчин сірчаної кислоти.
Завдання.
- Чи залежить окислювальна здатність аніону SO 4 2 від концентрації кислоти? Написати рівняння реакцій, що характеризують властивості розведеної та концентрованої кислоти.
- Приготувати 5% розчин сірчаної кислоти, маючи 50мл сірчаної кислоти з масовою часткою H 2 SO 4 30%.
- Колоїдні розчини, класифікація, визначення, молекулярно-кінетичніта оптичні властивості, отримання. Стійкість колоїдних розчинів. Коагуляція. Пептизація. Будова міцел. Діаліз.
· Сірка, що входить до складу амінокислот, окислюється в організмі. При цьому ендогенна сірчана кислота бере участь у знешкодженні отруйних сполук – фенолу, крезолу, індолу.
Завдання.
- Описати властивості сірчаної кислоти та перерахувати правила роботи з кислотами.
- Розрахувати, який об'єм сірчаної кислоти з масовою часткою H 2 SO 4 25% і густиною 1,18 г/мл необхідно взяти для нейтралізації гідроксиду калію, об'ємом 50 мл, з масовою часткою КОН 12 % і густиною 1,1 г/мл.
- Істинні розчини, визначення, основні поняття, сутність процесу розчинення. Дифузія. Осмос. Осмотичний тиск.
· У промислових районах, де спалюється багато вугілля, нерідко випадають кислотні дощі.
Завдання.
- Що являє собою по хімічного складукислотний дощ у цих районах? Як він утворюється? Написати рівняння реакцій.
- Скласти молекулярні та скорочені іонні рівняння гідролізу наступних солей:
K 2 S, Na 2 SO 4 , Na 2 SO 3 , Al 2 (SO 4) 3 , Cr 2 S 3
· Сірководень утворюється в природі в великих кількостяхза рахунок біохімічних процесів і міститься в про сірчаних мінеральних водах.
Завдання.
- Властивості сірководню.
- Здійснити перетворення:
H 2 S→SO 2 →H 2 SO 3 →NaHSO 3 →Na 2 SO 3
Написати рівняння реакцій у молекулярному та іонному вигляді.
- Дисоціація кислот, основ, солей, води. Кислотно-основна рівновага в розчинах. Іонний добуток води, рН-розчинів.
· Офіційним лікарським препаратом сірки є сірка, обложена (Sulfur praecipitafum).
Завдання.
- Описати властивості вільної сірки та алотропних модифікацій сірки.
- Здійснити перетворення:
Зрівняти реакції методом електронного балансу.
- Гідроліз. Сутність процесу гідролізу. Гідроліз різних типів солей. Ступінь гідролізу. Вплив різних факторів на ступінь гідролізу.
· Фармацевт проводить реакцію ідентифікації 3% розчину перекису водню: до 1 мл досліджуваного розчину додає 1 мл розведеної сірчаної кислоти, 1 мл ефіру та 0,5 мл розчину дихромату калію, в результаті шар ефіру забарвлюється в синій колір внаслідок утворення надхромової кислоти H 2 Cr 6
Завдання.
- Виконати реакцію ідентифікації перекису водню.
- Написати рівняння ідентифікації розчину перекису водню та зрівняти методом електронного балансу.
- Загальна характеристика елементів головної підгрупи VII групи та їх сполук. Медико- біологічне значеннягалогенів.
· Кисень є фармацевтичним препаратом та описаний у ГФ. Його застосовують для вдихання за різних типів кисневого голодування.
20. Завдання.
- Написати рівняння реакцій виявлення домішок СО, 2, NO, NO2.
- Написати рівняння реакцій, що у основі лабораторного способу отримання кисню. Зрівняти наведені реакції методом електронного балансу
- Хлор, хлороводень, соляна кислота, хлориди. Фізичні та хімічні властивості хлору та його сполук. Медико-біологічне значення галогенів.
· Фармацевт перевіряє справжність препаратів на основі хлориду натрію, броміду натрію та йодиду натрію.
Завдання.
- Для яких цілей використовують ці солі у фармації та медицині.
- Виконати якісні реакції на аніони Cl-, Br-, J-.
- Фізичні та хімічні властивості кисневих сполук хлору. Отримання. Застосування.
· Одним із промислових способів отримання йоду для фармації є процес виділення йоду із бурових вод. Йодиди, що у бурових водах, окислюють за схемою:
NaJ + NaNO 2 + H 2 SO 4 →J 2 +Na 2 SO 4 +NO+ H 2 O
22. Завдання.
- Які препарати йоду та з якою метою застосовуються в медицині.
- Зрівняти реакцію, що лежить в основі одержання йоду методом напівреакції.
- Загальна характеристика халькогенів. Властивості кисню та його сполук. Медико-біологічне значення кисню.
· Фармацевт визначає справжність препаратів хлоридів натрію, калію та кальцію.
Завдання.
- Для яких цілей використовують ці фармацевтичні препарати.
- Виконати реакції ідентифікації даних солей.
- Сполуки кисню з воднем. Фізичні та хімічні властивості води. Пероксид водню, властивості, застосування у медицині. Значення води у життєдіяльності організмів.
· Зі сполук галогенів з киснем лише гіпохлорити становлять інтерес для медицини як дезінфікуючі засоби.
Завдання.
- На якій властивості гіпохлоритів заснована їхня дезінфікуюча дія? Написати рівняння відповідних реакцій.
- Розрахувати, скільки грамів хлорного вапна необхідно взяти для отримання 2 л активного хлору.
- Сірка та її сполуки. Алотропія вільної сірки. Фізичні та хімічні властивості сірки, сірководню, сірководневої кислоти та її солей.
· При недостатній кислотності шлункового соку призначають внутрішньо розведену хлороводневу кислоту.
Завдання.
- Перелічити загальні правила роботи з кислотами.
- Розрахувати, скільки мл 36,5% - ного розчину (ρ=1,19г/мл) соляної кислоти необхідно взяти для приготування 100мл. 8,2% - ой (ρ=1,040 г/мл) кислоти.
- Фізичні та хімічні властивості оксидів сірки, сірчистої кислоти, сірчаної кислоти. Сульфіти. Сульфати. Властивості, одержання, застосування.
· У фармації одним із стандартних розчинів є розчин, що містить 33% ацетату калію, який отримують шляхом розчинення карбонату калію в 30% - му розчині оцтової кислоти.
Завдання.
1. Написати рівняння реакції у молекулярному та іонному вигляді.
- Загальна характеристика елементів головної підгрупи групи V. Властивості вільного азоту. Значення азоту у життєдіяльності організмів.
· Прописаний розчин речовини, що є сіллю сильної основи та слабкої кислоти. За вказівкою ГФХ як стабілізатор додається 0,1 н розчин їдкого натру з розрахунку 4 мл на 1 літр розчину.
Завдання.
- Написати рівняння реакції гідролізу солі CH3COONa.
- Розрахувати, скільки грамів NaOН необхідно зважити, щоб отримати 500мл 0,1н розчину. Приготує цей розчин з дотриманням техніки безпеки.
- Аміак. Солі амонію. Властивості. Застосування в медицині та фармації.
· Фармацевт готує за рецептом захисну мазь: 1 г карбонату калію і 0,5 г тетраборату натрію розчиняє в 70 мл дистильованої води, 10 г стеарину сплавляє з 15 г вазелінової олії і тонким струменем при помішуванні додає в теплий водний розчин карбонату. .
Завдання.
- Які речовини утворюються внаслідок цього змішування? Яке середовище утворюється і чому? Відповідь підтвердити рівняннями реакцій.
- Підготувати техно-хімічні ваги для роботи. Зважити 1 г карбонату калію на техно-хімічних терезах.
- Оксиди азоту. Азотиста кислота та її солі. Фізичні та хімічні властивості. Медико-біологічне значення сполук азоту
· Фармацевту необхідно приготувати 0,05% розчин калію перманганату об'ємом 200мл для полоскання порожнини рота та горла.
Завдання.
- На якій властивості перманганату калію ґрунтується його лікувальна дія? Які сполуки марганцю застосовуються в лікувальних цілях?
- Розрахувати скільки грамів KMnO 4 необхідно зважити для отримання 200мл 0,05% розчину KMnO 4 (ρ= 0,9994 г/мл.). Продемонструвати техніку виготовлення даного розчину.
- Будова молекул азотної кислоти. Фізичні та хімічні властивості азотної кислоти та її солей. Медико – біологічне значення азоту та її сполук.
· У фармації оксид ртуті (II), який використовується як антисептичний засіб, отримують дією розведеного розчину гідроксиду натрію на розчинні солі ртуті (II).
Завдання.
1. Написати відповідну реакцію одержання оксиду ртуті (II). Чому реакції необхідно проводити у темряві?
3. Основні закони хімії.
K 2 Cr 2 O 7 +H 2 O 2 +H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 +H 2 O
Надхромова кислота, що утворюється при цьому, H 2 CrO 6 являє собою з'єднання синього кольору. Синє забарвлення кислоти підтверджує справжність препарату Н2О2.
Завдання.
- Зрівняти цю реакцію електронно-іонним методом.
- Які сполуки хрому виявлятимуть окислювальні властивості, а які – відновлювальні?
- Властивості фосфіну, оксидів фосфору та фосфорних кислот, їх одержання. Медико-біологічне значення фосфору
· Суміш оксиду магнію (85%) та пероксиду магнію (15%) є препаратом, відомим під назвою «магній перекис», який застосовують при шлунково-кишкових розладах.
Завдання.
- Пояснити антацидну та бактерицидну дію препарату. Відповідь підтвердити рівняннями реакцій.
- Розрахувати, скільки грамів MgO та MgO 2 вам необхідно взяти для приготування 100г даного препарату. Зважити на техно-хімічних терезах 10 г оксиду магнію.
- Загальна характеристика елементів ІV групи головної підгрупи. Будова, Фізичні властивостіалотропів вуглецю. Хімічні властивості вільного вуглецю.
· Розчини гідрокарбонату натрію (питної соди) застосовують у вигляді полоскань, промивань при запальних захворюваннях очей, слизових оболонок верхніх дихальних шляхів.
Завдання.
- На якій властивості гідрокарбонату натрію ґрунтується його антисептична дія? Відповідь підтвердити рівняннями реакцій. Чи можна використовувати як антисептичний засіб тетраборат натрію Na 2 B 4 O 7 ∙ 10Н 2 Про?
- Приготувати 5% розчин NaHCO 3 об'ємом 50мл (=1,036г/мл).
- Будова молекул, фізико-хімічні властивості кисневих сполук вуглецю. Медико – біологічне значення вуглецю та його сполук.
В· Антацидні препарати, що містять гідрокарбонат натрію, використовують при різних захворюваннях, що супроводжуються підвищеною кислотністю, тобто. ацидоз.
Завдання.
- На якій властивості цієї солі ґрунтується дія антацидних препаратів? Відповідь підтвердити рівняннями реакцій. Які інші речовини можуть бути використані для цих цілей?
- Здійснити перетворення:
NaOH→NaHCO 3 →Na 2 CO 3 →NaCl→NaNO 3
Написати рівняння реакцій у молекулярному та іонному вигляді.
Виконати реакції Na 2 CO 3 →NaCl→NaNO 3.
- Кремній та його сполуки, знаходження у природі, отримання, фізичні та хімічні властивості. Медико – біологічне значення кремнію.
· 2,5%-ний розчин NaCl призначають внутрішньо для промивання шлунка при отруєнні AgNO 3 .
Завдання.
1. На чому ґрунтується дія розчину NaCl? Відповідь підтвердити рівняннями реакцій.
3. Загальна характеристика елементів головної підгрупи ІІІ групи. Властивості бору та його сполук. Медико-біологічне значення у медицині.
· Для розведення рідких лікарських форм, призначених для ін'єкцій, використовують ізотонічний розчин.
Завдання.
1. Що таке ізотонічний розчин? Чому його називають ізотонічним?
3. Алюміній та його сполуки, властивості, отримання. Медико-біологічне значення алюмінію.
· 3%-ний водний розчин перекису водню застосовують як зовнішній бактерицидний засіб.
Завдання.
1. На чому заснована бактерицидна та кровоспинна дія перекису водню. Яких запобіжних заходів необхідно дотримуватися при роботі з пергідролем?
2. Розрахувати, скільки мл. пергідролю (30%-ний водний розчин Н 2 Про 2, ρ= 1,1 г/мл) необхідно взяти для отримання 500 мл 3% - го розчину (ρ= 1,005г/мл). Приготувати цей розчин з дотриманням техніки безпеки.
3. Метали головної підгрупи ІІ групи. Загальна характеристика, отримання, фізичні та хімічні властивості. Солі кальцію та магнію. Жорсткість води. Усунення жорсткості води. Медико-біологічне значення елементів головної підгрупи ІІ групи.
· Сучасна фармацевтична промисловість випускає лікарські препарати по агрегатному стану, типу дисперсних систем, способу введення в організм.
Завдання.
1. Які системи називають дисперсними?
Як класифікуються дисперсні системи?
У вигляді дисперсних систем випускаються лікарські препарати? Навести конкретні приклади.
- Отримати гідрозолю каніфолі методом заміни розчинника.
- Загальна характеристика лужних металів, одержання, фізико-хімічні властивості. Найважливіші сполуки лужних металів. Медико-біологічне значення лужних металів
· У вигляді водних розчинів різних речовин зазвичай застосовуються рідкі лікарські форми, що мають повну взаємну розчинність.
Завдання.
- Справжні розчини, розчинність, насичений, ненасичений, перенасичений розчин. Від яких чинників залежить розчинність речовин?
- Приготувати 5% розчин CuSO 4 об'ємом 100мл (ρ= 1,051г/мл) з мідного купоросу CuSO 4 ∙5H 2 O
- Загальна характеристика d – елементів. Метали побічної підгрупи І групи та їх сполук. Медико-біологічне значення.
· У Росії використовується електрообробка соковитої та малосокового свіжої рослинної та тваринної сировини: ягід, плодів, коренеплодів овочів, різних органів тварин з метою виділення соків (внутрішньоклітинного вмісту) у нативному вигляді. Внутрішньоклітинний вміст являє собою колоїдні розчини білків, нуклеїнових кислот, вуглеводів, дубильних речовин
Завдання.
1. Які розчини називаються колоїдними розчинами? Як вони класифікуються? Перелічити властивості колоїдних розчинів. Який процес лежить в основі виділення соків із рослинної сировини?
2. Отримати гідрозоль гідроксиду заліза (III) методом гідролізу FeCl 3. Написати схему будови міцели.
- Метали побічної підгрупи ІІ групи, загальна характеристика, будова, фізичні та хімічні властивості. Медико-біологічне значення.
· При виготовленні таблеток на основі екстракту валеріанового кореня не рекомендується використовувати магнію карбонат як основний наповнювач, тому що він може спричинити нейтралізацію ізовалеріанової кислоти та руйнування валтратів – речовин, дуже чутливих до впливу лугів та кислот.
Завдання.
1. Пояснити прояв лужних властивостей карбонату магнію. Написати рівняння реакції у молекулярному та іонному вигляді. Які наповнювачі можна використовувати для приготування таблеток з екстрактом валеріани?
2. Здійснити перетворення:
MgO→MgCl 2 →MgSO 4 →Mg(OH) 2 →MgOHCl
Написати рівняння реакцій у молекулярному та іонному вигляді.
3. Загальна характеристика елементів VI, VII груп побічних підгруп. Окисно-відновні властивості хрому, марганцю та їх сполук. Медико-біологічне значення.
· Зріджений вуглекислий газ використовують у фармацевтичному виробництві для вилучення біологічно активних речовин із лікарської рослинної сировини.
Завдання.
- На яких властивостях вуглекислого газу ґрунтується застосування його в цих цілях?
- Здійснити перетворення:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
Реакції іонного обміну написати у молекулярному та іонному вигляді.
- Загальна характеристика елементів VIII групи побічної підгрупи. Властивості заліза та його сполук. Медико-біологічне значення.
Список екзаменаційних питань з дисципліни
Основні поняття та закони хімії. Сучасні ставлення до будову атома.
Періодичний закон та періодична система Д.І. Менделєєва у світлі вчення будову атома.
Визначення, види, умови освіти, природа хімічного зв'язку.
Визначення, механізм освіти, властивості ковалентного зв'язку. Валентність. Ступінь окислення.
Оксиди: визначення, класифікація, номенклатура, властивості та способи одержання.
Кислоти: визначення, класифікація, номенклатура, властивості та способи одержання.
Підстави: визначення, класифікація, номенклатура, властивості та способи одержання.
Солі: визначення, класифікація, номенклатура, властивості та способи одержання.
Комплексні сполуки: визначення, будова за Вернером, типи, номенклатура.
Швидкість хімічної реакції. Чинники, що впливають швидкість хімічної реакції.
Необоротні та оборотні хімічні реакції. Хімічна рівновага. Принцип М. Шательє. Константа рівноваги.
Окисно-відновні реакції: визначення, основні поняття, сутність окислення та відновлення, найважливіші окислювачі та відновники реакції.
Дисперсні системи: визначення, класифікація. Грубодисперсні системи: суспензії, аерозолі, емульсії.
Колоїдні розчини: визначення, властивості, одержання, будова міцел.
Істинні розчини: визначення, основні поняття, сутність процесу розчинення. Дифузія. Осмос. Осмотичний тиск.
Основні положення теорії електролітичної дисоціації. Механізм електролітичної дисоціації. Ступінь та константа дисоціації.
Дисоціація кислот, основ, солей. Дисоціація води рН-розчинів.
Сутність гідролізу. Гідроліз різних типів солей. Ступінь гідролізу.
Загальна характеристика елементів основної підгрупи VII групи. Медико-біологічне значення галогенів
Хлор, хлороводень та соляна кислота. Отримання, властивості. Хлориди.
Кисневі сполукихлору.
Загальна характеристика халькогенів. Кисень та його сполуки. Медико-біологічне значення кисню.
Властивості сполук кисню з воднем (вода, пероксид водню). Застосування Н 2 Про 2 у медицині. Значення води.
Сірка. Алотропія вільної сірки. Хімічні властивості сірки. Сірководень. Сірководнева кислота та її солі.
Фізичні та хімічні властивості оксидів сірки, сірчистої та сірчаної кислот, солей сірчистої, сірчаної кислот, їх застосування.
Загальна характеристика елементів головної підгрупи групи V. Азот та його властивості.
Властивості аміаку та солей амонію. Застосування в медицині та фармації.
Оксиди азоту. Азотиста кислота та її солі. Фізичні та хімічні властивості, застосування.
Фізичні та хімічні властивості азотної кислоти. нітрати. Медико – біологічне значення азоту та її сполук.
Характеристика елемента 15 Р. Вільний фосфор: алотропія, фізичні та хімічні властивості, одержання.
Фосфін. Оксиди фосфору та фосфорні кислоти: властивості, одержання. Медико-біологічне значення фосфору
Загальна характеристика елементів ІV групи головної підгрупи. Вуглець: будова та фізичні властивості алотропів вуглецю, хімічні властивості.
Кисневі сполуки вуглецю: будова молекул, фізичні та хімічні властивості. Медико-біологічне значення вуглецю та його сполук.
Кремній та його сполуки: знаходження у природі, отримання, фізичні та хімічні властивості. Медико – біологічне значення кремнію.
Головна підгрупа ІІІ групи: загальна характеристика елементів. Бор та його сполуки: отримання, фізичні та хімічні властивості, застосування в медицині.
Алюміній та його сполуки: одержання, фізичні та хімічні властивості. Медико-біологічне значення алюмінію.
Метали головної підгрупи ІІ групи: загальна характеристика, одержання, фізичні та хімічні властивості. Солі кальцію та магнію. Жорсткість води. Усунення жорсткості води. Медико-біологічне значення елементів головної підгрупи ІІ групи.
Лужні метали: загальна характеристика, одержання, властивості, найважливіші сполуки. Медико-біологічне значення.
Загальна характеристика d-елементів. Метали побічної підгрупи І групи. Поєднання міді, срібла. Медико-біологічне значення.
Метали побічної підгрупи ІІ групи: загальна характеристика будови, фізичні та хімічні властивості. Медико-біологічне значення.
Побічні підгрупи VI,VII групи: загальна характеристика елементів підгрупи, властивості хрому, марганцю та їх сполук. Медико-біологічне значення.
Побічна підгрупа VIII групи: загальна характеристика елементів підгрупи, властивості заліза та його сполук. Медико-біологічне значення.
Устаткування.На кожному столі перед учнями план уроку, схема взаємодії азотної кислоти з металами, набір реактивів, тести закріплення вивченого матеріалу.
Оксиди азоту
Вчитель.Згадайте та напишіть формули оксидів азоту. Які оксиди називаються солеутворюючими, які – несолетворними? Чому?
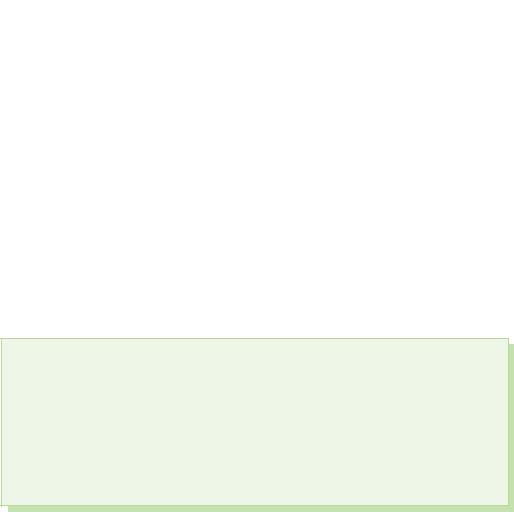
Учні самостійно записують формули п'яти оксидів азоту, називають їх, згадують азотовмісні кисневі кислоти та встановлюють відповідність між оксидами та кислотами. Один із учнів записує на дошці (таблиця).
Таблиця
Зіставлення оксидів азоту, кислот та солей
Демонстраційний досвід:
взаємодія оксиду азоту(IV) з водою
Вчитель. У посудину з NO 2 приливаємо трохи води і збовтуємо вміст, потім випробовуємо отриманий розчин лакмусом.
Що спостерігаємо? Розчин червоніє через дві кислоти, що утворилися.
2NO 2 + H 2 O = HNO 2 + HNO 3 .
Ступінь окислення азоту в NO 2 дорівнює +4, тобто. вона є проміжною між +3 і +5, які у розчині стійкіші, тому оксиду азоту(IV) відповідають відразу дві кислоти – азотиста та азотна.
Склад та будова молекули
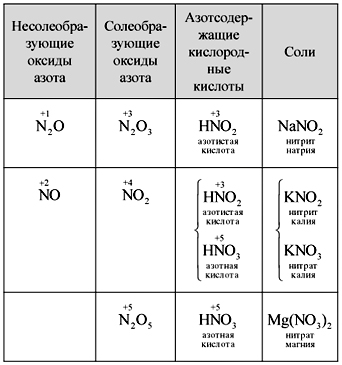
Вчитель.На дошці запишіть молекулярну формулу азотної кислоти, обчисліть її молекулярну масу та відзначте ступеня окиснення елементів. Складіть структурну та електронну формули.
Учні становлять такі формули (рис. 1).
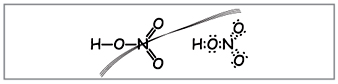
Вчитель.Відповідно до цих формул навколо азоту обертається десять електронів, але цього не може бути, т.к. азот знаходиться у другому періоді і максимально на зовнішньому шарі у нього може бути лише вісім електронів. Ця суперечність усувається, якщо припустити, що між атомом азоту та одним з атомів кисню утворюється ковалентний зв'язок за донорно-акцепторним механізмом(Рис. 2).
Мал. 2. Електронна формула азотної кислоти.
Електрони атома азоту позначені чорними точками
Тоді структурну формулу азотної кислоти можна було б зобразити так(Рис. 3) :
Мал. 3. Структурна формула азотної кислоти
(донорно-акцепторний зв'язок показаний стрілкою)
Однак дослідним шляхом доведено, що подвійний зв'язок рівномірно розподілено між двома атомами кисню. Ступінь окислення азоту в азотній кислоті дорівнює +5, а валентність (зверніть увагу) дорівнює чотирьом, бо є лише чотири загальні електронні пари.
Фізичні властивості азотної кислоти
Вчитель.Перед вами флакони з розведеною та концентрованою азотною кислотою. Опишіть фізичні властивості, які ви спостерігаєте.
Учні описують азотну кислоту як рідина важча за воду, жовтуватого кольору, з різким запахом. Розчин азотної кислоти без кольору та без запаху.
Вчитель. Додам, що температура кипіння азотної кислоти +83 °С, температура замерзання –41 °З, тобто. за звичайних умов це рідина. Різкий запах і те, що при зберіганні вона жовтіє, пояснюється тим, що концентрована кислота є малостійкою і під дією світла або при нагріванні частково розкладається.
Хімічні властивості кислоти
Вчитель. Згадайте, з якими речовинами взаємодіють кислоти?(Учні називають.)
Перед вами реактиви, проробіть перелічені реакції та запишіть свої спостереження (реакції записувати треба у світлі ТЕД).
А тепер звернемося до специфічних властивостей азотної кислоти.
Ми наголосили, що кислота при зберіганні жовтіє, тепер доведемо це хімічною реакцією:
4HNO 3 = 2H 2 O + 4NO 2 + O 2 .
(Учні самостійно записують електронний баланс реакції.)
«Бурий газ», що виділяється(NO 2) фарбує кислоту.
Особливо поводиться ця кислота по відношенню до металів. Ви знаєте, що метали витісняють водень із розчинів кислот, але при взаємодії з азотною кислотою цього не відбувається.
Подивіться на схему у вас на парті, де показано, які гази виділяються при реакції кислоти різної концентрації з металами.(Робота зі схемою.)
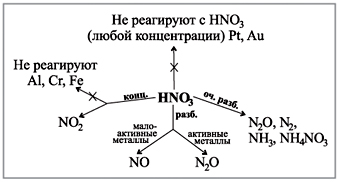
Демонстраційний досвід:
взаємодія концентрованої азотної кислоти з міддю
Дуже ефективна демонстрація реакції азотної кислоти (конц.) з порошком міді або дрібно нарізаними шматочками мідного дроту:
Учні самостійно записують електронний баланс реакції:
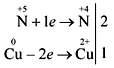
Одержання кислоти
Вчитель. Урок буде неповним, якщо ми не розглянемо питання одержання азотної кислоти.
Лабораторний спосіб: дія концентрованої сірчаної кислоти на нітрати (рис. 5).
NaNO3+H2SO4=NaHSO4+HNO3.
У промисловості кислоту в основному одержують аміачним способом.
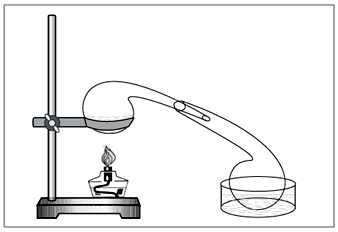
Мал. 5. Для отримання азотної кислоти в лабораторії досі
зручно використовувати старовинний хімічний посуд – реторту
Спосіб одержання кислоти з азоту та кисню при температурі понад 2000 °С (електродуговий) особливого поширення не отримав.
У Росії її історія отримання азотної кислоти пов'язані з ім'ям хіміка-технолога Івана Івановича Андреева (1880–1919).
Він у 1915 р. створив першу установку з виробництва кислоти з аміаку та реалізував розроблений спосіб у заводському масштабі у 1917 р. Перший завод був збудований у Донецьку.
Цей метод включає кілька етапів.
1) Підготовка аміачно-повітряної суміші.
2) Окислення аміаку киснем повітря на платиновій сітці:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) Подальше окислення оксиду азоту(II) до оксиду азоту(IV):
2NO + O2 = 2NO2.
4) Розчинення оксиду азоту(IV) у воді та одержання кислоти:
3NO2+H2O=2HNO3+NO.
Якщо розчинення проводити у присутності кисню, весь оксид азоту(IV) перетворюється на азотну кислоту.
5) Заключний етап отримання азотної кислоти – очищення газів, які у атмосферу, від оксидів азоту. Склад цих газів: до 98% азоту, 2-5% кисню та 0,02-0,15% оксидів азоту. (Азот спочатку був у повітрі, взятому для окислення аміаку.) Якщо оксидів азоту в цих газах більше 0,02%, то спеціально проводять каталітичне відновлення їх до азоту, тому що навіть такі малі кількості цих оксидів призводять до великих екологічних проблем.
Після всього сказаного постає питання: а навіщо нам потрібна кислота?
Застосування кислоти
Вчитель.Азотну кислоту використовують для виробництва: азотних добрив, і в першу чергу аміачної селітри (як її одержують?); вибухових речовин (чому?); барвників; нітратів, про які йтиметься на наступному уроці.
Закріплення матеріалу
Фронтальне опитування класу
– Чому рівень окислення азоту в азотній кислоті +5, а валентність чотири?
– З якими металами азотна кислота не входить у реакцію?
– Вам потрібно розпізнати соляну та азотну кислоти, на столі три метали – мідь, алюміній та залізо. Як ви вчините і чому?
Тест
Варіант 1
1. Який ряд чисел відповідає розподілу електронів за енергетичними рівнями в атомі азоту?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Закінчіть рівняння практично здійсненних реакцій:
1) HNO 3 (розб.) + Cu …;
2) Zn + HNO 3 (конц.) …;
3) HNO 3 + MgCO 3 …;
4) CuO + KNO 3 … .
3. Вкажіть, яке рівняння ілюструє одну із стадій процесу промислового виробництваазотної кислоти.
1) 4NH 3 + 5O 2 = 4NO + 6H 2 O;
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Негативний ступінь окислення проявляється азотом у поєднанні:
1) N 2 O; 2) NO; 3) NO 2; 4) Na 3 N.
5. Взаємодія мідної стружки з концентрованою азотною кислотою призводить до утворення:
1) NO 2; 2) NO; 3) N 2; 4) NH 3 .
Варіант 2
1. Значення вищої валентності азоту одно:
1) 1; 2) 2; 3) 5; 4) 4.
2. Запишіть можливу взаємодію концентрованої азотної кислоти з наступними металами: натрій, алюміній, цинк, залізо, хром.
3. Виберіть речовини, які є сировиною для виробництва азотної кислоти:
1) азот та водень;
2) аміак, повітря та вода;
3) нітрати.
4. Концентрована азотна кислота не реагує з:
1) вуглекислим газом;
2) соляною кислотою;
3) вуглецем;
4) гідроксидом барію.
5. При взаємодії дуже розведеної кислоти з магнієм утворюється:
1) NO 2; 2) NO; 3) N 2 O; 4) NH 4 NO 3 .
Відповіді на тести Варіант 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Варіант 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Трирівневий залік вертушка 11 клас
Тема: « НЕМЕТАЛИ»
Форма уроку:залік
Ціль: перевірити засвоєння знань учнів на тему: «Неметали»; узагальнити знання про загальних властивостяхнеметалів та їх сполук; продовжити формувати навички застосування знань у нестандартних та життєвих ситуаціях, з використанням індивідуальних та диференційованих завдань.
Завдання:
1. Перевірити узагальнити та закріпити знання учнів про неметали та їх сполуки; сприяти розвитку вміння мислити логічно та володіти хімічною мовою; переходу від формального – логічного сприйняття матеріалу цієї теми до образно-логічного мислення з допомогою різнорівневих, посильних і нестандартних завдань.
2. Розвинути навички спостереження, виявлення помилок, вирішення завдань, вміння виділяти головне, порівнювати факти, що вивчаються, логічно викладати думки і робити висновки; вчити розмірковувати, робити припущення, прогнозувати.
3. Сприяти формуванню основних світоглядних ідей через пізнавальну активність та творчу самостійність учнів.
4. Виховувати вміння працювати самостійно із застосуванням само- та взаємоконтролю. Показати зв'язок теми, що вивчається з життям. Виховувати науковий світогляд на основі взаємозв'язку властивостей та будови.
Обладнання та реактиви:пробірки, спиртовки, пробіркотримачі, сірники та розчини: ; ;
; ;
;
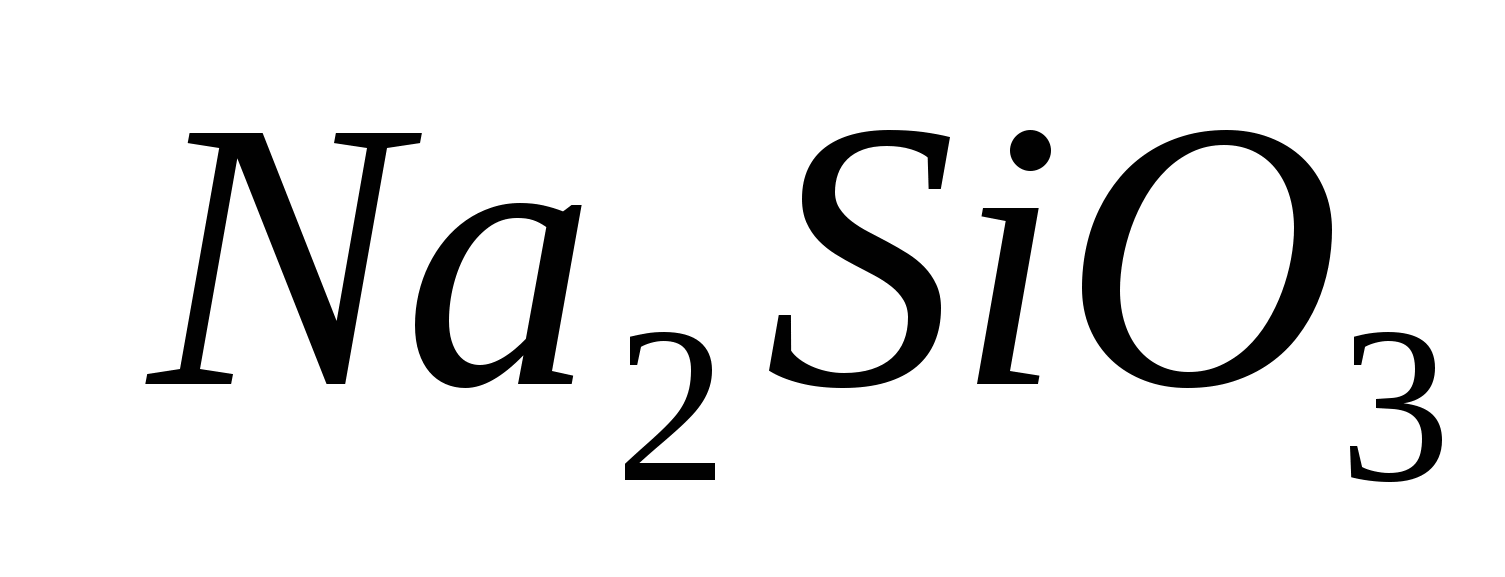 .
.
Підготовка до заліку.
Вчитель готує завдання трьох рівнів складності наступних видів: тест, теоретичне питання, якісні та розрахункові завдання, завдання на перетворення речовин.
Вчитель готує учнів, які перевіряють завдання.
За 1 – 2 тижні у кабінеті вивішується інформаційний лист до заліку.
Кожному учню видається маршрутний лист. Черговість роботи на етапах вказується у маршрутних листах.
МАРШРУТНИЙ ЛИСТ.
Ф.І. учня
Назва етапу
Черговість етапів
№ завдання
Підпис перевіряючого
Розрахункова задача
Розпізнавання
Перетворення
Хід уроку.
Учні входять до класу з маршрутними листами, 5 чистими листами, ручкою і йдуть на етап, позначений за № 1. Учні обирають завдання за рівнями складності та відповідають на нього письмово чи усно, на етапі «розпізнавання речовин» виконують експеримент.
На роботу кожному етапі відводиться 7 – 8 хвилин, перевіряючий виставляє в маршрутний лист рівень, № завдання, бали за виконане завдання.
Оцінка виставляється як середнє арифметичне всіх етапів.
ДОДАТОК
«Розпізнавання речовин»
1 рівень
1. Доведіть наявність іона 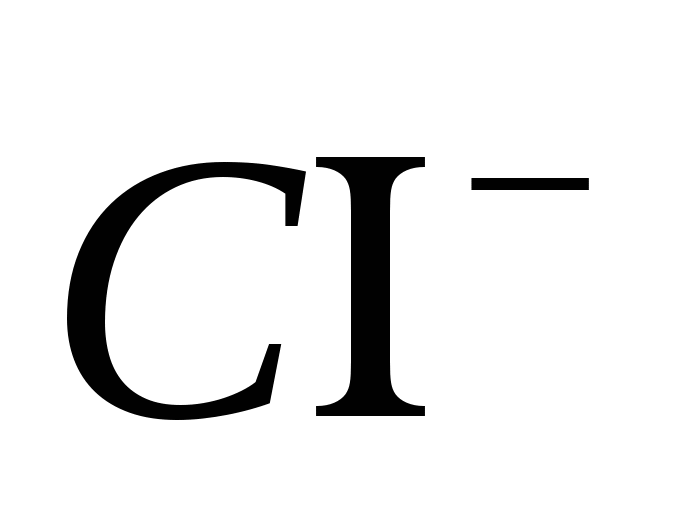
2. Доведіть наявність іона 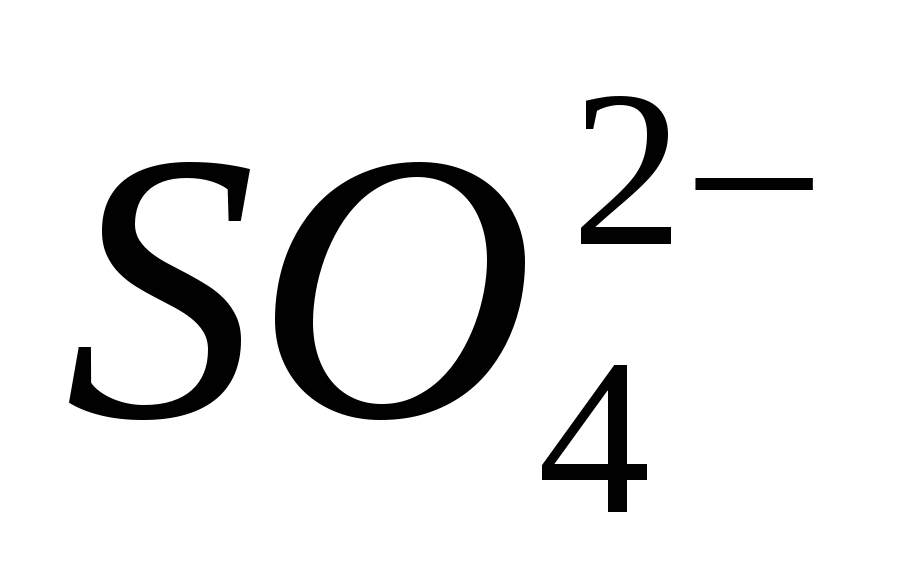
3. Доведіть наявність іона 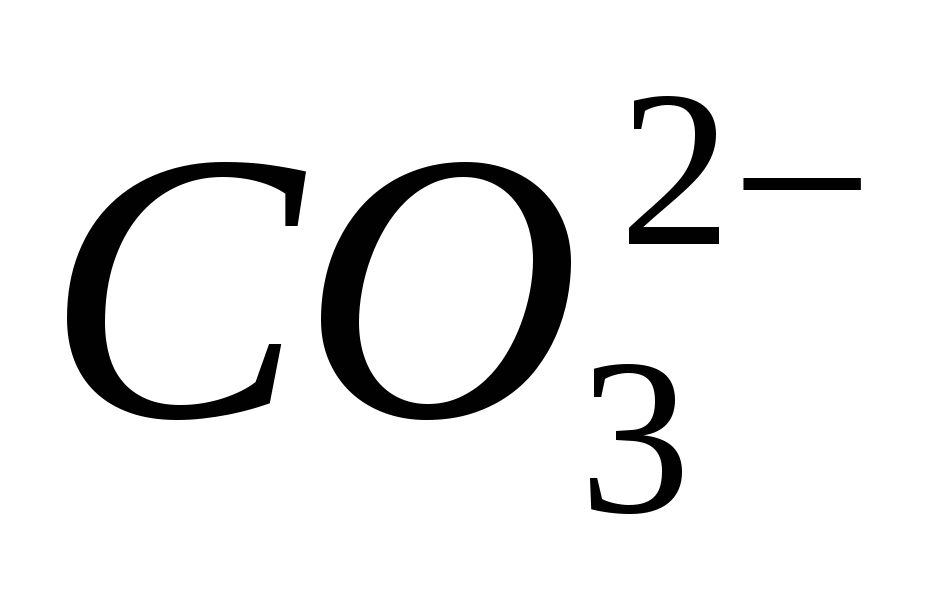
4. Доведіть наявність іона 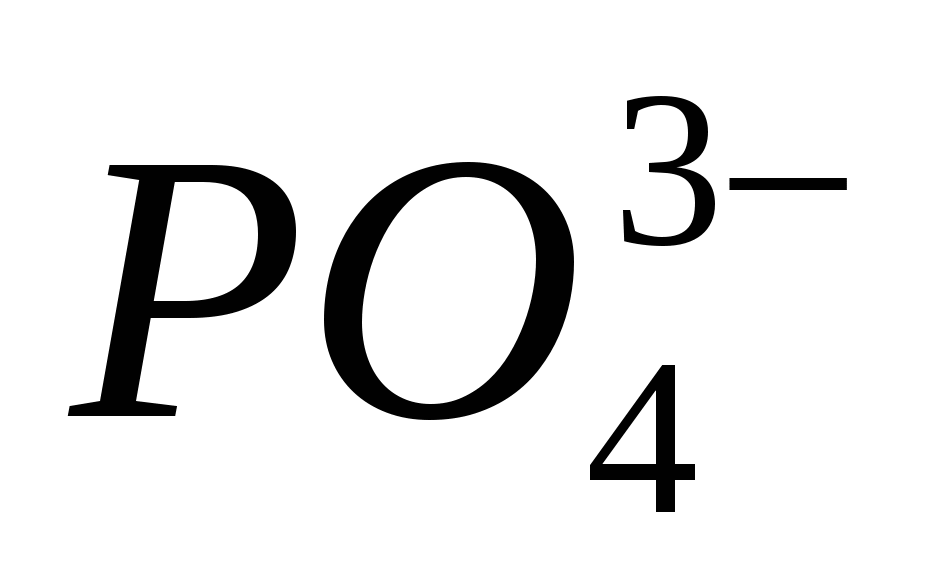
5. Доведіть наявність іона 
2 рівень
1. Розпізнайте розчини за допомогою одного реактиву:
2. Розпізнайте розчини за допомогою одного реактиву:
3. Розпізнайте розчини за допомогою одного реактиву:
4. Розпізнайте розчини за допомогою одного реактиву: 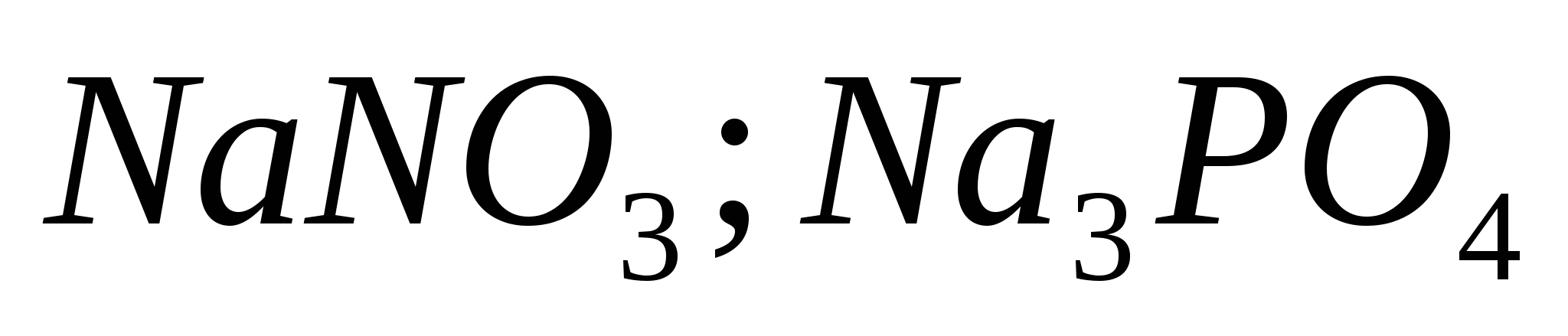 ;
;
5. Розпізнайте розчини за допомогою одного реактиву:
3 рівень
1. Розпізнати без додаткових реактивів розчини:
2. Розпізнати без додаткових реактивів розчини:
3. Розпізнати без додаткових реактивів розчини:
4. Розпізнати без додаткових реактивів розчини:
5. Розпізнати без додаткових реактивів розчини:
Етап «Перетворення речовин»
1 рівень
1. Закінчити рівняння реакцій
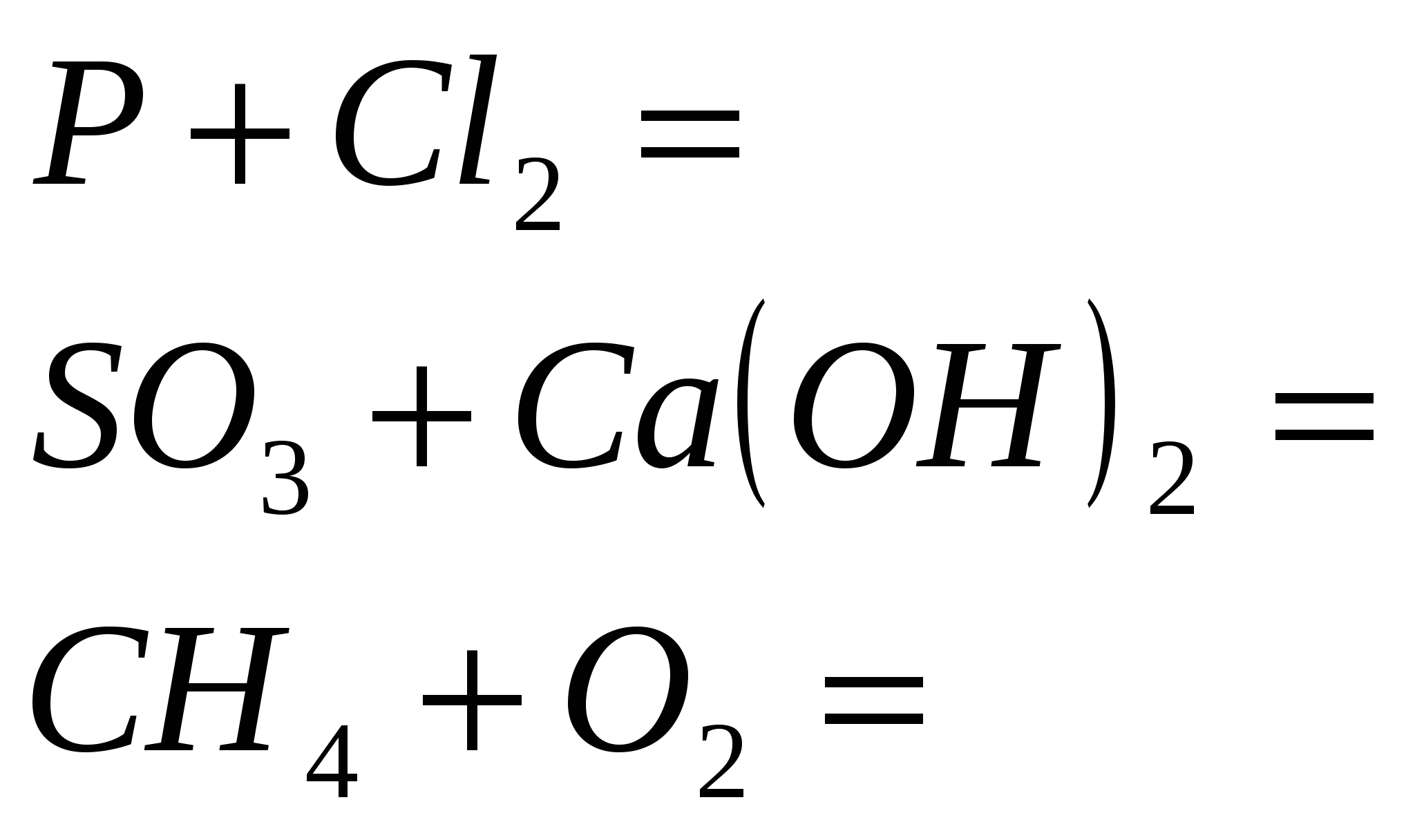
2.Закінчіть рівняння реакцій
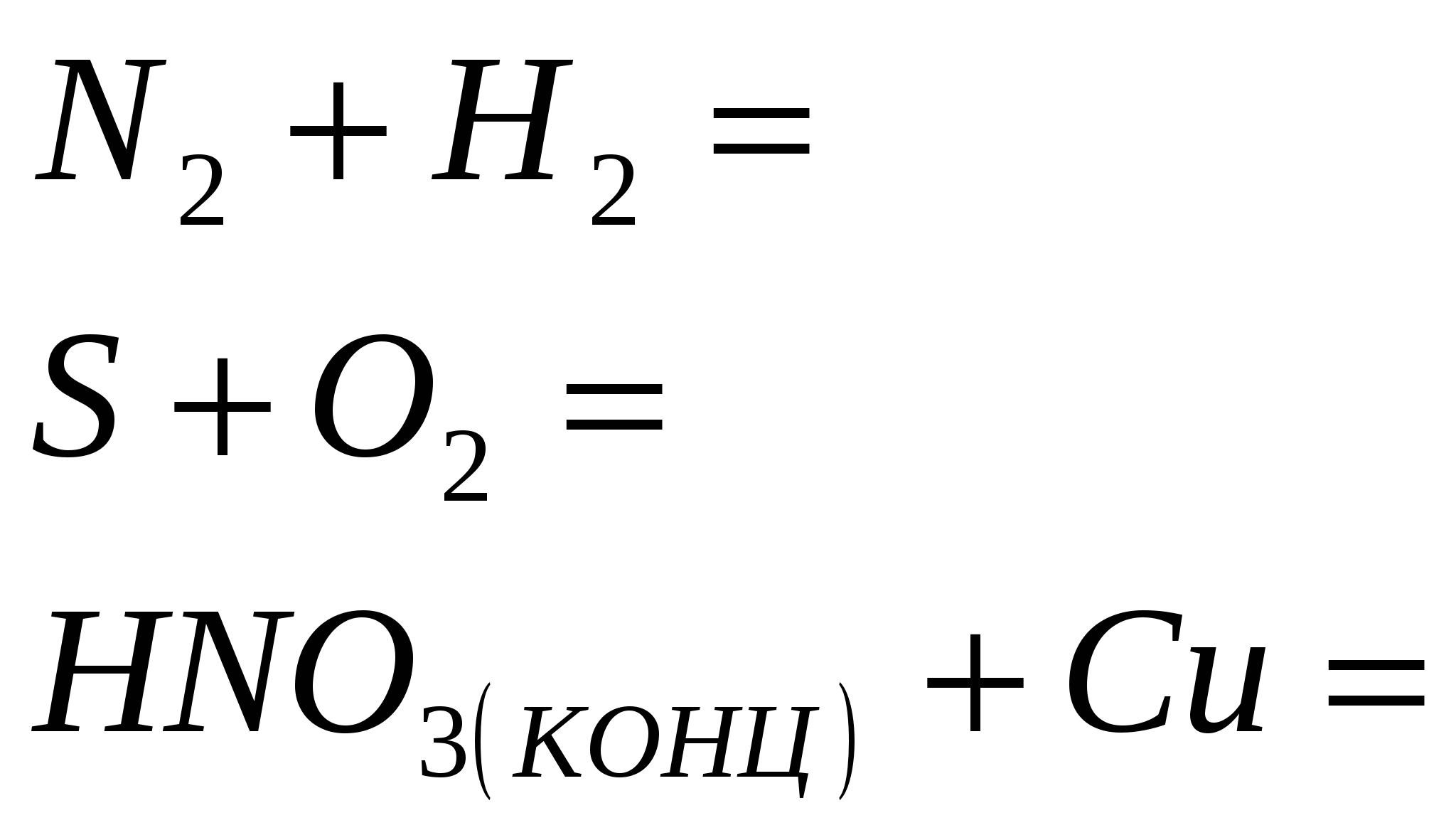
3. Закінчіть рівняння реакцій
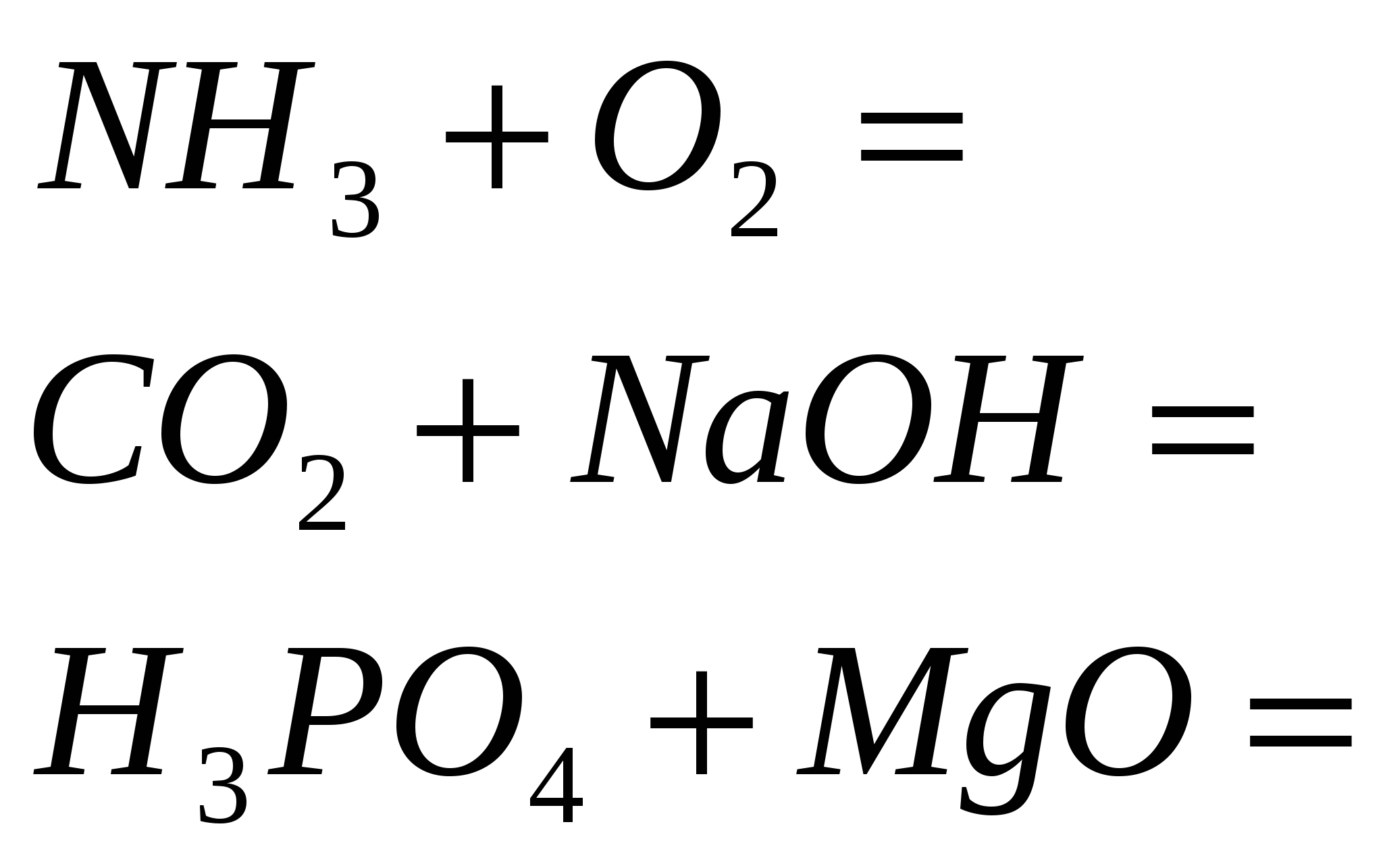
4. Закінчіть рівняння реакцій
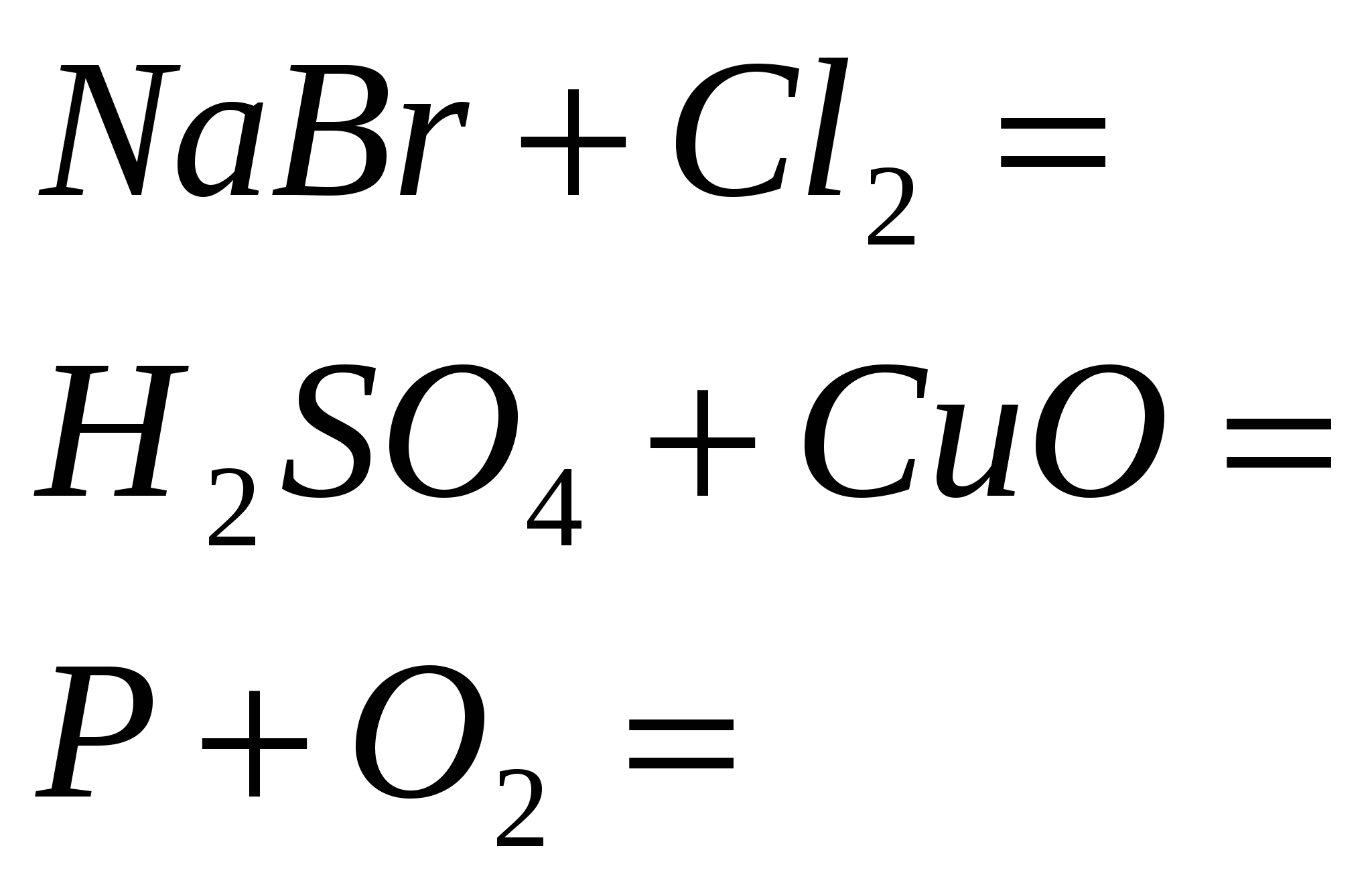
5. Закінчіть рівняння реакцій
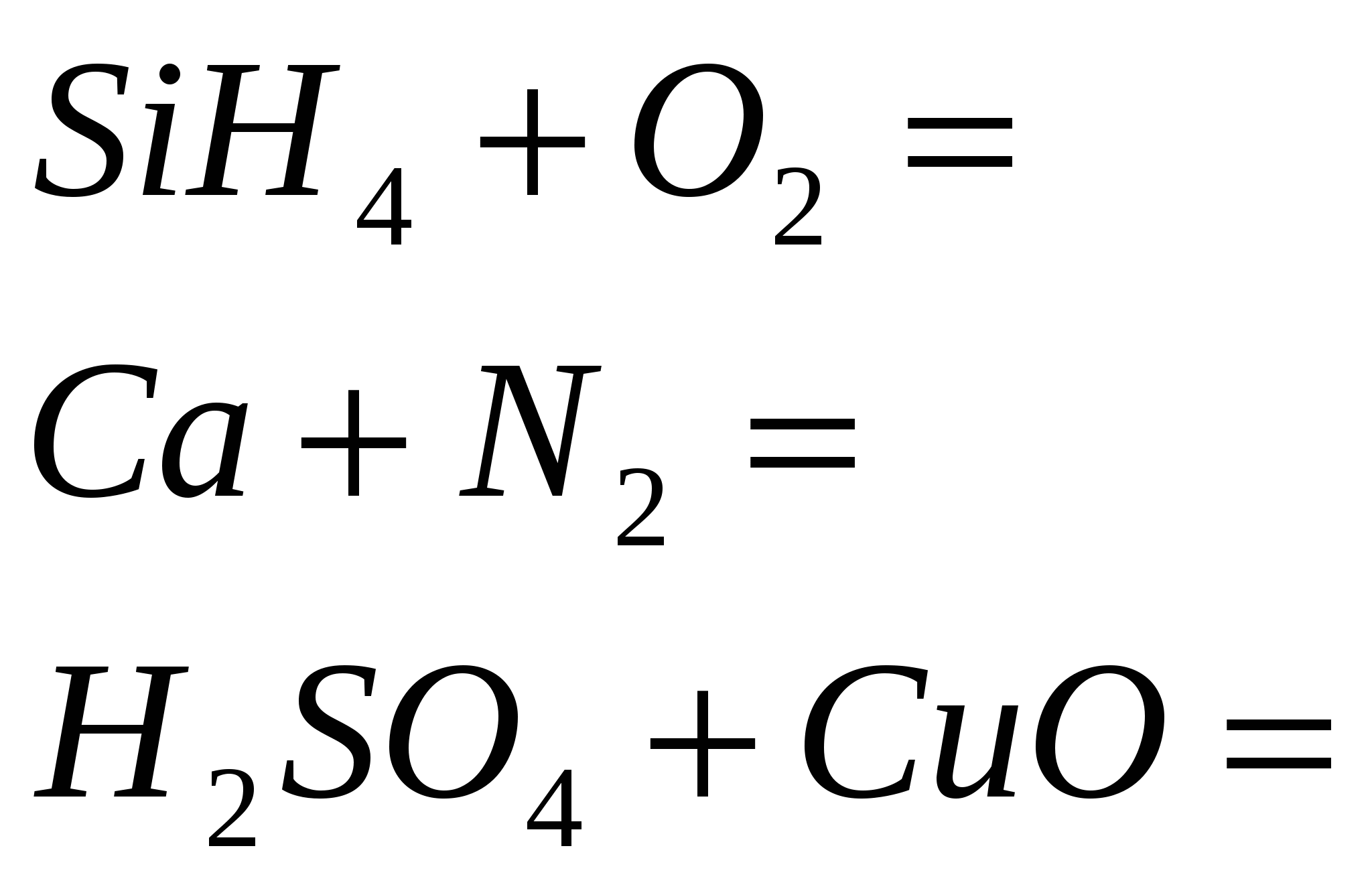
2 рівень
Здійсніть перетворення:
3рівень
Здійсніть перетворення:
3.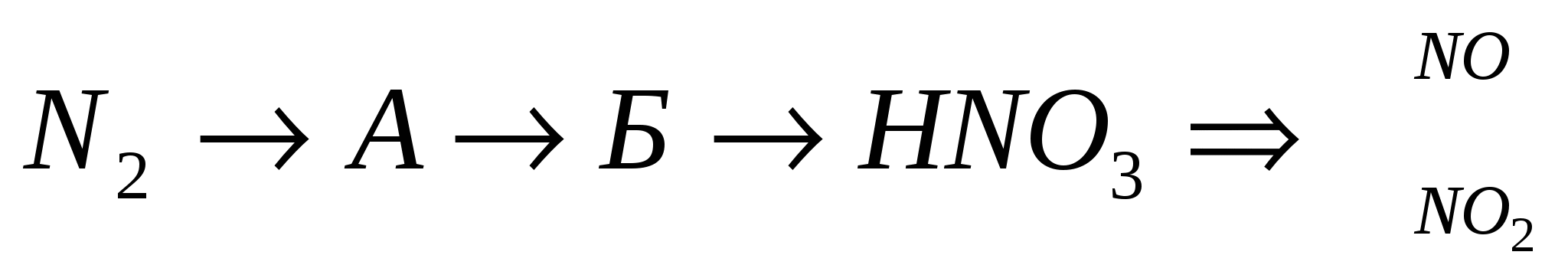
Етап «Тест»
Варіант 1
а) О, б) S, в) Cl, г) C, д) Si.
а) 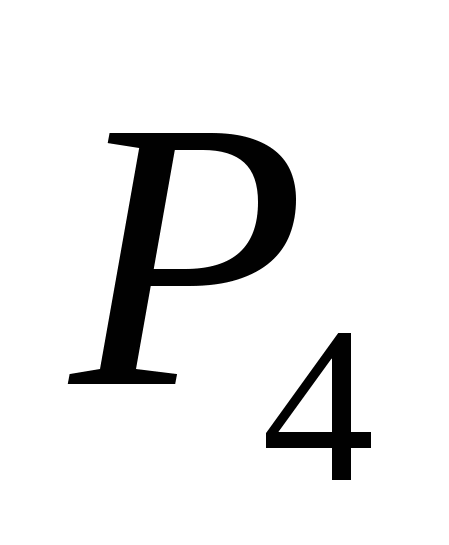 , б) C , в)
, б) C , в) 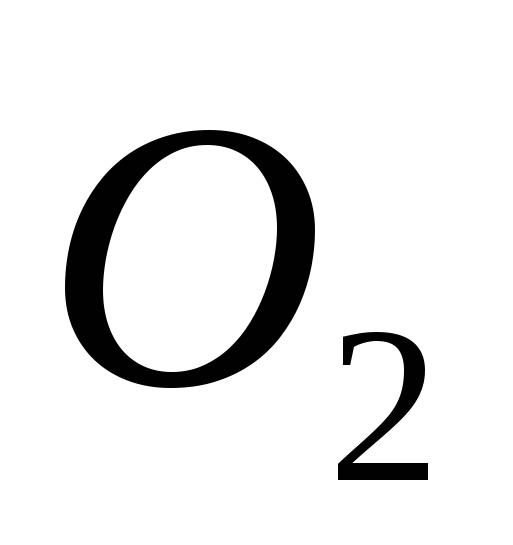 , г)
, г) 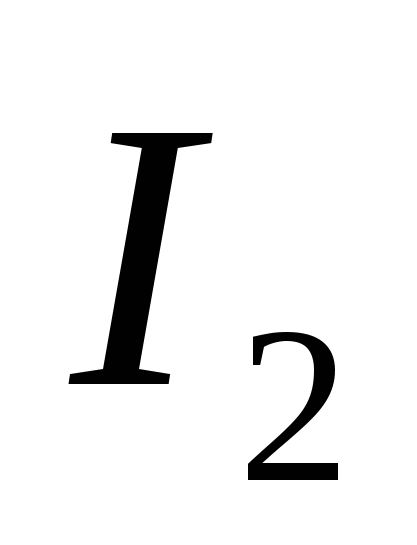 д)
д) 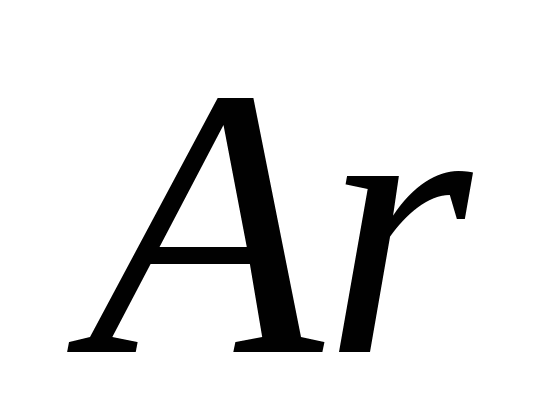 .
.
а)  , б)
, б) 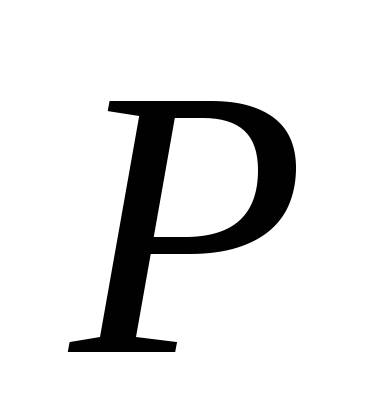 , в)
, в)  , г)
, г)  д)
д)  .
.
4. Електронна формула елемента. Його летюча воднева сполука:
а)  , б)
, б)  , в)
, в)  , г)
, г)  .
.
5.Сила галогеноводородних кислот зростає у ряду:
а) ![]()
б) 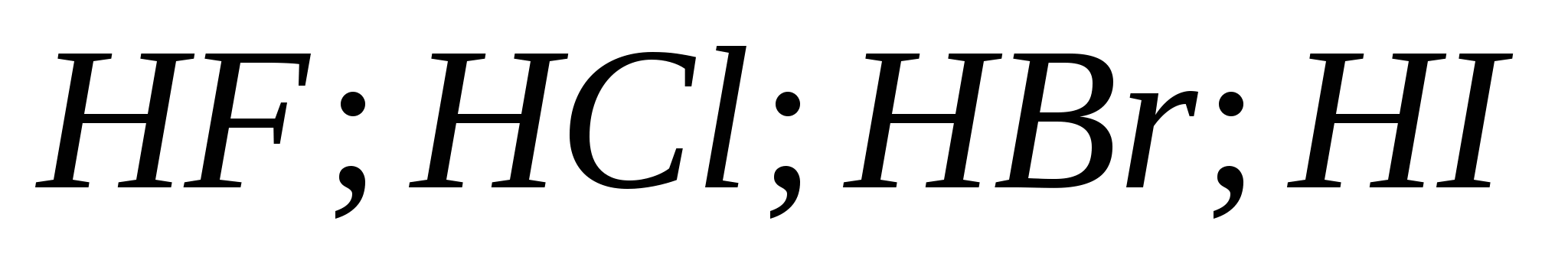
в) 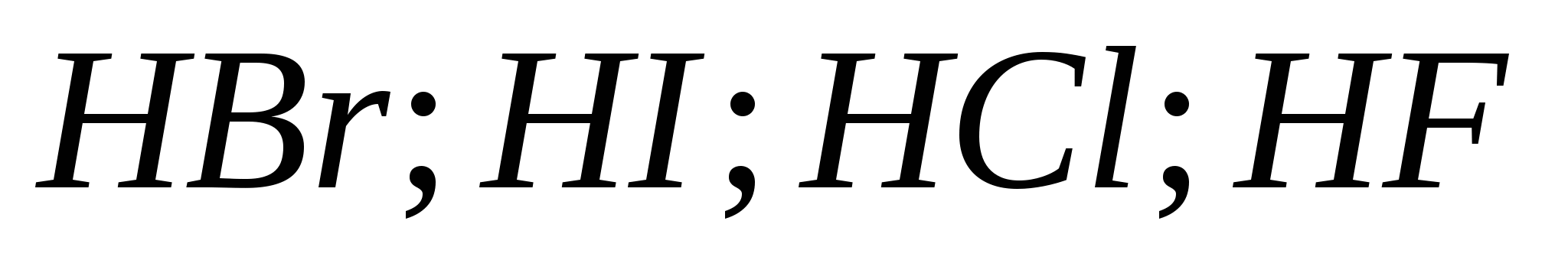
г) 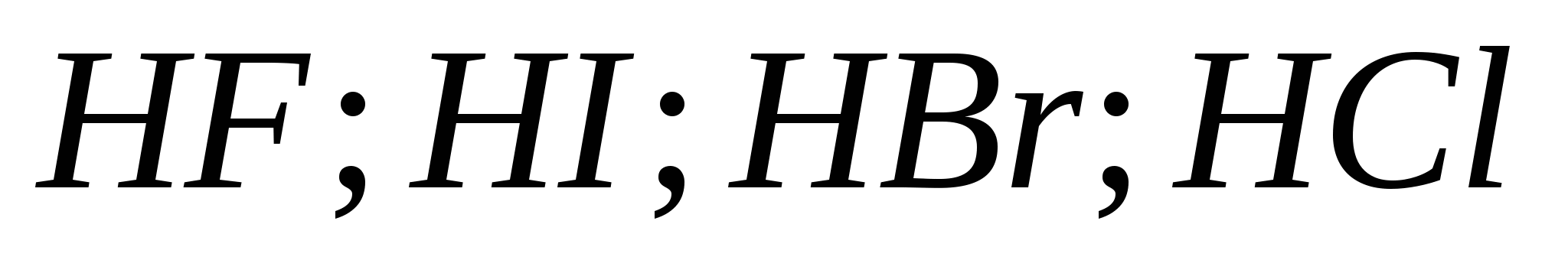
6. З галогенів вперше у бойових діях було застосовано речовину:
а) фтор; б) хлор; в) йод; г) бром.
7. Розведена сірчана кислота виявляє окислювальні властивості за рахунок атомів:
а)  , б)
, б)  , в)
, в)  .
.
8.Оксид азоту V може взаємодіяти:
а) 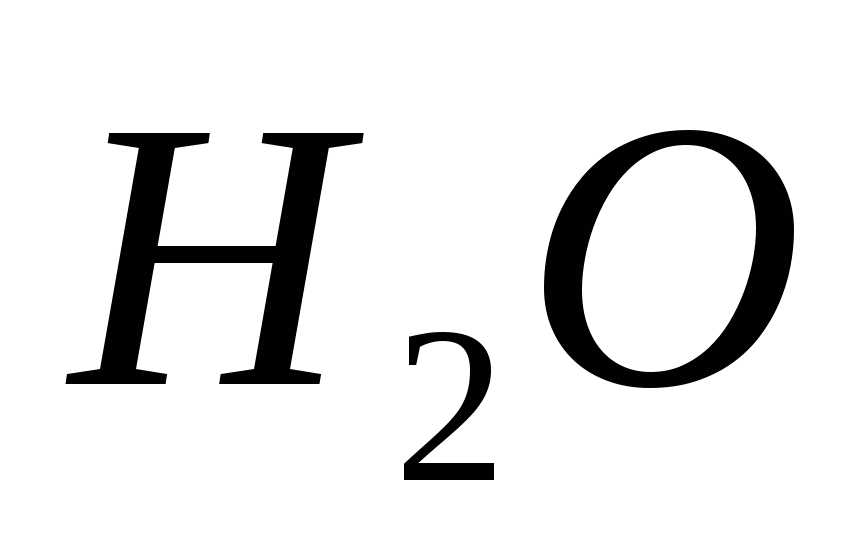 , б)
, б) 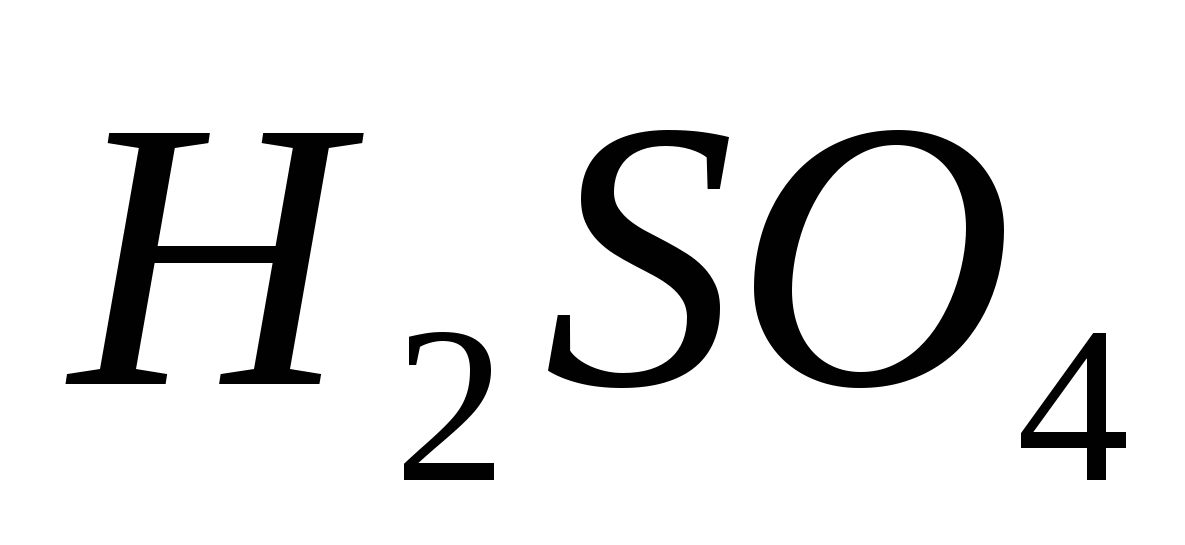 , в)
, в)  , г)
, г) 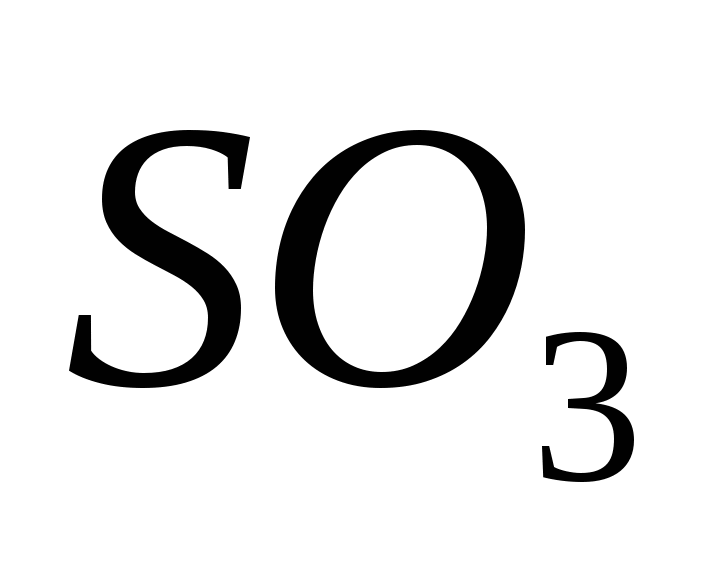 д)
д)  .
.
9. Реакція: доводить такі властивості аміаку:
а) окислювальні, б) відновлювальні, в) кислотні, г) основні.
10. Сила кислот у ряду
а) зменшується, б) збільшується, в) спочатку збільшується, потім зменшується; г) спочатку падає, потім зростає, д) не змінюється.
Варіант 2
Атомні кристалічні грати мають прості речовини, утворені:
а)  , б)
, б)  , в)
, в) 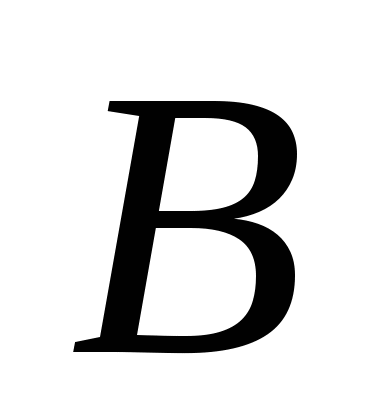 , г)
, г) 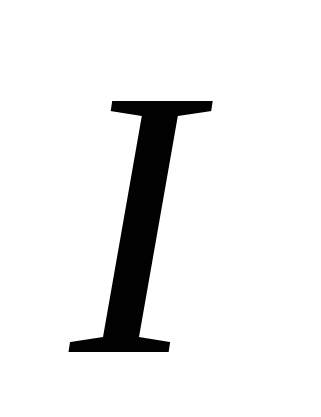 д)
д)  .
.
2. Газами за нормальних умов є:
а)  , б)
, б)  , в)
, в)  , г)
, г)  д)
д) 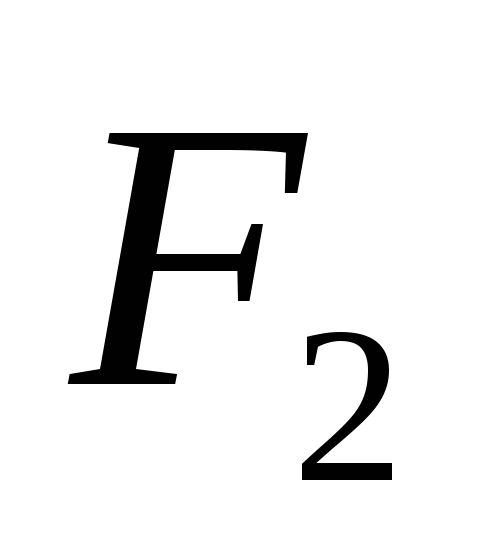 .
.
3. Алотропні модифікації утворюють такі елементи:
а) 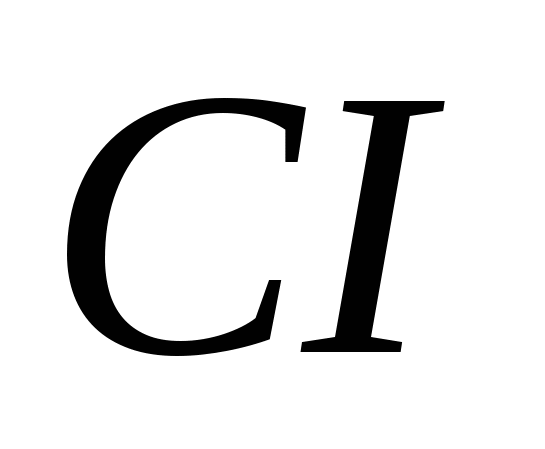 , б)
, б) 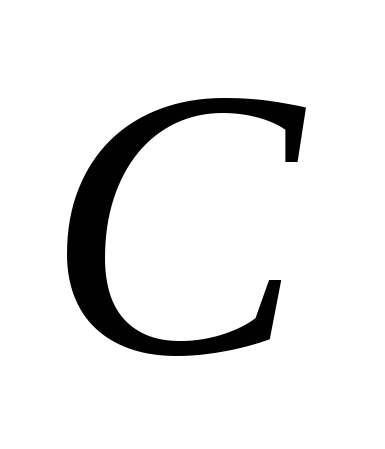 , в)
, в) 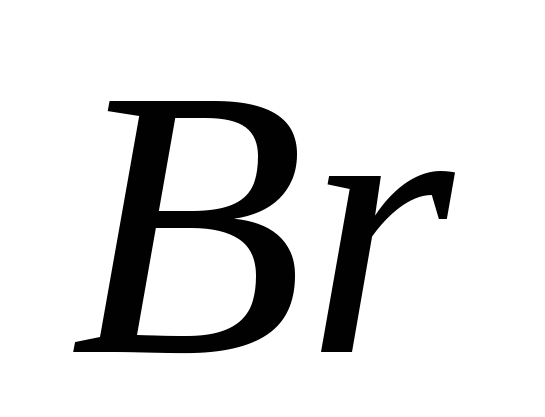 , г)
, г) 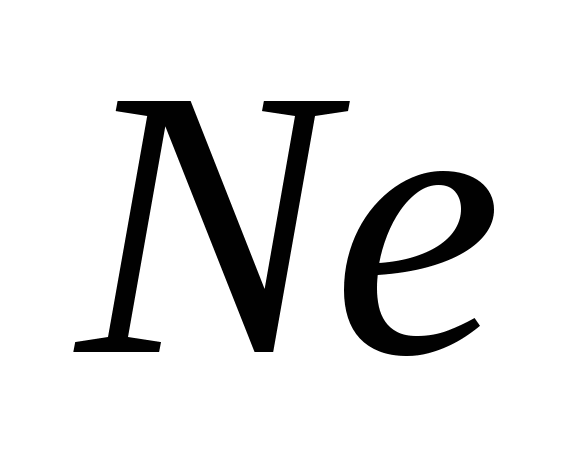 д)
д)  ,
,
4. Електронна формула елемента. Його летюча воднева сполука:
а) 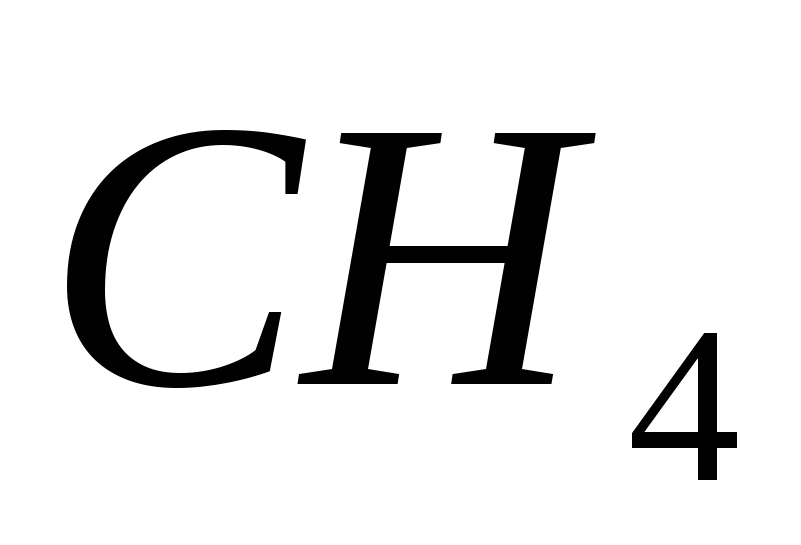 , б)
, б) 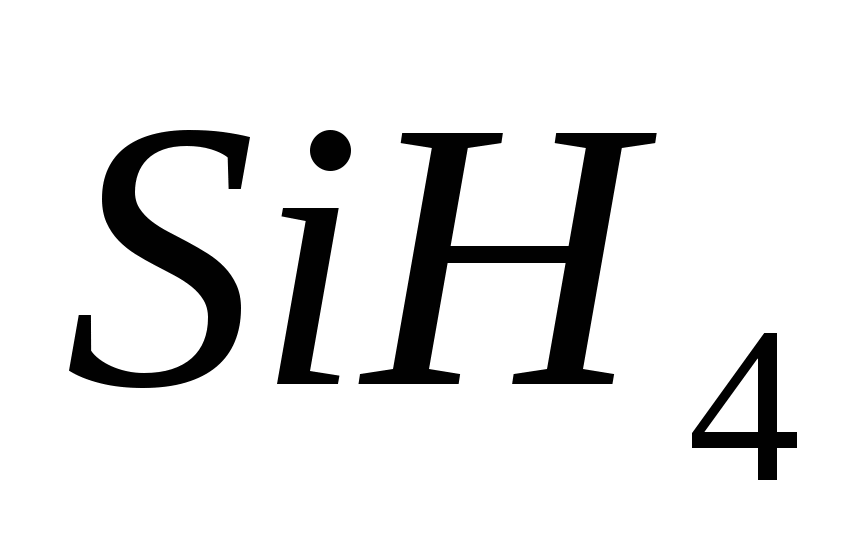 , в)
, в)  , г)
, г) 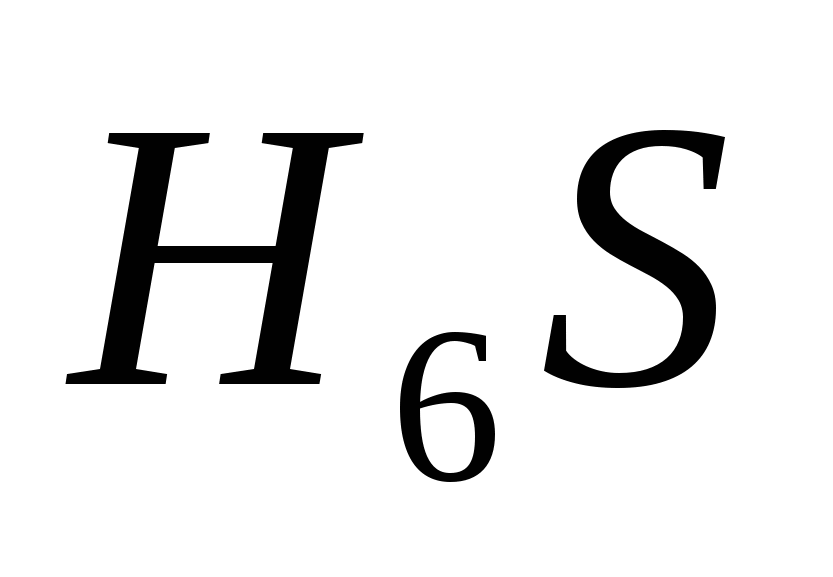 д)
д)  .
.
5. Основні властивості летких водневих сполук зменшується в ряду:
а) 
б) 
в) 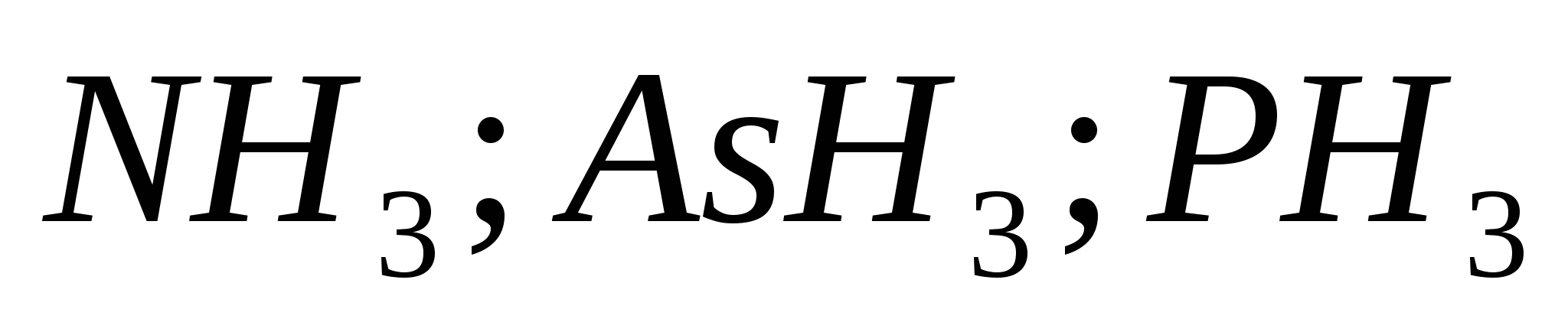
г) 
6. Для поглинання хлору можна використовувати концентровані розчини:
а)  , б)
, б) 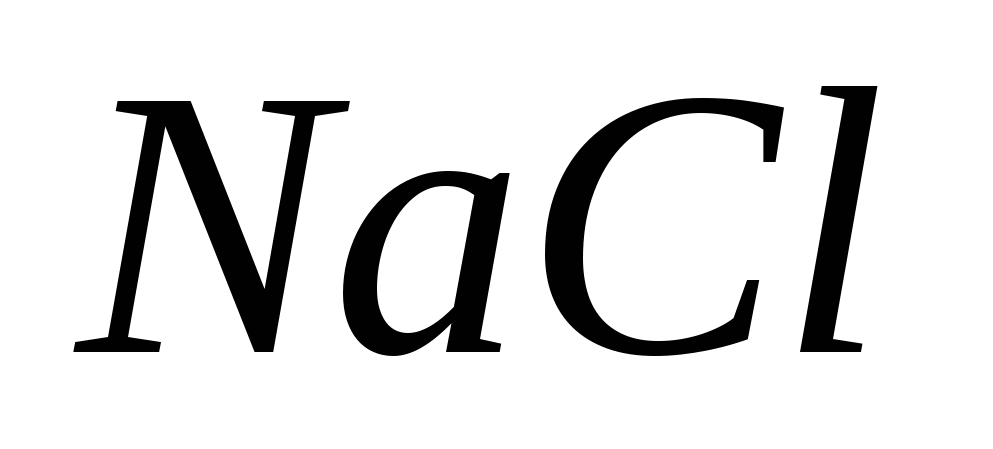 , в)
, в)  , г)
, г)  .
.
7. Концентрована сірчана кислота виявляє окислювальні властивості за рахунок атомів:
а)  , б)
, б)  , в)
, в)  .
.
ПРИМІТКА: 9-10 правильних відповідей-«5»; 7-8-«4»; 5-6-«3»; менше 5-2
Етап «Теорія»
І рівень (на «3»)
Напишіть рівняння реакцій, що характеризують властивості розведеної сірчаної кислоти.
Напишіть рівняння реакцій, що характеризують властивості оксиду сірки (VI).
Напишіть рівняння реакцій, що характеризують властивості содяної кислоти.
Напишіть рівняння реакцій, що характеризують властивості оксиду фосфору (V).
Напишіть рівняння реакцій, що характеризують властивості аміаку.
II рівень (на «4»)
Запишіть формули летких водневих сполук неметалів ІІ періоду. Поясніть, як і чому змінюються їхні кислотні властивості.
Запишіть формули вищих оксидів неметалів ІІІ періоду. Поясніть, як і чому змінюються їхні кислотні властивості.
Запишіть формули найвищих кислот елементів III періоду. Поясніть, як і чому змінюються їхні кислотні властивості.
Запишіть формули летючих водневих сполук неметалів VI підгрупи. Поясніть, як і чому змінюються їхні кислотні властивості.
Запишіть формули найвищих кислот елементів VA підгрупи. Поясніть, як і чому змінюються їхні кислотні властивості.
III рівень (на «5»)
Порівняйте окисні та кислотні властивості сірчаної та азотної кислот. Відповідь підтвердьте рівняннями реакцій.
Порівняйте окислювально-відновні та кислотні властивості оксиду сірки (IV) та оксиду вуглецю (IV). Відповідь підтвердьте рівняннями реакцій.
Порівняйте окислювальні та кислотні властивості води та фтороводню. Відповідь підтвердьте рівняннями реакцій.
Порівняйте окисні та кислотні властивості концентрованої та розведеної азотної кислоти. Відповідь підтвердьте рівняннями реакцій.
Порівняйте окисні та кислотні властивості оксиду вуглецю (II) та оксиду вуглецю (IV). Відповідь підтвердьте рівняннями реакцій.
Етап «Розрахункова задача»
І рівень (на «3»)
II рівень (на «4»)
При взаємодії 37г гідроксиду кальцію з сульфатом амонію отримано 15 г аміаку. Обчисліть масову частку виходу аміаку %.
При спалюванні в кисні 62 г фосфору було отримано 130 г оксиду фосфору (V). Обчисліть масову частку виходу оксиду фосфору (V) %.
Скільки грамів 10% розчину гідроксиду натрію знадобиться для нейтралізації 8,96 л хлороводню?
Скільки літрів вуглекислого газу можна отримати розкладанням 10 кг вапняку, що містить 20% домішок.
Скільки грамів осаду утворюється за пропускання 11,2 л вуглекислого газу через 900 г 10% розчину гідроксиду барію?
III рівень (на «5»)
Який об'єм 80% азотної кислоти (пл. 1,46 г/мл) необхідний для «розчинення» 32 г міді?
Яка маса міді буде потрібна для реакції з надлишком концентрованої азотної кислоти для отримання 4 л (н.у.) оксиду азоту (IV), якщо об'ємна частка його виходу становить 96%?
При «розчиненні» в концентрованій сірчаній кислоті 20 г золотого сплаву з міддю виділилося 4,2 л (н.у.) оксиду сірки (IV ). Визначте масову частку в % міді у цьому сплаві.
Суміш газів хлору та водню об'ємом 1 л пропустили через розчин іодиду калію. У цьому виділилося 5,08 р йоду. Визначте об'ємну частку (%) газу хлору у вихідній суміші.
Суміш кремнію та вугілля масою 10 г обробили надлишком концентрованого розчину гідроксиду натрію. Внаслідок реакції виділилося 5,6 л водню (н.у). Визначте масову частку кремнію (%) у цій суміші.
