При з'єднанні 28 г кремнію з киснем. Кисневі сполуки кремнію
Кремній.Общая характерістіка.Основное відміну від вуглецю: відсутність п зв'язку в соедіненіях.Сіліціди.Соедіненія з воднем (силани), окислення і гідроліз.Тетрафторід і тетрахлорид кремнію, гідроліз.Гексафторосілікати.Кіслородние соедіненія.Оксід кремнію (IV) .Сілікагель.Кремневая кіслота.Сілікати.Растворімость і гідроліз.Пріродние силікати і алюмосилікати, цеоліти.Кремнійорганіческіе соедіненія.Сілікони і сілоксани.Іспользованіе в медицині сполук кремнію.
кремній (Лат. Silicium), Si, хімічний елемент IV групи періодичної системи Менделєєва; атомний номер 14, атомна маса 28,086. Для кремнію також характерна sp3-гібридизація електронних
орбіталей. На зовнішньому електронному шарі атома кремнію є валентні 3d-
орбіталі (Si: 3s23p23d0),
Кремній після кисню - найпоширеніший елемент у земній корі. На відміну від вуглецю у вільному стані кремній в природі не зустрічається. Найбільш поширеними його сполуками є оксид кремнію (IV) SiO2 і солі кремнієвих кислот - силікати. Вони утворюють оболонку земної кори. З'єднання кремнію містяться в організмах рослин і тварин. За хімічними властивостями кремній, як і вуглець, є неметаллом, але його неметаллічность виражена слабше, так як він має більший атомний радіус
Кремній. утворює сполуки майже з усіма металами - з іліціди (Не виявлені з'єднання лише з Bi, Tl, Pb, Hg). Отримано більше 250 силіцидів, склад яких (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si і ін.) Зазвичай не відповідає класичним валентності. Силіциди відрізняються тугоплавкостью і твердістю; найбільше практичне значення мають феросиліцій (відновник при виплавці спеціальних сплавів, см. Феросплави) і силицид молібдену MoSi2 (нагрівачі електропечей, лопатки газових турбін і т. д.).
Сілан. При дії на силіциди соляної кислоти отримують найпростіше водневе з'єднання кремнію силан SiH4:
Сілан - отруйний газ з неприємним запахом, самозаймається на повітрі
Вони реакционноспособни і є сильними відновниками,
реагують з водою при кімнатній температурі:
SiH4 + 2H2O → SiO2 + 4H2 ,:
тетрафторид кремнію отримують фторированием діоксиду кремнію елементним фтором.
Процес фторування ведуть в дві стадії в полум'яних реакторах, направляючи надлишок елементного фтору з 1-ої стадії на 2-у.
Технічним результатом є виробництво кремнію в безперервному режимі з високими виходом і якістю продукції.
тетрафторид кремнію SiF4 утворюється при дії фтороводородной (плавиковою) кислоти на скло:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Кисневі сполуки кремнію
Найважливішим кисневим з'єднанням кремнію є діоксид кремнію SiO2 (кремнезем), що має кілька кристалічних модифікацій.
Низькотемпературна модифікація (до 1143 К) називається кварцом. Кварц має п'єзоелектричні властивості. Природні різновиди кварцу: гірський кришталь, топаз, аметист. Різновидами кремнезему є халцедон, опал, агат ,. яшма, пісок.
Кремнезем хімічно стійок; на нього діють лише фтор, плавикова кислота і розчини лугів. Він легко переходить в склоподібного стану (кварцове скло). Кварцові скло крихке, хімічно і термічно досить стійко. Відповідає SiO2 кремнієва кислота не має певного складу. Зазвичай кремнієву кислоту записують у вигляді xH2O-ySiO2. Виділено кремнієві кислоти: H2SiO3 (H2O-SiO2) - метакремнієва (три-оксокремніевая), H4Si04 (2H20-Si02) - ортокремнієвої (тетра-оксокремніевая), H2Si2O5 (H2O * SiO2) - діметакремніевая.
Кремнієві кислоти - погано розчинні речовини. Відповідно до менш металлоидной характером кремнію в порівнянні з вуглецем H2SiO3 як електроліт слабкіше Н2СОз.
Відповідають кремнієвим кислотам солі-силікати-у воді нерозчинні (крім силікатів лужних металів). Розчинні силікати гідролізуються за рівнянням
2SiOз2- + H20 = Si2O52- + 20H-.
Концентровані розчини розчинних силікатів називають рідким склом. Звичайне віконне скло-силікат натрію і кальцію-має склад Na20-CaO-6Si02. Його отримують по реакції
Відома велика різноманітність силікатів (точніше, оксосілікатов). У будові оксосілікатов спостерігається певна закономірність: всі складаються з тетраедрів Si04, які через атом кисню з'єднані один з одним. Найбільш поширеними поєднаннями тетраедрів є (Si2O76-), (Si3O9) 6, (Si40l2) 8-, (Si6O1812-), які як структурні одиниці можуть об'єднуватися в ланцюжки, стрічки, сітки і каркаси (рис 4).
Найважливішими природними силікатами є, наприклад, тальк (3MgO * H20-4Si02) і азбест (SmgO * H2O * SiO2). Як і для SiO2, для силікатів характерно стеклообразное (аморфне) стан. При керованої кристалізації скла можна отримати мелкокристаллическое стан (ситалли). Ситалли характеризуються підвищеною міцністю.
Крім силікатів в природі широко поширені алюмосилікати. Алюмосилікати - каркасні оксосілікати, в яких частина атомів кремнію замінена на тривалентний Аl; наприклад Na12 [(Si, Al) 04] 12.
Для кремнієвої кислоти характерно колоїдне стан при впливі на її солі кислот H2SiO3 випадає не одразу. Колоїдні розчини кремнієвої кислоти (золи) за певних умов (наприклад, при нагріванні) можна перевести в прозору, однорідну студнеобразную масу-гель кремнієвої кислоти. Гелі - високомолекулярні з'єднання з просторової, вельми крихкою структурою, утвореної молекулами Si02, порожнечі якої заповнені молекулами H2O. При зневодненні гелів кремнієвої кислоти отримують силікагель - пористий продукт, що володіє високою адсорбційною здатністю.
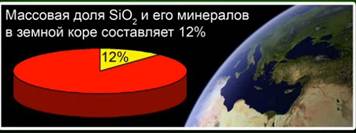
Оксид кремнію (IV) (Кремнезем) - найбільш поширене в земній корі з'єднання, що становить у вигляді різних мінералів 12% її маси. Розрізняють кристалічний і аморфний кремнезем. Найпростіша формула оксиду кремнію (IV) - SiO2. Він кристалізується в атомній решітці.
1) Кристалічний кремнезем - у вигляді мінералу кварцу і його різновидів (гірський кришталь, халцедон, агат, яшма, кремінь); кварц становить основу кварцових пісків, широко використовуваних в будівництві і в силікатної промисловості.
2) Аморфний кремнезем - у вигляді мінералу опала складу SiO2 nН2О; землистими формами аморфного кремнезему є діатоміт, трепел (інфузорна земля); прикладом штучного аморфного безводного кремнезему може служити силікагель, який отримують з метасилікат натрію:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Силікагель має розвинену поверхню, тому добре адсорбує вологу.
Силікагель являє собою висушений гель, що утворюється з перенасичених розчинів кремнієвих кислот (nSiO2 · mH2O) при pH\u003e 5-6. Твердий гідрофільний сорбент.
отримання
Виходить при підкисленні розчинів силікатів лужних металів з наступним промиванням і висушуванням утворився гелю:
Кремнієві кислоти. SiO2 є ангідридом ряду кремнієвих кислот
Кремнієва кислота побудована з тетраедричних структурних ланок (в кожному такому ланці атом кремнію знаходиться в центрі тетраедра, а по вершинах розташовані атоми кисню). Структурні ланки, об'єднуючись в ланцюзі, утворюють більш стійкі полікремнієві кислоти:
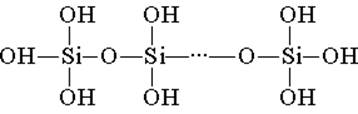
Склад такого з'єднання можна виразити формулою (H2SiO3) n. Однак зазвичай кремнієву кислоту зображують формулою H2SiO3. H2SiO3 - кислота дуже слабка, в воді мало розчинна. При нагріванні легко розпадається аналогічно вугільної кислоти:
Все кремнієві кислоти дуже слабкі (слабше вугільної).
силікати. Солі всіх кремнієвих кислот називають силікатами, хоча, як правило, в навчальній літературі під силикатами увазі солі метакремнієвої кислоти. Їх склад зазвичай зображують формулою у вигляді сполук оксидів елементів. Наприклад, силікат кальцію CaSiO3 можна висловити так: СаО × SiO2.
Силікати складу R2О × nSiO2, де R2O - оксиди натрію або калію, називаються розчинним склом, а їх концентровані водні розчини - рідким склом. Найбільше значення має натриевое розчинне скло.
При стоянні на повітрі розчини силікатів мутніють, так як знаходиться в повітрі оксид вуглецю (IV) витісняє кремнієву кислоту з її солей:
Кремнієва кислота практично нерозчинні в воді - це властивість використовують як якісну реакцію на іон SiO32-.
Силікати отримують сплавом оксиду кремнію з лугами або карбонатами:
Розчинність кремнієвої кислоти і швидкість її розчинення залежать від декількох факторів, з яких найважливіші - взята модифікація двоокису кремнію, ступінь її дисперсності і температура. При струшуванні з водою гелю кремнієвої кислоти рівновагу розчинності встановлюється за кілька годин, в разі кварцу потрібні багато місяців і навіть роки.
силікати ПРИРОДНІ (Від лат. Silex, рід. Падіж silicis - кремінь * а. Natural silicates; н. Naturliche Silikate; ф. Silicates naturels; і. Silicatos naturales) - клас мінералів, солей кремнієвої, ізо- та гетерополікремніевих кислот. На частку силікатів природних доводиться до 75% маси земної кори і близько 25% мінеральних видів. У природі відомо понад 700 силікатів природних, включаючи найважливіші породообразующие мінерали (польові шпати, піроксени, амфіболи, слюди та ін.)
алюмосилікати - група природних і синтетичних силікатів, комплексні аніони яких містять кремній і алюміній. Приклади комплексних аніонів: -, -, 2. Як катіонів виступають Na +, K +, Mg2 +, Ca2 +, а іноді Ba2 + і Li +.
Природні алюмосилікати є найбільш поширеними мінералами, на їх частку припадає до 50% маси земної кори. До них відносяться польові шпати (альбіт, ортоклаз, анортит), глинисті мінерали і слюди.
Цеоліт - це водні алюмосилікати кальцію, натрію, калію, барію і деяких інших елементів. До групи цеолітів входить понад сорок мінералів, які розрізняються і за складом (особливо за кількістю молекул води в кристалогідраті), і звичайно ж по фізичних і хімічних властивостях. Але практично у всіх представників цієї групи мінералів є загальна властивість - вони хороші сорбенти, мають іонообмінні властивості, здатні змінювати рухливість окремих іонів і працювати молекулярними ситами. А порівняно недавно ці мінерали знайшли абсолютно несподіване застосування - їх стали використовувати в сільському господарстві.
кремнійорганічні сполуки - з'єднання, в молекулах яких є зв'язок між атомами кремнію і вуглецю. Кремнійорганічні сполуки іноді називають силіконамі, від латинської назви кремнію «силіциуму». Кремнійорганічні сполуки використовуються для виробництва мастил, полімерів, гум, каучуків, кремнійорганічних рідин і емульсій. Кремнійорганічні сполуки застосовуються в косметиці, побутової хімії, лакофарбових матеріалах, миючих засобах. Відмінною особливістю продукції на основі кремнійорганічних сполук від продукції на основі звичайних органічних сполук є, як правило, більш високі експлуатаційні якості і характеристики, а також безпеку застосування людиною. Кремнійорганічні полімери можуть використовуватися для виготовлення форм в кулінарії. Полімеризація кремнійорганічних компаундов і герметиків безпечна для людини і не вимагає витяжки.
СІЛОКСАН - сполуки, що містять в молекулі чергуються атоми кремнію і кисню. Найбільше мають високомолекулярні силоксани - поліорганосилоксани; см. Кремнийорганические полімери.
Силікони (Поліорганосилоксани) - кислородосодержащие високомолекулярні кремнійорганічні сполуки з хімічною формулою n, де R = органічна група (метильная, етільний або фенільна). Зараз цього визначення дотримуються вже вкрай рідко, і в «силікони» об'єднуються також поліорганосилоксани (наприклад силіконові масла типу ПМС, гідрофобізатори типу ГКЖ або низькомолекулярні каучуки типу СКТН) і навіть кремнійорганічні мономери (різні силани), стираючи відмінності між поняттями «силікони» і « кремнійорганікі ».
металевий кремній  кристалічний кремній
кристалічний кремній
кремній (Si). Цей хімічний елемент займає 1/4 складу земної кори. Кварц, гірський кришталь, пісок, глина, граніт, слюда, азбест - все це хімічні сполуки кремнію
Кремній відноситься до проміжних елементів (амфотерним) і може проявляти як металеві так і неметалеві властивості. Він може утворювати хімічні сполуки, як з металами, так і з неметалами.
чистий кремній - хімічно проста речовина сірого кольору, тверде, тугоплавкое і крихке. кристалічний кремній має металевий блиск і широко використовується в напівпровідниковій промисловості (є напівпровідником).
Кремній вможет стречаются як в кристалічному стані ( кристалічний кремній), Так і в аморфному стані ( аморфний кремній). Кристалічний кремній утворюється при охолодженні розчину аморфного кремнію в розплавленому металі. У свою чергу, кристалічний кремній, дуже крихкий матеріал і легко подрібнюється в аморфний порошок. Таким образів, аморфний кремній являє собою уламки кристалів кристалічного кремнію.
У вільному стані кремній отримати досить складно. Його промислове отримання пов'язане з відновленням кварцу, хімічна формула якого - SiO 2, реакцію відновлення виробляють розпеченим коксом (вуглецем).
SiO 2 + C → CO 2 + Si
У лабораторії чистий кремній відновлюють з кварцового піску за допомогою металевого магнію за такою реакції:
SiO 2 + 2Mg → Si + 2MgO.
У процесі такої реакції утворюється бурий порошок аморфного кремнію. При нагріванні порошок може повільно реагувати з концентрованими розчинами лугів (наприклад, гідроксидом натрію NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - отримане складне речовина - ще називають рідким склом.
Цікаво те, що хімічна активність кремнію залежить від розмірів його кристалів. Крупнокрісталліческій кремній хімічно менш активний, ніж аморфний. Останній легко реагує з фтором навіть при звичайній температурі, а при температурі 400 - 600 0 C реагує з киснем, хлором, бромом, сіркою з утворенням відповідних хімічних сполук. При дуже високих температурах кремній реагує з азотом і вуглецем з утворенням відповідно нітриду і карбіду кремнію.
Якщо спробувати розчинити кремній в суміші фтористоводородной HF (плавиковою) і азотної HNO 3 кислот, то реакція протікати не буде. Але якщо провести хімічну реакцію з лугом, наприклад, з гідроксидом калію, то реакція пройде з утворенням солі кремнієвої кислоти
Si + KOH → K 2 SiO 3 + H 2
Якщо прожарювати в печі оксид кремнію (пісок) з коксом, то виходить дуже тверде кристалічна речовина карборунд SiC
SiO 2 + 3C → SiC + 2CO
карборунд - дуже тверде і вогнетривке речовина. У промисловості його отримують у великих кількостях через названих властивостей. Що цікаво, кристалічна решітка карборунда подібна з кристалічною решіткою самого твердого речовини - алмазу, але в ній окремі атоми вуглецю рівномірно замінені атомами кремнію.
При високих температурах, а також в процесі хімічних реакцій при дії кислот на з'єднання металів з кремнієм утворюється силан SiH 4.
Сила - це самозаймистий безбарвний газ. Він може запалюється на повітря з утворенням оксиду кремнію і води
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Якщо оксид кремнію SiO 2 нагрівати в присутності вуглецю в струмені хлору, то протікає хімічна реакція з утворенням хлориду кремнію
SiO 2 + 2C +2 Cl 2 → SiCl 4 + 2CO
хлорид кремнію - це рідина, температура закипання якої складає всього 54 0 C. Хлорид кремнію легко розчиняється у воді з утворенням розчину двох кислот: кремнієвої і соляної
SiСl 4 + H 2 О → H 2 SiO 3 + HCl
Якщо ця хімічна реакція буде протікати в атмосфері вологого повітря, то в процесі освіти двох кислот буде з'являтися густий дим.
фторид кремнію SiF 4 - утворюється в результаті хімічної реакції плавикової кислоти та оксиду кремнію
SiO 2 + 4HF → SiF 4 + 2H 2 O
Фторид кремнію - безбарвний газ, який має "різкий" запах. Також, як і хлорид кремнію, в воді цей газ утворює дві кислоти: кремнієву і плавиковую. Але що цікаво, фторид кремнію може взаємодіяти з плавиковою кислотою з утворенням гексафторкремніевой кислоти , Хімічна формула якої H 2 SiF 6. Її солі та сама кислота - отруйні.
кремній
Основні метали і неметали
На цьому уроці ви вивчите тему «Кремній». Розгляньте відомості про кремнії: його електронна будова, де в природі знаходиться кремній, вивчіть алотропія кремнію, поясніть його фізичні і хімічні властивості. Дізнаєтеся про те, де в промисловості та інших сферах застосовується кремній, як його отримують. Ви познайомитеся з диоксидами кремнію, кремнієвої кислотою і її солями - силікатами.
Тема: Основні метали і неметали
Урок: Кремній. благородні гази
Кремній - один з найпоширеніших хімічних елементів земної кори. Його зміст становить майже 30%. У природі він в основному зустрічається у вигляді різних форм діоксиду кремнію, силікатів і алюмосилікатів.
Майже у всіх своїх сполуках кремній чотиривалентний. При цьому атоми кремнію перебувають у збудженому стані. Мал. 1.
Для переходу в такий стан один з 3s-електронів займає вакантне місце на 3р-орбіталі. При цьому замість 2-х неспарених електронів в основному стані, у атома кремнію в збудженому стані буде 4 неспарених електрона. Він зможе утворювати 4 ковалентні зв'язки за обмінним механізмом.


Атоми кремнію не схильні до утворення кратних зв'язків, але утворюють з'єднання з одинарними зв'язками -Si-O-. Кремнію, на відміну від вуглецю, невластива аллотропия.
Одною з аллотропних модифікацій є кристалічний кремній, В якому кожен атом кремнію знаходиться в sp 3-гібридизації. Мал. 2, 3. Кристалічний кремній - це тверде, тугоплавкое і міцне кристалічна речовина темно-сірого кольору з металевим блиском. При звичайних умовах - напівпровідник. Іноді в якості ще однієї аллотропной модифікації кремнію виділяють аморфний кремній. Це темно-коричневий порошок, хімічно більш активний, ніж кристалічний кремній. Чи є він аллотропной модифікацією - питання спірне.
Хімічні властивості кремнію
1. Взаємодія з галогенами
Si + 2F 2 → SiF 4
2. При нагріванні кремній згорає в кисні, утворюється оксид кремнію (IV).
Si + О 2 → SiО 2
3. При високих температурах кремній взаємодіє з азотом або вуглецем.
3Si + 2N 2 → Si 3 N 4
4. З водними розчинами кислот кремній не реагує. Але розчиняється в лугах.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. При сплаві кремнію з металами, утворюються силіциди.
Si + 2Mg → Mg 2 Si
6. Кремній безпосередньо з воднем не взаємодіє, але водневі сполуки кремнію можна отримати при взаємодії силіцидів з водою.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (силан)
Сілани за будовою подібні до алканів, але значно реакційно здатні. Найстабільніший моносилан запалюється на повітрі.
SiH 4 +2 О 2 → SiО 2 + 2H 2 О
отримання кремнію
Кремній отримують відновленням з оксиду кремнію (IV)
SiО 2 + 2Mg → Si + 2MgO
Одне із завдань - це отримання високочистого кремнію. Для цього технічний кремній переводять в тетрахлорид кремнію. Одержаний тетрахлорид відновлюють до силана, а силан розкладається при нагріванні на кремній і водень.
Кремній здатний утворювати два оксиду: SiО 2 - оксид кремнію (IV) і SiО - оксид кремнію (II).
SiПро - оксид кремнію (II) - це аморфне темно-коричневе речовина, яка утворюється при взаємодії кремнію з оксидом кремнію (IV)
Si + SiO 2 → 2 SiO.
Незважаючи на стабільність, ця речовина майже не використовується.
SiО 2 - оксид кремнію (IV)


На частку цієї речовини припадає 12% земної кори. Мал. 4. Він представлений такими мінералами, як гірський кришталь, кварц, аметист, цитрин, яшма, халцедон. Мал. 5.
SiО 2 - оксид кремнію (IV) - речовина немолекулярного будови.
Його кристалічна решітка - атомна. Мал. 6. Кристали SiО 2 мають форму тетраедра, які пов'язані між собою атомами кисню. Більш правильною була б формула молекули (SiО 2) n. Так як SiО 2 утворює речовина атомної будови, а СО 2 - молекулярного будови, то очевидна різниця в їх властивості. СО 2 - це газ, а SiО 2 - тверде прозоре кристалічна речовина, нерозчинна у воді і тугоплавкое.
Хімічні властивостіSiО 2
1. Оксид кремнію (IV) SiО 2 - це кислотний оксид. Він не реагує з водою. Кремнієву кислоту можна отримати гидратацией SiО 2. Її солі - силікати - можна отримати при взаємодії SiО 2 з гарячими розчинами лугів.
SiО 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Реагує з карбонатами лужних і лужноземельних металів.
CaCO 3 + SiО 2 CaSiO 3 + CO 2
3. Взаємодіє з металами.
SiО 2 + 2Mg → Si + 2MgO
4. Реакція з плавиковою кислотою.
SiО 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Хімічні властивості кремнієвої кислоти і силікатів
Отримання кремнієвої кислоти
Кремнієва кислота осідає у вигляді полімерного з'єднання. Формули для кремнієвої кислоти -
H 2 SiO 3 (мета форма) і H 4 SiO 4 (орто форма) - відображають співвідношення елементів, але не справжній склад. Умовно на площині склад кремнієвої кислоти зображується як Рис. 7.
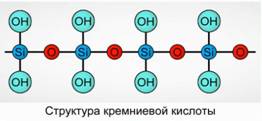
Для кремнієвої кислоти завжди використовується формула H 2 SiO 3.
1. H 2 SiO 3 при нагріванні розкладається
H 2 SiO 3 H 2 O + SiO 2 (силікагель)
2. Взаємодіє з розчинами лугів
H 2 SiО 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Солі кремнієвої кислоти - силікати - відносяться до іонних сполук. Це тверді безбарвні речовини. У воді розчинні тільки силікати лужних металів, крім літію.
1. Розчинні силікати піддаються гідролізу за аніоном
Na 2 SiО 3 + H 2 O ⇆ NaHSiО 3 + NaОH
2. Розчинні силікати взаємодіють з сильними кислотами
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
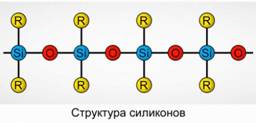
Поліорганосилоксани (силікони)
Поліорганосилоксани (силікони) - це кисень високомолекулярні кремнійорганічні сполуки.
R 2 [ SiO] n
R - органічна група (метильная, етільний або фенільна). В основі будови сілоксанов лежить ланцюжок з чергуються атомів кремнію і кисню. Рис.8. Варіюючи довжину ланцюжка і органічні групи, можна отримати силікони з різними властивостями. Змінюючи умови полімеризації, можна отримувати молекули різної довжини.


Полімери з коротким ланцюжком - це рідини, довші - цінні мастильні матеріали. Мал. 9, які зберігають свої властивості в величезному інтервалі температур від
100 0 С до + 300 0 С. Довші молекули утворюють каучуки, які не втрачають своєї еластичності при низьких температурах. Мають високу стійкість до стирання, хімічно інертні. Мал. 10. Це обумовлює різні варіанти їх застосування. Вони можуть використовуватися для створення апаратів штучного серця або нирки, а можуть застосовуватися як підошви для черевиків. Силоксанові полімери використовуються в медицині для створення різних імплантатів м'яких тканин, оскільки такі полімери хімічно інертні і не відторгаються організмом. Вони не змочуються водою. Це використовується в кремах. При нанесенні такого крему на руки, він замінять собою гумові рукавички.
неорганічний сад
У прозору склянку, заповнений силікатом натрію, опускаємо кристали забарвлених солей, наприклад, мідного купоросу. Через деякий час можна побачити, що з кристалів утворилися тонкі порожнисті трубки, які складаються з нерозчинних силікатів. Мал. 11.

Отримання «безглуздій» замазки
Змішуються рівні об'єми силікату натрію і медичного спирту. Випав осад фільтрується і віджимається, щоб не капав спирт. Це і є замазка. Мал. 12. Вона названа так, тому що планувалося використовувати її як замазку для вікон. Але виявилося, що вона має такі властивості, що використовувати її за призначенням не вийшло. Якщо скачати кульку і кинути на підлогу, то він відскочить, як каучуковий м'ячик. Якщо покласти на стіл, то розтечеться, як рідина. Якщо вдарити твердим предметом, то розлетиться, як тверде тіло. Через деякий час, коли висохне спирт, ця замазка просто розсиплеться.
![]()
Підбиття підсумку уроку
На цьому уроці ви вивчили тему «Кремній». Розглянули відомості про кремнії: його електронна будова, де в природі знаходиться кремній, вивчили алотропія кремнію, пояснили його фізичні і хімічні властивості. Дізналися про те, де в промисловості та інших сферах застосовується кремній, як його отримують. Ви познайомилися з диоксидами кремнію, кремнієвої кислотою і її солями - силікатами.
Список літератури
1. Рудзитис Г.Є. Хімія. Основи загальної хімії. 11 клас: підручник для загальноосвітніх установ: базовий рівень / Г.Є. Рудзитис, Ф.Г. Фельдман. - 14-е изд. - М .: Просвещение, 2012.
2. Попель П.П. Хімія: 8 кл .: Підручник для загальноосвітніх навчальних закладів / П.П. Попель, Л.С.Крівля. - К .: ВЦ «Академія», 2008. - 240 с .: іл.
3. Габрієлян О.С. Хімія. 11 клас. Базовий рівень. 2-е изд., Стер. - М .: Дрофа, 2007. - 220 с.
Домашнє завдання
1. №№2-4 (с. 138) Рудзитис Г.Є. Хімія. Основи загальної хімії. 11 клас: підручник для загальноосвітніх установ: базовий рівень / Г.Є. Рудзитис, Ф.Г. Фельдман. - 14-е изд. - М .: Просвещение, 2012.
2. Назвіть області застосування полиорганосилоксанов.
3. Порівняйте властивості аллотропних модифікацій кремнію.
