Alta concentrazione di silicio. Tu sai come
Processore? Pisok? E cosa hai con la parola associazioni? O forse la Silicon Valley?
Come se non ci fosse, con il silicio ci attacchiamo oggi, e se hai bisogno di sapere cos'è Si e perché mangi, chiedo un gatto.
Iscrizione
Essendo uno studente di una delle università di Mosca nella specialità "Nanomateriali", voglio conoscerti, caro lettore, con gli elementi chimici più importanti del nostro pianeta. Scelgo qualcosa da molto tempo, carbone o silicone, eppure ho deciso di usare Si io stesso, in modo che il cuore di qualsiasi gadget moderno sia basato su di esso stesso, quindi puoi dirlo magnificamente. Cercherò di rendere i miei pensieri estremamente semplici e accessibili, avendo scritto questo materiale, l'ho salvato, principalmente sui neofiti, ma sempre più persone possono ottenerlo da cicave, quindi vorrei dire che l'articolo è stato scritto esclusivamente per espandere gli interessi, cosa è rimasto bloccato. E quindi cominciamo.
Silicio
Silicio (lat. Silicium), Si, elemento chimico del IV gruppo del sistema periodico di Mendeliev; numero atomico 14, peso atomico 28,086.
In natura l'elemento è rappresentato da tre isotopi stabili: 28Si (92,27%), 29Si (4,68%) e 30Si (3,05%).
Spessore (n.s.) 2,33 g/cm?
Punto di fusione 1688 K

Polvere Si
Prova storica
Colline di silicio, vaste terre, viali di persone dall'età della pietra. C'erano migliaia di spratti di pietra e l'irrigazione della pietra. Zastosuvannya spoluk Il silicio, legato alla loro lavorazione, - la preparazione di un magazzino - iniziò intorno al 3000 a.C. e. (Antico Egitto). In precedenza in casa veniva utilizzato il silicio: ossido SiO2 (silice). Nel XVIII secolo, la silice veniva iniettata con un corpo semplice e portata nelle "terre" (che è usata nel suo nome). Skladnіst in un magazzino di silice che ha installato І. I. Berzelius. Nella stessa vpershe, nel 1825, dopo aver rimosso il silicio elementare dal fluoruro di silicio SiF4, sostituendo il restante potassio metallico. Il nuovo elemento è stato chiamato "silicium" (lat. silex - selce). Nome russo vvіv G. I. Hess al 1834 roci.

Arco di estensioni in silicio in natura presso il magazzino del suono sonoro
Silicio espandente in natura
Per l'ampiezza nella crosta terrestre, il silicio è un altro elemento (dopo acido), la sua media nella litosfera è del 29,5% (dietro la massa). La corteccia della terra, grigio silicio, ha lo stesso ruolo primario, come il carbone della luce terrena della creatura. Per la geochimica del silicio, è importante, in particolare, che il legame tra yogo e sour sia importante. Quasi il 12% della litosfera diventa silice SiO2 sotto forma di quarzo minerale e varie varietà. Il 75% della litosfera è composto da vari silicati e alluminosilicati (polova, mica, anfibolo toshcho). Il numero totale di minerali, che possono essere sostituiti dalla silice, supera i 400.
Potere fisico del silicio
Penso che soprattutto non sia varto, tutto qui Potenza fisica Ho libero accesso, ma elencherò i più comuni.
Punto di ebollizione 2600 °С
Prozorium di silicio per dovgokhvilovyh ІCh-promenіv
Penetrazione dielettrica 11.7
Durezza del silicio Mohs 7.0
Vorrei dire che il materiale tendente al silicio, la deformazione plastica commemorativa inizia a temperature superiori a 800°C.
Il silicio è un conduttore, lo stesso vino che conosciamo molto di zastosuvannya. L'energia elettrica del silicio può trovarsi in casa.
Potere chimico.
È ricco qui, è incredibile, si potrebbe dire, ma mi sto imbattendo in quello più famoso. Negli scaffali di Si (simile al carbonio) 4-valente.
Sulla superficie dello zavdyak di silicio, la fusione dell'ossido è stabile al vento a temperature elevate. In acido, si ossida a 400 °C, dissolvendo l'ossido di silicio (IV) SiO2.
Silicio resistente agli acidi ed è meno probabile che si mescoli con acido nitrico e fluoridrico, facilmente distinguibile nei prati caldi dall'acqua visibile.
Il silicio produce 2 gruppi di silani acidi: silossano e silossenio. Il silicio reagisce con l'azoto a temperature superiori a 1000 °C. è un materiale prezioso per l'industria chimica, oltre che per la produzione di estintori. L'elevata durezza, nonché la resistenza termica e chimica, sono trattate con pavimenti in carburo di silicio (carburo di silicio SiC) e boro (SiB3, SiB6, SiB12).
Silicio Otrimanya
Penso che tse naytsіkavіsha parte, ecco il rapporto.
Il tipo di riconoscimento incolto è diviso:
1.
Potenza elettronica al silicio(t.z. silicio elettronico"") - il silicio più silicio fuori dalla nebbia di silicio oltre il 99,999% dietro il muro, il supporto elettrico della qualità elettronica del silicio può essere modificato nell'intervallo da circa 0,001 a 150 ohm cm, ma con cui il valore del supporto è colpa di buti viene fornita una casa tutto compreso, in modo da poter entrare nella casa di cristallo degli altri, volendo occuparsi dei compiti dell'asilo nido dell'opir elettrico, squillare, inaccettabile.
2.
Qualità Sony in silicone(t.z. "sonyachny silicon") - silicio da silicio misto oltre il 99,99% per fibra, utilizzato per la produzione di dispositivi di conversione fotoelettrica (batterie soniche).

3.
Silicio tecnico- blocchi di silicio a struttura policristallina, prelevati con il metodo del rinnovamento carbotermico da puro cigolio di quarzo; copertura con silicio al 98%, la casa principale è carbone, è ventilata con un'elevata quantità di elementi leggeri - boro, fosforo, alluminio; utilizzato principalmente indirettamente per il possesso di silicio policristallino.
Il silicio di purezza tecnica (95-98%) possiede esplosioni elettriche di silice ispirata SiO2 tra elettrodi di grafite. Al collegamento con lo sviluppo del metodo nap_v_dnikovoї tehnіko razrobleno per ottenere silicio puro e soprattutto puro. Per il bene della sintesi in avanti del puro silicio vih_dnih spoluk, z yakikh vityagyat silіkі vіdnovlennya vіdnovlennya аbo termіchnogo razkladannya.
Silicio policristallino ("polisilicio") - la forma più pura di silicio, commercialmente valida, - un prodotto che viene utilizzato per la purificazione del silicio tecnico mediante metodi di cloruro e fluoruro ed è vittorioso per la produzione di mono e multicristallino silicio.
Tradizionalmente, il silicio policristallino viene rimosso dal silicio tecnico con un percorso di trasferimento dello yoga in rubinetti di silano (monosilano, clorosilano, fluorosilano) con un fondo offensivo di silani, che vengono depositati, purificazione rettificata del silano convertito e rinnovamento del silano in silicio metallico .
I conduttori in silicio puro si ottengono in due tipologie: policristallino(rinforzo di SiCl4 o SiHCl3 con zinco o acqua, dilatazione termica di SiI4 e SiH4) e monocristallino(Fusione della zona senza crogiolo e "avvolgimento" di un singolo cristallo da silicio fuso - il metodo Czochralsky).

Qui puoi usare il metodo Czochralski per far vibrare il silicio.
Metodo Czochralski- il metodo di vibrazione dei cristalli con un percorso di avvolgimento su per la collina nell'aria sulla superficie del grande obbligo di sciogliersi con l'inizio della pannocchia di cristallizzazione con il percorso di portare il seme di cristallo (o un gran numero di cristalli ) di una data struttura e orientamento cristallografico a contatto con una superficie libera fusa.
Zastosuvannya Silicio
Il silicio appositamente legato è ampiamente utilizzato come materiale per la preparazione di conduttori elettrici (transistor, termistori, vibratori di potenza, tiristori; fotocellule Sony utilizzate nei veicoli spaziali, nonché molte cose di ogni genere).
Frammenti di prosoria di silicio per passare da peli lunghi delle dimensioni da 1 a 9 micron, possono essere collocati nell'ottica a infrarossi.
Il silicio può essere diverso e tutte le aree di zastosuvannya, che si stanno espandendo. In metallurgia Si
vikoristovuetsya per la rimozione dell'acidità (disossidazione) dai metalli fusi.
Silicio magazzino un gran numero di leghe della sala e dei metalli colorati.
Leghe di silicio sano per aumentare la resistenza alla corrosione, migliorare il loro potere livar e aumentare la resistenza meccanica; prote con un maggiore zmistі Il silicio può viklikati kryhkіst.
Le più importanti sono le leghe, leghe di rame e alluminio, che possono essere utilizzate per vendicare le cinture.
La silice viene lavorata da vetro, cemento, ceramica, galze industriali elettriche e di altro tipo.
La pulizia del silicio è importante per la produzione di singoli dispositivi elettronici (ad esempio, il processore del computer) e microcircuiti a chip singolo.
Il silicio puro, utilizzato per il silicio puro, la purificazione del silicio metallurgico come silicio cristallino è la principale materia prima per l'energia Sony.
Silicio monocristallino: la crema dell'elettronica e dell'ingegneria energetica Sony viene utilizzata per realizzare specchi di laser a gas.

Pulizia in silicone e un prodotto di yoga
Silicio nel corpo
Il silicio nel corpo si trova negli occhi di vari spoluks, che partecipano in prima linea all'illuminazione di parti e tessuti scheletrici duri. Particolarmente ricchi di silicio possono accumularsi deak di alghe (ad esempio alghe diatomee) e creature (ad esempio spugne di corno di silicio, radiolaria), che al momento dell'oceano sul fondo dell'oceano sono indurite da depositi di ossido di silicio (IV). Nei mari freddi e nei laghi, i muli biogenici, ricchi di silicio, sono più importanti, nei mari tropicali - i muli vaping con basso contenuto di silicio. Erbe, carici, palme ed equiseti accumulano molto silicio nel mezzo delle crescite terrestri. Nelle creature della spina dorsale, invece dell'ossido di silicio (IV), nei fiumi di cenere 0,1-0,5%. Nel maggior numero di manifestazioni di silicio nell'alcalino tessuto felice, nirkah, caveau pidshlunkovy. In una dieta supplementare, le persone hanno fino a 1 g di silicio. Con un'elevata assunzione di ossido di silicio (IV) nell'aria, viene consumato nella legenia di una persona che causa la malattia: la silicosi.
Visnovok
Ebbene, da tutto, se hai letto fino alla fine e sei penetrato un po ', allora sei un po' più vicino al successo. I spodіvayus, scrivendo io non per niente e mi sono concesso di hoch komu. Per rispetto.
SILICIO. (Silicio), Si - chem. elemento IV del gruppo del sistema periodico di elementi; A. N. 14, a. M. 28.086. Discorso grigio scuro di silicio cristallino con una lucentezza resinosa. Nella maggior parte dei casi, viene rivelato il grado di ossidazione: 4, +2 e +4. Il silicio naturale è costituito dagli isotopi stabili 28Si (92,28%), 29Si (4,67%) e 30Si (3,05%). Ritiro degli isotopi radioattivi 27Si, 31Si e 32Si con periodi di decadimento inverso di 4,5 secondi, 2,62 anni e 700 anni. visto per la prima volta nel 1811 francese. il chimico e fisico J. L. Gay-Lussac e il francese. chimico L. J. Tenar, ma ci sono meno identificazioni nel 1823 Svedese, chimico e mineralogista J. Ya. Berzelius.
Per l'ampiezza nella crosta terrestre (27,6%), silicio-altro elemento (dopo acido). Conoscere è importante. sotto forma di silice Si02 e altri discorsi aspri (silicati, alluminosilicati, ecc.). Per le menti migliori, viene stabilita una modifica stabile del tovagliolo, che ha una struttura cubica centrata sulla faccia come il diamante, con un periodo di a = 5,4307 A. La penetrazione intermittente è 2,35 A. La larghezza è 2,328 gcm. Con un'alta pressione (120-150 kbar) vai ai fili più grandi e alle modifiche metalliche. Superconduttore di modifica del metallo con una temperatura di transizione di 6,7 K. Con l'aumentare della pressione, il punto di fusione diminuisce da 1415 ± 3 ° C a una pressione di 1 bar a 810 ° C a una pressione di 15.104 bar (raro). ). Quando fuso, c'è un aumento del numero di coordinazione e della metallizzazione dei legami interatomici. Carattere silicico amorfo dell'ordine a corto raggio, che mostra una struttura cubica centrata sul volume fortemente creata, quasi rara. Debievskaya t-ra è vicino a 645 K. Coef. la dilatazione lineare della temperatura cambia al variare di t-ri secondo la legge estrema, inferiore a t-ri 100 To wine diventa negativa, raggiungendo il minimo (-0,77 10 -6) deg -1 a t-ri 80 K; a t-rі 310 K il vino è 2,33 10-6 deg-1, e a t-rі 1273 K-4,8 10 deg-1. Calore di fusione 11,9 kcal/g-atomo; tkіp.3520 K.
Il calore di sublimazione ed evaporazione alla temperatura di fusione è di 110 e 98,1 kcal/g-atomo. La conduttività termica e la conduttività elettrica del silicio risiedono nella purezza e completezza dei cristalli. Zі rostannyam t-ri coef. la conduttività termica del puro K. aumenta gradualmente (fino a 8,4 cal/cm X X sec deg a t-ri 35 K), quindi cambia, raggiungendo 0,36 e 0,06 cal/cm sec deg a t-ri vіdpovidno 300 e 1200 K. Entalpia, entropia e capacità termica K. nelle menti standard, è pari a 770 cal/g-atomo, 4,51 e 4,83 cal/g-atomo - deg. Silicio diamagnetico, suscettibilità magnetica dei solidi (-1.1 10 -7 mu/g) e raro (-0.8 10 -7 mu/g). Il silicio è debolmente depositato in t-ri. Energia superficiale, spessore e viscosità cinematica di rari K. alla temperatura di fusione diventano 737 erg/cm2, 2,55 g/cm3 e 3 10 m2/sec. Un tipico conduttore di silicio cristallino con una larghezza della zona recintata di 1,15 ev a t-p da 0 a 1,08 u - a t-p 300 K. A temperatura ambiente, la concentrazione di cariche di trasporto umido è vicina a 1,4 10 10 cm - 3;
Il potere di caduta del silicio è dovuto alla natura e alla concentrazione delle case, nonché alla perfezione del cristallo. Anello per otrimannya napіvprovіdnikovogo Do. con la conduzione dello yoga di tipo r e n, sono combinati con il sottogruppo degli elementi IIIb (boro, alluminio, gallio) e Vb (fosforo, mish'yak, antimonio, bismuto), che creano sukupnіst vіdpovіdno all'accettore e al donatore rіvnі in , roztashovannyh vicino ai cordoni delle zone. Per la legatura di vicorist, quegli altri elementi (per esempio) sono modellati così. glybokі rivnі, yakі obumovlyuyut seppellimento e ricombinazione di accuse di nosesіїv. Tse ti consente di prendere materiali con elettro alto. supporto (1010 ohm cm a t-rі 80 K) quella piccola banalità della base di cariche di usura minori, che è importante per l'aumento del numero di diversi annessi. Coefficiente l'energia termoelettrica con silicio deve essere depositata solo nel t-ri e al posto della casa, zbіlshyuyuchi zі zrostannym elektroopor (a p = 0,6 ohm - cm, a = 103 microvolt / grandine). La penetrazione dielettrica del silicio (da 11 a 15) è debolmente depositata nel magazzino e la completezza dei monocristalli. Le leggi dell'argilla ottica del silicio sono notevolmente cambiate a causa del cambiamento di purezza, concentrazione e natura dei difetti nella vita, nonché della longevità.
Il cordone di argilla indiretta del kolivan elettromagnetico è vicino a 1,09 euro, argilla diretta - fino a 3,3 euro. Nella regione visibile dello spettro dei parametri del complesso indicatore di frattura (n - ik), è già possibile sdraiarsi sulla superficie della casa. Per Do particolarmente puro. (Aλ \u003d 5461 A e t-re 293 K) n \u003d 4,056 e k \u003d 0,028. L'output del robot dell'elettronica è vicino a 48 euro. Tendenza del silicio. Durezza Yogo (t-ra 300 K) per Moos - 7; HB = 240; HV y \u003d 103; I = 1250 kgf/mm2; modulo di norme, elasticità (policristallo) 10890 kgf/mm2. Tra la mineralità per sdraiarsi nella profondità del cristallo: sul vigin, la profondità è da 7 a 14; coef. Rigidità 0,325 1066 cm2/kg.
A temperatura ambiente, il silicio praticamente non interagisce con i reagenti simili a gas (incluso) e solidi, anche se. Quando si sposta t-ri, c'è un'interazione attiva con metalli e non metalli. Zocrema, che dissolve carburo di SiC (a temp. 1600 K), nitruro di Si3N4 (a temp. 1300 K), fosfuro SiP (a temp. 1200 K) e arseniuro Si As, SiAS2 (a temp. 1000 K). Con reazione acida a una temperatura di 700 K, spegnimento del biossido di Si02, con alogeni - fluoruro di SiF4 (a una temperatura superiore a 300 K), cloruro di SiCl4 (a una temperatura superiore a 500 K), bromuro di SiBr4 (a una temperatura di 700 K) i nodide SiI4 (a mp 1000). Reagire intensamente con molti altri. metalli, stabilendo solide differenze nella loro sostituzione con chi chem. sui mezzi siliciuri. Le aree di concentrazione di omogeneità delle rose solide si verificano a seconda della natura della rosetta (ad esempio, Nimechchin da 0 a 100%, in caduta fino al 15%, in alfa zirconio inferiore allo 0,1%).
La differenza tra metalli e non metalli nel silicio solido è significativamente inferiore e sembra retrograda. Con quali confini, invece di una casa, cosa si fa a Do. poco profonda, raggiunge il massimo ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 cm) zona t-r da 1400 a 1600 K. Case con rіvenny profondo vіdznyayutsya rozchinnіstyu leggermente più piccolo (con 1015 per selenio e 5 10 16 per zalіza fino a 7 10 17 per nichel e 10 18 cm-3 per midi). In un acciaio raro, il silicio non è circondato da metalli comuni, spesso con grandi visioni di calore. Il silicio puro viene preparato da un prodotto tecnico 99% Si і - 0,03% Fe, Al і Co), temperato con quarzo e carbone in forni elettrici. Inizia con un nuovo respiro a casa (sum_shy cloridrico e sirchanoy, e poi acqua fluorurata e sirchanoy), dopodiché il prodotto (99,98%) viene portato via, trattato con cloro. Le sintesi vengono purificate mediante distillazione.
Il conduttore di silicio viene utilizzato in combinazione con il cloruro di SiCl4 (o SiHCl3) in acqua o nell'espansione termica dell'idruro di SiH4. La purificazione residua e la macinazione dei monocristalli viene eseguita con un metodo liscio senza crogiolo o con il metodo Czochralsky, tenendo conto del sugo particolarmente puro (in casa fino a 1010-1013 cm-3) cf\u003e 10 3 ohm cm iv a cui entrare dosando il numero di case necessarie. Si preparano così creme cilindriche di 2-4 cm di diametro e 3-10 cm di lunghezza per speciali. scopo è quello di produrre ancora più monocristalli. Silicio tecnico e in particolare leghe yogo da sali vicorosi come acciai e leghe acidi, nonché additivi leggeri. Zrazki monocristallo particolarmente puro K., drogato con vari elementi, è noto per essere utilizzato come base di vari attacchi a bassa corrente (zocrema, termoelettrico, radio, luminoso e fototecnico) e ad alta corrente (vibrante, di conversione).
Silicio e silicio
Il silicio viene portato ai non metalli e 4 elettroni possono trovarsi sullo stesso livello energetico. Può vіddavati їх, mostrando lo stadio di ossidazione + 4 e aggiungere elettroni, mostrando lo stadio di ossidazione - 4. Tuttavia, la capacità di aggiungere elettroni al silicio è significativamente inferiore, inferiore al carbonio. Gli atomi di silicio possono avere un raggio maggiore, atomi di carbonio inferiori.
La conoscenza della natura del silicio .
Arco di estensioni in silicio in natura. per її parte del fall pon oltre il 26% della massa morbillo terrestre. Per la larghezza dei vini, siediti in un altro posto (dopo l'acido). Sul vіdmіnu vіd uglec C vіlny stіnі vіrіdі non zustrichaetsya. Entra nel magazzino di varie composizioni chimiche, principalmente varie modifiche di ossido di silicio (IV) e sali di acidi silicici (silicati).
Ossessione per il silicio .
Il silicio di grado industriale di purezza tecnica (95 - 98%) è dominato da SiO 2 coke nei forni elettrici durante la tostatura:
SiO 2 + 2C \u003d Si + 2CO
SiO 2 + 2Mg \u003d Si + 2MgO
In questo modo si preleva dalle case polvere di silicio amorfo di colore marrone. La ricristallizzazione da metalli in fusione (Zn, Al) può essere trasferita a un mulino per cristalli.
Il tetracloruro di silicio, anche di elevata purezza, viene utilizzato a 1000°C per il tetracloruro di silicio SiCl 4 paia di zinco:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
quella pulizia yogo seguendo metodi speciali.
Fisico Potere chimico silicio.
Silicio cristallino puro - pendio tenditny e duro, flaccido. Come un diamante, ha un reticolo cristallino cubico con un legame di tipo covalente. Punto di fusione Yogo 1423 °C. Per le menti più grandi, un elemento inattivo al silicio, che reagisce solo con il fluoro, ma quando riscaldato entra in varie reazioni chimiche.
Yogo vikoristovuyut come materiale prezioso per napіvprovіdnikovіy tehnіtsі. Abbinato ad altri conduttori di vino, si distingue per una notevole resistenza agli acidi diluiti e una grande resistenza elettrica fino a 300°C. Viscorista tecnico di silicio e ferrosilicio anche nella metallurgia per acciai resistenti al calore, agli acidi e per utensili, chavun e altre leghe ricche.
Con metalli di silicio chimiche, Chiamati siliciuri, quando riscaldato con magnesio, il siliciuro di magnesio si dissolve:
Si + 2Mg = Mg2Si
I siliciuri dei metalli dietro la struttura di quella dominanza predicono i carburi, quindi i siliciuri simili ai metalli, proprio come i carburi simili ai metalli, si distinguono per la grande durezza, l'alto punto di fusione, la conduttività elettrica calda.
Quando si frigge sumish pisku con coke in forni elettrici, il carburo di silicio e il carbonio vengono mescolati con carburo di silicio o carborundum:
SiO2 + 3C = SiC + 2CO
Il carborundum è un disco duro e refrattario, un prezioso materiale abrasivo e termico. Carborundum, yak i, maє atomico cristallino grati. Alla stazione pulita c'è un isolante, ma in presenza della casa diventa un conduttore.
Silicio yak i , dissolve due ossidi: ossido di silicio (II) SiO e ossido di silicio (IV) SiO 2 . L'ossido di silicio (IV) è un discorso refrattario duro, ampiamente ampliato in natura nel paese libero. Tse discorso chimicamente stabile, che interagisce solo con fluoro e fluoro gassoso in acqua o acido fluoridrico:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
L'indicazione diretta delle reazioni è spiegata dal fatto che il silicio può avere una grande sporicità rispetto al fluoro. Inoltre, il tetrafluoruro di silicio è un discorso volante.
A tekhnіtsі prozoriya SiO 2 vykorovuyut per la preparazione di una lastra di quarzo refrattario stabile, poiché manca gentilmente il cambiamento ultravioletto, può avere un grande coefficiente di espansione, che mostra i significativi cambiamenti di temperatura. Modifica amorfa dell'ossido di silicio (II) tripoli maє grande porosità. Yogo vikoristovuyut come isolante termico e acustico per la vibrazione della dinamite (discorso del naso vibukhovo) e così via. L'ossido di silicio (IV) in un suono vibrante è uno dei principali materiali quotidiani. È vigoroso nella produzione di materiali resistenti al fuoco e agli acidi, acciaio, come un flusso nella metallurgia e così via.
Secondo le formule molecolari, il potere chimico e fisico dell'ossido di carbonio (IV) e dell'ossido di silicio (IV) è facile da abbinare, il potere di questi è simile in magazzino chimico z'ednan raznі. Perché viene spiegato che l'ossido di silicio (IV) non è formato solo da molecole di SiO 2 , come s їх associati, in alcuni di essi gli atomi di silicio sono uniti insieme dagli atomi di acido. Ossido di silicio (IV) (SiO 2 )N. Immagine її sulla piazza:
Un altro rappresentante degli elementi del caposottogruppo del IV gruppo (gruppo IVA) del sistema periodico di D. I. Mendeliev - silicio Si.
In natura, il silicio è un altro elemento chimico per la larghezza dell'acido. La crosta terrestre è sempre più piegata in quarti da yogo spoluk. Il silicio più diffuso è l'ossido di silicio (IV) SiO 2, l'altro nome è silice. In natura, i vini sono prodotti con il quarzo minerale (piccolo 158), una ricca varietà di tale - cristallo girsky, e anche la famosa forma lilla - ametista, così come agata, opale, diaspro, calcedonio, corniola, sotto forma di virobnі e pietre inebrianti. L'ossido di silicio (IV) è anche composto da una notevole sabbia di quarzo.

Mal. 158.
Cristalli di quarzo intervallati da dolomite
Tre diversi minerali a base di ossido di silicio (IV) (selce, calcedonio e altri) prime persone preparato znaraddya pracі. La stessa pietra focaia, che è poco appariscente e non più stretta di una pietra, che posa la pannocchia di una pietra vіtsі - vіtsі kremіnyh znaryad pratsі (Fig. 159). Ci sono due ragioni per questo: l'ampiezza e la disponibilità della selce, così come la costruzione di edifici con quanto sono affilati i bordi.

Mal. 159.
Znaryaddya pietra vіku
Un altro tipo di materiali naturali per il silicio è il silicato. Tra questi ci sono le larghezze maggiori di alluminosilicati (si è capito che questi silicati possono sostituire l'elemento chimico dell'alluminio). Il granito viene aggiunto agli alluminosilicati, vedere diverso argilla, mica. Silicato, che non vendica l'alluminio, ad esempio l'amianto, che viene utilizzato per fabbricare fuochi d'artificio.
L'ossido di silicio (IV) SiO 2 è necessario per la vita dei coltivatori e delle creature. I vini danno i gambi di roslin e zahisnymi veli di creature (Fig. 160). Zavdyaki yomu code, code e equiseti stanno mitzno, come bagnets, carici a foglia di gostre tagliati, come coltelli, stoppie su un campo in pendenza, come una testa, e gambi di cereali sul pavimento di un mitzna, che non consentono campi di grano nei campi sdraiarsi su una tavola e vento. Costola di Luska, conchiglie di coma, krill meteliks, pir'ya ptahiv in lana di creature di mіtsnі, oskіlki colpiscono la silice.

Mal. 160.
L'ossido di silicio (IV) dona mineralità agli steli di roslin e alle curve soffocanti delle creature
Il silicio Z'ednannya dona levigatezza e morbidezza ai capelli e alle unghie di una persona.
Il silicio per entrare e nel magazzino degli organismi viventi inferiori - diatomee e radiolari, i seni più bassi della materia vivente, come se creassero le loro imperfezioni dietro la bellezza dello scheletro con la silice (figura 161).
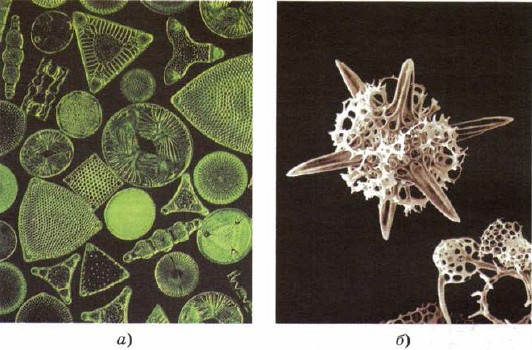
Mal. 161.
Scheletri di diatomee (a) e radiolari (b) sono composti da silice
Il predominio del silicio. Stai usando un microcalcolatore con una batteria Sony, quindi c'è un avviso sul silicio cristallino. Tse napіvprovіdnik. Sul vіdmіnu con metalіv, con la temperatura pіdvishennyam yogo elektroprovіdnіst zbіshuєtsya. Su satelliti, astronavi, stazioni e dahah budinkiv (piccolo 162) installano batterie sony che convertono l'energia sony in elettricità. La puzza lavora cristalli di napіvprovіdnikіv, e alla prima pietra focaia nera. Le fotocellule al silicio possono essere convertite in elettricità fino al 10% dell'energia sony argillosa.

Mal. 162.
Batteria assonnata per stand dahu
Silicio da bruciare all'acidità, saziandovi con l'ossido di silicio (IV):
![]()
Essendo non metallico, quando riscaldato, il silicio si fonde con i metalli con soluzioni di siliciuro, ad esempio:
![]()
I siliciuri si diffondono facilmente con acqua o acidi, quando vedi un silicio simile all'acqua simile al gas - silano:
Sulla superficie dei carboidrati, il silano sulla superficie si auto-impegna e brucia con ossido di silicio disciolto (IV) e acqua:
L'aumento della reazione tra silano e metano CH 4 è spiegato dal fatto che l'espansione dell'atomo di silicio è maggiore, minore al carbonio, quindi i legami chimici Si-H sono più piccoli, i legami C-H sono inferiori.
Interazione del silicio con i cambi d'acqua concentrati dei prati, formando silicato e acqua:
Il silicio possiede, simile all'ossido di silicio (IV) al magnesio o al carbonio:
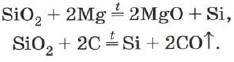
Ossido di silicio (IV), o biossido di silicio, o silice SiO 2 yak in CO 2 є ossido acido. Tuttavia, sulla superficie della CO2 esiste un reticolo cristallino molecolare, ma atomico. A quel SiO 2 è un discorso duro e refrattario. I vini non differiscono per acidi dell'acqua, crema fluoridrica e aloe ad alte temperature con prati con sali disciolti di acido silicico - silicati:
La silice può anche essere utilizzata per legare l'ossido di silicio (IV) con ossidi metallici o carbonati:
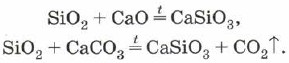
I silicati di sodio e il potassio sono chiamati lastre al dettaglio. Їх fornitura d'acqua- È bene usare la colla ai silicati.
Acido silico H 2 SiO 3 (Fig. 163):
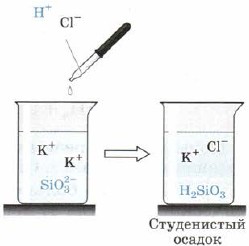
Mal. 163. Reazione acida allo ione silicato
Inoltre, H2SiO3 è anche un acido debole. È incoerente nell'acqua e cade dal tumulto reazionario guardando la feccia dell'assedio, che a volte comprime l'intero volume della differenza, trasformandolo in una massa solida, vado alla gelatina, gelatina. Quando si appende il masi, viene stabilito un discorso altamente poroso - il gel di silice, che è ampiamente usato come adsorbente - argilla di altri discorsi.
Certificato di laboratorio n. 40
Possesso di acido silicico e quella rivendicazione del potere
Iniezione di silicio. Sapete già che il silicio viene utilizzato per la produzione di materiali conduttivi, oltre che di leghe resistenti agli acidi. Quando la sabbia di quarzo viene fusa con la lana ad alte temperature, si dissolve il carburo di silicio SiC, che è disponibile solo per il diamante. Pertanto, è necessario vicorare per affilare rіztsіv metalorіzalnyh verstatіv e lucidare pietre costose.
Dal quarzo fuso vengono preparati vari piatti di quarzo chimico, che possono resistere alle alte temperature e non si rompono quando sono freddi.
Z'ednannya silicio є la base per la deformazione del magazzino al cemento.
L'errore di Zvichayne può essere immagazzinato, che può essere espresso dalla formula Na 2 O CaO 6SiO 2. Yogo viene vinto in speciali forni a cottura con sumish soda, vapnyak e piska fusi.
Vіdmіnna rice skla - zdatnіst rozm'yakshuvatisya і nell'acciaio fuso si gonfia se è una forma, poiché viene salvata quando il magazzino viene catturato. Sulla base del quale si fabbricano gli utensili e si fabbricano le altre merci.
Dodatkovі yakosti sklu dà diversi additivi. Quindi, l'introduzione dell'ossido di piombo si riduce a un colore cristallino, l'ossido di cromo diventa di colore verde, l'ossido di cobalto è blu, ecc. (Fig. 164).

Mal. 164.
Prodotti dal magazzino colori
Sklo è uno dei più antichi produttori di vino del popolo. Già 3-4 tassi. Per questo scoppiò la guerra in Egitto, Siria, Finiki e nel Mar Nero.
Sklo: lo stesso materiale non è meno di remіsnikіv, ma anche artisti. Il maestro ha raggiunto il massimo livello di perfezione Antica Roma, come se potessero togliere la pendenza del colore e il lavoro dei loro mosaici.

Mal. 165.
Vetro colorato alle vetrate della cattedrale di Notre Dame, Chartres
Crea opere d'arte dal magazzino con attributi obov'yazkovymi di un grande museo e vetrate colorate della chiesa, pannelli a mosaico - mozziconi luminosi di questo (Fig. 165). In uno dei locali della filiale di San Pietroburgo dell'Accademia delle scienze russa, c'è un ritratto a mosaico di Pietro I, vittorioso M. V. Lomonosov (Fig. 166).

Mal. 166.
Ritratto a mosaico di Pietro I
Le aree di congestione sono piuttosto ampie. Tse vikonne, plyashkove, lampov, dzerkalne sklo; pendenza ottica - dagli oculari agli occhiali della fotocamera; lenti di dispositivi ottici indistinguibili - dai microscopi ai telescopi.
Il secondo materiale più importante, i rivestimenti a base di silicio, è il cemento. Yogo viene utilizzato per cuocere l'argilla e svapare in forni speciali che vengono avvolti.
Se la polvere di cemento viene mescolata con acqua, il cemento non è saldamente stabilito, altrimenti, come si chiama sveglia, cemento rozchin, che è gradualmente più duro. Quando si aggiunge cemento al cemento o pietrisco, il cemento dovrebbe essere rimosso come uno strato superiore. La materialità del calcestruzzo sta crescendo, così che una nuova cornice viene introdotta in quella nuova: esce il calcestruzzo gettato, da cui vengono realizzate le pareti del pannello, blocchi di sovrapposizioni, ponti fermi, ecc.
Il magazzino è impegnato nella produzione di cemento industria dei silicati. Vaughn produce anche ceramiche silicatiche: ceglu, porcellana (piccola 167), maiolica e articoli da loro.

Mal. 167.
Varietà di porcellana
Vіdkrittya silicio. Anche se nei tempi antichi le persone erano ampiamente vittoriose nell'uso del silicio, il silicio stesso fu portato via per la prima volta nel 1824 dal chimico svedese J. Ya Berzelius. Tuttavia, 12 anni prima della nuova pietra focaia, J. Gay-Lussac e L. Tenard furono portati via, ale vin duzhe zabrudneniy case.
Il nome latino silicum prende la sua pannocchia dalla parola latina silex-selce. Il nome russo "silicio" ricorda il noce kremnos - "skel, skel".
Nuove parole che capiscono
- Fonti naturali di silicio: silice, quarzo e altre varietà, silice, alluminosilicato, amianto.
- Significato biologico del silicio.
- Il predominio del silicio: napіvprovіdnikovі, interazione con acido, metalli, prati.
- Silano.
- Ossido di silicio (IV). Yoga Budova e potere: interazione con prati, ossidi di base, carbonati e magnesio.
- Acido silicico e sali її. Rozchinne slo.
- Zastosuvannya silicio e metà yogo.
- Sklo.
- Cemento.
nominare il giorno
Molto spesso in natura, il silicio si trova in un aspetto simile alla silice, una base a base di biossido di silicio (IV) SiO 2 (circa il 12% della massa del morbillo terrestre). I principali minerali e rocce che vengono spenti dal biossido di silicio sono la catena (ricca e quarzo), il quarzo e la quarzite, la selce, il polov_spar. La silice e l'alluminosilicato sono piegati l'uno all'altro per la larghezza in natura.
Si nota uno ad uno il fatto dell'importanza del silicio puro nel suo aspetto nativo.
Otrimannya
Il silicio uscirà durante la frittura del pisku bianco croccante (biossido di silicio) con il magnesio:
S io O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \rightarrow \ 2MgO+Si)))A cosa ti accontenti silicio amorfo , quello che può sembrare polvere marrone.
Nell'industria, la purezza tecnica del silicio si ottiene fondendo SiO 2 con coke ad una temperatura di circa 1800 ° C in forni termici del tipo ad albero. La purezza del silicio rimosso da tale grado può raggiungere il 99,9% (le case principali sono carbone, metallo).
Puoi allontanarti dalla purificazione del silicio dalle case.
- La purificazione nei bagni di laboratorio può essere effettuata mediante un percorso di possesso frontale di siliciuro di magnesio Mg 2 Si. Abbiamo dato siliciuro di magnesio per ulteriori acidi cloridrico o ottico per rimuovere il monosilano SiH4 simile al gas. Il monosilano viene purificato mediante rettifica, assorbimento e altri metodi, quindi posto su silicio e acqua a una temperatura di circa 1000 °C.
- La purificazione del silicio su scala industriale viene effettuata mediante un percorso di clorurazione non intermedia del silicio. Con questo, le semipieghe del magazzino SiCl 4, SiHCl 3 e SiH 2 Cl 2 vengono sciolte. Їх in un altro modo pulire la casa (di norma, per distillazione e sproporzione) e nella fase finale aggiungere acqua pura a temperature da 900 a 1100 °C.
- Sono in fase di sviluppo tecnologie industriali più economiche, pulite ed efficienti per la purificazione del silicio. Per il 2010 prima di loro è possibile introdurre tecnologie per la purificazione del silicio con fluoro vicario (in sostituzione del cloro); tecnologie che trasferiscono la distillazione al monossido di silicio; tecnologie basate su case di vetro colorato che si concentrano sui confini tra i cristalli.
Vmіst domіshok al silicio finalizzato può essere ridotto a 10 -8 -10 -6% per massa. Altri rapporti sulla nutrizione del silicio puro sono esaminati nell'articolo Silicio policristallino.
Il metodo per ottenere il silicio in una forma pura di frammentazione di Mikola, Mikolayovich Beketov.
Potenza fisica
Il reticolo cristallino di silicio è cubico a facce centrate come il diamante, parametro a = 0,54307 nm (a alta morsa rimuovere altre modifiche polimorfiche al silicio), ma attraverso un legame più grande tra gli atomi Si-Si in un legame con un legame zv'azku SS la durezza del silicio è significativamente inferiore a quella del diamante. Il crepitio del silicio, solo se riscaldato a 800°C, diventa discorso plastico. In prozory per infrachervonogo viprominyuvannya s dozhini khvili 1,1 micron. La concentrazione umida del naso nella carica è 5,81 10 15 m-3 (per una temperatura di 300 K).
Potere elettrofisico
Il silicio elementare in forma monocristallina è un conduttore a gap indiretto. La larghezza dell'area recintata a temperatura ambiente stoccaggio 1,12 eV e a T \u003d 0 K - 1,21 eV. La concentrazione di portatori di carica bagnati nel silicio per menti normali si avvicina a 1.5·10 10 cm −3 .
Sul potere elettrotrofico del silicio cristallino, un grande afflusso costruisce case che vagano nell'oscurità. Per estrarre cristalli di silicio con una conduttività profonda, introdurre nel silicio atomi di elementi del gruppo III, come boro, alluminio, gallio e indio. Per estrarre cristalli dal silicio con conducibilità elettronica al silicio, introdurre gli atomi elementi V-ї groupi, come fosforo, mish'yak, surma.
Quando i dispositivi elettronici sono assemblati sulla base del silicio, è importante fissare la superficie sferica al materiale (fino a decine di micron), quindi la qualità della superficie del cristallo può essere aggiunta alla potenza elettrostatica del silicio e, a quanto pare, sulla potenza dell'utensile finito. Nel corso dell'assemblaggio di alcuni dispositivi, viene aggiunto vicoroso, applicato alla modifica della superficie, ad esempio, la superficie è rivestita con silicio con vari agenti chimici e її oprominennya.
Potere chimico
Simile agli atomi di carbonio, gli atomi di silicio sono caratterizzati dall'ibridazione sp 3 degli orbitali. Al legame con l'ibridazione, il silicio cristallino puro produce grani simili al diamante, in cui il silicio è cotivalente. Allo stesso tempo, il suono del silicio si manifesta anche come elemento cotivalente con uno stato di ossidazione di +4 o -4. Zustrichayutsya mezzo silicio bivalente, ad esempio ossido di silicio (II) - SiO.
Per le menti normali, il silicio è chimicamente inattivo e reagisce attivamente solo con il fluoro simile al gas, con il quale si dissolve il tetrafluoruro di silicio volatile SiF4. Tale “inattività” del silicio è dovuta alla pasivazione della superficie della sfera nanometrica di biossido di silicio, che si deposita negativamente in presenza di acqua acida, ancora e ancora (vapore acqueo).
acidificazione con il biossido di SiO 2 disciolto, il processo è accompagnato da un aumento del volume della sfera di biossido sulla superficie, la stabilità del processo di ossidazione è limitata dalla diffusione dell'acido atomico e del biossido di crioconservazione.
Se riscaldato a una temperatura superiore a 400-500 ° C, il silicio reagisce con cloro, bromo e iodio - con l'adozione di tetraalogenuri facilmente volatili SiHal 4 e, possibilmente, alogenuri in un magazzino piegato.
Con l'acqua il silicio senza mezzo non reagisce, ma con l'acqua il silicio - i silani con la formula Si n H 2n + 2 - possiedono un modo indiretto. Il monosilano SiH 4 (yogo è spesso chiamato semplicemente silano) è visto nell'interazione di siliciuri metallici con acidi, ad esempio:
C un 2 S io + 4 H C l → 2 C un C l 2 + S io H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \rightarrow \ 2CaCl_(2)+SiH_(4)\ ) in alto)))SiH 4 silano, che si dissolve in questa reazione, vendica case e altri silani, zokrem, Si 2 H 6 disilano e Si 3 H 8 trisilano, in alcune lancette per atomi di silicio, legati insieme da legami singoli (- Si -Si-Si- ).
Il silicio reagisce con azoto e boro a temperature vicine a 1000 ° C, dissolvendo nitruro Si 3 N 4 e boruro termicamente e chimicamente stabile SiB 3 , SiB 6 e SiB 12 .
A temperature superiori a 1000 ° C, è possibile utilizzare il silicio che è l'analogo più vicino alla tavola periodica - carbonio - carburo di silicio SiC (carborundum), caratterizzato da elevata durezza e bassa attività chimica. Il carborundum è ampiamente usato come materiale abrasivo. Con questo, tuttavia, la fusione del silicio (1415 °C) può essere messa a contatto per tre ore con il carbone in vista dei grandi pezzi di grafite a grana fine sinterizzata della pressatura isostatica, praticamente non cambiando e non interferendo con il resto.
Gli elementi inferiori del 4° gruppo (Ge, Sn, Pb) non sono rivestiti di silicio, così come la maggior parte degli altri metalli. Se riscaldati con silicio e metalli, si possono formare i loro semigusci, i siliciuri. I siliciuri possono essere suddivisi in due gruppi: ionici-covalenti (silicidi di pozzanghera, metalli pozzanghera e magnesio tipo Ca 2 Si, Mg 2 Si e in) e simil-metallici (siliciuri di metalli di transizione). I siliciuri di metalli attivi sono disposti sotto la diluizione degli acidi; I siliciuri metallici hanno un alto punto di fusione (fino a 2000 °C). I magazzini di siliciuro simili al metallo sono spesso utilizzati Me Sì, Me 3Si2, Me 2 Si 3 , Me 5 Si 3 i Me Si 2. I siliciuri metallici sono chimicamente inerti, resistenti all'acidità alle alte temperature.
È particolarmente importante notare che il silicio sigilla la somma eutettica, che consente l'aggiunta (fusione) di materiali per la sigillatura di ceramiche ferrosilicio a temperature sensibilmente inferiori, inferiori alla temperatura di fusione della guarnizione e del silicio.
Quando si aggiunge SiO 2 al silicio a temperature superiori a 1200 ° C, l'ossido di silicio (II) - SiO viene sciolto. Questo processo è costantemente supportato dalla produzione di cristalli con metodi al silicio
Il silicio in prima linea nelle visioni nel 1811. J.Gay-Lussac e L.Tenar quando passano vapori di fluoruro di silicio su metallo di potassio, le proteine non sono descritte da loro come un elemento. Il chimico svedese J. Berzelius nel 1823 dando una descrizione del silicio da lui rimosso durante la lavorazione del sale di potassio K 2 SiF 6 con potassio metallico ad alta temperatura. Il nuovo elemento è stato chiamato "silicium" (lat. silex - selce). Il nome russo "silicio" fu introdotto nel 1834 dal chimico russo Herman Ivanovich Hess. Alla traduzione di altri greci. krmnoz- Kut, montagna.
Conoscenza in natura, otrimannya:
In natura, il silicio si trova in biossido vibrante e silicati in un magazzino diverso. Il biossido di silicio naturale è più importante sotto forma di quarzo, volendo utilizzare altri minerali: cristobalite, tridimite, balena, cousite. La silice amorfa si accumula nei depositi di diatomee sul fondo dei mari e degli oceani: questi depositi si depositano con SiO 2, entrando nel magazzino di diatomee e altri ciliati.
Il silicio Vilniy può essere utilizzato per arrostire con pisku bianco croccante al magnesio, che per un magazzino chimico può essere pulito con ossido di silicio SiO 2 + 2Mg = 2MgO + Si. Nell'industria, la purezza tecnica del silicio si ottiene fondendo SiO 2 con coke ad una temperatura di circa 1800 ° C in forni ad arco. La purezza del silicio ottenuta da un tale rango può raggiungere il 99,9% (le case principali sono carbone, metallo).
Poteri fisici:
Il silicio amorfo può sembrare una polvere marrone, il cui spessore è più denso di 2,0 g / cm 3. Silicio cristallino - discorso cristallino grigio scuro, scintillante, cristallizzato e duro, si cristallizza in diamanti. Questo è un conduttore tipico (è meglio condurre elettricità, gomma di tipo isolante inferiore e superiore per un conduttore - medio). Il crepitio del silicio, solo se riscaldato a 800°C, diventa discorso plastico. Cіkavo, scho prosorium siliceo a infrachervony viprominyuvannya, che inizia con un vento lungo 1,1 micron.
Potere chimico:
Chimicamente silicio poco attivo. A temperatura ambiente, reagisce solo con il fluoro gassoso, il tetrafluoruro di silicio volatile SiF 4 si dissolve a questa temperatura. Se riscaldato a una temperatura di 400-500 ° C, il silicio reagisce con l'acido con biossido disciolto, con cloro, bromo e iodio - con tetraalogenuri facilmente volatili disciolti SiHal 4 . A temperature vicine a 1000 ° C, il silicio reagisce con l'azoto per dissolvere il nitruro Si 3 N 4 con boro - boruro termicamente e chimicamente stabile SiB 3, SiB 6 e SiB 12. Con il silicio acquoso, non reagisce senza intoppi.
Per l'attacco con silicio, la somma degli acidi fluoridrico e nitrico è la più utilizzata.
Sistemati sui prati.
Il silicio è caratterizzato da una fase di ossidazione di +4 o -4.
I campi più importanti:
Biossido di silicio, SiO2- (Anidride di silicio) ...
...
Acidi silicici- debole, indistinto, utvoryuyuyutsya quando si aggiunge acido alla dimensione del silicato sembra un gel (discorso simile alla gelatina). È noto che H 4 SiO 4 (orto-silicio) e H 2 SiO 3 (meta-silicio o silicio) variano e si convertono irrevocabilmente in SiO 2 solo quando riscaldati ed essiccati. Prodotto solido poroso per entrare - gel di silice può essere aperto in superficie e vigoroso come adsorbente di gas, agente essiccante, catalizzatore e catalizzatore di usura.
silicato- i sali degli acidi silicici del bene (crym silicati di sodio e potassio) non sono solubili in acqua. energia.
Cascate- analoghi dei carboidrati, silani, a malincuore, in alcuni atomi di silicio con un solo legame, forza yakscho atom silicon z'єdnаnі podvіyny zv'yazkom. Lance e kiltsya sono usati in modo simile ai carboidrati. Tutti i poteri possono essere impiegati autonomamente, creare vibrazioni di sumish con la ripetizione e reagire facilmente con l'acqua.
Zastosuvannya:
La quantità più significativa di silicio è nota per la selezione delle leghe per l'applicazione di alluminio, rame e magnesio e per la selezione dei ferosiliciuri, che possono essere importanti per la selezione degli acciai e delle apparecchiature di riscaldamento. Cristalli di silicio zastosovuyut batterie Sony e napіvprovіdnikovih annessi - transistor e diodi. Il silicio funge anche da syrovina per la produzione di lastre di organosilicio, o silossani, macchianti con olio, olio, plastica e gomme sintetiche. Lumache inorganiche il silicio vicorista è utilizzato nella tecnologia della ceramica e dell'acciaio, come materiale isolante e p'ezocrystals
Per alcuni organismi, il silicio è un importante elemento biogenico. Entra nel magazzino delle capanne di supporto al roslin e scheletrico - alle creature. Gli organismi marini – diatomee, alghe, radiolari, spugne – sono concentrati in vaste aree di silicio. Grandi numeri equiseti e cereali si concentrano con silicio, nel primo nero - pidrodins simili a bambù e riso, tra cui - piantare riso. M'yazova tessuto di una persona per vendetta (1-2) 10 -2% silicio, tessuto osseo - 17 10 -4%, sangue - 3,9 mg / l. Tuttavia, fino a 1 g di silicio può essere ingerito oggi nel corpo di una persona.
Antonov S.M., Tomilin K.G.
HF Tyumen State University, gruppo 571.
