Proprietà fisiche di sio2. Composti di ossigeno Silicio (II) SiO
Ossido di silicio (II) SiO. In natura, non si verifica, ma può essere ottenuto dalla reazione:
SiO 2 + Si → 2 SiO.
Sotto pressione normale, la sublimazione del monossido di silicio inizia a circa 1200 ° C (quando i materiali di partenza stessi praticamente non evaporano ancora). In coppia, SiO è un composto individuale. L'energia di dissociazione degli elementi è 789 kJ / mol. La conversione a stato solido può essere ottenuta solo mediante raffreddamento rapido ("spegnimento") della fase gas. Altrimenti, lo smantellamento dell'equazione ha il tempo di passare:
2 SiO = SiO 2 + Si.
Il monossido di silicio viene lentamente ossidato dall'ossigeno atmosferico e si dissolve facilmente in alcali per formare sali di acido silicico e rilascio di idrogeno. E 'facilmente elettrificato dall'attrito, acquisendo una forte carica negativa.
Ossido di silicio (IV) SiO 2.L'ossido di silicio (IV) è anche chiamato silice. È una sostanza refrattaria solida. (punto di fusione 1700 ° C)diffuso in natura in due forme: 1) silice cristallina - sotto forma di un minerale di quarzo e sue varietà (cristallo di rocca, calcedonio, agata, diaspro, pietra focaia); il quarzo costituisce la base delle sabbie di quarzo ampiamente utilizzate nella costruzione e industria dei silicati; 2) silice amorfa - sotto forma di una composizione opale minerale SiO 2 nH 2 O; le forme terrene di silice amorfa sono diatomite, tripoli (terra infusoriale); Un esempio di silice amorfa artificiale amorfa è il gel di silice, che è ottenuto dal metasilicato di sodio:
Il gel di silice ha una superficie sviluppata e quindi assorbe bene l'umidità.
Al 1710 ° il quarzo si scioglie. Con il rapido raffreddamento della massa fusa, si forma il vetro di quarzo. Ha un coefficiente di espansione molto basso, quindi il vetro al quarzo caldo non si incrina quando l'acqua viene rapidamente raffreddata. Vetreria da laboratorio e strumenti per la ricerca scientifica sono realizzati in vetro di quarzo.
La struttura di SiO 2 in un'immagine planare può essere rappresentata come segue:
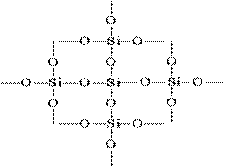
Ogni atomo di silicio è racchiuso in un tetraedro di 4 atomi di ossigeno. In questo caso, l'atomo di silicio si trova al centro e gli atomi di ossigeno si trovano ai vertici del tetraedro. L'intero pezzo di silice può essere considerato un cristallo la cui formula è (SiO 2) n. Una tale struttura di ossido di silicio (IV) determina la sua elevata durezza e refrattarietà.
su proprietà chimiche ossido di silicio (IV) SiO 2 si riferisce agli ossidi acidi. Quando si fondono con alcali solidi, ossidi basici e carbonati, si formano sali di acido silicico:
Solo l'acido fluoridrico interagisce con l'ossido di silicio (IV) (attacco di vetro):
SiO 2 + HF → SiF 4 + H 2 O
L'ossido di silicio (IV) non si dissolve in acqua e non interagisce chimicamente con esso. Pertanto, l'acido silicico è ottenuto indirettamente, ad esempio, per idrolisi:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 acido ortosiliconico.
H 4 SiO 4 è solubile, quando riscaldato o in piedi, è in corso un processo di polimerizzazione:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 acido diorthokremnievy.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 acido tetraorotremilicico.
Lei chiude l'anello:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 acido tetrametaclicico.
In questo caso, l'acido silicico (a seconda della concentrazione delle soluzioni iniziali di sale e acido) può essere ottenuto sia sotto forma di una massa gelatinosa contenente acqua, sia sotto forma di una soluzione colloidale (sol). La composizione dell'acido silicico ottenuto dipende dai materiali di partenza e dalle condizioni di preparazione. Tutti gli acidi silicici sono molto deboli (più deboli del carbone).
Se l'acido carbonico in una soluzione rilascia acido silicico dai suoi sali, allora la reazione inversa si verifica durante la calcinazione. Il primo è dovuto alla minore forza (grado di dissociazione) dell'acido silicico, il secondo - la sua minore volatilità quando riscaldato.
Quando si riscaldano acidi polisilici e la loro graduale disidratazione si può ottenere un SiO 2 fine, che viene chiamato gel di silice . Assorbe bene l'acqua, la posiziono nei dispositivi per prevenire l'ossidazione di elementi costosi.
Sottogruppo Germania
Ge (+4) Sn (+2, +4) Pb(+2) - stati di ossidazione resistenti
Il germanio fu predetto da DI Mendeleev nel 1871 e scoperto nel 1886. Lo stagno e il piombo appartengono agli elementi che erano più noti all'umanità da molto tempo: gli egiziani furono in grado di annusarli dai minerali più di 3000 anni prima di Cristo. e. In India, il piombo divenne noto per circa 2500 anni e si conservò 1500 anni prima di Cristo. e. Latta di fusione prodotta nell'antica Cina.
Ottenere.I composti naturali del germanio vengono convertiti in GeO 2 e ridotti con idrogeno:
GeO 2 + H 2 t → Ge + H 2 O a temperature di circa 1000 ° C.
Lo stagno è ottenuto da minerali naturali cassiterite(SnO 2):
SnO 2 + C → Sn + CO.
Lo schema più semplice per la riduzione del piombo industriale si basa su due reazioni successive:
PbS + O 2 → SO 2 + PbO galena(PbS) viene bruciato e quindi ridotto con carbone:
PbO + С → СO + Pb.
Applicazione.Tutti e tre gli elementi sono molto importanti per la tecnologia moderna. Alcuni composti di stagno e piombo sono anche di uso considerevole. I derivati di piombo sono altamente tossici.
Il germanio è un tipico semiconduttore (tipo n con larghezza di banda passante di 0,75 eV) e trova vari usi nell'ingegneria elettrica. È il più usato per la produzione di raddrizzatori AC.. Questa applicazione si basa sulla conduttività unipolare derivante dal contatto tra germanio puro e lega di germanio con indio. La corrente (flusso di elettroni) passa in tale installazione praticamente solo dal germanio alla lega, ma non viceversa. I raddrizzatori al germanio sono caratterizzati da un coefficiente estremamente elevato (circa il 98%) effetto benefico e una vita di servizio molto lunga (se usata correttamente). Il principale svantaggio di tali raddrizzatori è la loro sensibilità al riscaldamento - superiore a 70 ° C, la loro efficienza diminuisce rapidamente.
Area di utilizzo importante la Germania è un'ottica a infrarossi, poiché i raggi con una lunghezza d'onda superiore a 2 micron, praticamente non ritarda. Al contrario, nella luce e vicino ad esso varia (0,2 ± 2 micron), il germanio assorbe intensivamente l'energia. Se una superficie metallica lucida (che immagazzina bene il calore, ma non si scalda bene) è coperta con pellicola di germanio, quindi la superficie si riscalda molto più che senza un film. È stato riferito che in un barile preparato in questo modo sotto l'azione della luce solare, si può ottenere acqua bollente.
Lo stagno è utilizzato principalmente per la stagnatura del ferro al fine di proteggerlo dalla ruggine. (banda stagnata per l'industria conserviera). Lo spessore di tali rivestimenti di stagno è molto piccolo - dell'ordine di micron. Sotto forma di fogli sottili (i cosiddetti Stannioles) si consuma stagno per la produzione di condensatori nell'industria elettrica . Il piombo viene utilizzato per la produzione di piastre per batterie, piastre di cavi elettrici, proiettili e pallini, per proteggersi dai raggi X e dai raggi g, nonché dall'industria chimica (condotte, ecc.). Molto grandi quantità stagno e piombo sono spesi per la produzione di una serie di leghe tecnicamente importanti.
Il più importante di essi sono vari bronzi (leghe di rame e di rame), leghe per cuscinetti (babbit, solitamente realizzati sulla base di Pb o Sn e contenenti anche Sb e Cu), leghe tipografiche (5-30% Sn, 10-20% Sb, il resto è Pb) e la solita saldatura "soft" (30-70% Sn, 70-30% Pb). Spesso può essere sostituito da una lega più economica di 90% Pb, 6% Sn, 4% Sb. Di grande importanza sono le leghe per cuscinetti con una composizione approssimativa di 98% Pb, 1% Ca, 1% Na.
La silice (silice, silice) è una sostanza costituita da cristalli incolori con elevata resistenza, durezza e refrattarietà. Il biossido di silicio è resistente agli acidi e non interagisce con l'acqua. Con un aumento della temperatura di reazione, la sostanza interagisce con gli alcali, si dissolve in acido fluoridrico, è un eccellente dielettrico.
In natura, il biossido di silicio è ampiamente distribuito: l'ossido di silicio cristallino è rappresentato da minerali come diaspro, agata (composti di biossido di silicio cristallino), cristallo di rocca (grandi cristalli di materia), quarzo (diossido di silicio libero), calcedonio, ametista, morione, topazio (cristalli colorati silice).
In condizioni normali (a temperatura ambiente e pressione naturali), ci sono tre modifiche cristalline di biossido di silicio - tridimite, quarzo e cristobalite. Quando la temperatura aumenta, il diossido di silicio si trasforma prima in coesite e poi in stishovite (un minerale trovato nel 1962 in un cratere di meteoriti). Secondo gli studi, è lo stishovit, un derivato del biossido di silicio, che forma una grande parte del mantello terrestre.
La formula chimica della sostanza - SiO 2
Preparazione di silice
Il biossido di silicio viene prodotto industrialmente da piante di quarzo che producono concentrato di quarzo puro, che viene poi utilizzato nell'industria chimica ed elettronica, nella produzione di ottiche, riempitivi in gomma e vernice, vernici, ecc. Il biossido di silicio naturale, altrimenti chiamato silice, è ampiamente usato nella costruzione (cemento, sabbia, materiali fonoassorbenti e termoisolanti).
La sintesi del biossido di silicio mediante un metodo sintetico viene effettuata mediante l'azione degli acidi sul silicato di sodio, in alcuni casi su altri silicati solubili o con il metodo di coagulazione della silice colloidale sotto l'influenza di ioni. Inoltre, il biossido di silicio viene prodotto dall'ossidazione del silicio con l'ossigeno a una temperatura di circa 500 gradi Celsius.
Applicazione di biossido di silicio
I materiali contenenti silicio sono ampiamente usati sia nel campo delle alte tecnologie che nella vita di tutti i giorni. Il biossido di silicio viene utilizzato nella produzione di vetro, ceramica, prodotti in calcestruzzo, materiali abrasivi, nonché nella radiotecnica, nelle installazioni a ultrasuoni, negli accendini, ecc. In combinazione con un numero di ingredienti, la silice viene utilizzata nella produzione di cavi in fibra ottica.
Il biossido di silicio amorfo non poroso è utilizzato anche nell'industria alimentare come additivo, registrato con il numero E551, che impedisce l'aggregazione e l'agglomerazione del prodotto principale. biossido  il silicio alimentare viene utilizzato nell'industria farmaceutica come sostanza enterosorbente, nella produzione di dentifrici. La sostanza si trova in chip, cracker, bastoncini di mais, caffè istantaneo, ecc.
il silicio alimentare viene utilizzato nell'industria farmaceutica come sostanza enterosorbente, nella produzione di dentifrici. La sostanza si trova in chip, cracker, bastoncini di mais, caffè istantaneo, ecc.
Silica Harm
Ufficialmente confermato che la sostanza del biossido di silicio passa attraverso il tratto gastrointestinale invariato, dopo di che viene completamente rimosso dal corpo. Secondo uno studio di 15 anni condotto da esperti francesi, bere acqua potabile ad alto contenuto di allumina riduce il rischio di sviluppare il morbo di Alzheimer del 10%.
Pertanto, l'informazione sui pericoli del diossido di silicio, che è una sostanza chimicamente inerte, è falsa: l'integratore alimentare E551, ingerito per via orale, è completamente sicuro per la salute.
L'ossido di silicio SiO 2 è una sostanza solida molto refrattaria (punto di fusione superiore a 1700 ° C), ampiamente distribuita in natura, dove si trova principalmente nella forma del minerale di quarzo, nonché in cristobalite e tridimite.
A temperature usuali, il quarzo è una modifica stabile, con le trasformazioni polimorfiche a temperatura crescente osservate:
La silice di tutte le modifiche nella forma di un monomero non esiste; è sempre polimerico e "costruito" di tetraedri che formano un reticolo atomico molto forte
Ogni atomo di silicio in (SiO 2) n cristalli è tetraedrico circondato da quattro atomi di ossigeno, ciascuno dei quali è a ponte. Attraverso un comune atomo di ossigeno, i tetraedri ad angoli diversi si legano l'un l'altro, formando un reticolo tridimensionale continuo; la disposizione reciproca dei tetraedri nello spazio determina l'una o l'altra modifica della silice.
In diverse modifiche della resistenza del legame di silice varia. Ciò influenza la grandezza degli angoli Si-O-Si e le distanze Si-O, ad esempio, l'angolo di legame Si-O-Si in varie modifiche di silice varia da 120 a 180 °. Le transizioni quarzo-tridimite-cristobalite sono accompagnate da rottura e trasformazione dei legami, che possono verificarsi solo a temperature elevate.
Quartz. Spesso trovato in natura sotto forma di cristalli estremamente ben formati, a volte di dimensioni considerevoli. I cristalli sono formati da tetraedri disposti a spirale attorno all'asse centrale, a forma di spirale. Nello stesso cristallo, la direzione dell'elica potrebbe essere opposta. Tali cristalli sono isomeri ottici. Ruotano il piano di polarizzazione della luce e possono essere sia destrorsi che mancini. Quelli e altri cristalli differiscono come soggetto dalla loro immagine speculare.
Il quarzo viene utilizzato in vari campi della scienza e della tecnologia, ei suoi cristalli sono spesso coltivati artificialmente. Alcuni tipi di quarzo hanno nomi speciali. I cristalli trasparenti incolori sono chiamati cristalli di rocca. Ci sono anche varietà colorate di quarzo: quarzo rosa, viola (ametista), marrone scuro (topazio fumoso), verde (crisoprasio), ecc. La modificazione cristallina del quarzo con additivi di altre sostanze è chiamata calcedonio. Le varietà di calcedonio sono l'agata, il diaspro e altri.Il cristallo di rocca e le varietà colorate di quarzo sono usati come pietre preziose e semipreziose.
La tridimite si presenta nelle rocce vulcaniche, ma in quantità molto piccole. Tridimite nota e origine meteoritica.
La natura Cristobalite si trova talvolta sotto forma di piccoli cristalli incastonati nella lava, come la tridimite. Tridimite e cristobalite hanno una struttura più "sciolta" rispetto al quarzo. Quindi, la densità di cristobalite, tridimite e quarzo è 2,32; 2,26 e 2,65 g / cm 3, rispettivamente.
La fusione di silice con raffreddamento lento forma facilmente vetro amorfo di quarzo. La silice sotto forma di vetro si trova anche in natura. La densità del vetro amorfo è di 2,20 g / cm 3 - inferiore a quella di tutte le modifiche cristalline. Il vetro al quarzo ha un leggero coefficiente di dilatazione della temperatura, pertanto viene utilizzato per preparare vetreria da laboratorio resistente agli sbalzi di temperatura.
Tutte le modificazioni della silice in acqua sono praticamente insolubili (a una temperatura di 25 ° C, la solubilità del quarzo è 7, cristobalite - 12, tridimite - 16, vetro al quarzo - 83 mg / l). Pertanto, in condizioni normali, solo le soluzioni alcaline e l'acido fluoridrico agiscono su di esse:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O. (2)
Quest'ultima reazione è utilizzata nella "incisione" del vetro.
La silice aggiunta reagisce con ossidi basici, alcali (reazione (1)) e carbonati per formare silicati:
SiO 2 + CaO = СaSiO 3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2. (4)
Le reazioni (3) e (4) sono alla base della produzione industriale di vari vetri e del cemento. Pertanto, la composizione del vetro ordinario (ad esempio, finestra, per la fabbricazione di piatti) è espressa dalla formula Na 2 O. CaO. 6SiO 2. Tale vetro è prodotto fondendo una miscela di soda, sabbia e calcare. Il processo viene eseguito ad una temperatura di ~ 1400 ° C fino alla completa rimozione dei gas:
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O. CaO. 6SiO 2 + 2CO 2.
Per gradi speciali di vetro - refrattari, "infrangibili" - quando si cucina, aggiungere ossidi di bario, piombo, boro. Per ottenere vetri colorati vengono anche introdotti vari additivi, ad esempio l'aggiunta di ossido di cobalto Co 2 O 3 dà un colore blu, ossido di cromo Cr 2 O 3 - verde, diossido di manganese MnO 2 - rosa.
L'ossido di SiO 2 è un'anidride di un numero di acidi silici, la cui composizione può essere espressa dalla formula generale xSiO 2 ∙ yH 2 O, dove xey sono numeri interi: 1) x = 1, y = 1: SiO 2. H 2 Oh, ad es. H 2 SiO 3 - acido meta-silicio; 1) x = 1, y = 2: SiO 2. 2H 2 O, cioè acido ortosilicico; 1) x = 2, y = 1: 2SiO 2. H 2 Oh, ad es. H 2 Si 2 O 5 - acido silicico bimeta.
Gli acidi le cui molecole contengono più di una molecola di SiO 2 appartengono al polisilicio.
Il più semplice degli acidi silicici è H 2 SiO 3, che viene spesso chiamato semplicemente silicio, e i suoi sali sono silicati. Di silicati, solo i silicati di sodio e di potassio sono solubili in acqua, i silicati rimanenti sono sostanze refrattarie e insolubili in acqua.
Le soluzioni di silicati crescono torbide quando ci si trova in aria, poiché la CO 2 in essa contenuta allontana l'acido silicico dai suoi sali (H 2 SiO 3 è più debole dell'acido carbonico, la costante di dissociazione di H 2 SiO 3 nel primo stadio è K 1 = 2,2. ).
H 2 SiO 3 è praticamente insolubile in acqua - questa proprietà viene utilizzata come reazione qualitativa per il rilevamento di ioni di silicato:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
I silicati si ottengono fondendo SiO 2 con alcali o carbonati.
Le soluzioni concentrate di silicati di sodio e di potassio si chiamano vetro liquido, hanno una reazione fortemente alcalina a causa del fatto che sono altamente idrolizzate:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Il vetro liquido viene utilizzato, ad esempio, per la produzione di colla, tessuti impermeabili.
Il cemento è molto usato nella costruzione come legante, che quando viene mescolato con l'acqua si indurisce. Di solito, il cemento viene prodotto in grandi forni rotanti dove vari silicati vengono tostati e macinati (a una temperatura di -1000 ° C).
Esistono diversi tipi di cemento, tuttavia è possibile condizionare in modo distinto due tipi di cemento secondo il principio del loro "laminazione": cemento ordinario e cemento Portland. Il processo di "fissazione" di cemento convenzionale costituito da silicato di calcio, si verifica a causa della formazione di carbonato di calcio a causa dell'anidride carbonica nell'aria:
Cao. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Quando si imposta il cemento Portland, il biossido di carbonio non è coinvolto nel processo e l'idrolisi dei silicati si verifica con la successiva formazione di idrati cristallini insolubili:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Carburi e siliciuri
· Composti di carbonio e silicio con metalli - carburi e siliciuri, oltre alle reazioni considerate, sono ottenuti anche dall'interazione del silicio con idruri metallici, ad esempio:
· 2CaH 2 + Si = Ca 2 Si + 2H 2.
· Tutte queste reazioni hanno luogo a temperature elevate. Tra i carburi emettono i cosiddetti "metanidi" e "acetilene". I primi sono considerati come derivati del metano contenenti carbonio in stato di ossidazione -4 (Be 2 C, Al 4 C 3), il secondo - come derivati dell'acetilene con un grado di ossidazione del carbonio -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2 , CAC 2). Acetilidi di argento e rame (I) possono essere facilmente ottenuti facendo passare acetilene attraverso una soluzione di ammoniaca di ossido di argento o rame (I) cloruro. La maggior parte dei metanidi e degli acetilidi reagiscono attivamente con l'acqua (soprattutto con gli acidi), rilasciando i corrispondenti idrocarburi:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag 2 C 2 + 2HCl = 2AgCl ↓ + C 2 H 2.
· A differenza dei carburi, solo i siliciuri di metalli alcalini o alcalino-terrosi interagiscono con l'acqua e gli acidi, producendo il più semplice silano monosilano composto da idrogeno, che viene spesso chiamato semplicemente silano SiN 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4.
· Il silano è un gas incolore che ha l'odore della muffa, infiammabile spontaneamente nell'aria, che brucia al SiO 2 e all'acqua:
· SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· Gli alcali si decompongono molto facilmente a causa dell'equazione:
· SiH 4 + 2 KON + H 2 O = K 2 SiO 3 + 4H 2,
· L'acqua idrolizza anche il silano, ma molto più lentamente:
· SiH 4 + 2H 2 O = SiO 2 + 4H 2.
· Se riscaldato sopra i 400 ° C senza accesso all'aria, il silano si decompone in silicio e idrogeno (uno dei metodi per produrre silicio):
· SiH 4 = Si + 2H 2.
· Oltre al monosilano, sono noti anche Si 2 H 6 disilano, Si 3 H 8 di trisilano, Si 4 H 10 di tetrasilano, ecc. Nello stato individuale, i composti sono stati isolati solo fino a Si 6 H 14 inclusi. Tutti questi composti appartengono alla serie omogenea di silani, a cui corrisponde la formula generale Si n H 2 n + 2. Come gli alcani, i silani sono incolori, i primi membri delle serie omologhe sono gassosi in condizioni normali, i seguenti sono liquidi. L'attività chimica dei silani e degli idrocarburi è diversa: in contrasto con gli alcani sufficientemente inerti, il silano tutto reattivo. Ciò è dovuto all'affinità del silicio inferiore per l'idrogeno rispetto al carbonio e l'altissima affinità del silicio per l'ossigeno. Inoltre, i legami Si-Si sono meno durevoli di connessione C-C. A differenza della comunicazione С-Н comunicazione Si-H ha un carattere più ionico.
· L'energia dei legami Si-E e CE.
· La bassa resistenza del legame Si-Si è dovuta al limite dell'omonima serie di silani.
· Tra carburi e siliciuri, un posto speciale è occupato dal carborundum SiC, che può essere chiamato sia carburo di silicio che siliciuro di carbonio. Il carborundum ha un alto punto di fusione grazie alla sua struttura a forma di diamante; la sua durezza è vicina a quella del diamante. Chimicamente, il SiC è molto stabile.
· Il concetto di soluzioni colloidali
In natura e tecnologia, si trovano spesso sistemi dispersi in cui una sostanza è uniformemente distribuita come particelle all'interno di un'altra sostanza.
Nei sistemi dispersi, c'è una fase dispersa - una sostanza finemente suddivisa e un mezzo di dispersione - una sostanza omogenea in cui è distribuita la fase dispersa. I sistemi dispersi comprendono soluzioni (vere) ordinarie, soluzioni colloidali, nonché sospensioni ed emulsioni. Essi differiscono l'uno dall'altro principalmente nelle dimensioni delle particelle, cioè il grado di dispersione (frammentazione).
I sistemi con una dimensione delle particelle inferiore a 1 nm sono vere soluzioni composte da molecole di soluto o ioni. Dovrebbero essere considerati come un sistema monofase. I sistemi con dimensioni delle particelle superiori a 100 nm sono sistemi a dispersione grossolana - sospensioni ed emulsioni.
Le sospensioni sono sistemi dispersi in cui la fase dispersa è un solido e il mezzo di dispersione è un liquido e il solido è praticamente insolubile nel liquido.
Le emulsioni sono sistemi dispersi in cui sia la fase dispersa che il mezzo di dispersione sono liquidi che non sono reciprocamente miscibili. Un esempio di un'emulsione è il latte, in cui piccole sfere di grasso galleggiano in un liquido.
Le sospensioni e le emulsioni sono sistemi bifasici.
Le soluzioni colloidali sono sistemi bifasici ad alta dispersione costituiti da un mezzo di dispersione e una fase dispersa, e le dimensioni lineari delle particelle di quest'ultimo si trovano nell'intervallo da 1 a 100 nm. Come si può vedere, le soluzioni colloidali per dimensione delle particelle sono intermedie tra soluzioni vere e sospensioni ed emulsioni. Le particelle colloidali di solito consistono in un gran numero di molecole o ioni.
Le soluzioni colloidali sono anche chiamate sol. Sono ottenuti per dispersione e metodi di condensazione. La dispersione viene spesso eseguita utilizzando speciali "mulini colloidali". Nel metodo di condensazione, le particelle colloidali si formano combinando atomi o molecole in aggregati. Nel corso di molte reazioni chimiche, si verifica la condensazione e si formano sistemi altamente dispersi (precipitazione, idrolisi, reazioni di riduzione dell'ossidazione, ecc.).
1 nm - nanometro (1 nm = 10 -9 m).
In contrasto con le soluzioni vere, i sind sono caratterizzati dall'effetto Tyndall, cioè dalla dispersione della luce da parte delle particelle colloidali. Quando un cono di luce appare attraverso un raggio di luce, appare in una stanza buia. 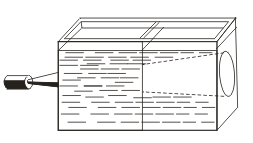 . Quindi puoi riconoscere se questa soluzione è colloidale o vera.
. Quindi puoi riconoscere se questa soluzione è colloidale o vera.
Una delle proprietà importanti dei sol è che le loro particelle hanno cariche elettriche dello stesso segno. A causa di ciò, non si fondono in particelle più grandi e non precipitano. Allo stesso tempo, le particelle di alcuni sol, per esempio metalli, solfuri, silici e acidi di stagno, hanno una carica negativa, mentre altre, ad esempio idrossidi, ossidi metallici, hanno una carica positiva. L'aspetto di una carica è spiegato dall'adsorbimento di ioni dalla soluzione mediante particelle colloidali.
Per precipitare un sol, è necessario che le sue particelle si fondano in aggregati più grandi. La combinazione di particelle in aggregati più grandi si chiama coagulazione e la loro sedimentazione sotto l'influenza della gravità è chiamata sedimentazione.
Di solito si verifica la coagulazione quando si aggiunge ai sol: 1) elettrolita, 2) un altro sol di cui le particelle hanno una carica opposta e 3) quando riscaldato.
