Formula chimica dell'acido solforico. Acido solforico: proprietà chimiche, preparazione
H2SO3, acido dibasico debole. In una forma libera non è assegnato, esiste in soluzioni acquose. Solfiti di acido solforico ... Grande dizionario enciclopedico
Acido solforico - (H2SO3) acido dibasico debole. Esiste solo in soluzioni acquose. Sali S. a. Solfiti. Applicato nella carta e nell'industria alimentare. Vedi anche Acidi e anidridi ... Enciclopedia russa sulla protezione del lavoro
acido solforico - - [A.S. Goldberg. Dizionario energetico russo inglese. 2006] Argomenti di energia in generale EN acido solforoso ... Guida del traduttore tecnico
H2SO3, acido dibasico debole. In una forma libera non è assegnato, esiste in soluzioni acquose. Solfiti di acido solforico * * * Acido solforico, acido solforico, H2SO3, acido dibasico debole. Gratuito non è selezionato, ... ... Dizionario enciclopedico
acido solforico - sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: angl. acido solforoso rus. acido solforico ryšiai: sinonimas - vandenilio trioksosulfatas (2-) ... Chemijos terminų aiškinamasis žodynas
H2SO3, acido dibasico debole, corrispondente al grado di ossidazione dello zolfo +4. Conosciuto solo in soluzioni acquose diluite. Le costanti di dissociazione: K1 = 1,6 · 10 2, K2 = 1,0 · 10 7 (18 ° C). Dà due file di sali: solfiti normali e acidi ... ... Grande Enciclopedia Sovietica
H2SO3, acido dibasico debole. Nella forma libera non è evidenziato, esiste nelle acque. p rah. Sali S. k. Solfiti ... Scienze naturali Dizionario enciclopedico
Vedi lo zolfo ... Dizionario enciclopedico di FA Brockhaus e I.A. Efron
Il diossido di zolfo (diossido) si forma bruciando zolfo in aria o ossigeno. Si ottiene anche calcinando nell'aria ("brucia") solfuri di metalli, ad esempio pirite di ferro:
Secondo questa reazione, l'anidride solforosa viene solitamente ottenuta nell'industria (per altri metodi industriali di ottenere cm, 9 § 131).
L'anidride solforosa è un gas incolore ("diossido di zolfo") con un briciolo di zolfo caldo. Si condensa abbastanza facilmente in un liquido incolore che bolle. Quando il liquido evapora, c'è una forte diminuzione della temperatura (prima).
Il diossido di zolfo è altamente solubile in acqua (circa 40 volumi in 1 volume di acqua a); allo stesso tempo, la reazione con acqua avviene parzialmente e si forma acido solforoso:
Pertanto, il biossido di zolfo è l'anidride dell'acido solforico. Quando riscaldato, la solubilità diminuisce e l'equilibrio si sposta a sinistra; gradualmente tutto il diossido di zolfo viene rilasciato nuovamente dalla soluzione.
La molecola è costruita in modo simile alla molecola di ozono. I nuclei dei suoi atomi costituenti formano un triangolo isoscele:
Qui, l'atomo di zolfo, come l'atomo di ossigeno centrale nella molecola dell'ozono, si trova nello stato di ibridazione α e l'angolo è vicino. Orientato perpendicolarmente al piano della molecola, l'orbitale dell'atomo di zolfo non partecipa all'ibridazione. A causa di questi orbitali e, in modo simile orientato, orbitali di atomi di ossigeno, si forma un legame a tre centri; la coppia di elettroni che la trasporta appartiene a tutti e tre gli atomi della molecola.
L'anidride solforosa viene utilizzata per produrre acido solforico e anche (in quantità molto minori) per lo sbiancamento di paglia, lana, seta e come disinfettante (per la distruzione di funghi muffa in scantinati, cantine, botti di vino, serbatoi di fermentazione).
L'acido solforico è un composto molto fragile. È noto solo in soluzioni acquose. Quando cerca di isolare l'acido solforoso, si disintegra in acqua. Ad esempio, quando l'acido solforico concentrato agisce sul solfito di sodio, viene rilasciato biossido di zolfo anziché acido solforoso:
La soluzione di acido solforico deve essere protetta dall'aria, altrimenti, assorbendo ossigeno dall'aria, si ossida lentamente in acido solforico:
L'acido solforico è un buon agente riducente. Ad esempio, gli alogeni liberi vengono ripristinati da esso agli alogenuri di idrogeno:
![]()
Tuttavia, quando interagiscono con forti agenti riducenti, l'acido solforico può svolgere il ruolo di un agente ossidante. Quindi, la sua reazione con l'idrogeno solforato procede principalmente secondo l'equazione:
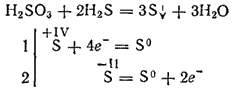
Essendo dibasico, l'acido solforoso forma due file di sali. I suoi sali medi sono chiamati solfiti, sali acidi - idrosolfiti.
Come acido, solfiti e idrosolfiti sono agenti riducenti. Quando sono ossidati, si ottengono sali di acido solforico.
I solfiti dei metalli più attivi durante la calcinazione si decompongono con la formazione di solfuri e solfati (reazione di auto-ossidazione - auto-riduzione):
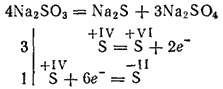
Solfiti di potassio e sodio sono utilizzati per sbiancare alcuni materiali nell'industria tessile per la tintura di tessuti, in fotografia. La soluzione (questo sale esiste solo in soluzione) viene utilizzata per lavorare il legno nella cosiddetta pasta di solfito, da cui si ottiene la carta.
L'acido solforoso è in grado di reagire con l'ossigeno. Questo forma l'acido solforico. Questa reazione richiede molto tempo ed è possibile solo se vengono violate le regole di archiviazione. L'acido solforico ha proprietà sia ossidanti che riducenti. Con il suo aiuto puoi ottenere gli acidi alogeni. Una soluzione acquosa reagendo con il cloro forma acido cloridrico e solforico.
Quando reagisce con agenti riducenti forti, l'acido solforoso svolge il ruolo di un agente ossidante. Una di queste sostanze è l'idrogeno solforato, un gas con un odore molto sgradevole. Interagendo con una soluzione acquosa di acido solforico, forma zolfo e acqua. I sali dell'acido solforico hanno anche proprietà riducenti. Sono suddivisi in solfiti e idrosolfiti. Le reazioni di ossidazione di questi sali producono acido solforico.
Produzione di acido solforico
L'acido solforico è formato solo dall'interazione di anidride solforosa e acqua. Hai bisogno di procurarti gas acido. Questo può essere fatto con rame e acido solforico. Versare delicatamente l'acido solforico concentrato nel tubo e gettare un pezzo di rame in esso. Riscaldare il tubo con una lampada ad alcool.
Come risultato del riscaldamento, si formano solfato di rame (solfato di rame), acqua e anidride solforosa, che con l'aiuto di un tubo speciale devono essere portati al cono acqua limpida. In questo modo si può ottenere acido solforico.
Ricorda che il biossido di zolfo è dannoso per l'uomo. Provoca danni alle vie aeree, perdita di appetito e mal di testa. L'inalazione prolungata può causare lo svenimento. Quando si lavora con lui è necessario essere prudenti.
Uso di acido solforico
L'acido solforico ha proprietà antisettiche. È usato nella disinfezione delle superfici, nella fermentazione del grano. Può essere usato per sbiancare alcune sostanze che si decompongono quando reagiscono con forti ossidanti (ad esempio il cloro). Tali sostanze includono lana, seta, carta e alcune altre. Le sue proprietà antibatteriche sono utilizzate per impedire la fermentazione del vino in barrique. Così, una bevanda nobile può essere conservata per un tempo molto lungo, acquisendo un gusto nobile e un aroma unico.
L'acido solforico è utilizzato nella produzione di carta. L'aggiunta di questo acido è inclusa nella tecnologia della produzione di pasta di solfito. Quindi viene trattato con una soluzione di idrosolfito di calcio per legare insieme le fibre.
