Serie genetiche di esempi non metallici. Relazione genetica tra classi di sostanze - Ipermercato della conoscenza
Esiste una connessione genetica tra sostanze semplici, ossidi, basi, acidi e sali, vale a dire la possibilità della loro transizione reciproca (trasformazione).
Ad esempio, una sostanza semplice - il calcio come risultato dell'interazione con l'ossigeno si trasforma in un ossido: 2Ca + O 2 = 2CaO.
L'ossido di calcio quando interagisce con l'acqua forma l'idrossido di calcio CaO + H 2 O = Ca (OH) 2, e quest'ultimo, quando interagisce con l'acido, si trasforma in un sale: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
Queste trasformazioni possono essere rappresentate dallo schema:
Ca → CaO → Ca (OH) 2 → CaSO 4
Uno schema simile può essere scritto per non-metallo, per esempio, zolfo:
S → SO 3 → H 2 SO 4 → CaSO 4
Quindi, lo stesso sale si ottiene in vari modi.
È anche possibile la transizione inversa dal sale ad altre classi di composti inorganici e sostanze semplici:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (riduzione del rame)
Una relazione simile tra classi di composti inorganici, basata sulla produzione di sostanze di una classe dalle sostanze di un'altra, è chiamata genetica.
Le proprietà dei composti complessi si riflettono nello schema genetico delle principali classi di composti inorganici (vedi figura). Riflette le fasi di sviluppo della materia inorganica lungo due linee principali, dai metalli tipici ai non metalli tipici con proprietà opposte.
Metalli la cui proprietà chimica di un atomo è la capacità di donare elettroni e non metalli, la principale proprietà chimica di questi è la capacità dei loro atomi di attaccare gli elettroni l'uno di fronte all'altro nelle proprietà. Con la complicazione della composizione delle sostanze, queste tendenze opposte continuano ad apparire.
I metalli tipici e gli elementi di transizione nello stato di ossidazione più basso formano gli ossidi di base, mentre i tipici non-metalli e gli elementi di transizione nell'alto stato di ossidazione formano gli ossidi di acido opposti.
Sostanze semplici
amphoteric
Metalloidi
Ossidi di base
amphoteric
acido
motivo
amphoteric
idrossidi
Schema genetico delle principali classi di composti inorganici
Con ulteriore complicazione della composizione delle sostanze, si formano idrossidi, gli ossidi di base corrispondenti alla base e gli ossidi acidi corrispondenti all'acido. Le basi opposte in proprietà e acido reagiscono attivamente tra loro, formando sali. L'interazione degli opposti è la forza trainante della reazione. Pertanto, ossidi, basi e acidi basici e acidi interagiscono attivamente tra loro e due ossidi acidi o due ossidi basici non interagiscono, poiché le loro proprietà sono vicine.
Pertanto, le proprietà di un composto complesso sono determinate in base alle proprietà dei suoi elementi costitutivi. Le principali leggi del cambiamento di queste proprietà sono riassunte nelle seguenti applicazioni (Tabella 6).
1. Nei periodi con un aumento del numero di sequenza, le proprietà degli elementi cambiano da metallico a non metallico. Il numero di elettroni a livello esterno aumenta, il grado di ossidazione dell'elemento aumenta, il raggio dell'atomo e la diminuzione di ioni, l'energia di ionizzazione e l'affinità per l'aumento di elettroni. In accordo con ciò, il basic diminuisce e aumentano le proprietà acide degli ossidi e degli idrossidi.
2. Nei sottogruppi principali, le proprietà di base degli ossidi e degli idrossidi aumentano all'aumentare del numero atomico. Per elementi di gruppi laterali con un aumento del numero di sequenza, è caratteristico un cambiamento più complesso nelle proprietà. Innanzitutto, le proprietà metalliche vengono migliorate e quindi ridotte.
3. I metalli attivi corrispondono agli ossidi e agli idrossidi con proprietà basiche fortemente pronunciate. I metalli più attivi sono alcali e alcalino-terrosi. Formano ossidi idrosolubili e basi solubili forti - alcali.
4. I metalli a bassa attività (tutti tranne alcalino e alcalino-terra) formano basi deboli che sono difficili da sciogliere in acqua:
Cu (OH) 2, Fe (OH) 3.
5. Gli ossidi e gli idrossidi con proprietà acide fortemente pronunciate corrispondono ai non metalli attivi.
6. I metalli anfoteri formano ossidi e idrossidi anfoteri.
7. Se un elemento presenta diversi gradi di ossidazione, gli ossidi e gli idrossidi con proprietà diverse corrispondono ad esso.
Argomento: CONNESSIONE GENETICA TRA metalli e non metalli e loro composti. 9 ° grado
Obiettivi: educativo: consolidare il concetto di "serie genetica", "connessione genetica"; insegnare come creare serie genetiche di elementi (metalli e non metalli), per costituire le equazioni di reazione corrispondenti alle serie genetiche; controlla come si impara la conoscenza proprietà chimiche ossidi, acidi, sali, basi; sviluppo: sviluppare la capacità di analizzare, confrontare, sintetizzare e trarre conclusioni, comporre le equazioni delle reazioni chimiche; educativo: promuovere la formazione di una visione scientifica del mondo.
Fornire classi: tabelle "Sistema periodico", "Tabella di solubilità", "Serie di attività sui metalli", istruzioni per gli studenti, compiti per testare le conoscenze.
Progresso: 1) Org. il momento
2) Controllare d / s
3) Studia nuovo materiale
4) Fissaggio
5) D / C
1) Org. il momento. Benvenuti.
2) Controllare d / s.
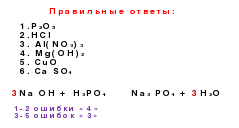
Le connessioni genetiche sono connessioni tra classi diverse in base alle loro interconversioni.
Conoscendo le classi di sostanze inorganiche, è possibile costituire la serie genetica di metalli e non metalli. La base di queste serie è lo stesso elemento.
Tra i metalli ci sono due tipi di file:
1
. Una serie genetica in cui l'alcali funge da base. Questa serie può essere rappresentata utilizzando le seguenti trasformazioni:metallo → ossido di base → alcali → sale
Ad esempio, K → K
2 O → KOH → KCl2
. La serie genetica, dove la base è una base insolubile, quindi la serie può essere rappresentata come una catena di trasformazioni:metallo → ossido di base → sale → base insolubile →
→ossido di base → metallo
Ad esempio, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. La serie genetica di non metalli, dove l'acido solubile agisce come un collegamento nella serie. La catena di trasformazioni può essere rappresentata come segue:non metallico → ossido acido → acido solubile → sale
Ad esempio, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. La serie genetica di non metalli, dove l'acido insolubile agisce come un collegamento nella serie:non metallico → ossido di acido → sale → acido →
→ossido acido → non metallico
Per esempio
Si→ SiO 2 → na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si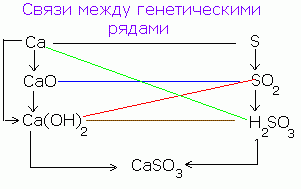
Conversazione frontale su:
Che cos'è una connessione genetica? Le connessioni genetiche sono connessioni tra diverse classi in base alle loro interconversioni. Che cos'è una serie genetica?
Serie genetiche - una serie di sostanze - rappresentanti di diverse classi, che sono composti di un elemento chimico, collegati da interconversioni e che riflettono le trasformazioni di queste sostanze. La base di queste serie è lo stesso elemento.
Quali tipi di serie genetiche si possono distinguere? Tra i metalli, si possono distinguere due tipi di serie:
a) Una serie genetica in cui l'alcali funge da base. Questa serie può essere rappresentata utilizzando le seguenti trasformazioni:
metallo → ossido di base → alcali → sale
per esempio, la serie genetica di potassio K → K
2 O → KOH → KClb) Le serie genetiche, dove la base è una base insolubile, quindi la serie può essere rappresentata come una catena di trasformazioni:
metallo → ossido di base → sale → base insolubile → ossido di base → metallo
ad esempio: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuTra i non metalli è anche possibile distinguere due tipi di file:
a) La serie genetica di non metalli, in cui l'acido solubile agisce come un collegamento nella serie. La catena di trasformazioni può essere rappresentata come segue: non metallico → ossido acido → acido solubile → sale.
Ad esempio: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Fila genetica di non metalli, dove l'acido insolubile: non metallico → ossido di acido → sale → acido → ossido di acido → non metallico funge da collegamento nella serie
Ad esempio: Si → SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → SiEsecuzione di compiti per opzioni:
1. Scegli le formule di ossido nella tua versione, spiega la tua scelta, in base alla conoscenza delle caratteristiche della composizione di questa classe di composti. Chiamali
2. Nella colonna della formula della tua variante, trova le formule acide e spiega la tua scelta in base all'analisi della composizione di questi composti.
3. Determinare le valenze dei residui acidi nella composizione acida.
4. Selezionare le formule salate e assegnarle un nome.
5. Componi le formule di sali, che possono essere formate con magnesio e acidi della tua variante. Scrivili, chiamalo.
6. Nella colonna della formula della variazione, trova le formule di base e spiega la tua scelta in base all'analisi della composizione di questi composti.
7. Nella tua variante, scegli le formule di sostanze con le quali una soluzione di acido ortofosforico (cloridrico, solforico) può reagire. Crea le equazioni di reazione appropriate.
9. Tra le formule della tua opzione, seleziona le formule di sostanze che possono interagire tra loro. Crea le equazioni di reazione appropriate.
10. Crea una catena di legami genetici di composti inorganici, che includerà una sostanza, la cui formula è data nella tua versione al numero uno.
Opzione 1
Opzione 2
CaO
HNO
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbO
LiOH
Ag
3 PO 4P
2 O 5NaOH
ZnO
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4CuSO
4Da queste sostanze si crea una linea genetica utilizzando tutte le formule. Scrivi le equazioni di reazione con le quali puoi realizzare questa catena di trasformazioni:
Opzione I: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opzione:na 2 SO 4, NaOH, na, na 2 O 2 , na 2 O4) Fissaggio1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.n
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Compito:
tracciare una transizione graduale dal calcio al carbonato di calcio e preparare una relazione sull'uso di qualsiasi sale in medicina (usando letteratura aggiuntiva).

Tra i metalli si possono distinguere due tipi di file: 1. Serie genetiche, in cui l'alcali funge da base. Questa serie può essere rappresentata dalle seguenti trasformazioni: metallo - ossido di base - alcali - sale, ad esempio, la serie genetica di potassio K - K 2 O - KOH - KCl.

2. Una serie genetica, in cui una base insolubile funge da base, quindi la serie può essere rappresentata come una catena di trasformazioni: metallo - ossido di base - sale - base insolubile - ossido di base - metallo. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu serie genetica di rame "\u003e Cu è una serie genetica di rame"\u003e "title =" (! LANG: 2. Le serie genetiche, dove la base è una base insolubile, quindi la serie può essere rappresentata come una catena di trasformazioni: metallo - base ossido - sale - base insolubile-- l'ossido principale è metallo Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. Una serie genetica, in cui una base insolubile funge da base, quindi la serie può essere rappresentata come una catena di trasformazioni: metallo - ossido di base - sale - base insolubile - ossido di base - metallo. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Tra i non metalli è anche possibile distinguere due tipi di file: 1. La serie genetica di non metalli, in cui l'acido solubile agisce come un collegamento nella serie. La catena di trasformazioni può essere rappresentata come segue: non metallico - ossido acido - acido solubile - -sol. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Gamma genetica del fosforo

Esiste un legame genetico tra le classi di composti inorganici. Da sostanze semplici puoi diventare complesso e viceversa. Dai composti di una classe, puoi ottenere composti di un'altra classe.
La relazione genetica semplificata tra classi di composti inorganici può essere rappresentata dallo schema seguente:
La sequenza di tali trasformazioni per non metalli può essere rappresentata dallo schema seguente: CANPO 4
Р → Р 2 О 5 → Í 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Per i metalli tipici puoi creare la seguente catena di trasformazioni:
Ba → BaO → Ba (OH) 2 → BaSO 4
Per i metalli i cui ossidi e idrossidi sono anfoteri (semimetalli), si possono effettuare le seguenti trasformazioni:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
Collegamenti tra classi:
1. Metalli, non metalli→ sale.
Con l'interazione diretta di metalli e non-metalli, si formano sali di acidi privi di ossigeno (alogenuri, solfuri):
2Na + C1 2 = 2NaCl
Questi composti sono stabili e non si decompongono se riscaldati.
2. Ossidi basici, ossidi acidi→ sale.
CaO + CO 2 = CaCO 3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Basi, acidi→ sale.
È effettuato attraverso una reazione di neutralizzazione:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Metalli→ ossidi di base.
La maggior parte dei metalli interagisce con l'ossigeno per formare ossidi:
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Oro, argento, platino e altri metalli nobili non interagiscono con l'ossigeno, gli ossidi di tali metalli sono ottenuti indirettamente.
5. Non metalli→ ossidi acidi.
I non metalli (con l'eccezione di alogeni e gas nobili) interagiscono con l'ossigeno, formando ossidi:
4P + 5O 2 = 2P 2 O 5;
S + O 2 = SO 2.
6. Ossidi di base→ base.
L'interazione diretta con l'acqua può essere ottenuta solo idrossidi di metalli alcalini e alcalino-terrosi (alcali):
Na 2 O + H 2 O = 2NaOH;
CaO + H 2 O = Ca (OH) 2.
I motivi rimanenti sono ottenuti indirettamente.
7. Ossidi acidi→ L'acido.
Gli ossidi acidi reagiscono con l'acqua per formare gli acidi corrispondenti:
SO 3 + H 2 O = H 2 SO 4;
Р 2 O 5 + 3H 2 O = 2H 3 PO 4.
L'eccezione è SiO 2, che non reagisce con l'acqua.
8. Basi, ossidi acidi→ sale.
Gli alcali interagiscono con gli ossidi acidi per formare sali:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2- + H 2 O;
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Acidi, ossidi di base→ sale.
Gli ossidi metallici si sciolgono in acidi, formando sali:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HS1 = 2NaCl + H 2 O,
Na 2 O + 2 H + = 2Na + + H 2 O.
10. Motivi→ ossidi di base.
Le basi insolubili e il LiOH si decompongono quando riscaldate:
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H 2 O.
11. Acidi→ ossidi acidi.
Gli acidi contenenti ossigeno instabili si decompongono quando riscaldati (H 2 SiO 3) e anche senza riscaldamento (H 2 CO 3, HClO). Allo stesso tempo, un certo numero di acidi sono resistenti al riscaldamento (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = H 2 O + SiO 2;
H 2 CO 3 = H 2 O + CO 2.
12. Ossidi metallici→ metalli.
Alcuni ossidi di metalli pesanti possono decomporsi in metallo e ossigeno:
2HgO = 2Hg + O 2.
Inoltre, i metalli sono ottenuti dai corrispondenti ossidi con l'aiuto di agenti riducenti:
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3;
Fe 2 O 3 + 3H 2 = 2 Fe + 3 H 2 O.
13. Ossidi acidi→ non metalli.
La maggior parte degli ossidi non metallici non si decompongono se riscaldati. Non metalli e ossigeno decompongono solo alcuni ossidi instabili (ossidi di alogeno).
Alcuni non metalli sono ottenuti per riduzione dagli ossidi corrispondenti:
SiO 2 + 2Mg = 2MgO + Si.
14. Sali, basi → basi.
Le basi insolubili sono ottenute dall'azione di alcali su soluzioni degli acidi corrispondenti:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Sali, acidi → acidi.
I sali solubili reagiscono con gli acidi (secondo la serie di pressione) se il risultato è un acido più debole o volatile:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s.) + H 2 SO 4 (k) = NaHSO 4 + HCl.
16. Sali→ ossidi basici, ossidi acidi.
I sali di alcuni acidi contenenti ossigeno (nitrati, carbonati) si decompongono quando riscaldati:
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
ESERCIZI DI LAVORO INDIPENDENTE SUL TEMA "CONNESSIONE GENETICA TRA LE CLASSI DI COMPOSTI INORGANICI"
1. Denominare le sostanze elencate di seguito, distribuirle nelle classi di composti inorganici: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2. Da quali sostanze elencate di seguito è possibile ottenere idrossido (acido o base) in uno stadio: rame, ossido di ferro (P), ossido di bario, ossido di azoto (P), ossido di azoto (V), ossido di silicio, solfato di rame, cloruro di potassio , potassio, carbonato di magnesio.
3. Dall'elenco sopra riportato, scrivere le formule delle sostanze relative a: 1) ossidi; 2) motivi; 3) acidi; 4) sali:
CO 2, NaOH, HCl, SO 3, CuSO 4, NaNO 3, KCl, H 2 SO 4, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3.
4. Denominare le sostanze: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Indicare a quale classe appartiene ciascuna sostanza.
5. Scrivere le formule molecolari delle seguenti sostanze e indicare a quale classe appartiene ogni sostanza:
1) idrossicarbonato di rame (II);
2) ossido di azoto (V);
3) idrossido di nichel (II);
4) fosfato di idrogeno di bario;
5) acido perclorico;
6) idrossido di cromo (III);
7) clorato di potassio;
8) acido idrogeno solforato;
9) sodio zinco.
6. Fornisci esempi delle reazioni della connessione tra:
1) sostanze semplici - non metalli;
2) sostanza semplice e ossido;
3) ossidi;
4) sostanze complesse che non sono ossidi;
5) metallo e non metallo;
6) tre sostanze.
7. Quale delle seguenti sostanze può reagire:
1) monossido di carbonio (IV): HCl, O 2, NO 2, KOH, H 2 O;
2) ossido di magnesio: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) idrossido di ferro (II): KCl, HCl, KOH, O 2, H 2 O, HNO 3;
4) cloruro di idrogeno: Zn, MgO, ZnCl 2, HNO 3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. È possibile l'interazione tra le seguenti sostanze?
1) monossido di carbonio (IV) e idrossido di potassio;
2) idrosolfato di potassio e idrossido di calcio;
3) fosfato di calcio e acido solforico;
4) idrossido di calcio e ossido di zolfo (IV);
5) acido solforico e idrossido di potassio;
6) bicarbonato di calcio e acido fosforico;
7) silice e acido solforico;
8) ossido di zinco e ossido di fosforo (V).
Scrivi le equazioni delle possibili reazioni, specifica le condizioni in cui si verificano. Se le reazioni possono portare a sostanze diverse, indicare la differenza nelle condizioni della loro attuazione.
9. Fornire le equazioni delle reazioni per ottenere le seguenti sostanze: sodio ortofosfato (4 modi), solfato di potassio (7 modi), idrossido di zinco.
10. Uno dei metodi per produrre soda (carbonato di sodio) è l'azione dell'acqua e del monossido di carbonio (IV) sull'alluminato di sodio. Componi le equazioni di reazione.
11. Modificando i coefficienti, scrivi i prodotti di reazione:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Effettua le equazioni delle reazioni per ricevere diversi tipi di sali:
1) SO 2 + Ba (OH) 2 → (sali medi e acidi),
2) A1 2 O 3 + H 2 O + HNO 3 → (sale medio, sali basici),
3) Na 2 O + H 2 S → (sali medi e acidi),
4) SO 3 + Sa (OH) 2 → (sali medi e basici),
5) CaO + H 2 O + P 2 O 5 → (sale basico, sali acidi).
13. Completa le equazioni di reazione:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (insufficiente) →
AlCl 3 + NaOH (carente) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (eccesso) →
AlC1 3 + NaOH (eccesso.) → Ca (AlO 2) 2 + HCl (eccesso) →
14. Annota le equazioni di reazione con le quali puoi effettuare le seguenti trasformazioni:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Í 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Í 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) solfato di alluminio → cloruro di alluminio → nitrato di alluminio → ossido di alluminio → alluminato di potassio → idrossido di alluminio → idrossido di alluminio → cloruro di alluminio.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) bario → idrossido di bario → bicarbonato di bario → cloruro di bario → carbonato di bario → cloruro di bario → idrossido di bario
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → Í 3 РО 4 → СаНРО 4 → Са (Н 2 РО 4) 2 → Са 3 (РО 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
ESPERIENZE SPERIMENTALI SUL TEMA "CLASSI BASE DI COMPOSTI INORGANICI"
ESPERIENZA 1.Reazioni di neutralizzazione
a) L'interazione di un acido forte e una base forte.
Versare 5 ml di soluzione di acido cloridrico 2N in un recipiente di porcellana e aggiungere ad essa 2 n di soluzione di idrossido di sodio. Mescolare la soluzione con una bacchetta di vetro e testarne l'effetto sulla cartina di tornasole, trasferendo una goccia della soluzione alla cartina di tornasole. È necessario ottenere una reazione neutra (la carta tornasole blu e rossa non cambia colore). Evaporare la soluzione risultante a secchezza. Cosa è stato formato? Scrivi equazioni di reazione molecolare e ionica.
b) L'interazione di un acido debole e una base forte.
Versare in una provetta 2 ml di soluzione alcalina 2N e aggiungere una soluzione di acido acetico fino a quando la soluzione è neutra. Scrivi equazioni di reazione molecolare e ionica. Spiega perché la reazione degli ioni di equilibrio, alla quale partecipa un elettrolita debole (acido acetico), si sposta verso la formazione di molecole d'acqua.
ESPERIENZA 2. Idrossidi anfoteri
Dai reagenti disponibili in laboratorio, ottenere un precipitato di idrossido di zinco. Agitare il precipitato ottenuto e versare piccole quantità di esso in 2 provette. In uno dei tubi aggiungere una soluzione di acido cloridrico, nell'altro - una soluzione di idrossido di sodio (eccesso). Cosa si osserva? Scrivi le equazioni delle reazioni corrispondenti in forma molecolare e ionica.
ESPERIENZA 3.Proprietà chimiche dei sali.
a) L'interazione di soluzioni saline con la formazione di una sostanza scarsamente solubile.
Versare 2 ml di soluzione di carbonato di sodio nella provetta e aggiungere la soluzione di cloruro di bario fino alla comparsa di un precipitato bianco. Scrivi l'equazione di reazione chimica in forma ionica e molecolare. Il precipitato è diviso in due parti. Versare la soluzione di acido solforico in uno dei tubi e l'idrossido di sodio nell'altro. Fai una conclusione sulla solubilità del precipitato in acidi e alcali.
b) Interazione della soluzione salina con acidi per formare un composto volatile.
Versare 2 ml di soluzione di carbonato di sodio nella provetta e aggiungere un piccolo volume di soluzione di acido cloridrico. Cosa si osserva? Scrivi le equazioni di reazione chimica in forma ionica e molecolare.
c) Interazione di soluzioni saline con alcali con la formazione di un composto volatile.
Versare una piccola soluzione di sale d'ammonio nel tubo, aggiungere 1-2 ml di soluzione di idrossido di sodio e scaldare fino all'ebollizione. In una provetta con la miscela di reazione per fare una prova al tornasole rossa bagnata. Cosa si osserva? Dare una spiegazione. Scrivi le equazioni di reazione.
g ) Interazioni di sali con metalli più attivi rispetto al metallo che fa parte del sale.
Pulire l'unghia di ferro (acciaio) con carta vetrata fine. Quindi immergerlo nella soluzione di solfato di rame. Dopo un po 'di tempo, osserva il rilascio di rame sulla superficie dell'unghia. Scrivi l'equazione di reazione corrispondente in forma ionica e molecolare.
ESPERIENZA 4.Ottenere sali basici e acidi
a) Preparazione dell'idrossicarbonato di piombo.
Aggiungere un po 'di ossido di piombo (II) alla soluzione di acetato di piombo (II) e far bollire la miscela per alcuni minuti. La soluzione raffreddata viene drenata dal precipitato e viene attraversata da una corrente di anidride carbonica. Cosa si osserva? Filtrare il precipitato e asciugare tra i fogli di carta da filtro. Segnare il colore e la natura del precipitato risultante di idrossicarbonato di piombo. Scrivi le equazioni di reazione. Crea una formula grafica del sale ottenuto.
b) Preparazione del bicarbonato di magnesio.
Ad una soluzione altamente diluita di sale di magnesio aggiungere una piccola soluzione di carbonato di sodio. Quale sostanza precipita? Soluzione satura con precipitato con anidride carbonica. Osserva la graduale dissoluzione del precipitato. Perché sta succedendo questo? Scrivi le equazioni di reazione.
ESPERIENZA 5.Ottenere sali complessi.
a) Formazione di composti con catione complesso.
Aggiungere una soluzione di ammoniaca goccia a goccia in una provetta con 2-3 ml di soluzione di cloruro di rame (II) fino a formare un precipitato di idrossido di rame (II), quindi aggiungere un eccesso di soluzione di ammoniaca per sciogliere il precipitato. Confrontate il colore degli ioni Cu 2+ con il colore della soluzione risultante. Quali ioni sono presenti nella soluzione? Scrivi l'equazione di reazione per ottenere un composto complesso.
b) Formazione di composti con un anione complesso.
Ad una soluzione di 1-2 ml di nitruro di mercurio (II) aggiungere goccia a goccia una soluzione diluita di ioduro di potassio per formare un precipitato di HgI 2. Quindi versare un eccesso di soluzione di ioduro di potassio fino a quando il precipitato non si scioglie. Scrivi le reazioni di ottenere un sale complesso.
ESPERIENZA 6.Preparazione di doppio sali (allume di potassio).
Pesare 7,5 g di Al 2 (SO 4) 3 ∙ 18H 2 O e sciogliere in 50 ml di acqua, portando a tale scopo un piatto di porcellana sufficientemente grande. Calcolare l'equazione di reazione e pesare la massa di solfato di potassio necessaria per la reazione. Preparare una soluzione calda e satura di solfato di potassio e versarla in un recipiente di porcellana con una soluzione di solfato di alluminio sotto agitazione. Osservare dopo un po 'la precipitazione di cristalli di alluminio di allume di potassio. Dopo il raffreddamento e la cristallizzazione, versare il liquido madre, asciugare i cristalli di allume tra i fogli di carta da filtro e pesare i cristalli risultanti. Calcola la percentuale di rendimento.
COMPITI DI COMPOSIZIONE
1. Facendo passare un eccesso di idrogeno solforato attraverso 16 g di soluzione di solfato di rame (II), sono stati ottenuti 1,92 g di precipitato. Trova la frazione di massa di solfato di rame nella soluzione utilizzata e il volume di idrogeno solforato consumato.
2. Per la precipitazione completa del rame sotto forma di solfuro da 291 cm 3 di soluzione di solfato di rame (II) con una frazione di massa del 10%, è stato utilizzato gas ottenuto facendo reagire 17,6 g di solfuro di ferro (II) con un eccesso di acido cloridrico. Trova la densità della soluzione di solfato di rame originale.
3. Il gas rilasciato durante l'interazione della soluzione di K 2 S con acido solforico diluito viene fatto passare attraverso una soluzione di nitrato di piombo (II) in eccesso. Il precipitato risultante ha una massa di 71,7 g Trova il volume della soluzione reagita di acido solforico, se la sua densità è 1.176 g / cm 3, e la frazione di massa è del 25%.
4. Ad una soluzione contenente 8 g di solfato di rame (II), è stata aggiunta una soluzione contenente 4,68 g di solfuro di sodio. Il precipitato è stato filtrato, il filtrato è stato evaporato. Determinare la massa di sostanze nel filtrato dopo l'evaporazione e la massa del precipitato di solfuro di rame.
5. Parte del solfuro di ferro (II) è stato trattato con un eccesso di acido cloridrico. Il gas risultante nella reazione con 12,5 cm 3 di soluzione di NaOH con una frazione di massa del 25% e una densità di 1,28 g / cm 3 formava un sale acido. Trova la massa del solfuro di ferro originale.
6. Il solfuro di ferro (II) del peso di 176 g è stato trattato con un eccesso di acido cloridrico e il gas risultante è stato bruciato in eccesso di aria. Quale volume di soluzione KOH con una frazione di massa del 40% e una densità di 1,4 g / cm 3 è necessario per neutralizzare completamente il gas prodotto durante la combustione?
7. Durante la tostatura di 100 g di pirite tecnica, hanno ottenuto un gas, che è stato completamente neutralizzato con 400 cm 3 di soluzione di NaOH con una frazione di massa del 25% e una densità di 1,28 g / cm 3. Determina la frazione di massa delle impurità nella pirite.
8. A 2 g di una miscela di ferro, ossido di ferro (II) e ossido di ferro (III) sono stati aggiunti 16 cm 3 della soluzione di HC1 con una frazione di massa del 20% e una densità di 1,09 g / cm 3. Per neutralizzare l'acido in eccesso, sono stati necessari 10,8 cm 3 di soluzione di NaOH con una frazione in massa del 10% di densità di 1,05 g / cm 3. Trova le masse delle sostanze nella miscela se il volume di idrogeno rilasciato è 224 cm 3 (NU).
9. C'è una miscela di Ca (OH) 2, CaCO 3 e BaSO 4 con una massa di 10,5 g Quando la miscela è stata trattata con un eccesso di acido cloridrico, sono stati rilasciati 672 cm 3 (UI) di gas e 71,2 g di acido hanno reagito quota del 10%. Determinare la massa di sostanze nella miscela.
10. Esiste una miscela di cloruro di bario, carbonato di calcio e bicarbonato di sodio. Quando 10 g di questa miscela viene disciolta in acqua, il residuo insolubile è pari a 3,5 g Quando si calcola 20 g della miscela iniziale, la sua massa diminuisce di 5,2 g Trova le frazioni di massa delle sostanze nella miscela iniziale.
11. Esiste una soluzione contenente sia acido solforico che acido nitrico. Per neutralizzare completamente 10 g di questa soluzione, 12,5 cm 3 di soluzione KOH vengono consumati con una frazione di massa del 19% e una densità di 1,18 g / cm 3. Quando si aggiunge un eccesso di cloruro di bario a 20 g della stessa miscela di soluzione acida, cadono 4,6 g di precipitato. Trova le frazioni di massa degli acidi nella miscela.
12. Tutto il cloruro di idrogeno ottenuto da 100 g di una miscela di KC1 e KNO 3 è stato sciolto in 71,8 cm 3 di acqua. Quando si calcola 100 g della stessa miscela di sali, rimangono 93,6 g di residuo solido. Trova la frazione di massa di acido cloridrico nell'acqua.
13. Passando 2 m 3 di aria (NU) attraverso una soluzione di Ca (OH) 2, si ottenevano 3 g di precipitato di sale di acido carbonico. Trova il volume e la frazione di massa di CO 2 nell'aria.
14. L'anidride carbonica viene fatta passare attraverso una sospensione contenente 50 g di CaCO 3. La reazione è arrivata a 8,96 dm 3 gas (NU). Qual è la massa di CaCO 3 rimasta nella fase solida?
15. Quando si aggiunge acqua a CaO, la sua massa è aumentata del 30%. Quale parte di CaO (in% in massa) è stata estinta?
16. L'ossido di piombo (II) del peso di 18,47 g è stato riscaldato in una corrente di idrogeno. Dopo la reazione, la massa del piombo risultante e dell'ossido non reagito era di 18,07 g. Qual è la massa di ossido di piombo che non ha reagito?
17. Il monossido di carbonio viene fatto passare attraverso l'ossido di ferro (III) quando riscaldato. La massa del residuo solido dopo la reazione è 2 g in meno rispetto alla massa iniziale di ossido di ferro. Quale volume di CO ha preso la reazione (l'ossido è completamente ridotto)?
18. Vi è 8,96 dm 3 (NU) di una miscela di N 2, CO 2 e SO 2 con una densità relativa di idrogeno 25. Dopo averlo fatto passare attraverso un eccesso di soluzione di KOH, il volume della miscela è diminuito di 4 volte. Trova i volumi di gas nella miscela originale.
19. In due bicchieri ci sono 100 g di soluzione di HC1 con una frazione di massa del 2,5%. In un bicchiere sono stati aggiunti 10 g di CaCO 3, nell'altro - 8,4 g di MgCO 3. In che modo la massa di occhiali cambierà dopo la reazione?
20. Quale volume (NU) di anidride solforosa deve essere passato attraverso 200 cm 3 di una soluzione con una frazione di massa dello 0,1% di NaOH e una densità di 1 g / cm 3 per ottenere un sale acido?
21. Qual è la quantità massima (diossido di carbonio) dell'anidride carbonica in grado di assorbire 25 cm 3 di una soluzione con una frazione di massa del 25% di NaOH e una densità di 1,1 g / cm 3?
22. Qual è il volume minimo della soluzione con una frazione di massa di 20% KOH e una densità di 1,19 g / cm 3 in grado di assorbire tutto il biossido di carbonio prodotto con la riduzione completa di 23,2 g di magnetite con monossido di carbonio?
23. Qual è la massa minima di KOH che deve essere reagita con 24,5 g di acido ortofosforico in modo tale che solo il fosfato di potassio fosfato sia il prodotto?
24. Qual è la massa minima di Ca (OH) 2 da aggiungere a 16 g di soluzione di bicarbonato di calcio con una frazione in massa del 5% di sale per ottenere un sale medio?
25. Quale massa di idrogeno fosfato di potassio dovrebbe essere aggiunta ad una soluzione contenente 12,25 g di H 3 PO 4 in modo che dopo questa soluzione la soluzione contenga solo il diidrogeno fosfato di potassio?
26. La soluzione conteneva 56,1 g di una miscela di carbonati di calcio e magnesio in sospensione. Per convertirli in idrocarbonati, hanno speso tutto il biossido di carbonio prodotto bruciando 7 dm 3 (NU) di etano. Trova la massa di carbonato di calcio nella miscela iniziale.
27. Per convertire 9,5 g di una miscela di sodio idro- e diidrogeno fosfato in un sale medio, è necessario 10 cm 3 di una soluzione con una frazione in massa di NaOH del 27,7% e una densità di 1,3 g / cm 3. Trova la massa di idrogeno fosfato nella miscela.
28. Facendo passare anidride carbonica attraverso una soluzione contenente 6 g di NaOH, sono stati ottenuti 9,5 g di una miscela di acidi e sali medi. Trova la quantità di anidride carbonica consumata.
29. Dopo aver passato 11,2 dm 3 (NU) di CO 2 attraverso la soluzione di KOH, sono stati ottenuti 57,6 g di una miscela di acidi e sali medi. Trova la massa di sale medio.
30. Quale massa di acido ortofosforico deve essere neutralizzata per ottenere 1,2 g di diidro- e 4,26 g di idrogeno fosfato di sodio?
31. Il NaOH è stato aggiunto alla soluzione di acido solforico per ottenere 3,6 g di idrosolfato e 2,84 g di solfato di sodio. Determinare le quantità chimiche dell'acido e degli alcali che hanno reagito.
32. Dopo aver fatto passare l'idrogeno cloruro attraverso 200 cm 3 di soluzione di NaOH con una frazione di massa del 10% e una densità di 1,1 g / cm 3, la frazione di NaOH nella soluzione risultante è dimezzata. Determinare la frazione di massa di NaCl nella soluzione risultante.
33. Sciogliere 14,4 g di una miscela di rame e il suo ossido (II) ha consumato 48,5 g di una soluzione con una frazione di massa HNO 3 dell'80%. Trova le frazioni di massa di rame e ossido nella miscela iniziale.
34. La massa di ossido di sodio di 6,2 g fu disciolta in 100 cm 3 di acqua e fu ottenuta la soluzione No. 1. Quindi acido cloridrico con una frazione in massa del 10% fu aggiunto a questa soluzione fino a quando il mezzo divenne neutro, e la soluzione No. 2 fu ottenuta. :
1) frazioni di massa di sostanze nelle soluzioni n. 1, 2;
2) la massa della soluzione di HC1, che è andato a neutralizzare la soluzione numero 1.
35. 3 g di zinco interagiscono con 18,69 cm 3 di soluzione di HC1 con una frazione in massa del 14,6% e una densità di 1,07 g / cm 3. Una volta riscaldato, il gas risultante viene trasferito su CuO caldo del peso di 4 g. Qual è la massa di rame che si ottiene?
36. Il gas rilasciato dopo il trattamento di idruro di calcio con acqua in eccesso, mancato FeO. Di conseguenza, la massa di ossido è diminuita di 8 g. Trova la massa di CaH 2 trattata con acqua.
37. Durante la calcinazione del campione di CaCO 3, la sua massa è diminuita del 35,2%. I prodotti di reazione solidi sono stati sciolti in un eccesso di acido cloridrico per ottenere 0,112 dm 3 (NU) di gas. Determina la massa del campione originale di carbonato di calcio.
38. Il nitrato di rame è stato decomposto e l'ossido di rame (II) risultante è stato completamente ridotto dall'idrogeno. I prodotti risultanti sono passati attraverso un tubo con P 2 O 5 e la massa del tubo dopo quella aumentata di 3,6 g Qual è il volume minimo di acido solforico con una frazione di massa dell'88% e una densità di 1,87 g / cm 3 necessari per la dissoluzione ottenuta nell'esperimento rame e qual è la massa del sale decomposto?
39. Assorbendo l'ossido nitrico (IV) con un eccesso di soluzione di KOH nel freddo in assenza di ossigeno, sono stati ottenuti 40,4 g di KNO 3. Quale sostanza è ancora formata e qual è la sua massa?
40. Per neutralizzare 400 g di una soluzione contenente cloridrato e acido solforico, ha consumato 287 cm 3 di soluzione di idrossido di sodio con una frazione in massa del 10% e una densità di 1,115 g / cm 3. Se si aggiunge una soluzione in eccesso di cloruro di bario a 100 g della soluzione iniziale, cadranno 5,825 g di precipitato. Determinare le frazioni di massa degli acidi nella soluzione iniziale.
41. Dopo aver passato l'anidride carbonica attraverso una soluzione di idrossido di sodio, si ottennero 13,7 g di una miscela di sali medi e acidi. Per convertirli in cloruro di sodio sono necessari 75 g di acido cloridrico con una frazione di HCl del 10%. Trova il volume di anidride carbonica assorbito.
42. Una miscela di acidi cloridrico e solforico con una massa totale di 600 g di soluzione con le stesse frazioni di massa di acidi è stata trattata con un eccesso di bicarbonato di sodio e 32,1 dm 3 di gas (N o.) Ottenuto. Trova la frazione di massa degli acidi nella miscela iniziale.
43. Per neutralizzare 1 dm 3 di soluzione di NaOH, 66,66 cm 3 di soluzione di HNO 3 sono stati consumati con una frazione in massa del 63% e una densità di 1,5 g / cm 3. Quale volume di soluzione di acido solforico con una frazione di massa del 24,5% e una densità di 1,2 g / cm 3 sarebbe necessario per neutralizzare la stessa quantità di alcali?
44. In quale rapporto di volume si dovrebbe prendere una soluzione di acido solforico con una frazione in massa del 5% e una densità di 1,03 g / cm 3 e una soluzione di idrossido di bario con una frazione in massa del 5% e una densità di 1,1 g / cm 3 per la completa neutralizzazione? Immagina la risposta come il quoziente del volume della soluzione alcalina sulla soluzione acida.
45. Calcolare il volume minimo di soluzione di ammoniaca con una densità di 0,9 g / cm 3 e una frazione di massa del 25%, necessaria per il completo assorbimento del biossido di carbonio ottenuto dalla decomposizione di 0,5 kg di calcare naturale con una frazione in massa di carbonato di calcio pari al 92%.
46. Per la conversione completa di 2,92 g di una miscela di idrossido di sodio e carbonato di sodio in cloruro, è necessario 1.344 dm 3 di acido cloridrico (NU). Trova la massa di carbonato di sodio nella miscela.
47. A 25 g di soluzione di solfato di rame (II) con una frazione in massa del 16% è stata aggiunta una quantità di soluzione di idrossido di sodio con una frazione in massa del 16%. Il precipitato formato è stato filtrato, dopo di che il filtrato era alcalino. Per neutralizzare completamente il filtrato, sono stati necessari 25 cm 3 di una soluzione di acido solforico con una concentrazione molare di 0,1 mol / dm 3 della soluzione. Calcolare la massa della soluzione di idrossido di sodio aggiunta.
48. La sostanza ottenuta con la riduzione completa di CuO con una massa di 15,8 g di idrogeno con un volume di 11,2 dm 3 (NU) è stata sciolta riscaldando in acido solforico concentrato. Qual è il volume di gas (NU) rilasciato come risultato della reazione?
49. Per la neutralizzazione completa di 50 cm 3 di acido cloridrico con una frazione in massa di HC1 del 20% e una densità di 1,10 g / cm 3, è stata utilizzata una soluzione di idrossido di potassio con una frazione in massa di KOH del 20%. Qual è la quantità chimica di acqua contenuta nella soluzione risultante?
50. Il gas ottenuto facendo passare un eccesso di CO 2 su 0,84 g di carbone caldo, viene inviato alla reazione con 14,0 g di ossido di rame riscaldato (II). Quale volume di una soluzione di acido nitrico con una frazione in massa del 63% e una densità di 1,4 g / cm 3 è necessario per dissolvere completamente la sostanza ottenuta nell'ultima reazione?
51. Quando calcinato a peso costante di nitrato di rame (II), il peso del sale è diminuito di 6,5 g. Quale peso del sale è stato decomposto?
52. Quando è stato usato un eccesso di acido cloridrico, 6,72 dm 3 (NW) di gas sono stati rilasciati su una miscela di alluminio con un metallo monovalente sconosciuto e la massa della miscela è stata dimezzata. Trattando il residuo con acido nitrico diluito, è stato rilasciato 0,373 dm 3 (NU) NO. Identifica il metallo sconosciuto.
53. La massa del campione di gesso è di 105 g, e la quantità chimica dell'elemento di ossigeno nella sua composizione è di 1 mole. Determinare la frazione di massa di CaCO 3 nel campione di gesso (l'ossigeno è incluso solo nella composizione di carbonato di calcio).
54. Nell'interazione dell'ossido di zolfo (VI) con acqua, è stata ottenuta una soluzione con una frazione in massa di acido solforico del 25%. Quando a questa soluzione è stato aggiunto un eccesso di Ba (OH) 2, è stato depositato un precipitato del peso di 29,13 g Quali masse di SO 3 e H 2 O sono state utilizzate per la formazione di una soluzione acida?
55. Passando SO 2 a 200 g di una soluzione con una frazione di massa di NaOH del 16%, è stata formata una miscela di sali, inclusi 41,6 g di un sale acido. Qual è la massa di zolfo contenente il 4,5% di impurità in peso, è stata utilizzata per ottenere SO 2? Qual è il peso del sale medio?
56. L'interazione con 80 g di soluzione di Ca (NO 3) 2 ha richiesto 50 g di soluzione di Na 2 CO 3. La precipitazione è stata separata, mentre il trattamento con un eccesso di acido cloridrico, 2,24 dm 3 (NU) di gas è stato rilasciato. Quali sono le frazioni di massa di sali nelle soluzioni iniziali? Qual è la frazione di massa del nitrato di sodio nella soluzione dopo la separazione del precipitato?
57. Quando lo zinco interagisce con acido solforico, si formano 10 dm 3 (NU) di una miscela di SO 2 e H 2 S con una densità relativa di argon di 1,51. Qual è la quantità chimica di zinco sciolto? Qual è la frazione di massa di SO 2 nella miscela di gas?
58. Un campione di una miscela di segatura di zinco e alluminio con una massa totale di 11 g è stato sciolto in un eccesso di soluzione alcalina. Determinare il volume (NU) del gas rilasciato, se la frazione di massa di zinco nella miscela è del 30%.
59. L'idrossido di sodio del peso di 4,0 g è stato alligato con idrossido di alluminio del peso di 9,8 g. Calcolare la massa del metaalluminato di sodio ottenuto.
60. Durante la lavorazione di 10 g di una miscela di rame e alluminio con acido nitrico concentrato a temperatura ambiente rilasciato 2.24 dm 3 gas (NU). Quale volume (NU) di gas verrà rilasciato quando si elabora la stessa massa della miscela con un eccesso di soluzione KOH?
61. Una lega di rame e alluminio del peso di 20 g è stata trattata con un eccesso di alcali, il residuo insolubile è stato sciolto in acido nitrico concentrato. Il sale ottenuto è stato isolato, calcinato a peso costante e sono stati ottenuti 8 g di residuo solido. Determinare il volume della soluzione NaOH esausta con una frazione di massa del 40% e una densità di 1,4 g / cm 3).
62. Una miscela di alluminio e ossido di metallo (II) (ossido non anfotero) del peso di 39 g è stata trattata con un eccesso di soluzione di KOH, il gas emesso è stato bruciato per ottenere 27 g di acqua. Il residuo indisciolto è stato completamente disciolto in 25,2 cm 3 di una soluzione con una frazione in massa di HC1 del 36,5% e una densità di 1,19 g / cm 3). Determina l'ossido.
63. Una miscela di zinco e rame è stata trattata con un eccesso di soluzione di KOH, mentre è stato rilasciato un gas di 2,24 dm 3 (NU). Per la clorurazione completa dello stesso campione di metallo, era necessario cloro con un volume di 8,96 dm 3 (NU). Calcola la frazione di massa di zinco nel campione.
64. Una miscela di segatura di ferro, alluminio e magnesio con una massa di 49 g è stata trattata con H 2 SO 4 in eccesso diluito, ottenendo così 1,95 mol di gas. Un'altra porzione della stessa miscela del peso di 4,9 g è stata trattata con un eccesso di soluzione alcalina, ottenendo 1,68 dm 3 (NU) di gas. Trova la massa di metalli nella miscela.
65. Qual è la massa di sedimento formatasi quando si uniscono soluzioni contenenti 10 g di NaOH e 13,6 g di ZnCl 2?
66. Ci sono due parti della miscela di Al, Mg, Fe, Zn, la stessa in composizione molare, ciascuna del peso di 7,4 g.Una porzione è stata disciolta in acido cloridrico e sono stati ottenuti 3,584 dm 3 di gas (NU), l'altro in soluzione alcalina e Ricevuto 2,016 dm 3 gas (NU). È noto che in entrambe le miscele ci sono 3 atomi di Zn per atomo A1. Trova la massa di metalli nella miscela.
67. Una miscela di rame, magnesio e alluminio del peso di 1 g è stata trattata con un eccesso di acido cloridrico. La soluzione è stata filtrata, un eccesso di soluzione di NaOH è stato aggiunto al filtrato. Il precipitato è stato separato e calcinato ad una massa costante di 0,2 g. Il residuo, che era indisciolto dopo il trattamento con acido cloridrico, è stato calcinato nell'aria e sono stati ottenuti 0,8 g di sostanza nera. Trova la frazione di massa di alluminio nella miscela.
68. Quando riscaldato in una corrente di lega di ossigeno di zinco, magnesio e rame, la massa della miscela aumentava di 9,6 g Il prodotto è parzialmente disciolto in alcali e 40 cm 3 di una soluzione con una frazione in massa di KOH 40% e una densità di 1,4 g / cm è necessaria per la dissoluzione 3. Per la reazione con la stessa porzione della lega, è necessario 0,7 mol HC1. Trova le quantità chimiche di metalli nella lega.
69. Una lega di rame e zinco del peso di 5 g è stata trattata con un eccesso di soluzione di NaOH. Quindi il residuo solido è stato separato e trattato con HNO 3 concentrato, il sale così ottenuto è stato isolato, calcinato a peso costante e sono stati ottenuti 2,5 g di un residuo solido. Determina la massa di metalli nella lega.
70. Una lega di rame e alluminio del peso di 12,8 g è stata trattata con un eccesso di acido cloridrico. Il residuo non disciolto è stato sciolto in acido nitrico concentrato, la soluzione risultante è stata evaporata, il residuo secco è stato calcinato a peso costante e sono stati ottenuti 4 g di solido. Determina la frazione di massa del rame nella lega.
71. In quale rapporto di massa dovrebbero prendere due parti di A1, in modo che quando si aggiunge alla soluzione di alcali e l'altro a pari quantità di idrogeno vengono rilasciati nell'acido cloridrico?
72. Durante la lavorazione di una miscela di alluminio e ossido di rame (II) con un eccesso di soluzione di KOH, furono rilasciati 6,72 dm 3 (NU) di gas e sciogliendo la stessa porzione della miscela in HNO 3 concentrato a temperatura ambiente, si ottennero 75,2 g di sale. Trova la massa della miscela iniziale di sostanze.
73. Quale massa di ossido di rame (II) può essere ripristinata dall'idrogeno ottenuto facendo reagire un eccesso di alluminio con 139,87 cm 3 di una soluzione con 40% di NaOH e una densità di 1,43 g / cm 3?
74. Con l'ossidazione completa di 7,83 g della lega di due metalli, si formarono 14,23 g di ossidi, durante il cui trattamento un eccesso di alcali rimase non disciolto 4,03 g di sedimento. Determinare la composizione qualitativa dei metalli che formano la lega, se i loro cationi hanno uno stato di ossidazione di +2 e +3, e il rapporto molare degli ossidi è 1: 1 (supponiamo che l'ossido di metallo con stato di ossidazione +3 abbia proprietà anfotero).
75. Due parti di alluminio, aventi la stessa massa, sono state disciolte: una in una soluzione di idrossido di potassio, l'altra in acido cloridrico. In che modo i volumi di gas evoluti (nas) si correlano tra loro?
76. Una lega di rame con alluminio del peso di 1.000 g è stata trattata con un eccesso di soluzione alcalina, il precipitato non sciolto è stato sciolto in acido nitrico, quindi la soluzione è stata evaporata, il residuo è stato calcinato a peso costante. La massa del nuovo residuo è 0,398 g Qual è la massa di metalli nella lega?
77. Una lega di zinco e rame del peso di 20 g è stata trattata con un eccesso di soluzione di NaOH con una frazione in massa del 30% e una densità di 1,33 g / cm 3. Il residuo solido è stato isolato e trattato con un eccesso di una soluzione concentrata di HNO 3. Il sale formato durante questo processo è stato isolato e calcinato a peso costante. La massa del residuo solido era 10.016 g. Calcolare le frazioni di massa dei metalli nella lega e il volume della soluzione alcalina consumata.
78. Una lega di rame e alluminio del peso di 2 g è stata trattata con un eccesso di soluzione alcalina. Il residuo è stato filtrato, lavato, disciolto in HNO 3, la soluzione è stata evaporata e calcinata a peso costante. La massa del residuo dopo la calcinazione era di 0,736 g Calcolare le frazioni di massa dei metalli nella lega.
79. La clorurazione di una miscela di ferro, rame e alluminio richiede 8,96 dm 3 di cloro (NU) e l'interazione dello stesso campione con acido cloridrico richiede 5,6 dm 3 (NU). Quando si interagisce con la stessa massa di una miscela di metalli con alcali, viene rilasciato 1,68 dm 3 (NU) di gas. Trova le quantità chimiche di metalli nella miscela.
80. L'idruro di potassio del peso di 5,0 g è stato sciolto in acqua con un volume di 80 cm 3 e alla soluzione risultante sono stati aggiunti alluminio con un peso di 0,81 g.Risultare le frazioni di massa delle sostanze nella soluzione risultante con una precisione fino a millesimi di punto percentuale.
ELENCO DELLA LETTERATURA
1. Barannik, V.P. Nomenclatura russa moderna di composti inorganici / V.P. Barannik // Journal of All-Union Chemical Society. DI Mendeleev. - 1983. - Vol. XXVIII. - p.9-16.
2. Wroblewski, A.I. Simulatore di chimica / A.I. Wroblewski. - 2a ed., Pererab. e aggiungi - Minsk: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Compiti ed esercizi in chimica generale: studi. manuale per università / ed. VA Rabinovich e H.M. Rubina. - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Compiti in generale e chimica inorganica: studi. manuale per studenti di livello superiore. Proc. istituzioni / R.A. Lidin, V.A. Latte, L.L. Andreev; di ed. RA Lidin. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. Nomenclatura delle basi delle sostanze inorganiche / R.А. Lidin [et al.]; di ed. BD Stepin. - M.: Chemistry, 1983. - 112 p.
6. Stepin, B.D. Applicazione delle norme IUPAC sulla nomenclatura dei composti inorganici in russo / B.D. Stepin, R.A. Lidin // Journal of All-Union Chemical Society. DI Mendeleev. - 1983. - Vol. XXVIII. - p.17-20.
| Introduzione .............................................................................. Regole generali per la gamma di sostanze inorganiche ............ .. Ossidi ....................................... .................................... Ossidi di base .................................................................. ... Ossidi acidi ....................................... ............................ Ossidi anfoteri ............................................................... .. Ottenere ossidi .................................................................. Esercizi per lavori indipendenti su L'argomento "Ossidi" ................................................................... Acidi ............................................................................... Esercizi per lavori indipendenti sull'argomento "Acidi" .................................................................. Motivi ............................................................ ......... .. Esercizi per lavori indipendenti sul tema "Fondamenti" ................................................................ Sali ..................................................................................... Esercizi per lavori indipendenti sull'argomento "Sali" .......................................................... Relazione genetica tra classi di composti inorganici ......................................... ............... .. Esercizi per lavori indipendenti sul tema "Connessione genetica tra classi di composti inorganici" ...................................................... Esperimenti sperimentali sull'argomento "Principali classi di composti inorganici ............... ......... .. Attività di insediamento ..................................................................... Riferimenti .................................... |
istruzione: fissare il concetto di "serie genetica", "connessione genetica"; insegnare come creare serie genetiche di elementi (metalli e non metalli), per costituire le equazioni di reazione corrispondenti alle serie genetiche; verificare come viene assimilata la conoscenza delle proprietà chimiche di ossidi, acidi, sali, basi;
in via di sviluppo: sviluppare la capacità di analizzare, confrontare, sintetizzare e trarre conclusioni, comporre le equazioni delle reazioni chimiche;
educativo : promuovere la formazione di una visione scientifica del mondo.
2. Fornire lezioni le tabelle "Sistema periodico", "Tabella di solubilità", "Serie di attività sui metalli", istruzioni per gli studenti, compiti per testare le conoscenze.
3. Ordine di esecuzione:
3.1. Indagine frontale
3.2. La soluzione dei compiti.
3.3. Eseguire il lavoro di verifica sulle opzioni.
4. Layout del report:
4.1. Scrivi l'argomento e gli obiettivi della lezione pratica.
4.2. Registra la risoluzione dei problemi.
4.3. Risolvi la tua versione del lavoro indipendente, la decisione di scrivere in un taccuino e passare al docente per la revisione.
Progresso del lavoro
1. Conversazione frontale su:
Cos'è una connessione genetica?
Connessioni genetiche - Queste sono connessioni tra classi diverse in base alle loro interconversioni.
Cos'è una serie genetica?
Fila genetica - una serie di sostanze - rappresentanti di diverse classi, che sono composti di un elemento chimico, collegati da interconversioni e che riflettono le trasformazioni di queste sostanze. La base di queste serie è lo stesso elemento.
Di quali tipi di serie genetiche vengono solitamente assegnati?
Tra i metalli ci sono due tipi di file:
a) Una serie genetica in cui l'alcali funge da base. Questa serie può essere rappresentata utilizzando le seguenti trasformazioni:
metallo → ossido di base → alcali → sale
per esempio, la serie genetica di potassio K → K 2 O → KOH → KCl
b) Le serie genetiche, dove la base è una base insolubile, quindi la serie può essere rappresentata come una catena di trasformazioni:
metallo → ossido di base → sale → base insolubile → ossido di base → metallo
ad esempio: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Tra i non metalli è anche possibile distinguere due tipi di file:
a) La serie genetica di non metalli, in cui l'acido solubile agisce come un collegamento nella serie. La catena di trasformazioni può essere rappresentata come segue: non metallico → ossido acido → acido solubile → sale.
Ad esempio: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Fila genetica di non metalli, dove l'acido insolubile: non metallico → ossido di acido → sale → acido → ossido di acido → non metallico funge da collegamento nella serie
Ad esempio: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Esecuzione di compiti per opzioni:
| Opzione 1 | Opzione 2 |
|
Opzione I: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opzione II: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
compiti a casa: tracciare una transizione graduale dal calcio al carbonato di calcio e preparare una relazione sull'uso di qualsiasi sale in medicina (usando letteratura aggiuntiva).
Istruzioni per la lezione pratica
Relazione genetica tra le principali classi di sostanze inorganiche.
obiettivi: fissare il concetto di "serie genetica", "connessione genetica"; imparare a creare serie genetiche di elementi (metalli e non metalli), per costituire le equazioni di reazione corrispondenti alle serie genetiche; ripetere le proprietà di ossidi, acidi, sali, basi.
Progresso del lavoro
Annota le definizioni dei concetti:
Relazione genetica - __________________________________________
Fila genetica - ___________________________________________
Una serie genetica di metalli in cui l'alcali funge da base. può essere rappresentato in generale: metallo → ossido di base → alcali → sale. Crea questa serie usando il potassio. Scrivi le equazioni delle reazioni, con l'aiuto del quale puoi realizzare questa catena di trasformazioni.
La serie genetica di non metalli, dove l'acido solubile agisce come un collegamento nella serie può essere rappresentato come segue: non metallico → ossido acido → acido solubile → sale. Crea questa serie usando il fosforo. Scrivi le equazioni delle reazioni, con l'aiuto del quale puoi realizzare questa catena di trasformazioni.
Fila genetica, dove la base è base insolubile può essere rappresentato dalla catena di trasformazioni: metallo → ossido di base → sale → base insolubile → ossido di base → metallo. Costruisci questa serie usando il rame. Scrivi le equazioni delle reazioni, con l'aiuto di cui puoi fare questa catena di trasformazioni.
La serie genetica di non metalli, dove l'acido insolubile agisce come un collegamento nella serie può essere rappresentato dalla catena di trasformazioni: non metallico → ossido acido → sale → acido → ossido acido → non metallico. Costruisci questa serie usando il silicio. Scrivi le equazioni delle reazioni, con l'aiuto di cui puoi fare questa catena di trasformazioni.
Esegui attività per opzioni:
| Opzione 1 | Opzione 2 |
|
1. Scegli le formule di ossido nella tua versione, spiega la tua scelta, in base alla conoscenza delle caratteristiche della composizione di questa classe di composti. Chiamali
2. Nella colonna della formula della tua variante, trova le formule acide e spiega la tua scelta in base all'analisi della composizione di questi composti.
3. Determinare le valenze dei residui acidi nella composizione acida.
4. Selezionare le formule salate e assegnarle un nome.
5. Componi le formule di sali, che possono essere formate con magnesio e acidi della tua variante. Scrivili, chiamalo.
6. Nella colonna della formula della variazione, trova le formule di base e spiega la tua scelta in base all'analisi della composizione di questi composti.
7. Nella tua variante, scegli le formule di sostanze con le quali una soluzione di acido ortofosforico (cloridrico, solforico) può reagire. Crea le equazioni di reazione appropriate.
9. Tra le formule della tua opzione, seleziona le formule di sostanze che possono interagire tra loro. Crea le equazioni di reazione appropriate.
10. Crea una catena di legami genetici di composti inorganici, che includerà una sostanza, la cui formula è data nella tua versione al numero uno.
Da queste sostanze si crea una linea genetica utilizzando tutte le formule. Scrivi le equazioni di reazione con le quali puoi realizzare questa catena di trasformazioni:
io opzione: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIopzione: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
compiti a casa: tracciare una transizione graduale dal calcio al carbonato di calcio e preparare una relazione sull'uso di qualsiasi sale in medicina (usando letteratura aggiuntiva).
