Schema della struttura del silicio. Struttura a guscio elettronico
Struttura atomica Posizione in PS: Periodo III; gruppo IV, leader; Carica del kernel: +14 Si; Massa atomica relativa: Ar (Si) = 28 Struttura atomica: p = 14, e = 14, n = = 14 Formula elettronica: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
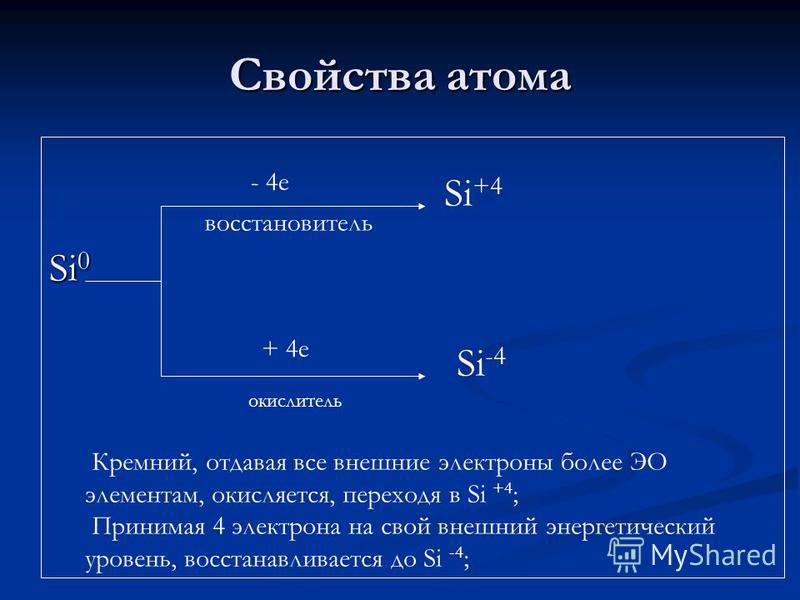
Proprietà atomiche Agente riducente Si + 4 e ossidante Si + 4 Si -4 Il silicio, dando tutti gli elettroni esterni a più elementi EO, viene ossidato, passando in Si + 4; Prendendo 4 elettroni al suo livello di energia esterna, è ridotto a Si-4;

Proprietà fisiche del silicio Il silicio è un non-metallo, esiste in uno stato cristallino e amorfo. Il silicio cristallino è una sostanza di acciaio grigiastro con una lucentezza metallica, molto dura ma fragile. Silicio amorfo - polvere marrone. p = 2,33 g / cm 3; t pl. = C; t kip. = C;

Struttura cristallina del silicio Un reticolo cristallino di silicio è un tipo di diamante cubico centrato sul fronte. Ma a causa della maggiore lunghezza del legame tra Si-Si, la durezza del silicio è significativamente inferiore a quella del diamante. Il silicio è fragile, solo quando riscaldato sopra C.

elettro proprietà fisiche Silicio elementare Il silicio elementare è un tipico semiconduttore. tipico semiconduttore. Le proprietà elettrofisiche del silicio cristallino sono fortemente influenzate dalle tracce di impurità contenute in esso. Per ottenere monocristalli di silicio con conduttività di tipo p, gli additivi degli elementi del 3 ° gruppo di boro, alluminio, gallio e indio, con conduttività elettronica dell'additivo, vengono introdotti nel silicio elementi V gruppi di fosforo, arsenico o antimonio.


Flint Flint, questa pietra focaia, questa pietra brutta e molto brutta e molto resistente, pietra resistente, ha gettato le basi per un inizio di pietra dell'età della pietra - il secolo - il secolo di strumenti di lavoro in selce. strumenti di selce. Ci sono due ragioni: - la prevalenza e la disponibilità del silicio; - prevalenza e disponibilità di silicio; - la capacità di formare bordi taglienti affilati quando scheggiati; - la capacità di formare bordi taglienti affilati quando scheggiati;




Lo sai ... Il metodo per ottenere il silicio nella sua forma pura è stato sviluppato da Nikolai Nikolayevich Beketov. Il silicio in Russia viene prodotto nelle fabbriche: Kamensk - Uralsky (Regione di Sverdlovsk) Kamensk - Uralsky (Regione di Sverdlovsk) Shelekh (Regione di Irkutsk). Shelekh (regione di Irkutsk).

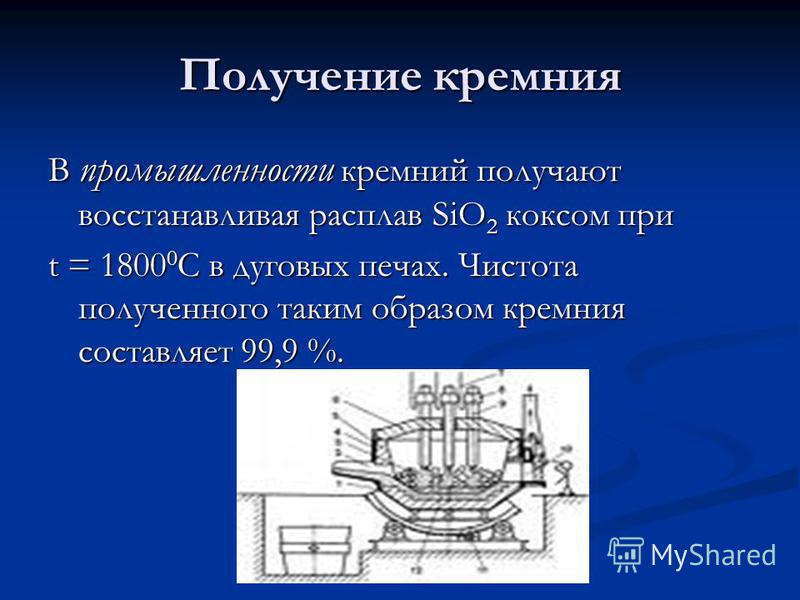
Produzione di silicio Nell'industria, il silicio si ottiene riducendo la fusione di SiO 2 per coke a t = C in forni ad arco. La purezza del silicio così ottenuta è del 99,9%.
Ottenimento del silicio Metodo di produzione in laboratorio: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Proprietà chimiche del silicio Quando riscaldato a 400 - C, il silicio reagisce con l'ossigeno per formare biossido di silicio: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
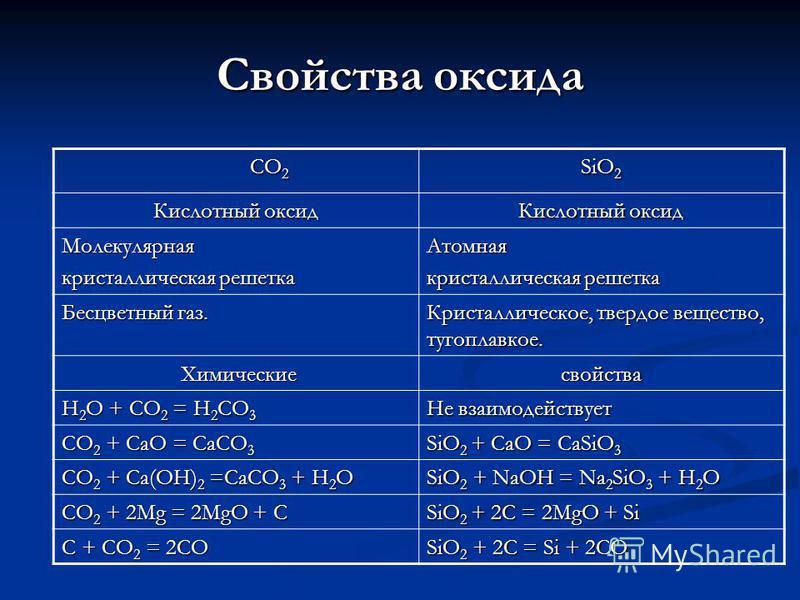
Proprietà di CO 2 CO 2 SiO 2 ossido Ossido acido Molecolare reticolo cristallino Atomico Gas incolore. Cristallino, solido, refrattario. Proprietà chimiche chimiche H 2 O + CO 2 = H 2 CO 3 Non reagisce CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Proprietà degli acidi H 2 CO 3 H 2 SiO 3 Dibasico, contenente ossigeno, debole, fragile, poiché pipistrello. Dibasico, contenente ossigeno, debole, insolubile in acqua. Ricezione: CO 2 + H 2 O = H 2 CO 3 Ricezione: SiO 2 + H 2 O = impossibile Instabile, fragile, si decompone in piedi o riscaldato: H 2 CO 3 = CO 2 + H 2 O Non può essere selezionato nella sua forma pura, perché si decompone quando riscaldato: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Evoluzione del gas minore __________

Acidi carbonici di acido silicico - carbonati; - idrocarburi; - silicati; - silicati; I carbonati hanno tutte le proprietà dei sali, sono elettroliti forti, si dissociano completamente in ioni (solubili in acqua). Solo i sali di metalli alcalini sono solubili, gli altri sono insolubili o non formano affatto sali (Al +3, Cr +3, Ag +).
![]()



Ruolo biologico Il più importante composto di silicio, SiO 2, è essenziale per la vita vegetale e animale. Grazie a lui, canne, canne Grazie a lui, canne, canne e equiseti si ergono saldamente come baionette. e gli equiseti stanno fermi, come le baionette. Foglie di carice affilate tagliate come foglie di carice affilate tagliate come coltelli, stoppie su coltelli da campo falciati, stoppie su un campo falciato punteggiano come aghi, e gambi di cereali attaccano come aghi, e gli steli dei cereali sono così forti che non permettono così forti che non permettere che il campo nei campi cada dalla pioggia e il campo di vento nei campi per andare dalla pioggia e dal vento


Il silicio è un oligoelemento che è costantemente contenuto nel corpo umano. La sua maggiore quantità è contenuta nei linfonodi, nel tessuto connettivo dell'aorta, nella trachea, nei capelli e nella pelle. Il silicio è necessario per costruire cellule epiteliali. Il silicio è un oligoelemento che è costantemente contenuto nel corpo umano. La sua maggiore quantità è contenuta nei linfonodi, nel tessuto connettivo dell'aorta, nella trachea, nei capelli e nella pelle. Il silicio è necessario per costruire cellule epiteliali. Il silicio svolge un ruolo importante nel processo di mineralizzazione delle ossa; necessario per mantenere l'elasticità della parete arteriosa, ha un effetto positivo sul sistema immunitario e rallenta il processo di invecchiamento nei tessuti del corpo umano. Il contenuto medio di silicio nel sangue è 8,25 mg / giorno. Con l'età, il suo livello nel corpo diminuisce, così negli anziani la necessità di silicio tende ad aumentare. Migliora l'assorbimento del silicio da parte del corpo la presenza di calcio, magnesio, manganese e potassio. Il silicio svolge un ruolo importante nel processo di mineralizzazione delle ossa; necessario per mantenere l'elasticità della parete arteriosa, ha un effetto positivo sul sistema immunitario e rallenta il processo di invecchiamento nei tessuti del corpo umano. Il contenuto medio di silicio nel sangue è 8,25 mg / giorno. Con l'età, il suo livello nel corpo diminuisce, così negli anziani la necessità di silicio tende ad aumentare. Migliora l'assorbimento del silicio da parte del corpo la presenza di calcio, magnesio, manganese e potassio.

Il ruolo biologico del silicio è anche incluso nella composizione degli organismi viventi inferiori - diatomee e radiolari - i grumi più delicati della materia vivente, che creano i loro scheletri di bellezza insuperati fatti di silice. Il silicio è anche parte degli organismi viventi inferiori - diatomee e radiolari - i grumi più delicati della materia vivente, che creano la loro insuperata bellezza di scheletri di silice. Diatomee Radiolaria Autocontrollo 1. Qual è il posto del silicio nel sistema periodico: a) 2 periodi, 4 og. b) 3 periodi, 3 gr. capitolo. c) 3 periodi, 4 gr. capitolo) 2 periodo, 4 gr. b) 3 periodi, 3 gr. capitolo. c) 3 periodi, 4 gr. capitolo. 2. Reticolo di silicio: a) ionico; b) atomico; c) molecolare; a) ionico; b) atomico; c) molecolare; 3. Secondo la prevalenza in natura del silicio ... elemento: a) prima; b) il secondo; c) il terzo; a) il primo; b) il secondo; c) il terzo; 4. Il silicio reagisce con: a) metalli, idrogeno, alogeni; a) metalli, idrogeno, alogeni; b) metalli, alogeni, facilmente solubili in alcali; b) metalli, alogeni, facilmente solubili in alcali; c) ossidi, acidi, non metalli. c) ossidi, acidi, non metalli. 5. Sali di acido silicico: a) siliciuri; b) idrosilicati; c) silicati; a) siliciuri; b) idrosilicati; c) silicati;

Silicon.
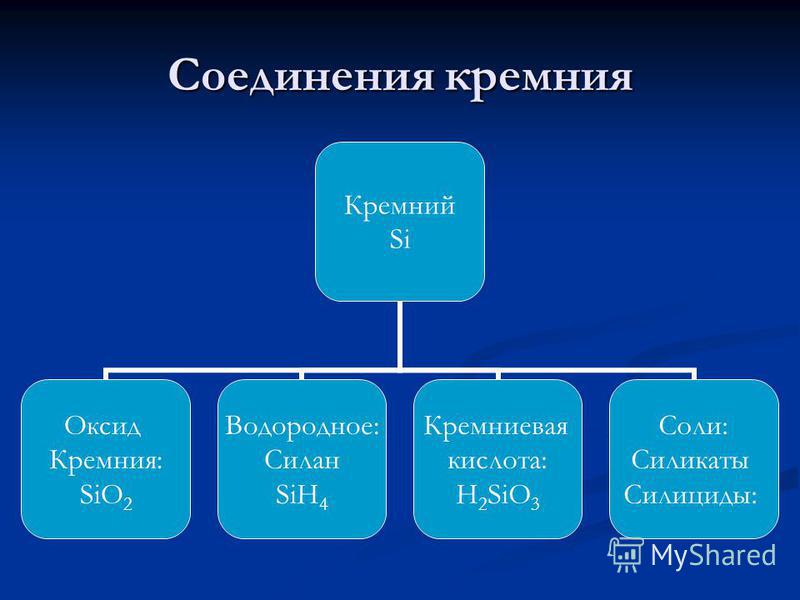
silicio - un elemento del sottogruppo principale IV del gruppo del 3o periodo del sistema periodico di elementi chimici DI Mendeleev, con numero atomico 14, massa atomica: 28,0855. Nei composti, di solito mostra un grado di ossidazione di +4 (valenza IV) e molto raramente +3, +2 e +1 (valenze, rispettivamente, III, II e I). Nella tavola periodica, il silicio di Mendeleev si trova nel gruppo IVA (A: indica che questo è il sottogruppo principale) (nel gruppo carbonio), nel terzo periodo. metalloide . Denotato dal simbolo Si(lat. Silicio). In forma libera - polvere marrone o materiale compatto grigio chiaro con una lucentezza metallica. Struttura reticolare: cubico, diamante.
Stato principale: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, elemento-p.
2. Proprietà fisiche.
Il silicio cristallino è una sostanza grigio scuro con una lucentezza d'acciaio. La struttura del silicio è simile alla struttura del diamante. Nel suo cristallo, ogni atomo è circondato da altri quattro tetraedrici ed è collegato con loro da un legame covalente, che è molto più debole che tra gli atomi di carbonio in un diamante. In un cristallo di silicio, anche in condizioni normali, alcuni dei legami covalenti vengono distrutti. Pertanto, ha elettroni liberi, che causano una piccola conduttività elettrica. Quando si accende e si riscalda aumenta il numero di legature rotte, il che significa che aumenta il numero di elettroni liberi e aumenta la conduttività elettrica. Quindi dovrebbe spiegare le proprietà dei semiconduttori del silicio.
Il silicio è molto fragile, la sua densità è 2,33 g / cm3. Come il carbone, si riferisce alle sostanze refrattarie.
Il silicio è costituito da tre isotopi stabili: 2814Si (92,27%), 2914Si (4,68%) e 3014Si (3,05%).
3. Essere nella natura.
Molto spesso in natura, il silicio si trova nella forma silice - composti a base di biossido di silicio (IV) SiO2 (circa il 12% della massa della crosta terrestre). I principali minerali e rocce formati dal biossido di silicio sono sabbia (fiume e quarzo), quarzo e quarzite, selce e feldspato. I silicati naturali hanno una composizione e una struttura complesse. Ecco la composizione di alcuni silicati naturali:
ü feldspato K 2 O × Al 2 O 3 × 6SiO 2,
ü amianto 3MgO × 2SiO 2 × 2H 2 O,
ü mica K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü kaolinite 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
Il secondo gruppo più comune in natura di composti di silicio è silicati e allumino-silicati.
Sono noti fatti singoli di ricerca di silicio puro nella forma nativa.
4. Proprietà chimiche del silicio e dei suoi composti.
su proprietà chimiche il silicio, come il carbonio, è un non-metallo, ma il suo non-metallo è meno pronunciato, poiché ha un raggio atomico più grande. Poiché gli atomi di silicio hanno 4 elettroni sul livello di energia esterna, lo stato di ossidazione di -4 e +4 è tipico per il silicio (un composto di silicio è noto, dove il suo stato di ossidazione è +2).
Il silicio in condizioni normali è piuttosto inerte, il che dovrebbe essere spiegato dalla forza del suo reticolo cristallino. Interagisce direttamente solo con fluoro:
acidi (eccetto miscela di HF fluorurrico e HNO 3 nitrico)il silicio non agisce. Tuttavia, si dissolve in idrossidi di metalli alcalini, formando silicato e idrogeno:
Delle due modifiche allotropiche del silicio, cristallino e amorfo, il silicio amorfo è più chimicamente attivo. Lui reagisce con ossigeno quando riscaldato, formando SiO 2:
così come con tutto alogeniper esempio:
![]()
A temperatura elevata il silicone si connette con carbonioformando il carborundum SiC:
Il carborundum ha un reticolo cristallino simile al diamante, in cui ogni atomo di silicio è circondato da quattro atomi di carbonio e viceversa, e i legami covalenti sono molto forti, come nel diamante. Pertanto, nella durezza è vicino al diamante. Le mole e le mole sono realizzate in carburo di silicio.
Magnesio siliciuro. Nelle reazioni con metalli attivi, che si verificano con la formazione di siliciuro, Il silicio agisce come un agente ossidante:
Ad alte temperature, il silicio recupera molti metalli dai loro ossidi. (!!!)
Silano. Sotto l'azione dell'acido cloridrico sui siliciuri, il più semplice composto di idrogeno del silicio è silano SiH 4:
Il silano è un gas velenoso con un odore sgradevole, autoinfiammabile all'aria (!!!):
Ossido di silicio (IV).Viene anche chiamato l'ossido di silicio (IV) silice. È una sostanza refrattaria solida. (punto di fusione 1700 ° C) diffuso in natura in due forme:
1) silice cristallina - sotto forma di un minerale di quarzo e sue varietà (cristallo di rocca, calcedonio, agata, diaspro, pietra focaia); il quarzo costituisce la base delle sabbie di quarzo ampiamente utilizzate nella costruzione e industria dei silicati;
2) silice amorfa - nella forma della composizione minerale opalina SiO 2 × n H 2 O; le forme terrene di silice amorfa sono diatomite, tripoli (terra infusoriale); un esempio di silice amorfa artificiale amorfa è il gel di silice, che è ottenuto dal metasilicato di sodio:
Il gel di silice ha una superficie sviluppata e quindi assorbe bene l'umidità. .
Al 1710 ° il quarzo si scioglie. Con il rapido raffreddamento della massa fusa si forma vetro al quarzo . Ha un coefficiente di espansione molto basso, quindi il vetro al quarzo caldo non si incrina quando l'acqua viene rapidamente raffreddata. Vetreria da laboratorio e strumenti per la ricerca scientifica sono realizzati in vetro di quarzo.
La formula più semplice di ossido di silicio (IV) SO 2 è simile alla formula di monossido di carbonio (IV) CO 2. Nel frattempo, le loro proprietà fisiche sono molto diverse (SiO 2 - solido, CO 2 - gas). Questa differenza è dovuta alla struttura dei reticoli cristallini. C0 2 cristallizza nel reticolo molecolare, SiO 2 - nell'atomico. La struttura di SiO 2 in un'immagine planare può essere rappresentata come segue:
Il numero di coordinazione di un atomo di carbonio in CO 2 solido è 2, e il silicio in SiO 2 è 4. Ciascun atomo di silicio è racchiuso in un tetraedro di 4 atomi di ossigeno. Allo stesso tempo, l'atomo di silicio è al centro e gli atomi di ossigeno si trovano ai vertici del tetraedro . L'intero pezzo di silice può essere considerato un cristallo la cui formula è (SiO 2) n. Questa struttura di ossido di silicio (IV) determina la sua elevata durezza e refrattarietà .
Proprietà chimiche dell'ossido di silicio (IV) SiO 2 si riferisce agli ossidi acidi. Quando si fondono con alcali solidi, ossidi basici e carbonati, si formano sali di acido silicico:
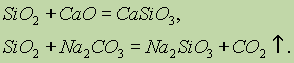
Solo l'acido fluoridrico interagisce con l'ossido di silicio (IV):
Questa reazione è usata per incidere il vetro. .
Il silicio (IV) non si dissolve in acqua e non interagisce chimicamente con esso. (!!!) Pertanto, l'acido silicico è ottenuto indirettamente agendo con un acido su una soluzione di potassio o silicato di sodio:
In questo caso, l'acido silicico (a seconda della concentrazione delle soluzioni iniziali di sale e acido) può essere ottenuto sia sotto forma di una massa gelatinosa contenente acqua, sia sotto forma di una soluzione colloidale (sol).
Acido silicico SiO 2 è l'anidride di un certo numero di acidi silici, la cui composizione può essere espressa dalla formula generale: xSiO 2 × yH 2 O, dove x e y - interi:
1) x = 1, y = 1: SiO 2 × H 2 O, cioè H 2 SiO 3 - acido metasilicico;
2) x = 1, y = 2: SiO 2 × 2H 2 O, cioè H 4 SiO 4 - acido ortosilicico;
3) x = 2, y = 1: 2SiO 2 × H 2 O, cioè H 2 Si 2 O 5 - acido bimetacrynico.
L'acido silicico è costruito da unità strutturali tetraedriche (in ciascuna di queste unità l'atomo di silicio si trova nel centro del tetraedro e ci sono degli atomi di ossigeno nelle parti superiori). I collegamenti strutturali, uniti in catene, formano acidi polisilicici più stabili:
La composizione di tali composti può essere espressa dalla formula (H 2 SiO 3) n. Tuttavia, solitamente l'acido silicico è rappresentato dalla formula H 2 SiO 3. H 2 SiO 3 - l'acido è molto debole, poco solubile in acqua. Quando riscaldato si decompone facilmente come l'acido carbonico:
Tutti gli acidi silicici sono molto deboli (più deboli del carbone).
Silicati. I sali di tutti gli acidi silicici sono chiamatisilicati, sebbene, di regola, nella letteratura educativa, i silicati implichino sali dell'acido metacrilico. La loro composizione è solitamente rappresentata dalla formula sotto forma di composti di ossidi di elementi. Ad esempio, il calcio silicato CaSiO 3 può essere espresso come: CaO × SiO 2.
I silicati della composizione R 2 O × nSiO 2, dove R 2 O - ossidi di sodio o di potassio , sono chiamati vetro solubile , e le loro soluzioni acquose concentrate - vetro liquido . Il bicarbonato di sodio è il più importante..
Quando si trovano in aria, le soluzioni dei silicati si sviluppano torbide, poiché l'anidride carbonica (IV) nell'aria allontana l'acido silicico dai suoi sali:
L'acido silicico è praticamente insolubile in acqua - questa proprietà viene utilizzata come reazione qualitativa allo ione SiO 3 2-.
I silicati si ottengono fondendo la silice con alcali o carbonati:
5. Scoperta dello ione SiO 3 2. (Non riesco a trovare nulla ...)
6. Il ruolo dei composti di silicio nella formazione del suolo e nella silvicoltura.
Le rocce ignee sono abbastanza stabili nella loro composizione e contengono principalmente composti di silicio, alluminio, ferro, alcali, magnesio e calcio. Secondo il contenuto di Si0 2, le rocce ignee sono suddivise in quattro gruppi: acido (\u003e 65%), medio (52-65%), basico (40-52%) e ultrabasico (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Rocce ignee acide- graniti, pegmatiti, rioliti, daciti e altri - di solito hanno un colore chiaro e brunastro con cristalli pronunciati di quarzo, feldspato, mica. Il contenuto di SiO 2 in essi è elevato (oltre il 65%) con una quantità significativa di potassio e sodio. Allo stesso tempo, ferro da stiro e calcio e magnesio sono trascurabili. Suoli su rocce ignee acide, ad esempio, su graniti, si differenziano nelle prime fasi di invecchiamento per friabilità, carattere ghiaia del materiale sorgente. Se esposto alle intemperie, perdono facilmente elementi di terra alcalina, in conseguenza dei quali il terreno su tali substrati alterati (eluvium di rocce) è estremamente povero, scarsamente fertile.
Principali rocce ignee -basalto, gabbro, ecc., di regola, hanno un colore scuro (al nero). Sono caratterizzati da un minor contenuto di SiO 2 rispetto alle rocce acide. Le rocce ignee principali sono relativamente ricche in composti di ferro, manganese, cromo, cobalto, zinco, titanio, nichel, rame. I prodotti dei loro agenti atmosferici acquisiscono rapidamente un carattere di argilla, mantengono a lungo una reazione alcalina e neutra e si distinguono per un maggiore contenuto di humus e minerali argillosi. Il terreno su tali rocce è più fertile.
Oltre alle specie acide e basiche si trovano spesso rocce ignee di tipo transitorio(medio) - rocce intrusive del gruppo diorite e le loro controparti effusive - andesiti. Di conseguenza, i terreni su queste rocce acquisiscono caratteristiche simili a quelle limitate a rocce acide o basiche. Molto meno comune razze ultrabasiche:peridotiti e picriti, che hanno il minor contenuto di SiO 2.
Rocce metamorfiche -transitorio tra massicce rocce cristalline e sedimentarie. Le antiche rocce sedimentarie in immersione, alta pressione e temperature sono metamorfosate, formando gneiss, serpentiniti, marmi, quarziti, scisti. Gli gneiss sono particolarmente simili nella composizione ai graniti. I terreni che si formano su tali rocce hanno caratteristiche simili ai terreni delle rocce ignee acide stesse.
Cloro.
1. La posizione dell'alluminio nel tavolo DI Mendeleev. La struttura dell'atomo, manifestato grado di ossidazione.
cloro - un elemento del sottogruppo principale del gruppo VII, il 3 ° periodo, con numero atomico 17. Esso è indicato dal simbolo Cl (lat Chlorum). Chimicamente attivo metalloide . Incluso nel gruppo alogeno .
Cloro semplice sostanza in condizioni normali - gas velenoso di colore giallo-verde è più pesante dell'aria, con un forte odore . Molecola di cloro biatomico (formula Cl 2).
Stato principale: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, elemento-p. Art.: -1 +1 +3 +5 +7.
La struttura del guscio dell'elettrone.
Al livello di valenza dell'atomo di cloro contiene 1 elettrone spaiato : 1s 2 2s 2 2p 6 3s 2 3p 5, quindi la valenza di 1 per un atomo di cloro è molto stabile. A causa della presenza nell'atomo di cloro degli orbitali non occupati del d-sottolivello, l'atomo di cloro può mostrare altri gradi di ossidazione. Schema di formazione di stati eccitati dell'atomo:
Sono anche noti composti di cloro in cui l'atomo di cloro esibisce formalmente valenza 4 e 6, ad esempio ClO 2 e Cl 2 O 6. Tuttavia, questi composti sono radicali, cioè hanno un elettrone spaiato.
2. Proprietà fisiche.
In condizioni normali, il cloro è un gas giallo-verde con un odore soffocante. Alcune delle sue proprietà fisiche sono presentate di seguito.
Densità: 3,214 g / l, liq. - a -35 ° C - 1,555, TV. a -105 0 С- 1,9 g / cm 3.
Punto di fusione: 172,2 K
Punto di ebollizione: 238,6 K
Calore di fusione: 6,41 kJ / mol
Calore di evaporazione: 20,41 kJ / mol.
Il gas di cloro è relativamente facile da liquefare. A partire da una pressione di 0,8 MPa (8 atmosfere), il cloro sarà liquido già a temperatura ambiente. Quando viene raffreddato a una temperatura di -34 ° C, anche il cloro diventa liquido alla normale pressione atmosferica. Il cloro liquido è un liquido giallo-verde con un effetto corrosivo molto elevato (dovuto ad un'alta concentrazione di molecole). Aumentando la pressione, è possibile ottenere l'esistenza di cloro liquido fino a una temperatura di +144 ° C (temperatura critica) a una pressione critica di 7,6 MPa. In termini di conduttività elettrica, il cloro liquido ha luogo tra gli isolanti più forti: conduce corrente quasi un miliardo di volte peggio dell'acqua distillata e 10 volte peggio dell'argento. La velocità del suono nel cloro è circa una volta e mezza inferiore a quella dell'aria.
3. Essere nella natura.
In natura, ci sono due isotopi di cloro 35 Cl e 37 Cl. Il cloro è l'alogeno più comune nella crosta terrestre. . Il cloro è molto attivo - si collega direttamente con quasi tutti gli elementi del sistema periodico. Pertanto, in natura, si trova solo sotto forma di composti nella composizione dei minerali:
ü halite NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl 2 · 6H 2 O,
ü carnallite KCl · MgCl 2 · 6H 2 O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
Le maggiori riserve di cloro sono contenute in sali, acque, mari e oceani (il contenuto in acqua di mare è di 19 g / l). Il cloro rappresenta lo 0,024% del numero totale di atomi nella crosta terrestre; numero di clarke (numeri che esprimono il contenuto medio di elementi chimici nella crosta terrestre, nell'idrosfera, nella Terra, nei corpi spaziali, nei sistemi geochimici o cosmochimici, ecc., relativi alla massa totale di questo sistema.È espressa in% o in g / kg.) cloro - 0,017%. Il corpo umano contiene lo 0,25% di ioni di cloro in peso. Negli uomini e negli animali, il cloro si trova principalmente nei fluidi intercellulari (compreso il sangue) e svolge un ruolo importante nella regolazione dei processi osmotici, nonché nei processi associati al lavoro delle cellule nervose.
4. Proprietà chimiche del cloro e dei suoi composti. Ottenere cloro
La struttura dell'atomo di silicio. Si. 14. Stato eccitato E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Foto 3 della presentazione "Silicon" alle lezioni di chimica sul tema del "silicio"Dimensioni: 960 x 720 pixel, formato: jpg. Per scaricare un'immagine gratuita per una lezione di chimica, fare clic con il tasto destro sull'immagine e fare clic su "Salva immagine con nome ...". Per mostrare le immagini della lezione, puoi anche scaricare gratuitamente la presentazione di "Silicon.ppt" con tutte le immagini in un archivio zip. Dimensione dell'archivio: 562 KB.
Scarica la presentazionesilicio
"Il silicio e i suoi composti" - La struttura e le proprietà degli atomi. Semiconductor. t melt (Si) = 1415? C, t melt (diamante) = 3730? C. Ottenere silicio. La scoperta del silicio. Incluso anche nella composizione di piante e animali. Le proprietà fisiche del silicio. Quindi, il mattone è ceramica, e le piastrelle ei frammenti dell'antica anfora greca sono anche ceramiche. Obiettivi: proprietà chimiche del silicio.
"Composti di silicio": il silicio e i suoi composti. Proprietà chimiche di SiO2. Silano. Ottenere acido silicico. Proprietà del silicio. Ossido di silicio Silicati naturali Stato di ossidazione Strass. Topaz. Ottenere il silicio in laboratorio. Essere nella natura. Reticoli cristallini La scoperta del silicio. Ametista. Ottenere silicio.
"Isotopi di silicio" - Separazione degli isotopi di silicio. Produzione di silicio policristallino. Prospettive per l'uso del silicio monoisotopico. Diluizione isotopica durante la crescita di un singolo cristallo da un crogiolo di quarzo. Produzione di semi di cristallo singolo. Dipendenza dalla posizione del massimo della banda Raman sulla massa atomica.
"Lezione di silicio" - Quale degli elementi chimici più importanti nella natura vivente e non vivente? Ossidi di carbonio e silicio. La sostanza è trasparente Sulla manifestazione di proprietà non metalliche e metalliche. Riassumendo il riflesso. Test finali Ossidi di carbonio e idrossidi di silicio? Lo stato di aggregazione: a) liquido, b) gas, c) solido.
"Silicio": il silicio è una sostanza semplice. Proprietà fisiche Ossido di silicio (IV). Siliciuri. Significato per gli organismi viventi. Interazione con metalli Interazione con non metalli. Carburo di silicio. Silicio in natura. Silicon. Prodotti dell'industria dei silicati. Uno dei tipi di composti di silicio naturale è il silicato.
"Carbonio e silicio" - Ossido di silicio (IV). Elementi del gruppo IV del sottogruppo principale. Tossicità. 7. Interessante per il carbonio. Silicati. Slip al tatto. Il diamante è la sostanza naturale più dura. Proprietà chimiche Più del 99% del carbonio nell'atmosfera è sotto forma di anidride carbonica. Carburi. 6. Applicazione. Uno dei più morbidi tra i solidi.
Ci sono 6 presentazioni in totale.
