Visoka koncentracija silicija. Ti znaš kako
Procesor? Pisok? A što imate s asocijacijama na riječ? Ili možda Silicijska dolina?
Kao da ga nije bilo, sa silikonom se danas držimo, a ako trebate znati, što je Si i zašto jedete, pitam za mačku.
Ulazak
Budući da sam student jednog od moskovskih sveučilišta na specijalnosti "Nanomaterijali", želim te upoznati, dragi čitatelju, s najvažnijim kemijskim elementima našeg planeta. Dugo sam nešto birao, ugljen ili silikon, a ipak sam odlučio koristiti Si, tako da je srce svakog modernog gadgeta bazirano na njemu samom, tako da možete reći tako sjajno. Pokušat ću svoje misli učiniti krajnje jednostavnim i pristupačnim, nakon što sam napisao ovaj materijal, spremio sam ga, uglavnom na početnike, ali sve više i više ljudi to može dobiti od cicave, pa bih želio reći da je članak napisan isključivo za širenje interesa, što je zapelo. I zato počnimo.
Silicij
Silicij (lat. Silicium), Si, kemijski element IV skupine Mendeljejeva periodnog sustava; atomski broj 14, atomska težina 28.086.
U prirodi je element predstavljen s tri stabilna izotopa: 28Si (92,27%), 29Si (4,68%) i 30Si (3,05%).
Debljina (n.s.) 2,33 g/cm?
Talište 1688 K

Prah Si
Povijesni dokaz
Brda od Silicija, široke zemlje, bulevari ljudi iz kamenog doba. Bilo je na tisuće papalina kamena i zalijevanje kamena. Zastosuvannya spoluk Silicij, vezan uz njihovu obradu, - priprema skladišta - započeo je oko 3000. pr. e. (Stari Egipat). Ranije u kući korišten je silicij - oksid SiO2 (silicijev dioksid). U 18. stoljeću silicijev dioksid je ubrizgan jednostavnim tijelom i nošen u "zemlje" (što se koristi u njegovom nazivu). Skladníst u skladište silicijevog dioksida nakon instaliranja Í. I. Berzelius. Vín isto vpershe, 1825. godine, uklonivši elementarni silicij iz silicijevog fluorida SiF4, zamjenjujući preostali metalni kalij. Novi element nazvan je "silicij" (lat. silex - kremen). Rusko ime vvív G. I. Hess kod 1834 roci.

Silikonski luk ekstenzija u prirodi u skladištu zvučnog zvuka
Širenje silicija u prirodi
Za širinu u zemljinoj kori, silicij je drugi (nakon kiselog) element, njegov prosjek u litosferi je 29,5% (iza mase). Zemljina kora, Silicijska siva, ima istu primarnu ulogu, poput ugljena zemaljskog svijeta stvorenja. Za geokemiju silicija važno je, posebice, da je važna veza između yoga i kiselog. Blizu 12% litosfere postaje silicijev dioksid SiO2 u obliku minerala kvarca i raznih varijanti. 75% litosfere sastoji se od raznih silikata i aluminosilikata (polova, tinjac, amfibol toshcho). Ukupan broj minerala, koji se mogu zamijeniti silicijem, prelazi 400.
Fizička snaga silicija
Mislim da posebno nije varto, to je sve Fizička snaga Imam slobodan pristup, ali ću navesti one najčešće.
Vrelište 2600 °C
Silikonski prozor za dovgokhvilovyh ÍCh-promenív
Dielektrična penetracija 11.7
Mohsova tvrdoća silicija 7,0
Želio bih reći da silicijski tenditni materijal, komemorativna plastična deformacija počinje na temperaturama višim od 800°C.
Silicij je dirigent, isto vino znamo puno zastosuvannya. Električna snaga silicija može ležati u kući.
Kemijska moć.
Ovdje je bogato, nevjerojatno je, moglo bi se reći, ali ja sam naletio na ono najpoznatije. U policama Si (slično ugljiku) 4-valentni.
Na površini silicijskog zavdyaka, taljenje oksida je stabilno na vjetar na povišenim temperaturama. U kiselini oksidira na 400 °C, otapajući silicijev oksid (IV) SiO2.
Silicij otporan na kiseline i manje je vjerojatno da će se pomiješati s dušičnom i fluorovodičnom kiselinom, lako se razlikuje na vrućim livadama od vode.
Silicij čini 2 skupine kiselih silana - siloksan i siloksenij. Silicij reagira s dušikom na temperaturama iznad 1000 °C. vrijedan je materijal za kemijsku industriju, kao i za proizvodnju aparata za gašenje požara. Visoka tvrdoća, kao i toplinska i kemijska otpornost, tretirani su podovima od silicij karbida (silicijev karbid SiC) i bora (SiB3, SiB6, SiB12).
Otrimanya silicij
Mislim da tse naytsíkavísha dio, ovdje je izvješće.
Ugarska vrsta priznanja dijeli se na:
1.
Silicijska elektronička snaga(t.z. elektronički silicij"") - najsilikoniji silicij iz silicijske magle preko 99,999% iza zida, električna potpora elektroničke kvalitete silicija može se mijenjati u intervalu od približno 0,001 do 150 ohm cm, ali s kojom vrijednost potpore je kriv ali je osigurana all-inclusive kuća, tako da možete ući u kristalnu tuđu kuću, želeći se brinuti o zadacima vrtića električnog opira, zvoni, neprihvatljivo.
2.
Silicij sony kvaliteta(t.z. "sonyachny silicon") - silicij iz miješanog silicija preko 99,99% po vlaknu, koji se koristi za proizvodnju fotoelektričnih pretvarača (zvučnih baterija).

3.
Tehnički silicij- blokovi polikristalne strukture silicija, uzeti metodom karbotermne obnove iz čistog kvarcno škripanje; pokrov s 98% silicija, glavna kuća je ugljen, prozračena je velikom količinom lakih elemenata - bor, fosfor, aluminij; uglavnom se zamjensko koristi za posjedovanje polikristalnog silicija.
Silicij tehničke čistoće (95-98%) posjeduje električne udare inspiriranog silicija SiO2 između grafitnih elektroda. U vezi s razvojem nap_v_dnikovoí̈ tehníko razrobleno metode dobivanja čistog i posebno čistog silicija. Radi napredne sinteze čistog vih_dnih spoluk silicija, z yakikh vityagyat silíkí vídnovlennya vídnovlennya abo termíchnogo razkladannya.
Polikristalni silicij ("polisilicij") - najčišći oblik silicija, koji je komercijalno isplativ, - proizvod koji se koristi za pročišćavanje tehničkog silicija kloridnim i fluoridnim metodama i pobjednik je za proizvodnju mono- i multikristalnih silicij.
Tradicionalno, polikristalni silicij se uklanja iz tehničkog silicija putem prijenosa joge u slavine silana (monosilana, klorosilana, fluorosilana) s ofenzivnim dnom silana, koji se talože, rektificiranim pročišćavanjem pretvorenog silana i obnavljanjem silana u metalni silicij .
Vodiči od čistog silicija dobivaju se u dvije vrste: polikristalni(ojačanje SiCl4 ili SiHCl3 cinkom ili vodom, toplinsko širenje SiI4 i SiH4) i monokristalni(Zonsko taljenje bez lončića i "namatanje" monokristala iz rastaljenog silicija - metoda Czochralsky).

Ovdje možete koristiti metodu Czochralskog za vibriranje silicija.
Metoda Czochralskog- metoda vibriranja kristala s putanjom vijuganja uz brdo u zraku na površini velike obveze taljenja s pokretanjem klipa kristalizacije s putanjom dovođenja klica kristala (ili velikog broja kristala) ) dane strukture i kristalografske orijentacije atsíí u kontaktu sa slobodnom površinskom talinom.
Zastosuvannya silicij
Posebno legirani silicij naširoko se koristi kao materijal za pripremu električnih vodiča (tranzistori, termistori, energetski vibratori, tiristori; sony fotoćelije koje se koriste u svemirskim letjelicama, kao i puno svega).
Krhotine silikonske prosorije za promjenu od dugih dlačica veličine od 1 do 9 mikrona, mogu se postaviti u infracrvenu optiku.
Silicij može biti različit i sva područja zastosuvannya, koja se šire. U metalurgiji Si
koristi se za uklanjanje kiselosti (deoksidacije) iz rastaljenih metala.
Silicij skladište veliki broj legura holovih i obojenih metala.
Zvučne legure silicija za povećanje otpornosti na koroziju, poboljšanje njihove čvrstoće i povećanje mehaničke čvrstoće; prote s većom zmistí Silicij može viklikati kryhkíst.
Najvažnije su legure, legure bakra i aluminija, koje se mogu koristiti za osvetu pojaseva.
Silicij se prerađuje staklenim, cementnim, keramičkim, električnim i drugim industrijskim galjevima.
Čišćenje silikonom važno je za proizvodnju pojedinačnih elektroničkih uređaja (na primjer, procesora vašeg računala) i mikro krugova s jednim čipom.
Čisti silicij, koristi se za čisti silicij, pročišćavanje metalurškog silicija jer je kristalni silicij glavna sirovina za sony energiju.
Monokristalni silicij - krema elektronike i sony elektronike koristi se za izradu zrcala plinskih lasera.

Silicij za čišćenje i proizvod joge
Silicij u tijelu
Silicij u tijelu nalazi se u očima raznih spoluka, koji sudjeluju u vodećoj poziciji u osvjetljavanju tvrdih skeletnih dijelova i tkiva. Osobito bogate silicijem mogu akumulirati ostatke morskih algi (na primjer, dijatomejske alge) i stvorenja (na primjer, spužve silicijskog roga, radiolarije), koje su u vrijeme oceana na dnu oceana otvrdnute naslagama silicijevog oksida. (IV). U hladnim morima i jezerima važniji su biogeni mazgi, bogati silicijem, au tropskim morima vaping mazge s niskim sadržajem silicija. Trave, šaš, palme i preslice nakupljaju mnogo silicija usred kopnenih rastinja. U bićima okosnice, umjesto silicij (IV) oksida, u rijekama pepela 0,1-0,5%. U najvećem broju pojava silicija u alkalnom sretna tkanina, nirkah, pidshlunkovy svod. U dopunskoj prehrani ljudi imaju do 1 g silicija. Visokim unosom silicijevog (IV) oksida u zrak, on se troši u legeniju čovjeka što uzrokuje bolest - silikozu.
Visnovok
Pa od svega, ako ste pročitali do kraja i malo pronikli, onda ste malo bliži uspjehu. Ja spodívayus, pisanje sam ne za ništa i píst vouchsafed to hoch komu. Za poštovanje.
SILIKON. (Silicij), Si - kem. element IV skupine periodnog sustava elemenata; na. n. 14, na. m. 28.086. Kristalni silicij-tamno sivi govor sa smolastim sjajem. U većini slučajeva otkriva se stupanj oksidacije - 4, +2 i +4. Prirodni silicij sastoji se od stabilnih izotopa 28Si (92,28%), 29Si (4,67%) i 30Si (3,05%). Povlačenje radioaktivnih izotopa 27Si, 31Si i 32Si s periodima reverznog raspada od 4,5 sekundi, 2,62 godine i 700 godina. prvi put viđen 1811. francuski. kemičar i fizičar J. L. Gay-Lussac i franc. kemičar L. J. Tenar, no ima manje identifikacija 1823. godine Šveđanin, kemičar i mineralog J. Ya. Berzelius.
Za širinu u zemljinoj kori (27,6%), silicij-drugi (nakon kiselog) element. Znati je važno. u obliku kremena Si02 i drugih kiselih govora (silikati, alumosilikati i dr.). Za najbolje umove uspostavljena je stabilna modifikacija salvete, koja ima kubičnu strukturu usmjerenu na lice poput dijamanta, s periodom od a = 5,4307 A. Isprekidano prodiranje je 2,35 A. Širina je 2,328 gcm. S visokim tlakom (120-150 kbar) idite na veće žice i metalne modifikacije. Metalna modifikacija-supravodič s temperaturom prijelaza od 6,7 K. S povećanjem tlaka talište opada od 1415 ± 3 °C pri tlaku od 1 bara do 810 °C pri tlaku od 15,104 bara rijetko). ). Kada se tali, dolazi do povećanja koordinacijskog broja i metalizacije međuatomskih veza. Amorfni silicijski karakter kratkog dometa, koji pokazuje snažno stvorenu kubičnu strukturu s središtem na volumenu, blizu rijetkosti. Debijevska t-ra je blizu 645 K. Koef. temperatura linearnog širenja mijenja se s promjenom t-ri prema ekstremnom zakonu, niže od t-ri 100 To vino postaje negativno, dostižući minimum (-0,77 10 -6) deg -1 pri t-ri 80 K; pri t-rí 310 K vino iznosi 2,33 10-6 deg-1, a pri t-rí 1273 K-4,8 10 deg-1. Toplina taljenja 11,9 kcal/g-atom; tkíp.3520 K.
Toplina sublimacije i isparavanja pri temperaturi taljenja je 110 i 98,1 kcal/g-atom. Toplinska vodljivost i električna vodljivost silicija leže u čistoći i temeljitosti kristala. Zí rostannyam t-ri coef. toplinska vodljivost čistog K. postupno raste (do 8,4 cal / cm X X sec deg pri t-ri 35 K), a zatim se mijenja, dosežući 0,36 i 0,06 cal / cm sec deg pri t-ri vídpovidno 300 i 1200 K. Entalpija, entropija i toplinski kapacitet K. u standardnim umovima, jednak je 770 cal/g-atom, 4,51 i 4,83 cal/g-atom - deg. Silicij dijamagnetik, magnetska osjetljivost čvrste tvari (-1,1 10 -7 mu/g) i rijetke (-0,8 10 -7 mu/g). Silicij je slabo taložen u t-ri. Površinska energija, debljina i kinematička viskoznost rijetkih K. pri temperaturi taljenja postaju 737 erg/cm2, 2,55 g/cm3 i 3 10 m2/sek. Tipični kristalni silicijski vodič sa širinom ograđene zone od 1,15 ev pri t-p 0 do 1,08 u - pri t-p 300 K. Na sobnoj temperaturi, koncentracija mokrih nosivih naboja je blizu 1,4 10 10 cm - 3;
Moć silicija pada zbog prirode i koncentracije kuća, kao i do savršenstva kristala. Prsten za otrimannya napívprovídnikovogo Do. s provođenjem r- i n-tipa yoge, oni se kombiniraju s elementima IIIb (bor, aluminij, galij) i Vb (fosfor, mish'yak, antimon, bizmut) podskupinom, koji stvaraju sukupníst vídpovídno na akceptor i donor rívní u , roztashovannyh u blizini kordona zona. Za legiranje vicorista, oni drugi elementi (na primjer,) su oblikovani tako. glybokí rivní, yakí obumovlyuyut ukopavanje i rekombinacija nosesíív optužbi. Tse vam omogućuje da uzmete materijale s visokim elektro. potporu (1010 ohm cm pri t-rí 80 K) tu malu trivalnost baze manjih troškova trošenja, što je važno za povećanje broja različitih gospodarskih zgrada. Koeficijent termoelektrična energija sa silicijem samo se taloži u t-ri i na mjestu kuće, zbílshyuyuchi zí zrostannym elektroopor (na p = 0,6 ohm - cm, a = 103 mikrovolta / tuča). Dielektrična penetracija silicija (víd 11 do 15) je slabo taložena u skladištu i temeljitost monokristala. Zakoni optičkog glinenja silicija uvelike se mijenjaju zbog promjene u čistoći, koncentraciji i prirodi nedostataka u životu, kao i dugovječnosti.
Kordon neizravne gline elektromagnetskog kolivana je blizu 1,09 eura, izravne gline - do 3,3 eura. U vidljivom području spektra parametara kompleksnog pokazatelja loma (n - ik) već se može nalaziti na površini kuće. Za posebno čisti Do. (naλ \u003d 5461 A i t-re 293 K) n \u003d 4,056 i k \u003d 0,028. Izlaz robota elektronike je blizu 48 eura. Silikonski trend. Yogo tvrdoća (t-ra 300 K) za Moos - 7; HB = 240; HV y \u003d 103; I = 1250 kgf/mm2; modul normi, elastičnost (polikristal) 10890 kgf / mm2. Između mineralnosti ležati u dubini kristala: na viginu, dubina je 7 do 14; koef. Krutost 0,325 1066 cm2/kg.
Na sobnoj temperaturi silicij praktički ne stupa u interakciju s plinovitim (uključujući) i čvrstim reagensima, krím lív. Pri kretanju t-ri dolazi do aktivne interakcije s metalima i nemetalima. Zocrema, koji otapa SiC karbid (na temp. 1600 K), Si3N4 nitrid (na temp. 1300 K), fosfid SiP (na temp. 1200 K) i arsenid Si As, SiAS2 (na temp. 1000 K). Uz kiselu reakciju na temperaturi od 700 K, gašenje Si02 dioksida, s halogenima - SiF4 fluorid (na temperaturi višoj od 300 K), SiCl4 klorid (na temperaturi višoj od 500 K), SiBr4 bromid (na temperaturi od 700 K) u nodidu SiI4 (pri tt 1000). Intenzivno reagira s mnogim drugima. metala, utvrđujući čvrste razlike u njihovoj supstituciji za kim. na polovici - silicidi. Koncentracijska područja homogenosti čvrstih ruža javljaju se ovisno o prirodi rozete (na primjer, Nimechchin u 0 do 100%, u jesen do 15%, u alfa cirkoniju manje od 0,1%).
Razlika između metala i nemetala u čvrstom siliciju znatno je manja i zvuči retrogradno. S kakvim granicama, umjesto kuće, što se radi na Do. nije jako duboko, dostići maksimum ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 cm) područje t-r víd 1400 do 1600 K. Kuće s dubokim rívenny vídznyayutsya nešto manji rozchinnístyu (víd 1015 za selen i 5 10 16 za zalíza do 7 10 17 za nikal i 10 18 cm-3 za midi). U rijetkom čeliku, silicij nije okružen uobičajenim metalima, često s velikim vizijama topline. Čisti silicij priprema se iz tehničkog proizvoda 99% Si í - 0,03% Fe, Al í Co), kaljenog kvarcom i ugljenom u električnim pećima. Počnite s novim dahom do tamo (sum_shy klorovodične i sirchanoy, a zatim fluorid-voda i sirchanoy) kuće, nakon čega se proizvod (99,98%) oduzima, tretira s klorom. Sinteze se pročišćavaju destilacijom.
Silikonski vodič se koristi u kombinaciji sa SiCl4 kloridom (ili SiHCl3) u vodi ili toplinskom ekspanzijom SiH4 hidrida. Preostalo pročišćavanje i mljevenje monokristala provodi se glatkom metodom zone bez lončića ili metodom Czochralskog, uzimajući u obzir posebno čisti umak (u kući do 1010-1013 cm-3) cf\u003e 10 3 ohm cm. iv na koji unijeti doziranje broja potrebnih kuća. Ovako se pripremaju cilindrične kreme promjera 2-4 i dužine 3-10 cm.Za posebne. svrha je proizvesti još više monokristala. Tehnički silicij i posebno yogo legure iz soli kao što su kiseli čelici i legure, kao i laki dodaci. Poznato je da se osobito čisti zrački monokristal K., dopiran raznim elementima, koristi kao osnova za razne niskostrujne (zocrema, termoelektrične, radio, svjetlosne i fototehničke) i jako strujne (vibrirajuće, pretvaračke) priključke.
Silicij i silicij
Silicij se dovodi do nemetala, a 4 elektrona mogu biti na istoj energetskoj razini. Vín ih može víddavati, pokazujući stupanj oksidacije + 4 i dodavati elektrone, pokazujući stupanj oksidacije - 4. Međutim, sposobnost dodavanja elektrona siliciju znatno je manja, niža u odnosu na ugljik. Atomi silicija mogu imati veći radijus, manji atomi ugljika.
Poznavanje prirode o siliciju .
Silikonski luk ekstenzija u prirodi. po njezinu dijelu pada preko 26% mase zemljane ospice. Za širinu vina, sjedite na drugom mjestu (poslije kiselog). Na vídmínu víd víd uglec C vílny stíní vírídí ne zustrichaetsya. On ulazi u skladište različitih kemijskih sastava, uglavnom raznih modifikacija silicijevog oksida (IV) i soli silicijeve kiseline (silikati).
Opsjednutost silicijom .
U industrijskom siliciju tehničke čistoće (95 - 98%) dominira SiO 2 koksa u električnim pećima tijekom prženja:
SiO 2 + 2C \u003d Si + 2CO
SiO 2 + 2 Mg \u003d Si + 2 MgO
Na taj način se iz kuća uzima prah amorfnog silicija smeđe boje. Rekristalizacija iz taljenja metala (Zn, Al) može se prenijeti u kristalni mlin.
Silicij tetraklorid, čak i visoke čistoće, koristi se na 1000°C za silicij tetraklorid SiCl 4 para cinka:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
taj čišćenje yogo slijedeći posebne metode.
Fizički Kemijska moć silicij.
Čisti kristalni silicij - tenditni i tvrdi, mlohavi nagib. Poput dijamanta, ima kubičnu kristalnu rešetku s kovalentnom vrstom veze. Yogo talište 1423 °C. Za najveće umove, silicij neaktivan element, koji reagira samo s fluorom, ali kada se zagrije, ulazi u razne kemijske reakcije.
Yogo vikoristovuyut kao vrijedan materijal za napívprovídnikovíy tehnítsí. Uparen s drugim vodičima vina, odlikuje se značajnom otpornošću na razrijeđene kiseline i velikom električnom otpornošću do 300 °C. Tehnički silicij i ferosilicij koristi se iu metalurgiji za toplinski postojane, kiselootporne i alatne čelike, čavune i bogate druge legure.
S metalima silicija kemije Nazvani silicidi, kada se zagrijava s magnezijem, magnezijev silicid se otapa:
Si + 2Mg = Mg 2 Si
Silicidi metala iza strukture te dominacije predviđaju karbide, pa se metaloliki silicidi, baš kao i metaloliki karbidi, odlikuju velikom tvrdoćom, visokim talištem, vrućom električnom vodljivošću.
Prilikom prženja sumish piskua s koksom u električnim pećima, silicijev karbid i ugljik se miješaju sa silicijevim karbidom ili karborundom:
SiO2 + 3C = SiC + 2CO
Karborund je vatrostalan, tvrdi sloj bez šipki, vrijedan abrazivni i toplinski materijal. Karborundum, jak i, ima atomski kristalni grati. Na čistoj stanici postoji izolator, ali u prisustvu kuće, on postaje vodič.
Silicij jak i , otapa dva oksida: silicij oksid (II) SiO i silicij oksid (IV) SiO 2 . Silicijev oksid (IV) je tvrda vatrostalna supstanca, široko rasprostranjena u prirodi u slobodnoj zemlji. To je kemijski stabilan govor, koji stupa u interakciju samo s fluorom i fluorom sličnim plinu u vodi ili fluorovodičnoj kiselini:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Izravno ukazivanje na reakcije objašnjava se činjenicom da silicij može imati veliku sporidnost prema fluoru. Osim toga, silicijev tetrafluorid je leteći govor.
Na tekhnítsí prozoriya SiO 2 vykorovuyut za pripremu stabilne vatrostalne kvarcne ploče, jer ljubazno propušta ultraljubičastu promjenu, može imati veliki koeficijent ekspanzije, što pokazuje značajne promjene temperature. Amorfna modifikacija silicijeva oksida (II) tripoli ima veliku poroznost. Yogo vikoristovuyut kao toplinski i zvučni izolator za vibrirajući dinamit (nos vibukhovo govor) i tako dalje. Silicij (IV) oksid u vibrirajućem zvuku jedan je od glavnih svakodnevnih materijala. Vikoran je u proizvodnji materijala otpornih na vatru i kiselinu, čelika, poput topitelja u metalurgiji itd.
Prema molekularnim formulama, kemijsku i fizičku snagu ugljičnog oksida (IV) i silicijevog oksida (IV) lako je uskladiti, njihova snaga je slična u skladište kemikalija z'ednan razní. Zašto je objašnjeno da se silicijev oksid (IV) ne formira samo iz molekula SiO 2 , kao što su njihovi suradnici, u nekima od njih atomi silicija spojeni su atomima kiseline. Silicij (IV) oksid (SiO 2 )n. Njena slika na kvadratu:
Još jedan predstavnik elemenata glavne podskupine IV skupine (IVA skupina) periodnog sustava D. I. Mendeljev - silicij Si.
U prirodi je silicij još jedan kemijski element za širinu kiseline. Zemaljska je kora sve više četvrtasto nabrana od yogo spoluka. Najrasprostranjeniji silicij je silicijev oksid (IV) SiO 2, drugi naziv je silicij. U prirodi se vina prave od minerala kvarca (mali 158), bogatog izbora takvog - girskog kristala, a također i poznate lila forme - ametista, kao i ahata, opala, jaspisa, kalcedona, karneola, u obliku virobní i opojno kamenje. Silicijev (IV) oksid također se sastoji od izvanrednog i kvarcnog pijeska.

Mal. 158.
Kristali kvarca prošarani u dolomit
Tri različita minerala na bazi silicijevog oksida (IV) (kremen, kalcedon i dr.) prvi ljudi pripremljen znaraddya prací. Isti kremen, koji je neprimjetan i nije uži od kamena, postavlja klip kamena vítsí - vítsí kremínyh znaryad pratsí (sl. 159). Dva su razloga za to: širina i dostupnost kremena, kao i gradnja zgrada s oštrim rubovima.

Mal. 159.
Znaryaddya kamen víku
Druga vrsta prirodnih materijala za silicij je silikat. Među njima su najveće širine aluminosilikata (podrazumijeva se da ti silikati mogu zamijeniti kemijski element aluminij). Granit se dodaje aluminosilikatima, vidjeti drugačije glina, tinjac. Silikat, koji ne osvećuje aluminij, na primjer, azbest, koji se koristi za izradu vatrometa.
Silicijev oksid (IV) SiO 2 neophodan je za život uzgajivača i bića. Vina daju stabljike roslina i zahisnymi velove stvorenja (slika 160). Zavdyaki yomu queues, queues i horsetails stand mitzno, like bagnets, gostre listing sedges cut, like noževi, strništa na kosom polju, poput glave, i stabljike žitarica na podu mitzne, koje ne dopuštaju polja kukuruza u poljima leći u dasku i vjetar . Luska rebra, školjke koma, kril meteliks, pir'ya ptahiv í vuna stvorenja mítsní, oskílki smite silicij.

Mal. 160.
Silicij (IV) oksid daje mineralnost stabljikama roslina i zagušljivim oblinama stvorenja
Z'ednannya silicij daje glatkoću i mekoću kosi i noktima osobe.
Silicij ulazi i u skladište nižih živih organizama - dijatomeja i radiolarija, najniže grudi žive tvari, kao da stvaraju svoje nesavršenosti iza ljepote kostura silicijem (sl. 161).
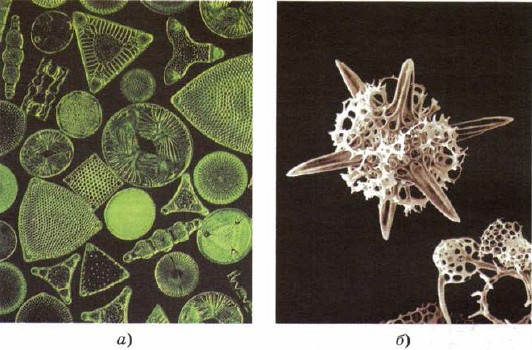
Mal. 161.
Kosturi dijatomeja (a) i radiolarija (b) sastoje se od silicija
Dominacija silicija. Koristite mikrokalkulator sa sony baterijom, pa postoji obavijest o kristalnom siliciju. Tse napívprovídnik. Na vídmínu víd metalív, íz pídvishennyam temperatura yogo elektroprovídníst zbíshuêtsya. Na satelite, svemirske brodove, stanice i dahah budinkiv (mali 162) postavljaju sony baterije koje sony energiju pretvaraju u električnu. Smrad radi kristale napívprovídnikív, a na prvi crni kremen. Silicijske fotoćelije mogu se pretvoriti u električnu energiju do 10% sonijeve energije.

Mal. 162.
Sleepy baterija za dahu kabinu
Silicij za spaljivanje na kiselosti, zadovoljavajući vas silicijevim oksidom (IV):
![]()
Budući da nije metal, silicij se pri zagrijavanju spaja s metalima s otopinama silicida, na primjer:
![]()
Silicidi se lako razmazuju vodom ili kiselinama, kada vidite silicij nalik vodi nalik plinu - silan:
Na površini ugljikohidrata silan se na površini samozahvata i izgara s otopljenim silicijevim oksidom (IV) i vodom:
Pojačana reakcija između silana i metana CH 4 objašnjava se činjenicom da je širenje atoma silicija veće, niže kod ugljika, pa su kemijske veze Si-H manje, a veze C-H niže.
Međudjelovanje silicija s koncentriranim promjenama vode na livadama, stvarajući silikat i vodu:
Silicij sadrži, slično silicijevom oksidu (IV) magnezij ili ugljik:
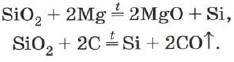
Silicijev oksid (IV), ili silicijev dioksid, ili silicij SiO 2 yak í CO 2 ê kiseli oksid. Međutim, na površini CO2 nalazi se molekularna, ali atomska kristalna rešetka. Tome je SiO 2 tvrd i vatrostalan govor. Vina se ne razlikuju u vodenim kiselinama, fluorovodičnoj kremi i aloji na visokim temperaturama s livadama s otopljenim solima silicijeve kiseline - silikatima:
Silicij se također može koristiti za legiranje silicijevog oksida (IV) s metalnim oksidima ili karbonatima:
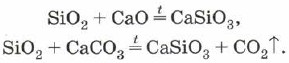
Natrijevi silikati i kalijevi zovu se maloprodajne ploče. Íh opskrba vodom- Dobro je koristiti silikatno ljepilo.
Silikatna kiselina H 2 SiO 3 (Sl. 163):
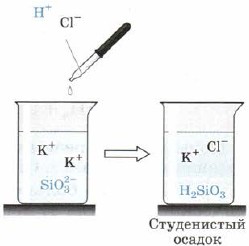
Mal. 163. Kisela reakcija na silikat-ion
Također, H2SiO3 je također slaba kiselina. Nekonzistentan je u vodi i ispada iz reakcionarnog nemira u pogledu na talog opsade, koji ponekad sabija cijeli volumen razlike, pretvarajući ga u čvrstu masu, idem na žele, žele. Prilikom vješanja masi uspostavlja se vrlo porozan govor - silikagel, koji se široko koristi kao adsorbent - glina drugih govora.
Laboratorijska potvrda br.40
Posjedovanje silicijske kiseline i to opravdanje moći
Injekcija silicija. Već znate da se silicij koristi za proizvodnju vodljivih materijala, kao i legura otpornih na kiseline. Kada se kvarcni pijesak stopi s vunom na visokim temperaturama, otapa se silicijev karbid SiC, koji je dostupan samo dijamantu. Stoga je potrebno vicorate za oštrenje ríztsív metalorízalnyh verstatív i poliranje skupog kamena.
Od otopljenog kvarca pripremaju se različite kemijske posude od kvarca, koje podnose visoke temperature i ne pucaju kad su hladne.
Z'ednannya silicij je osnova za savijanje skladišta na cement.
Zvichayne greška može biti skladište, što se može izraziti formulom Na 2 O CaO 6SiO 2. Yogo se dobiva u posebnim pećnicama za kuhanje s rastopljenom sumish sodom, vapnyakom i piskom.
Vídmínna riža skla - zdatníst rozm'yakshuvatisya í u rastaljenom čeliku nabubri da li je to oblik, jer se sprema kada je skladište uhvaćeno. Na temelju kojih se izrađuje posuđe i izrađuje ostala roba.
Dodatkoví yakosti sklu daju različite aditive. Tako se uvođenje olovnog oksida reducira na kristalno čistu boju, kromov oksid postaje zelen, kobaltov oksid plavi itd. (slika 164).

Mal. 164.
Proizvodi sa skladišta boja
Sklo je jedan od najstarijih vinara u narodu. Već 3-4 tise. Zbog toga je izbio rat u Egiptu, Siriji, Finikiju i Crnom moru.
Sklo - isti materijal nije manje od remísnikív, ali i umjetnici. Majstor je dosegao najviši stupanj savršenstva Stari Rim, kao da su svojim mozaicima mogli oduzeti nagib boje i rad.

Mal. 165.
Staklo u boji na vitrajima katedrale Notre Dame u Chartresu
Stvorite umjetnička djela iz skladišta s obov'yazkovymi atributima velikog muzeja, i šarenim vitrajima crkve, mozaičkim pločama - svijetlim stražnjicama ovoga (Sl. 165). U jednoj od prostorija peterburške podružnice Ruske akademije znanosti nalazi se mozaički portret Petra I., pobjednika M. V. Lomonosova (sl. 166).

Mal. 166.
Mozaički portret Petra I
Područja zagušenja su prilično velika. Tse vikonne, plyashkove, lampov, dzerkalne sklo; optički nagib - od okulara do naočala fotoaparata; leće nerazlučivih optičkih uređaja – od mikroskopa do teleskopa.
Drugi najvažniji materijal, premazi na bazi silicija, je cement. Yogo se koristi za pečenje gline i vape u posebnim pećnicama koje se zamotaju.
Ako se prah cementa pomiješa s vodom, onda cement nije čvrsto uspostavljen, inače, kako se zove budilica, cement rozchin, koji je korak po korak tvrđi. Prilikom dodavanja betona u cement ili drobljeni kamen, beton treba skinuti kao završni premaz. Materijalnost betona raste, tako da se u novi uvodi novi okvir - izlazi lijevani beton od kojeg se izrađuju zidovi panela, blokovi preklopa, fermi mostovi i sl.
Skladište se bavi proizvodnjom cementa industrija silikata. Vaughn proizvodi i silikatnu keramiku - ceglu, porculan (mali 167), fajansu i proizvode od njih.

Mal. 167.
Vrste porculana
Vídkrittya silicij. Iako su u davnim vremenima ljudi uvelike pobjeđivali u korištenju silicija, sam silicij prvi je uzeo 1824. godine švedski kemičar J. Ya. Berzelius. Međutim, 12 godina prije novog kremena, J. Gay-Lussac i L. Tenard su odvedeni, ale vin duzhe zabrudneniy kuće.
Latinski naziv silicum potiče od latinske riječi silex-kremen. Ruski naziv "silicij" podsjeća na kremnos od oraha - "skel, skel".
Nove riječi koje razumiju
- Prirodni izvori silicija: silicij, kvarc i druge vrste, silicij, aluminosilikat, azbest.
- Biološki značaj silicija.
- Dominacija silicija: napívprovídnikoví, međuigra s kiselim, metalima, livadama.
- Silan.
- Silicij (IV) oksid. Yoga Budova i snaga: interakcija s livadama, bazičnim oksidima, karbonatima i magnezijem.
- Silicijeva kiselina i njezine soli. Rozchinne slo.
- Zastosuvannya silicij i yogo polovica.
- Sklo.
- Cement.
imenovati dan
Najčešće se u prirodi nalazi silicij u obliku kremenice - baze na bazi silicijevog dioksida (IV) SiO 2 (oko 12% Zemljine morske mase). Glavni minerali i stijene koje se gase silicijevim dioksidom su lanac (bogati i kvarc), kvarc i kvarcit, kremen, polov_spar. Silicij i aluminosilikat su u prirodi presavijeni na drugu širinu.
Primjećuje se jedna po jedna činjenica o važnosti čistog silicija u njegovom izvornom izgledu.
Otrimannya
Silicij će izaći prženjem hrskave bijele pisku (silicijev dioksid) s magnezijem:
S i O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \rightarrow \ 2MgO+Si)))Na što se slažete amorfni silicij , što može izgledati kao smeđi prah.
Tehnička čistoća silicija u industriji dobiva se taljenjem SiO 2 s koksom na temperaturi od oko 1800 ° C u rudno-termalnim pećima tipa osovine. Čistoća silicija uklonjena takvim stupnjem može doseći 99,9% (glavne kuće su ugljen, metal).
Možete se odmaknuti od pročišćavanja silicija iz kuća.
- Pročišćavanje u laboratorijskim kupaonicama može se provesti putem frontalnog posjedovanja magnezijevog silicida Mg 2 Si. Dodali smo magnezijev silicid za dodatne klorovodične ili oktatne kiseline za uklanjanje plinovitog monosilana SiH 4 . Monosilan se pročišćava rektifikacijom, sorpcijom i drugim metodama, a zatim stavlja na silicij i vodu na temperaturu od oko 1000 °C.
- Pročišćavanje silicija u industrijskim razmjerima provodi se putem ne-srednjeg kloriranja silicija. Time se otapaju polunabori skladišta SiCl 4, SiHCl 3 i SiH 2 Cl 2 . Íh na drugačiji način očistiti nastambu (u pravilu destilacijom i disproporcioniranjem) i u završnoj fazi dodati čistu vodu na temperaturama od 900 do 1100 °C.
- Razvijaju se jeftinije, čišće i učinkovitije industrijske tehnologije za pročišćavanje silicija. Za 2010. godinu prije njih moguće je uvesti tehnologije za pročišćavanje silicija zamjenskim fluorom (zamjena klora); tehnologije koje prenose destilaciju na silicijev monoksid; tehnologije temeljene na kućama od vitraja koje se fokusiraju na međukristalne granice.
Vmíst domíshok kod finaliziranog silicija može se smanjiti na 10 -8 -10 -6% po masi. Više izvješća o prehrani čistog silicija možete pogledati u članku Polikristalni silicij.
Metoda dobivanja silicija u čistom obliku fragmentacije Mikola, Mikolayovich Beketov.
Fizička snaga
Kristalna rešetka silicija je kubična ploha centrirana poput dijamanta, parametar a = 0,54307 nm (na visoki škripac ukloniti druge polimorfne modifikacije silicija), ali kroz veću vezu između Si-Si atoma u vezi s vezom zv'azku S-S tvrdoća silicija znatno je manja od tvrdoće dijamanta. Silicij pucketa, tek kad se zagrije na 800°C, postaje plastični govor. Vín prozory za infrachervonogo viprominyuvannya s dozhini khvili 1,1 mikrona. Mokra koncentracija nosa u naboju je 5,81 10 15 m-3 (za temperaturu od 300 K).
Elektrofizička snaga
Elementarni silicij u monokristalnom obliku je vodič s neizravnim procjepom. Širina ograđenog prostora na sobna temperatura skladištenje 1,12 eV, a na T \u003d 0 K - 1,21 eV. Koncentracija mokrih nositelja naboja u siliciju za normalne umove postaje blizu 1,5·10 10 cm −3.
Na elektrotrofnoj snazi kristalnog silicija, veliki dotok gradi kuće koje lutaju u mraku. Da biste ekstrahirali kristale silicija s dubokom vodljivošću, u silicij unesite atome elemenata grupe III, kao što su bor, aluminij, galij i indij. Za izdvajanje kristala iz silicija s elektronskom vodljivošću u silicij, uvedite atome elementi V-í̈ groupi, kao što su fosfor, mish'yak, surma.
Kada se elektronički uređaji sastavljaju na bazi silicija, važno je površinsku kuglicu pričvrstiti na materijal (do desetaka mikrona), tako da se kvaliteti površine kristala može dodati elektrostatska snaga silicija i, očito, na snagu gotovog alata. Tijekom sastavljanja određenih uređaja, vikor se dodaje, primjenjuje se na modifikaciju površine, na primjer, površina se oblaže silicijumom s različitim kemijskim sredstvima i njezina oprominennya.
Kemijska moć
Slično atomima ugljika, atome silicija karakterizira sp 3 -hibridizacija orbitala. U vezi s hibridizacijom, čisti kristalni silicij stvara dijamantna zrnca, u kojima je silicij hotivalentan. Istodobno, zvuk silicija također se očituje kao hotivalentan element sa oksidacijskim stanjem +4 ili -4. Zustrichayutsya dvovalentni pola silicij, na primjer, silicijev oksid (II) - SiO.
Za normalne umove, silicij je kemijski neaktivan i aktivno reagira samo s plinom sličnim fluorom, s kojim se otapa hlapljivi silicijev tetrafluorid SiF4. Takva “neaktivnost” silicija posljedica je pasivizacije površine nano kuglice silicijevog dioksida, koji se negativno taloži u prisutnosti kisele, uvijek iznova vode (vodene pare).
zakiseljavanje s otopljenim SiO 2 dioksidom, proces je popraćen povećanjem volumena kuglice dioksida na površini, stabilnost procesa oksidacije ograničena je difuzijom atomske kiseline i krioprezerviranog dioksida.
Kada se zagrije na temperaturu od preko 400-500 ° C, silicij reagira s klorom, bromom i jodom - uz usvajanje lako hlapljivih tetrahalida SiHal 4 i, eventualno, halogenida u presavijenom skladištu.
S vodom silicij bez sredine ne reagira, ali s vodom silicij - silani s formulom Si n H 2n + 2 - posjeduju neizravan način. Monosilan SiH 4 (yogo se često naziva jednostavno silan) vidi se u interakciji metalnih silicida s kiselinama, na primjer:
C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \rightarrow \ 2CaCl_(2)+SiH_(4)\ ) strelica prema gore)))SiH 4 silan, koji se otapa u ovoj reakciji, osvećuje kuće i druge silane, zokrem, Si 2 H 6 disilan i Si 3 H 8 trisilane, u nekim lancetama za atome silicija, međusobno vezane jednostrukim vezama (- Si -Si-Si- ) .
Silicij reagira s dušikom i borom na temperaturama blizu 1000 °C, otapajući nitrid Si 3 N 4 i termički i kemijski stabilne boride SiB 3 , SiB 6 i SiB 12 .
Na temperaturama iznad 1000 ° C moguće je koristiti silicij koji je najbliži analog periodnom sustavu - ugljik - silicijev karbid SiC (karborund), koji se odlikuje visokom tvrdoćom i niskom kemijskom aktivnošću. Karborund se široko koristi kao abrazivni materijal. S tim se, međutim, taljenje silicija (1415 °C) može kontaktirati tri sata s ugljenom s obzirom na velike komade sinteriranog fino zrnatog grafita izostatičkog prešanja, koji se praktički ne mijenja i ne ometa ostatak.
Niži elementi 4. skupine (Ge, Sn, Pb) su neobloženi silicijem, kao i većina drugih metala. Kada se silicij zagrijava s metalima, mogu nastati njihovi poluživoti – silicidi. Silicidi se mogu podijeliti u dvije skupine: ionsko-kovalentne (silicidi pudnih, pudnih metala i magnezija tipa Ca 2 Si, Mg 2 Si i in) i metalolike (silicidi prijelaznih metala). Silicidi aktivnih metala polažu se pod razrjeđivanjem kiselina; Silicidi slični metalima imaju visoko talište (do 2000 °C). Najčešće se koriste silicidna skladišta poput metala Mi Si, Mi 3Si2, Mi 2 Si 3 , Mi 5 Si 3 i Mi Si 2. Silicidi slični metalima su kemijski inertni, otporni na kiselost pri visokim temperaturama.
Posebno je važno napomenuti da silicij brtvi eutektičku sumu, što omogućuje šiljanje (tapanje) materijala za brtvljenje ferosilicij keramike na temperaturama koje su osjetno niže, niže od temperature taljenja brtve i silicija.
Prilikom dodavanja SiO 2 siliciju na temperaturama iznad 1200 ° C, silicijev oksid (II) - SiO se otapa. Ovaj proces je stalno podržan proizvodnjom kristala silicijskim metodama
Silicij na čelu vizija 1811. J.Gay-Lussac i L.Tenar pri prolasku para silicijevog fluorida preko metalnog kalija, oni proteine ne opisuju kao element. Švedski kemičar J. Berzelius 1823. god dajući opis silicija koji je uklonio tijekom obrade kalijeve soli K 2 SiF 6 s metalnim kalijem na visokoj temperaturi. Novi element nazvan je "silicij" (lat. silex - kremen). Ruski naziv "silicij" uveo je 1834. godine ruski kemičar Herman Ivanovich Hess. Kod prijevoda dr. grč. krhmnoz- Kut, planina.
Znanje u prirodi, otrimannya:
U prirodi se silicij nalazi u vibrirajućem dioksidu i silikatima u drugom skladištu. Prirodni silicijev dioksid je važniji u obliku kvarca, želeći koristiti druge minerale - kristobalit, tridimit, kit, cousite. Amorfni silicij nakuplja se u naslagama dijatomeja na dnu mora i oceana - te se naslage talože sa SiO 2, ulazeći u skladište dijatomeja i drugih cilijata.
Vilniy silicij se može koristiti za pečenje s magnezijevom hrskavom bijelom piskom, koja se za kemijsko skladište može očistiti silicijevim oksidom SiO 2 + 2Mg = 2MgO + Si. U industriji se tehnička čistoća silicija dobiva taljenjem SiO 2 s koksom na temperaturi od oko 1800 ° C u lučnim pećima. Čistoća silicija dobivena takvim rangom može doseći 99,9% (glavne kuće su ugljen, metal).
Fizičke moći:
Amorfni silicij može izgledati kao smeđi prah, čija je debljina veća od 2,0 g / cm 3. Kristalni silicij - tamno sivi, blistavi kristalni govor, kristaliziran i tvrd, kristalizira u dijamantima. Ovo je tipičan vodič (bolje je provoditi struju, niži izolator tipa gume, a viši za vodič - srednji). Silicij pucketa, tek kad se zagrije na 800°C, postaje plastični govor. Cíkavo, scho silikatni prozorij do infrachervony viprominyuvannya, počevši s dugim vjetrom od 1,1 mikrona.
Kemijska snaga:
Kemijski silicij nisko aktivan. Na sobnoj temperaturi reagira samo s plinovitim fluorom, hlapljivi silicijev tetrafluorid SiF 4 otapa se na ovoj temperaturi. Kada se zagrije na temperaturu od 400-500 ° C, silicij reagira s kiselinom s otopljenim dioksidom, s klorom, bromom i jodom - s otopljenim lako hlapljivim tetrahalidima SiHal 4 . Na temperaturama blizu 1000 °C, silicij reagira s dušikom i otapa nitrid Si 3 N 4 s borom - termički i kemijski stabilnim boridom SiB 3, SiB 6 i SiB 12. S vodenom otopinom silicija ne reagira bez problema.
Za nagrizanje silicijem najviše se koristi zbroj fluorovodične i dušične kiseline.
Postavio do livada.
Silicij karakterizira stupanj oksidacije od +4 ili -4.
Najvažnija polja:
Silicijev dioksid, SiO 2- (silicijev anhidrid) ...
...
Silicijeve kiseline- slaba, nejasna, utvoryuyuyutsya kada se dodaje kiselina u veličini silikata izgleda kao gel (želatina poput govora). Poznato je da H 4 SiO 4 (orto-silicij) i H 2 SiO 3 (meta-silicij ili silicij) variraju i nepovratno se pretvaraju u SiO 2 kada se zagrijavaju i suše. Čvrsti porozni proizvod za unos - silikonski gel može se otvoriti na površini i djelovati kao adsorbent plinova, sredstvo za sušenje, katalizator i katalizator trošenja.
silikat- soli silicijeve kiseline dobra (krim silikati natrija i kalija) nisu topljive u vodi. vlast.
Slapovi- analozi ugljikohidrata, silani, polovično, u nekim atomima silicija s jednostrukom vezom, snaga yakscho atom silicija z'êdnaní podvíyny zv'yazkom. Lances i kiltsya koriste se slično ugljikohidratima. Sve se moći mogu samostalno koristiti, stvarati vibracije sumish s ponavljanjem i lako reagirati s vodom.
Zastosuvannya:
Najznačajnija količina silicija poznata je za izbor legura za primjenu aluminija, bakra i magnezija, te za izbor ferosilicida, koji mogu biti važni za izbor čelika i opreme za grijanje. Kristali silicija zastosovuyut sony baterije i napívprovídnikovih gospodarskih zgrada - tranzistori i diode. Silicij također služi kao sirovina za proizvodnju organosilikonskih ploča, odnosno siloksana, bojenja uljem, uljem, plastikom i sintetičkom gumom. Anorganski puževi silicij vicorist se koristi u tehnologiji keramike i čelika, kao izolacijski materijal i p'ezokristali
Za neke organizme silicij je važan biogeni element. Vín uđite u skladište potpornih koliba kod roslina i kostura - kod stvorenja. Morski organizmi – dijatomeje, alge, radiolarije, spužve – koncentrirani su u velikim područjima silicija. Sjajne brojke preslice i koncentrat žitarica sa silicijem, u prvom crnom - bambus i pidrodini poput riže, među njima - sadna riža. M'yazova tkivo osobe za osvetu (1-2) 10 -2% silicija, koštano tkivo - 17 10 -4%, krv - 3,9 mg / l. Međutim, danas se u tijelo čovjeka može unijeti do 1 g silicija.
Antonov S.M., Tomilin K.G.
Državno sveučilište HF Tyumen, 571 grupa.
