Genetski nizovi primjera nemetala. Genetski odnos između klasa tvari - hipermarket znanja
Postoji genetska veza između jednostavnih tvari, oksida, baza, kiselina i soli, odnosno mogućnosti njihovog međusobnog prijelaza (transformacije).
Na primjer, jednostavna tvar - kalcij kao rezultat interakcije s kisikom pretvara se u oksid: 2Ca + O2 = 2CaO.
Kalcijev oksid u interakciji s vodom tvori kalcijev hidroksid CaO + H20 = Ca (OH) 2, a posljednji, u interakciji s kiselinom, pretvara se u sol: Ca (OH) 2 + H2S04 = CaSO4 + 2H2O.
Ove transformacije mogu biti predstavljene shemom:
Ca → CaO → Ca (OH) 2 → CaSO 4
Sličnu shemu može se napisati i za nemetalne, na primjer, sumpor:
S → SO3 → H2S04 → CaSO4
Dakle, ista se sol dobiva na različite načine.
Također je moguć povratni prijelaz iz soli u druge klase anorganskih spojeva i jednostavnih tvari:
CuSO4 → Cu (OH) 2 → CuO → Cu
CuS04 + 2NaOH = Cu (OH) 2 + Na2S04
Cu (OH) 2 = CuO + H20
CuO + H 2 = Cu + H 2 O (redukcija bakra)
Sličan odnos između klasa anorganskih spojeva, koji se temelji na proizvodnji tvari jedne klase od tvari drugog, naziva se genetski.
Svojstva kompleksnih spojeva odražavaju se u genetskoj shemi glavnih klasa anorganskih spojeva (vidi sliku). On odražava stupnjeve razvoja anorganske tvari duž dviju glavnih linija, od tipičnih metala do tipičnih nemetala s suprotnim svojstvima.
Metali čije je kemijsko svojstvo atoma sposobnost darovanja elektrona i ne-metala, čije je glavno kemijsko svojstvo sposobnost njihovih atoma da u svojstvima vežu elektrone koji su međusobno suprotni. S kompliciranjem sastava tvari te suprotstavljene tendencije nastavljaju se pojavljivati.
Tipični metali i prijelazni elementi u najnižem oksidacijskom stanju formiraju osnovne okside, dok tipični nemetali i prijelazni elementi u visokom oksidacijskom stanju tvore suprotne kisele okside.
Jednostavne tvari
amfoterni
Nemetala
Osnovni oksidi
amfoterni
kiseli
teren
amfoterni
hidroksidi
Genetička shema glavnih klasa anorganskih spojeva
Daljnjim kompliciranjem sastava tvari stvaraju se hidroksidi, osnovni oksidi koji odgovaraju bazi, te kiseli oksidi koji odgovaraju kiselini. Baze suprotne osobinama i kiselina aktivno reagiraju jedna s drugom, formirajući soli. Interakcija suprotnosti je pokretačka snaga reakcije. Stoga, bazični i kiseli oksidi, baze i kiseline aktivno međusobno djeluju, a dva kisela oksida ili dva bazična oksida ne djeluju međusobno, jer su njihova svojstva bliska.
Stoga se svojstva kompleksnog spoja određuju na temelju svojstava njegovih sastavnih elemenata. Glavni zakoni promjene tih svojstava sažeti su u sljedećim primjenama (Tablica 6).
1. U razdobljima s povećanjem broja sekvenci, svojstva elemenata mijenjaju se iz metalnog u nemetalni. Povećava se broj elektrona na vanjskoj razini, povećava se stupanj oksidacije elementa, smanjuje polumjer atoma i iona, povećava se ionizacijska energija i afinitet za elektron. U skladu s tim povećavaju se osnovna smanjenja i kiselinska svojstva oksida i hidroksida.
2. U glavnim podskupinama, osnovna svojstva oksida i hidroksida povećavaju se s povećanjem atomskog broja. Za elemente bočnih skupina s povećanjem broja sekvenci karakteristična je složenija promjena svojstava. Prvo, metalna se svojstva povećavaju, a zatim smanjuju.
3. Aktivni metali odgovaraju oksidima i hidroksidima s jako izraženim osnovnim svojstvima. Najaktivniji metali su alkalijski i zemno alkalni. One tvore okside topive u vodi i jake topive baze - alkalije.
4. Nisko aktivni metali (sve osim alkalnih i alkalnih) tvore slabe baze koje se teško otapaju u vodi:
Cu (OH) 2, Fe (OH) 3.
5. Oksidi i hidroksidi s izrazito izraženim kiselinskim svojstvima odgovaraju aktivnim nemetalima.
6. Amfoterni metali tvore amfoterne okside i hidrokside.
7. Ako element ima različite stupnjeve oksidacije, onda mu odgovaraju oksidi i hidroksidi različitih svojstava.
Tema: GENETIČKA POVEZANOST IZMEĐU metala i nemetala i njihovih spojeva. 9. razred
Ciljevi: odgojni: učvrstiti pojam "genetičke serije", "genetske veze"; naučiti kako napraviti genetske nizove elemenata (metali i nemetali), sastaviti jednadžbe reakcije koje odgovaraju genetskoj seriji; provjerite kako se znanje uči kemijska svojstva oksidi, kiseline, soli, baze, razvoj: razviti sposobnost analize, usporedbe, sažimanja i donošenja zaključaka, sastaviti jednadžbe kemijskih reakcija; obrazovni: promicati formiranje znanstvenog svjetonazora.
Pružanje nastave: tablice "Periodni sustav", "Tablica topljivosti", "Serija aktivnosti metala", upute za studente, zadaci testiranja znanja.
Napredak: 1) Org. trenutak
2) Provjerite d / s
3) Proučavanje novog materijala
4) Pričvršćivanje
5) D / C
1) Org. trenutak. Dobro došli.
2) Provjerite d / s.
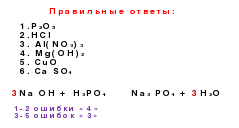
Genetske veze su veze između različitih klasa na temelju njihovih interkonverzija.
Poznavajući klase anorganskih tvari, moguće je napraviti genetske serije metala i nemetala. Temelj tih serija je isti element.
Među metalima postoje dvije vrste redaka:
1
, Genetska serija u kojoj alkali djeluju kao baza. Ova serija može se prikazati pomoću sljedećih transformacija:metal → osnovni oksid → lužina → sol
Na primjer, K → K
2 O → KOH → KCl2
, Genetska serija, gdje je baza netopljiva baza, zatim niz može biti predstavljen kao lanac transformacija:metal → osnovni oksid → sol → netopljiva baza →
→osnovni oksid → metal
Na primjer, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
, Genetska serija nemetala, gdje topiva kiselina djeluje kao veza u nizu. Lanac transformacija može se predstaviti na sljedeći način:nemetalni → kiseli oksid → topiva kiselina → sol
Na primjer, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
, Genetska serija nemetala, gdje netopljiva kiselina djeluje kao veza u nizu:nemetalni → kiseli oksidi → soli → kiseline →
→kiseli oksid → nemetalni
Na primjer
si→ SiO 2 → na 2 SiO 3 → H 2 SiO 3 → SiO 2 → si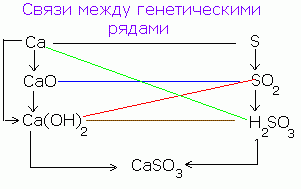
Frontalni razgovor o:
Što je genetska veza? Genetske veze su veze između različitih klasa na temelju njihovih interkonverzija Što je genetska serija?
Genetski nizovi - niz tvari - predstavnici različitih klasa, koji su spojevi jednog kemijskog elementa, povezani međusobnim konverzijama i odražavaju transformacije tih tvari. Temelj tih serija je isti element.
Koje vrste genetskih nizova se mogu razlikovati Među metalima se mogu razlikovati dvije vrste serija:
a) Genetska serija u kojoj alkali djeluju kao baza. Ova serija može se prikazati pomoću sljedećih transformacija:
metal → osnovni oksid → lužina → sol
na primjer, genetska serija kalija K → K
2 O → KOH → KClb) Genetska serija, gdje je baza netopljiva baza, tada se serija može predstaviti kao lanac transformacija:
metal → oksid baze → sol → netopljiva baza → oksid baze → metal
na primjer: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuOd nemetala moguće je razlikovati i dvije vrste redaka:
a) Genetska serija nemetala, gdje topljiva kiselina djeluje kao karika u nizu. Lanac transformacija može se predstaviti na sljedeći način: ne-metal → kiseli oksid → topljiva kiselina → sol.
Na primjer: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Genetski niz nemetala, gdje netopljiva kiselina: nemetalni → kiseli oksid → sol → kiselina → kiseli oksid → nemetali djeluju kao karika u seriji
Na primjer: Si → SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → SiIzvršavanje zadataka za opcije:
1. Odaberite formulaciju oksida u svojoj verziji, objasnite svoj izbor, na temelju znanja o karakteristikama sastava ove klase spojeva. Nazovite ih.
2. U stupcu formule vaše varijante, pronađite formule kiseline i objasnite svoj izbor na temelju analize sastava tih spojeva.
3. Odrediti valencije kiselinskih ostataka u kiselom sastavu.
4. Odaberite formule soli i nazovite ih.
5. Napravite formule soli koje se mogu formirati s magnezijem i kiselinama iz vaše varijante. Zapiši ih, nazovi ih.
6. U stupcu formule svoje varijacije pronađite osnovne formule i objasnite svoj izbor na temelju analize sastava tih spojeva.
7. U vašoj varijanti odaberite formule tvari s kojima otopina ortofosforne kiseline (klorovodična, sumporna) može reagirati. Napravite odgovarajuće jednadžbe reakcije.
9. Između formula vaše opcije, odaberite formule tvari koje mogu međusobno djelovati. Napravite odgovarajuće jednadžbe reakcije.
10. Napravite lanac genetskih veza anorganskih spojeva, koji će sadržavati tvar, čija je formula dana u vašoj verziji na prvom mjestu.
Opcija 1
Opcija 2
CaO
HNO
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbO
LiOH
Ag
3 PO 4P
2 O 5NaOH
ZnO
CO
2BaC
2HCl
H
2 CO 3H
2 SO 4CuSO
4Iz tih supstanci napravite genetsku liniju koristeći sve formule. Napišite reakcijske jednadžbe pomoću kojih možete ostvariti ovaj lanac transformacija:
I opcija: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opcija:na 2 SO 4, NaOH, na, na 2 O 2 , na 2 O4) Učvršćivanje1.
al→ al 2 O 3 → ALCL 3 → al( OH) 3 → al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Domaći zadatak:
nacrtati postupni prijelaz iz kalcija u kalcijev karbonat i pripremiti izvješće o uporabi bilo koje soli u medicini (koristeći dodatnu literaturu).

Od metala se mogu razlikovati dvije vrste redova: 1. Genetski nizovi u kojima alkali djeluju kao baza. Ova serija može se prikazati sljedećim transformacijama: metal - osnovni oksid - alkalna - sol, na primjer, genetska serija kalija K - K2O - KOH - KCl.

2. Genetska serija, u kojoj je netopljiva baza djelovanje kao baza, zatim se serija može predstaviti kao lanac transformacija: metal - bazični oksid - sol netopljiva baza - bazični oksid - metal. Cu-- CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu genetski niz bakra "\u003e Cu je genetska serija bakra"\u003e "title =" (! LANG: 2. Genetska serija, gdje je baza netopljiva baza, zatim se serija može predstaviti kao lanac transformacija: metal - baza oksid - sol - netopljiva baza - glavni oksid je metal Cu-CuO-CuCl 2-Cu (OH) 2-CuO-\u003e"> title="2. Genetska serija, u kojoj je netopljiva baza djelovanje kao baza, zatim se serija može predstaviti kao lanac transformacija: metal - bazični oksid - sol netopljiva baza - bazični oksid - metal. Cu-- CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Među nemetalima moguće je razlikovati i dvije vrste redova: 1. Genetska serija nemetala, gdje topljiva kiselina djeluje kao veza u nizu. Lanac transformacija može se prikazati na sljedeći način: ne-metal - kiselina oksid - topiva kiselina - -sol. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Fosforni genetički raspon

Postoji genetska veza između klasa anorganskih spojeva. Od jednostavnih supstanci možete dobiti kompleksan i obrnuto. Od spojeva jedne klase, možete dobiti spojeve druge klase.
Pojednostavljeni genetski odnos između klasa anorganskih spojeva može se prikazati sljedećom shemom:
Slijed takvih transformacija za nemetale može se prikazati sljedećom shemom: CANPO 4
R → R 2 O 5 → N 3 RO 4 → S a 3 (RO 4) 2
(Saon) 3 PO 4
Za tipične metale možete napraviti sljedeći lanac transformacija:
Ba → BaO → Ba (OH) 2 → BaSO 4
Za metale čiji su oksidi i hidroksidi amfoterni (polumetali), mogu se provesti sljedeće transformacije:
Al → Al2O3 → Al (OH) 3 → Na → AlCl3 → AlOHCl2 → Al (OH) 3 → Al2O3.
Veze između klasa:
1. Metali, nemetali→ sol.
Izravnom interakcijom metala i nemetala nastaju soli kiselina bez kisika (halogenidi, sulfidi):
2Na + Cl2 = 2NaCl
Ovi spojevi su stabilni i ne raspadaju se pri zagrijavanju.
2. Osnovni oksidi, kiseli oksidi→ sol.
CaO + CO2 = CaCO3;
Na20 + S03 = Na2S04.
3. Baze, kiseline→ sol.
Provodi se reakcijom neutralizacije:
2NaOH + H2S04 = Na2S04 + 2H2O,
HE - + H + - H20;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H2O,
Mg (OH) 2 + 2H + → Mg2 + + 2H20.
4. Metali→ osnovne okside.
Većina metala reagira s kisikom i tvori okside:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A1203.
Zlato, srebro, platina i drugi plemeniti metali ne djeluju s kisikom, oksidi takvih metala se dobivaju posredno.
5. Nemetali→ kiseli oksidi.
Nemetali (osim halogena i plemenitih plinova) međusobno djeluju s kisikom, tvoreći okside:
4P + 5O2 = 2P205;
S + O2 = S02.
6. Osnovni oksidi→ baza.
Izravnom interakcijom s vodom mogu se dobiti samo hidroksidi alkalijskih i zemnoalkalijskih metala (alkalija):
Na20 + H20 = 2NaOH;
CaO + H20 = Ca (OH) 2.
Ostatak se dobiva posredno.
7. Kiselinski oksidi→ kiseline.
Kiseli oksidi reagiraju s vodom kako bi se formirale odgovarajuće kiseline:
S03 + H20 = H2S04;
R2O5 + 3H2O = 2H3P04.
Izuzetak je SiO2, koji ne reagira s vodom.
8. Baze, kiseli oksidi→ sol.
Alkali reagiraju s kiselim oksidima u obliku soli:
2NaOH + SO3 = Na2S04 + H20,
2OH - + S03 = SO4 2- + H20;
Ca (OH) 2 + S02 = CaCO3 + N2O,
Ca 2+ + 2OH - + CO 2 → CaC03 + H20.
9. Kiseline, bazični oksidi→ sol.
Metalni oksidi se otapaju u kiselinama, tvore soli:
CuO + H2S04 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na2O + 2HS1 = 2NaCl + H20,
Na20 + 2H + = 2Na + + H20.
10. Razlozi→ osnovne okside.
Netopljive baze i LiOH razgrađuju se pri zagrijavanju:
LiOH = Li20 + H20;
Cu (OH) 2 = CuO + H20.
11. Kiseline→ kiseli oksidi.
Nestabilne kiseline koje sadrže kisik razgrađuju se pri zagrijavanju (H2SiO3), pa čak i bez zagrijavanja (H2CO3, HClO). Istovremeno, brojne kiseline su otporne na zagrijavanje (H2S04, H3P04).
H2Si03 = H20 + Si02;
H2CO3 = H20 + CO2.
12. Metalni oksidi→ metali.
Neki oksidi teških metala mogu se razgraditi na metal i kisik:
2HgO = 2Hg + O2.
Također, metali se dobivaju iz odgovarajućih oksida uz pomoć redukcijskih sredstava:
3Mn02 + 4Al = 3Mn + 2Al203;
Fe203 + 3H2 = 2Fe + 3H20.
13. Kiselinski oksidi→ nemetala.
Većina ne-metalnih oksida ne raspada se pri zagrijavanju. Ne-metal i kisik razgrađuju samo neke nestabilne okside (halogene okside).
Neki nemetali se dobivaju redukcijom iz odgovarajućih oksida:
Si02 + 2Mg = 2MgO + Si.
14. Soli, baze → baze.
Netopljive baze dobivaju se djelovanjem alkalija na otopine odgovarajućih kiselina:
CuS04 + 2NaOH = Cu (OH) 2 + Na2S04,
Cu2 + + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH = Fe (OH) 2 + 2KCl,
Fe2 + + 2OH - = Fe (OH) 2 '.
15. Soli, kiseline → kiseline.
Topljive soli reagiraju s kiselinama (u skladu s nizom tlaka) ako je rezultat slabija ili hlapljiva kiselina:
Na2Si03 + 2HCl = 2NaCl + H 2 SiO 3,
Si02 2- + 2H + → H2Si03;
NaCl (s.) + H2S04 (k) = NaHS04 + HCl.
16. Soli→ bazični oksidi, kiseli oksidi.
Soli nekih kiselina koje sadrže kisik (nitrati, karbonati) razgrađuju se pri zagrijavanju:
CaC03 = CaO + CO2;
2Cu (NO3) 2 = 2CuO + 4NO2 + O2.
VJEŽBE ZA NEOVISNI RAD NA TEMU “GENETIČKA POVEZANOST RAZREDA ANORGANSKIH SPOJEVA”
1. Navedite dolje navedene tvari, rasporedite ih u klase anorganskih spojeva: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O7, Fe (OH) 2, P205, HF, Mn02.
2. Od onih tvari koje su navedene u nastavku moguće je dobiti hidroksid (kiselina ili baza) u jednom stupnju: bakar, željezni oksid (P), barijev oksid, dušikov oksid (P), dušikov oksid (V), silicijev oksid, bakrov sulfat, kalijev klorid kalij, magnezijev karbonat.
3. Iz gornjeg popisa napišite formule tvari koje se odnose na: 1) okside; 2) osnove; 3) kiseline; 4) soli:
C02, NaOH, HCl, SO3, CuS04, NaN03, KCl, H2S04, Ca (OH) 2, P205, HN03, Al (OH) 3.
4. Navedite tvari: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4) ) 2, CO, HI. Navedite kojoj klasi pripada svaka tvar.
5. Napišite molekularne formule sljedećih tvari i navedite kojoj klasi pripada svaka tvar:
1) bakar (II) hidroksoksarbonat;
2) dušikov oksid (V);
3) nikal (II) hidroksid;
4) barijev hidrogen fosfat;
5) perklorna kiselina;
6) krom (III) hidroksid;
7) kalijev klorat;
8) hidrogen sulfidna kiselina;
9) natrijev cinkat.
6. Navedite primjere reakcija na vezu između:
1) jednostavne tvari - nemetali;
2) jednostavna tvar i oksid;
3) oksidi;
4) složene tvari koje nisu oksidi;
5) metal i nemetali;
6) tri tvari.
7. Koja od sljedećih tvari može reagirati:
1) ugljikov monoksid (IV): HCl, 02, N02, KOH, H20;
2) magnezijev oksid: Ba (OH) 2, HCl, C02, 02, HN03;
3) željezo (II) hidroksid: KCl, HCl, KOH, 02, H20, HN03;
4) klorovodik: Zn, MgO, ZnCl2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Je li moguća interakcija između sljedećih tvari?
1) ugljikov monoksid (IV) i kalijev hidroksid;
2) kalijev hidrosulfat i kalcijev hidroksid;
3) kalcijev fosfat i sumporna kiselina;
4) kalcijev hidroksid i sumporni oksid (IV);
5) sumporna kiselina i kalijev hidroksid;
6) kalcijev bikarbonat i fosforna kiselina;
7) silicij-dioksid i sumpornu kiselinu;
8) cink oksid i fosfor-oksid (V).
Napišite jednadžbe mogućih reakcija, navedite uvjete u kojima se pojavljuju. Ako reakcije mogu dovesti do različitih tvari, onda naznačite koja je razlika u uvjetima njihove provedbe.
9. Dati jednadžbe reakcija za dobivanje sljedećih tvari: natrijev ortofosfat (4 načina), kalijev sulfat (7 načina), cinkov hidroksid.
10. Jedna od metoda za proizvodnju sode (natrijevog karbonata) je djelovanje vode i ugljičnog monoksida (IV) na natrijev aluminat. Sastavite jednadžbe reakcije.
11. Mijenjajući koeficijente, napišite proizvode reakcije:
1) MgO + 2H2S04 →
2) 2SO2 + Ba (OH) 2 →
3) 3N205 + 2Al (OH) 3 →
4) P205 + 4NaOH →
5) P205 + 6NaOH →
6) P205 + 2NaOH →
12. Izraditi jednadžbe reakcija za primanje različitih vrsta soli:
1) SO2 + Ba (OH) 2 → (srednje i kisele soli),
2) A1203 + H20 + HNO3 → (srednja sol, bazične soli),
3) Na2O + H2S → (srednje i kisele soli),
4) SO3 + Sa (OH) 2 → (srednje i bazične soli),
5) CaO + H 2 O + P 2 O 5 → (bazična sol, kisele soli).
13. Dovršite jednadžbe reakcije:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr2O3 + H2SO4 → AlOHSO4 + NaOH →
Cr203 + NaOH → CaCO3 + CO2 + H20 →
A1203 + HClO4 → Ca (HC03) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H2S →
NO2 + Ca (OH) 2 → CaSO4 + H2SO4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H2SO4 (nedovoljan) →
AlCl3 + NaOH (deficijentan) → (FeOH) Cl + NaHS →
AlCl3 + NaOH → Na2 ZnO2 + H2S04 (višak) →
AlC1 3 + NaOH (suvišak.) → Ca (Al02) 2 + HCl (višak) →
14. Zapišite jednadžbe reakcija s kojima možete izvršiti sljedeće transformacije:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na2 ZnO2 → ZnCl2
3) R → R 2 O 5 → N 3 RO 4 → K 3 RO 4 → S 3 (RO 4) 2 → N 3 RO 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgS04
5) Ca → CaO → Ca (OH) 2 → CaCO3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaSrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO2 → SO3 → NaHS04 → Na2S04 → BaS04
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na2 → Zn (NO3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO 3) 2 → Ca (NO3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO3 → Ca (NO3) 2
15) CuO → CuCl2 → Cu (NO3) 2 → CuO → CuSO4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO3) 2 → Ca (NO2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO4 → MgCl2 → Mg (NO3) 2 → Mg (OH) 2 → MgO
18) S02 → H2S03 → KHS03 → K2S03 → KHS03 → S02
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHS04 → K2S04 → KCl → KNO3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl2
35) ZnSO 4 → Zn (OH) 2 → ZnCl2 → AlCl3 → Al (OH) 3 → A1203
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) aluminijev sulfat → aluminijev klorid → aluminijev nitrat → aluminijev oksid → kalijev aluminat → aluminijev hidroksid → aluminijev hidroksid → aluminijev klorid.
41) Na → NaOH → Na3P04 → NaNO3 → HNO3 → N2O5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) barij → barijev hidroksid → barijev bikarbonat → barijev klorid → barijev karbonat → barijev klorid → barijev hidroksid
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO3 → CaCl2
51) S → CO 2 → NaHC03 → Na2C03 → CO 2
52) S → SO2 → K2S03 → KHS03 → K2S03
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) R 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO2 → KHS03 → CaSO3 → SO2
58) SO2 → H2S04 → CuSO4 → CuO → Cu (NO3) 2
59) KHSO 3 → CaS03 → Ca (HSO3) 2 → S02 → K2S04
60) S02 → CaS03 → S02 → NaHS03 → S02
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCl → KNO3 → K2SO4 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl2 → CuSO4 → CuS
66) Fe → FeSO4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO4 → Cu (OH) 2 → CuO → Cu
70) MgCO3 → MgO → MgCl2 → Mg (OH) 2 → Mg (NO3) 2
71) Mg → Mg (OH) 2 → MgS04 → MgC03 → Mg (HCO3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO3 → CO 2
73) CaCO3 → Ca (HCO3) 2 → CaCl2 → Ca (NO3) 2 → O2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K2S04 → KOH → K2C03 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO4 → CuO → Cu (NO3) 2 → CuO → CuS
79) ZnS → H2S → S02 → Na2S04 → NaOH
80) Al → Al (OH) 3 → A12 (SO4) 3 → A1203 → Al (OH) 3
81) CaCl2 → CaCO3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H2S → Ca (HSO3) 2 → S02
83) Na2S04 → NaCl → HCl → CaCl2 → Ca (NO3) 2
84) Na2S03 → S02 → H2S04 → HCl → FeCl2
85) S → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl2 → Cl2 → HCl → H2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH3 → NH4C1 → NH3H20 → NH4HC03 → NH3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2P04 → (NH4) 2HP04 → NH3 → NH4NO3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
Na) NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl2 → KC1 → K2S04 → KNO3 → KHS04
97) FeSO4 → FeS → SO2 → KHS03 → K2S04
98) KOH → Cu (OH) 2 → CuSO4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1203 → A1 (NO3) 3 → A1203 → Al (OH) 3
101) CaO → CaCO3 → CaSiO3 → Ca (NO3) 2 → O2
102) Cu → Cu (OH) 2 → Cu → CuSO4 → CuCl2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl2 → NaCl → HCl → CuCl2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl2 → CaS03 → Ca (OH) 2 → CaCl2 → Ca (NO3) 2
112) NaOH → Na2C03 → NaHS04 → NaN03 → NaHS04
113) Na2SiO3 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO3 → KHS04 → K2S04 → KCl → Na2S04
115) SiO2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl2 → Cu (NO3) 2 → NO2 → HNO3
117) Ca (NO3) 2 → O2 → Si02 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuS04 → Cu → CuS → CuO → CuCl2
120) Al → A12 (SO4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO3) 3
121) S → SO3 → H2SO4 → KHS04 → BaSO4
122) N2O5 → HNO3 → Cu (NO3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO3) 2 → CaO → CaCl2
125) NH3H20 → NH4C1 → NH3 → NH4HC03 → (NH4) 2C03
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) S02 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO3) 2
128) NH3H20 → NH4HC03 → CaCO3 → CaSiO3 → CaCl2
129) CuS04 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K3 → Al (OH) 3 → Na3 → A1C3 3 → Al (OH) 3
137) Al2O3 → KAlO2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K3 → Al (NO3) 3 → NaAlO2 → Al2O3
140) Be → Na2 → Be (OH) 2 → Na2 BeO2 → BaBeO2
EKSPERIMENTALNA ISKUSTVA NA TEMI "OSNOVNE RAZREDE ANORGANSKIH SPOJEVA"
ISKUSTVO 1.Reakcije neutralizacije.
a) Interakcija jake kiseline i jake baze.
Ulijte 5 ml 2N otopine klorovodične kiseline u porculansku posudu i dodajte u otopinu 2 n natrijeve lužine. Otopinu promiješamo staklenom šipkom i testiramo njezin učinak na lakmus, prenoseći kapi otopine u lakmus test. Potrebno je postići neutralnu reakciju (plavi i crveni lakmus papir ne mijenja boju). Dobivena otopina se upari do suhog. Što je nastalo? Zapišite jednadžbe molekularne i ionske reakcije.
b) Interakcija slabe kiseline i jake baze.
Ulijte u epruvetu 2 ml 2N alkalne otopine i dodajte otopinu octene kiseline dok otopina ne postane neutralna. Zapišite jednadžbe molekularne i ionske reakcije. Objasnite zašto se ravnotežna ionska reakcija u kojoj sudjeluje slabi elektrolit (octena kiselina) pomiče prema formiranju molekula vode.
ISKUSTVO 2. Amfoterni hidroksidi.
Iz reagensa u laboratoriju dobiti talog cinkovog hidroksida. Dobiveni talog protresti i ulijte male količine u 2 epruvete. U jednu od epruveta dodati otopinu klorovodične kiseline, u drugom - otopinu natrijevog hidroksida (višak). Što se promatra? Zapišite jednadžbe odgovarajućih reakcija u molekularnom i ionskom obliku.
ISKUSTVO 3.Kemijska svojstva soli.
a) Interakcija otopina soli sa stvaranjem slabo topljive tvari.
Ulijte 2 ml otopine natrijevog karbonata u epruvetu i dodajte otopinu barijevog klorida dok se ne pojavi bijeli talog. Napišite jednadžbu kemijske reakcije u ionskom i molekularnom obliku. Talog se dijeli na dva dijela. U jednu od epruveta sipajte otopinu sumporne kiseline, au drugu natrijev hidroksid. Napravite zaključak o topljivosti taloga u kiselinama i lužinama.
b) Interakcija otopine soli s kiselinama da se dobije hlapljivi spoj.
Ulijte 2 ml otopine natrijevog karbonata u epruvetu i dodajte malu količinu otopine klorovodične kiseline. Što se promatra? Napišite jednadžbe kemijske reakcije u ionskom i molekularnom obliku.
c) Interakcija otopina soli s alkalijama s nastankom hlapljivog spoja.
Ulijte malo otopine neke amonijeve soli u epruvetu, dodajte 1-2 ml otopine natrijevog hidroksida i zagrijte do vrenja. U epruvetu s reakcijskom smjesom napravite mokri crveni lakmus test. Što se promatra? Dajte objašnjenje. Napišite reakcijske jednadžbe.
g ) Interakcije soli s aktivnijim metalima od metala koji je dio soli.
Očistite čelika čelika finim brusnim papirom. Potom umočite u otopinu bakrenog sulfata. Nakon nekog vremena promatrajte otpuštanje bakra na površini nokta. Napišite odgovarajuću jednadžbu reakcije u ionskom i molekularnom obliku.
ISKUSTVO 4.Dobivanje osnovnih i kiselih soli.
a) Priprema olovnog hidroksokarbonata.
Doda se malo olova (II) oksida u otopinu olova (II) acetata i miješa se nekoliko minuta. Ohlađena otopina se odvodi iz taloga i kroz nju prolazi struja ugljičnog dioksida. Što se promatra? Precipitat se filtrira i suši između listova filter papira. Označite boju i prirodu nastalog precipitata olovnog hidroksoksarbonata. Napišite reakcijske jednadžbe. Napravite grafičku formulu dobivene soli.
b) Priprema magnezijevog bikarbonata.
Vrlo razrijeđenoj otopini neke magnezijeve soli dodajte malo otopine natrijevog karbonata. Koja tvar se taloži? Zasićena otopina s precipitatom s ugljičnim dioksidom. Promatrajte postupno otapanje taloga. Zašto se to događa? Napišite reakcijske jednadžbe.
ISKUSTVO 5.Dobivanje kompleksnih soli.
a) Stvaranje spojeva s kompleksnim kationom.
Dodajte otopinu amonijaka kap po kap u epruvetu s 2-3 ml otopine bakrenog (II) klorida dok ne nastane talog bakrenog (II) hidroksida, a zatim dodajte višak otopine amonijaka da otopi talog. Usporedite boju iona Cu 2+ s bojom dobivene otopine. Koji su ioni prisutni u otopini? Napišite reakcijsku jednadžbu za dobivanje složenog spoja.
b) Formiranje spojeva s kompleksnim anionom.
U 1-2 ml otopine živinog (II) nitrata dodajte kap po kap razrijeđenu otopinu kalijevog jodida kako bi nastao talog HgI 2. Zatim izlijte suvišak otopine kalijevog jodida dok se talog ne otopi. Napišite reakcije dobivanja složene soli.
ISKUSTVO 6.Priprema dvostrukih soli (kalijev aluminij).
Izvaže se 7,5 g Al2 (SO4) 3'18H20 i otopi u 50 ml vode, uzimajući dovoljno veliku porculansku posudu za tu svrhu. Izračunajte jednadžbu reakcije i odmjerite masu kalij sulfata potrebnu za reakciju. Pripremite vruću zasićenu otopinu kalijevog sulfata i ulijte je u porculansku posudu s otopinom aluminijevog sulfata uz miješanje. Promatrajte nakon nekog vremena taloženje kristala aluminijevog kalija. Nakon hlađenja i kristalizacije, izlijte matičnu otopinu, osušite alum kristale između listova filter papira i izvagajte nastale kristale. Izračunajte postotak prinosa.
ZADATKE U NASELJU
1. Propuštanjem suviška vodikovog sulfida kroz 16 g otopine bakar (II) sulfata dobije se 1,92 g taloga. Nađite maseni udio bakrenog sulfata u korištenoj otopini i količinu potrošenog sumporovodika.
2. Za potpuno taloženje bakra u obliku sulfida iz 291 cm3 otopine bakrenog (II) sulfata s masenim udjelom od 10% upotrijebljen je plin dobiven reakcijom 17,6 g željezovog (II) sulfida s viškom klorovodične kiseline. Nađite gustoću izvorne otopine bakrenog sulfata.
3. Plin oslobođen tijekom interakcije s otopinom K2S s razrijeđenom sumpornom kiselinom propušta se kroz višak otopine olova (II) nitrata. Nastali talog ima masu od 71,7 g. Nađite volumen reagirane otopine sumporne kiseline, ako je njegova gustoća 1,176 g / cm3, a maseni udio je 25%.
4. U otopinu koja sadrži 8 g bakar (II) sulfata, doda se otopina koja sadrži 4,68 g natrijevog sulfida. Talog se filtrira, filtrat se upari. Utvrdite masu tvari u filtratu nakon isparavanja i masu taloga bakrenog sulfida.
5. Dio željezovog (II) sulfida tretira se suviškom klorovodične kiseline. Dobiveni plin u reakciji s 12,5 cm3 otopine NaOH s masenim udjelom od 25% i gustoćom od 1,28 g / cm3 formira kiselinsku sol. Nađite masu izvornog željezovog sulfida.
6. Željezo (II) sulfid težine 176 g tretira se suviškom klorovodične kiseline, a nastali plin se spaljuje u suvišku zraka. Koji volumen otopine KOH s masenim udjelom od 40% i gustoćom od 1,4 g / cm3 je potreban da bi se potpuno neutralizirao plin proizveden tijekom izgaranja?
7. Prilikom prženja 100 g tehničkog pirita, dobiven je plin koji je potpuno neutraliziran s 400 cm3 otopine NaOH s udjelom mase 25% i gustoćom od 1,28 g / cm3. Odrediti maseni udio nečistoća u piritu.
8. U 2 g smjese željeza, željeznog oksida (II) i željeznog oksida (III) doda se 16 cm3 otopine HC1 s masenim udjelom od 20% i gustoćom od 1,09 g / cm3. Za neutralizaciju suviška kiseline, potrebno je 10,8 cm3 otopine NaOH s masenim udjelom od 10% gustoće od 1,05 g / cm3. Nađite mase tvari u smjesi ako je volumen oslobođenog vodika 224 cm 3 (NU).
9. Postoji smjesa Ca (OH) 2, CaCO3 i BaSO4 s masom od 10,5 g. Kada je smjesa obrađena sa suviškom klorovodične kiseline, oslobođeno je 672 cm3 (IU) plina, a 71,2 g kiseline reagiralo je s masom. udio od 10%. Odredite masu tvari u smjesi.
10. Postoji mješavina barijevog klorida, kalcijevog karbonata i natrijevog bikarbonata. Kada se 10 g ove smjese otopi u vodi, netopljivi ostatak je jednak 3,5 g. Prilikom kalciniranja 20 g početne smjese masa se smanjuje za 5,2 g. Pronađi se maseni udio tvari u početnoj smjesi.
11. Postoji otopina koja sadrži i sumpornu i dušičnu kiselinu. Za potpuno neutraliziranje 10 g ove otopine, konzumira se 12,5 cm3 otopine KOH s masenim udjelom od 19% i gustoćom od 1,18 g / cm3. Kada se višak barijevog klorida doda u 20 g iste smjese kiselinske otopine, ispada 4,66 g taloga. Nađite masene frakcije kiselina u smjesi.
12. Sav klorovodik dobiven iz 100 g smjese KC1 i KNO3 je otopljen u 71,8 cm3 vode. Pri kalciniranju 100 g iste smjese soli ostaje 93,6 g krutog ostatka. Nađite maseni udio klorovodika u vodi.
13. Propuštanjem 2 ml zraka (NU) kroz otopinu Ca (OH) 2 dobiveno je 3 g taloga soli ugljične kiseline. Nađite volumen i maseni udio CO 2 u zraku.
14. Ugljični dioksid propušta se kroz suspenziju koja sadrži 50 g CaC03. Reakcija je dala 8,96 dm3 plina (NU). Kolika je masa CaCO 3 u krutoj fazi?
15. Prilikom dodavanja vode u CaO, njegova se masa povećala za 30%. Koji je dio CaO (u masenim postotcima) ugašen?
16. Olovo (II) oksid mase 18,47 g zagrijavano je u struji vodika. Nakon reakcije masa dobivenog olova i neizreagiranog oksida iznosila je 18,07 g. Kolika je masa olovnog oksida koja nije reagirala?
17. Ugljik monoksid se propušta kroz željezo (III) oksid kada se zagrijava. Masa krutog ostatka nakon reakcije je 2 g manja od početne mase željeznog oksida. Kakav volumen CO potiče od reakcije (je li oksid potpuno smanjen)?
18. Postoji 8,96 dm3 (NU) smjese N2, CO2 i SO2 s relativnom gustoćom vodika 25. Nakon prolaska kroz višak otopine KOH, volumen smjese se smanjuje 4 puta. Pronađite količine plinova u izvornoj smjesi.
19. U dvije čaše nalazi se 100 g otopine HC1 s masenim udjelom od 2,5%. U jednu čašu se doda 10 g CaC03, u drugom - 8,4 g MgC03. Kako će se masa naočala nakon reakcije razlikovati?
20. Koji volumen (NU) sumpornog dioksida mora biti propušten kroz 200 cm3 otopine s 0,1% masenog udjela NaOH i gustoće od 1 g / cm3 da bi se dobila kisela sol?
21. Kolika je maksimalna količina (ugljični dioksid) ugljičnog dioksida može apsorbirati 25 cm3 otopine s 25% masenog udjela NaOH i gustoće od 1,1 g / cm3?
22. Kolika je minimalna zapremina otopine s masenim udjelom od 20% KOH i gustoćom od 1,19 g / cm3 koja može apsorbirati sav proizvedeni ugljični dioksid uz punu redukciju 23,2 g magnetita s ugljičnim monoksidom?
23. Koja je minimalna masa KOH koja mora reagirati s 24,5 g ortofosforne kiseline tako da je proizvod samo kalijev dihidrogen fosfat?
24. Kolika je minimalna masa Ca (OH) 2 za dodavanje 16 g otopine kalcijevog bikarbonata s masenim udjelom 5% soli da bi se dobila srednja sol?
25. Koju masu kalijevog hidrogenfosfata treba dodati u otopinu koja sadrži 12,25 g H3P04 tako da nakon toga otopina sadrži samo kalijev dihidrogen fosfat?
26. Otopina je sadržavala 56,1 g smjese kalcijevih i magnezijevih karbonata u suspenziji. Kako bi ih pretvorili u hidrokarbonate, potrošili su sav ugljični dioksid proizveden sagorijevanjem 7 dm 3 (NU) etana. Nađite masu kalcijevog karbonata u početnoj smjesi.
27. Pretvoriti 9,5 g smjese natrijevog hidrida i dihidrogen fosfata u srednje sol, potrebno je 10 cm3 otopine s masenim udjelom NaOH 27,7% i gustoću 1,3 g / cm3. Nađite masu hidrogen fosfata u smjesi.
28. Propuštanjem ugljičnog dioksida kroz otopinu koja sadrži 6 g NaOH, dobiveno je 9,5 g smjese kiselih i srednjih soli. Nađite količinu potrošenog ugljičnog dioksida.
29. Nakon prolaska 11,2 dm3 (NU) CO2 kroz otopinu KOH, dobiveno je 57,6 g smjese kiselih i srednjih soli. Pronađite masu srednje soli.
30. Koja se masa ortofosforne kiseline mora neutralizirati kako bi se dobilo 1,2 g dihidro- i 4,26 g natrijevog hidrogen fosfata?
31. U otopinu sumporne kiseline doda se NaOH kako bi se dobilo 3,6 g hidrosulfata i 2,84 g natrijevog sulfata. Odredite kemijske količine kiseline i lužine koje su reagirale.
32. Nakon prolaska klorovodika kroz 200 cm3 otopine NaOH s masenim udjelom od 10% i gustoćom od 1,1 g / cm3, maseni udio NaOH u dobivenoj otopini se smanjio za polovicu. Odredite maseni udio NaCl u dobivenoj otopini.
33. Otapanje 14,4 g smjese bakra i njegovog oksida (II) potrošilo je 48,5 g otopine s masenim udjelom HNO3 od 80%. Nađite masene udjele bakra i oksida u početnoj smjesi.
34. Masa natrijevog oksida od 6,2 g je otopljena u 100 cm3 vode i dobivena je otopina br. 1. Tada je u otopinu dodana klorovodična kiselina s masenim udjelom od 10% sve dok medij nije postao neutralan, te je dobivena otopina br. :
1) maseni udjeli tvari u otopinama br. 1, 2;
2) masa otopine HC1, koja je neutralizirala otopinu broj 1.
35. 3 g cinka reagira s 18,69 cm3 otopine HCl s masenim udjelom od 14,6% i gustoćom od 1,07 g / cm3. Kada se zagrijava, dobiveni plin se propušta preko vrućeg CuO mase 4 g. Koja je masa dobivenog bakra?
36. Plin oslobođen nakon obrade kalcijevog hidrida sa suviškom vode, propušten je iznad FeO. Kao rezultat, masa oksida se smanjila za 8 g. Nađite masu CaH2 obrađenu vodom.
37. Tijekom kalciniranja uzorka CaCO 3, njegova se masa smanjila za 35,2%. Kruti reakcijski produkti su otopljeni u suvišku klorovodične kiseline da se dobije 0,112 dm (NU) plina. Odredite masu izvornog uzorka kalcijevog karbonata.
38. Bakar nitrat se razgradio, a dobiveni bakrov (II) oksid potpuno je reduciran vodikom. Dobiveni proizvodi su prošli kroz cijev s P 2 O 5, a masa cijevi nakon toga povećana za 3,6 g. Kolika je minimalna zapremina sumporne kiseline s masenim udjelom od 88% i gustoćom od 1,87 g / cm3 potrebnom za otapanje dobiveno u pokusu bakra i što je masa razgrađene soli?
39. Nakon apsorpcije dušikovog oksida (IV) suviškom otopine KOH u hladnom u odsutnosti kisika dobiveno je 40,4 g KNO3. Koja je tvar još uvijek formirana i koja je njezina masa?
40. Neutralizirati 400 g otopine koja sadrži solnu kiselinu i sumporna kiselina, potrošeno je 287 cm3 otopine natrijevog hidroksida s masenim udjelom od 10% i gustoćom od 1,115 g / cm3. Ako se u 100 g početne otopine doda suvišak otopine barijevog klorida, ispada 5,825 g taloga. Odredite masene udjele kiselina u početnoj otopini.
41. Nakon što je ugljični dioksid propušten kroz otopinu natrijevog hidroksida, dobiveno je 13,7 g smjese srednjih i kiselih soli. Za pretvaranje u natrijev klorid potrebno je 75 g klorovodične kiseline s masenim udjelom HCl od 10%. Nađite količinu apsorbiranog ugljičnog dioksida.
42. Mješavina klorovodične i sumporne kiseline s ukupnom masom od 600 g otopine s istim masenim frakcijama kiselina obrađena je suviškom natrijevog bikarbonata i dobiveno je 32,1 dm3 plina (Br.). Nađite maseni udio kiselina u početnoj smjesi.
43. Za neutralizaciju 1 dm3 otopine NaOH, potrošeno je 66.66 cm3 otopine HNO3 s udjelom mase 63% i gustoćom od 1.5 g / cm3. Koji volumen otopine sumporne kiseline s masenim udjelom od 24,5% i gustoćom od 1,2 g / cm3 bi bio potreban da bi se neutralizirala ista količina lužine?
44. U kojem volumnom omjeru treba uzeti otopinu sumporne kiseline s masenim udjelom od 5% i gustoćom od 1,03 g / cm3 i otopinom barijevog hidroksida s masenim udjelom od 5% i gustoćom od 1,1 g / cm3 za potpunu neutralizaciju? Zamislite odgovor kao kvocijent volumena alkalne otopine na kiselinsku otopinu.
45. Izračunajte minimalnu zapreminu otopine amonijaka gustoće od 0,9 g / cm3 i maseni udio od 25%, koji je potreban za potpunu apsorpciju ugljičnog dioksida dobivenog razgradnjom 0,5 kg prirodnog vapnenca s masenim udjelom kalcijevog karbonata od 92%.
46. Za potpunu pretvorbu 2,92 g smjese natrijevog hidroksida i natrijevog karbonata u klorid, potrebno je 1,343 dm 3 klorovodika (NU). Nađite masu natrijevog karbonata u smjesi.
47. U 25 g otopine bakrenog (II) sulfata s masenim udjelom od 16% doda se količina otopine natrijevog hidroksida s masenim udjelom od 16%. Nastali talog je filtriran, nakon čega je filtrat bio alkalni. Za potpuno neutraliziranje filtrata, potrebno je 25 cm3 otopine sumporne kiseline s molarnom koncentracijom 0,1 mol / dm 3 otopine. Izračunajte masu dodane otopine natrijevog hidroksida.
48. Tvar dobivena potpunom redukcijom CuO s masom od 15,8 g vodika s volumenom 11,2 dm3 (NU) otopljena je zagrijavanjem u koncentriranoj sumpornoj kiselini. Koliki je volumen plina koji se oslobađa kao rezultat reakcije?
49. Za potpunu neutralizaciju 50 cm3 klorovodične kiseline masenim udjelom HCl od 20% i gustoću od 1,10 g / cm3, upotrijebljena je otopina kalijevog hidroksida masenog udjela KOH od 20%. Kolika je količina vode sadržane u dobivenoj otopini?
50. Plin dobiven propuštanjem suviška CO2 preko 0,84 g vrućeg ugljena, šalje se u reakciju s 14,0 g zagrijanog bakar (II) oksida. Koji volumen otopine dušične kiseline s masenim udjelom od 63% i gustoćom od 1,4 g / cm3 je potreban da bi se potpuno otopila tvar dobivena u posljednjoj reakciji?
51. Kada je kalcinirano do konstantne mase bakar (II) nitrata, težina soli se smanjila za 6,5 g. Koja je težina soli bila razgrađena?
52. Kada je korišten višak klorovodične kiseline, 6.72 dm3 (NW) plina je oslobođeno na mješavini aluminija s nepoznatim monovalentnim metalom, a masa smjese je prepolovljena. Kada se ostatak tretira razrijeđenom dušičnom kiselinom, oslobađa se 0,373 dm3 (NU) NO. Prepoznajte nepoznati metal.
53. Masa uzorka krede je 105 g, a kemijska količina elementa kisika u njegovom sastavu je 1 mol. Odredite maseni udio CaCO 3 u uzorku krede (kisik je uključen samo u sastav kalcijevog karbonata).
54. U interakciji sumporovog oksida (VI) s vodom dobivena je otopina s masenim udjelom sumporne kiseline od 25%. Kada se u otopinu doda suvišak Ba (OH) 2, taloži se precipitat težine 29,13 g. Koje su mase SO3 i H20 potrošene na stvaranje kiselinske otopine?
55. Kada se propušta SO2 kroz 200 g otopine s masenim udjelom NaOH od 16%, nastaje smjesa soli, uključujući 41,6 g kiselinske soli. Kolika je masa sumpora koji sadrži 4,5% nečistoća po masi, korištena je za dobivanje SO2? Kolika je težina srednje soli?
56. Interakcija s 80 g Ca (NO3) 2 otopine uzela je 50 g otopine Na2C03. Precipitacija je odvojena, dok je obrada sa suviškom klorovodične kiseline oslobođena 2,24 dm3 (NU) plina. Koji su maseni udjeli soli u početnim otopinama? Koliki je maseni udio natrijevog nitrata u otopini nakon odvajanja taloga?
57. Kada cink reagira sa sumpornom kiselinom, formira se 10 dm 3 (NU) smjese SO2 i H2S s relativnom gustoćom argona od 1,51. Kolika je količina otopljenog cinka u kemijskoj tvari? Koliki je maseni udio SO2 u plinskoj smjesi?
58. Uzorak mješavine piljevine od cinka i aluminija ukupne mase 11 g otopljen je u suvišku alkalne otopine. Odredite volumen (NU) oslobođenog plina, ako je maseni udio cinka u smjesi 30%.
59. Natrijev hidroksid mase 4,0 g legiran je aluminijevim hidroksidom težine 9,8 g. Izračunajte masu dobivenog natrijevog metaluminata.
60. Pri obradi 10 g smjese bakra i aluminija s koncentriranom dušičnom kiselinom u sobnoj temperaturi otpušteno 2,24 dm 3 plina (NU). Koji volumen (NU) plina će se osloboditi prilikom obrade iste mase smjese s viškom otopine KOH?
61. Legura bakra i aluminija težine 20 g tretirana je suviškom alkalija, netopivi ostatak je otopljen u koncentriranoj dušičnoj kiselini. Dobivena sol je izolirana, kalcinirana do konstantne težine i dobiveno je 8 g krutog ostatka. Odredite zapreminu otopine NaOH s masenim udjelom od 40% i gustoćom od 1,4 g / cm3).
62. Smjesa aluminija i metalnog oksida (II) (ne-amfoterni oksid) težine 39 g tretirana je suviškom otopine KOH, emitirani plin je spaljen da se dobije 27 g vode. Neotopljeni ostatak je potpuno otopljen u 25,2 cm3 otopine s masenim udjelom HC1 od 36,5% i gustoćom od 1,19 g / cm3). Odredite oksid.
63. Mješavina čipova cinka i bakra bila je obrađena sa suviškom otopine KOH, dok je oslobođen plin od 2.24 dm3 (NU). Za potpuno kloriranje istog uzorka metala bio je potreban klor s volumenom od 8,96 dm3 (NU). Izračunajte maseni udio cinka u uzorku.
64. Smjesa piljevine željeza, aluminija i magnezija mase 49 g tretirana je viškom razrijeđenog H2S04, čime je dobiveno 1,95 mol plina. Drugi dio iste smjese težine 4,9 g tretira se suviškom alkalne otopine, dobiva se 1,68 dm3 (NU) plina. Pronađite masu metala u smjesi.
65. Kolika je masa nastalog sedimenta pri spajanju otopina koje sadrže 10 g NaOH i 13,6 g ZnCl2?
66. Postoje dva dijela smjese Al, Mg, Fe, Zn, isti u molarnom sastavu, svaki težak 7,4 g. Jedan dio je otopljen u klorovodičnoj kiselini i dobiveno je 3,558 dm 3 plina (NU), a drugi u alkalnoj otopini i Dobiveno je 2.016 dm3 plina (NU). Poznato je da u obje smjese ima 3 Zn atoma po atomu A1. Pronađite masu metala u smjesi.
67. Smjesa bakra, magnezija i aluminija težine 1 g tretirana je suviškom klorovodične kiseline. Otopina je filtrirana, dodan je višak otopine NaOH u filtrat. Talog je odvojen i kalciniran do konstantne mase od 0.2 g. Ostatak koji je nakon obrade klorovodičnom kiselinom bio neotopljen, kalciniran je na zraku i dobiveno je 0.8 g crne tvari. Pronađite maseni udio aluminija u smjesi.
68. Kada se zagrijava u struji kisikove legure cinka, magnezija i bakra, masa smjese se povećala za 9,6 g. Proizvod je djelomično otopljen u lužinama, a 40 cm3 otopine s masenim udjelom KOH 40% i gustoće 1,4 g / cm je potrebno za otapanje. 3. Za reakciju s istim dijelom legure potreban je 0,7 mol HCl. Nađite kemijske količine metala u leguri.
69. Legura bakra i cinka težine 5 g tretirana je suviškom otopine NaOH. Tada se kruti ostatak odvoji i tretira s koncentriranom HN03, tako dobivena sol se izolira, kalcinira do konstantne težine i dobije se 2,5 g krutog ostatka. Odredite masu metala u leguri.
70. Legura bakra i aluminija težine 12,8 g tretirana je suviškom klorovodične kiseline. Neotopljeni ostatak je otopljen u koncentriranoj dušičnoj kiselini, dobivena otopina je uparena, suhi ostatak je kalciniran do konstantne težine i dobiveno je 4 g krutine. Odredite maseni udio bakra u leguri.
71. U kojem omjeru mase treba uzeti dva dijela A1, tako da kada se jedan doda u otopinu alkalija, a drugi u jednake količine vodika, ispuštaju se u klorovodičnu kiselinu?
72. Kada se obrađuje smjesa aluminija i bakar (II) oksida s viškom otopine KOH, otpušta se 6,72 dm3 (NU) plina, a otapanjem istog dijela smjese u koncentriranom HN03 na sobnoj temperaturi dobije se 75,2 g soli. Nađite masu početne smjese tvari.
73. Koja se masa bakrovog (II) oksida može obnoviti pomoću vodika dobivenog reakcijom viška aluminija s 139,87 cm3 otopine s 40% NaOH i gustoćom od 1,43 g / cm3?
74. Uz potpunu oksidaciju 7,83 g slitine dvaju metala nastalo je 14,23 g oksida, tijekom kojih je ostatak lužine ostao nerazrijeđen 4,03 g sedimenta. Odredite kvalitativni sastav metala koji formiraju leguru, ako njihovi kationi imaju oksidacijsko stanje +2 i +3, a molarni omjer oksida je 1: 1 (pretpostavimo da metalni oksid s oksidacijskim stanjem +3 ima amfoterna svojstva).
75. Otopljene su dvije porcije aluminija, iste mase, jedna u otopini kalijevog hidroksida, druga u klorovodičnoj kiselini. Kako se volumeni evoluiranih plinova (nos) odnose jedni na druge?
76. Legura bakra s aluminijem težine 1.000 g obrađena je suviškom alkalne otopine, neotopljeni precipitat je otopljen u dušičnoj kiselini, zatim je otopina uparena, ostatak je kalciniran do konstantne težine. Masa novog ostatka je 0,398 g. Koja je masa metala u slitini?
77. Legura cinka i bakra mase 20 g tretirana je suviškom otopine NaOH s masenim udjelom od 30% i gustoćom od 1,33 g / cm3. Kruti ostatak je izoliran i obrađen sa suviškom koncentrirane otopine HNO3. Sol nastala tijekom ovog postupka izolirana je i kalcinirana do konstantne težine. Masa krutog ostatka je 10.016 g. Izračunajte masene udjele metala u leguri i potrošeni volumen alkalne otopine.
78. Legura bakra i aluminija težine 2 g tretirana je suviškom alkalne otopine. Ostatak je filtriran, ispran, otopljen u HN03, otopina je uparena i kalcinirana do konstantne težine. Masa ostatka nakon kalcinacije iznosila je 0,736 g. Izračunajte masene udjele metala u leguri.
79. Kloriranje smjese željeza, bakra i aluminija zahtijeva 8,96 dm 3 klora (NU), a za interakciju istog uzorka s klorovodikom potrebno je 5,6 dm 3 (NU). U interakciji s istom masom mješavine metala s lužinom oslobađa se 1,68 dm 3 (NU) plina. Nađite kemijske količine metala u smjesi.
80. Kalijev hidrid težine 5,0 g otopljen je u vodi volumena 80 cm3 i u dobivenu otopinu je dodan aluminij težine 0,81 g. Nađite masene frakcije tvari u dobivenoj otopini s točnošću do tisućinki postotka.
POPIS LITERATURE
1. Barannik, V.P. Suvremena ruska nomenklatura anorganskih spojeva / V.P. Barannik // Časopis sveučilišnog kemijskog društva. DI Mendeljejev. - 1983. - tom XXVIII. - str.
2. Wroblewski, A.I. Simulator kemije / A.I. Wroblewski. - 2. izdanje, Pererab. i dodajte. - Minsk: Krasiko-Print, 2007. - 624 str.
3. Glinka, N.L. Zadaci i vježbe iz opće kemije: studije. priručnik za sveučilišta / ed. VA Rabinovich i H.M. Rubina. - M .: Integral-Press, 2004. - 240 str.
4. Lidin, R.A. Zadaci u općoj i anorganskoj kemiji: studije. priručnik za studente viših. Proc. institucije / R.A. Lidin, V.A. Milk, L.L. Andreev; by ed. RA Lidin. - M .: VLADOS, 2004. - 383 str.
5. Lidin, R.A. Osnove nomenklature anorganskih tvari / R.A. Lidin [et al.]; by ed. BD Stepin. - M.: Chemistry, 1983. - 112 str.
6. Stepin, B.D. Primjena IUPAC pravila na nomenklaturu anorganskih spojeva na ruskom jeziku / B.D. Stepin, R.A. Lidin // Časopis sveučilišnog kemijskog društva. DI Mendeljejev. - 1983. - tom XXVIII. - 17–20.
| Uvod ……………………………………………………………… Opća pravila za asortiman anorganskih tvari ………… .. Oksidi ………………………………… ……………………………… Osnovni oksidi ………………………………………………………… ... Kiseli oksidi ………………………………… ............................ Amfoterni oksidi ……………………………………………………… .. Dobivanje oksida ………………………………………………………… Vježbe za samostalni rad na Tema “Oksidi” ……………………………………………………. Kiseline ……………………………………………………………………. Vježbe za samostalan rad na temu “Kisele kiseline” ……………………………………………………………………………………………… ……… .. Vježbe za samostalni rad na temu „Temelji“ ………………………………………………………. Soli …………………………………………………………………………. Vježbe za samostalni rad na temu "Soli" .......................................................... Genetski odnos između klasa anorganskih spojeva ......................................... Vježbe za samostalni rad na temu „Genetska povezanost klasa anorganskih spojeva“ ……………………………………………… Eksperimentalni pokusi na temu „Glavne klase anorganskih spojeva …………… ……… .. Zadaci namire …………………………………………………………… Literatura …………………………………………………… |
obrazovanje: popraviti pojam "genetske serije", "genetske veze"; naučiti kako napraviti genetske nizove elemenata (metali i nemetali), sastaviti jednadžbe reakcije koje odgovaraju genetskoj seriji; provjeriti asimilaciju znanja o kemijskim svojstvima oksida, kiselina, soli, baza;
razvoju: razviti sposobnost analiziranja, uspoređivanja, sumiranja i donošenja zaključaka, sastavljanja jednadžbi kemijskih reakcija;
obrazovni : promicati stvaranje znanstvenog svjetonazora.
2. Pružanje nastave: tablice "Periodni sustav", "Tablica topljivosti", "Serija aktivnosti metala", upute za studente, zadaci za provjeru znanja.
3. Redoslijed izvedbe:
3.1. Frontalni pregled.
3.2. Rješavanje zadataka.
3.3. Izvršite verifikacijski rad na opcijama.
4. Izgled izvješća:
4.1. Napišite temu i ciljeve praktične nastave.
4.2. Zabilježite rješavanje problema.
4.3. Riješite svoju verziju samostalnog rada, odluku o pisanju u bilježnicu i proslijedite nastavniku na pregled.
Napredak u radu
1. Frontalni razgovor o:
Što je genetska veza?
Genetske veze - to su veze između različitih klasa na temelju njihovih međusobnih konverzija.
Što je genetska serija?
Genetski red - niz tvari - predstavnici različitih klasa, koji su spojevi jednog kemijskog elementa, povezani međusobnim konverzijama i odražavaju transformacije tih tvari. Temelj tih serija je isti element.
Koje vrste genetskih serija se obično dodjeljuju?
Među metalima postoje dvije vrste redaka:
a) Genetska serija u kojoj alkali djeluju kao baza. Ova serija može se prikazati pomoću sljedećih transformacija:
metal → osnovni oksid → lužina → sol
na primjer, genetska serija kalija K → K2O → KOH → KCl
b) Genetska serija, gdje je baza netopljiva baza, tada se serija može predstaviti kao lanac transformacija:
metal → oksid baze → sol → netopljiva baza → oksid baze → metal
na primjer: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Od nemetala moguće je razlikovati i dvije vrste redaka:
a) Genetska serija nemetala, gdje topljiva kiselina djeluje kao karika u nizu. Lanac transformacija može se predstaviti na sljedeći način: ne-metal → kiseli oksid → topljiva kiselina → sol.
Na primjer: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Genetski niz nemetala, gdje netopljiva kiselina: nemetalni → kiseli oksid → sol → kiselina → kiseli oksid → nemetali djeluju kao karika u seriji
Na primjer: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Izvršavanje zadataka za opcije:
| Opcija 1 | Opcija 2 |
|
I opcija: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
Opcija II: Na2S04, NaOH, Na, Na2O2, Na2O
Domaća zadaća: nacrtati postupni prijelaz iz kalcija u kalcijev karbonat i pripremiti izvješće o uporabi bilo koje soli u medicini (koristeći dodatnu literaturu).
Upute za praktičnu nastavu
Genetski odnos između glavnih klasa anorganskih tvari.
ciljevi: popraviti pojam "genetske serije", "genetske veze"; naučiti napraviti genetske nizove elemenata (metali i nemetali), sastaviti jednadžbe reakcije koje odgovaraju genetskoj seriji; ponoviti svojstva oksida, kiselina, soli, baza.
Napredak u radu
Zapišite definicije pojmova:
Genetski odnos - __________________________________________
Genetski redak - ___________________________________________
Genetski nizovi metala u kojima alkali djeluju kao baza. može se općenito predstaviti: metalni → bazični oksid → alkalijska → sol. Napravite ovu seriju pomoću kalija. Napišite jednadžbe reakcija pomoću kojih možete ostvariti ovaj lanac transformacija.
Genetska serija nemetala, gdje topiva kiselina djeluje kao veza u nizu može se predstaviti na sljedeći način: nemetalna → kisela oksid → topiva kiselina → sol. Neka ova serija koristi fosfor. Napišite jednadžbe reakcija pomoću kojih možete ostvariti ovaj lanac transformacija.
Genetski red, gdje je baza netopljiva baza može se predstaviti lancem transformacija: metalni → bazični oksid → sol → netopljiva baza → bazični oksid → metal. Izgradite ovu seriju pomoću bakra. Napišite jednadžbe reakcija pomoću kojih možete napraviti ovaj lanac transformacija.
Genetska serija nemetala, gdje netopljiva kiselina djeluje kao veza u nizu može biti predstavljen lancem transformacija: nemetalni → kiseli oksid → sol → kiselina → kiseli oksid → nemetali. Izgradite ovu seriju pomoću silicija. Napišite jednadžbe reakcija pomoću kojih možete napraviti ovaj lanac transformacija.
Obavljajte zadatke za opcije:
| Opcija 1 | Opcija 2 |
|
1. Odaberite formulaciju oksida u svojoj verziji, objasnite svoj izbor, na temelju znanja o karakteristikama sastava ove klase spojeva. Nazovite ih.
2. U stupcu formule vaše varijante, pronađite formule kiseline i objasnite svoj izbor na temelju analize sastava tih spojeva.
3. Odrediti valencije kiselinskih ostataka u kiselom sastavu.
4. Odaberite formule soli i nazovite ih.
5. Napravite formule soli koje se mogu formirati s magnezijem i kiselinama iz vaše varijante. Zapiši ih, nazovi ih.
6. U stupcu formule svoje verzije pronađite osnovne formule i objasnite svoj izbor na temelju analize sastava tih spojeva.
7. U vašoj varijanti odaberite formule tvari s kojima otopina ortofosforne kiseline (klorovodična, sumporna) može reagirati. Napravite odgovarajuće jednadžbe reakcije.
9. Između formula vaše opcije, odaberite formule tvari koje mogu međusobno djelovati. Napravite odgovarajuće jednadžbe reakcije.
10. Napravite lanac genetskih veza anorganskih spojeva, koji će sadržavati tvar, čija je formula dana u vašoj verziji na prvom mjestu.
Iz tih supstanci napravite genetsku liniju koristeći sve formule. Napišite reakcijske jednadžbe pomoću kojih možete ostvariti ovaj lanac transformacija:
ja opcija: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
IIopcija: Na2S04, NaOH, Na, Na2O2, Na2O
Domaća zadaća: nacrtati postupni prijelaz iz kalcija u kalcijev karbonat i pripremiti izvješće o uporabi bilo koje soli u medicini (koristeći dodatnu literaturu).
