Kemijska formula sumporne kiseline. Sumporna kiselina: kemijska svojstva, priprema
H2SO3, slaba dvobazna kiselina. U slobodnom obliku nije dodijeljena, postoji u vodenim otopinama. Sulfiti sumporne kiseline ... Veliki enciklopedijski rječnik
Sumporna kiselina - (H2S03) slaba dvobazna kiselina. Postoji samo u vodenim otopinama. Soli S. to. Sulfiti. Primijenjen u papirnoj i prehrambenoj industriji. Vidi i Kiseline i anhidridi ... Ruska enciklopedija o zaštiti na radu
sumporna kiselina - [A.S. Goldberg. Engleski ruski energetski rječnik. Teme energije općenito EN sumporne kiseline ... Tehnički vodič za prevoditelje
H2SO3, slaba dvobazna kiselina. U slobodnom obliku nije dodijeljena, postoji u vodenim otopinama. Sulfiti sumporne kiseline. * * * Sumporna kiselina, sumporna kiselina, H2SO3, slaba dvobazna kiselina. Besplatno nije odabrano, ... ... Enciklopedijski rječnik
sumporna kiselina - sulfito rūgštis statusas Tritis kemija formula H₂SO₃ atitikmenys: angl. sumporna kiselina rus. sumporna kiselina ryšiai: sinonimas - vandenilio trioksosulfatas (2–) Chemijos terminų aiškinamasis žodynas
H2SO3, slaba dvobazna kiselina koja odgovara stupnju oksidacije sumpora +4. Poznat samo u razrijeđenim vodenim otopinama. Konstante disocijacije: K1 = 1,6 · 10 2, K2 = 1,0 · 10 7 (18 ° C). Daje dva reda soli: normalni sulfiti i kiseli ... Velika sovjetska enciklopedija
H2SO3, slaba dvobazna kiselina. U slobodnom obliku nije istaknuto, postoji u vodama. p rah. Soli S. k. Sulfiti ... Prirodne znanosti. Enciklopedijski rječnik
Pogledajte Sumpor ... Enciklopedijski rječnik FA Brockhaus i I.A. Efron
Sumporni dioksid (dioksid) nastaje spaljivanjem sumpora u zraku ili kisiku. Također se dobiva kalciniranjem u zraku ("spaljivanjem") sulfida metala, primjerice željeznih pirita:
Prema toj reakciji, sumporni dioksid se obično dobiva u industriji (za druge industrijske metode dobivanja cm, 9 § 131).
Sumporni dioksid je bezbojni plin ("sumporni dioksid") s oštrim vrućim sumporom. Vrlo se lako kondenzira u bezbojnu tekućinu koja ključa. Kada tekućina ispari, dolazi do snažnog pada temperature (prije).
Sumporni dioksid je visoko topljiv u vodi (oko 40 volumena u 1 volumenu vode); istodobno dolazi do reakcije s vodom djelomično i nastaje sumporna kiselina:
Tako je sumporni dioksid anhidrid sumporne kiseline. Kada se zagrijava, topljivost se smanjuje i ravnoteža se pomiče ulijevo; postupno se iz otopine ponovno oslobađa sav sumporni dioksid.
Molekula je izgrađena slično molekuli ozona. Jezgre njegovih sastavnih atoma tvore jednakokračan trokut:
Ovdje je atom sumpora, kao i središnji atom kisika u molekuli ozona, u stanju a-hibridizacije i kut je blizu. Orijentirana okomito na ravninu molekule, orbita atoma sumpora ne sudjeluje u hibridizaciji. Zbog ovih orbitala i, slično orijentiranih, orbitala atoma kisika, formira se trocentralna veza; elektronski par koji ga nosi nosi sva tri atoma molekule.
Sumporni dioksid se koristi za proizvodnju sumporne kiseline, a također (u mnogo manjim količinama) za izbjeljivanje slame, vune, svile i kao dezinficijensa (za uništavanje plijesni u podrumima, podrumima, bačvama za vino, spremnicima za fermentaciju).
Sumporna kiselina je vrlo lomljiv spoj. Poznat je samo u vodenim otopinama. Pokušavajući izolirati sumpornu kiselinu, ona se raspada u vodu. Na primjer, kada koncentrirana sumporna kiselina djeluje na natrijev sulfit, umjesto sumporne kiseline otpušta se sumporni dioksid:
Otopina sumporne kiseline mora biti zaštićena od zraka, inače ona, apsorbirajući kisik iz zraka, polako oksidira u sumpornu kiselinu:
Sumporna kiselina je dobar redukcijski agens. Na primjer, slobodni halogeni se vraćaju u vodikov halogenide:
![]()
Međutim, pri interakciji s jakim redukcijskim sredstvima, sumporna kiselina može igrati ulogu oksidacijskog sredstva. Dakle, njegova reakcija sa sumporovodikom uglavnom se odvija prema jednadžbi:
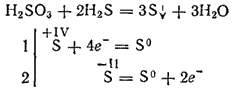
Budući da je dibazična, sumporna kiselina tvori dva reda soli. Njegove srednje soli se nazivaju sulfiti, kisele soli - hidrosulfiti.
Poput kiseline, sulfiti i hidrosulfiti su reducensi. Kada se oksidiraju, dobivaju se soli sumporne kiseline.
Sulfiti najaktivnijih metala tijekom kalciniranja razgrađuju se formiranjem sulfida i sulfata (samo-oksidacijska reakcija - samoreklamacija):
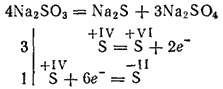
Kalijev i natrijev sulfiti koriste se za izbjeljivanje nekih materijala u tekstilnoj industriji za bojenje tkanina, u fotografiji. Rješenje (ova sol postoji samo u otopini) koristi se za obradu drva u tzv. Sulfitnu pulpu, iz koje se zatim dobiva papir.
Sumporna kiselina može reagirati s kisikom. To tvori sumpornu kiselinu. Ova reakcija traje jako dugo i moguća je samo ako se krše pravila skladištenja. Sumporna kiselina ima svojstva oksidacije i redukcije. Uz njegovu pomoć možete dobiti halogene kiseline. Vodena otopina u reakciji s klorom stvara klorovodičnu i sumpornu kiselinu.
Kada reagira s jakim redukcijskim sredstvima, sumporna kiselina ima ulogu oksidacijskog sredstva. Jedna od tih tvari je vodikov sulfid, plin s vrlo neugodnim mirisom. U interakciji s vodenom otopinom sumporne kiseline, ona tvori sumpor i vodu. Soli sumporne kiseline također imaju reducirajuća svojstva. Podijeljeni su na sulfite i hidrosulfite. Reakcije oksidacije ovih soli proizvode sumpornu kiselinu.
Proizvodnja sumporne kiseline
Sumporna kiselina nastaje samo interakcijom sumpornog dioksida i vode. Trebate dobiti kiseli plin. To se može učiniti s bakrom i sumpornom kiselinom. Lagano ulijte koncentriranu sumpornu kiselinu u epruvetu i bacite u nju komad bakra. Zagrijte cijev žaruljom.
Kao rezultat zagrijavanja nastaje bakreni sulfat (bakrov sulfat), voda i sumporni dioksid, koji se uz pomoć posebne cijevi dovodi do konusa čistom vodom, Na taj način može se dobiti sumporna kiselina.
Zapamtite da je sumporni dioksid štetan za ljude. To uzrokuje oštećenje dišnih putova, gubitak apetita i glavobolju. Dugotrajno udisanje može uzrokovati nesvjesticu. Kada radite s njim potrebno je oprez.
Upotreba sumporne kiseline
Sumporna kiselina ima antiseptička svojstva. Koristi se za dezinfekciju površina, fermentaciju zrna. Može se koristiti za izbjeljivanje nekih tvari koje se razgrađuju kada reagiraju s jakim oksidansima (na primjer, klor). Takve tvari uključuju vunu, svilu, papir i neke druge. Njegova antibakterijska svojstva koriste se za sprečavanje fermentacije vina u bačvama. Tako se plemenito piće može čuvati jako dugo, dobivajući plemeniti okus i jedinstvenu aromu.
Sumporna kiselina se koristi u proizvodnji papira. Dodavanje ove kiseline uključeno je u tehnologiju proizvodnje sulfitne pulpe. Zatim se tretira otopinom kalcijevog hidrosulfita kako bi se vlakna vezala zajedno.
