Shema strukture silicija. Struktura ljuske elektrona
Atomska struktura Položaj u PS: Razdoblje III; skupina IV, vodeći; Naboj kernela: +14 Si; Relativna atomska masa: Ar (Si) = 28 Atomska struktura: p = 14, e = 14, n = = 14 Elektronska formula: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
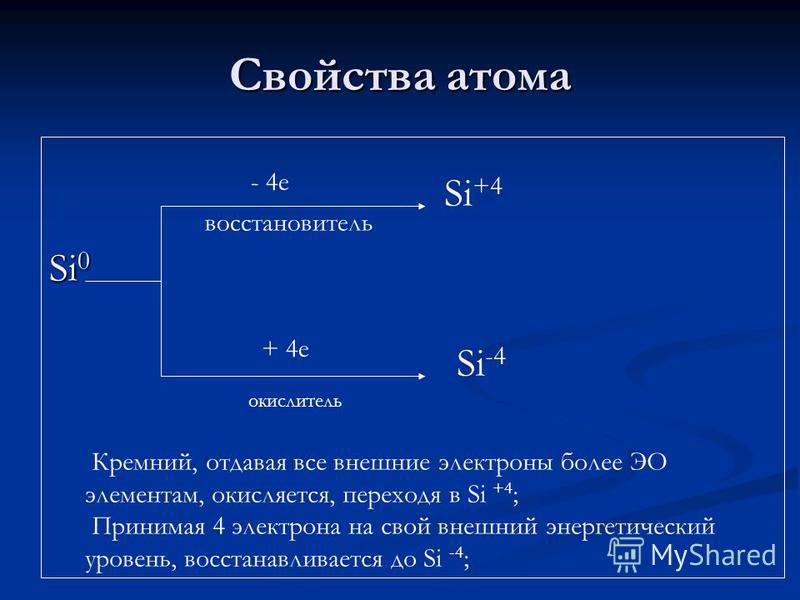
Atomska svojstva Si e redukcijsko sredstvo + 4 e oksidans Si + 4 Si -4 Silicij, koji svim vanjskim elektronima daje više EO elemenata, oksidira, prelazeći u Si + 4; Uzimajući 4 elektrona na svoju vanjsku razinu energije, reducira se na Si-4;

Fizička svojstva silicija Silicij je ne-metal, on postoji u kristalnom i amorfnom stanju. Kristalni silicij je sivkasto-čelični materijal s metalnim sjajem, vrlo čvrst, ali krhak. Amorfni silicij - smeđi prah. p = 2,33 g / cm3; t pl. = C; t kip. = C;

Kristalna struktura silikona Kristalna rešetka silikona je kubični oblik dijamanta usmjeren na lice. Ali zbog dužine dužine veze između Si - Si, tvrdoća silicija je znatno manja od tvrdoće dijamanta. Silicij je krhak, samo kada se zagrijava iznad C.

elektro fizikalna svojstva Elementarni silicij Elementarni silicij je tipičan poluvodič. tipični poluvodič. Elektrofizička svojstva kristalnog silicija pod velikim su utjecajem nečistoća u tragovima. Za dobivanje silikonskih monokristala s p-tipskom provodljivošću, u silicij se uvode aditivi elemenata 3. skupine bora, aluminija, galija i indija s elektroničkom vodljivošću aditiva. elementi V skupine fosfora, arsena ili antimona.


Flint Flint, ovaj Flint, ovaj ružni i vrlo ružan i vrlo izdržljiv kamen, izdržljiv kamen, postavio je temelj za kameni početak kamenog doba - stoljeće - stoljeće kremenih radnih alata. alat od kremena Dva su razloga: prevalencija i dostupnost silicija; - učestalost i dostupnost silicija; - sposobnost oblikovanja oštrih reznih rubova kada se usitne; - sposobnost oblikovanja oštrih reznih rubova kada se usitne;




Znate li da .. Metodu za dobivanje silicija u svom čistom obliku razvio je Nikolaj Nikolayevich Beketov. Silicij u Rusiji se proizvodi u tvornicama: Kamensk - Uralsky (Regija Sverdlovsk) Kamensk - Uralsky (Regija Sverdlovsk) Shelekh (Regija Irkutsk). Shelekh (regija Irkutsk).

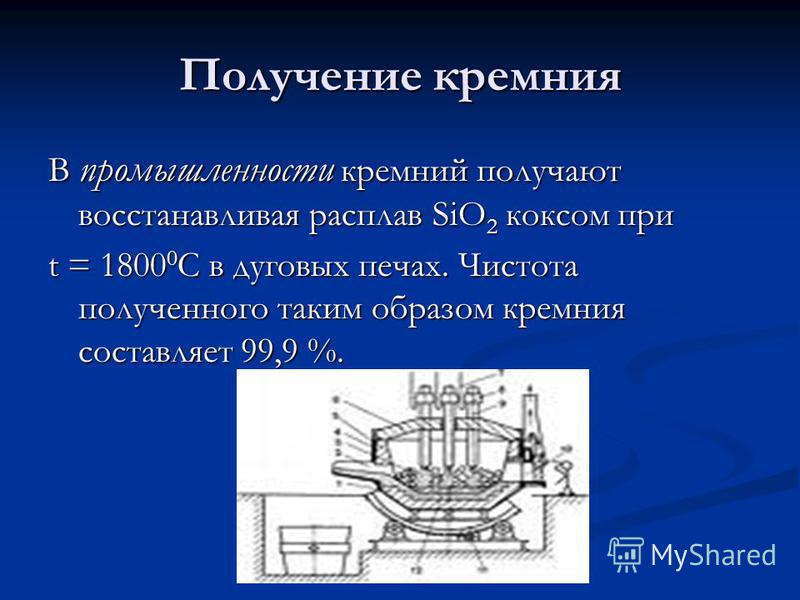
Proizvodnja silicija U industriji se silicij dobiva redukcijom taline SiO2 koksom pri t = C u elektrolučnim pećima. Čistoća tako dobivenog silicija iznosi 99,9%.
Dobivanje silicija Laboratorijski postupak proizvodnje: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Kemijska svojstva silicija Pri zagrijavanju na 400 ° C silicij reagira s kisikom i tvori silicij dioksid: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
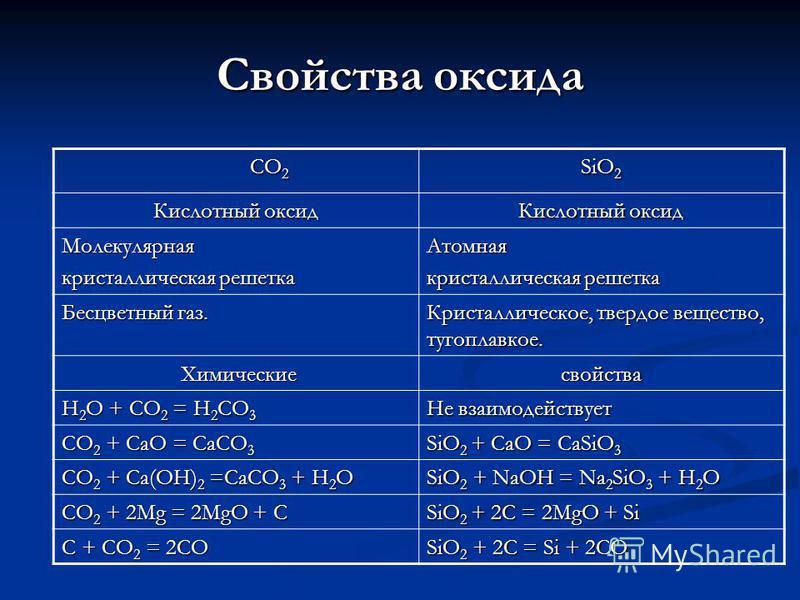
Svojstva CO 2 CO 2 SiO2 oksida Kiselinski oksid Molekularna kristalna rešetka Atomski bezbojni plin. Kristalni, kruti, vatrostalni. Kemijska kemijska svojstva H 2 O + CO 2 = H 2 CO 3 Ne reagira na CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Svojstva kiselina H 2 CO 3 H 2 SiO 3 Dibazično, kisik, slabo, lomljivo, od šišmiš. Dibazično, slabo sadržano kisik, netopivo u vodi. Primanje: CO 2 + H 2 O = H 2 CO 3 Primanje: SiO 2 + H 2 O = ne može biti nestabilno, lomljivo, razgrađuje se pri stajanju ili grijanju: H 2 CO 3 = CO 2 + H 2 O Ne može se odabrati u čistom obliku, jer raspada se pri zagrijavanju: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Manja evolucija plina __________

Ugljične kiseline silicijeve kiseline - karbonati; - ugljikovodici; silikati; silikati; Karbonati imaju sva svojstva soli, jaki su elektroliti, potpuno disociraju na ione (topljivi u vodi). Samo su soli alkalijskih metala topljive, ostale su netopljive ili uopće ne tvore soli (Al + 3, Cr + 3, Ag +).
![]()



Biološka uloga Najvažniji silicijev spoj, SiO2, bitan je za biljni i životinjski svijet. Zahvaljujući njemu, trstici, trstici Zahvaljujući njemu, trstici, trska i preslice čvrsto stoje poput bajoneta. i horsetails stajati čvrsto, kao bajuneta. Oštri šašasti listovi isječeni poput oštrih šašastih listova isječeni kao noževi, strnjika na pokošenim noževima, strnjika na pokošenim terenskim ubodima poput igala, a stabljike žitarica poput igle, a stabljike žitarica toliko su jake da ne dopuštaju tako jake ne dopustite da polje u polju padne s kiše i polja vjetra u polju da ode od kiše i vjetra


Silicij je element u tragovima koji se stalno nalazi u ljudskom tijelu. Najveća količina se nalazi u limfnim čvorovima, vezivnom tkivu aorte, traheje, kose i kože. Silicij je potreban za izgradnju epitelnih stanica. Silicij je element u tragovima koji se stalno nalazi u ljudskom tijelu. Najveća količina se nalazi u limfnim čvorovima, vezivnom tkivu aorte, traheje, kose i kože. Silicij je potreban za izgradnju epitelnih stanica. Silicij ima važnu ulogu u procesu mineralizacije kostiju; potrebno za održavanje elastičnosti arterijske stijenke, ima pozitivan učinak na imunološki sustav i usporava proces starenja u tkivima ljudskog tijela. Prosječan sadržaj silicija u krvi iznosi 8,25 mg / dan. S godinama se njegova razina u tijelu smanjuje, pa se kod starijih osoba potreba za silicijem povećava. Poboljšati apsorpciju silikona u tijelu prisutnost kalcija, magnezija, mangana i kalija. Silicij ima važnu ulogu u procesu mineralizacije kostiju; potrebno za održavanje elastičnosti arterijske stijenke, ima pozitivan učinak na imunološki sustav i usporava proces starenja u tkivima ljudskog tijela. Prosječan sadržaj silicija u krvi iznosi 8,25 mg / dan. S godinama se njegova razina u tijelu smanjuje, pa se kod starijih osoba potreba za silicijem povećava. Poboljšati apsorpciju silikona u tijelu prisutnost kalcija, magnezija, mangana i kalija.

Biološka uloga silicija također je uključena u sastav nižih živih organizama - dijatomeje i radiolarije - najosjetljivije kvržice žive materije, koje stvaraju njihove nenadmašne ljepote skeleta napravljenih od silicijevog dioksida. Silicij je također dio nižih živih organizama - dijatomeja i radiolarija - najdelikatnijih komada žive materije, koji stvaraju svoju nenadmašnu ljepotu silikatnih kostura. Dijatomeje Radiolaria Samokontrola 1. Koje je mjesto silicija u periodičnom sustavu: a) 2 razdoblje, 4 og. b) 3 perioda, 3 gr. poglavlje. c) 3 perioda, 4 gr. poglavlje) 2 razdoblje, 4 gr. b) 3 perioda, 3 gr. poglavlje. c) 3 perioda, 4 gr. poglavlje. 2. Silikonska rešetka: a) ionska; b) atomska; c) molekulska; a) ionski; b) atomska; c) molekulska; 3. Prema prevalenciji u prirodi silicija ... element: a) prvi; b) drugi; c) treći; a) prvi; b) drugi; c) treći; 4. Silikon reagira s: a) metalima, vodikom, halogenima; a) metali, vodik, halogeni; b) metale, halogene, lako topljive u alkalijama; b) metale, halogene, lako topljive u alkalijama; c) oksidi, kiseline, nemetali. c) oksidi, kiseline, nemetali. 5. Silikatne kiseline: a) silikidi; b) hidrosilikati; c) silikati; a) silikidi; b) hidrosilikati; c) silikati;

Silicij.
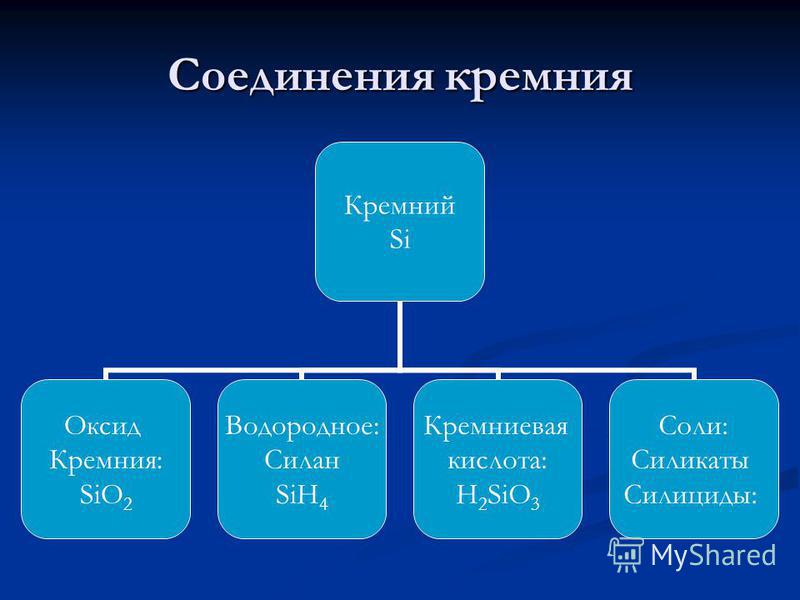
silicij - element glavne podskupine IV skupine trećeg razdoblja periodičkog sustava kemijskih elemenata DI Mendeleev, s atomskim brojem 14, atomska masa: 28.0855, U spojevima obično pokazuje stupanj oksidacije +4 (valentni IV) i vrlo rijetko +3, +2 i +1 (valencije, III, II i I). U periodnom sustavu, Mendelejev silicij se nalazi u skupini IVA (A - označava da je to glavna podskupina) (u skupini ugljika), u trećem razdoblju. nemetalne , Označava se simbolom si(lat. silicij). U slobodnom obliku - smeđi prah ili svijetlo sivi kompaktni materijal s metalnim sjajem. Struktura rešetke: kubni, dijamant.
Glavno stanje: + 14 Si14e 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Fizička svojstva.
Kristalni silicij je tamno siva tvar s čeličnim sjajem. Struktura silicija slična je strukturi dijamanta. U svom kristalu, svaki atom je okružen četverostrukim tetraedrama i povezan je s njima kovalentnom vezom, koja je mnogo slabija nego između ugljikovih atoma u dijamantu. U silicijskom kristalu, čak i pod normalnim uvjetima, neke od kovalentnih veza su uništene. Stoga ima slobodne elektrone, koji uzrokuju malu električnu vodljivost. Kada rasvjeta i grijanje poveća broj slomljenih veza, što znači da se broj slobodnih elektrona povećava i električna vodljivost se povećava. Stoga bi trebalo objasniti poluvodička svojstva silicija.
Silicij je vrlo krhak, njegova gustoća je 2,33 g / cm3. Kao i ugljen, odnosi se na vatrostalne tvari.
Silicij se sastoji od tri stabilna izotopa: 2814Si (92,27%), 2914Si (4,68%) i 3014Si (3,05%).
3. Biti u prirodi.
Najčešće u prirodi, silicij se nalazi u obliku silika - spojevi na bazi silicijevog dioksida (IV) SiO2 (oko 12% mase zemljine kore). Glavni minerali i stijene koje tvore silicijev dioksid su pijesak (rijeka i kvarc), kvarc i kvarcit, kremen i feldspat. Prirodni silikati imaju složen sastav i strukturu. Ovdje je sastav nekih prirodnih silikata:
feldspat K2Oxl2O3x6Si02,
est azbest 3MgOx2Si02 × 2H2O,
m. K2Ox3Al203x6Si02 × 2H2O,
kaolinit 3Al203x2Si02 × 2H20.
Druga najzastupljenija skupina u prirodi silicijevih spojeva je silikata i aluminijevog silikata.
Zabilježene su pojedinačne činjenice pronalaženja čistog silicija u izvornom obliku.
4. Kemijska svojstva silicija i njegovih spojeva.
na kemijska svojstva silicij, kao i ugljik, je nemetal, ali je njegov nemetal manje izražen, budući da ima veći atomski polumjer. Budući da atomi silicija imaju 4 elektrona na vanjskoj energetskoj razini, oksidacijsko stanje i -4 i +4 je tipično za silicij (poznat je silicijski spoj, gdje je njegovo oksidacijsko stanje +2).
Silicij u normalnim uvjetima je prilično inertan, što treba objasniti jačinom kristalne rešetke. On izravno komunicira samo s njima fluor:
kiseline (osim mješavine fluorovodične HF i dušičnog HNO 3)silicij ne djeluje. Međutim, otapa se u hidroksidima alkalijskih metala, tvoreći silikat i vodik:
Od dvije alotropne modifikacije silicija, kristalnog i amorfnog, amorfni silicij je kemijski aktivniji. On reagira s kisikom kada se zagrije, formira se SiO2:
kao i sa svima halogenana primjer:
![]()
Na visokoj temperaturi silicij povezuje s ugljikomformiranje karborundne SiC:
Karborund ima kristalnu rešetku sličnu dijamantu, u kojoj je svaki atom silicija okružen s četiri ugljikova atoma i obratno, a kovalentne veze su vrlo jake, kao u dijamantu. Stoga je u tvrdoći blizu dijamanta. Brusni kamen i brusni kotači izrađeni su od silicijevog karbida.
Magnezijev silikid. U reakcijama s aktivnim metalima, javljaju se s formiranjem silicide, Silicij djeluje kao oksidacijsko sredstvo:
Na visokim temperaturama silicij oporavlja mnoge metale iz njihovih oksida. (!!!)
Silan. Pod djelovanjem klorovodične kiseline na silicide najjednostavniji vodikov spoj silicija je silan SiH 4:
Silan je otrovni plin s neugodnim mirisom, samozapaljivim u zraku (!!!):
Silicijev oksid (IV).Naziva se i silicij oksid (IV) silika. To je čvrsta vatrostalna tvar. (točka taljenja 1700 ° C) rasprostranjena u prirodi u dva oblika:
1) kristalni silicijev dioksid - u obliku minerala kvarca i njegovih sorti (kameni kristal, kalcedon, ahat, jaspis, kremen); kvarc je osnova kvarcnog pijeska široko korištenog u graditeljstvu i industrija silikata;
2) amorfni silicijev dioksid - u obliku mineralnog sastava opal SiO2 × n H20; zemljani oblici amorfnog silicija su diatomit, tripoli (infuzorijska zemlja); primjer umjetnog amorfnog bezvodnog silicija je silikagel, koji se dobiva iz natrijevog metasilikata:
Silikagel ima razvijenu površinu i stoga dobro upija vlagu. .
Pri 1710 ° kvarc se topi, Uz brzo hlađenje nastaje rastaljena masa kvarcno staklo , Ima vrlo nizak koeficijent ekspanzije, tako da vruće kvarcno staklo ne puca kada se voda brzo ohladi. Laboratorijsko stakleno posuđe i instrumenti za znanstvena istraživanja izrađeni su od kvarcnog stakla.
Najjednostavnija formula silicijevog oksida (IV) SO2 slična je formuli ugljik monoksida (IV) CO 2. U međuvremenu, njihova fizička svojstva su vrlo različita (SiO2 - kruti, CO2 - plin). Ta razlika je posljedica strukture kristalnih rešetki. C02 kristalizira u molekularnoj rešetki, SiO2 - u atomskoj. Struktura SiO 2 u ravnoj slici može se prikazati kako slijedi:
Koordinacijski broj ugljikovog atoma u krutom CO2 je 2, a silicij u Si02 je 4. Svaki atom silicija je zatvoren u tetraedron od 4 atoma kisika. U isto vrijeme, atom silicija je u središtu, a atomi kisika su smješteni u vrhovima tetraedra , Cijeli komad silike može se smatrati kristalom čija je formula (SiO2) n. Ova struktura silicij oksida (IV) određuje njegovu visoku tvrdoću i vatrostalnost .
Kemijska svojstva silicijevog oksida (IV) Si02 se odnosi na kisele okside. Prilikom stapanja s čvrstim alkalijama, bazičnim oksidima i karbonatima, nastaju soli silicijeve kiseline
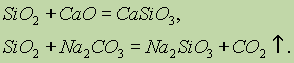
Samo fluorovodična kiselina u interakciji s silicijevim oksidom (IV):
Ova reakcija se koristi za narezivanje stakla. .
Silicij (IV) se ne otapa u vodi i kemijski ne djeluje s njom. (!!!) Stoga se silicijumska kiselina dobiva posredno djelovanjem kiseline na otopinu kalijevog ili natrijevog silikata:
U tom slučaju, silicijska kiselina (ovisno o koncentraciji početnih otopina soli i kiseline) može se dobiti i u obliku želatinozne mase koja sadrži vodu, te u obliku koloidne otopine (sol).
Silikatna kiselina. SiO2 je anhidrid određenog broja silicijevih kiselina, čiji se sastav može izraziti općom formulom: xSiO 2 × yH 2 O, gdje x i y - cijeli brojevi:
1) x = 1, y = 1: Si02 × H20, tj. H2S03; metasilikatna kiselina;
2) x = 1, y = 2: Si02 × 2H20, tj. H4SiO4 - ortosilikatnu kiselinu;
3) x = 2, y = 1: 2SiO2 × H20, tj. H2S02O5 - bimetakrinsku kiselinu.
Silikatna kiselina je izgrađena od tetraedarnih strukturnih jedinica (u svakoj takvoj jedinici atom silicija je u središtu tetraedra, a u vrhovima su atomi kisika). Strukturne veze, koje se ujedinjuju u lance, tvore stabilnije polisilicijske kiseline:
Sastav takvih spojeva može se izraziti formulom (H2S03) n. Međutim, obično silikatna kiselina je predstavljena formulom H2 Si02. H 2 SiO 3 - kiselina je vrlo slaba, slabo topljiva u vodi. Kada se zagrijava lako se razgrađuje kao ugljična kiselina:
Sve silicijske kiseline su vrlo slabe (slabije od ugljena).
Silikata. Nazivaju se soli svih silicijevih kiselinasilikataiako, u pravilu, u obrazovnoj literaturi, silikati podrazumijevaju soli metacilikinske kiseline. Njihov sastav najčešće predstavlja formula u obliku spojeva oksida elemenata. Na primjer, kalcijev silikat CaSi03 može se izraziti kao: CaO x Si02.
Silikati u sastavu R 2 O × nSiO 2, gdje je R 2 O - natrijev ili kalijev oksid , se zovu topljivo staklo , i njihove koncentrirane vodene otopine - tekuće staklo . Najvažnije je staklo od natrijeve sode..
Kada stoje na zraku, otopine silikata postaju mutne, jer ugljični dioksid (IV) u zraku istiskuje silicijsku kiselinu iz njenih soli:
Silikatna kiselina je praktički netopljiva u vodi - ovo svojstvo se koristi kao kvalitativna reakcija na ion SiO 3 2-.
Silikati se dobivaju taljenjem silicijevog dioksida s alkalijama ili karbonatima:
5. Otkriće ionskog SiO 3 2. (ne mogu naći ništa ...)
6. Uloga silicijevih spojeva u formiranju tla i šumarstvu.
Magmatske stijene su prilično stabilne u svom sastavu i sadrže uglavnom spojeve silicija, aluminija, željeza, alkalija, magnezija i kalcija. Prema sadržaju Si0 2, magmatske stijene se dijele u četiri skupine: kisele (\u003e 65%), srednje (52-65%), bazične (40-52%) i ultrabazične (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Kisele magmatske stijene- graniti, pegmatiti, rioliti, dacit i drugi - obično su svjetlo smeđe boje s izraženim kristalima kvarca, feldspata, tinjca. Sadržaj SiO 2 u njima je visok (više od 65%) sa značajnom količinom kalija i natrija. U isto vrijeme, malo željeza i kalcija i magnezija su zanemarivi. Tla na kiselim magmatskim stijenama, na primjer, na granitima, razlikuju se u ranim fazama trošenja zbog krhkosti, šljunčastog karaktera izvornog materijala. Kada se troši u vlažnim uvjetima, lako gube alkalno-zemaljske elemente, zbog čega je tlo na takvim podlogama (eluviju stijena) izrazito siromašno, slabo plodno.
Glavne magmatske stijene -bazalt, gabro, itd., u pravilu, imaju tamnu (do crnu) boju. Karakterizira ih niži sadržaj SiO2 u usporedbi s kiselim stijenama. Glavne magmatske stijene relativno su bogate spojevima željeza, mangana, kroma, kobalta, cinka, titana, nikla, bakra. Proizvodi njihovog trošenja vrlo brzo poprimaju karakter gline, dugo zadržavaju alkalnu i neutralnu reakciju i odlikuju se povećanim sadržajem minerala humusa i gline. Tlo na takvim stijenama je plodnije.
Često se nalaze i kisele i osnovne vrste magmatske stijene prijelaznog tipa(srednja) - nametljive stijene dioritne skupine i njihovi izlučni kolege - andeziti. Prema tome, tla na tim stijenama dobivaju značajke slične onima ograničenim na kisele ili osnovne stijene. Mnogo rjeđe ultrabazične pasmine:peridotiti i pikriti, koji imaju najniži sadržaj SiO2.
Metamorfne stijene -tranzicijski između masivnih kristalnih i sedimentnih stijena. Drevne sedimentne stijene pod ronjenjem, visoki tlak i temperature su metamorfizirane, formirajući gnajse, serpentinite, mramor, kvarcite, škriljce. Gneisi su po sastavu posebno slični granitima. Tlo koje se formira na takvim stijenama ima slične značajke kao i tla na kiselim magmatskim stijenama.
Klor.
1. Položaj aluminija u tablici DI Mendeleev. Struktura atoma, očituje stupanj oksidacije.
klor - element glavne podgrupe VII grupe, treće razdoblje, s atomskim brojem 17. Označava se simbolom Cl (lat. Chlorum). Kemijski aktivan nemetalne . Uključeno u halogenu skupinu .
Jednostavna tvar klor u normalnim uvjetima - otrovni plin žućkasto-zelene boje teži je od zraka, s jakim mirisom . Dvojna molekula klora (formula Cl 2).
Glavno stanje: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. Čl. -1 +1 +3 +5 +7.
Struktura elektronske ljuske.
Na razini valencije sadrži atom klora 1 neupareni elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, tako da je valencija od 1 za atom klora vrlo stabilna. Zbog prisutnosti u atomu klora slobodnih d-sublevel orbitala, atom klora može pokazivati i druge stupnjeve oksidacije. Shema formiranja pobuđenih stanja atoma:
Poznati su i spojevi klora u kojima atom klora formalno pokazuje valenciju 4 i 6, na primjer Cl02 i Cl206. Međutim, ti spojevi su radikali, tj. Imaju jedan nespareni elektron.
2. Fizička svojstva.
U normalnim uvjetima, klor je žuto-zeleni plin s gušenjem. Neka od njegovih fizikalnih svojstava prikazana su u nastavku.
Gustoća: 3.214 g / l, tekućina - na -35 ° C - 1.557, TV. pri -105 ° C - 1,9 g / cm3.
Talište: 172,2 K
Vrelište: 238,6 K
Toplina fuzije: 6.41 kJ / mol
Toplina isparavanja: 20,41 kJ / mol.
Plin klor je relativno lako rastopiti. Počevši od tlaka od 0,8 MPa (8 atmosfera), klor će biti tekućina već na sobnoj temperaturi. Kada se ohladi na temperaturu od -34 ° C, klor također postaje tekućina pri normalnom atmosferskom tlaku. Tekući klor je žuto-zelena tekućina s vrlo visokim korozijskim učinkom (zbog visoke koncentracije molekula). Povećavajući tlak možete postići postojanje tekućeg klora do temperature od +144 ° C (kritična temperatura) pri kritičnom tlaku od 7,6 MPa. U pogledu električne provodljivosti, tekući se klor odvija među najjačim izolatorima: provodi struju gotovo milijardu puta lošije od destilirane vode, a 10 22 puta gore od srebra. Brzina zvuka u kloru je oko jedan i pol puta manja nego u zraku.
3. Biti u prirodi.
U prirodi postoje dva izotopa klora 35 Cl i 37 Cl. Klor je najčešći halogen u zemljinoj kori. , Klor je vrlo aktivan - izravno se povezuje s gotovo svim elementima periodnog sustava. Dakle, u prirodi, nalazi se samo u obliku spojeva u sastavu minerala:
ü halite NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
biskofit MgCl2 · 6H2O,
karnalit KCl · MgCl2 · 6H20,
Cainite KCl · MgS04 · 3H20.
Najveće rezerve klora sadržane su u solima, vodama, morima i oceanima (sadržaj u morskoj vodi iznosi 19 g / l). Klor čini 0,024% ukupnog broja atoma u zemljinoj kori; broj klarka (brojevi koji izražavaju prosječan sadržaj kemijskih elemenata u zemljinoj kori, hidrosferi, Zemlji, svemirskim tijelima, geokemijskim ili kosmokemijskim sustavima, itd., u odnosu na ukupnu masu ovog sustava. Izražava se u% ili g / kg.) klor - 0,017%. Ljudsko tijelo sadrži 0,25% klornih iona po težini. U ljudi i životinja klor se nalazi uglavnom u međustaničnim tekućinama (uključujući krv) i igra važnu ulogu u regulaciji osmotskih procesa, kao iu procesima povezanim s radom živčanih stanica.
4. Kemijska svojstva klora i njegovih spojeva. Dobivanje klora.
Struktura silicijevog atoma. Si. 14. Uzbuđeno stanje. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Slika 3 prezentacije "Silicij" na satove kemije na temu "silicij"Dimenzije: 960 x 720 piksela, format: jpg. Za preuzimanje besplatne slike za sat kemije, desnom tipkom miša kliknite na sliku i kliknite na "Spremi sliku kao ...". Da biste prikazali slike u lekciji, možete i besplatno preuzeti prezentaciju “Silicon.ppt” sa svim slikama u zip arhivi. Veličina arhive - 562 KB.
Preuzmite prezentacijusilicij
"Silicij i njegovi spojevi" - Struktura i svojstva atoma. Poluvodiča. t rastopiti (Si) = 1415 ° C, t rastopiti (dijamant) = 3730 ° C. Dobivanje silikona. Otkriće silicija. Uključeni su iu sastav biljaka i životinja. Fizička svojstva silicija. Opeka je stoga keramika, a pločice i fragmenti antičke grčke amfore također su keramika. Ciljevi: Kemijska svojstva silicija.
"Silikonski spojevi" - silicij i njegovi spojevi. Kemijska svojstva Si02. Silan. Dobivanje silicijeve kiseline. Silikonska svojstva. Silicij oksid. Prirodni silikati. Stanje oksidacije Vještački dijamant. Topaz. Dobivanje silikona u laboratoriju. Biti u prirodi. Kristalne rešetke. Otkriće silicija. Ametist. Dobivanje silikona.
"Izotopi silicija" - Odvajanje izotopa silicija. Proizvodnja polikristalnog silicija. Izgledi za upotrebu monoizotopnog silicija. Razrjeđenje izotopa kada se uzgaja jedan kristal iz kvarcnog lonca. Proizvodnja sjemena jednog kristala. Ovisnost položaja maksimuma Ramanovog pojasa o atomskoj masi.
"Silikonska lekcija" - Koji od najvažnijih kemijskih elemenata u živoj i neživoj prirodi? Ugljični oksidi i silicij. Tvar je prozirna. O manifestiranju nemetalnih i metalnih svojstava. Sažetak razmišljanja. Završno testiranje. Oksidi ugljika i silicijevih hidroksida? Stanje agregacije: a) tekućina, b) plin, c) krutina.
"Silicij" - Silicij je jednostavna tvar. Fizička svojstva. Silicijev oksid (IV). Silicides. To znači za žive organizme. Interakcija s metalima. Interakcija s nemetalima. Silicij karbid. Silicij u prirodi. Silicij. Proizvodi silikatne industrije. Jedan od tipova prirodnih silicijevih spojeva je silikat.
"Ugljik i silicij" - silicijev oksid (IV). Elementi skupine IV glavne podskupine. Toksičnost. 7. Zanimljivo za ugljik. Silikata. Spustite se na dodir. Dijamant je najteža prirodna tvar. Kemijska svojstva Više od 99% ugljika u atmosferi je u obliku ugljičnog dioksida. Karbida. 6. Primjena. Jedan od najmekših među krutim tvarima.
Ukupno je 6 prezentacija.
