Fizikalna svojstva sio2. Spojevi kisika. Silicijev oksid (II) SiO
Silicijev oksid (II) SiO. U prirodi se ne događa, ali se može dobiti reakcijom:
SiO2 + Si → 2 SiO.
Pod normalnim tlakom sublimacija silicijevog monoksida počinje na oko 1200 ° C (kada sami polazni materijali praktički još ne isparavaju). U paru, SiO je pojedinačni spoj. Energija disocijacije elemenata je 789 kJ / mol. Pretvorba u kruto stanje može se postići samo brzim hlađenjem ("gašenjem") plinske faze. Inače, dismutacija jednadžbom ima vremena proći:
Si02 = Si02 + Si.
Silicijev monoksid se polako oksidira atmosferskim kisikom i lako se otapa u lužinama kako bi se dobile soli silicijeve kiseline i oslobađanje vodika. Lako se naelektrira pomoću trenja i dobiva jak negativni naboj.
Silicijev oksid (IV) Si02.Silicij oksid (IV) se također naziva silicij. To je čvrsta vatrostalna tvar. (točka taljenja 1700 ° C)rasprostranjena u prirodi u dva oblika: 1) kristalni silicijev dioksid - u obliku minerala kvarca i njegovih sorti (kameni kristal, kalcedon, ahat, jaspis, kremen); kvarc je osnova kvarcnog pijeska široko korištenog u graditeljstvu iu industriji silikata; 2) amorfni silicijev dioksid - u obliku mineralne kompozicije opale SiO2 nH20; zemljani oblici amorfnog silicija su diatomit, tripoli (infuzorijska zemlja); Primjer umjetnog amorfnog bezvodnog silicija je silikagel, koji se dobiva iz natrijevog metasilikata:
Silikagel ima razvijenu površinu i stoga dobro upija vlagu.
Pri 1710 ° kvarc se topi. Brzim hlađenjem rastaljene mase nastaje kvarcno staklo. Ima vrlo nizak koeficijent ekspanzije, tako da vruće kvarcno staklo ne puca kada se voda brzo ohladi. Laboratorijsko stakleno posuđe i instrumenti za znanstvena istraživanja izrađeni su od kvarcnog stakla.
Struktura SiO 2 u ravnoj slici može se prikazati kako slijedi:
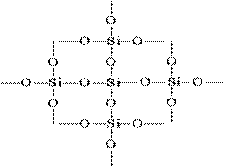
Svaki atom silicija je zatvoren u tetraedron od 4 atoma kisika. U tom slučaju, atom silicija se nalazi u središtu, a atomi kisika su smješteni u vrhovima tetraedra. Cijeli komad silike može se smatrati kristalom čija je formula (SiO2) n. Takva struktura silicijevog oksida (IV) određuje njegovu visoku tvrdoću i vatrostalnost.
Kemijska svojstva silicijevog oksida (IV) Si02 se odnosi na kisele okside. Prilikom fuzije s čvrstim alkalijama, bazičnim oksidima i karbonatima, nastaju soli silicijeve kiseline:
Samo fluorovodična kiselina stupa u interakciju s silicijevim oksidom (IV) (jetkanje stakla):
Si02 + HF → SiF4 + H20
Silicij (IV) oksid se ne otapa u vodi i ne reagira kemijski s njim. Stoga se silikatna kiselina dobiva posredno, na primjer, hidrolizom:
SiS2 + H20OH2S + H4Sio04 ortosilikonska kiselina.
H 4 SiO 4 je topljiv, kada se zagrijava ili stoji, u tijeku je postupak polimerizacije:
2H4SiO4 → H20 + H6Si207dorthokremnievna kiselina.
2H6Si207H2O + H10Si04 13 tetraorotremilinska kiselina.
Zatvara prsten:
H10Si4O13 → H20 + (H2Si03) 4-tetrametilacitna kiselina.
U tom slučaju silikatna kiselina (ovisno o koncentraciji početnih otopina soli i kiseline) može se dobiti i u obliku želatinozne mase koja sadrži vodu, te u obliku koloidne otopine (sol). Sastav dobivene silicijeve kiseline ovisi o početnim materijalima i uvjetima pripreme. Sve silicijske kiseline su vrlo slabe (slabije od ugljena).
Ako ugljična kiselina u otopini oslobađa silicijsku kiselinu iz svojih soli, tada se tijekom kalcinacije odvija obrnuta reakcija. Prvi je zbog niže čvrstoće (stupanj disocijacije) silikatne kiseline, drugi - njegove manje hlapljivosti pri zagrijavanju.
Pri zagrijavanju polisilikatnih kiselina i njihovoj postupnoj dehidraciji može se dobiti fini SiO 2, koji se naziva silikagel , Dobro upija vodu, stavljam je u uređaje da spriječim oksidaciju skupih elemenata.
Njemačka podgrupa
ge (+4) Sn (+2, +4) Pb(+2) - otporna oksidacijska stanja
Germanium je 1871. godine predvidio DI Mendeleev, a otkriven je 1886. godine. Kositar i olovo pripadaju elementima koji su čovječanstvu već dugo poznati: Egipćani su ih mogli topiti više od 3000 godina prije Krista. e. U Indiji, olovo je postalo poznato oko 2500 godina, a do 1500 godina prije Krista. e. Taljenje kositra proizvedeno u drevnoj Kini.
Uzimajući.Prirodni spojevi germanija se pretvaraju u GeO 2 i reduciraju s vodikom:
GeO2 + H2t → Ge + H20 pri temperaturama od oko 1000 ° C.
Kositar se dobiva iz prirodnog minerala cassiterite(SnO 2):
SnO2 + C → Sn + CO.
Najjednostavnija shema industrijske redukcije olova temelji se na dvije uzastopne reakcije:
PbS + O2 → SO2 + PbO galica(PbS) se spaljuje i zatim smanjuje ugljenom:
PbO + S → SO + Pb.
Primjena.Sva tri elementa vrlo su važna za modernu tehnologiju. Neki spojevi kositra i olova također su od velike koristi. Derivati olova su vrlo toksični.
Germanij je tipičan poluvodič (n-tipa s širinom zona razmaka od 0,75 eV) i pronalazi različite namjene u elektrotehnici. Najviše se koristi za proizvodnju AC ispravljača., Ova primjena temelji se na unipolarnoj vodljivosti koja nastaje iz kontakta između čistog germanija i legure germanija s indijem. Struja (struja elektrona) prolazi u takvoj instalaciji praktički samo od germanija do legure, ali ne i obrnuto. Germanium ispravljači karakterizira iznimno visoka (oko 98%) učinkovitost i vrlo velik (uz pravilan rad) vijek trajanja. Glavni nedostatak takvih ispravljača je njihova osjetljivost na grijanje - iznad 70 ° C, njihova učinkovitost brzo pada.
Važno područje uporabe njemačka je infracrvena optika, budući da zrake s valnom duljinom većom od 2 mikrona, praktički ne odgađa. Nasuprot tome, u rasponu svjetla i blizu njega (0,2 - 2 mikrona), germanij intenzivno apsorbira energiju. Ako je sjajna metalna površina (koja dobro skladišti toplinu, ali se ne zagrijava dobro) prekrivena filmom iz germanija, onda se površina zagrijava mnogo više nego bez filma. To je izvijestio da je u bačvi pripremljeni na taj način pod djelovanjem sunčeve svjetlosti, kipuće vode može se dobiti.
Kositar se uglavnom koristi za kositrenje željeza kako bi ga se zaštitilo od hrđanja. (bijeli lim za industriju konzerviranja). Debljina takvih premaza kositra vrlo je mala - reda veličine mikrona. U obliku tankih listova (tzv. Stannioles) konzervira se za proizvodnju kondenzatora u elektroindustriji , Olovo se koristi za proizvodnju baterijskih ploča, ploča električnih kabela, metaka i metaka, za zaštitu od rendgenskih zraka i g-zraka, kao iu kemijskoj industriji (cjevovodi, itd.). Vrlo velike količine kositra i olova troše se na proizvodnju brojnih tehnički važnih legura.
Najznačajnije od njih su različite bronce (legure Cu i Sn), legure za ležajeve (babice, obično izrađene na bazi Pb ili Sn te također sadrže Sb i Cu), tipografske legure (5-30% Sn, 10-20% Sb, ostalo je Pb) i uobičajeni "meki" lem (30-70% Sn, 70-30% Pb). Često se može zamijeniti jeftinijom legurom od 90% Pb, 6% Sn, 4% Sb. Od velike su važnosti legure za ležajeve s približnim sastavom od 98% Pb, 1% Ca, 1% Na.
Silicij (silicij, silicijev dioksid) je tvar koja se sastoji od bezbojnih kristala visoke čvrstoće, tvrdoće i vatrostalnosti. Silikonski dioksid je otporan na kiseline i ne reagira s vodom. Sa povećanjem temperature reakcije, tvar reagira s alkalijama, otapa se u fluorovodičnoj kiselini, odličan je dielektrik.
U prirodi je silicij dioksid široko rasprostranjen: kristalni silicijev oksid je predstavljen mineralima kao što su jaspis, agat (kristalni silicijev dioksid), kameni kristal (veliki kristali tvari), kvarc (slobodni silicij dioksid), kalcedon, ametist, morion, topaz (obojeni kristali). silicijev dioksid).
U normalnim uvjetima (pri prirodnoj temperaturi okoline i tlaku) postoje tri kristalne modifikacije silicijevog dioksida - tridimita, kvarca i kristobalita. Kada temperatura raste, silicijev dioksid se prvo pretvara u kojezit, a zatim u stišovit (mineral pronađen 1962. u meteoritskom krateru). Prema studijama, to je stishovit, derivat silicijevog dioksida, koji povezuje veliki dio Zemljinog plašta.
Kemijska formula tvari - SiO2
Priprema silicijevog dioksida
Silikon dioksid se industrijski proizvodi na kvarcnim postrojenjima za proizvodnju čistog kvarcnog koncentrata, koja se zatim koristi u kemijskoj i elektroničkoj industriji, u proizvodnji optike, guma i punila za boje i lakove, izradi nakita itd. Prirodni silicij-dioksid, koji se inače naziva silicij-dioksid, naširoko se koristi u građevinarstvu (beton, pijesak, zvučni i toplinski izolacijski materijali).
Sinteza silicijevog dioksida sintetičkom metodom provodi se djelovanjem kiselina na natrijev silikat, u nekim slučajevima i na drugim topljivim silikatima ili metodom koagulacije koloidnog silicija pod utjecajem iona. Osim toga, silicij dioksid se proizvodi oksidacijom silicija kisikom pri temperaturi od oko 500 stupnjeva Celzija.
Nanošenje silicijevog dioksida
Materijali koji sadrže silicij široko se primjenjuju u području visokih tehnologija iu svakodnevnom životu. Silikon dioksid se koristi u proizvodnji stakla, keramike, betonskih proizvoda, abrazivnih materijala, kao iu radio-inženjerstvu, ultrazvučnim instalacijama, upaljačima itd. U kombinaciji s nizom sastojaka, silicijev dioksid se koristi u proizvodnji optičkih kabela.
Neporozni amorfni silicijev dioksid također se koristi u prehrambenoj industriji kao aditiv, registriran pod brojem E551, koji sprječava sljepljivanje i slaganje glavnog proizvoda. dioksid  silikonska hrana se koristi u farmaceutskoj industriji kao lijek enterosorbent, u proizvodnji zubnih pasta. Tvar se nalazi u čipsu, krekerima, kukuruznim štapićima, instant kavi itd.
silikonska hrana se koristi u farmaceutskoj industriji kao lijek enterosorbent, u proizvodnji zubnih pasta. Tvar se nalazi u čipsu, krekerima, kukuruznim štapićima, instant kavi itd.
Silica Harm
Službeno je potvrđeno da tvar silicijevog dioksida prolazi kroz gastrointestinalni trakt nepromijenjena, nakon čega se potpuno uklanja iz tijela. Prema petnaestogodišnjem istraživanju francuskih stručnjaka, ispijanje vode s visokom glinicom smanjuje rizik od razvoja Alzheimerove bolesti za 10%.
Prema tome, informacije o opasnostima silicij-dioksida, koji je kemijski inertna tvar, su pogrešne: dodatak prehrani E551, unesen oralno, potpuno je siguran za zdravlje.
Silicijev oksid SiO2 je čvrsta, vrlo vatrostalna tvar (točka taljenja iznad 1700 ° C), široko rasprostranjena u prirodi, gdje se nalazi uglavnom u obliku kvarcnog minerala, kao i kristobalita i tridimita.
Na uobičajenim temperaturama kvarc je stabilna modifikacija, s porastom temperaturnih polimorfnih transformacija:
Silicijev dioksid svih modifikacija u obliku monomera ne postoji; ona je uvijek polimerna i “izgrađena” od tetraedra tvoreći vrlo jaku atomsku rešetku
Svaki atom silicija u (Si02) n kristalima je tetraedralno okružen s četiri atoma kisika, od kojih je svaki premošten. Kroz uobičajeni atom kisika tetraedre se pod različitim kutovima međusobno vežu, stvarajući kontinuiranu trodimenzionalnu rešetku; uzajamno uređenje tetraedara u prostoru određuje jednu ili drugu modifikaciju silicija.
U različitim modifikacijama silika čvrstoća veze varira. To utječe na veličinu kutova Si-O-Si i udaljenosti Si-O, na primjer, kut veze Si-O-Si u različitim modifikacijama silicija varira od 120 do 180 °. Kvarc-tridimit-kristobalitni prijelazi popraćeni su lomljenjem i transformacijom veza, koje se mogu pojaviti samo na visokim temperaturama.
Kvarc. Često se nalaze u prirodi u obliku izrazito dobro oblikovanih kristala, ponekad značajnih veličina. Kristali su formirani od tetraedara raspoređenih spiralno oko središnje osi, u obliku spirale. U istom kristalu, smjer spirale može biti suprotan. Takvi kristali su optički izomeri. Oni rotiraju ravninu polarizacije svjetlosti i mogu biti i desna i lijeva. Ti i drugi kristali razlikuju se kao subjekt od svoje zrcalne slike.
Kvarc se koristi u raznim područjima znanosti i tehnologije, a njegovi se kristali često uzgajaju umjetno. Neke vrste kvarca imaju posebna imena. Prozirni bezbojni kristali nazivaju se rock kristal. Tu su i obojene sorte kvarca: ružičasti kvarc, ljubičica (ametist), tamno smeđa (dimi topaz), zelena (krizopraz), itd. Kristalna modifikacija kvarca s primjesama drugih tvari naziva se kalcedon. Sorte kalcedona su ahat, jaspis i dr. Rock kamen i obojene sorte kvarca koriste se kao dragocjeno i poludrago kamenje.
Tridimit se javlja u vulkanskim stijenama, ali u vrlo malim količinama. Poznato je tridimitsko i meteoritsko podrijetlo.
Kristobalit u prirodi ponekad se nalazi u obliku malih kristala ugrađenih u lavu, poput tridimita. Tridimit i kristobalit imaju više "labavu" strukturu od kvarca. Prema tome, gustoća kristobalita, tridimita i kvarca je 2.32; 2,26 i 2,65 g / cm3.
Talina silicijevog dioksida sa sporim hlađenjem lako formira amorfno staklo kvarca. U prirodi se nalazi i silicij u obliku stakla. Gustoća amorfnog stakla je 2,20 g / cm3 - niža od svih kristalnih modifikacija. Kvarcno staklo ima blagi temperaturni koeficijent ekspanzije, stoga se koristi za pripremu laboratorijskog stakla otpornog na nagle promjene temperature.
Sve modifikacije silicijevog dioksida u vodi praktički su netopljive (na temperaturi od 25 ° C, topivost kvarca je 7, kristobalit-12, tridimit-16, kvarcno staklo - 83 mg / l). Stoga, pod normalnim uvjetima, na njih djeluju samo alkalne otopine i fluorovodična kiselina:
Si02 + 2KO = K2Si03 + H20, (1)
Si02 + 4HF = SiF4 + 2H2O. (2)
Potonja reakcija se koristi u "jetkanju" stakla.
Dodani silicij reagira s bazičnim oksidima, lužinama (reakcija (1)) i karbonatima u obliku silikata:
SiO 2 + CaO = SaSiO 3, (3)
Si02 + Na2C03 = Na2Si03 + COz. (4)
Reakcije (3) i (4) su temelj industrijske proizvodnje različitih stakala, kao i cementa. Dakle, sastav običnog stakla (na primjer, prozor, za proizvodnju posuđa) izražava se formulom Na2O.CaO. 6SiO 2. Takvo staklo se dobiva spajanjem smjese sode, pijeska i vapnenca. Postupak se provodi na temperaturi od ~ 1400 ° C do potpunog uklanjanja plinova:
Na2C03 + CaC03 + 6 Si02 = Na2O.CaO. 6SiO2 + 2C02.
Za posebne vrste stakla - vatrostalne, "neraskidive" - prilikom kuhanja dodajte okside barija, olova, bora. Za dobivanje obojenih stakala, također se uvode različiti aditivi, na primjer, dodavanje kobaltnog oksida Co 2 O 3 daje plavu boju, kromov oksid Cr 2 O 3 - zeleni, mangan dioksid MnO 2 - ružičasti.
Si02 oksid je anhidrid određenog broja silicijevih kiselina, čiji se sastav može izraziti općom formulom xSiO2 H yH2O, gdje su x i y cijeli brojevi: 1) x = 1, y = 1: Si02. H2, t.j. H2Si03-meta-silikonska kiselina; 1) x = 1, y = 2: Si02. 2H20, tj. ortosilikatnu kiselinu; 1) x = 2, y = 1: 2SiO2. H2, t.j. H 2 Si 2 O 5 - bimeta silicijska kiselina.
Kiseline čije molekule sadrže više od jedne SiO2 molekule pripadaju polisilikonu.
Najjednostavnije silikatne kiseline je H 2 SiO 3, koji se često naziva silicij, a njegove soli su silikati. Od silikata, samo natrijevi i kalijev silikati su topljivi u vodi, preostali silikati su vatrostalne supstance netopljive u vodi.
Otopine silikata rastu mutno pri stajanju u zraku, jer CO 2 sadržan u njemu zamjenjuje silikatnu kiselinu iz svojih soli (H 2 SiO 3 je slabija od ugljične kiseline; konstanta disocijacije H 2 SiO 3 u prvoj fazi jednaka je K 1 = 2.2. 10 -10 ).
H 2 SiO 3 je praktički netopljiv u vodi - ovo svojstvo se koristi kao kvalitativna reakcija za detekciju silikatnih iona:
Na2SiO3 + CO2 + H20 = Na2C03 + H2SiO3.
Silikati se dobivaju fuzijom Si02 s alkalijama ili karbonatima.
Koncentrirane otopine natrijevog i kalijevog silikata se nazivaju tekuće staklo, imaju jaku alkalnu reakciju zbog činjenice da su visoko hidrolizirane:
K2Si03 + H202KON + H2Si03.
Tekuće staklo se koristi, na primjer, za proizvodnju ljepila, vodootpornih tkanina.
Cement se vrlo široko koristi u građevinarstvu kao vezivo koje se, kada se miješa s vodom, stvrdnjava. Obično se cement proizvodi u velikim rotacijskim pećima gdje se peku i melju razne silikate (na temperaturi od -1000 ° C).
Postoji nekoliko vrsta cementa, međutim, uvjetno je moguće razlikovati dvije vrste cementa prema načelu "valjanja" - običnog cementa i portland cementa. Proces "postavljanja" konvencionalnog cementa koji se sastoji od kalcijevog silikata nastaje uslijed stvaranja kalcijevog karbonata zbog ugljičnog dioksida u zraku:
CaO. Si02 + C02 + H20 = CaC03 + H2SiO3.
Prilikom postavljanja Portland cementa ugljični dioksid nije uključen u proces, a hidroliza silikata nastaje s naknadnim stvaranjem netopljivih kristaliničnih hidrata:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca2SiO4 + 4H2O = Ca2SiO4. 4H2O.
· Karbidi i silicidi
· Ugljični i silicijevi spojevi s metalima - karbidima i silicidima, osim razmatranih reakcija, također se dobivaju interakcijom silicija s metalnim hidridima, na primjer:
2CaH2 + Si = Ca2Si + 2H2.
· Sve ove reakcije odvijaju se na visokim temperaturama. Među karbidima emitiraju se takozvani "metanidi" i "acetilen". Prvi se smatraju derivatima metana koji sadrže ugljik u oksidacijskom stanju -4 (Be 2 C, Al 4 C 3), a drugi - derivate acetilena sa stupnjem oksidacije ugljika -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2). , CAC 2). Acetilidi srebra i bakra (I) mogu se lako dobiti prolaskom acetilena kroz otopinu amonijaka srebrnog oksida ili bakar (I) klorida. Većina metanida i acetilida aktivno reagira s vodom (posebno s kiselinama), oslobađajući odgovarajuće ugljikovodike:
· SAS 2 + 2N 2 O = Sa (ON) 2 + S 2 N 2,
· Al4C3 + 12H20 = 4Al (OH) 3 + 3CH4,
· Ag2C2 + 2HCl = 2AgCl2 + C2H2.
· Za razliku od karbida, samo silikidi alkalijskih ili zemnoalkalijskih metala međusobno djeluju s vodom i kiselinama, proizvodeći najjednostavniji vodikov spoj silicij monosilan, koji se često naziva silan SiN 4:
· Ca2Si + 4HCl = 2CaCl2 + SiH4.
· Silan je bezbojni plin koji ima miris plijesni, spontano zapaljiv na zraku, gori do SiO 2 i vode:
SiH4 + 2O2 = Si02 + 2H20.
· Alkalije se vrlo lako razgrađuju silanom jednadžbom:
· SiH4 + 2KON + H20 = K2Si03 + 4H2,
· Voda također hidrolizira silan, ali mnogo sporije:
SiH4 + 2H20 = Si02 + 4H2.
· Pri zagrijavanju iznad 400 ° C bez pristupa zraku, silan se raspada u silicij i vodik (jedan od načina proizvodnje silicija):
· SiH4 = Si + 2H2.
Osim monosilana, također su poznati disilan Si2H6, trisilan Si3H8, tetrasilan Si4H10, itd.. U pojedinačnom stanju, spojevi su izolirani samo do Si6H14 uključivo. Svi ti spojevi pripadaju homolognoj seriji silana, kojoj odgovara opća formula Si nH2n + 2. Kao i alkani, silani su bezbojni, prvi članovi homolognih serija su u normalnim uvjetima plinoviti, slijedeći su tekućine. Kemijska aktivnost silana i ugljikovodika je različita: za razliku od dovoljno inertnih alkana, silan je sve reaktivan. To je zbog nižeg afiniteta silicija za vodik u odnosu na ugljik i vrlo visokog afiniteta silicija za kisik. Štoviše, Si-Si veze su manje izdržljive od veza S-S. Za razliku od veze C - H, veza Si - H ima više ionski karakter.
· Energija veza Si-E i CE.
· Mala čvrstoća Si-Si veze nastaje zbog ograničenosti homologne serije silana.
• Među karbidima i silicidima posebno mjesto zauzima karborundni SiC, koji se može nazvati i silicijev karbid i ugljični silicid. Karborund ima visoku točku taljenja zbog svoje dijamantne strukture; tvrdoća je bliska onoj dijamanta. Kemijski, SiC je vrlo stabilan.
· Pojam koloidnih otopina
U prirodi i tehnologiji često se nalaze raspršeni sustavi u kojima je jedna tvar ravnomjerno raspoređena kao čestice unutar druge tvari.
U disperznim sustavima postoji raspršena faza - fino podijeljena tvar i disperzijski medij - homogena tvar u kojoj se distribuira disperzirana faza. Disperzni sustavi uključuju uobičajene (istinite) otopine, koloidne otopine, kao i suspenzije i emulzije. Oni se međusobno razlikuju prvenstveno veličinama čestica, tj. Stupnjem disperzije (fragmentacija).
Sustavi s veličinom čestica manjih od 1 nm su prave otopine koje se sastoje od molekula ili iona otopljenih tvari. Trebaju se smatrati jednofaznim sustavom. Sustavi s veličinama čestica većim od 100 nm su krupno raspršeni sustavi - suspenzije i emulzije.
Suspenzije su disperzirani sustavi u kojima je dispergirana faza kruta i disperzijski medij je tekućina, a krutina je praktički netopljiva u tekućini.
Emulzije su disperzirani sustavi u kojima su i disperzna faza i disperzijski medij tekućine koje se međusobno ne miješaju. Primjer emulzije je mlijeko u kojem male tekuće kuglice lebde u tekućini.
Suspenzije i emulzije su dvofazni sustavi.
Koloidne otopine su visoko dispergirani dvofazni sustavi koji se sastoje od disperzijskog medija i disperzne faze, a linearne dimenzije čestica potonjih leže u rasponu od 1 do 100 nm. Kao što se može vidjeti, koloidne otopine veličine čestica su međuprostor između istih otopina i suspenzija i emulzija. Koloidne čestice obično se sastoje od velikog broja molekula ili iona.
Koloidne otopine se također nazivaju solima. Dobivaju se metodama disperzije i kondenzacije. Disperzija se najčešće provodi pomoću posebnih “koloidnih mlinova”. U metodi kondenzacije, koloidne čestice nastaju spajanjem atoma ili molekula u agregate. Tijekom mnogih kemijskih reakcija dolazi do kondenzacije i formiranja visoko dispergiranih sustava (taloženje, hidroliza, oksidacijsko-redukcijske reakcije, itd.).
1 nm - nanometar (1 nm = 10 - 9 m).
Nasuprot pravim otopinama, karakterizira ih Tyndallov efekt, tj. Raspršivanje svjetlosti koloidnim česticama. Kada se svjetlosni snop pojavi kroz snop svjetla, pojavljuje se u zamračenoj sobi. 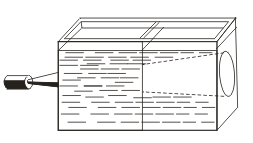 , Tako možete prepoznati je li ovo rješenje koloidno ili istinito.
, Tako možete prepoznati je li ovo rješenje koloidno ili istinito.
Jedno od važnih svojstava sola je da njihove čestice imaju električne naboje istog znaka. Zbog toga se ne stapaju u veće čestice i ne precipitiraju. U isto vrijeme, čestice nekih sola, na primjer, metali, sulfidi, silikatne i kositarske kiseline, imaju negativan naboj, dok drugi, na primjer hidroksidi, metalni oksidi, imaju pozitivan naboj. Pojava naboja objašnjava se adsorpcijom iona iz otopine koloidnim česticama.
Da bi se istaložio sol, potrebno je da se njegove čestice stope u veće agregate. Kombinacija čestica u veće agregate naziva se koagulacija, a njihova sedimentacija pod utjecajem gravitacije naziva se sedimentacija.
Obično dolazi do koagulacije kada se dodaju solima: 1) elektrolit, 2) drugi sol čije čestice imaju suprotan naboj i 3) kada se zagrijava.
