Sumpor. Vodikov sulfid i sulfidi
4.doc
240Sumpor. Vodikov sulfid, sulfidi, hidrosulfidi. Sumporni oksidi (IV) i (VI). Sumporna kiselina i sumporna kiselina i njihove soli. Esteri sumporne kiseline. Natrijev tiosulfat
4.1. sumpor
Sumpor je jedan od rijetkih kemijskih elemenata koji su ljudi koristili nekoliko tisućljeća. Široko je rasprostranjen u prirodi i nalazi se iu slobodnom stanju (prirodni sumpor) iu spojevima. Minerali koji sadrže sumpor mogu se podijeliti u dvije skupine - sulfidi (piriti, gliteri, lutke) i sulfati. Izvorni sumpor nalazi se u velikim količinama u Italiji (otok Sicilija) i SAD-u. U CIS-u, prirodne naslage sumpora nalaze se u regiji Volge, u državama središnje Azije, na Krimu i drugim područjima.
Minerali prve skupine uključuju sjaj svinjetine PbS, bakreni sjaj Cu 2 S, srebrni sjaj - Ag 2 S, cinkovu smjesu - ZnS, kadmijev snag - CdS, pirit ili željezni pirit - FeS 2, kalkopirit - CuFeS 2, cinabar - HgS.
Minerali druge skupine uključuju gipsani CaSO4H2O, mirabilit (Glauberova sol) - Na2S0410H20, i kizerite - MgS04H20.
Sumpor se nalazi u životinjama i biljkama, kao dio proteinskih molekula. Organski spojevi sumpora nalaze se u nafti.
recepcija
1. Kada se sumpor dobiva iz prirodnih spojeva, na primjer iz piritnog sumpora, zagrijava se na visoke temperature. Sumporni pirit razgrađuje se u željezni (II) sulfid i sumpor:
2. Sumpor se može dobiti oksidacijom sumporovodika zbog nedostatka kisika reakcijom:
2H2S02 = 2S2H20
3. U današnje vrijeme dobivanje sumpora sumpornim dioksidom SO 2 redukcijom ugljikovog dioksida uobičajeni je nusproizvod u taljenju metala iz sumpornih ruda:
SO2C = C02S
4. Otpadni plinovi metalurške i koksne peći sadrže mješavinu sumpornog dioksida i sumporovodika. Ova smjesa se propušta pri visokoj temperaturi preko katalizatora:
H2S02 = 2H203S
^ Fizička svojstva
Sumpor je tvrda, krhka limun žuta boja. Praktički je netopljiv u vodi, ali dobro topljiv u CS 2 anilinu u ugljikovom disulfidu i nekim drugim otapalima.
Loše provodi toplinu i električnu struju. Sumpor tvori nekoliko alotropnih modifikacija:
1 . ^ Romski sumpor (najstabilniji), kristali imaju oblik oktaedra.
Kod zagrijavanja sumpora mijenja se njegova boja i viskoznost: prvo se formira svijetlo žuta, a nakon povećanja temperature postaje tamnija i postaje toliko viskozna da ne izlazi iz cijevi, pri daljnjem zagrijavanju, viskoznost ponovno pada, a kod 444, 6 ° S sumpora se vraća ,
2. ^ Monoklinski sumpor - modifikacija u obliku tamno žutih iglica, dobivenih polaganim hlađenjem rastaljenog sumpora.
3. Plastični sumporako se sumpor zagrijan do vrenja ulije u hladnu vodu. Lako se rasteže poput gume (vidi sliku 19).
Prirodni sumpor sastoji se od mješavine četiri stabilna izotopa: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Kemijska svojstva
Atom sumpora, koji ima nepotpunu razinu vanjske energije, može pričvrstiti dva elektrona i pokazati stupanj
Oksidacija -2. Sumpor pokazuje takvo oksidacijsko stanje u spojevima s metalima i vodikom (Na2S, H2S). Kada se odbije ili osiromaši elektrona na atom elektronegativnijeg elementa, stupanj oksidacije sumpora može biti 2, 4, 6
Sumpor je relativno hladan na hladnoći, ali s porastom temperature povećava se njegova reaktivnost. 1. Kod metala sumpor pokazuje oksidirajuća svojstva. Kada te reakcije tvore sulfide (sa zlatom, platinom i iridijem ne reagira): Fe S = FeS
2. U normalnim uvjetima sumpor ne reagira s vodikom, a na 150–200 ° C dolazi do reverzibilne reakcije:
3. U reakcijama s metalima i vodikom, sumpor se ponaša kao tipično oksidacijsko sredstvo, au prisustvu jakih oksidirajućih sredstava pokazuje reducirajuća svojstva.
S 3F 2 = SF 6 (ne reagira s jodom)
4. Izgaranje sumpora u kisiku odvija se na 280 ° C, a na zraku na 360 ° C. To tvori mješavinu SO2 i SO3:
S02 = S02S3O2 = 2S03
5. Kada se grije bez zraka, sumpor se izravno spaja s fosforom, ugljikom, pokazujući oksidirajuća svojstva:
2P 3S = P 2 S 3 2S C = CS 2
6. U interakciji sa složenim tvarima, sumpor se uglavnom ponaša kao redukcijski agens:
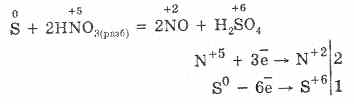
7. Sumpor je sposoban za reakcije nesrazmjernosti. Dakle, pri kuhanju sumpora u prahu s alkalijama nastaju sulfiti i sulfidi:
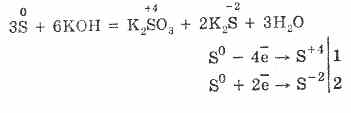
primjena
Sumpor se široko koristi u industriji i poljoprivredi. Oko polovice njegove proizvodnje troši se na proizvodnju sumporne kiseline. Sumpor se koristi za vulkanizaciju gume: u ovom slučaju, guma se pretvara u gumu.
U obliku sumpora (fini prah) sumpor se koristi u borbi protiv bolesti vinograda i pamuka. Koristi se za dobivanje baruta, šibica, sjajnih kompozicija. U medicini, pripremljena sumporna mast za liječenje kožnih bolesti.
4.2. Vodikov sulfid, sulfidi, hidrosulfidi
Vodikov sulfid je analog vode. Njegova elektronička formula
To pokazuje da su dva p-elektrona vanjske razine atoma sumpora uključena u stvaranje veza H-S-H. H 2 S molekula ima kutni oblik, tako da je polarna.
^ Biti u prirodi
Vodikov sulfid nalazi se u prirodi u vulkanskim plinovima iu vodama nekih mineralnih izvora, kao što su Pyatigorsk, Matsesta. Nastaje raspadanjem organskih tvari koje sadrže sumpor iz različitih životinjskih i biljnih ostataka. To objašnjava karakterističan neugodan miris kanalizacije, septičkih jama i odlagališta.
recepcija
1. Sulfid vodika može se dobiti izravnom vezom sumpora s vodikom zagrijavanjem:
2. Ali obično se dobiva djelovanjem razrijeđene klorovodične ili sumporne kiseline na željezni (III) sulfid:
2HCl FeS = FeCl2H2S2H FeS = Fe2H2S Ova reakcija se često provodi u Kippovom aparatu.
^ Fizička svojstva
Pod normalnim uvjetima, sumporovodik je bezbojni plin s jakim karakterističnim mirisom pokvarenih jaja. Vrlo otrovno, inhalacija se veže na hemoglobin, uzrokujući paralizu, što je nezdravo.
Ko vodi u smrt. U niskim koncentracijama, manje opasan. Potrebno je raditi s njim u ispušnim ormarima ili s hermetički zatvorenim uređajima. Dopušteni sadržaj H 2 S u proizvodnim pogonima iznosi 0,01 mg na 1 litru zraka.
Vodikov sulfid je relativno dobro topljiv u vodi (pri 20 ° C 2,5 volumena sumporovodika se otapa u 1 volumenu vode).
Otopina sumporovodika u vodi naziva se vodik sulfidna voda ili vodik sulfidna kiselina (detektira svojstva slabe kiseline).
^ Kemijska svojstva
1, Kada se snažno zagrije, sumporovodik se gotovo u potpunosti razgrađuje u sumpor i vodik.
2. Plinoviti sumporovodik gori u zraku plavim plamenom s nastankom sumporovog oksida (IV) i vode:
2H2S302 = 2S02 2H20
Uz nedostatak kisika, formiraju se sumpor i voda: 2H2SO2 = 2S2H2O
3. Vodikov sulfid je prilično jak redukcijski agens. Ovo važno kemijsko svojstvo može se objasniti na sljedeći način. U otopini H2S relativno je lako donirati elektrone molekulama kisika u zraku:
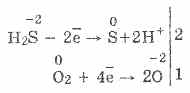
U isto vrijeme, kisik u zraku oksidira sumporovodik u sumpor, što čini sumporovodik mutnom:
2H2S02 = 2S2H2O
To objašnjava činjenicu da se sumporovodik ne akumulira u vrlo velikim količinama u prirodi kada se organska tvar raspada - kisik iz zraka oksidira u slobodni sumpor.
4, Vodikov sulfid snažno reagira s halogenim otopinama, na primjer:
Sumpor se oslobađa, a otopina joda postaje bezbojna.
5. Razni oksidanti snažno reagiraju sa sumporovodikom: pod djelovanjem dušične kiseline nastaje slobodni sumpor.
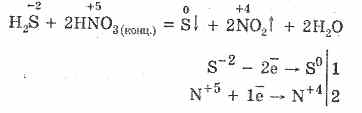
6. Otopina sumporovodika je kisela zbog disocijacije:
H2SHH HS - HS - H S - 2
Prva faza obično prevladava. To je vrlo slaba kiselina: slabija od ugljene kiseline, koja obično zamjenjuje H2S iz sulfida.
Sulfidi i hidrosulfidi
Fluorovodična kiselina, kao dvobazična, tvori dva reda soli:
Srednji - sulfidi (Na2S);
Kiselo-hidrosulfidi (NaHS).
Ove soli se mogu dobiti: interakcijom hidroksida sa sumporovodikom: 2NaOHH2S = Na2S2H2O
Izravna interakcija sumpora s metalima:
Reakcija izmjene soli s H2S ili između soli:
Pb (NO3) 2Na2S = PbSi2NaNO3
CuS04H2S = CuS02H2S04Cu2H2S = CuS02H
Hidrosulfidi su gotovo svi topljivi u vodi.
Sulfidi alkalnih i zemnoalkalijskih metala su također lako topljivi u vodi, bezbojni.
Sulfidi teških metala su praktički netopljivi ili slabo topljivi u vodi (FeS, MnS, ZnS); Neke od njih se ne otapaju u razrijeđenim kiselinama (CuS, PbS, HgS).
Kao soli slabe kiseline, sulfidi u vodenim otopinama su visoko hidrolizirani. Na primjer, sulfidi alkalijskih metala, kada su otopljeni u vodi, imaju alkalnu reakciju:
Na 2 S NONNaHS NaOH
Svi sulfidi, kao i sam vodikov sulfid, snažni su redukcijski agensi:
3PbS -2 8HN5O3 (par.) = 3PbS6O4 4H2O8N2O2
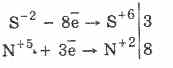
Neki sulfidi imaju karakterističnu boju: CuS i PbS - crni, CdS - žuti, ZnS - bijeli, MnS - ružičasti, SnS - smeđi, Al 2 S 3 - narančasti. Kvalitativna analiza kationa temelji se na različitim topljivostima sulfida i različitim bojama mnogih od njih.
^ 4.3. Sumporni oksid (IV) i sumporna kiselina
Sumporni oksid (IV), ili sumporni dioksid, u normalnim uvjetima, je bezbojni plin s oštrim mirisom koji guši. Kada se ohladi na -10 ° C, ukapljuje se u bezbojnu tekućinu.
recepcija
1. U laboratorijskim uvjetima, sumporni oksid (IV) se dobiva iz soli sumporne kiseline djelovanjem jakih kiselina na njih:
Na2S03H2S04 = Na2S04S022H2O2NaHSO3H2S04 = Na2S04 2SO2 - 2H2O2HS02 - 2H = 2S02H2O
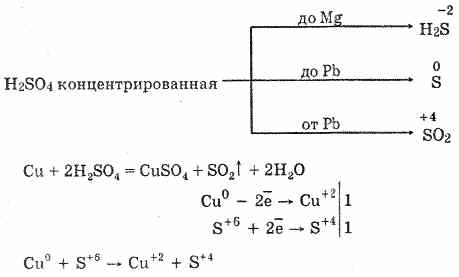
2. Također, sumporni dioksid nastaje interakcijom koncentrirane sumporne kiseline pri zagrijavanju s nisko-aktivnim metalima:
Cu2H2S04 = CuS04S02 2H2O
Cu 4H 2 SO 2-4 = Cu2S02-4S02 2H2O
3. Sumporni oksid (IV) također nastaje kada se sumpor sagorijeva u zraku ili kisiku:
4. U industrijskim uvjetima, SO2 se dobiva prženjem pirita s FeS 2 ili sumpornim rudama obojenih metala (cinkova mješavina ZnS, olovni sjaj PbS, itd.):
4FeS 2 1O 2 = 2Fe2O3 8SO2
Strukturna formula molekula SO2:
Četiri atoma sumpora i četiri elektrona iz dva atoma kisika sudjeluju u formiranju veza u molekuli SO2. Uzajamno odbijanje parova veznih elektrona i usamljeni elektronski par sumpora daje molekuli kutni oblik.
Kemijska svojstva
1. Sumporni oksid (IV) pokazuje sva svojstva kiselih oksida:
Interakcija vode
Interakcija s alkalijama
Interakcija s osnovnim oksidima.
2. Sumporni oksid (IV) karakteriziraju reducirajuća svojstva:
S 4 O 2 O 0 2 S 2S 6 O -2 3 (u prisutnosti katalizatora, kada se zagrijava)
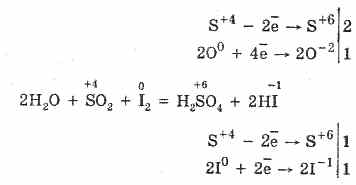
Ali u prisutnosti jakih redukcijskih sredstava, SO2 se ponaša kao oksidacijsko sredstvo:
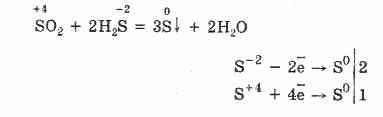
Redoks dvojnost sumpornog (IV) oksida objašnjava se činjenicom da sumpor ima u njemu oksidacijsko stanje 4, te se stoga može, odustavajući od 2 elektrona, oksidirati do S6, a uzimanjem 4 elektrona može se reducirati na S °. Pojava tih ili drugih svojstava ovisi o prirodi reaktivne komponente.
Sumporni oksid (IV) je dobro topljiv u vodi (40 volumena SO2 se otopi u 1 volumenu pri 20 ° C). U ovom slučaju nastaje sumporna kiselina koja postoji samo u vodenoj otopini:
SO2H2OHH2S03
Reakcija je reverzibilna. U vodenoj otopini sumporni oksid (IV) i sumporna kiselina su u kemijskoj ravnoteži, što se može pomaknuti. S vezanjem H2S03 (neutralizacija kiseline
Vi) reakcija se odvija u smjeru stvaranja sumporne kiseline; kada se ukloni SO2 (puhanje kroz otopinu dušika ili zagrijavanje), reakcija se nastavlja prema početnim materijalima. Otopina sumporne kiseline uvijek sadrži sumporni oksid (IV), što mu daje oštar miris.
Sumporna kiselina ima sva svojstva kiselina. U rješenju se razdvaja u koracima:
H2S03-HSO3-HSO-3HH-2-3
Termički nestabilan, nepostojan. Sumporna kiselina, kao dvobazična, tvori dvije vrste soli:
Srednji - sulfiti (Na2S03);
Kiselo-hidrosulfit (NaHS03).
Sulfiti nastaju kada je alkalija potpuno neutralizirana kiselinom:
H2S03 2NaOH = Na2S03 2H20
Hidrosulfiti se dobivaju s manjkom alkalija:
H2S03 NaOH = NaHS03H20
Sumporna kiselina i njezine soli posjeduju i oksidirajuća i reducirajuća svojstva, što je određeno prirodom reakcijskog partnera.
1. Dakle, pod djelovanjem kisika sulfiti se oksidiraju u sulfate:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
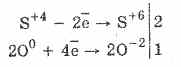
Još lakše se odvija oksidacija sumporne kiseline bromom i kalijevim permanganatom:
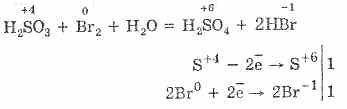
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
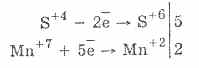
2. U prisutnosti snažnijih redukcijskih sredstava, sulfiti pokazuju oksidativna svojstva:
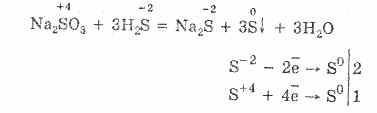
Gotovo svi hidrosulfiti i sulfiti alkalijskih metala otapaju se iz soli sumporne kiseline.
3. Budući da je H2S03 slaba kiselina, djelovanje kiselina na sulfite i hidrosulfite rezultira otpuštanjem SO2. Ova metoda se obično koristi pri dobivanju SO2 u laboratorijskim uvjetima:
NaHS03H2S04 = Na2S04S02 + H20
4. U vodi topljivi sulfiti lako prolaze hidrolizu, što rezultira povećanjem koncentracije OH - iona u otopini:
Na2S03 NON-NaHS03 NaOH
primjena
Sumporni oksid (IV) i sumporna kiselina mijenjaju boju mnogih boja, formirajući s njima bezbojne spojeve. Potonji se mogu ponovno razgraditi kada se zagriju ili na svjetlu, zbog čega se boja ponovno uspostavlja. Zbog toga je učinak izbjeljivanja SO2 i H2S03 različit od učinka izbjeljivanja klora. Obično sumpor (IV) izbjeljuje vunu, svilu i slamu.
Sumporni oksid (IV) ubija mnoge mikroorganizme. Stoga, da bi se uništili plijesni, oni fumigiraju sirove podrume, podrume, vinske bačve, itd. Također se koriste u prijevozu i skladištenju voća i bobičastog voća. U velikim količinama, za proizvodnju sumporne kiseline koristi se sumporni oksid IV.
Važna primjena je otopina kalcijevog hidrosulfita CaHSO 3 (sulfitna tekućina) koja se koristi za obradu drva i papirne pulpe.
^ 4.4. Sumporni oksid (VI). Sumporna kiselina
Sumporni oksid (VI) (vidi tablicu 20) je bezbojna tekućina koja se skraćuje na temperaturi od 16,8 ° C do čvrste kristalne mase. Vrlo snažno upija vlagu, tvoreći sumpornu kiselinu: SO3H2O = H2SO4
Tablica 20. Svojstva oksida sumpora
Otapanje sumpornih oksida (VI) u vodi popraćeno je oslobađanjem značajne količine topline.
Sumporni oksid (VI) je vrlo topiv u koncentriranoj sumpornoj kiselini. Otopina SO3 u bezvodnoj kiselini naziva se oleum. Oleumi mogu sadržavati do 70% SO3.
recepcija
1. Sumporni oksid (VI) dobiva se oksidacijom sumpornog dioksida kisikom u prisutnosti katalizatora na temperaturi od 450 ° C (vidi Proizvodnja sumporne kiseline):
2SO202 = 2S03
2. Drugi način oksidacije SO2 u SO3 je upotreba dušičnog (IV) oksida kao oksidacijskog sredstva:
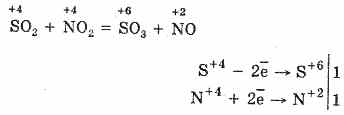
Dobiveni dušikov oksid (II) u interakciji s atmosferskim kisikom lako i brzo prelazi u dušikov oksid (IV): 2NO O 2 = 2NO 2
Koji se opet može koristiti u oksidaciji SO2. Prema tome, NO2 djeluje kao nosač kisika. Ovaj postupak oksidacije SO2 u SO3 naziva se nitroz. Molekula SO3 ima oblik trokuta, u čijem središtu je
Atom sumpora nalazi se:
Takva struktura je posljedica međusobnog odbijanja parova veznih elektrona. Atom sumpora osigurao je šest vanjskih elektrona za njihovo formiranje.
Kemijska svojstva
1. SO3 - tipični kiseli oksid.
2. Sumporni oksid (VI) ima svojstva jakog oksidirajućeg sredstva.
primjena
Za proizvodnju sumporne kiseline koristi se sumporni oksid (VI). Najvažniji je kontaktni način dobivanja
Sumporna kiselina. Ovom metodom možete dobiti H2S04 bilo koje koncentracije, kao i oleum. Postupak se sastoji od tri faze: dobivanje SO2; oksidacija SO2 u SO3; dobivanje H2S04.
SO2 se dobiva spaljivanjem pirita FeS 2 u posebnim pećima: 4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Da bi se ubrzao pražnjenje, pirit je predzemljen, a za potpunije sagorijevanje sumpora injektira se znatno više zraka (kisika) nego što je potrebno reakciji. Plin koji izlazi iz peći sastoji se od sumpornog (IV) oksida, kisika, dušika, spojeva arsena (od nečistoća u piritima) i vodene pare. To se naziva plin za prženje.
Plin za pečenje prolazi temeljito čišćenje, jer čak i mali sadržaj spojeva arsena, kao i prašina i vlaga, truju katalizator. Plin se čisti od spojeva arsena i prašine, prolazi kroz posebne elektrostatičke taložnike i toranj za pranje; Koncentrirana sumporna kiselina apsorbira vlagu u tornju za sušenje. Pročišćeni plin koji sadrži kisik zagrijava se u izmjenjivaču topline do 450 ° C i ulazi u kontaktni uređaj. Unutar kontaktnog aparata nalaze se rešetkaste police ispunjene katalizatorom.
Prije se kao katalizator koristi fino usitnjena metalna platina. Zatim je zamijenjen vanadijevim spojevima - vanadijevim oksidom (V) V205 ili vanadil sulfatom VOSO 4, koji je jeftiniji od platine i sporije otrovan.
Reakcija oksidacije SO2 u SO3 je reverzibilna:
2SO202S03
Povećanje sadržaja kisika u kalcinacijskom plinu povećava prinos sumpornog oksida (VI): na temperaturi od 450 ° C, obično doseže 95% ili više.
Formirani oksid sumpora (VI) se zatim dovodi metodom protustruje u apsorpcijski toranj, gdje se apsorbira koncentriranom sumpornom kiselinom. Kako zasićuje, prvo se stvara bezvodna sumporna kiselina, a zatim oleum. U budućnosti će se oleum razrijediti do 98% sumporne kiseline i isporučiti potrošačima.
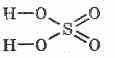
Strukturna formula sumporne kiseline:
^ Fizička svojstva
Sumporna kiselina je teška, bezbojna uljasta tekućina koja kristalizira pri 10,4 ° C, gotovo dvostruko ( = 1,83 g / cm3) je teži od vode, bez mirisa, nehlapljiv. Izuzetno higroskopan. Vlaga upija uz oslobađanje velikih količina topline, tako da ne možete sipati vodu u koncentriranu sumpornu kiselinu - doći će do prskanja kiseline. Za
Sumporna kiselina mora biti dodana u vodu u malim obrocima.
Bezvodna sumporna kiselina otapa do 70% sumpornog oksida (VI). Kada se zagrije, uklanja se SO3 dok se ne dobije otopina s masenim udjelom H20S04 od 98,3%. Bezvodni H2S04 gotovo ne provodi električnu struju.
^ Kemijska svojstva
1. Miješa se s vodom u svim omjerima i tvori hidrate različitog sastava:
H2S04H20, H2S04 2H2O, H2S04 3H20, H2S04 4H2O, H2S04 6,5H2O
2. Koncentrirana sumporna kiselina karbonizira organsku tvar - šećer, papir, drvo, vlakna, oduzimajući im elemente vode:
C12H22O11H2S04 = 12Ch2S04lH20
Nastali ugljen djelomično djeluje s kiselinom:
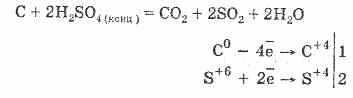
Dehidracija plina temelji se na upijanju vode sumpornom kiselinom.
Kao jaka nehlapljiva kiselina, H2S04 zamjenjuje druge kiseline iz suhih soli:
NaN03H2S04 = NaHS04HNO3
Međutim, ako se u otopine soli doda H2S04, ne dolazi do istiskivanja kiseline.
H2S04 - jaka dvobazna kiselina: H2S04'H HSO - 4 HSO - 4 'H SO 2-4
Ima sva svojstva nehlapljivih jakih kiselina.
Razrijeđenu sumpornu kiselinu karakteriziraju sva svojstva neoksidirajućih kiselina. Naime: interagira s metalima koji su u elektrokemijskom nizu napona metala sve do vodika:
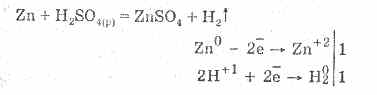
Interakcija s metalima posljedica je redukcije vodikovih iona.
6. Koncentrirana sumporna kiselina je energetski oksidirajući agens. Kada se zagrijava, oksidira većinu metala, uključujući one u elektrokemijskom nizu naprezanja nakon vodika, ne reagira samo s platinom i zlatom. Ovisno o aktivnosti metala, redukcijski produkti mogu biti S-2, S ° i S4.
U hladnoj, koncentriranoj sumpornoj kiselini nije u interakciji s tako jakim metalima kao što su aluminij, željezo i krom. To je zbog pasivizacije metala. Ova značajka se široko koristi kada se transportira u željeznom spremniku.
Međutim, kada se grije:
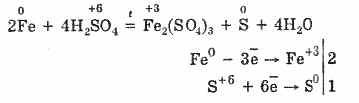
Tako koncentrirana sumporna kiselina u interakciji s metalima zbog redukcije atoma koji stvaraju kiselinu.
Kvalitativna reakcija na sulfatni ion SO 2-4 je stvaranje bijelog kristalnog taloga BaSO 4, netopljivog u vodi i kiselinama:
SO2-4Ba2 'BaSO4'
primjena
Sumporna kiselina je najvažniji proizvod glavne kemijske industrije koja se bavi proizvodnjom ne-
Organske kiseline, lužine, soli, mineralna gnojiva i klor.
Za razne primjene sumporna kiselina je na prvom mjestu među kiselinama. Najveća količina konzumira se za dobivanje fosfatnih i dušičnih gnojiva. Kao nehlapljiva, sumporna kiselina se koristi za proizvodnju drugih kiselina - klorovodične, fluorovodične, fosforne i octene.
Mnogo toga se odnosi na pročišćavanje naftnih derivata - benzina, kerozina, mazivih ulja - od štetnih nečistoća. U strojarstvu sumporna kiselina očisti površinu metala od oksida prije premazivanja (niklovanje, kromiranje, itd.). Sumporna kiselina se koristi u proizvodnji eksploziva, umjetnih vlakana, boja, plastike i mnogih drugih. Koristi se za punjenje baterija.
Soli sumporne kiseline su važne.
Ium Natrijev sulfatNa2S04 kristalizira iz vodenih otopina u obliku hidrata Na2S0410H2O, koji se naziva Glauberova sol. Koristi se u medicini kao laksativ. Bezvodni natrijev sulfat koristi se u proizvodnji sode i stakla.
^ Amonijev sulfat(NH 4) 2 SO 4 - dušično gnojivo.
Kalijev sulfatK 2 SO 4 - gnojivo s kalijem.
Kalcijev sulfat CaSO4 se nalazi u prirodi u obliku gipsanog minerala CaSO4H2O. Kada se zagrije na 150 ° C, gubi dio vode i odlazi u hidrat 2CaSO4H20, zvani spaljeni gips ili alabaster. Kada se pomiješa s vodom u pastoznu masu, alabaster se nakon nekog vremena ponovno stvrdne, pretvarajući se u CaSO 4 2H 2 O. Gips se široko koristi u građevinarstvu (gips).
Magnezijev sulfatMgSO 4 nalazi se u morskoj vodi, uzrokujući njen gorki okus. Kristalni hidrat, nazvan gorka sol, koristi se kao laksativ.
vitriol- tehnički naziv kristalnih hidrata metalnih sulfata Fe, Cu, Zn, Ni, Co (dehidrirane soli nisu vitriji). Bakar sulfatCuSO 4 5H 2 O je plava otrovna tvar. Biljke su poprskane razrijeđenom otopinom i sjemenke su posijane prije sjetve. Željezni vitriolFeSO4 7H2O je svjetlozelena tvar. Koristi se za suzbijanje štetočina biljaka, tinte, mineralnih boja itd. Cink sulfatZnSO 4 7H 2 O se koristi u proizvodnji mineralnih boja, u sittoprechatanii, medicini.
^ 4.5. Esteri sumporne kiseline. Natrijev tiosulfat
Esteri sumporne kiseline uključuju dialkil sulfate (RO2) S02. To su tekućine visokog vrelišta; niže topljivi u vodi; u prisutnosti alkalija, nastaju alkohol i soli sumporne kiseline. Niži dialkil sulfati su alkilirajući agensi.
Dietil sulfat(C2H5) 2S04. Točka topljenja -26 ° C, vrelište 210 ° C, topljivo u alkoholima, netopivo u vodi. Dobiva se interakcijom sumporne kiseline s etanolom. Je sredstvo za etiliranje u organskoj sintezi. Prodire u kožu.
Dimetil sulfat(CH3) 2S04. Talište -26,8 ° C, vrelište 188,5 ° C. Topivo u alkoholima, loše - u vodi. Reagira s amonijakom u odsutnosti otapala (s eksplozijom); Sumpor nekim aromatičnim spojevima, kao što su esteri fenola. Dobiva se interakcijom 60% -tnog oleuma s metanolom na 150 ° C. To je metilacijsko sredstvo u organskoj sintezi. Kancerogen, djeluje na oči, kožu, dišne organe.
^ Natrijev tiosulfat Na2S203
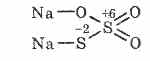
Sol tiosulfurne kiseline u kojoj dva atoma sumpora imaju različita oksidacijska stanja: 6 i -2. Kristalna tvar, dobro topljiva u vodi. Dostupan u obliku kristalnog Na2S2O3 5H2O, koji se obično naziva hiposulfit. Dobiva se interakcijom natrijevog sulfita s sumporom tijekom ključanja:
Na2S03S = Na2S203
Kao i tiosulfurna kiselina, ona je jako reducirajuće sredstvo, lako se oksidira klorinom u sumpornu kiselinu:
Na2S203 4Cl2 5H2O = 2H2S04 2NaCl 6HCl
Primjena natrijevog tiosulfata za apsorpciju klora (u prvim plinskim maskama) temelji se na ovoj reakciji.
Nešto različita oksidacija nastaje slabo oksidirajućim sredstvima natrijevog tiosulfata. To tvori soli tetratonske kiseline, na primjer:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2 Na
Natrijev tiosulfat je nusproizvod u proizvodnji NaHSO 3, sumpornih boja, u pročišćavanju industrijskih plinova od sumpora. Koristi se za uklanjanje tragova klora nakon tkanina za izbjeljivanje, za izdvajanje srebra iz ruda; je fiksativ u fotografiji, reagens u jodometriji, antidot za trovanje spojevima arsena, živom, protuupalnim sredstvom.
Kemijski element sumpor nalazi se u VIA-skupini, u razdoblju 3 PSCE. Na vanjskom elektronskom sloju atoma sumpora nalazi se 6 elektrona. Pokazujući svojstva oksidirajućeg agensa u stvaranju tvari s metalima i vodikom, sumpor stječe oksidacijsko stanje -2 (uzima 2 elektrona).
U sastavu spojeva koji sadržavaju kisik sumpor pokazuje oksidacijska stanja +4 i +6. Dakle, sumpor je karakteriziran oksidacijskim stanjima -2; 0; 4; 6.
U prirodi se sumpor nalazi u njegovom izvornom stanju iu sastavu minerala. Na primjer, sumpor sadrži olovni sjaj (glavna komponenta je olovni sulfid PbS) i bakreni sjaj (glavna komponenta je bakreni sulfid Cu 2 S).
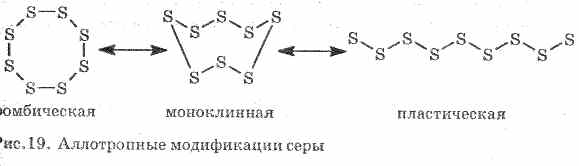
Sumpor tvori nekoliko jednostavnih tvari - alotropne modifikacije. Romski sumpor je najstabilniji na sobnoj temperaturi (slika 1). Ova tvar se sastoji od S8 molekula. Rombični sumpor je žut i topi se na temperaturi od + 112,8 ° C.
Sl. 1. Rombička modifikacija sumpora
Kada se zagrije, rombični sumpor postupno prelazi u viskoznu tamno smeđu masu. Ovo je još jedna alotropna modifikacija sumporno-plastičnog sumpora. Plastični sumpor sastoji se od linearnih molekula sumpora S n.
Sumpor u kemijskim reakcijama s metalima i vodikom igra ulogu oksidacijskog sredstva. Njegov stupanj oksidacije opada od 0 do -2. U reakciji s kisikom, sumpor djeluje kao redukcijsko sredstvo, povećavajući njegov stupanj oksidacije od 0 do +4.
Razmotrite primjere interakcija koje uključuju sumpor.
Kada sumpor reagira s vodikom, nastaje sumporovodik:
Kada cink reagira sa sumporom, nastaje cinkov sulfid:
Sumpor gori u kisiku uz stvaranje sumporovog oksida (IV) (Sl. 2):

Sl. 2. Spaljivanje sumpora u kisiku
Uzeti u obzir svojstva sumpornih spojeva s oksidacijskim stanjem "-2". Takvi spojevi uključuju vodikov sulfid i sulfide - soli sumporovodonične kiseline.
Vodikov sulfid je plin s mirisom pokvarenih jaja. Gori u zraku. Štoviše, uz nedostatak i višak kisika, izgaranje se odvija različito.
U suvišku kisika, sumporovodik gori u obliku sumpornog oksida (IV) i vode:
2H2S + 302 = 2SO2 + 2H20.
Uz nedostatak kisika dolazi do nepotpunog izgaranja sumporovodika s oslobađanjem sumpora: 2H2S + O2 = 2S + 2H2O.
Vodikov sulfid je vrlo topiv u vodi. Dobivena otopina je slaba sumporovodična kiselina. Soli sumporovodika nazivaju se sulfidi. Hidrofluorna kiselina i vodotopivi sulfidi ulaze u reakcije izmjene.
Interakcija vodik sulfidne kiseline i bakrenog (II) klorida formira netopljivi bakar (II) sulfid i klorovodičnu kiselinu: H 2 S + CuCl 2 = CuS + 2HCl.
Kada interakcija kalijevog sulfida s cinkovim nitratom izaziva taloženje cinkovog sulfida i nastaje kalijev nitrat: K2S + Zn (NO3) 2 = ZnS + 2 KNO 3.
reference
- Orzhekovsky P.A. Zbirka zadataka i vježbi iz kemije: 9. razred: na udžbenik P.A. Orzhekovsky i drugi. “Kemija. Ocjena 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M.: AST: Astrel, 2007. (str. 91-97)
- Orzhekovsky P.A. Kemija: 9. razred: studije. za općenitu sliku. uspostavljena. / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. - M.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Kemija: 9. razred: studije za opće. uspostavljena. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Kemija: neorgan. kemija. Tijelo. Kemija: studije. za 9 cl. / G.E. Rudzitis, F.G. Feldman. - M.: Obrazovanje, OJSC Moskovih udžbenika, 2009.
- Khomchenko I.D. Zbirka zadataka i vježbi iz kemije za srednju školu. - M.: RIA "Novi val": Izdavač Umerenkov, 2008.
- Enciklopedija za djecu. Svezak 17. Kemija / Poglavlje. Ed. VA Volodin, Ved. znanstvena. Ed. I. Leenson. - M.: Avanta +, 2003.
- Jedna zbirka digitalnih obrazovnih resursa (video iskustva na tu temu) ().
- Elektronska verzija časopisa "Kemija i život" ().
domaći zadatak
- a. 136 No. 3; str.140 №№ 2-4 iz udžbenika P.A. Orzhekovsky "Kemija: 9. razred" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M.: Astrel, 2013.
sulfidi (od lat. sumpora, sumpora, sumpora)
sumpornih spojeva s više elektropositivnih elemenata; mogu se smatrati solima hidrogen sulfidne kiseline (Vidi Vodikov sulfidna kiselinaH 2 S. Postoje dva C serije: prosječna (normalna) opće formule M2S i kiselina (hidrosulfidi) opće formule MHS, gdje je M monovalentni metal. C. alkalni metali su bezbojni, topljivi u vodi. Njihove vodene otopine su visoko hidrolizirane i alkalne. Pod djelovanjem razrijeđenih kiselina ispuštaju H 2 S. C. zemnoalkalni metali su bezbojni, slabo topljivi u vodi. H2S se emitira u vlažnom zraku, a ostala svojstva su slična S. alkalnim metalima. I oni i drugi S. lako se oksidiraju u sulfate. C. Teški metali su praktički netopljivi u vodi. Gotovo svi su crni ili crno-smeđi (osim bijelog ZnS-a, ružičastog MnS, žutog CdS-a, narančasto-crvene Sb 2 S 3, žute SnS 2). Neujednačen omjer C. i kiselina i C. amonijak koristi se u kemijskoj analizi. I.K. Malina.
Velika sovjetska enciklopedija. - M: Sovjetska enciklopedija. 1969-1978 .
Pogledajte što su "Sulfidi" u drugim rječnicima:
Spojevi sumpora s metalima i nekim nemetalima. Metalni sulfidi su soli vodik sulfidne kiseline H2S: medij (na primjer, Na2S) i kiseli, ili hidrosulfidi (NaHS). Spaljivanjem prirodnih sulfida dobivaju se obojeni metali i SO2. Fosforni sulfidi i ... Veliki enciklopedijski rječnik
Moderna enciklopedija
sulfidi - SULFIDI, anorganski sulfidi spojeva sumpora s metalima i nekim nemetalima. Uključene u sulfidne rude; kao fosfor (na primjer, CdS, ZnS). Molibden sulfid, titan maziva. Fosforni sulfidi ... ... Ilustrirani enciklopedijski rječnik
- (novi lat., od lat. sumpor sumpora). Spojevi nekog tijela sa sumporom, koji odgovaraju oksidima ili kiselinama. Rječnik stranih riječi uključenih u ruski jezik. Chudinov, AN, 1910. SULFIDI Novolatinsk., Iz lat. sumpor, sumpor. Veza ... ... Rječnik stranih riječi ruskog jezika
1. Prirodni spojevi sumpora metala i nekih nemetala. U kemikaliji odnose se na soli vodik sulfidne kiseline H2S. Brojni elementi formiraju polisulfide sa sumporom, koji su soli polu sumporne kiseline H2Sx. Glavni ... ... Geološka enciklopedija
sulfidi - - spojevi sumpora s metalima i nekim nemetalima; metalni sulfidni soli vodik sulfidne kiseline H2S. Terminološki rječnik za beton i armirani beton. FSU “SIC“ Izgradnja ”NIIZHB i stanica metroa A. A. Gvozdeva, Moskva, 2007. 110 str.]…… Enciklopedija pojmova, definicija i objašnjenja građevinskih materijala
SULPHES, s, u sulfid, muž (Spec.). Kemijski spojevi sumpora s metalima i određenim nemetalima. Organski sa Prirodni s. | adj. sulfid, oh, oh. Rječnik Ozhegova. SI Ozhegov, N.Yu. Shvedova. 1949 ... Rječnik Ozhegova
Sulfidi, R2S (R aromatski radikal), najlakše se dobivaju dodavanjem kap po kap otopine diazo soli na 60 ... Enciklopedija Brockhausa i Efrona
sulfidi - (1) u anorganskoj kemiji, takvi spojevi elemenata sa sumporom, u kojima atomi sumpora imaju oksidacijsko stanje 2. U kemiji. odnose se na soli slabe hidrogen sulfidne kiseline (vodena otopina H2S). Mnogi S. su prirodni ... ... Velika Politehnička Enciklopedija
s; pl. (jedinice sulfid, i; m.). [od lat. sumpor sumpor] Chem. Spojevi sumpora s metalima i nekim nemetalima. C. titan. Organski sa Prirodni s. (klasa minerala). Ide Sulfid, th, oh. S mješovitim smjesama. Od rudne rude. * * * sulfidi spojeva sumpora ... Enciklopedijski rječnik
- (iz latinskog sumpornog sumpora) klasa kemijskih spojeva koji su spojevi metala (kao i brojni ne-metali B, Si, P, As) sa sumporom (S), gdje ima oksidacijsko stanje -2. Može se smatrati solima sumporovodika ... ... Wikipedia
knjige
- Uranovi ležišta neslaganja u fanerozoiku, Andrej Borisovič Khalezov. Na primjeru triju regija Uralske regije s različitim ... \\ tPrikazuje se obilježja uranovih naslaga u strukturama riječne paleo-doline na površinama strukturnog i stratigrafskog neslaganja.
sumpor - Element trećeg razdoblja i VIA grupa Periodnog sustava, serijski broj 16, odnosi se na halogenog. Elektronska formula atoma [10 Ne] 3s 2 3p 4, karakteristična oksidacijska stanja 0, -II, + IV i + VI, stanje S VI smatra se stabilnim.
Ljestvica oksidacije sumpora:
Elektronegativnost sumpora je 2,60, karakterizirana je nemetalnim svojstvima. U spojevima vodika i kisika nalazi se u raznim anionima, tvori kiseline i njihove soli, binarne spojeve.
U prirodi - petnaesti element kemijske prevalencije (sedmi među nemetalima). Nalazi se u slobodnom (izvornom) i srodnom obliku. Vitalni element za više organizme.
Sulphur S. Jednostavna tvar. Kristalno žuta (α-rombična i β-monoklinska,
na 95,5 ° C) ili amorfni (plastični). U mjestima rešetke postoje S8 molekule (ne-planarni ciklusi tipa korona), amorfni sumpor se sastoji od S n lanaca. Low-melting tvar, viskoznost tekućine prolazi kroz maksimum na 200 ° C (razmak molekula S 8, isprepletanje lanaca S n). U paru - molekule S8, S6, S4, S2. Pri 1500 ° C pojavljuje se monoatomski sumpor (u kemijskim jednadžbama za jednostavnost, svaki sumpor je predstavljen kao S).
Sumpor se ne otapa u vodi i pod normalnim uvjetima ne reagira s njim, dobro je topljiv u ugljikovom disulfidu CS 2.
Sumpor, osobito u prahu, ima visoku aktivnost kada se zagrijava. Reagira kao oksidacijsko sredstvo s metalima i nemetalima:
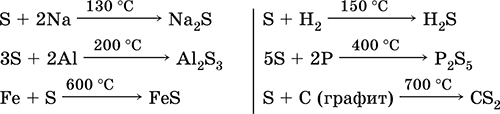
o čemu redukcijsko sredstvo - s fluorom, kisikom i kiselinama (pri ključanju):
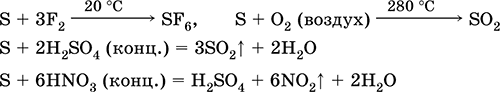
Sumpor se podvrgava dismutaciji u alkalnim otopinama:
3S 0 + 6KOH (konc.) = 2K 2 S-II + K 2 S IV O 3 + 3H 2 O
Na visokim temperaturama (400 ° C) sumpor zamjenjuje jod iz jodida vodika:
S + 2NI (g) = I 2 + H 2 S,
ali u otopini reakcija ide suprotno:
I2 + H2S (p) = 2 HI + S ↓
recepcija: in industrija topi se iz prirodnih naslaga prirodnog sumpora (korištenjem vodene pare), koji se oslobađa tijekom desulfurizacije proizvoda za rasplinjavanje ugljena.
Sumpor se koristi za sintezu disulfidnih, sumpornih kiselina, sumpornih (vat) boja, u vulkanizaciji gume, kao sredstva za zaštitu biljaka od pepelnice, te za liječenje kožnih bolesti.
Vodikov sulfid H 2 S. Kisik bez kisika. Bezbojan plin sa smrdljivim mirisom, teži od zraka. Molekula ima strukturu dvostruko nekompletnog tetraedra [:: S (H) 2]
(sp 3 - hibridizacija, kut utora H - S - H daleko je od tetraedarske). Nestabilan pri zagrijavanju iznad 400 ° C. Slabo je topljiv u vodi (2,6 l / 1 l H2O na 20 ° C), zasićena otopina je decimolarna (0,1 M, „vodik sulfid voda“). Vrlo slaba kiselina u otopini praktički se ne odvaja u drugom stupnju od S 2 - iona (maksimalna koncentracija S 2 -1 je jednaka 1 10 –13 mol / l). Kada stoji na zraku, otopina postaje mutna (inhibitor - saharoza). Neutralizira se alkalijama, a ne potpuno - hidratom amonijaka. Snažno sredstvo za redukciju. On ulazi u reakcije ionske izmjene. Sredstvo za sulfidiranje taloži se iz otopine različitih obojenih sulfida s vrlo niskom topljivošću.
Kvalitativne reakcije - sedimentacija sulfida, kao i nepotpuno izgaranje H 2 S uz stvaranje naslaga žutog sumpora na hladnom predmetu koji se uvodi u plamen (porcelanska lopatica). Nusproizvod rafiniranja nafte, prirodnog i koksnog plina.
Koristi se u proizvodnji sumpora, anorganskih i organskih spojeva koji sadrže sumpor kao analitički reagens. Izuzetno otrovan. Jednadžbe najvažnijih reakcija:
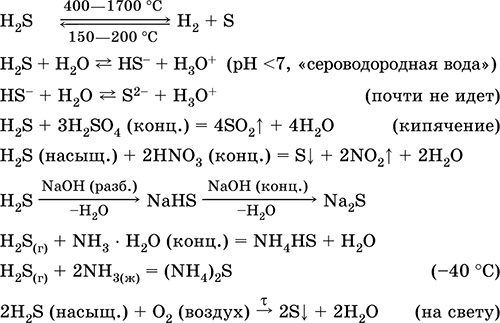

recepcija: in industrija - izravna sinteza:
H2 + S = H2S(150–200 ° C)
ili zagrijavanjem sumpora s parafinom;
u laboratorija - istiskivanje sulfida jakim kiselinama
FeS + 2NCl (konc.) = FeCl2 + H2S
ili potpuna hidroliza binarnih spojeva:
Al2S3 + 6H2O = 2Al (OH) 3 + 3 H2S
Natrijev sulfid Na 2 S. Sol bez kisika. Bijela, vrlo higroskopna. Topi se bez raspadanja, termički stabilno. Dobro je topljiv u vodi, hidroliziran anionom, stvara visoko alkalni medij u otopini. Kada stoji na zraku, otopina postaje mutna (koloidni sumpor) i postaje žuta (polisulfidna boja). Tipično redukcijsko sredstvo. Pridaje sumpor. On ulazi u reakcije ionske izmjene.
Kvalitativne reakcije na ionskom S 2– - taloženju različito obojenih metalnih sulfida, od kojih se MnS, FeS, ZnS razgrađuju u HCl (s).
Koristi se u proizvodnji sumpornih boja i celuloze, za uklanjanje dlake kože tijekom štavljenja kože, kao reagens u analitičkoj kemiji.
Jednadžbe najvažnijih reakcija:
Na2S + 2NCl (dec.) = 2NaCl + H2S
Na2S + 3H2S04 (konc.) = SO2 + S + 2H2O + 2NaHS04 (do 50 ° C)
Na2S + 4HNO3 (konc.) = 2NO + S + 2H2O + 2NaNO3 (60 ° C)
Na2S + H2S (zas.) = 2NaHS
Na2S (t) + 2O2 = Na2S04 (iznad 400 ° C)
Na2S + 4H202 (konc.) = Na2S04 + 4H20
S2- + M2+ = MnS (korporalni) ↓; FeS (crna) ↓; ZnS (bijeli)
S 2 - + 2Ag + = Ag 2 S (crno) ↓
S 2 - + M 2+ = CdS (žuto) ↓; PbS, CuS, HgS (crno)
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (corr. - crno) ↓
3S 2 - + 6H 2 O + 2 M 3+ = 3 H 2 S + 2 M (OH) 3 ↓ (M = Al, Cr)
recepcija u industrija - kalciniranje minerala mirabilit Na2S0410H20 u prisutnosti redukcijskih sredstava:
Na2S04 + 4H2 = Na2S + 4H20 (500 ° C, kat. Fe203)
Na2S04 + 4C (koks) = Na2S + 4CO (800-1000 ° C)
Na2S04 + 4CO = Na2S + 4SO2 (600-700 ° C)
Aluminijev sulfid Al2S3. Sol bez kisika. Bijela, Al-S veza je pretežno kovalentna. Topi se bez raspadanja pod prekomjernim tlakom N2, lako se sublimira. Kada se kalcinira, oksidira se u zraku. Potpuno hidroliziran vodom, ne istaloži se iz otopine. Raspadanjem jakih kiselina. Koristi se kao čvrsti izvor čistog vodikovog sulfida. Jednadžbe najvažnijih reakcija:
Al2S3 + 6H2O = 2Al (OH) 3 + 3H2S (čist)
Al2S3 + 6NCl (dec.) = 2AlCl3 + 3H2S
Al2S3 + 24HNO3 (konc.) = Al2 (SO4) 3 + 24NO2 + 12H2O (100 ° C)
2Al2S3 + 9O2 (zrak) = 2Al2O3 + 6SO2 (700-800 ° C)
recepcija: interakcija aluminija s rastaljenim sumporom u odsutnosti kisika i vlage:
2Al + 3S = AL 2 S 3(150–200 ° C)
Željezo (II) sulfid FeS. Sol bez kisika. Crna i siva sa zelenom nijansom, vatrostalne, raspadaju se kada se zagrijavaju u vakuumu. U mokrom stanju je osjetljivo na kisik u zraku. Netopljiv u vodi. Ne taloži se zasićenjem otopina soli željeza (II) s vodikovim sulfidom. Razgrađena kiselinama. Koristi se kao sirovina u proizvodnji željeza, čvrstog izvora vodikovog sulfida.
Spoj željeznog (III) sastava Fe2S3 nije poznat (nije primljen).
Jednadžbe najvažnijih reakcija:
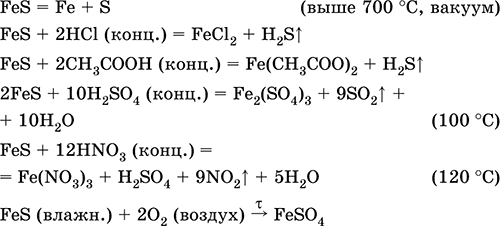
primanje:
Fe + S = FeS (600 ° C)
Fe2O3 + H2 + 2H2S = 9 FeS + 3H20 (700-1000 ° C)
FeCl2 + 2NH4HS (g) = FeS + 2NH4Cl + H2S
Željezni disulfid FeS2. Binarna veza. Ima ionsku strukturu Fe 2+ (–S - S–) 2 -. Tamno žuta, termički stabilna, razgrađuje se pri paljenju. Nerastvorljiv u vodi, ne reagira s razrijeđenim kiselinama, alkalijama. Razgrađuje se sredstvima koja oksidiraju kiseline, peku se u zraku. Koristi se kao sirovina u proizvodnji željeza, sumpora i sumporne kiseline, katalizatora u organskoj sintezi. U prirodi - rudni minerali pirit i marcasite.
Jednadžbe najvažnijih reakcija:
FeS2 = FeS + S (iznad 1170 ° C, vakuum)
2FeS 2 + 14H 2 SO 4 (konc., Planine) = Fe 2 (SO 4) 3 + 15SO 2 + 14N 2 O
FeS2 + 18HNO3 (konc.) = Fe (NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
4FeS 2 + 11O 2 (zrak) = 8SO2 + 2Fe2O3 (800 ° C, prženje)
Amonijev hidrosulfid NH 4 HS. Kisela sol bez kisika. Bijeli, rastopljen pod pritiskom. Izuzetno hlapljiv, termički nestabilan. On oksidira na zraku. Dobro je topljiv u vodi, hidroliziran kationom i anionom (prevladava), stvara alkalno okruženje. Otopina postaje žuta u zraku. Razgrađuje se kiselinama, u zasićenoj otopini dodaje se sumpor. Alkalije se ne neutraliziraju, srednja sol (NH4) 2S ne postoji u otopini (za uvjete dobivanja srednje soli, vidi naslov "H2S"). Koristi se kao sastavni dio fotografa, kao analitički reagens (sulfidni precipitator).
Jednadžbe najvažnijih reakcija:
NH4SH = NH3 + H2S (iznad 20 ° C)
NH4HS + HCl (raspad) = NH4C1 + H2S
NH4HS + 3HNO3 (konc.) = S + 2NO2 + NH4NO3 + 2H2O
2NH 4 HS (zasić. H2S) + 2CuSO4 = (NH4) 2S04 + H2SO4 + 2CuS.
recepcija: zasićenje koncentrirane otopine NH3 sa sumporovodikom:
NH3H20 (konc.) + H2S (g) = NH4SH + H20
U analitičkoj kemiji, otopina koja sadrži jednake količine NH 4 HS i NH 3 H 2 O konvencionalno se smatra otopinom (NH4) 2S, a prosječna formula soli se koristi za pisanje jednadžbi reakcije, iako je amonijev sulfid potpuno hidroliziran u vodi do NH 4 HS i NH. 3H20.
Sumporni dioksid. sulfite
Sumporni dioksid SO2. Kiseli oksid. Bezbojni plin s oštrim mirisom. Molekula ima strukturu nepotpunog trokuta [: S (O) 2] (sp2 - hibridizacija), sadrži σ, π - veze S = O. Lako ukapljen, termički stabilan. Topljiv je u vodi (~ 40 l / l 1 H 2 O na 20 ° C). Formira polihidrat sa svojstvima slabe kiseline, proizvode disocijacije - ione HSO 3 - i SO 3 2 -. Ion HSO 3 - ima dva tautomerna oblika - simetričan (bezkiselinski) sa strukturom tetraedra (sp3 - hibridizacija), koji prevladava u smjesi, i asimetričan (kisela) sa strukturom nekompletnog tetraedrona [: S (0) 2 (OH)] (sp3 - hibridizacija). Ion SO32 je također tetraedarski [: S (O) 3].
Reagira s alkalijama, amonijakom hidratom. Tipično redukcijsko sredstvo, slabo oksidacijsko sredstvo.
Kvalitativna reakcija - obezbojenje žuto-smeđe "jodne vode". Međuprodukt u proizvodnji sulfita i sumporne kiseline.
Koristi se za izbjeljivanje vune, svile i slame, čuvanje i čuvanje voća, kao dezinfekcijsko sredstvo, antioksidans, rashladno sredstvo. Otrovne.
Spoj H2S03 (sumporne kiseline) nije poznat (ne postoji).
Jednadžbe najvažnijih reakcija:
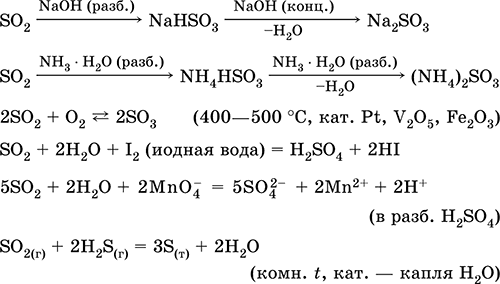
Otapanje u vodi i kiselinska svojstva:
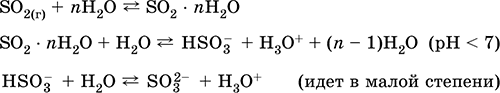
recepcija: u industriji - spaljivanje sumpora u zraku obogaćenom kisikom i, u manjoj mjeri, pečenje sulfidnih ruda (SO 2 - pridruženi plin tijekom pečenja pirita):
S + O2 = SO2(280–360 ° C)
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2(800 ° C, prženje)
u laboratoriju - istiskivanje sulfita sumpornom kiselinom:
BaS03 (t) + H2S04 (konc.) = BaS04 + + S02 + H20
Natrijev sulfit Na2S03. Oksosol. Bijela. Kada se zagrijava u zraku, razgrađuje se bez topljenja, tali se pod tlakom argona. U mokrom stanju i u otopini osjetljivoj na kisik u zraku. Topiv je u vodi, hidroliziran anionom. Razgrađena kiselinama. Tipično redukcijsko sredstvo.
Kvalitativna reakcija na ion SO 3 2 - formiranje bijelog precipitata barijevog sulfita, koji se prenosi u otopinu s jakim kiselinama (HCl, HNO 3).
Koristi se kao reagens u analitičkoj kemiji, komponenta fotografskih rješenja, neutralizator klora u izbjeljivanju tkanina.
Jednadžbe najvažnijih reakcija:
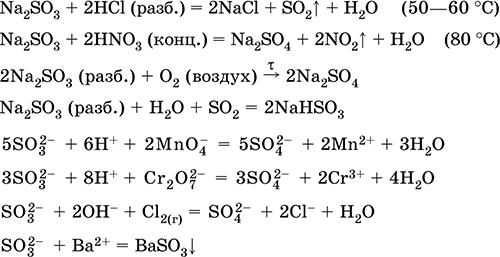
primanje:
Na2C03 (konc.) + S02 = Na2S03 + CO 2
Sumporna kiselina. sulfate
Sumporna kiselina H2S04. Okso kiselina. Bezbojna tekućina, vrlo viskozna (uljna), vrlo higroskopna. Molekula ima izobličenu tetraedarnu strukturu (hibridizacija sp 3 giba), sadrži kovalentne σ - veze S - OH i σπ - veze S = O. Ion SO 4 2- ima ispravno tetraedarnu strukturu. Ima široki temperaturni raspon tekućeg stanja (~ 300 stupnjeva). Pri grijanju iznad 296 ° C djelomično se raspada. Destilira se kao azeotropna smjesa s vodom (maseni udio kiseline je 98,3%, vrelište je 296–340 ° C), potpuno se razgrađuje s jačim zagrijavanjem. Neograničeno miješa s vodom (s jakim exo-effect). Jaka kiselina u otopini, neutralizirana lužinama i amonijakom hidratom. Pretvara metale u sulfate (s viškom koncentrirane kiseline u normalnim uvjetima, stvaraju se topivi hidrosulfati), ali Be, Bi, Co, Fe, Mg i Nb metali pasiviziraju se u koncentriranoj kiselini i ne reagiraju s njom. Reagira s osnovnim oksidima i hidroksidima, razgrađuje soli slabih kiselina. Slaba oksidacija u razrijeđenoj otopini (zbog H I), jaka - u koncentriranoj otopini (zbog S VI). Dobro otapa SO 3 i reagira s njim (stvara se teška uljasta tekućina - oleum, sadrži H2S207).
Kvalitativna reakcija na SO 4 2 - ion - taloženje bijelog barijevog sulfata BaSO 4 (precipitat se ne pretvara u otopinu klorovodične i dušične kiseline, za razliku od bijelog taloga BaSO 3).
Koristi se u proizvodnji sulfata i drugih spojeva sumpora, mineralnih gnojiva, eksploziva, boja i lijekova, u organskoj sintezi, za "otvaranje" (prva faza prerade) industrijski važnih ruda i minerala, u rafiniranju naftnih proizvoda, elektrolizi vode, kao elektrolitu olovnih baterija , Otrovan, uzrokuje opekline kože. Jednadžbe najvažnijih reakcija:
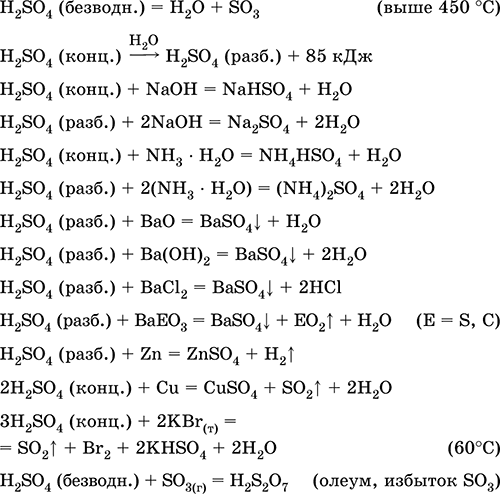
recepcija u industrija:
a) sinteza SO2 iz sumpora, sulfidnih ruda, sumporovodika i sulfatnih ruda:
S + O 2 (zrak) = SO2(280–360 ° C)
4FeS 2 + 11O2 (zrak) = 8 SO2 + 2Fe 2 O 3 (800 ° C, prženje)
2H2S + 302 (g) = 2 SO2 + 2H 2 O (250–300 ° C)
CaSO 4 + S (koks) = CaO + SO2 + CO (1300–1500 ° C)
b) konverziju SO2 u SO3 u kontaktnom uređaju:
c) sinteza koncentrirane i bezvodne sumporne kiseline:
H20 (Zbroj H2S04) + S03 = H2S04(konc., anhid.)
(apsorpcija SO3 čistom vodom uz proizvodnju H2S04 se ne provodi zbog jakog zagrijavanja smjese i obrnute razgradnje H2S04, vidi gore);
d) sinteza oleum mješavinu bezvodnog H2S04, disarične kiseline H2S2O7 i suviška SO3. Otopljeni SO3 osigurava bezvodnost oleuma (H 2 SO 4 se odmah formira kada voda ulazi), što omogućuje da se sigurno transportira u čeličnim spremnicima.
Natrijev sulfat Na2S04. Oksosol. Bijela, higroskopna. Topi se i vri bez raspadanja. Stvara kristalni hidrat (mineral mirabilit) lako gubi vodu; tehničko ime Glauberova sol. Topiv je u vodi, a ne hidroliziran. Reagira s H2S04 (konc.), S03. Obnovljen vodikom, koksom pri zagrijavanju. On ulazi u reakcije ionske izmjene.
Koristi se u proizvodnji staklenih, celuloznih i mineralnih boja, kao lijek. Sadržana u slanoj vodi soli jezera, posebno u zaljevu Kara-Bogaz-Gol Kaspijskog mora.
Jednadžbe najvažnijih reakcija:
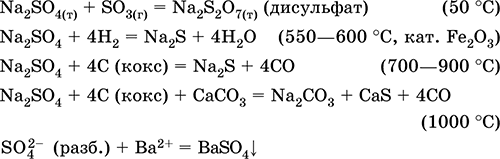
Kalijev hidrosulfat KHS04. Kiselu oksolnu sol. Bijela, higroskopna, ali ne tvori kristalne hidrate. Kada se zagrijava topi se i raspada. Dobro je topljiv u vodi, anion se podvrgava disocijaciji u otopini, otopina je jako kisela. Neutralizira se alkalijama.
Koristi se kao sastavni dio fluksa u metalurgiji, sastavni dio mineralnih gnojiva.
Jednadžbe najvažnijih reakcija:
2KHSO4 = K2S04 + H2S04 (do 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO 4 (razr.) + KOH (konc.) = K2S04 + H2O KHS04 + KCl = K2S04 + HCl (450-700 ° C)
6KHSO4 + M2O3 = 2KM (SO4) 2 + 2K2SO4 + 3H2O (350–500 ° C, M = Al, Cr)
recepcija: obrada kalijevog sulfata u hladnoj (s više od 60%) sumporne kiseline
K2S04 + H2S04 (konc.) = 2 KHSO 4
Kalcijev sulfat CaSO4. Oksosol. Bijela, vrlo higroskopna, vatrostalna, raspada se pri kalciniranju. Prirodni CaSO 4 nalazi se u obliku vrlo čestog minerala gips CaSO4H2O. Na 130 ° C gips gubi dio vode i ulazi u spaljena žbuka2CaSO4H20 (tehnički naziv Alabaster). Potpuno dehidrirani (200 ° C) gips odgovara na mineral anhidritCaS04. Lako je topljiv u vodi (0,206 g / 100 g H 2 O na 20 ° C), a topljivost se smanjuje pri zagrijavanju. Reakcija s H2S04 (konc.). Dobiva se koksom tijekom fuzije. Određuje većinu "konstantne" tvrdoće slatke vode (za više detalja, vidi 9.2).
Jednadžbe najvažnijih reakcija: 100–128 ° C
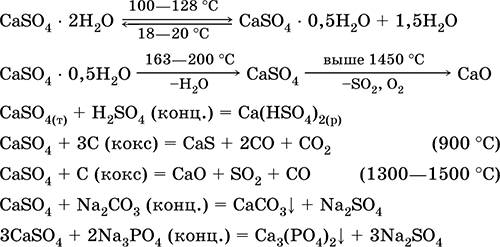
Koristi se kao sirovina u proizvodnji SO2, H2S04 i (NH4) 2S04, kao fluksa u metalurgiji, punila za papir. Vezujući mort pripremljen od spaljenog gipsa "postavlja" se brže nego smjesa na bazi Ca (OH) 2. Stvrdnjavanje se vrši vezanjem vode, formiranjem gipsa u obliku kamene mase. Spaljeni gips se koristi za izradu gipsanih odljeva, arhitektonskih i dekorativnih oblika i proizvoda, pregradnih zidova i panela te kamenih podova.
Aluminij kalij sulfat KAl (S04) 2. Dvostruka oksolna sol. Bijela, higroskopna. S jakom toplinom raspada se. Oblikuje kristalni hidrat - aluminijev kalijev aluminij. Umjereno topljiv u vodi, hidroliziran aluminijevim kationom. Reagira s alkalijama, amonijakom hidratom.
Koristi se kao sredstvo za bojanje tkanina, štavljenje kože, koagulant u pročišćavanju svježe vode, sastavni dio kompozicija za dimenzioniranje papira i vanjski hemostatični agens u medicini i kozmetologiji. Nastaje ko-kristalizacijom aluminija i kalij sulfata.
Jednadžbe najvažnijih reakcija:
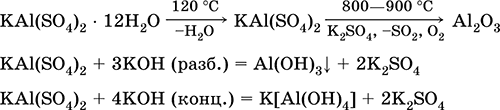
Krom (III) sulfat - kalij KCr (SO4) 2. Dvostruka oksolna sol. Crveno (tamno ljubičasti hidrat, tehničko ime kalijev aluminij). Kada se zagrijava razgrađuje bez topljenja. Lako se otapa u vodi (sivo-plava boja otopine odgovara aquacomplexu 3+), hidrolizira se kationom kroma (III). Reagira s alkalijama, amonijakom hidratom. Slabo sredstvo za oksidaciju i redukciju. On ulazi u reakcije ionske izmjene.
Kvalitativne reakcije na ion Cr 3+ - redukcija do Cr2 + ili oksidacija do žutog CrO 4 2-.
Koristi se kao sredstvo za tamnjenje kože, kao sredstvo za bojanje tkanina, reagens na fotografiji. Stvoren istodobnom kristalizacijom krom (III) sulfata i kalija. Jednadžbe najvažnijih reakcija:
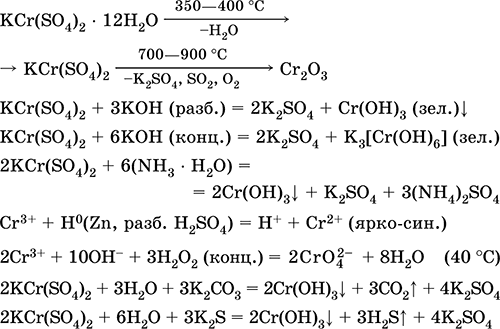
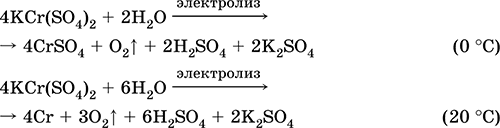
Manganov (II) sulfat MnS04. Oksosol. Bijela, kad se kalcinira, topi se i raspada. Kristalni hidrat MnSO 4 5H 2 O - crveno-ružičasti, tehnički naziv vitamina mangana. Topiva je u vodi, svijetlo ružičasta (gotovo bezbojna) boja otopine odgovara vodenom kompleksu 2+; hidroliziran kationom. Reagira s alkalijama, amonijakom hidratom. Slab redukcijski agens reagira s tipičnim (jakim) oksidirajućim sredstvima.
Kvalitativne reakcije ionu Mn 2+ - vodljivost s ionom MnO 4 i nestankom ljubičaste boje potonje, oksidacijom Mn 2+ u MnO 4 i pojavom ljubičaste boje.
Koristi se za dobivanje Mn, MnO 2 i drugih spojeva mangana kao mikronutrijenata i analitičkog reagensa.
Jednadžbe najvažnijih reakcija:
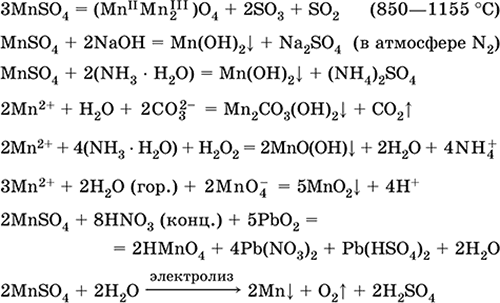
primanje:
2Mn02 + 2H2S04 (konc.) = 2 MnS04 + O2 + 2H2O (100 ° C)
Željezo (II) sulfat FeSO4. Oksosol. Bijela (hidrat svijetlo zelena, tehnički naziv željezni vitriol),higroskopan. Raspada se pri zagrijavanju. Topiv je u vodi, u maloj mjeri hidroliziran kationom. Brzo se oksidira u otopini kisikom u zraku (otopina postaje žuta i postaje mutna). Reagira s kiselinskim oksidacijskim sredstvima, lužinama, amonijakom i hidratom. Tipično redukcijsko sredstvo.
Koristi se kao sastavni dio mineralnih boja, elektrolita u galvanizaciji, konzervansa drva, fungicida, lijeka protiv anemije. U laboratoriju se češće uzima kao dvostruka sol Fe (NH 4) 2 (SO 4) 2 6N 2 O ( salt mora) otporniji na zrak.
Jednadžbe najvažnijih reakcija:
![]()
primanje:
Fe + H2SO4 (dec.) = FeSO 4+ H2
FeC03 + H2S04 (par.) = FeSO 4 + COz + H20
7.4. VA-ne-metalne skupine
Dušik. amonijak
dušik - element 2. razdoblja i VA skupina Periodnog sustava, serijski broj 7. Formula atomskog elektrona [2 He] 2s 2 2p 3, karakteristična oksidacijska stanja 0, –III, + III i + V, rjeđe + II, + IV i itd.; N v stanje se smatra relativno stabilnim.
Skala oksidacije dušika:
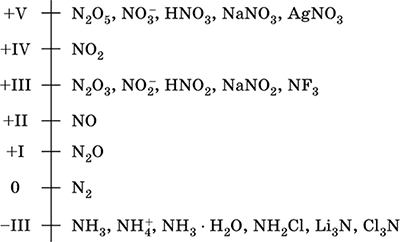
Dušik ima visoku elektronegativnost (3,07), treći nakon F i O. Pokazuje tipična nemetalna (kisela) svojstva. Stvara različite kiseline, soli i binarne spojeve koji sadržavaju kisik, kao i amonijev kation NH4 + i njegove soli.
U prirodi - sedamnaesti element kemijske prevalencije (deveti među ne-metalima). Bitan element za sve organizme.
Dušik N2. Jednostavna tvar. Sastoji se od nepolarnih molekula s vrlo stabilnom σππ - vezom N, N, što objašnjava kemijsku inertnost dušika u normalnim uvjetima. Bezbojni plin bez mirisa koji se kondenzira u bezbojnu tekućinu (za razliku od O2).
Glavna komponenta zraka: 78,09% po volumenu, 75,52% po masi. Iz tekućeg zraka dušik kipi iznad kisika O2. Slabo je topljiv u vodi (15,4 ml / 1 l H2O na 20 ° C), topljivost dušika je manja od topljivosti kisika.
Na sobnoj temperaturi, N 2 reagira samo s litijem (u vlažnoj atmosferi), tvoreći litijev nitrid Li 3 N, nitridi drugih elemenata sintetizirani su s jakim zagrijavanjem:
N2 + 3Mg = Mg3N2 (800 ° C)
U električnom pražnjenju, N2 reagira s fluorom iu vrlo maloj mjeri s kisikom:
Reverzibilna reakcija za proizvodnju amonijaka odvija se pri 500 ° C, pod tlakom do 350 atm i nužno u prisutnosti katalizatora (Fe / F 2 O 3 / FeO, u Pt laboratoriju):
U skladu s načelom Le Chateliera, povećanje prinosa amonijaka trebalo bi se dogoditi s povećanjem tlaka i sniženjem temperature. Međutim, brzina reakcije na niskim temperaturama je vrlo niska, tako da se proces provodi na 450-500 ° C, postižući 15% -tni prinos amonijaka. Nereagirani N2 i H2 se vraćaju u reaktor i time povećavaju stupanj reakcije.
Dušik je kemijski pasivan u odnosu na kiseline i lužine, ne podržava izgaranje.
recepcija u industrija - frakcijska destilacija tekućeg zraka ili uklanjanje kisika iz zraka kemijskim sredstvima, na primjer, reakcijom 2C (koks) + O 2 = 2CO zagrijavanjem. U tim se slučajevima proizvodi dušik, koji također sadrži nečistoće plemenitih plinova (uglavnom argona).
laboratorija male količine kemijski čistog dušika mogu se dobiti reakcijom kombinacije s umjerenim zagrijavanjem:
N-III H 4 N III O 2 (t) = N 2 0 + 2 H 2 O (60–70 ° C)
NH4C1 (p) + KNO2 (p) = N2O + KCl + 2H20 (100 ° C)
Koristi se za sintezu amonijaka, dušične kiseline i drugih proizvoda koji sadrže dušik, kao inertno okruženje za kemijske i metalurške procese i skladištenje zapaljivih tvari.
Amonijak NH3. Binarni spoj, stupanj oksidacije dušika je - III. Bezbojni plin s oštrim karakterističnim mirisom. Molekula ima strukturu nekompletnog tetraedrona [: N (H) 3)] (sp3 gib-hibridizacija). Prisutnost dušika u molekuli NH 3 para donora elektrona u sp3 - hibridnoj orbitalnoj liniji uzrokuje karakterističnu reakciju dodavanja kationa vodika, uz formiranje kationa amonijum NH4 +. Ukapljuje se pod tlakom na sobnoj temperaturi. U tekućem stanju je povezano zbog vodikovih veza. Termički nestabilan. Topljiv je u vodi (više od 700 l / 1 l H20 pri 20 ° C); udio u zasićenoj otopini je = 34 mas.% i = 99 vol.%, pH = 11,8.
Visoko reaktivan, sklon reakcijama dodavanja. Nastaje u kisiku, reagira s kiselinama. Ima svojstva reduciranja (zbog N-III) i oksidirajućih (zbog HI) svojstava. Isušuje se samo s kalcijevim oksidom.
Kvalitativne reakcije - formiranje bijelog "dima" u dodiru s plinovitim HCl, pocrnjenje papira navlaženog otopinom Hg 2 (NO 3) 2.
Međuprodukt u sintezi HNO3 i amonijevih soli. Koristi se u proizvodnji sode, dušičnih gnojiva, bojila, eksploziva; tekući amonijak je rashladno sredstvo. Otrovne.
Jednadžbe najvažnijih reakcija:
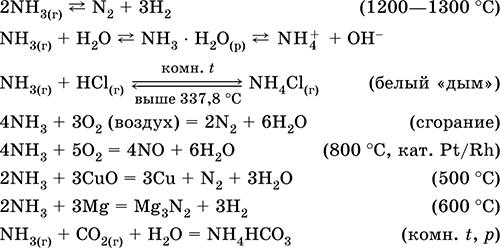
recepcija: in laboratorija - premještanje amonijaka iz amonijevih soli kada se zagrijava s natrijevim krečom (NaOH + CaO):
ili vrenje vodene otopine amonijaka, nakon čega slijedi sušenje plina.
industrija amonijak se sintetizira iz dušika (vidi) s vodikom. Proizvedeno u industriji u tekućem obliku ili u obliku koncentrirane vodene otopine pod tehničkim nazivom amonijačna voda.
Amonijak hidrat NH3H20. Intermolekularni spoj. Bijela, u kristalnoj rešetki su NH 3 i H 2 O molekule, vezane uz slabu vodikovu vezu H3N ... HON. Prisutna je u vodenoj otopini amonijaka, slaba baza (proizvodi disocijacije - kation NH4 - i anion OH -). Amonijev kation ima redovito π-tetraedarnu strukturu (sp3 - hibridizacija). Termički nestabilna, potpuno razgrađena kuhanjem otopine. Neutralizirano jakim kiselinama. Pokazuje redukcijska svojstva (zbog N III) u koncentriranoj otopini. On ulazi u reakciju ionske izmjene i kompleksacije.
Kvalitativna reakcija - stvaranje bijelog "dima" u dodiru s plinovitim HCl.
Koristi se za stvaranje slabog alkalnog medija u otopini, za vrijeme taloženja amfoternih hidroksida.
1M otopina amonijaka sadrži uglavnom NH3H20 hidrat i samo 0,4% NH4 + i OH - iona (zbog disocijacije hidrata); prema tome, ionski "amonijev hidroksid NH4OH" praktički nije sadržan u otopini, nema takvog spoja u krutom hidratu. Jednadžbe najvažnijih reakcija:
NH3H20 (konc.) = NH3 + H20 (ključanje s NaOH)
NH3H20 + HCl (raspad) = NH4C1 + H20
3 (NH3H20) (konc.) + CrCl3 = Cr (OH) 3 + 3NH 4 Cl
8 (NH3H20) (konc.) + ZBr 2 (p) = N2 + 6NH 4 Br + 8H2O (40–50 ° C)
2 (NH3H20) (konc.) + 2KMnO 4 = N2 + 2MnO2 + 4H2O + 2KON
4 (NH3H20) (konc.) + Ag2O = 2OH + 3H20
4 (NH3H20) (konc.) + Cu (OH) 2 + (OH) 2 + 4H20
6 (NH3H20) (konc.) + NiCl2 = Cl2 + 6H20
Često se naziva razrijeđena otopina amonijaka (3-10% vremena) tekući amonijak (ime su izmislili alkemičari) i koncentriranu otopinu (18,5–25%) amonijačna voda (proizvodi industrija).
