Na amorfnom siliciju. Silicij dioksid.
SILIKON DIOKSID (silicij) Si02, bestsv. kristalnu, amorfnu ili staklastu tvar.
Struktura. SILICA DIOKSID d. Postoji u nekoliko polimorfnih modifikacija (vidi tablicu). Prelazne temperature pri normalnom tlaku: a-kvarc D b -kartz 575 ° C (DH 0 prijelaz 0,41 kJ / mol), p-kvarc D p-kristobalit 927 ° C (2,26 kJ / mol), p-kvarc D g -tridimit 867 ° S (0,50 kJ / mol), a-tridmmit D b -tridimit 115 ° S (0,27 kJ / mol), b -tridimit D g -tridimit 160 ° S (0,15 kJ) / mol), g -ditimit D b-kristobalit 1470 ° C (0,21 kJ / mol), a-kristobalit D b-kristobalit 270 ° S. Točka p-kvarca je 1610 ° S (DH 0 mp 8,53 kJ / mol), g -tridimit 1680 ° S, b -kristobalit 1723 ° S (DH 0 pl 9,6 kJ / mol). Polimorfni transformirani kvarc, tridimit i kristobalit popraćeni su promjenom volumena. Kristalni oblici SILICON DIOXIDE konstruirani su od tetraedra SiO 4, a a- i b-oblici se odlikuju blagim pomicanjem i rotacijom tetraedara. Za niskotemperaturne tridimite, podaci su također dani za druge kristalne kristale. modifikacije, međutim, sve one sadrže b-tremitit kao glavnu strukturnu jedinicu, ali su različito iskrivljene. Na primjer, opisani su triklinski i monoklinski tridimiti. U prirodi se također nalazi kubni. Si02 modifikacija - melanflogit (a = 1.3402 nm, z = 48, prostorna skupina Pt3p). Pri visokim tlakovima nastaju kitovi (80-130 MPa, 400-500 ° C), kojezit (1,5-4 GPa, 300-1700 ° C), stishovite (16-18 GPa, 1200-1400 ° C). Stishovit je jedina modifikacija SILIKON DIOKSIDA, izgrađena od SiO 6 oktaedri. Stabilnost tridimita vjerojatno je određena nečistoćama Na i Al. Nestabilan oblik silicija DIOXIDd. - rombo-dipiramidni "vlaknasti silicij". Osim kristalnih kristala, SILICON DIOXIDE može imati i druge oblike postojanja. Skriveni kristal oblici (kalcedon) slični su strukturi kvarca. Pri ekstrakciji kationa iz određenih silikata s kiselinom dobiva se hidrat. kristal, silicij. Oni nasljeđuju teksturu izvornih minerala, formirajući vlaknaste, ljuskaste (lepidoidne) i listaste strukture. Poznate su amorfne anizotropne i izotropne (opalne) formacije, fini prirodni silicijev dioksid (tripoli, sintetski koloidni silicijev dioksid i silicijev prah). Hydrated. amorfni silicij-dioksid, taložen iz otopina Na-silikata, itd., polimeriziranih do sfernih spojeva. čestice promjera manjeg od 100 nm, obično 2-3 nm. Dobiven je amorfni silicij u obliku letaka, traka i vlakana (vidi Silikagel). Pri visokim temperaturama fini prašci pirogenog bezvodnog silicijevog dioksida - Aerosil i drugi - oslobađaju se iz plinske faze. O staklastom siliciju, vidi Kvarcno staklo.
Svojstva. Tlak pare SILICON DIOXIDE, 13.3-133 Pa, blizu točke taljenja. SILICA DIOXIDED. - dielektrik, r 10 12 Ohm * m (20 ° S), 9 * 10 - 1 Ohm * m (1600 ° C). Monokristali A-kvarca imaju kiralnu strukturu koja određuje njihovu optičku aktivnost i piezoelektričnost. svojstva. Kvarc je proziran za UV i djelomično IR zrake.
Kliničku sliku akutne silikoze karakterizira kratkoća daha, koja se brzo pogoršava, kaheksija, kronični znakovi plućnog srca i histološka alveolarna proteinoza. Kod akutne silikoze nije potrebna plućna fibroza. X-ray pronaći punjenje zračnog prostora u različitim stupnjevima, što čini sliku "kondenzacije" ili "matirano staklo", koji je pogodan za diferencijalnu dijagnozu idiopatske alveolarne proteinoze, radiološke, hemoragijske alveolitis, upale pluća, akutni plućni edem.
* Indeksi loma: N g - više, N p - manje. ** A - iB - kvarc imaju dva mjesta. kao i za oba oblika, mogući su lijevi i desni optički izomeri. *** b -120 ° C.
Topivost α-kvarca u vodi je 10–3% po masi (25 ° C), amorfni oblici silicijevog dioksida su 0,007-0,015% (za vodene otopine Si02, vidi Silikatne kiseline). Topivost SILICON DIOXIDE u kiselom i alkalnom mediju određena je prirodom otapala. SILICA DIOKSID d. Netopljiv u većini organskih otapala. Reagira s fluorovodičnom kiselinom kako bi nastao fluorosilikatna kiselina. Na 250-400 ° C, interakcija s plinovitim HF, F2 (davanje SiF4), pri 200-250 ° C - s NH4HF2. U smjesi s ugljenom reagira s Cl2 kada se zagrijava, formirajući SiCl4. Amorfni silicijev dioksid se polako topi u vodenim otopinama alkalija, Na2C03 (daje silikate) i NH4F (tvore fluorosilikati), brzina otapanja se povećava s povećanjem tlaka i temperature. Kada se mješavine praškastog silicij-dioksida zagrijavaju s različitim oksidima, nastaju silikati, a kada su spojeni s Na2C03 i Na2S04 to je vodotopivi natrijev silikat (vidi također topljivo staklo).
Distribucija u prirodi. Sadržaj bez SILIKON DIOKSIDA u zemljinoj kori 12%; ona je također uključena u stijene u obliku različitih silikata ili u obliku mješavina s drugim mineralima (granitima). Kvarc je jedan od najčešćih minerala: tridimit, kristobalit, lschatelit (prirodno kvarcno staklo), kalcedon, opali su mnogo rjeđi. Mali, različito orijentirani kvarcni kristali tvore "kvarcni" kvarc. Uništavanjem stijena nastaju kvarcni pijesci, čije zbijanje dovodi do stvaranja pješčenjaka i kvarcita. Haib. čisti kvarc je kameni kristal, čiji kristali mogu doseći nekoliko metara i težiti desetinama tona. Pojedinačni kristali kvarca su prozirni, bezbojni (kameni kristali) ili obojeni s nečistoćama u ljubičastoj (ametist), crnoj (marion), žutoj (citrinskoj) boji dima (rauch-topaz). Vrste kriptokristala. kvarcni oblici: ružičasto-crveni karneti, plavkasti safirin, jabučno-zelena krizopraza, trakasti agati i oniksi, fino obojeni jaspis, silicij i hornfelsi. Wiikalen amorfni "plemeniti" opal, koji se sastoji od homogenih koloidnih čestica promjera 0,1-0,3 μm, čvrsto upakiranih u uređene aglomerate; sadržaj vode manji je od 1% po masi (za većinu uobičajenih opala 4–9%). Na str. naslage silicijevog dioksida također tvore tripoli, diatomit, itd. Ljuske dijatomeja i kosturi nekih spužvi izgrađene su od silicijevog dioksida; jača stabljike biljaka - konjski repovi, bambus, trska, nalazi se u slami. SILIKON DIOKSID je odgovoran za silikaciju oblika živih biljnih organizama. Koncentracija silicijevog dioksida u ljudskoj krvi i plazmi iznosi 0,001% po masi.
Uzimajući. Sintetička. SILIKON DIOKSID d. Primiti: djelovanje kiselina (H2S04, HCl, CO 2) na Na silikat, rjeđe na druge topljive silikate (glavni način proizvodnje u kapitalističkim zemljama); iz koloidnog silika koagulacijom pod djelovanjem iona Na +, NH4, F - ili zamrzavanjem; hidroliza SiCl4, SiF4, (NH4) 2SiF6, (C2H5O) 4Si u vodenim otopinama amonijak-voda (ponekad s dodatkom etanola ili organskih baza) i u plinskoj fazi. Amorfni silicij-dioksid D. Također se dobiva iz tripolija i dijatomejske zemlje spaljivanjem riževe ljuske i mljevenjem rastaljenog kvarcnog pijeska. Bezvodni prah silicijevog dioksida s visokom specifičnom površinom dobiven je kemijskim isparavanjem pomoću spaljivanja para SiCl 4 u smjesi H 2 i O 2 (aerosil, u SAD-u - Cabosil), oksidirajućim i hidroliznim parama estera Si (dimljeni silicijev dioksid), i također SiF4 (fluosil). Početno kondenzirane čestice SILICON DIOXIDE, promjera 1 nm, gusto su pakirane u sekundarne konglomerate, spojene u rastresitu strukturu specifične površine od 200-400 m2 / g. Samokristali A-kvarca uzgajaju se iz alkalnih otopina SILICON DIOXIDE u visokotlačnim autoklavama (35-120 MPa) pri 300-420 ° C (vidi Hidrotermalni procesi). U proizvodnji materijala korištenih u tehnici na bazi SILICON DIOXIDE, koriste se sljedeći postupci:
- kemijsko taloženje iz plinske faze tijekom visokotemperaturnog izgaranja SiCl4, prethodno pročišćenog destilacijom. Čestice SILIKON DIOKSIDA, formirane u plamenu ili plamenu kisika-vodika, talože se tako da se dobije masivno kvarcno staklo ili slojevi predoblika optičkih vlakana;
- površinska oksidacija jednog kristala. Si s formiranjem heterostruktura (u proizvodnji integriranih krugova);
- sinteriranje finog silicij-dioksida u kvarcnu keramiku (vidi također Keramika);
- sol-gel postupak, uključujući hidrolizu organskog spoja Si, sporo dehidriranje nastalog gela i umjereno zagrijavanje. Koristi se za proizvodnju kvarca i stakla visokog silika;
- dobivanje SILICON DIOXIDE i poroznih čaša visoke čistoće (tip Vicore) termodinamičkom obradom vodećeg borosilikatnog stakla, ispiranjem s kiselinom i pranjem silikatnog okvira.
Na str. Silicij se koristi u proizvodnji silikatnih stakala, porculana i keramike, abraziva, betona, silikatnih opeka, dinasa i keramike. Sintetička. SILIKON DIOKSID d. ("Bijela čađa") - punilo u proizvodnji gume (do 70% proizvedenog SILICON DIOXIDE d.). Pobijedili smo. koristiti istaloženi hidrat. silicijev dioksid (koji sadrži 85-95% SiO2) sa specifičnom površinom od 60-300 m2 / g, u manjoj mjeri - bezvodni silicijev dioksid aerosila. Aerosil je također i adsorbent u kromatografiji, ugušćivač maziva, ljepila, boje, kvarcni monokristali koji se koriste u radio-inženjerstvu (piezoelektrični, frekvencijski stabilizatori, filtri, rezonatori itd.) U akustooptici i akustoelektroniki (vidi Akustički materijali), u optičkim instrumentima (prizme za spektrografi, monokromatori, leće za UV optiku itd.) u nakitu (prozirne, lijepo obojene sorte - poludrago kamenje). Kao prom. Koristi se silikagel s efektivnim promjerom pora od 2-15 nm. sorbensi i nosači katalizatora. Sintetička. SILIKON DIOKSID i kameni kristali su sirovina za proizvodnju monokristala kvarca, kvarcnog stakla, keramike i kvarcnih vlakana. Kvarcno staklo i keramika - konstrukts. materijala u aviatima. industrija (na primjer, za prozore i poklopce prozora zrakoplova), u optici (za ulazne prozore, optičke uređaje UV i IK raspona), u elektroniku (linije kašnjenja), itd. Kvarcna tkanina je toplinski izolacijski materijal. Kvarcna vlakna koriste se za izradu optičkih (svjetlovodnih) komunikacijskih linija i sustava za prijenos informacija. Sintetička proizvodnja SILIKON DIOKSID d. U kapitalističkom. zemlje 600-700 tisuća tona godišnje (1980.). Kada SILIKON DIOKSID uđe u živo tkivo, granulomi se polako razvijaju. Silicijska prašina izaziva iritaciju. dyhat. načina i bronhija, bolest gastrointestinalnog trakta, s dugotrajnim udisanjem - ozbiljna bolest - silikoza pluća. MPC na sadržaju SiO 2 u prašini sv. 70% - 1 mg / m3, 10-70% - 2 mg / m3, 2-10% - 4 mg / m3.
Plućna funkcija: restriktivna disfunkcija, promijenjen alveolokapilyarnogo prijenos. Izrađuje se diferencijalna dijagnoza akutne silikoze: alveolarna proteinoza, idiopatski hemoragijski alveolitis, upala pluća, plućni edem. Veza između silikoze i tuberkuloze zahtijeva aktivan tuberkulozni proces.
Kronična opstruktivna bronhopneumopatija. Najčešća veza između silikoze i reumatoidnog artritisa je povezanost koja definira Kaplanov sindrom. Erasmus sindrom je udruženje silikoze-skleroderme. Jednostavna neoplazma. Komplikacije silikoze komplikacije respiratornih infekcija, kronični bronhitis, emfizem, pneumotoraks, respiratorna insuficijencija, kronična plućna srčana bolest.
Fizikalna i kemijska svojstva aerosila (silicij dioksid)
aeroforces (od latinske riječi Aerosilum), oksili (od latinske riječi - Oxylum) silicij dioksid, Silica colloidalis anhydrica (Ph. Eur.), Koloidni silicijev dioksid (USP), bezvodni koloidni silicijev dioksid (BP), silicij (CAS br. 7631-86-9) - bezvodni amorfni silicij, spada u skupinu sintetičkih aktivnih visoko dispergiranih mineralnih punila. U farmaciji se kao pomoćna tvar koristi Aerosil (silicij dioksid), stabilizator, gelirajuće sredstvo, adsorbent, poboljšava fluidnost tableta, masti, gela i drugih smjesa. Ponekad se silicij dioksid koristi kao aktivni farmakološki sastojak (ima antibakterijska svojstva, detoksifikator, sorbent).
Radiografski snimci su standard za odbore plućnog vezanja Pneumokonioza je organizirana u klinikama za profesionalne bolesti. Simptomatsko liječenje: kliničke manifestacije nisu prisutne u ranim stadijima, pa se simptomatsko liječenje koristi na kraju početka, složeno i uključuje liječenje antibioticima, bronhodilatatorima, GCS-om, fluidizacijom i iskašljavanjem, iskašljavanjem, tuberkulozom, diureticima, inotropnim sredstvima i digitalisima, blokatorima vazodilatatori kalcijevih kanala.
Prevencija infektivnih komplikacija: kirurško liječenje akutnih respiratornih infekcija; Kemoprofilaksa TB korisna je za prevenciju tuberkuloze i prevenciju recidiva kod bolesnika sa silikozom tuberkuloze, influence i pneumokokne imunizacije polisaharidima.
dobiti silicij dioksid hidrolizom para silicijevog tetraklorida u plamenu vodika pri temperaturi\u003e 1000 ° C (1100-1400 ° C). Dobiveni produkt je bijeli, amorfan, neporozan, praškast, indiferentan, raspršen, sadrži 99,3% Si02; ima visoku disperziju (promjer čestica 4-40 mikrona, ima sferični ili skoro sferični oblik), specifična adsorpcijska površina je 50-450 m2 / g; volumenski volumen je oko 50 g / l, gustoća - 2,36 g / cm3; pH vodene suspenzije je 4,0; indeks loma n20D = 1,46. Aerosil se ne otapa u vodi, kiselinama i razrijeđenim lužinama. Pri koncentraciji aerosila u vodi u količini od 10-12%, formira se suspenzija niskog viskoznog fluida, na 17% - polukruta masa, na 20% - krupna masa, koja se, kada se protrlja, pretvara u homogenu masu sličnu masti. Zbog visokog afiniteta za vodu, aerosil se naziva hidrofilnim tvarima. Ali silicij dioksid (aerosil) marke R972 ima hidrofobna svojstva.
Druge korisne mjere su izliječene, pušenje se ne preporučuje, smanjuje unos soli, visokoproteinska dijeta. Hunter Veche, Bukurešt. Nalazi se u čvrstom stanju i jedan je od najobilnijih minerala na Zemlji, koji je glavna komponenta pijeska. Silikat može postojati u kristalnom ili amorfnom obliku. Oblici silicijevog dioksida obično se šire poput vulkanske lave. Kristalni oblici silicija s skupljanjem s amorfnim oblicima imaju znatno manju otpornost na nečistoće.
Ima ih nekoliko zaštitni znakovi Aerosil (silicij dioksid)koji se razlikuju uglavnom po specifičnoj površini, stupnju hidrofilnosti ili hidrofobnosti, kao i prisutnosti drugih punila. Prema definiciji komisije za nomenklaturu, amorfni silicijev dioksid naziva se oksid. U Ukrajini, kemijska i metalurška tvornica koju je izdao Degussa proizvodi nemodificirani standardni aerosil od 175 vrsta; 300 380 s hidrofilnom površinom; Metil-arosil AM-1/175 i AM-1/300, modificirani dimetildiklorosilan; eterni organosilikus marki ADEG-175 i ADEG-300, modificirane etilen glikolom i dietilen glikolom, i AM-2, modificirane amino alkoholima. U SAD-u se proizvodi modificirani aerosil - organosil i kebosil (Cabot), u Rusiji, butosil, aerosil-K, koji je kombinacija 85% silicija i 15% škroba, COK-84 aerosil, koji je koagulant od 85% silicija i 14% amonijevog oksida. U Njemačkoj, tvrtka "Degussa" proizvodi hidratizirane marke aerosilakoji sadrže vezanu vodu (durosil, vulkasin, sifloks, ultrasil, itd.) koji se razlikuju u sadržaju SiO2, promjeru čestica, gustoći i svojstvima), aerosil u obliku suspenzija (K-314, sadrži 14% A., K-328, sadrži 28% A.). U Japanu se mikrosil proizvodi i nosi, u Francuskoj - Francil, u Engleskoj - Manosil. Za kozmetiku može biti u obliku paste. Nedavno je aerosil uveden u farmakopeju različitih zemalja (Mađarska, Danska, Austrija, itd.). U SAD-u je silicij-dioksid (aerosil) također dopušten kao dodatak prehrambenim proizvodima u iznosu od 2%.
Organski i mineralni silicijev dioksid pojavljuje se u ljudskom tijelu u njegovom prirodnom obliku i sadrži različite količine sirovog povrća, biljaka i žitarica. Ima visoku tvrdoću. Često: amorfni oblik silicijevog dioksida se otopi u lužinama. Aventurin - Rosiatik. Zbog nečistoća: citrin je žut. Kristalni oblik je vrlo važna komponenta vrlo velike količine minerala i dragog kamenja. 9 - Budući da ima nizak koeficijent toplinskog širenja. Čista je i bijela u obliku praha.
Vrlo je otporan na temperaturne promjene i može se koristiti u dijelovima koji su izloženi toplom i hladnom. U laboratorijima od kvarcnog stakla gotovo je neophodna. Predmeti umjetnosti. A za sve probleme s kožom ovo je pravo rješenje. Proizvodnja deterdženata. Ili filtrirajte ultraljubičasto zračenje. Važnost: Andy Sintetički silicijev dioksid se koristi u proizvodnji boja. Silica djeluje na sve upalne procese. Kao električni izolator.
aeroforces pripisuje teoriji "čistih" tvari koje oslobađaju aktivne sastojke bez troškova energije. Elektronsko mikroskopska istraživanja pokazala su da se svaka osnovna čestica aerosila sastoji od četiri zasebna sloja (slika). Jezgra ove čestice je trodimenzionalni polimer elemenata Si02. Imajući Silane Si-OH i siloksan Si-O-Si grupe na površini čestica, Aerosil je sposoban stvoriti okvir sličan uzorku zbog vodikovih veza, što omogućuje ograničavanje toplinskog širenja gelirane tekućine. Skupine siloksana i silana u aerosilu su funkcionalne, a veza silicij-kisik je karakterizirana visokom čvrstoćom (doseže 372,5 J / mol), što se objašnjava njegovim polaritetom, zbog čega se kovalentna veza približava ionskoj vezi.
Također se koristi u kozmetičkoj industriji. jezero. U metalurgiji. Dobivanje silikonskog silicijevog dioksida s raznim redukcijskim sredstvima. Tako se dobiva nečisti silicij. Reakcija je vrlo egzotermna. Koristi električnu peć s grafitnim elektrodama. Nastali silicij je na taj način rafiniran ili silanski triklor. Sirovi silicij ili ferosilicij se pretvaraju. Nastali silicij se otopi u suvišku rastaljenog aluminija kontaminiranog magnezijevim silicijem. Kroz ovaj proces, nečistoće se skupljaju na jednom kraju silikonske kore koja se tretira.
Tablica - Glavna svojstva silicijevog dioksida (Aerosil)
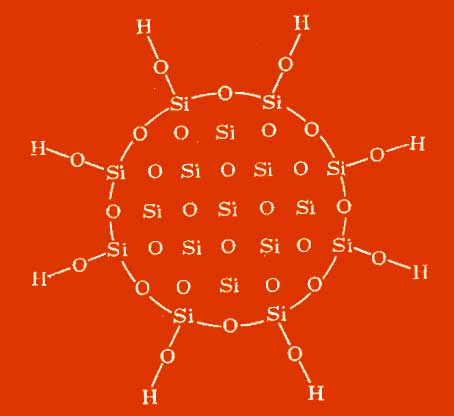
Slika. Struktura prostorne mreže Aerosila u hidrogelu
Silanolne skupine su neravnomjerno raspoređene. Postoje površinske silanske skupine, koje mogu biti slobodne ili povezane vodikovim mostovima, i silanolne skupine unutar molekule, koje također mogu biti međusobno povezane vodikovim mostovima. Kao rezultat, stvara se razgranata struktura mase, što rezultira da se aerosil naziva anorganskim polimerima. Siloksanske skupine imaju hidrofobna svojstva, stabilne su (OH silanolne skupine razdvojene na temperaturi\u003e 300 ° C), uzrokuju kiselu reakciju; imaju hidroksilne skupine kako na površini tako i iznutra aerosil molekule, Uz ravnomjernu distribuciju, svaki drugi atom silicija ima na površini hidroksilnu skupinu.
Elektroliza vode provodi se uvođenjem baze u vodu. Instalacija koja se koristi za elektrolizu naziva se električar Coleman. Postrojenje za elektrolizu vode sastoji se od: - elektrolize gdje se odvija elektroliza. - grafitni elektroliti, koji imaju posebna imena: anodna ili pozitivna elektroda i katodna ili negativna elektroda. Nakon završetka lanca nalazi se kiselina ili elektrolit ili elektrolizer. - dobro električno vodljivo rješenje. Ne prolazi kroz čistu vodu, alkalije ili sol, ali ne sudjeluje u reakciji.
U proizvodnji stakla korišten je silicijev dioksid. Na anodi se proizvodi čak i kisik. Elektroliza je svojstvo određenih tvari da se razgradi pomoću električne struje, koja djeluje kao katalizator. Ali mnogo prije pojave. Istraživači su uspjeli oporaviti podatke. Otkriće kisika: kisika otkrili su Karl Wilhelm Scheele i Joseph Priestley. Dobivanje uzoraka primarnog kisika može pomoći istraživačima da odrede kako su se nebeska tijela razvijala na različite načine. Kisik-17 i kisik - nakon što se kapsula Biti srušila u pustinji Utah.
To uzrokuje tri vrste interakcija aerosila: fizikalna adsorpcija, kemijska adsorpcija (stvaranje vodikovih mostova silanolnim skupinama s vodom, alkoholi, kiseline i druge tvari) i kemijske reakcije na površini molekule. Dakle, silanolne skupine međusobno djeluju s alkoholima da bi formirale etere.
Aerosil (silicij dioksid) ima dobra sorpcijska svojstva, apsorbira od 15 do 60% različitih tekućina ovisno o njihovoj prirodi, bez promjene izgleda i protočnosti praška. Prvi sloj vode apsorbira aerosil zbog stvaranja vodikovih mostova (kemijska adsorpcija), a sljedeći slojevi su zbog fizičke adsorpcije. Fizički adsorbirana voda oslobađa se na temperaturi od 25-150 ° C, dok se kemijski adsorbirana voda oslobađa na 800 ° C.
Dakle, riječ "kisik" znači kiselinski proizvođač. Otkriće je vrlo važno za obnavljanje evolucije nebeskih tijela u blizini Zemlje. Ali uzrok promjena u različitim dijelovima Sunčevog sustava nije poznat. Becher otkriva da silika sadrži novu zemlju, a zatim silicij. Ime koje je predložio Lavoisier potječe od pogreške velikog kemičara, koji je vjerovao da sve kiseline sadrže kisik. Antoine Lavoisier pročišćenom zraku daje novo ime. Otkrio je prisutnost plina. Kemijska svojstva: Ricky 6 milijardi godina.
U godini, neovisno jedan o drugom. H. smatra se izgubljenim. Skupljanje uzoraka kisika s periferije našeg Sunčevog sustava. Mjesec i meteoriti imaju tri različita izotopa. Od samog početka ljudske civilizacije silikati se koriste u keramici. Fokusiranje s solarnom lećom. Silicij je praktički netopljiv u vodi ili kiselinama, osim reakcije fluorovodične kiseline, u kojoj se oslobađa silicij tetrafluorid formule. Posebno, amorfni oblik silicijevog dioksida je topiv u lužinama.
Aerosil, koji se koristi za proizvodnju lijekova, mora imati visoku čistoću. Tablica 1 prikazuje kemijski sastav različitih zaštitnih znakova Aerosila, koji mogu imati određene nečistoće nastale tijekom proizvodnih procesa, na primjer, tragovi klorovodične kiseline, koja uzrokuje pH od 4% vodene suspenzije polimera (3.6-4.3). Dakle, Aerosil (silicij) se ponaša kao slaba kiselina.
Zrak stvara samo pri iznimno visokim temperaturama. Silicij je prekriven zaštitnim slojem. Na normalnoj temperaturi silicij ne reagira s zrakom. Nastajanje natrijevog silikata. Silicum je u travi. Drugim riječima, da budete ispravno informirani, a ne samo informirani.
Možda bi bilo lakše razumjeti za početak, kakav građevinski materijal. Ovdje su rezultati istraživanja. Nađimo ih zajedno. Nalazimo se usred ljeta, pa želimo lakše podnijeti vruće dane. Jednostavno i slobodno hlađenje unutarnjim zrakom.
Tablica 1 - Kemijski sastav različitih vrsta aerosila (prema suhoj tvari, prema MM Astrakhanov)
| Sadržaj,% | Aerosil marke, sastav,% | ||||
| 200; 300; 380 | 0 | SOK84 | R972 | kombinirana | |
| SiO2 | >99,87 | >99,8 | 82–86 | >98,3 | 85 |
| Al2O2 | 14–18 | – | |||
| Fe2O3 | – | ||||
| TiO2 | – | 0,03 | – | ||
| Na2O | – | – | – | – | |
| kao | – | – | – | – | |
| B2O3 | – | – | – | – | |
| Bi2O3 | – | – | – | – | |
| P2O5 | – | – | – | – | |
| HCl | – | 0,05 | |||
| škrob | – | – | – | – | – |
U tablici 2 prikazana su najvažnija fizikalno-kemijska svojstva različitih aerosil markekoji se široko koriste u proizvodnji lijekova
Nadamo se da će sve gore navedene informacije biti korisne kada se odlučite za izgradnju kuće, a vi ćete biti u procesu odabira materijala. Ono što je zanimljivo u ovom slučaju je da ovaj učinak dezinfekcije uzrokuje i čak dozira bakterija. Na dijagramu je prikazan samodezinfekcijski učinak nanočestica srebra i kalcijevog fosfata koji se talože na plastičnu foliju.
Zbog toga su bogate obitelji koristile srebrni srebrni pribor za jelo koje je imalo antibakterijski učinak, a siromašniji svijet koristio je metodu uvođenja srebrnih novčića u zdjelu mlijeka. Tijekom dva stoljeća srebro se koristilo u medicini prije nego su se antibiotici zauzeli i dugo vremena koristili samo u alternativnoj medicini. Od početka nanotehnologije ovaj plemeniti metal doživljava pravu renesansu u medicini. Medicinska oprema i proteze, bolnički namještaj ili čak bolnički namještaj oblači se, omata ili obogaćuje njima.
Tablica 2. Fizikalna i kemijska svojstva aerosila različitih marki
| pokazatelj | Pečati aerosila | |||||
| 200 | 300 | 380 | 0 | SOK-84 | R-972 | |
| Specifična površina, m2 / g | 200 ± 25 | 300 ± 30 ° C | 380 ± 30 | 200 ± 25 | 170 ± 30 ° C | 120 ± 30 |
| Gubici tijekom paljenja,% | 1 | 2 | 2,5 | 1 | 1 | 2 |
| Prosječna veličina čestica | 12 | 7 | 7 | 12 | – | 16 |
| Sadržaj vlage,% (sušeno na 105 ° C) | – | 1,5 | 1,5 | 1,5 | 0,5 | 2,5 |
| Zasićena masa, g / l, standardna (neprešana) prešana | ≈60≈120 | |||||
| poroznost | porozan | neporozni | ||||
| pH 4% vodene disperzije | 3,6–4,3 | – | – | 3,6–4,3 3,5–4,1 (u metanolu) |
||
proizvodnja lijekova Aerosil kao stabilizator za suspenziju ulja. Ima visoku sposobnost adsorbiranja raznih tekućina. Dodavanje aerosila sastavu ulja i suspenzije vode i alkohola-glicerola povećava sedimentaciju, agregaciju i agregacijsku stabilnost tih sustava, stvarajući dovoljno jaku prostornu strukturu koja može zadržati imobiliziranu tekuću fazu s suspendiranim česticama farmaceutskih tvari u stanicama. U vodenim i vodeno-alkoholnim suspenzijama stabilizirajući učinak aerosila uglavnom je posljedica elektrostatskih sila. Sedimentacija čestica čvrste faze u stabiliziranim vodeno-alkoholnim suspenzijama događa se 3 puta sporije nego u nestabiliziranim sustavima. Stabilizirajući učinak aerosila povećava se u prisutnosti male količine surfaktanta, na primjer, Tween-80. Prisutnost aerosila (u koncentraciji od 1,0–5,0%) u emulzijama i suspenzijama povećava njihovu stabilnost, sposobnost boljeg fiksiranja na koži i djelotvornost terapijskog djelovanja. S vodom i alkoholom silicij dioksid u koncentraciji od 3% stvara mutne suspenzije, čije dionice imaju negativan naboj.
Supstrat punjenja aktivira mehanizam. U vrijeme ove znanstvene komunikacije bilo je nemoguće koristiti točan i doziran plemeniti metal. Ključni čimbenik je da bakterije koriste kalcij kako bi podržale njihov metabolizam. Čestice kalcijevog fosfata u rasponu od 20-50 nanometara apsorbiraju mikroorganizmi kao hrana i tako se razgrađuju. U tom procesu emitiraju se tisuće malih čestica srebra od 1 do 2 nanometra, koje su istraživači primijenili na temelju kalcijevih hranjivih tvari.
Koliko znamo, nanočestice srebra različito djeluju na bakterije: one sprječavaju prijenos hranjivih tvari u stanicu, napadaju staničnu membranu i ometaju staničnu podjelu i, implicitno, klijanje. Ispitivanja korištenjem kalcijevog fosfata i silicijevog dioksida, od kojih je svaki obložen srebrom, pokazala su različite učinke na različite vrste bakterija u ispitivanjima. Podrška kalcijevog fosfata dala je do 1000 puta više intenziteta od silicijevog dioksida. Budući da je potrošnja kalcijevog fosfata, prema istraživačima, također hranjena bakterijama - bez povećanja količine srebra u roku od 24 sata s faktorom od tisuću - srebro bi se trebalo boriti ne samo s postojećim bakterijama, nego i sa Novoformiranim. "Zato je učinak još upečatljiviji", kaže Wendelin Stark.
Jedno od svojstava aerosila je njegova sposobnost zgušnjavanja (zgušnjivača) (tablica 3).
Tablica 3. Učinak zgušnjavanja Aerosil-200
Ovo svojstvo se koristi za dobivanje aerosila koji sadrže gelove i baze za mast, koje uključuju aerosil. Kao tekuća faza za njihove pripravke, upotrebljava se polietil-siloksanska tekućina pod nazivom Esilon-5 ili Esilon-4, riblje ulje, PEG-400, ricinusovo ulje, masna ulja i slično. Esilon-5 je zgusnuo 16% aerosila poznatog kao vazelin KV-E / 16, ne iritira kožu i ne sprječava apsorpciju aktivnih tvari. Kao sredstvo za zgušnjavanje koristi se tekuća faza aerosil (silicij dioksid) u iznosu od 8-16%. Nastali gelovi imaju mekanu plastičnu konzistenciju, dobro su raspoređeni i fiksirani na koži. Imaju dobru koloidnu stabilnost na povišenim temperaturama (≥40 ° C), zadržavaju potrebnu konzistenciju, koja se ne mijenja ni na 100 ° C, te se stoga gelovi i masti koji sadrže aerosil mogu koristiti u tropskim klimatskim uvjetima. Prema strukturnim i mehaničkim svojstvima gelova, koji uključuju aerosil, čine tiksotropni plastični termostabilni sustavi i imaju antimikrobnu otpornost. Kvantitativni sadržaj aerosila u sustavu utječe na reološka i biofarmaceutska svojstva gelova. Povećanje silicijevog dioksida u sastavu gelova dovodi do povećanja njihove plastične viskoznosti i tiksotropnih svojstava, dok značajno usporava oslobađanje aktivnog farmakološkog sastojka.
Zahvaljujući novom proizvodu, skupina na čelu s g. Starckom uspjela je razviti učinkovit lijek protiv brojnih patogenih bakterija koje su aktivne u desnoj i desnoj dozi samo ako postoji bakterija. Kalcijev fosfat, koji se oksidira kalcijevim fosfatom, oslobađa se samo u odgovarajućoj količini, koju bakterija troši iz kalcijevog fosfata. Ova metoda štedi troškove, pokazuje učinkovitost i manje je zahtjevna za ljudsko tijelo. Film se može koristiti, na primjer, u bolnicama, u ne-ljubičastim točkama s gledišta prijenosa embrija.
Uporaba aerosila (silicij dioksida) u medicinskoj i veterinarskoj farmaceutskoj industriji
Aerosil se koristi u proizvodnji tableta. u koncentraciji od 0,1-0,5% kao klizna i labava (0,1-2,0%) supstanca, koja smanjuje vrijeme njihovog raspadanja, olakšava proces granulacije, poboljšava fluidnost mase tablete. Adsorpcijska svojstva Aerosila koriste se u proizvodnji prašaka, ekstrakata i drugih farmaceutskih pripravaka.
Vrata, kreveti ili sanitarne prostorije u kojima se pričvršćuje film za samozapaljivanje može pomoći pacijentima sa strašnim i opasnim patogenim mikroorganizmima u bolnicama, što može dovesti do komplikacija intervencije operatera. Potrebno ih je redovito mijenjati, jer bakterija konzumira kalcij, te stoga folija nema neograničen učinak.
Većina alata za procjenu ranjivosti jednostavno uzimaju svoje trenutne mrežne skenere i upućuju na bežičnu infrastrukturu. Ovaj pristup vam ne daje informacije koje su jedinstvene za bežične mreže. Osim toga, dok tradicionalni skeneri mogu navesti ranjivosti određenog cilja, oni ne mogu procijeniti je li kontrola omekšavanja instalirana na cilj ili u okoliš.
Brojne farmakološke, toksikološke i biofarmaceutske studije potvrdile su da je aerosil, ako se koristi interno, indiferentan, dobro ga toleriraju pacijenti, ima ljekovita svojstva za bolesti gastrointestinalnog trakta i druge upalne procese, te može biti izvor opskrbe silicija u tijelu. Postoje dokazi da aerosil (silicij dioksid) može pridonijeti smanjenju glatkih mišića i krvnih žila, a također ima i antibakterijska svojstva.
Farmaceutski sustavi koji sadrže aerosil ne pokazuju iritirajuće i toksične učinke. Ista svojstva su svojstvena masti kada se koristi epsilon i aerosil kao osnova (sastav epsilon-5, zgusnut s 15% aerosila u proizvodnji masti s antibioticima i kortikosteroidima). Masti s aerosilom (silika) lako istisnuti iz cijevi, dobro učvršćeni na kožu, imaju produljeni učinak.
književnost
Žoglo F., Wozniak V., Popovich V., Bogdan J. Pomoćne tvari i njihova uporaba u tehnologiji medicinskih oblika. - Lviv, 1996; Pertsev I.M., Kotenko A.M., Chueshov A.V., Khaleeva E.L. Farmaceutski i biološki aspekti masti: Monografija. - H., 2003; Pechkovskaya K.A. Punjenje gume. U knjizi: Enciklopedija polimera. U 3 t - M., 1974.
