Υψηλή συγκέντρωση πυριτίου. Ξέρεις πως
Επεξεργαστής; Πισόκ; Και τι έχετε με τις λέξεις συνειρμούς; Ή μήπως η Silicon Valley;
Σαν να μην ήταν εκεί, με το πυρίτιο κολλάμε σήμερα, και αν χρειάζεται να μάθεις, τι είναι το Si και γιατί τρως, ζητώ μια γάτα.
Είσοδος
Όντας φοιτητής σε ένα από τα πανεπιστήμια της Μόσχας στην ειδικότητα «Νανοϋλικά», θέλω να σε γνωρίσω, αγαπητέ αναγνώστη, με τα σημαντικότερα χημικά στοιχεία του πλανήτη μας. Επιλέγω κάτι εδώ και πολύ καιρό, κάρβουνο ή πυρίτιο, και παρόλα αυτά αποφάσισα να χρησιμοποιήσω το Si ο ίδιος, έτσι ώστε η καρδιά κάθε σύγχρονου gadget να βασίζεται σε αυτό καθεαυτό, ώστε να μπορείτε να το πείτε υπέροχα. Θα προσπαθήσω να κάνω τις σκέψεις μου εξαιρετικά απλές και προσιτές, έχοντας γράψει αυτό το υλικό, το έχω αποθηκεύσει, κυρίως σε αρχάριους, αλλά όλο και περισσότεροι άνθρωποι μπορούν να το πάρουν από το cicave, οπότε θα ήθελα να πω ότι το άρθρο γράφτηκε αποκλειστικά για διευρυνόμενα συμφέροντα, τι κόλλησε. Και ας ξεκινήσουμε λοιπόν.
Πυρίτιο
Πυρίτιο (λατ. πυρίτιο), Si, χημικό στοιχείο της ομάδας IV του περιοδικού συστήματος Mendeliev. ατομικός αριθμός 14, ατομικό βάρος 28,086.
Στη φύση, το στοιχείο αντιπροσωπεύεται από τρία σταθερά ισότοπα: 28Si (92,27%), 29Si (4,68%) και 30Si (3,05%).
Πάχος (ν.σ.) 2,33 g/cm;
Σημείο τήξεως 1688 Κ

Σκόνη Si
Ιστορική απόδειξη
Λόφοι του πυριτίου, πλατιές εκτάσεις, λεωφόροι ανθρώπων από πέτρινη εποχή. Υπήρχαν χιλιάδες παπαλίνα πέτρας και το πότισμα της πέτρας. Zastosuvannya spoluk Πυρίτιο, δεμένο με την επεξεργασία τους, - η προετοιμασία μιας αποθήκης - ξεκίνησε γύρω στο 3000 π.Χ. ε. (Παλαιά Αίγυπτος). Νωρίτερα στο σπίτι, χρησιμοποιήθηκε πυρίτιο - οξείδιο SiO2 (πυρίτιο). Τον 18ο αιώνα, το πυρίτιο εγχύθηκε με ένα απλό σώμα και μεταφέρθηκε στα «χώματα» (που χρησιμοποιείται στο όνομά του). Skladnіst σε μια αποθήκη πυριτίου έχοντας εγκαταστήσει І. Ι. Μπερζέλιους. Vіn ίδιο vpershe, το 1825, έχοντας αφαιρέσει το στοιχειώδες πυρίτιο από το φθοριούχο πυρίτιο SiF4, αντικαθιστώντας το υπόλοιπο μέταλλο κάλιο. Το νέο στοιχείο ονομάστηκε «πυρίτιο» (λατ. silex - πυριτόλιθος). Ρωσική ονομασία vvіv G. I. Hess at 1834 roci.

Τόξο πυριτίου προεκτάσεων στη φύση στην αποθήκη του ηχητικού ήχου
Διόγκωση πυριτίου στη φύση
Για το πλάτος στον φλοιό της γης, το πυρίτιο είναι ένα άλλο (μετά το ξινό) στοιχείο, ο μέσος όρος του στη λιθόσφαιρα είναι 29,5% (πίσω από τη μάζα). Ο φλοιός της γης, ο γκρι πυριτίου, έχει τον ίδιο πρωταρχικό ρόλο, όπως το κάρβουνο του γήινου φωτός του πλάσματος. Για τη γεωχημεία του πυριτίου, είναι σημαντικό, ειδικότερα, ότι η σύνδεση μεταξύ yogo και ξινής είναι σημαντική. Σχεδόν το 12% της λιθόσφαιρας γίνεται πυρίτιο SiO2 με τη μορφή του ορυκτού χαλαζία και διαφόρων ποικιλιών. Το 75% της λιθόσφαιρας αποτελείται από διάφορα πυριτικά και αργιλοπυριτικά άλατα (polova, μαρμαρυγία, αμφιβολία toshcho). Ο συνολικός αριθμός ορυκτών, που μπορούν να αντικατασταθούν από πυρίτιο, ξεπερνά τα 400.
Η φυσική δύναμη του πυριτίου
Νομίζω ότι ειδικά δεν είναι varto, αυτό είναι όλο Φυσική δύναμηΈχω δωρεάν πρόσβαση, αλλά θα αναφέρω τα πιο συνηθισμένα.
Σημείο βρασμού 2600 °C
Prozorium πυριτίου για dovgokhvilovyh ІCh-promenіv
Διηλεκτρική διείσδυση 11.7
Mohs Silicon Hardness 7.0
Θα ήθελα να πω ότι το υλικό σιλικόνης, η αναμνηστική πλαστική παραμόρφωση ξεκινά σε θερμοκρασίες υψηλότερες από 800°C.
Το πυρίτιο είναι ένας αγωγός, το ίδιο κρασί ξέρουμε πολλά zastosuvannya. Η ηλεκτρική ισχύς του πυριτίου μπορεί να βρίσκεται στο σπίτι.
Χημική ισχύς.
Είναι πλούσιο εδώ, είναι καταπληκτικό, θα πει κανείς, αλλά σκοντάφτω στο πιο διάσημο. Στα ράφια του Si (παρόμοιο με το carbon) 4-valent.
Στην επιφάνεια του πυριτίου zavdyak, η τήξη του οξειδίου είναι σταθερή στον αέρα σε υψηλές θερμοκρασίες. Σε οξύ, οξειδώνεται στους 400 °C, διαλύοντας το οξείδιο του πυριτίου (IV) SiO2.
Το πυρίτιο είναι ανθεκτικό στα οξέα και είναι λιγότερο πιθανό να αναμιχθεί με νιτρικό και υδροφθορικό οξύ, διακρίνεται εύκολα σε ζεστά λιβάδια από το να βλέπει νερό.
Το πυρίτιο κάνει 2 ομάδες όξινων σιλανίων - σιλοξάνη και σιλοξένιο. Το πυρίτιο αντιδρά με το άζωτο σε θερμοκρασίες άνω των 1000 °C. είναι πολύτιμο υλικό για τη χημική βιομηχανία, καθώς και για την παραγωγή πυροσβεστήρων. Η υψηλή σκληρότητα, καθώς και η θερμική και χημική αντοχή, επεξεργάζονται με δάπεδα καρβιδίου του πυριτίου (καρβίδιο του πυριτίου SiC) και βορίου (SiB3, SiB6, SiB12).
Otrimanya πυρίτιο
Νομίζω tse naytsіkavіsha μέρος, εδώ είναι η έκθεση.
Ο τύπος αναγνώρισης αγρανάπαυσης χωρίζεται:
1.
Ηλεκτρονική ισχύς πυριτίου(t.z. ηλεκτρονικό πυρίτιο”) - το πιο πυριτικό πυρίτιο από την ομίχλη πυριτίου πάνω από 99,999% πίσω από τον τοίχο, η ηλεκτρική υποστήριξη της ποιότητας ηλεκτρονικής πυριτίου μπορεί να αλλάξει σε διάστημα περίπου 0,001 έως 150 ohm cm, αλλά με το μέγεθος του στηρίγματος είναι φταίει η buti παρέχεται με ένα all-inclusive σπίτι, έτσι ώστε να μπορείτε να μπείτε στο κρύσταλλο του σπιτιού άλλων, θέλοντας να φροντίσει τα καθήκοντα του νηπιαγωγείου του ηλεκτρικού opir, ring out, απαράδεκτο.
2.
Ποιότητα σιλικόνης sony(t.z. "sonyachny silicon") - πυρίτιο από μικτό πυρίτιο πάνω από 99,99% ανά ίνα, το οποίο χρησιμοποιείται για την παραγωγή φωτοηλεκτρικών συσκευών μετατροπής (ηχητικές μπαταρίες).

3.
Τεχνικό πυρίτιο- μπλοκ πολυκρυσταλλικής δομής πυριτίου, που λαμβάνονται με τη μέθοδο της καρβοθερμικής ανανέωσης από καθαρό τρίξιμο χαλαζία; κάλυμμα με 98% πυρίτιο, το κύριο σπίτι είναι άνθρακας, αερίζεται με μεγάλη ποσότητα ελαφρών στοιχείων - βόριο, φώσφορο, αλουμίνιο. χρησιμοποιείται κυρίως για την κατοχή πολυκρυσταλλικού πυριτίου.
Το πυρίτιο τεχνικής καθαρότητας (95-98%) διαθέτει ηλεκτρικές εκρήξεις εμπνευσμένου πυριτίου SiO2 μεταξύ ηλεκτροδίων γραφίτη. Στη σύνδεση με την ανάπτυξη της μεθόδου nap_v_dnikovoї tehnіko razrobleno απόκτησης καθαρού και ιδιαίτερα καθαρού πυριτίου. Για χάρη της μπροστινής σύνθεσης καθαρού πυριτίου vih_dnih spoluk, z yakikh vityagyat silіkі vіdnovlennya vіdnovlennya аbo termіchnogo razkladannya.
Πολυκρυσταλλικό πυρίτιο ("πολυσυρίτιο") - η πιο καθαρή μορφή πυριτίου, η οποία είναι εμπορικά βιώσιμη, - ένα προϊόν που χρησιμοποιείται για τον καθαρισμό του τεχνικού πυριτίου με μεθόδους χλωρίου και φθορίου και είναι νικηφόρο για την παραγωγή μονοκρυσταλλικού και πολυκρυσταλλικού πυρίτιο.
Παραδοσιακά, το πολυκρυσταλλικό πυρίτιο αφαιρείται από το τεχνικό πυρίτιο με μια διαδρομή μεταφοράς της γιόγκα σε βρύσες σιλανίου (μονοσιλάνιο, χλωροσιλάνιο, φθοριοσιλάνιο) με επιθετικό πυθμένα σιλανίων, τα οποία καθιζάνουν, διορθώνεται καθαρισμός του μετατρεπόμενου σιλανίου και ανακαίνιση μεταλλικού σιλανίου σε .
Οι αγωγοί καθαρού πυριτίου παράγονται σε δύο τύπους: πολυκρυσταλλικό(ενίσχυση SiCl4 ή SiHCl3 με ψευδάργυρο ή νερό, θερμική διαστολή SiI4 και SiH4) και μονοκρυσταλλική(Ζώνη χωρίς χωνευτήριο τήξη και «τύλιγμα» ενός μόνο κρυστάλλου από λιωμένο πυρίτιο - η μέθοδος Czochralsky).

Εδώ μπορείτε να χρησιμοποιήσετε τη μέθοδο Czochralski για να δονήσετε το πυρίτιο.
Μέθοδος Czochralski- η μέθοδος δόνησης των κρυστάλλων με μια διαδρομή περιέλιξης του λόφου στον αέρα στην επιφάνεια της μεγάλης υποχρέωσης να λιώσει με την έναρξη του στάχυ της κρυστάλλωσης με τη διαδρομή φέρνοντας τον κρυστάλλο του σπόρου (ή μεγάλο αριθμό κρυστάλλων ) δεδομένης δομής και κρυσταλλογραφικού προσανατολισμού atsії σε επαφή με τήγμα ελεύθερης επιφάνειας.
Zastosuvannya πυρίτιο
Το ειδικά κράμα πυριτίου χρησιμοποιείται ευρέως ως υλικό για την παρασκευή ηλεκτρικών αγωγών (τρανζίστορ, θερμίστορ, δονητές ισχύος, θυρίστορ, φωτοκύτταρα sony που χρησιμοποιούνται σε διαστημόπλοια, καθώς και πολλά άλλα είδη).
Θραύσματα προσωρίας πυριτίου για αλλαγή από μακριές τρίχες σε μέγεθος από 1 έως 9 μικρά, μπορούν να τοποθετηθούν σε υπέρυθρες οπτικές.
Το πυρίτιο μπορεί να είναι διαφορετικό και όλες οι περιοχές της zastosuvannya, οι οποίες επεκτείνονται. Στη μεταλλουργία Si
vikoristovuetsya για την αφαίρεση της ξινίσεως (αποξείδωσης) από λιωμένα μέταλλα.
Πυρίτιο αποθήκημεγάλος αριθμός κραμάτων του χωλ και χρωματικών μετάλλων.
Ηχητικά κράματα πυριτίου για την αύξηση της αντοχής στη διάβρωση, τη βελτίωση της ισχύος τους και την αύξηση της μηχανικής αντοχής. prote με μεγαλύτερη zmistі Πυρίτιο μπορεί viklikati kryhkіst.
Τα πιο σημαντικά είναι τα κράματα, τα κράματα χαλκού και αλουμινίου, τα οποία μπορούν να χρησιμοποιηθούν για την εκδίκηση των ζωνών.
Το πυρίτιο επεξεργάζεται με γυαλί, τσιμέντο, κεραμικό, ηλεκτρικό και άλλα βιομηχανικά γαλάζια.
Ο καθαρισμός με πυρίτιο είναι σημαντικός για την κατασκευή μεμονωμένων ηλεκτρονικών συσκευών (για παράδειγμα, του επεξεργαστή του υπολογιστή σας) και μικροκυκλωμάτων ενός τσιπ.
Καθαρό πυρίτιο, που χρησιμοποιείται για καθαρό πυρίτιο, ο καθαρισμός του μεταλλουργικού πυριτίου ως κρυσταλλικό πυρίτιο είναι η κύρια πρώτη ύλη για την ενέργεια της sony.
Πυρίτιο μονοκρυστάλλου - η κρέμα των ηλεκτρονικών και της sony power engineering χρησιμοποιείται για την κατασκευή καθρεφτών λέιζερ αερίου.

Πυρίτιο καθαρισμού και προϊόν γιόγκα
Πυρίτιο στο σώμα
Το πυρίτιο στο σώμα βρίσκεται στα μάτια διαφόρων σπόλουκων, που παίρνουν μέρος στην πρώτη θέση στον φωτισμό σκληρών σκελετικών μερών και ιστών. Ιδιαίτερα πλούσιο σε πυρίτιο μπορεί να συσσωρεύσει απορρίψεις φυκιών (για παράδειγμα, φύκια διατόμων) και πλασμάτων (για παράδειγμα, σφουγγάρια με κέρατο πυριτίου, ραδιολάρια), τα οποία τη στιγμή του ωκεανού στον πυθμένα του ωκεανού σκληραίνουν από εναποθέσεις οξειδίου του πυριτίου (IV). Σε κρύες θάλασσες και λίμνες, τα βιογενή μουλάρια, πλούσια σε πυρίτιο, είναι πιο σημαντικά, στις τροπικές θάλασσες - ατμιστικά μουλάρια με χαμηλή περιεκτικότητα σε πυρίτιο. Τα χόρτα, οι σπαθόχοιροι, οι φοίνικες και οι αλογοουρές συσσωρεύουν πολύ πυρίτιο στη μέση των χερσαίων φυτών. Στα πλάσματα της ραχοκοκαλιάς, αντί για οξείδιο του πυριτίου (IV), στα στάχτη ποτάμια 0,1-0,5%. Στο μεγαλύτερο αριθμό εκδηλώσεων πυριτίου στο αλκαλικό χαρούμενο ύφασμα, nirkah, pidslunkovy θησαυροφυλάκιο. Σε μια συμπληρωματική δίαιτα, οι άνθρωποι έχουν έως και 1 g πυριτίου. Με υψηλή πρόσληψη οξειδίου του πυριτίου (IV) στον αέρα, καταναλώνεται στη λεγένια ενός ατόμου που προκαλεί ασθένεια - πυριτίαση.
Visnovok
Λοιπόν, από όλα, αν έχεις διαβάσει μέχρι το τέλος και έχεις διεισδύσει λίγο, τότε είσαι λίγο πιο κοντά στην επιτυχία. I spodіvayus, γράφοντας δεν είναι για τίποτα και pіst βεβαίωσα να hoch komu. Για σεβασμό.
ΠΥΡΙΤΙΟ. (Πυρίτιο), Si - χημικ. στοιχείο IV της ομάδας του περιοδικού συστήματος στοιχείων. στο. n. 14, στο. μ. 28.086. Κρυσταλλική ομιλία πυριτίου-σκούρο γκρι με ρητινώδη λάμψη. Στις περισσότερες περιπτώσεις, ο βαθμός οξείδωσης αποκαλύπτεται - 4, +2 και +4. Το φυσικό πυρίτιο αποτελείται από σταθερά ισότοπα 28Si (92,28%), 29Si (4,67%) και 30Si (3,05%). Απόσυρση ραδιενεργών ισοτόπων 27Si, 31Si και 32Si με περιόδους αντίστροφης διάσπασης 4,5 δευτερολέπτων, 2,62 ετών και 700 ετών. πρωτοεμφανίστηκε το 1811 Γαλλικά. χημικός και φυσικός J. L. Gay-Lussac και French. χημικός L. J. Tenar, αλλά υπάρχουν λιγότερες ταυτοποιήσεις το 1823 Σουηδός, χημικός και ορυκτολόγος J. Ya. Berzelius.
Για το πλάτος στον φλοιό της γης (27,6%), πυρίτιο-άλλο (μετά το ξινό) στοιχείο. Η γνώση είναι σημαντική. με τη μορφή πυριτίου Si02 και άλλων όξινων λόγων (πυριτικά, αργιλοπυριτικά κ.λπ.). Για τα καλύτερα μυαλά, καθιερώνεται μια σταθερή τροποποίηση σερβιέτας, η οποία έχει μια κυβική δομή με επίκεντρο το πρόσωπο σαν διαμάντι, με περίοδο a = 5,4307 A. Η διαλείπουσα διείσδυση είναι 2,35 A. Το πλάτος είναι 2,328 gcm. Με υψηλή πίεση (120-150 kbar) πηγαίνετε στα μεγαλύτερα σύρματα και μεταλλικές τροποποιήσεις. Μεταλλική τροποποίηση-υπεραγωγός με θερμοκρασία μετάπτωσης 6,7 Κ. Με την αύξηση της πίεσης, το σημείο τήξης μειώνεται από 1415 ± 3 ° C σε πίεση 1 bar σε 810 ° C σε πίεση 15.104 bar σπάνια). ). Όταν τήκεται, υπάρχει αύξηση στον αριθμό συντονισμού και μετάλλωση των διατομικών δεσμών. Άμορφος πυριτικός χαρακτήρας της τάξης μικρής εμβέλειας, που παρουσιάζει έντονα δημιουργημένη ογκοκεντρική κυβική δομή, σχεδόν σπάνια. Το Debievskaya t-ra είναι κοντά στο 645 Κ. Συντ. Η γραμμική διαστολή της θερμοκρασίας αλλάζει με την αλλαγή του t-ri σύμφωνα με τον ακραίο νόμο, χαμηλότερη από t-ri 100 To κρασί γίνεται αρνητικό, φτάνοντας στο ελάχιστο (-0,77 10 -6) deg -1 σε t-ri 80 K; σε t-rі 310 K το κρασί είναι 2,33 10-6 deg-1, και σε t-rі 1273 K-4,8 10 deg-1. Θερμότητα σύντηξης 11,9 kcal/g-άτομο; tkіp.3520 K.
Η θερμότητα της εξάχνωσης και της εξάτμισης σε θερμοκρασία τήξης είναι 110 και 98,1 kcal/g-άτομο. Η θερμική αγωγιμότητα και η ηλεκτρική αγωγιμότητα του πυριτίου βρίσκονται στην καθαρότητα και την πληρότητα των κρυστάλλων. Zі rostannyam t-ri συν. η θερμική αγωγιμότητα του καθαρού K. αυξάνεται σταδιακά (έως 8,4 cal/cm X X sec deg σε t-ri 35 K) και στη συνέχεια αλλάζει, φτάνοντας τα 0,36 και 0,06 cal/cm sec deg στους t-ri vіdpovidno 300 και 1200 K. Ενθαλπία, εντροπία και θερμοχωρητικότητα Κ. σε τυπικά μυαλά, είναι ίση με 770 cal/g-άτομο, 4,51 και 4,83 cal/g-atom - deg. Πυρίτιο διαμαγνητικό, μαγνητική επιδεκτικότητα στερεού (-1,1 10 -7 mu/g) και σπάνιο (-0,8 10 -7 mu/g). Το πυρίτιο εναποτίθεται ασθενώς στο t-ri. Η επιφανειακή ενέργεια, το πάχος και το κινηματικό ιξώδες του σπάνιου Κ. σε θερμοκρασία τήξης γίνονται 737 erg/cm2, 2,55 g/cm3 και 3 10 m2/sec. Ένας τυπικός αγωγός κρυσταλλικού πυριτίου με πλάτος περιφραγμένης ζώνης 1,15 ev σε t-p 0 έως 1,08 u - σε t-p 300 K. Σε θερμοκρασία δωματίου, η συγκέντρωση των υγρών φορτίων είναι κοντά στο 1,4 10 10 cm - 3.
Η δύναμη του πυριτίου να πέφτει λόγω της φύσης και της συγκέντρωσης των σπιτιών, καθώς και της τελειότητας του κρυστάλλου. Δαχτυλίδι για otrimannya napіvprovіdnikovogo Do. με τη διεξαγωγή της γιόγκα τύπου r και n, συνδυάζονται με τα στοιχεία IIIb (βόριο, αλουμίνιο, γάλλιο) και Vb (φώσφορος, mish'yak, αντιμόνιο, βισμούθιο) υποομάδα, τα οποία δημιουργούν sukupnіst vіdpovіdno σε δέκτη και δότη rіvnі σε , roztashovannyh κοντά στους κλοιούς των ζωνών. Για το κράμα του βικορίστη, αυτά τα άλλα στοιχεία (για παράδειγμα,) διαμορφώνονται έτσι. glybokі rivnі, yakі obumovlyuyut θάψιμο και ανασυνδυασμός μύτης και φορτίων. Το Tse σας επιτρέπει να παίρνετε υλικά με υψηλή ηλεκτρική. υποστηρίζουν (1010 ohm cm σε t-rі 80 K) αυτή τη μικρή ασήμαντη τιμή της βάσης των μικρών φορτίων φθοράς, η οποία είναι σημαντική για την αύξηση του αριθμού των διαφορετικών βοηθητικών κτιρίων. Συντελεστής Η θερμοηλεκτρική ισχύς με πυρίτιο είναι ακριβώς για να αποτεθεί στο t-ri και στη θέση του σπιτιού, zbіlshyuyuchi zі zrostannym elektroopor (σε p = 0,6 ohm - cm, a = 103 microvolt / χαλάζι). Η διηλεκτρική διείσδυση του πυριτίου (vіd 11 έως 15) εναποτίθεται ασθενώς στην αποθήκη και η πληρότητα των μονοκρυστάλλων. Οι νόμοι της οπτικής αργίλου του πυριτίου έχουν αλλάξει πολύ λόγω της αλλαγής στην καθαρότητα, τη συγκέντρωση και τη φύση των ελαττωμάτων στη ζωή, καθώς και τη μακροζωία.
Ο κλοιός της έμμεσης αργίλωσης του ηλεκτρομαγνητικού κολιβάν είναι κοντά στα 1,09 ευρώ, η άμεση αργίλωση - έως και τα 3,3 ευρώ. Στην ορατή περιοχή του φάσματος των παραμέτρων του σύνθετου δείκτη κατάγματος (n - ik), είναι ήδη δυνατό να βρεθείτε στην επιφάνεια του σπιτιού. Για ιδιαίτερα αγνό Do. (στολ \u003d 5461 A και t-re 293 K) n \u003d 4,056 και k \u003d 0,028. Η απόδοση ρομπότ ηλεκτρονικών είναι κοντά στα 48 ευρώ. Τάση πυριτίου. Σκληρότητα Yogo (t-ra 300 K) για Moos - 7; ΗΒ = 240; HV y \u003d 103; I = 1250 kgf/mm2; μέτρο κανόνων, ελαστικότητα (πολυκρύσταλλος) 10890 kgf/mm2. Μεταξύ της ορυκτότητας να ξαπλώνεις στο βάθος του κρυστάλλου: στο παρθένο, το βάθος είναι 7 έως 14. συντ. Δυσκαμψία 0,325 1066 cm2/kg.
Σε θερμοκρασία δωματίου, το πυρίτιο πρακτικά δεν αλληλεπιδρά με αέρια (συμπεριλαμβανομένων) και στερεά αντιδραστήρια, krіm lіv. Κατά την κίνηση του t-ri, υπάρχει ενεργή αλληλεπίδραση με μέταλλα και αμέταλλα. Zocrema, που διαλύει καρβίδιο SiC (σε θερμοκρασία 1600 Κ), νιτρίδιο Si3N4 (σε θερμοκρασία 1300 Κ), φωσφίδιο SiP (σε θερμοκρασία 1200 Κ) και αρσενίδιο Si As, SiAS2 (σε θερμοκρασία 1000 Κ). Με ξινή αντίδραση σε θερμοκρασία 700 K, απόσβεση διοξειδίου Si02, με αλογόνα - φθόριο SiF4 (σε θερμοκρασία μεγαλύτερη από 300 K), χλωριούχο SiCl4 (σε θερμοκρασία μεγαλύτερη από 500 K), βρωμιούχο SiBr4 (σε θερμοκρασία 700 K) i nodide SiI4 (στα σ.τ. 1000). Εντατικά αντιδρώντας με πολλούς άλλους. μέταλλα, καθιερώνοντας στερεές διαφορές στην υποκατάστασή τους για τη χημ. στο μισό - πυριτικά. Οι περιοχές συγκέντρωσης ομοιογένειας των στερεών τριαντάφυλλων εμφανίζονται ανάλογα με τη φύση της ροζέτας (για παράδειγμα, Nimechchin σε 0 έως 100%, το φθινόπωρο έως 15%, σε άλφα ζιρκόνιο λιγότερο από 0,1%).
Η διαφορά μεταξύ μετάλλων και μη μετάλλων στο στερεό πυρίτιο είναι σημαντικά μικρότερη και ακούγεται ανάδρομος. Με τι σύνορα, αντί για σπίτι, τι γίνεται στο Ντο. όχι πολύ βαθιά, φτάστε το μέγιστο ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 cm) περιοχή t-r vіd 1400 έως 1600 K. Σπίτια με βαθύ rіvenny vіdznyayutsya ελαφρώς μικρότερο rozchinnіstyu (vіd 1015 για σελήνιο και 5 10 16 για zalіza έως 7 10 17 για νικέλιο και 10 18 cm-3 για midi). Σε έναν σπάνιο χάλυβα, το πυρίτιο δεν περιβάλλεται από κοινά μέταλλα, συχνά με μεγάλα οράματα θερμότητας. Το καθαρό πυρίτιο παρασκευάζεται από ένα τεχνικό προϊόν 99% Si і - 0,03% Fe, Al і Co), σκληρυμένο με χαλαζία και άνθρακα σε ηλεκτρικούς κλιβάνους. Ξεκινήστε με μια νέα πνοή προς εκεί (sum_shy hydrochloric and sirchanoy, και στη συνέχεια φθόριο-νερό και sirchanoy) σπίτια, μετά την οποία το προϊόν (99,98%) αφαιρείται, υποβάλλεται σε επεξεργασία με χλώριο. Οι συνθέσεις καθαρίζονται με απόσταξη.
Ο αγωγός πυριτίου χρησιμοποιείται σε συνδυασμό με χλωριούχο SiCl4 (ή SiHCl3) σε νερό ή θερμική διαστολή του υδριδίου SiH4. Ο υπολειπόμενος καθαρισμός και λείανση μονοκρυστάλλων πραγματοποιείται με λεία μέθοδο ζώνης χωρίς χωνευτήριο ή με τη μέθοδο Czochralsky, λαμβάνοντας υπόψη ιδιαίτερα την καθαρή σάλτσα (στο σπίτι έως 1010-1013 cm-3) cf\u003e 10 3 ohm cm. iv στο που να εισάγει δοσομέτρηση του αριθμού των απαραίτητων σπιτιών. Έτσι ετοιμάζετε κυλινδρικές κρέμες με διάμετρο 2-4 και μήκος 3-10 εκ. Για ειδικές. σκοπός είναι η παραγωγή ακόμη περισσότερων μονοκρυστάλλων. Τεχνικό πυρίτιο και ειδικά κράματα γιόγκο από αλατούχο ορό όπως όξινοι χάλυβες και κράματα, καθώς και ελαφριά πρόσθετα. Ιδιαίτερα καθαρό Zrazki μονοκρυστάλλου K., ντοπαρισμένο με διάφορα στοιχεία, είναι γνωστό ότι χρησιμοποιείται ως βάση διαφόρων εξαρτημάτων χαμηλού ρεύματος (ζωκρέμα, θερμοηλεκτρικό, ραδιόφωνο, φως και φωτοτεχνικό) και υψηλού ρεύματος (δόνηση, μετατροπή).
Πυρίτιο και πυρίτιο
Το πυρίτιο μεταφέρεται σε μη μέταλλα και 4 ηλεκτρόνια μπορούν να βρίσκονται στο ίδιο επίπεδο ενέργειας. Το Vіn μπορεί να vіddavati їх, δείχνοντας το στάδιο οξείδωσης + 4 και να προσθέσει ηλεκτρόνια, δείχνοντας το στάδιο οξείδωσης - 4. Ωστόσο, η ικανότητα προσθήκης ηλεκτρονίων στο πυρίτιο είναι σημαντικά μικρότερη, χαμηλότερη σε άνθρακα. Τα άτομα πυριτίου μπορεί να έχουν μεγαλύτερη ακτίνα, χαμηλότερα άτομα άνθρακα.
Η γνώση της φύσης για το πυρίτιο .
Αψίδα προεκτάσεων πυριτίου στη φύση. ανά її μέρος της πτώσης πάνω από το 26% της μάζας ιλαρά της γης. Για το φάρδος των κρασιών, καθίστε σε άλλο μέρος (μετά ξινί). Στο vіdmіnu vіd vіd uglec C vіlny stіnі vіrіdі δεν zustrichaetsya. Він εισάγετε στην αποθήκη διαφόρων χημικών συνθέσεων, κυρίως διάφορες τροποποιήσεις οξειδίου του πυριτίου (IV) και αλάτων πυριτικών οξέων (πυριτικά).
Εμμονή με το πυρίτιο .
Το πυρίτιο βιομηχανικής ποιότητας τεχνικής καθαρότητας (95 - 98%) κυριαρχείται από SiO 2 κοκ σε ηλεκτρικούς φούρνους κατά το ψήσιμο:
SiO 2 + 2C \u003d Si + 2CO
SiO 2 + 2Mg \u003d Si + 2MgO
Με αυτόν τον τρόπο λαμβάνεται από τα σπίτια άμορφη σκόνη πυριτίου καφέ χρώματος. Η ανακρυστάλλωση από μέταλλα που τήκονται (Zn, Al) μπορεί να μεταφερθεί σε κρυσταλλικό μύλο.
Το τετραχλωριούχο πυρίτιο, ακόμη και υψηλής καθαρότητας, χρησιμοποιείται στους 1000°C για το τετραχλωριούχο πυρίτιο SiCl 4 ζεύγη ψευδάργυρου:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
ότι το γιόγκο καθαρισμού ακολουθώντας ειδικές μεθόδους.
Φυσικός Χημική ισχύςπυρίτιο.
Καθαρό κρυσταλλικό πυρίτιο - τεντωμένη και σκληρή, πλαδαρή κλίση. Όπως ένα διαμάντι, έχει ένα κυβικό κρυσταλλικό πλέγμα με ομοιοπολικό τύπο δεσμού. Σημείο τήξης Yogo 1423 °C. Για τα μεγαλύτερα μυαλά, ένα ανενεργό στοιχείο πυριτίου, το οποίο αντιδρά μόνο με το φθόριο, αλλά όταν θερμαίνεται, εισέρχεται σε διάφορες χημικές αντιδράσεις.
Yogo vikoristovuyut ως πολύτιμο υλικό για napіvprovіdnikovіy tehnіtsі. Σε συνδυασμό με άλλους αγωγούς του κρασιού, διακρίνεται από σημαντική αντοχή στα αραιά οξέα και μεγάλη ηλεκτρική αντίσταση έως και 300°C. Τεχνικό βίκορο πυριτίου και σιδηροπυριτίου επίσης στη μεταλλουργία για ανθεκτικούς στη θερμότητα, ανθεκτικούς στα οξέα και χάλυβες εργαλείων, chavuns και πλούσια άλλα κράματα.
Με μέταλλα πυριτίου χημείες, που ονομάζονται πυριτικά, όταν θερμαίνεται με μαγνήσιο, το πυριτικό μαγνήσιο διαλύεται:
Si + 2Mg = Mg 2 Si
Τα πυριτίδια μετάλλων πίσω από τη δομή αυτής της κυριαρχίας προβλέπουν τα καρβίδια, έτσι τα πυριτίδια που μοιάζουν με μέταλλα, όπως τα μεταλλικά καρβίδια, διακρίνονται από μεγάλη σκληρότητα, υψηλό σημείο τήξης, θερμή ηλεκτρική αγωγιμότητα.
Όταν τηγανίζετε sumish pisku με οπτάνθρακα σε ηλεκτρικούς φούρνους, το καρβίδιο του πυριτίου και ο άνθρακας αναμιγνύονται με καρβίδιο του πυριτίου ή carborundum:
SiO2 + 3C = SiC + 2CO
Το Carborundum είναι ένα πυρίμαχο, σκληρό λόγο, ένα πολύτιμο λειαντικό και θερμικό υλικό. Carborundum, yak i, maє ατομικό κρυσταλλικό δωρεάν. Στον καθαρό σταθμό υπάρχει μονωτήρας, αλλά παρουσία του σπιτιού, γίνεται αγωγός.
Silicon yak i , διαλύει δύο οξείδια: οξείδιο του πυριτίου (II) SiO και οξείδιο του πυριτίου (IV) SiO 2 . Το οξείδιο του πυριτίου (IV) είναι μια σκληρή πυρίμαχη ομιλία, ευρέως διευρυμένη στη φύση στην ελεύθερη χώρα. Tse χημικά σταθερή ομιλία, η οποία αλληλεπιδρά μόνο με φθόριο και φθόριο παρόμοιο με αέριο σε νερό ή υδροφθορικό οξύ:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Η άμεση αναφορά στις αντιδράσεις εξηγείται από το γεγονός ότι το πυρίτιο μπορεί να έχει μεγάλη σποριωδότητα στο φθόριο. Επιπλέον, το τετραφθοριούχο πυρίτιο είναι μια ιπτάμενη ομιλία.
Στο tekhnіtsі prozoriya SiO 2 vykorovuyut για την προετοιμασία μιας σταθερής πυρίμαχης πλάκας χαλαζία, καθώς μια ευγενικά χάνει την υπεριώδη αλλαγή, μπορεί να έχει μεγάλο συντελεστή διαστολής, που δείχνει τις σημαντικές αλλαγές στη θερμοκρασία. Άμορφη τροποποίηση του οξειδίου του πυριτίου (II) τρίπολη με μεγάλο πορώδες. Yogo vikoristovuyut ως μονωτικό θερμότητας και ήχου για δονούμενο δυναμίτη (μύτη vibukhovo ομιλία) και ούτω καθεξής. Το οξείδιο του πυριτίου (IV) σε έναν δονούμενο ήχο είναι ένα από τα κύρια καθημερινά υλικά. Είναι χαρισματικό στην παραγωγή υλικών ανθεκτικών στη φωτιά και στα οξέα, χάλυβα, όπως μια ροή στη μεταλλουργία και ούτω καθεξής.
Σύμφωνα με τους μοριακούς τύπους, η χημική και φυσική ισχύς του οξειδίου του άνθρακα (IV) και του οξειδίου του πυριτίου (IV) είναι εύκολο να συνδυαστεί, η ισχύς αυτών είναι παρόμοια σε χημική αποθήκη z'ednan raznі. Γιατί εξηγείται ότι το οξείδιο του πυριτίου (IV) δεν σχηματίζεται μόνο από μόρια SiO 2 , όπως τα s їх associates, σε μερικά από αυτά τα άτομα του πυριτίου ενώνονται μεταξύ τους με τα άτομα του ξινιού. Οξείδιο του πυριτίου (IV) (SiO 2 ) n. Εικόνα її στην πλατεία:
Ένας άλλος εκπρόσωπος των στοιχείων της επικεφαλής υποομάδας της ομάδας IV (ομάδα IVA) του Περιοδικού συστήματος του D. I. Mendeliev - πυρίτιο Si.
Στη φύση, το πυρίτιο είναι ένα άλλο χημικό στοιχείο για το πλάτος του οξέος. Ο φλοιός της γης αναδιπλώνεται όλο και περισσότερο ανά τρίμηνο από το yogo spoluk. Το πιο διαδεδομένο πυρίτιο είναι το οξείδιο του πυριτίου (IV) SiO 2, το άλλο όνομα είναι πυρίτιο. Στη φύση, τα κρασιά παρασκευάζονται με τον ορυκτό χαλαζία (μικρό 158), μια πλούσια ποικιλία από τέτοιο - κρύσταλλο, καθώς και τη διάσημη πασχαλιά μορφή - αμέθυστος, καθώς και από αχάτη, οπάλιο, ίασπι, χαλκηδόνιο, καρνελιάνο, σε μορφή virobnі και μεθυστικές πέτρες. Το οξείδιο του πυριτίου (IV) αποτελείται επίσης από μια αξιοσημείωτη και χαλαζιακή άμμο.

Mal. 158.
Κρύσταλλοι χαλαζία διάσπαρτοι σε δολομίτη
Τρία διαφορετικά ορυκτά με βάση το οξείδιο του πυριτίου (IV) (πυριτόλιθος, χαλκηδόνιος και άλλα) πρώτοι άνθρωποιέτοιμη znaraddya pracі. Ο ίδιος πυριτόλιθος, που είναι δυσδιάκριτος και όχι πιο στενός από μια πέτρα, που στρώνει το στάχυ μιας πέτρας vіtsі - vіtsі kremіnyh znaryad pratsі (Εικ. 159). Υπάρχουν δύο λόγοι για αυτό: το εύρος και η διαθεσιμότητα του πυριτόλιθου, καθώς και η κατασκευή κτιρίων με το πόσο αιχμηρές είναι οι άκρες.

Mal. 159.
Znaryaddya πέτρα vіku
Ένας άλλος τύπος φυσικών υλικών για το πυρίτιο είναι το πυριτικό. Ανάμεσά τους είναι τα μεγαλύτερα πλάτη αργιλιοπυριτικών (κατανοήθηκε ότι αυτά τα πυριτικά μπορούν να αντικαταστήσουν το χημικό στοιχείο αλουμινίου). Ο γρανίτης προστίθεται στα αργιλοπυριτικά, δείτε διαφορετικάπηλός, μαρμαρυγία. Πυριτικό, το οποίο δεν εκδικείται το αλουμίνιο, για παράδειγμα, τον αμίαντο, που χρησιμοποιείται για την κατασκευή πυροτεχνημάτων.
Το οξείδιο του πυριτίου (IV) SiO 2 είναι απαραίτητο για τη ζωή των καλλιεργητών και των πλασμάτων. Τα κρασιά δίνουν στους μίσχους του roslin και zahisnymi πέπλα των πλασμάτων (Εικ. 160). Zavdyaki yomu ουρές, ουρές και αλογοουρές στέκονται mіtsno, σαν μπαγκέτες, γόστρες που ξεφυλλίζουν κομμένα, σαν μαχαίρια, καλαμάκια σε ένα επικλινές χωράφι, σαν κεφάλι, και κοτσάνια δημητριακών στα χαλάκια του mіtsnі, που δεν επιτρέπουν στα χωράφια με καλαμπόκι στα χωράφια να ξαπλώστε στο ξύλο και τον άνεμο. Λούσκα πλευρό, κοχύλια κώματος, κριλ μετελικά, pir'ya ptahiv і μαλλί πλασμάτων από mіtsnі, oskіlki smite silica.

Mal. 160.
Το οξείδιο του πυριτίου (IV) δίνει ορυκτότητα στους μίσχους του roslin και στις ασφυκτικές καμπύλες των πλασμάτων
Το πυρίτιο Z'ednannya δίνει απαλότητα και απαλότητα στα μαλλιά και τα νύχια ενός ατόμου.
Πυρίτιο για να μπει και στην αποθήκη των κατώτερων ζωντανών οργανισμών - διατόμων και ραδιολαρίων, τα χαμηλότερα στήθη ζωντανής ύλης, σαν να δημιουργούν τις ατέλειές τους πίσω από την ομορφιά του σκελετού με πυρίτιο (Εικ. 161).
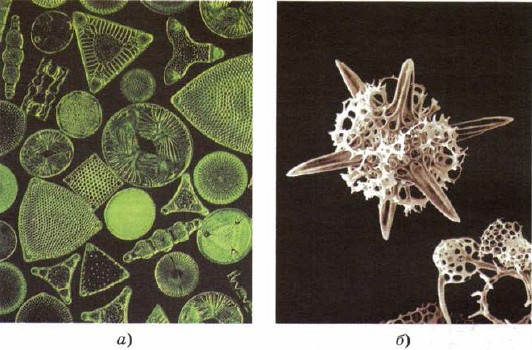
Mal. 161.
Οι σκελετοί των διατόμων (α) και των ραδιολαρίων (β) αποτελούνται από πυρίτιο
Η κυριαρχία του πυριτίου. Χρησιμοποιείτε μικροϋπολογιστή με μπαταρία sony, και έτσι υπάρχει μια ειδοποίηση για το κρυσταλλικό πυρίτιο. Tse napіvprovіdnik. Στο vіdmіnu vіd metalіv, іz pіdvishennyam θερμοκρασία yogo elektroprovіdnіst zbіshuєtsya. Σε δορυφόρους, διαστημόπλοια, σταθμούς και dahah budinkiv (μικρά 162) εγκαθιστούν μπαταρίες sony που μετατρέπουν την ενέργεια της sony σε ηλεκτρική. Η δυσοσμία χρησιμοποιείται για την κατασκευή κρυστάλλων από nap_vprov_dnik_v, και στο πρώτο μαύρο από πυριτόλιθο. Τα φωτοκύτταρα πυριτίου μπορούν να μετατραπούν σε ηλεκτρική ενέργεια έως και 10% της αργιλώδους ενέργειας της sony.

Mal. 162.
Υπνηλία μπαταρία για το περίπτερο dahu
Πυρίτιο για καύση στην οξύτητα, ικανοποιώντας σας με οξείδιο του πυριτίου (IV):
![]()
Όντας μη μεταλλικό, όταν θερμαίνεται, το πυρίτιο συγχωνεύεται με μέταλλα με διαλύματα πυριτίου, για παράδειγμα:
![]()
Τα πυριτίδια απλώνονται εύκολα με νερό ή οξέα, όταν βλέπετε ένα πυρίτιο - σιλάνιο που μοιάζει με νερό:
Στην επιφάνεια των υδατανθράκων, το σιλάνιο στην επιφάνεια αυτοεμπλέκεται και καίγεται με διαλυμένο οξείδιο του πυριτίου (IV) και νερό:
Η αυξημένη αντίδραση μεταξύ σιλανίου και μεθανίου CH 4 εξηγείται από το γεγονός ότι η διαστολή του ατόμου του πυριτίου είναι μεγαλύτερη, χαμηλότερη στον άνθρακα, επομένως οι χημικοί δεσμοί Si-H είναι μικρότεροι, οι δεσμοί C-H είναι χαμηλότεροι.
Το πυρίτιο αλληλεπιδρά με το συμπυκνωμένο νερό των λιβαδιών, δημιουργώντας πυριτικό άλας και νερό:
Το πυρίτιο διαθέτει, παρόμοιο με το οξείδιο του πυριτίου (IV) μαγνήσιο ή άνθρακα:
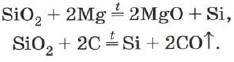
Οξείδιο του πυριτίου (IV), ή διοξείδιο του πυριτίου, ή πυρίτιο SiO 2 yak і CO 2 є όξινο οξείδιο. Ωστόσο, στην επιφάνεια του CO2, υπάρχει ένα μοριακό, αλλά ατομικό, κρυσταλλικό πλέγμα. Για αυτό το SiO 2 είναι σκληρή και ανθεκτική ομιλία. Τα κρασιά δεν διαφέρουν σε οξέα νερού, υδροφθορική κρέμα και αλόη σε υψηλές θερμοκρασίες με λιβάδια με διαλυμένα άλατα πυριτικού οξέος - πυριτικά:
Το πυρίτιο μπορεί επίσης να χρησιμοποιηθεί για το κράμα του οξειδίου του πυριτίου (IV) με οξείδια μετάλλων ή ανθρακικά:
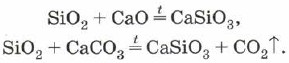
Το πυριτικό νάτριο και το κάλιο ονομάζονται πλάκες λιανικής. Їх παροχή νερού- Είναι καλό να χρησιμοποιείτε πυριτική κόλλα.
Πυριτικό οξύ H 2 SiO 3 (Εικ. 163):
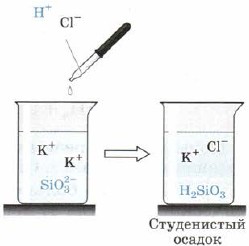
Mal. 163. Αντίδραση οξέος σε πυριτικό ιόν
Επίσης, το H2SiO3 είναι επίσης ένα ασθενές οξύ. Είναι ασυνεπές στο νερό και πέφτει έξω από την αντιδραστική αναταραχή κοιτάζοντας τα κατακάθια της πολιορκίας, που μερικές φορές συμπιέζει ολόκληρο τον όγκο της διαφοράς, μετατρέποντάς τον σε συμπαγή μάζα, πηγαίνω στο ζελέ, ζελέ. Κατά την ανάρτηση του μασί, εγκαθίσταται μια υψηλής πορώδης ομιλία - σιλικαζέλ, η οποία χρησιμοποιείται ευρέως ως προσροφητικό - πηλός άλλων ομιλιών.
Πιστοποιητικό εργαστηρίου Νο 40
Κατοχή πυριτικού οξέος και αυτή η δικαίωση της εξουσίας
Έγχυση πυριτίου. Γνωρίζετε ήδη ότι το πυρίτιο χρησιμοποιείται για την παραγωγή αγώγιμων υλικών, καθώς και ανθεκτικών στα οξέα κραμάτων. Όταν η χαλαζιακή άμμος συντήκεται με μαλλί σε υψηλές θερμοκρασίες, το καρβίδιο του πυριτίου SiC διαλύεται, το οποίο είναι διαθέσιμο μόνο για το διαμάντι. Ως εκ τούτου, είναι απαραίτητο να βιδώσετε για ακόνισμα rіztsіv metalorіzalnyh verstatіv και γυάλισμα ακριβής πέτρας.
Από λιωμένο χαλαζία παρασκευάζονται διάφορα πιάτα χημικού χαλαζία, τα οποία αντέχουν σε υψηλές θερμοκρασίες και δεν ραγίζουν όταν είναι κρύα.
Το πυρίτιο Z'ednannya είναι η βάση για τη στρέβλωση της αποθήκης στο τσιμέντο.
Το σφάλμα Zvichayne μπορεί να είναι αποθήκη, το οποίο μπορεί να εκφραστεί με τον τύπο Na 2 O CaO 6SiO 2. Το Yogo κερδίζεται σε ειδικούς φούρνους με λιωμένη σόδα sumish, vapnyak και piska.
Vіdmіnna ρύζι skla - zdatnіst rozm'yakshuvatisya і στο διογκωμένο λιωμένο χάλυβα είτε είναι μορφή, καθώς σώζεται όταν πιαστεί η αποθήκη. Με βάση τα οποία φτιάχνονται τα σκεύη και τα άλλα σκεύη.
Dodatkovі yakosti sklu δίνουν διαφορετικά πρόσθετα. Έτσι, η εισαγωγή του οξειδίου του μολύβδου μειώνεται σε ένα κρυστάλλινο χρώμα, το οξείδιο του χρωμίου γίνεται πράσινο χρώμα, το οξείδιο του κοβαλτίου είναι μπλε, κ.λπ. (Εικ. 164).

Mal. 164.
Προϊόντα από την αποθήκη χρωμάτων
Ο Σκλό είναι ένας από τους παλαιότερους οινοποιούς του λαού. Ήδη 3-4 πουρνάρια. Για το λόγο αυτό ξέσπασε ο πόλεμος στην Αίγυπτο, τη Συρία, το Φοινίκι και τη Μαύρη Θάλασσα.
Sklo - το ίδιο υλικό δεν είναι λιγότερο από remіsnikіv, αλλά και καλλιτέχνες. Ο κύριος έφτασε στο υψηλότερο επίπεδο τελειότητας Αρχαία Ρώμη, σαν να ήταν σε θέση να αφαιρέσουν τη χρωματική κλίση και το έργο των ψηφιδωτών τους.

Mal. 165.
Χρωματιστό γυαλί στα βιτρό του καθεδρικού ναού της Notre Dame, Chartres
Δημιουργήστε έργα τέχνης από την αποθήκη με obov'yazkovymi χαρακτηριστικά ενός μεγάλου μουσείου, και πολύχρωμα βιτρό παράθυρα της εκκλησίας, μωσαϊκά πάνελ - φωτεινά άκρα αυτού (Εικ. 165). Σε έναν από τους χώρους του παραρτήματος της Ρωσικής Ακαδημίας Επιστημών της Αγίας Πετρούπολης, υπάρχει ένα ψηφιδωτό πορτρέτο του Πέτρου Α', του νικητή M. V. Lomonosov (Εικ. 166).

Mal. 166.
Μωσαϊκό πορτρέτο του Peter I
Οι περιοχές συμφόρησης είναι μάλλον μεγάλες. Tse vikonne, plyashkove, lampov, dzerkalne sklo; οπτική κλίση - από προσοφθάλμιους φακούς έως γυαλιά κάμερας. φακοί αδιάκριτων οπτικών συσκευών - από μικροσκόπια έως τηλεσκόπια.
Το δεύτερο πιο σημαντικό υλικό, οι επικαλύψεις με βάση το πυρίτιο, είναι το τσιμέντο. Το Yogo χρησιμοποιείται για το ψήσιμο του πηλού και του ατμού σε ειδικούς φούρνους που τυλίγονται.
Εάν η σκόνη του τσιμέντου αναμιχθεί με νερό, τότε το τσιμέντο δεν έχει σταθεροποιηθεί, διαφορετικά, όπως λέγεται ξυπνητήρι, το τσιμέντο rozchin, το οποίο είναι βήμα προς βήμα πιο σκληρό. Όταν προσθέτετε σκυρόδεμα σε τσιμέντο, ή θρυμματισμένη πέτρα, το σκυρόδεμα πρέπει να αφαιρείται σαν ένα top coat. Η υλικότητα του σκυροδέματος μεγαλώνει, έτσι ώστε ένα νέο πλαίσιο εισάγεται στο νέο - βγαίνει το χυτό σκυρόδεμα, από το οποίο κατασκευάζονται τα τοιχώματα του πάνελ, μπλοκ επικαλύψεων, γέφυρες φερμί κ.λπ.
Η αποθήκη ασχολείται με την παραγωγή τσιμέντου βιομηχανία πυριτικών. Η Vaughn παράγει επίσης πυριτικά κεραμικά - ceglu, πορσελάνη (μικρά 167), φαγεντιανή και προϊόντα από αυτά.

Mal. 167.
Ποικιλίες πορσελάνης
Vіdkrittya πυρίτιο. Παρόλο που στην αρχαιότητα οι άνθρωποι ήταν ευρέως νικητές στη χρήση του πυριτίου, το ίδιο το πυρίτιο αφαιρέθηκε για πρώτη φορά το 1824 από τον Σουηδό χημικό J. Ya. Berzelius. Ωστόσο, 12 χρόνια πριν από το νέο πυριτόλιθο, οι J. Gay-Lussac και L. Tenard αφαιρέθηκαν, ale vin duzhe zabrudneniy σπίτια.
Το λατινικό όνομα silicum παίρνει το στάχυ του από τη λατινική λέξη silex-fint. Το ρωσικό όνομα "πυρίτιο" μοιάζει με το κρέμα καρυδιάς - "σκελετός, σκελός".
Νέες λέξεις που καταλαβαίνουν
- Φυσικές πηγές πυριτίου: πυρίτιο, χαλαζίας και άλλες ποικιλίες, πυρίτιο, αργιλοπυριτικό, αμίαντος.
- Βιολογική σημασία του πυριτίου.
- Η κυριαρχία του πυριτίου: napіvprovіdnikovі, αλληλεπίδραση με ξινό, μέταλλα, λιβάδια.
- Σιλάνιο.
- Οξείδιο του πυριτίου (IV). Γιόγκα Μπούντοβα και δύναμη: αλληλεπίδραση με λιβάδια, βασικά οξείδια, ανθρακικά και μαγνήσιο.
- Πυριτικό οξύ και άλατα її. Rozchinne slo.
- Zastosuvannya πυρίτιο και yogo μισό.
- Sklo.
- Τσιμέντο.
ονομάστε την ημέρα
Τις περισσότερες φορές στη φύση, το πυρίτιο βρίσκεται σε μορφή πυριτίου - μια βάση που βασίζεται στο διοξείδιο του πυριτίου (IV) SiO 2 (περίπου το 12% της μάζας της ιλαράς της γης). Τα κύρια ορυκτά και πετρώματα που σβήνονται από το διοξείδιο του πυριτίου είναι η αλυσίδα (πλούσιος και χαλαζίας), ο χαλαζίας και ο χαλαζίτης, ο πυριτόλιθος, ο polov_spar. Το πυρίτιο και το αργιλοπυριτικό διπλώνονται σε ένα άλλο για το πλάτος στη φύση.
Σημειώνεται ένα προς ένα το γεγονός της σημασίας του καθαρού πυριτίου στη φυσική του εμφάνιση.
Otrimannya
Το πυρίτιο θα βγει όταν τηγανίζετε τραγανό λευκό pisku (διοξείδιο του πυριτίου) με μαγνήσιο:
S i O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \δεξιό βέλος \ 2MgO+Si)))Σε τι συμβιβάζεσαι άμορφο πυρίτιο , τι μπορεί να μοιάζει με καφέ σκόνη.
Στη βιομηχανία, η τεχνική καθαρότητα του πυριτίου λαμβάνεται με τήξη SiO 2 με οπτάνθρακα σε θερμοκρασία περίπου 1800 ° C σε ορυκτοθερμικούς κλιβάνους του τύπου άξονα. Η καθαρότητα του πυριτίου που αφαιρείται από έναν τέτοιο βαθμό μπορεί να φτάσει το 99,9% (τα κύρια σπίτια είναι άνθρακας, μέταλλο).
Μπορείτε να απομακρυνθείτε από τον καθαρισμό του πυριτίου από τα σπίτια.
- Ο καθαρισμός στις εργαστηριακές τουαλέτες μπορεί να πραγματοποιηθεί με μια διαδρομή της μετωπικής κατοχής πυριτικού μαγνησίου Mg 2 Si. Δώσαμε πυριτικό μαγνήσιο για πρόσθετα υδροχλωρικά ή οξικά οξέα για να αφαιρέσουμε το μονοσιλάνιο SiH 4 που μοιάζει με αέριο. Το μονοσιλάνιο καθαρίζεται με ανόρθωση, ρόφηση και άλλες μεθόδους και στη συνέχεια τοποθετείται σε πυρίτιο και νερό σε θερμοκρασία περίπου 1000 °C.
- Ο καθαρισμός του πυριτίου σε βιομηχανική κλίμακα πραγματοποιείται με μια διαδρομή μη ενδιάμεσης χλωρίωσης του πυριτίου. Με αυτό διαλύονται οι μισές πτυχές της αποθήκης SiCl 4, SiHCl 3 και SiH 2 Cl 2. Їх με ένα διαφορετικό τρόποκαθαρίστε το σπίτι (κατά κανόνα με απόσταξη και δυσαναλογία) και στο τελικό στάδιο προσθέστε καθαρό νερό σε θερμοκρασίες από 900 έως 1100 °C.
- Αναπτύσσονται φθηνότερες, καθαρότερες και πιο αποτελεσματικές βιομηχανικές τεχνολογίες για τον καθαρισμό του πυριτίου. Για το 2010 πριν από αυτά, είναι δυνατόν να εισαχθούν τεχνολογίες για τον καθαρισμό του πυριτίου και του αντικαταστάτη του φθορίου (αντικαθιστά το χλώριο). τεχνολογίες που μεταφέρουν την απόσταξη σε μονοξείδιο του πυριτίου· τεχνολογίες που βασίζονται σε σπίτια από βιτρό που εστιάζουν σε διακρυστάλλινα όρια.
Το Vmіst domіshok στο τελικό πυρίτιο μπορεί να μειωθεί σε 10 -8 -10 -6% ανά μάζα. Περισσότερες αναφορές για τη διατροφή του καθαρού πυριτίου εξετάζονται στο άρθρο Πολυκρυσταλλικό πυρίτιο.
Η μέθοδος απόκτησης πυριτίου σε μια καθαρή εμφάνιση κατακερματισμού από τον Mikola, Mikolayovich Beketov.
Φυσική δύναμη
Το κρυσταλλικό πλέγμα πυριτίου είναι κυβικό με επίκεντρο την όψη σαν διαμάντι, παράμετρος a = 0,54307 nm (στο ψηλή μέγγενηαφαιρέστε άλλες πολυμορφικές τροποποιήσεις στο πυρίτιο), αλλά μέσω ενός μεγαλύτερου δεσμού μεταξύ ατόμων Si-Si σε έναν δεσμό με δεσμό zv'azku S-Sη σκληρότητα του πυριτίου είναι σημαντικά μικρότερη από αυτή του διαμαντιού. Τρίξιμο πυριτίου, μόνο όταν θερμαίνεται στους 800 ° C, γίνεται πλαστική ομιλία. Vіn prozory για infrachervonogo viprominyuvannya s dozhini khvili 1,1 microns. Η υγρή συγκέντρωση της μύτης στο φορτίο είναι 5,81 10 15 m-3 (για θερμοκρασία 300 K).
Ηλεκτροφυσική ισχύς
Το στοιχειώδες πυρίτιο σε μονοκρυσταλλική μορφή είναι ένας αγωγός με έμμεσο διάκενο. Το πλάτος της περιφραγμένης περιοχής στο θερμοκρασία δωματίουαποθήκευση 1,12 eV και σε T \u003d 0 K - 1,21 eV. Η συγκέντρωση των φορέων υγρού φορτίου στο πυρίτιο για τα κανονικά μυαλά γίνεται κοντά στο 1,5·10 10 cm −3.
Με την ηλεκτροτροφική δύναμη του κρυσταλλικού πυριτίου, μια μεγάλη εισροή χτίζει σπίτια που περιφέρονται στο σκοτάδι. Για την εξαγωγή κρυστάλλων πυριτίου με βαθιά αγωγιμότητα, εισάγετε άτομα στοιχείων της ομάδας III στο πυρίτιο, όπως το βόριο, το αλουμίνιο, το γάλλιο και το ίνδιο. Για να εξαγάγετε κρυστάλλους από πυρίτιο με ηλεκτρονική αγωγιμότητα στο πυρίτιο, εισάγετε άτομα στοιχεία V-ї groupi, όπως φώσφορος, mish'yak, surma.
Όταν οι ηλεκτρονικές συσκευές συναρμολογούνται με βάση το πυρίτιο, είναι σημαντικό να προσαρτάται η επιφανειακή σφαίρα στο υλικό (έως δεκάδες μικρά), έτσι ώστε η ποιότητα της επιφάνειας του κρυστάλλου να μπορεί να προστεθεί στην ηλεκτροστατική ισχύ του πυριτίου και, προφανώς, στη δύναμη του έτοιμου εργαλείου. Κατά τη συναρμολόγηση ορισμένων συσκευών, προστίθεται vicorous, εφαρμόζεται στην τροποποίηση της επιφάνειας, για παράδειγμα, η επιφάνεια επικαλύπτεται με πυρίτιο με διάφορους χημικούς παράγοντες και її oprominennya.
Χημική ισχύς
Παρόμοια με τα άτομα άνθρακα, τα άτομα πυριτίου χαρακτηρίζονται από sp 3-υβριδισμό τροχιακών. Στη σύνδεση με τον υβριδισμό, το καθαρό κρυσταλλικό πυρίτιο δημιουργεί κόκκους τύπου διαμαντιού, στους οποίους το πυρίτιο είναι δισθενές. Ταυτόχρονα, ο ήχος του πυριτίου εκδηλώνεται επίσης ως chotivalent στοιχείο με κατάσταση οξείδωσης +4 ή -4. Zustrichayutsya δισθενές μισό πυρίτιο, για παράδειγμα, οξείδιο του πυριτίου (II) - SiO.
Για τα φυσιολογικά μυαλά, το πυρίτιο είναι χημικά ανενεργό και αντιδρά ενεργά μόνο με φθόριο που μοιάζει με αέριο, με το οποίο διαλύεται το πτητικό τετραφθοριούχο πυρίτιο SiF4. Αυτή η «αδράνεια» του πυριτίου οφείλεται στην παθητικοποίηση της επιφάνειας της νανο-μεγέθους μπάλας διοξειδίου του πυριτίου, η οποία καθιζάνει αρνητικά παρουσία ξινής, ξανά και ξανά νερού (υδροατμού).
οξίνιση με το διαλυμένο διοξείδιο SiO 2, η διαδικασία συνοδεύεται από αύξηση του όγκου της σφαίρας διοξειδίου στην επιφάνεια, η σταθερότητα της διαδικασίας οξείδωσης περιορίζεται από τη διάχυση ατομικού οξέος και διοξειδίου κρυοσυντήρησης.
Όταν θερμαίνεται σε θερμοκρασία άνω των 400-500 ° C, το πυρίτιο αντιδρά με χλώριο, βρώμιο και ιώδιο - με την υιοθέτηση εύκολα πτητικών τετρααλογονιδίων SiHal 4 και, πιθανώς, αλογονιδίων σε διπλωμένη αποθήκη.
Με νερό το πυρίτιο χωρίς μέση δεν αντιδρά, αλλά με το νερό το πυρίτιο - το σιλάνιο με τον τύπο Si n H 2n + 2 - έχει έμμεση διαδρομή. Το μονοσιλάνιο SiH 4 (το yogo ονομάζεται συχνά απλά σιλάνιο) εμφανίζεται στην αλληλεπίδραση μεταλλικών πυριτιδίων με οξέα, για παράδειγμα:
C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \δεξιό βέλος \ 2CaCl_(2)+SiH_(4)\ ) επάνω βέλος)))SiH 4 σιλάνιο, το οποίο διαλύεται σε αυτή την αντίδραση, εκδικείται σπίτια και άλλα σιλάνια, ζόκρεμ, Si 2 H 6 δισιλάνιο και Si 3 H 8 τρισιλάνιο, σε ορισμένες λόγχες για άτομα πυριτίου, συνδεδεμένα μεταξύ τους με απλούς δεσμούς (- Si -Si-Si- ) .
Το πυρίτιο αντιδρά με άζωτο και βόριο σε θερμοκρασίες κοντά στους 1000 ° C, διαλύοντας το νιτρίδιο Si 3 N 4 και το θερμικά και χημικά σταθερό βορίδιο SiB 3 , SiB 6 και SiB 12 .
Σε θερμοκρασίες άνω των 1000 ° C, είναι δυνατή η χρήση πυριτίου που είναι το πλησιέστερο ανάλογο στον περιοδικό πίνακα - άνθρακας - καρβίδιο του πυριτίου SiC (καρβορούνδιο), το οποίο χαρακτηρίζεται από υψηλή σκληρότητα και χαμηλή χημική δραστηριότητα. Το καρβορούνδιο χρησιμοποιείται ευρέως ως λειαντικό υλικό. Με αυτό, ωστόσο, η τήξη του πυριτίου (1415 °C) μπορεί να έλθει σε επαφή για τρεις ώρες με τον άνθρακα ενόψει των μεγάλων τεμαχίων πυροσυσσωματωμένου λεπτόκοκκου γραφίτη ισοστατικής συμπίεσης, πρακτικά δεν αλλάζει και δεν παρεμβαίνει στα υπόλοιπα.
Τα κατώτερα στοιχεία της 4ης ομάδας (Ge, Sn, Pb) δεν είναι επικαλυμμένα με πυρίτιο, όπως και τα περισσότερα άλλα μέταλλα. Όταν θερμαίνονται με πυρίτιο και μέταλλα, μπορούν να σχηματιστούν τα μισά κελύφη τους, πυριτίδια. Τα πυριτικά μπορούν να υποδιαιρεθούν σε δύο ομάδες: ιοντικά-ομοιοπολικά (πυριτικά λακκούβας, μέταλλα λακκούβας-γαίας και μαγνήσιο τύπου Ca 2 Si, Mg 2 Si και in) και παρόμοια με μέταλλα (πυριτικά από μεταβατικά μέταλλα). Τα πυριτικά των ενεργών μετάλλων απλώνονται υπό την αραίωση οξέων. Τα πυριτικά που μοιάζουν με μέταλλα έχουν υψηλό σημείο τήξης (έως 2000 °C). Συχνότερα χρησιμοποιούνται αποθήκες πυριτιοκτόνων που μοιάζουν με μέταλλο ΜουΣι, Μου 3Si2, Μου 2 Si 3, Μου 5 Si 3 i Μου Si 2. Τα πυριτικά που μοιάζουν με μέταλλα είναι χημικά αδρανή, ανθεκτικά στην ξινίλα σε υψηλές θερμοκρασίες.
Είναι ιδιαίτερα σημαντικό να σημειωθεί ότι το πυρίτιο σφραγίζει το ευτηκτικό άθροισμα, που επιτρέπει την αιχμή (τήξη) των υλικών για τη σφράγιση των κεραμικών σιδηροπυριτίου σε θερμοκρασίες αισθητά χαμηλότερες, χαμηλότερες από τη θερμοκρασία τήξης της σφράγισης και του πυριτίου.
Κατά την προσθήκη SiO 2 σε πυρίτιο σε θερμοκρασίες άνω των 1200 ° C, διαλύεται το οξείδιο του πυριτίου (II) - SiO. Αυτή η διαδικασία υποστηρίζεται συνεχώς από την παραγωγή κρυστάλλων με μεθόδους πυριτίου
Το πυρίτιο στην πρώτη γραμμή των οραμάτων το 1811. Οι J.Gay-Lussac και L.Tenar όταν περνούν ατμούς φθοριούχου πυριτίου πάνω από μέταλλο καλίου, οι πρωτεΐνες δεν περιγράφονται από αυτούς ως στοιχείο. Ο Σουηδός χημικός J. Berzelius το 1823 δίνοντας περιγραφή του πυριτίου που αφαιρέθηκε από αυτόν κατά την επεξεργασία του άλατος καλίου K 2 SiF 6 με μεταλλικό κάλιο σε υψηλή θερμοκρασία. Το νέο στοιχείο ονομάστηκε «πυρίτιο» (λατ. silex - πυριτόλιθος). Η ρωσική ονομασία «πυρίτιο» εισήχθη το 1834 από τον Ρώσο χημικό Herman Ivanovich Hess. Στη μετάφραση άλλων ελληνικών. krhmnoz- Κουτ, βουνό.
Γνώση στη φύση, otrimannya:
Στη φύση, το πυρίτιο βρίσκεται σε δονούμενο διοξείδιο και πυριτικά σε διαφορετική αποθήκη. Το φυσικό διοξείδιο του πυριτίου είναι πιο σημαντικό με τη μορφή χαλαζία, θέλοντας να χρησιμοποιήσει άλλα ορυκτά - κριστοβαλίτης, τριδυμίτης, φάλαινα, κουσίτης. Το άμορφο πυρίτιο συσσωρεύεται σε κοιτάσματα διατόμων στον πυθμένα των θαλασσών και των ωκεανών - αυτά τα κοιτάσματα εγκαταστάθηκαν με SiO 2, εισέρχονται στην αποθήκη διατόμων και άλλων βλεφαρίδων.
Το πυρίτιο Vilniy μπορεί να χρησιμοποιηθεί για ψήσιμο με τραγανό λευκό pisku μαγνησίου, το οποίο για μια χημική αποθήκη μπορεί να καθαριστεί με οξείδιο του πυριτίου SiO 2 + 2Mg = 2MgO + Si. Στη βιομηχανία, η τεχνική καθαρότητα του πυριτίου λαμβάνεται με τήξη SiO 2 με οπτάνθρακα σε θερμοκρασία περίπου 1800 ° C σε καμίνους τόξου. Η καθαρότητα του πυριτίου που λαμβάνεται από μια τέτοια κατάταξη μπορεί να φτάσει το 99,9% (τα κύρια σπίτια είναι άνθρακας, μέταλλο).
Φυσικές δυνάμεις:
Το άμορφο πυρίτιο μπορεί να μοιάζει με καφέ σκόνη, το πάχος της οποίας είναι πιο πυκνό 2,0 g / cm 3. Κρυσταλλικό πυρίτιο - σκούρο γκρι, αστραφτερή κρυσταλλική ομιλία, κρυσταλλωμένη και σκληρή, κρυσταλλώνεται σε διαμάντια. Αυτός είναι ένας τυπικός αγωγός (είναι καλύτερο να αγώγετε ηλεκτρισμό, χαμηλότερο ελαστικό τύπου μονωτή και υψηλότερο για αγωγό - μεσαίο). Τρίξιμο πυριτίου, μόνο όταν θερμαίνεται στους 800 ° C, γίνεται πλαστική ομιλία. Cіkavo, scho πυριτικό prosorium έως infrachervony viprominyuvannya, που ξεκινά με μακρύ άνεμο 1,1 microns.
Χημική ισχύς:
Χημικά πυρίτιο χαμηλής ενεργότητας. Σε θερμοκρασία δωματίου, αντιδρά μόνο με αέριο φθόριο, το πτητικό τετραφθοριούχο πυρίτιο SiF 4 διαλύεται σε αυτή τη θερμοκρασία. Όταν θερμαίνεται σε θερμοκρασία 400-500 ° C, το πυρίτιο αντιδρά με οξύ με διαλυμένο διοξείδιο, με χλώριο, βρώμιο και ιώδιο - με διαλυμένα εύκολα πτητικά τετρααλογονίδια SiHal 4 . Σε θερμοκρασίες κοντά στους 1000 ° C, το πυρίτιο αντιδρά με άζωτο για να διαλύσει το νιτρίδιο Si 3 N 4 με το βόριο - θερμικά και χημικά σταθερό βορίδιο SiB 3, SiB 6 και SiB 12. Με το νερό το πυρίτιο δεν αντιδρά χωρίς ενδιάμεσο.
Για τη χάραξη με πυρίτιο, το άθροισμα υδροφθορικού και νιτρικού οξέος χρησιμοποιείται ευρέως.
Στήστε στα λιβάδια.
Το πυρίτιο χαρακτηρίζεται από ένα βήμα οξείδωσης +4 ή -4.
Τα πιο σημαντικά πεδία:
Διοξείδιο του πυριτίου, SiO 2- (ανυδρίτης πυριτίου) ...
...
Πυριτικά οξέα- αδύναμο, δυσδιάκριτο, utvoryuyuyutsya όταν προσθέτετε οξύ στο μέγεθος του πυριτικού άλατος μοιάζει με τζελ (ομιλία που μοιάζει με ζελατίνη). Το H 4 SiO 4 (ορθο-πυρίτιο) και το H 2 SiO 3 (μετα-πυρίτιο ή πυρίτιο) είναι γνωστό ότι ποικίλλουν και μετατρέπονται αμετάκλητα σε SiO 2 όταν θερμαίνονται και ξηραίνονται. Στερεό πορώδες προϊόν για είσοδο - silica gelμπορεί να ανοίξει στην επιφάνεια και να είναι ιξώδες ως προσροφητικό αερίων, ξηραντικός παράγοντας, καταλύτης και καταλύτης φθοράς.
πυριτικό άλας- τα άλατα των καλών πυριτικών οξέων (πυριτικά άλατα νατρίου και καλίου) δεν είναι διαλυτά στο νερό. εξουσία.
Καταρράκτες- ανάλογα υδατανθράκων, σιλάνι, με μισή καρδιά, σε μερικά άτομα πυριτίου με έναν μόνο δεσμό, δύναμη yakscho άτομο πυρίτιο z'єdnаnі podvіyny zv'yazkom. Οι λόγχες και τα kiltsya χρησιμοποιούνται παρόμοια με τους υδατάνθρακες. Όλες οι δυνάμεις μπορούν να αυτοαπασχοληθούν, να δημιουργήσουν δονήσεις με την επανάληψη και να αντιδράσουν εύκολα με το νερό.
Zastosuvannya:
Η πιο σημαντική ποσότητα πυριτίου είναι γνωστή για την επιλογή κραμάτων για την εφαρμογή αλουμινίου, χαλκού και μαγνησίου και για την επιλογή σιδηροπυριτικών, τα οποία μπορεί να είναι σημαντικά για την επιλογή χάλυβα και εξοπλισμού θέρμανσης. Κρύσταλλοι πυριτίου zastosovuyut μπαταρίες sonyκαι napіvprovіdnikovich βοηθητικά κτίρια - τρανζίστορ και δίοδοι. Το πυρίτιο χρησιμεύει επίσης ως syrovina για την παραγωγή πλακών οργανοπυριτίου ή σιλοξανών, χρώσης με λάδι, λάδι, πλαστικά και συνθετικά καουτσούκ. Ανόργανοι γυμνοσάλιαγκεςΤο silicon vicorist χρησιμοποιείται στην τεχνολογία κεραμικών και χάλυβα, ως μονωτικό υλικό και πεζοκρύσταλλοι
Για ορισμένους οργανισμούς, το πυρίτιο είναι ένα σημαντικό βιογενές στοιχείο. Vіn εισέλθουν στην αποθήκη των υποστηρικτικών καλύβων στο roslin και skeletal - στα πλάσματα. Οι θαλάσσιοι οργανισμοί –διάτομα, άλγη, ραδιολάρια, σφουγγάρια– συγκεντρώνονται σε μεγάλες περιοχές πυριτίου. Υπέροχα νούμερααλογοουρές και δημητριακά συμπυκνώνονται με πυρίτιο, στο πρώτο μαύρο - μπαμπού και ρύζι-όπως pidrodins, μεταξύ αυτών - φύτευση ρυζιού. M'yazova ιστού ενός ατόμου για εκδίκηση (1-2) 10 -2% πυρίτιο, οστικός ιστός - 17 10 -4%, αίμα - 3,9 mg / l. Ωστόσο, έως και 1 g πυριτίου μπορεί να εισαχθεί στο σώμα ενός ατόμου σήμερα.
Antonov S.M., Tomilin K.G.
HF Tyumen State University, ομάδα 571.
