Γενετικές σειρές παραδειγμάτων μη-μετάλλων. Γενετική σχέση μεταξύ κατηγοριών ουσιών - Hypermarket γνώσης
Υπάρχει μια γενετική σύνδεση μεταξύ απλών ουσιών, οξειδίων, βάσεων, οξέων και αλάτων, δηλαδή η δυνατότητα της αμοιβαίας μετάβασης (μετασχηματισμού).
Για παράδειγμα, μια απλή ουσία - το ασβέστιο ως αποτέλεσμα της αλληλεπίδρασης με το οξυγόνο μετατρέπεται σε ένα οξείδιο: 2Ca + O2 = 2CaO.
οξειδίου του ασβεστίου με αντίδραση με νερό, σχηματίζει υδροξείδιο του ασβεστίου CaO + Η2Ο = Ca (OH) 2, και το τελευταίο με αντίδραση με ένα οξύ μετατρέπεται σε ένα άλας: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
Αυτοί οι μετασχηματισμοί μπορούν να αναπαρασταθούν από το σχήμα:
Ca → CaO → Ca (OH) 2 → CaS04
Ένα παρόμοιο σχήμα μπορεί να γραφτεί για μη μεταλλικά, για παράδειγμα, θείο:
S → SO3 → H2SO4 → CaSO4
Έτσι, το ίδιο άλας λαμβάνεται με διάφορους τρόπους.
Είναι επίσης δυνατή η αντίστροφη μετάβαση από το αλάτι σε άλλες κατηγορίες ανόργανων ενώσεων και απλών ουσιών:
CuS04 → Cu (OH) 2 - CuO - Cu
CuS04 + 2ΝaΟΗ = Cu (ΟΗ) 2 + + Na2S04
Cu (ΟΗ) 2 = CuO + Η2Ο
CuO + Η2 = Cu + Η2Ο (αναγωγή χαλκού)
Μια παρόμοια σχέση μεταξύ κατηγοριών ανόργανων ενώσεων, με βάση την παραγωγή ουσιών μιας τάξης από τις ουσίες μιας άλλης, ονομάζεται γενετική.
Οι ιδιότητες των σύνθετων ενώσεων αντικατοπτρίζονται στο γενετικό σχήμα των κύριων κατηγοριών ανόργανων ενώσεων (βλέπε σχήμα). Αντικατοπτρίζει τα στάδια ανάπτυξης ανόργανων υλικών κατά μήκος δύο κύριων γραμμών, από τυπικά μέταλλα έως τυπικά μη μέταλλα με αντίθετες ιδιότητες.
Μέταλλα των οποίων η χημική ιδιότητα ενός ατόμου είναι η ικανότητα να δωρίζουν ηλεκτρόνια και μη μέταλλα, η κύρια χημική ιδιότητα της οποίας είναι η ικανότητα των ατόμων τους να συνδέουν ηλεκτρόνια αντίθετα μεταξύ τους σε ιδιότητες. Με την επιπλοκή της σύνθεσης των ουσιών, αυτές οι αντιτιθέμενες τάσεις συνεχίζουν να εμφανίζονται.
Τυπικά μέταλλα και μεταβατικά στοιχεία στη χαμηλότερη κατάσταση οξείδωσης σχηματίζουν τα βασικά οξείδια, ενώ τυπικά μη-μέταλλα και μεταβατικά στοιχεία στην υψηλή κατάσταση οξείδωσης σχηματίζουν τα αντίθετα όξινα οξείδια.
Απλές ουσίες
Amphoteric
Μη μεταλλικά
Βασικά οξείδια
Amphoteric
Οξικό
Λόγοι
Amphoteric
υδροξείδια
Γενετικό σχήμα των κύριων κατηγοριών ανόργανων ενώσεων
Με περαιτέρω επιπλοκή της σύνθεσης των ουσιών, σχηματίζονται υδροξείδια, τα οξείδια βάσης που αντιστοιχούν στη βάση και τα όξινα οξείδια που αντιστοιχούν στο οξύ. Οι βάσεις αντίθετες στις ιδιότητες και το οξύ αντιδρούν ενεργά μεταξύ τους σχηματίζοντας άλατα. Η αλληλεπίδραση των αντιθέτων είναι η κινητήρια δύναμη της αντίδρασης. Συνεπώς, τα βασικά και όξινα οξείδια, βάσεις και οξέα αλληλεπιδρούν ενεργά μεταξύ τους και δύο όξινα οξείδια ή δύο βασικά οξείδια δεν αλληλεπιδρούν, καθώς οι ιδιότητές τους είναι κοντά.
Έτσι, οι ιδιότητες μιας σύνθετης ένωσης προσδιορίζονται με βάση τις ιδιότητες των συστατικών στοιχείων της. Οι κύριοι νόμοι αλλαγής αυτών των ιδιοτήτων συνοψίζονται στις ακόλουθες εφαρμογές (Πίνακας 6).
1. Σε περιόδους με αύξηση του αριθμού ακολουθίας, οι ιδιότητες των στοιχείων αλλάζουν από μεταλλικά σε μη μεταλλικά. Ο αριθμός των ηλεκτρονίων στο εξωτερικό επίπεδο αυξάνεται, ο βαθμός οξείδωσης του στοιχείου αυξάνεται, η ακτίνα του ατόμου και των ιόντων μειώνεται, η ενέργεια ιονισμού και η συγγένεια για την αύξηση των ηλεκτρονίων. Σύμφωνα με αυτό, οι βασικές μειώσεις και οι όξινες ιδιότητες των οξειδίων και των υδροξειδίων αυξάνονται.
2. Στις κύριες υποομάδες, οι βασικές ιδιότητες των οξειδίων και των υδροξειδίων αυξάνονται με τον αυξανόμενο ατομικό αριθμό. Για στοιχεία πλευρικών ομάδων με αύξηση του αριθμού ακολουθίας, μια πιο πολύπλοκη αλλαγή ιδιοτήτων είναι χαρακτηριστική. Κατ 'αρχάς, οι μεταλλικές ιδιότητες ενισχύονται και στη συνέχεια μειώνονται.
3. Τα ενεργά μέταλλα αντιστοιχούν σε οξείδια και υδροξείδια με ισχυρές βασικές ιδιότητες. Τα πιο ενεργά μέταλλα είναι αλκάλια και αλκαλικές γαίες. Δημιουργούν υδατοδιαλυτά οξείδια και ισχυρές διαλυτές βάσεις - αλκάλια.
4. Τα χαμηλά ενεργά μέταλλα (όλα αλκαλικά και αλκαλικά) σχηματίζουν αδύναμες βάσεις που είναι δύσκολο να διαλυθούν στο νερό:
Cu (ΟΗ) 2, Fe (ΟΗ) 3.
5. Οξείδια και υδροξείδια με έντονα έντονα όξινα χαρακτηριστικά αντιστοιχούν σε ενεργά μη μέταλλα.
6. Τα αμφοτερικά μέταλλα σχηματίζουν αμφοτερικά οξείδια και υδροξείδια.
7. Εάν ένα στοιχείο παρουσιάζει διαφορετικούς βαθμούς οξείδωσης, τότε αντιστοιχούν οξείδια και υδροξείδια με διαφορετικές ιδιότητες.
Θέμα: ΓΕΝΕΤΙΚΗ ΣΥΝΔΕΣΗ ΜΕΤΑΞΥ ΜΕΤΑΛΛΩΝ και μη-μετάλλων και των ενώσεών τους. 9η τάξη
Στόχοι: εκπαιδευτικό: να εδραιωθεί η έννοια των "γενετικών σειρών", "γενετικής σύνδεσης" · διδάσκουν πώς να δημιουργήσουν γενετικές σειρές στοιχείων (μέταλλα και μη μέταλλα), για να διαμορφώσουν τις εξισώσεις αντίδρασης που αντιστοιχούν στις γενετικές σειρές. ελέγξτε πώς μαθαίνεται η γνώση χημικές ιδιότητες οξέα, οξέα, άλατα, βάσεις · ανάπτυξη: ανάπτυξη της ικανότητας να αναλύονται, να συγκρίνονται, να συνοψίζονται και να εξάγονται συμπεράσματα, να συντίθενται οι εξισώσεις χημικών αντιδράσεων. εκπαιδευτικό: να προωθήσει τη διαμόρφωση μιας επιστημονικής κοσμοθεωρίας.
Παρέχοντας τάξεις: πίνακες "Περιοδικό σύστημα", "Πίνακας διαλυτότητας", "Σειρά Δραστηριοτήτων Μέταλλα", οδηγίες για μαθητές, εργασίες για τη δοκιμή γνώσεων.
Πρόοδος: 1) Org. τη στιγμή
2) Ελέγξτε d / s
3) Μελετήστε νέο υλικό
4) Στερέωση
5) D / C
1) Org. τη στιγμή. Χαιρετισμούς
2) Ελέγξτε d / s.
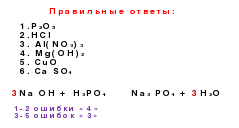
Οι γενετικές συνδέσεις είναι διασυνδέσεις μεταξύ διαφορετικών κατηγοριών με βάση τις μεταξύ τους μετατροπές.
Γνωρίζοντας τις κατηγορίες ανόργανων ουσιών, είναι δυνατόν να δημιουργήσουμε τη γενετική σειρά των μετάλλων και των μη-μετάλλων. Η βάση αυτών των σειρών είναι το ίδιο στοιχείο.
Μεταξύ των μετάλλων υπάρχουν δύο τύποι σειρών:
1
. Μια γενετική σειρά στην οποία το αλκάλιο δρα ως βάση. Αυτή η σειρά μπορεί να αναπαρασταθεί χρησιμοποιώντας τους ακόλουθους μετασχηματισμούς:μέταλλο → βασικό οξείδιο → αλκάλιο → αλάτι
Για παράδειγμα, K → K
2 O → ΚΟΗ → ΚΟΙ2
. Η γενετική σειρά, όπου η βάση είναι μια αδιάλυτη βάση, τότε η σειρά μπορεί να εκπροσωπείται ως μια αλυσίδα μετασχηματισμών:μέταλλο → οξείδιο βάσης → αλάτι → αδιάλυτη βάση →
→βασικό οξείδιο → μέταλλο
Για παράδειγμα, Cu → CuO → CuCl
2 → Cu (ΟΗ) 2 → CuO → Cu
1
. Η γενετική σειρά των μη-μετάλλων, όπου το διαλυτό οξύ δρα ως σύνδεσμος στη σειρά. Η αλυσίδα μετασχηματισμών μπορεί να αναπαρασταθεί ως εξής:μη-μέταλλο → όξινο οξείδιο → διαλυτό οξύ → άλας
Για παράδειγμα, P → P
2 Ο 5 → H 3 PO 4 → Na 3 PO 42
. Η γενετική σειρά των μη-μετάλλων, όπου το αδιάλυτο οξύ δρα ως σύνδεσμος στη σειρά:μη μέταλλο → όξινο οξείδιο → άλας → οξύ →
→οξείδιο οξέος → μη μέταλλο
Για παράδειγμα
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si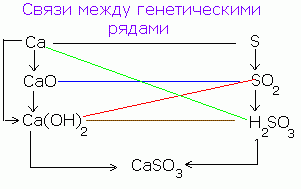
Μετωπική συνομιλία σχετικά με:
Τι είναι μια γενετική σύνδεση; Οι γενετικές συνδέσεις είναι διασυνδέσεις μεταξύ διαφορετικών κατηγοριών με βάση τις αλληλομετατροπές τους.
Γενετικές σειρές - μια σειρά ουσιών - εκπρόσωποι διαφορετικών τάξεων, οι οποίες είναι ενώσεις ενός χημικού στοιχείου, που συνδέονται με αλληλομετατροπές και αντανακλούν τις μετασχηματισμούς αυτών των ουσιών. Η βάση αυτών των σειρών είναι το ίδιο στοιχείο.
Ποια είδη γενετικών σειρών μπορούν να διακριθούν; Μεταξύ των μετάλλων, μπορούν να διακριθούν δύο τύποι σειρών:
α) Μια γενετική σειρά στην οποία το αλκάλιο δρα ως βάση. Αυτή η σειρά μπορεί να αναπαρασταθεί χρησιμοποιώντας τους ακόλουθους μετασχηματισμούς:
μέταλλο → βασικό οξείδιο → αλκάλιο → αλάτι
για παράδειγμα, η γενετική σειρά του καλίου Κ → Κ
2 O → ΚΟΗ → ΚΟΙβ) Η γενετική σειρά, όπου η βάση είναι μια αδιάλυτη βάση, τότε η σειρά μπορεί να εκπροσωπείται ως μια αλυσίδα μετασχηματισμών:
μέταλλο → οξείδιο βάσης → αλάτι → αδιάλυτη βάση → οξείδιο βάσης → μέταλλο
για παράδειγμα: Cu → CuO → CuCl
2 → Cu (ΟΗ) 2 → CuO → CuΜεταξύ των μη-μετάλλων είναι επίσης δυνατή η διάκριση δύο τύπων σειρών:
α) Η γενετική σειρά των μη-μετάλλων, όπου το διαλυτό οξύ δρα ως σύνδεσμος στη σειρά. Η αλυσίδα των μετασχηματισμών μπορεί να αναπαρασταθεί ως εξής: μη-μέταλλο → όξινο οξείδιο → διαλυτό οξύ → άλας.
Για παράδειγμα: P → P
2 Ο 5 → H 3 PO 4 → Na 3 PO 4β) Γενετική σειρά μη-μετάλλων, όπου αδιάλυτο οξύ: μη μέταλλο → όξινο οξείδιο → άλας → οξύ → οξείδιο οξέος → μη μέταλλο ενεργεί ως σύνδεσμος στη σειρά
Για παράδειγμα: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiΕκτέλεση εργασιών για επιλογές:
1. Επιλέξτε τους τύπους οξειδίων στην έκδοση σας, εξηγήστε την επιλογή σας, με βάση τη γνώση των χαρακτηριστικών της σύνθεσης αυτής της κατηγορίας ενώσεων. Καλέστε τους.
2. Στη στήλη του τύπου της παραλλαγής σας, βρείτε τους τύπους οξέων και εξηγήστε την επιλογή σας με βάση την ανάλυση της σύνθεσης αυτών των ενώσεων.
3. Προσδιορίστε τα σθένη των υπολειμμάτων οξέος στην σύνθεση οξέων.
4. Επιλέξτε τύπους αλάτων και ονομάστε τους.
5. Συμπληρώστε τους τύπους των αλάτων, τα οποία μπορούν να σχηματιστούν με μαγνήσιο και οξέα της παραλλαγής σας. Γράψτε τα, ονομάστε τα.
6. Στη στήλη του τύπου της παραλλαγής σας, βρείτε τους τύπους βάσης και εξηγήστε την επιλογή σας με βάση την ανάλυση της σύνθεσης αυτών των ενώσεων.
7. Στην παραλλαγή σας, επιλέξτε τους τύπους των ουσιών με τις οποίες μπορεί να αντιδράσει ένα διάλυμα ορθοφωσφορικού οξέος (υδροχλωρικό, θειικό). Κάντε τις κατάλληλες εξισώσεις αντίδρασης.
9. Μεταξύ των τύπων της επιλογής σας, επιλέξτε τύπους ουσιών που μπορούν να αλληλεπιδρούν μεταξύ τους. Κάντε τις κατάλληλες εξισώσεις αντίδρασης.
10. Κάντε μια αλυσίδα γενετικών δεσμών ανόργανων ενώσεων, οι οποίες θα περιλαμβάνουν μια ουσία, ο τύπος της οποίας δίνεται στην έκδοση σας στο νούμερο ένα.
Επιλογή 1
Επιλογή 2
Cao
Hno
3Fe (ΟΗ)
3Ν
2 ΟZn (NO
3 ) 2Cr (ΟΗ)
3H
2 Έτσι 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 Ο 5NaOH
Zno
CO
2BaCl
2ΗΟΙ
H
2 CO 3H
2 Έτσι 4Cuso
4Από αυτές τις ουσίες δημιουργεί μια γενετική γραμμή χρησιμοποιώντας όλους τους τύπους. Γράψτε τις εξισώσεις αντίδρασης με τις οποίες μπορείτε να ολοκληρώσετε αυτή την αλυσίδα μετασχηματισμών:
I επιλογή: ZnSO
4, Ζη, ΖηΟ, Ζη, Ζη (ΟΗ) 2 : ΙΙ επιλογή:Na 2 Έτσι 4, NaOH, Na, Na 2 Ο 2 , Na 2 Ο4) Στήριξη1.
Αλ→ Αλ 2 Ο 3 → AlCl 3 → Αλ( OH) 3 → Αλ 2 Ο 32.
P→ P 2 Ο 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Ζη (ΟΗ) 2 → ZnO → Zn (NO 3 ) 24. Cu - CuO - CuCl
2 → Cu (ΟΗ) 2 → CuO → Cu5.N
2 Ο 5 → HNO 3 → Fe (ΟΧΙ 3 ) 2 → Fe (ΟΗ) 2 → FeS → FeSO 45) Μαθηματικά:
καταγράψτε μια βαθμιαία μετάβαση από ασβέστιο σε ανθρακικό ασβέστιο και προετοιμάστε μια έκθεση σχετικά με τη χρήση οποιουδήποτε άλατος στην ιατρική (χρησιμοποιώντας επιπλέον βιβλιογραφία).

Μεταξύ των μετάλλων, μπορούν να διακριθούν δύο τύποι σειρών: 1. Γενετικές σειρές, στις οποίες το αλκάλιο λειτουργεί ως βάση. Αυτή η σειρά μπορεί να αναπαρασταθεί από τους ακόλουθους μετασχηματισμούς: μέταλλο - βασικό οξείδιο - αλκαλικό άλας, για παράδειγμα, η γενετική σειρά του καλίου K - K 2 O - KOH - KCl.

2. Μια γενετική σειρά, όπου μια αδιάλυτη βάση λειτουργεί ως βάση, τότε η σειρά μπορεί να εκπροσωπείται ως μια αλυσίδα μετασχηματισμών: μέταλλο - βασικό οξείδιο - άλας - αδιάλυτο βάσης - βασικό οξείδιο - μέταλλο. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e Cu γενετική σειρά χαλκού Η γενετική σειρά, όπου η βάση είναι μια αδιάλυτη βάση, τότε η σειρά μπορεί να εκπροσωπείται ως μια αλυσίδα μετασχηματισμών: οξείδιο μετάλλου - βάσης - άλατος - αδιάλυτη βάση - το κύριο οξείδιο είναι μέταλλο. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Μια γενετική σειρά, όπου μια αδιάλυτη βάση λειτουργεί ως βάση, τότε η σειρά μπορεί να εκπροσωπείται ως μια αλυσίδα μετασχηματισμών: μέταλλο - βασικό οξείδιο - άλας - αδιάλυτο βάσης - βασικό οξείδιο - μέταλλο. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Μεταξύ των μη-μετάλλων είναι επίσης δυνατή η διάκριση δύο τύπων σειρών: 1. Η γενετική σειρά των μη-μετάλλων, όπου το διαλυτό οξύ δρα ως σύνδεσμος στη σειρά. Η αλυσίδα μετασχηματισμών μπορεί να αναπαρασταθεί ως εξής: μη μεταλλικό οξείδιο - διαλυτό οξύ - σόλ. Ρ-Ρ2Ο5-Η3ΡΟ4-Να3ΡΟ4. 4. Φωσφορικό γενετικό εύρος

Υπάρχει ένας γενετικός δεσμός μεταξύ των κατηγοριών ανόργανων ενώσεων. Από απλές ουσίες μπορείτε να πάρετε πολύπλοκες και αντίστροφα. Από ενώσεις μιας τάξης, μπορείτε να πάρετε ενώσεις μιας άλλης τάξης.
Απλοποιημένη γενετική σχέση μεταξύ κατηγοριών ανόργανων ενώσεων μπορεί να αναπαρασταθεί από το ακόλουθο σχήμα:
Η ακολουθία τέτοιων μετασχηματισμών για μη-μέταλλα μπορεί να αναπαρασταθεί από το ακόλουθο σχήμα: CANPO 4
Ρ → Ρ 2 Ο 5 → Η 3 ΡΟ 4 → Ca 3 (ΡΟ 4) 2
(Saon) 3 PO 4
Για τυπικά μέταλλα μπορείτε να κάνετε την ακόλουθη αλυσίδα μετασχηματισμών:
Ba → BaO → Ba (OH) 2 → BaS04
Για τα μέταλλα των οποίων τα οξείδια και τα υδροξείδια είναι αμφοτερικά (ημιμεταλλικά), μπορούν να πραγματοποιηθούν οι ακόλουθοι μετασχηματισμοί:
Al → Al2O3 → Al (OH) 3 → Na → AlCl3 → AlOHCl2 → Al (OH) 3 → Al2O3.
Σύνδεσμοι μεταξύ κατηγοριών:
1. Μέταλλα, μη μέταλλα→ αλάτι.
Με την άμεση αλληλεπίδραση μετάλλων και μη-μετάλλων, σχηματίζονται άλατα οξέων ελεύθερων οξυγόνου (αλογονίδια, σουλφίδια)
2Na + C1 2 = 2NaCl
Αυτές οι ενώσεις είναι σταθερές και δεν αποσυντίθενται όταν θερμαίνονται.
2. Βασικά οξείδια, όξινα οξέα→ αλάτι.
CaO + CO2 = CaC03.
Na20 + SO3 = Na2S04.
3. Βάσεις, οξέα→ αλάτι.
Διεξάγεται μέσω αντίδρασης εξουδετέρωσης:
2NaOH + H2S04 = Na2S04 + 2Η2Ο,
HE - + Η + -\u003e Η20;
Mg (ΟΗ) 2 + 2ΗCl = MgCl2 + 2Η2Ο,
Mg (ΟΗ) 2 + 2Η + · Mg2 + + 2Η2Ο.
4. Μέταλλα→ βασικά οξείδια.
Τα περισσότερα μέταλλα αλληλεπιδρούν με το οξυγόνο και σχηματίζουν οξείδια:
2Ca + 02 = 2CaO;
4Α1 + 3Ο2 = 2Α1 2Ο3.
Ο χρυσός, ο ασήμι, η πλατίνα και άλλα ευγενή μέταλλα δεν αλληλεπιδρούν με το οξυγόνο, τα οξείδια αυτών των μετάλλων αποκτώνται έμμεσα.
5. Μη μέταλλα→ οξείδια οξέως.
Τα μη μέταλλα (με εξαίρεση τα αλογόνα και τα ευγενή αέρια) αλληλεπιδρούν με το οξυγόνο, σχηματίζοντας οξείδια:
4P + 502 = 2Ρ2Ο5;
S + O2 = SO2.
6. Βασικά οξείδια→ λόγους.
Άμεση αλληλεπίδραση με το νερό μπορεί να επιτευχθεί μόνο υδροξείδια αλκαλίων και μετάλλων αλκαλικών γαιών (αλκαλίων):
Na20 + Η2Ο = 2ΝaΟΗ;
CaO + Η2Ο = Ca (ΟΗ) 2.
Οι υπόλοιποι λόγοι προκύπτουν έμμεσα.
7. Οξείδια οξέων→ οξύ.
Τα οξείδια του οξέος αντιδρούν με νερό για να σχηματίσουν τα αντίστοιχα οξέα:
SO3 + Η2Ο = H2S04;
Ρ2Ο5 + 3Η2Ο = 2Η3ΡΟ4.
Η εξαίρεση είναι το SiO 2, το οποίο δεν αντιδρά με το νερό.
8. Βάσεις, όξινα οξείδια→ αλάτι.
Τα αλκάλια αλληλεπιδρούν με όξινα οξείδια για να σχηματίσουν άλατα:
2NaOH + SO3 = Na2S04 + Η2Ο,
2ΟΗ - + SO3 = SO4 2- + Η20;
Ca (ΟΗ) 2 + ΟΟ2 = CaC03 ↓ + Η2Ο,
Ca2 + + 2ΟΗ - + C02 - CaCO3 ↓ + Η2Ο.
9. Οξέα, βασικά οξείδια→ αλάτι.
Τα οξείδια μετάλλων διαλύονται σε οξέα, σχηματίζοντας άλατα:
CuO + H2S04 = CuS04 + Η2Ο,
CuO + 2H + = Cu2 + + Η20;
Na2O + 2HS1 = 2NaCl + Η2Ο,
Na2O + 2H + = 2Na + + Η2Ο.
10. Λόγοι→ βασικά οξείδια.
Οι αδιάλυτες βάσεις και το LiOH αποσυντίθενται όταν θερμαίνονται:
2LiOH = Li20 + Η2Ο.
Cu (ΟΗ) 2 = CuO + Η2Ο.
11. Οξέα→ οξείδια οξέως.
Τα ασταθή οξυγονούχα οξέα αποσυντίθενται όταν θερμαίνονται (H2SiO3) και ακόμη και χωρίς θέρμανση (H2C03, HClO). Ταυτόχρονα, ορισμένα οξέα είναι ανθεκτικά στη θέρμανση (H2S04, H3PO4).
Η2Si03 = Η2Ο + Si02;
Η2ΟΟ3 = Η2Ο + C02.
12. Οξείδια μετάλλων→ μέταλλα.
Μερικά οξείδια βαρέων μετάλλων μπορούν να αποσυντεθούν σε μέταλλο και οξυγόνο:
2HgO = 2Hg + 02.
Επίσης, τα μέταλλα λαμβάνονται από τα αντίστοιχα οξείδια με τη βοήθεια μειωτικών παραγόντων:
3MnO2 + 4Al = 3Mn + 2A1203;
Fe2O3 + 3Η2 = 2Fe + 3Η2Ο.
13. Οξείδια οξέων→ μη-μέταλλα
Τα περισσότερα μη-μεταλλικά οξείδια δεν αποσυντίθενται όταν θερμαίνονται. Το μη μέταλλο και το οξυγόνο αποσυντίθενται μόνο μερικά ασταθή οξείδια (οξείδια αλογόνου).
Ορισμένα μη-μέταλλα λαμβάνονται με αναγωγή από τα αντίστοιχα οξείδια:
Si02 + 2Mg = 2MgO + Si.
14. Αλάτια, βάσεις → βάσεις.
Αδιάλυτες βάσεις λαμβάνονται με τη δράση αλκαλίων σε διαλύματα των αντίστοιχων οξέων:
CuS04 + 2ΝaΟΗ = Cu (ΟΗ) 2 + + Na2S04,
Cu 2+ + 2ΟΗ -\u003e Cu (ΟΗ) 2 ↓;
FeCl2 + 2KOH = Fe (ΟΗ) 2 ↓ + 2ΚΟΙ,
Fe2 + + 2ΟΗ - = Fe (ΟΗ) 2 ↓.
15. Άλατα, οξέα → οξέα.
Τα διαλυτά άλατα αντιδρούν με οξέα (σύμφωνα με τη σειρά πίεσης) εάν το αποτέλεσμα είναι ασθενέστερο ή πτητικό οξύ:
Na2SiO3 + 2HCl = 2NaCl + H2Si03 ↓,
SiO3 2- + 2Η + · Η2SiO3 ↓;
NaCl (s) + H2S04 (k) = NaHS04 + HCl.
16. Άλατα→ βασικά οξείδια, όξινα οξέα.
Τα άλατα ορισμένων οξέων που περιέχουν οξυγόνο (νιτρικά, ανθρακικά) αποσυντίθενται όταν θερμαίνονται:
CaCO3 = CaO + CO2;
2Cu (NO3) 2 = 2CuO + 4NO2 + 02.
ΑΣΚΗΣΕΙΣ ΓΙΑ ΑΝΕΞΑΡΤΗΤΗ ΕΡΓΑΣΙΑ ΣΤΟ ΘΕΜΑ "ΓΕΝΕΤΙΚΗ ΣΥΝΔΕΣΗ ΜΕΤΑΞΥ ΤΩΝ ΤΑΞΕΩΝ ΤΩΝ ΑΝΟΡΓΑΝΩΝ ΕΝΩΣΕΩΝ"
1. Ονομασία οι ακόλουθες ουσίες, τους χωρίσει σε κατηγορίες ανόργανων ενώσεων: Na 3 PO 4, H 2 SiO 3, NO, Β 2Ο 3, mgs, Bai 2, Ca (OH) 2, ΚΝΟ3, ΗΝΟ2, Cl 2 O7, Fe (ΟΗ) 2, Ρ2Ο5, ΗΡ, ΜηΟ2.
2. Από οποιαδήποτε από τις ακόλουθες ουσίες μπορεί να είναι σε ένα στάδιο για να ληφθεί υδροξείδιο (οξύ ή βάση) οξείδιο του σιδήρου χαλκού (II), οξείδιο βαρίου, οξείδιο του αζώτου (Ρ), το οξείδιο του αζώτου (V), οξείδιο του πυριτίου, θειικό χαλκό, χλωριούχο κάλιο , κάλιο, ανθρακικό μαγνήσιο.
3. Από τον παραπάνω κατάλογο καταγράψτε τους τύπους των ουσιών που σχετίζονται με: 1) οξείδια, 2) λόγοι. 3) οξέα. 4) άλατα:
CO2, NaOH, ΗΟΙ, S03, CuS04, NaN03, KCI, H2S04, Ca (ΟΗ) 2, Ρ2Ο5, ΗΝΟ3, ΑΙ (ΟΗ) 3.
4. Ονομασία ουσίας: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, ΚΟΗ, (ΑΙΟΝ) 3 (ΡΟ 4) 2, Βα (MnO 4 ) 2, CO, ΗΙ. Αναφέρατε σε ποια κλάση ανήκει κάθε ουσία.
5. Γράψτε τους μοριακούς τύπους των ακόλουθων ουσιών και αναφέρετε σε ποια κλάση ανήκει κάθε ουσία:
1) υδροξείδιο του ανθρακικού χαλκού (II)
2) οξείδιο του αζώτου (V).
3) υδροξείδιο νικελίου (II)
4) όξινο φωσφορικό βάριο,
5) υπερχλωρικό οξύ.
6) υδροξείδιο του χρωμίου (III).
7) χλωρικό κάλιο.
8) όξινο θειώδες οξύ.
9) ψευδάργυρος νατρίου.
6. Δώστε παραδείγματα των αντιδράσεων της σύνδεσης μεταξύ:
1) απλές ουσίες-μη μέταλλα.
2) απλή ουσία και οξείδιο.
3) οξείδια.
4) πολύπλοκες ουσίες που δεν είναι οξείδια.
5) μέταλλο και μη μέταλλο.
6) τρεις ουσίες.
7. Ποια από τις ακόλουθες ουσίες μπορεί να αντιδράσει:
1) μονοξείδιο του άνθρακα (IV): ΗΟΙ, 02, ΝΟ2, ΚΟΗ, Η2Ο.
2) οξείδιο του μαγνησίου: Ba (ΟΗ) 2, ΗΟΙ, C02, 02, ΗΝΟ3;
3) υδροξείδιο σιδήρου (II): KCl, HCl, ΚΟΗ, 02, Η2Ο, ΗΝΟ3;
4) υδροχλώριο: Zn, MgO, ZnCl2, HNO3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Είναι δυνατή η αλληλεπίδραση μεταξύ των ακόλουθων ουσιών;
1) μονοξείδιο του άνθρακα (IV) και υδροξείδιο του καλίου,
2) υδροθειώδες κάλιο και υδροξείδιο του ασβεστίου.
3) φωσφορικό ασβέστιο και θειικό οξύ,
4) υδροξείδιο του ασβεστίου και οξείδιο του θείου (IV).
5) θειικό οξύ και υδροξείδιο καλίου,
6) όξινο ανθρακικό ασβέστιο και φωσφορικό οξύ,
7) διοξείδιο του πυριτίου και θειικό οξύ;
8) οξείδιο ψευδαργύρου και οξείδιο φωσφόρου (V).
Γράψτε τις εξισώσεις πιθανών αντιδράσεων, καθορίστε τις συνθήκες στις οποίες συμβαίνουν. Εάν οι αντιδράσεις μπορούν να οδηγήσουν σε διαφορετικές ουσίες, τότε υποδείξτε ποια είναι η διαφορά στις συνθήκες εφαρμογής τους.
9. Δώστε τις εξισώσεις των αντιδράσεων για να λάβετε τις ακόλουθες ουσίες: ορθοφωσφορικό νάτριο (4 τρόποι), θειικό κάλιο (7 τρόποι), υδροξείδιο ψευδαργύρου.
10. Μια από τις μεθόδους παραγωγής σόδας (ανθρακικό νάτριο) είναι η δράση του νερού και του μονοξειδίου του άνθρακα (IV) σε αργιλικό νάτριο. Κατασκευάστε τις εξισώσεις αντίδρασης.
11. Αλλάζει τους συντελεστές, γράφει τα προϊόντα αντίδρασης:
1) MgO + 2H2S04-
2) 2S02 + Ba (ΟΗ) 2
3) 3Ν2Ο5 + 2ΑΙ (ΟΗ) 3-
4) P2O5 + 4NaOH →
5) P205 + 6NaOH →
6) P2O5 + 2NaOH →
12. Κάντε τις εξισώσεις αντιδράσεων για τη λήψη διαφορετικών τύπων αλάτων:
1) SO2 + Ba (ΟΗ) 2 (μεσαία και όξινα άλατα),
2) ΑΙ2Ο3 + Η2Ο + ΗΝΟ3 (μέσου άλατος, βασικά άλατα),
3) Na20 + Η2S (μεσαία και όξινα άλατα),
4) SO3 + Sa (OH) 2 (μεσαία και βασικά άλατα),
5) CaO + H20 + P205 (βασικό άλας, όξινα άλατα).
13. Συμπληρώστε τις εξισώσεις αντίδρασης:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr2O3 + H2S04-\u003e AlOHSO4 + NaOH →
Cr2O3 + NaOH → CaC03 + C02 + Η2Ο
Α1203 + HClO4 → Ca (HCO3) 2 + ΗΟΙ →
Mn2O7 + KOH → ZnS + H 2 S →
ΝΟ 2 + Ca (OH) 2 - CaSO 4 + H 2 SO 4 →
Ζη (ΟΗ) 2 + ΝαΟΗ → (ΖηΟΗ) Cl + ΗΟΙ →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (ανεπαρκής) →
AlCl 3 + ΝαΟΗ (ανεπαρκής) → (FeOH) Cl + NaHS →
AlCl3 + NaOH → Na2ZnO2 + H2S04 (περίσσεια) →
AlC1 3 + NaOH (περίσσεια) → Ca (AI2) 2 + HCl (περίσσεια) →
14. Καταγράψτε τις εξισώσεις αντίδρασης με τις οποίες μπορείτε να πραγματοποιήσετε τους ακόλουθους μετασχηματισμούς:
1) Cu- CuO- CuS04- Cu (ΟΗ) 2- CuC1 2- Cu (NO3) 2
2) Zn → ZnO · ZnS04 · Zn (OH) 2 · Na2ZnO2 · ZnCl2
3) Ρ → Ρ 2Ο 5 → Η 3 ΡΟ 4 → Κ 3 ΡΟ 4 → 3 3 (ΡΟ 4) 2 → Η 3 ΡΟ 4
4) Mg · MgO · MgCl2 · Mg (OH) 2 · Mg (HSO4) 2 · MgS04
5) Ca - CaO - Ca (OH) 2 - CaC03 - Ca (HCO3) 2 - CO 2
6) Cr → Cr2 (SO4) 3 → Cr (OH) 3 → NaSrO2 → Cr2O3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS - CuO - CuSO4 - Cu (OH) 2 - CuO - Cu
9) Al → Al2O3 → Al2 (SO4) 3 → Al (HSO4) 3 → Al (OH) 3 → K
10) S - SO2 - SO3 - NaHSO4 - Na2S04 - BaSO4
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Ζη · ZnS04 · ZnCl2 · Zn (OH) 2 · Na2 · Zn (NO3) 2
13) Ca - CaCl2 - CaC03 - Ca (HCO3) 2 - Ca (NO3) 2
14) Ca → Ca (OH) 2 - CaC03 - CaCl2 - CaC03 - Ca (NO3) 2
15) CuO - CuCl2 - Cu (NO3) 2 - CuO - CuSO4 - Cu
16) CaO - Ca (OH) 2 - Ca (NO3) 2 - Ca (NO2) 2 - HNO2 - NaNO2
17) MgO · MgS04 · MgCl2 · Mg (NO3) 2 · Mg (ΟΗ) 2 · MgO
18) SO 2 → H 2SO 3 → KHSO 3 → K 2SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaS04
21) PbO · Pb (NO3) 2 · PbO · Na2PbO2 · Pb (OH) 2 · PbCl2
22) ZnO → ZnS04 → Zn (OH) 2 → Na2Zn02 → Zn (OH) 2 → Κ2
23) Al2O3 → AlCl3 → Al (OH) 3 → NaAlO2 → Al (OH) 3 → K
24) ZnS04 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (ΝΟ3) 2
25) AlCl3 → Al (ΝΟ3) 3 → ΑΙ (ΟΗ) 3 → NaAlO2 → A1C1 3 → Al
26) Pb (NO3) 2 - Pb (OH) 2 - PbO - Na 2 PbO 2 - Pb (OH) 2 - PbSO 4
27) Fe 2 (SO 4) 3 - FeCl 3 - Fe (OH) 3 - FeOH (NO 3) 2 - Fe (NO 3) 3 - Fe 2 O 3
28) Κ → ΚΟΗ → KHSO4 → Κ2SΟ4 → ΚΟΙ → ΚΝΟ3
29) Cu (ΟΗ) 2 - CuOHNO 3 - Cu (NO3) 2 - CuS04 - CuCl2 - Cu (NO3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO3) 2 → CaS04
31) Cu - Cu (NO3) 2 - Cu (OH) 2 - CuSO4 - Al2 (SO4) 3 - A1C1 3
32) Mg · MgS04 · MgCl2 · MgOHCl · Mg (OH) 2 · MgOHNO3
33) CuS04 · CuCl2 · ZnCl2 · Zn (OH) 2 · Na2ZnO2 · Zn (OH) 2
34) Hg (ΝΟ3) 2 · ΑΙ (ΝΟ3) 3 · ΑΙ2Ο3 · ΝaΑΙΟ2 · ΑΙ (ΟΗ) 3 · ΑlΟΗCl2
35) ZnS04 → Zn (OH) 2 → ZnCl2 → AICI3 → ΑΙ (ΟΗ) 3 »Α2203
36) CuCl2 · Cu (OH) 2 · CuS04 · ZnS04 · Zn (OH) 2 · Na2ZnO2
37) Fe (NO3) 3 · FeOH (NO3) 2 · Fe (OH) 3 · FeCl3 · Fe (NO3) 3 · Fe
38) Al2O3 → AlCl3 → Al (OH) 3 → NaAlO2 → NaNO3 → HNO3
39) Mg (ΟΗ) 2 · MgS04 · MgCl2 · Mg (ΝΟ3) 2 · Mg (ΟΗ) 2 · MgO
40) θειικό αργίλιο → χλωριούχο αργίλιο → νιτρικό αργίλιο → οξείδιο αλουμινίου → αργιλικό κάλιο → υδροξείδιο αργιλίου → υδροξείδιο αργιλίου → χλωριούχο αργίλιο.
41) Na → NaOH → Na3P04 → NaNO3 → HNO3 → N2O5
42) BaCO3 → Ba (HCO3) 2 → BaCO3 → (BaOH) 2C03 → BaO → BaS04
43) Cu - CuS04 - (CuOH) 2SO4 - Cu (OH) 2 - Cu (HSO4) 2 - CuS04
44) βάριο → υδροξείδιο του βαρίου → διττανθρακικό βάριο → χλωριούχο βάριο → ανθρακικό βάριο → χλωριούχο βάριο → υδροξείδιο του βαρίου
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr2O3 · CrCl3 · Cr (OH) 3 · Na3 · Cr2 (SO4) 3 · CrCl3
48) Κ → ΚΟΗ → ΚΟΙ → ΚΟΗ → Κ 2SΟ 4 → ΚΝΟ 3 → ΚΝΟ 2
49) S - FeS - Η2S - S02 - S - ZnS - ZnO - ZnCl2 - Zn (OH) 2 - K2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) C → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO2 → K2SO3 → KHSO3 → Κ2SO3
53) Cu - Cu (OH) 2 - Cu (NO3) 2 - CuO - Cu
54) Ρ 2Ο 5 → Η 3 ΡΟ 4 → СаНРО 4 → Sa (Η 2 ΡΟ 4) 2 → Ca 3 (ΡΟ 4) 2
55) Fe - FeCl2 - Fe (OH) 2 - FeSO4 - Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO3) 2 → ZnO
57) CuS → SO2 → KHSO3 → CaSO3 → SO2
58) SO2 → H2SO4 → CuSO4 »CuO» Cu (ΝΟ3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO2 → CaSO3 → SO2 → NaHSO3 → SO2
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) Κ → ΚΟΗ → ΚΟΙ → ΚΝΟ 3 »Κ2SO4» ΚΟΙ
63) ΝaCl → Na → NaOH → Na2S04 → NaCl
64) ΑΙ → ΑΙθ3 → ΑΙ (ΟΗ) 3 → Α1 2Ο3 → ΑΙ (ΟΗ) 3
65) CuO · Cu · CuCl2 · CuS04 · CuS
66) Fe - FeSO4 - Fe (ΟΗ) 2 - Fe - Fe (ΟΗ) 3
67) Fe - Fe (OH) 2 - FeCl 2 - Fe (NO 3) 2 - Fe
68) Fe (NO3) 3 - Fe2O3 - FeCl3 - Fe (NO3) 3 - Fe
69) CuO - CuS04 - Cu (OH) 2 - CuO - Cu
70) MgCO3 · MgO · MgCl2 · Mg (ΟΗ) 2 · Mg (ΝΟ3) 2
71) Mg · Mg (ΟΗ) 2 · MgS04 · MgCO3 · Mg (HCO3) 2
72) CaO - Ca (OH) 2 - CaCl2 - CaCO3 - CO2
73) CaC03 - Ca (HCO3) 2 - CaCl2 - Ca (NO3) 2 - O2
74) FeS - Fe2O3 - Fe (OH) 3 - Fe2 (SO4) 3 - FeCl3
75) KS1 → K2SO4 → ΚΟΗ → Κ2ΟΟ3 »ΚΟΗ
76) CuS - CuO - Cu (OH) 2 - CuS04 - Cu
77) Fe - Fe (ΟΗ) 3 - Fe (NO3) 3 - FeCl3 - Fe2 (SO4) 3
78) CuS04 - CuO - Cu (NO3) 2 - CuO - CuS
79) ZnS → Η2S-\u003e S02- Na2S04 → ΝαΟΗ
80) ΑΙ → ΑΙ (ΟΗ) 3 → Α1 2 (SO4) 3 → Α1 2Ο3 → ΑΙ (ΟΗ) 3
81) CaCl2 → CaC03- Ca (HCO3) 2 → CaC03- CaSiO3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na2S04 → NaCl → HCl → CaCl2 → Ca (ΝΟ3) 2
84) Na2SO3 -\u003e SO2 -\u003e H2S04 - HCl - FeCl2
85) C → Na2CO3 → CaCO3 → CaSiO3 → H2Si03
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl2 → Cl2 → HCl → Η2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) ΝΗ3 · ΝΗ4C1 · ΝΗ3 · Η2Ο · ΝΗ4ΗCO3 · ΝΗ3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (ΟΗ) 2
92) ΝΗ3 → ΝΗ4Η2ΡΟ4- (ΝΗ4) 2ΡΡΟ4 → ΝΗ3 → ΝΗ4ΝΟ3
93) ΚΟΗ → KHCO3 → K2CO3 → CO2 → Ca (HCO3) 2
94) Na → NaOH → NaHC03 → Na2S04 → ΝαΟΗ
95) KNO 3 → Κ 2 SO 4 → ΚΟ 1 → ΚΝΟ 3 → ΚΝΟ 2
96) Cl2 → KC1 → K2S04 »KNO3» KHSO4
97) FeS04 - FeS -\u003e SO2 - KHSO3 -\u003e K2S04
98) ΚΟΗ - Cu (ΟΗ) 2 - CuS04 - Cu (OH) 2 - Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) ΑΙ → Α1 2Ο3 → Α1 (ΝΟ3) 3 → Α1 2Ο3 → ΑΙ (ΟΗ) 3
101) CaO - CaCO3 - CaSiO3 - Ca (NO3) 2 - O2
102) Cu - Cu (OH) 2 - Cu - CuS04 - CuCl2
103) Η2S-S02- ZnS04- ZnS-ZnO
104) Cl2 → NaCl → HCl → CuCl2 → CuO
105) Cl2 - FeCl3 - Fe2O3 - Fe (OH) 3 - Fe (NO3) 3
106) P2O5 → Ca3 (PO4) 2 → Η3ΡΟ4 → CaHPO4 → Ca (H2P04) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO3) 2
108) ZnO → ZnS04 → Zn (NO3) 2 → ZnO → Ζη (ΟΗ) 2
109) Η3ΡΟ4 → ΝΗ4Η2ΡΟ4- (ΝΗ4) 2ΗΡΟ4 → Na3P04- Ca3 (PO4) 2
110) CaC03 - Na2CO3 - Na3P04 - NaH2PO4 - Ca3 (PO4) 2
111) CaCl2 - CaS03 - Ca (OH) 2 - CaCl2 - Ca (NO3) 2
112) ΝαΟΗ → Na2C03 → NaHS04 → NaN03 »NaHS04
113) Na2Si03 → Na2CO3 → Na2S04 → NaCl → Na2S04
114) KNO 3 → KHSO 4 → K 2SO 4 → KCl → Na 2 SO 4
115) Si02 → Κ2SίΟ3 → Η2Si03- Si02- CaSi03
116) Cu - CuCl2 - Cu (NO3) 2 - NO2 - HNO3
117) Ca (ΝΟ3) 2 → Ο2 → Si02 → Η2Si03 → Si02
118) Ρ - Η3ΡΟ4 - Ca3 (PO4) 2 - CaHPO4 - Ca (H2PO4) 2
119) CuS04 → Cu - CuS - CuO - CuCl2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO3 → H2S04 → KHSO4 → BaS4
122) Ν2Ο5 → ΗΝΟ3 → Cu (ΝΟ3) 2 - CuO - Cu (OH) 2
123) ΑΙ → Α1 2Ο3 → ΑΙ (ΟΗ) 3 → Α2 (SO4) 3 → Α1 (ΝΟ3) 3
124) Ca - Ca (OH) 2 - Ca (HCO3) 2 - CaO - CaCl2
125) ΝΗ3 · H2O · NH4C1 · NH3 · NH4HCO3 · (NH4) 2CO3
126) Cu (OH) 2 · H 2 O · HNO 3 · Fe (NO 3) 3 · Fe
127) SO2 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO3) 2
128) ΝΗ3 · Η2Ο · ΝΗ4ΗCO3 · CaC03- CaSi03- CaCl2
129) CuS04 → Cu - CuO - Cu (OH) 2 - Cu
130) Fe (ΟΗ) 3 · Fe · FeCl3 · Fe (NO3) 3 · Fe
131) Ζη → Ζη (ΟΗ) 2 → Na2 → Ζη (ΟΗ) 2 → Na2Zn02 → Ζη
132) Ζη · ΖηΟ · Na2ZnO2 · Zn (OH) 2 · Na2 · ZnCl2
133) Ζη · Κ 2 ΖηΟ2 · ΖηδΟ4 · Κ2 · Ζη (ΝΟ3) 2 · ΖηΟ
134) ΖηΟ · Ζη (ΟΗ) 2 · Κ2 ΖηΟ2 · ΖηδΟ4 · ΖηCl2 · ΖηΟ
135) Zn → Na2 → Na2Zn02 → Zn (NO3) 2 → ZnO → Zn
136) ΑΙ → Κ3 → ΑΙ (ΟΗ) 3 → Na3 → Α1Ο13 → ΑΙ (ΟΗ) 3
137) Al2O3 → KAlO2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) ΑΙ (ΟΗ) 3 - Α2 2Ο3 - Κ3 - ΑΙ2 (SO4) 3 - Α1 (ΝΟ3) 3
139) A1C1 3 → Κ3 → Al (ΝΟ3) 3 → NaAlO2 → Al2O3
140) Να → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
ΠΕΙΡΑΜΑΤΙΚΕΣ ΕΜΠΕΙΡΙΕΣ ΣΤΟ ΘΕΜΑ "ΒΑΣΙΚΕΣ ΚΛΑΣΕΙΣ ΑΝΟΡΓΑΝΩΝ ΕΝΩΣΕΩΝ"
ΕΜΠΕΙΡΙΑ 1.Αντιδράσεις εξουδετέρωσης.
α) Η αλληλεπίδραση ισχυρού οξέος και ισχυρής βάσης.
Ρίχνουμε 5 ml διαλύματος υδροχλωρικού οξέος 2Ν σε τρυβλίο από πορσελάνη και προσθέτουμε στάγδην 2 n διάλυμα υδροξειδίου του νατρίου. Αναμίξτε το διάλυμα με μια γυάλινη ράβδο και δοκιμάστε την επίδρασή του στο λακκούβωμα, μεταφέροντας μια σταγόνα του διαλύματος στη δοκιμή λακκούβας. Είναι απαραίτητο να επιτευχθεί μια ουδέτερη αντίδραση (το μπλε και το κόκκινο χόμπι δεν αλλάζει χρώμα). Το προκύπτον διάλυμα εξατμίζεται μέχρι ξηρού. Τι σχηματίστηκε; Γράψτε εξισώσεις μοριακής και ιοντικής αντίδρασης.
β) Η αλληλεπίδραση ενός ασθενούς οξέος και μιας ισχυρής βάσης.
Ρίξτε σε δοκιμαστικό σωλήνα 2 ml διαλύματος αλκαλικού διαλύματος 2Ν και προσθέστε ένα διάλυμα οξικού οξέος έως ότου το διάλυμα είναι ουδέτερο. Γράψτε εξισώσεις μοριακής και ιοντικής αντίδρασης. Εξηγήστε γιατί η αντίδραση ιόντων ισορροπίας, στην οποία συμμετέχει ασθενής ηλεκτρολύτης (οξικό οξύ), μετατοπίζεται προς το σχηματισμό μορίων νερού.
ΕΜΠΕΙΡΙΑ 2. Αμφοτερικά υδροξείδια.
Από τα διαθέσιμα στο εργαστήριο αντιδραστήρια, λαμβάνετε ένα ίζημα υδροξειδίου του ψευδαργύρου. Ανακινήστε το ίζημα και ρίξτε μικρές ποσότητες σε 2 σωλήνες. Σε έναν από τους σωλήνες προσθέστε ένα διάλυμα υδροχλωρικού οξέος, στην άλλη - ένα διάλυμα υδροξειδίου του νατρίου (περίσσεια). Τι παρατηρείται; Γράψτε τις εξισώσεις των αντίστοιχων αντιδράσεων σε μοριακή και ιοντική μορφή.
ΕΜΠΕΙΡΙΑ 3.Χημικές ιδιότητες αλάτων.
α) Η αλληλεπίδραση των διαλυμάτων άλατος με τον σχηματισμό μιας ελάχιστα διαλυτής ουσίας.
Ρυθμίστε 2 ml διαλύματος ανθρακικού νατρίου στο σωλήνα και προσθέστε διάλυμα χλωριούχου βαρίου μέχρι να εμφανιστεί ένα λευκό ίζημα. Γράψτε την εξίσωση της χημικής αντίδρασης σε ιοντική και μοριακή μορφή. Το ίζημα χωρίζεται σε δύο μέρη. Ρίξτε διάλυμα θειικού οξέος σε έναν από τους σωλήνες και υδροξείδιο του νατρίου στο άλλο. Πραγματοποιήστε ένα συμπέρασμα σχετικά με τη διαλυτότητα του ιζήματος σε οξέα και αλκάλια.
β) Αλληλεπίδραση του διαλύματος άλατος με οξέα για σχηματισμό πτητικής ένωσης.
Ρυθμίστε 2 ml διαλύματος ανθρακικού νατρίου στο σωλήνα και προσθέστε μικρό όγκο διαλύματος υδροχλωρικού οξέος. Τι παρατηρείται; Γράψτε τις εξισώσεις χημικής αντίδρασης σε ιοντική και μοριακή μορφή.
γ) Αλληλεπίδραση διαλυμάτων άλατος με αλκάλια με σχηματισμό πτητικής ένωσης.
Χύστε λίγο διάλυμα κάποιου αμμωνιακού άλατος μέσα στο σωλήνα, προσθέστε 1-2 ml διαλύματος υδροξειδίου του νατρίου και θερμαίνετε μέχρι βρασμού. Σε δοκιμαστικό σωλήνα με το μείγμα αντίδρασης για να γίνει δοκιμή υγρού κόκκινου χτυπήματος. Τι παρατηρείται; Δώστε μια εξήγηση. Γράψτε τις εξισώσεις αντίδρασης.
g ) Αλληλεπιδράσεις αλάτων με περισσότερο ενεργά μέταλλα από το μέταλλο που αποτελεί μέρος του αλατιού.
Καθαρίστε το καρφί σιδήρου (χάλυβα) με λεπτό γυαλόχαρτο. Στη συνέχεια, βυθίστε το σε διάλυμα θειικού χαλκού. Μετά από κάποιο χρονικό διάστημα, παρατηρήστε την απελευθέρωση χαλκού στην επιφάνεια του νυχιού. Γράψτε την αντίστοιχη εξίσωση αντίδρασης σε ιοντική και μοριακή μορφή.
ΕΜΠΕΙΡΙΑ 4.Λαμβάνοντας βασικά και όξινα άλατα.
α) Παρασκευή υδρογονανθρακικού μολύβδου.
Προσθέστε λίγο οξείδιο του μολύβδου (II) στο διάλυμα οξικού μολύβδου (II) και βράστε το μείγμα για λίγα λεπτά. Το ψυχθέν διάλυμα αποστραγγίζεται από το ίζημα και διέρχεται ρεύμα διοξειδίου του άνθρακα. Τι παρατηρείται; Διηθείται το ίζημα και ξηραίνεται μεταξύ των φύλλων του διηθητικού χαρτιού. Σημειώστε το χρώμα και τη φύση του προκύπτοντος ιζήματος υδρογονανθρακικού μολύβδου. Γράψτε τις εξισώσεις αντίδρασης. Δημιουργήστε μια γραφική φόρμουλα του ληφθέντος αλατιού.
β) Παρασκευή δισανθρακικού μαγνησίου.
Σε ένα πολύ αραιό διάλυμα μερικού άλατος μαγνησίου προσθέστε λίγο διάλυμα ανθρακικού νατρίου. Ποια ουσία κατακρημνίζεται; Κορεσμένο διάλυμα με ίζημα με διοξείδιο του άνθρακα. Παρατηρήστε τη σταδιακή διάλυση του ιζήματος. Γιατί συμβαίνει αυτό; Γράψτε τις εξισώσεις αντίδρασης.
ΕΜΠΕΙΡΙΑ 5.Λήψη σύνθετων αλάτων.
α) Σχηματισμός ενώσεων με σύνθετο κατιόν.
Προσθέστε ένα διάλυμα αμμωνίας στάγδην σε ένα σωλήνα με 2-3 ml διαλύματος χλωριούχου χαλκού (II) έως ότου σχηματιστεί ένα ίζημα υδροξειδίου του χαλκού (II), και στη συνέχεια προσθέστε περίσσεια διαλύματος αμμωνίας για να διαλύσετε το ίζημα. Συγκρίνετε το χρώμα των ιόντων Cu 2+ με το χρώμα του προκύπτοντος διαλύματος. Ποια ιόντα υπάρχουν στη λύση; Γράψτε την εξίσωση αντίδρασης για να αποκτήσετε μια σύνθετη ένωση.
β) Σχηματισμός ενώσεων με σύμπλοκο ανιόν.
Σε διάλυμα 1-2 ml νιτρικού υδραργύρου (II) προστίθεται στάγδην ένα αραιωμένο διάλυμα ιωδιούχου καλίου για να σχηματιστεί ένα ίζημα HgI2. Στη συνέχεια, ρίχνουμε σε περίσσεια διαλύματος ιωδιούχου καλίου μέχρι να διαλυθεί το ίζημα. Γράψτε τις αντιδράσεις της απόκτησης σύνθετου αλατιού.
ΕΜΠΕΙΡΙΑ 6.Παρασκευή διπλών αλάτων (στυπτηρία καλίου).
Ζυγίζονται 7,5 g Al 2 (SO 4) 3 · 18H 2 O και διαλύονται σε 50 ml νερού, λαμβάνοντας για το σκοπό αυτό επαρκές μέγεθος πορσελάνης. Υπολογίστε την εξίσωση αντίδρασης και ζυγίστε τη μάζα θειικού καλίου που είναι απαραίτητη για την αντίδραση. Προετοιμάστε ένα θερμό κεκορεσμένο διάλυμα θειικού καλίου και ρίξτε το σε τρυβλίο πορσελάνης με ένα διάλυμα θειικού αργιλίου με ανάδευση. Παρακολουθήστε μετά από λίγο την καθίζηση των κρυστάλλων αλουμινίου αλουμινίου. Μετά την ψύξη και την κρυστάλλωση, χύνονται τα μητρικά υγρά, ξηραίνονται οι κρύσταλλοι στυπτηρίας μεταξύ των φύλλων διηθητικού χαρτιού και ζυγίζονται οι προκύπτοντες κρύσταλλοι. Υπολογίστε το ποσοστό απόδοσης.
ΚΑΘΗΚΟΝΤΑ ΔΙΑΚΑΝΟΝΙΣΜΟΥ
1. Δια διαβιβάσεως μιας περίσσειας υδρόθειου δια 169 διαλύματος θειικού χαλκού (II) ελήφθησαν 1.92 γρ. Βρείτε το κλάσμα μάζας θειικού χαλκού στο χρησιμοποιούμενο διάλυμα και τον όγκο του καταναλωμένου υδρόθειου.
2. Για την πλήρη κατακρήμνιση χαλκού σε μορφή σουλφιδίου από 291 cm3 διαλύματος θειικού χαλκού (II) με κλάσμα μάζας 10%, χρησιμοποιήθηκε αέριο που αποκτήθηκε με αντίδραση 17,6 g σουλφιδίου σιδήρου (II) με περίσσεια υδροχλωρικού οξέος. Βρείτε την πυκνότητα του αρχικού διαλύματος θειικού χαλκού.
3. Το αέριο που απελευθερώνεται κατά τη διάρκεια της αλληλεπίδρασης του διαλύματος K 2 S με αραιό θειικό οξύ διέρχεται μέσω περίσσειας διαλύματος νιτρικού μολύβδου (II). Το προκύπτον ίζημα έχει μάζα 71,7 g. Βρείτε τον όγκο του αντιδραστικού διαλύματος θειικού οξέος, εάν η πυκνότητά του είναι 1,176 g / cm3 και το κλάσμα μάζας είναι 25%.
4. Σε διάλυμα που περιέχει 8 g θειικού χαλκού (II), προστέθηκε διάλυμα που περιείχε 4,68 g θειούχου νατρίου. Το ίζημα διηθήθηκε, το διήθημα εξατμίστηκε. Προσδιορίζεται η μάζα των ουσιών στο διήθημα μετά την εξάτμιση και η μάζα του ιζήματος θειούχου χαλκού.
5. Κάποιο σουλφίδιο σιδήρου (II) υποβλήθηκε σε επεξεργασία με περίσσεια υδροχλωρικού οξέος. Το προκύπτον αέριο στην αντίδραση με 12,5 cm3 διαλύματος ΝαΟΗ με κλάσμα μάζας 25% και πυκνότητα 1,28 g / cm3 σχημάτισε όξινο άλας. Βρείτε τη μάζα του αρχικού θειούχου σιδήρου.
6. Σουλφίδιο σιδήρου (II) βάρους 176 g υποβλήθηκε σε επεξεργασία με περίσσεια υδροχλωρικού οξέος και το προκύπτον αέριο καίγεται σε περίσσεια αέρα. Ποιος όγκος διαλύματος ΚΟΗ με κλάσμα μάζας 40% και πυκνότητα 1,4 g / cm3 είναι απαραίτητος για την πλήρη εξουδετέρωση του αερίου που παράγεται κατά την καύση;
7. Όταν ψήνουν 100 g τεχνικού πυρίτη, λαμβάνουν ένα αέριο το οποίο εξουδετερώθηκε πλήρως με 400 cm3 διαλύματος ΝαΟΗ με κλάσμα μάζας 25% και πυκνότητα 1,28 g / cm3. Προσδιορίστε το κλάσμα μάζας των ακαθαρσιών σε πυρίτη.
8. Σε 2 g ενός μείγματος σιδήρου, οξειδίου του σιδήρου (II) και οξειδίου του σιδήρου (III) προστέθηκαν 16 cm3 διαλύματος ΗΟΙ με κλάσμα μάζας 20% και πυκνότητα 1,09 g / cm3. Για την εξουδετέρωση της περίσσειας οξέος, χρειάστηκαν 10,8 cm3 διαλύματος ΝαΟΗ με κλάσμα μάζας 10% πυκνότητας 1,05 g / cm3. Βρείτε τις μάζες των ουσιών στο μείγμα αν ο όγκος του απελευθερωμένου υδρογόνου είναι 224 cm3 (NU).
9. Υπάρχει μίγμα Ca (OH) 2, CaC03 και BaS04 με μάζα 10,5 g. Όταν το μείγμα υφίσταται κατεργασία με περίσσεια υδροχλωρικού οξέος, απελευθερώνονται 672 cm3 (IU) αερίου και 71,2 g του οξέος αντιδρούν με μια μάζα μερίδιο 10%. Προσδιορίστε τη μάζα των ουσιών στο μείγμα.
10. Υπάρχει ένα μείγμα χλωριούχου βαρίου, ανθρακικού ασβεστίου και διττανθρακικού νατρίου. Όταν το 10 g αυτού του μίγματος διαλύεται σε νερό, το αδιάλυτο υπόλειμμα ισούται με 3,5 g. Όταν ψύχεται 20 g του αρχικού μίγματος, η μάζα του μειώνεται κατά 5,2 g. Βρείτε τα κλάσματα μάζας των ουσιών στο αρχικό μείγμα.
11. Υπάρχει ένα διάλυμα που περιέχει τόσο θειικό όσο και νιτρικό οξύ. Για να εξουδετερωθούν πλήρως 10 g αυτού του διαλύματος, καταναλώνονται 12,5 cm3 διαλύματος ΚΟΗ με κλάσμα μάζας 19% και πυκνότητα 1,18 g / cm3. Όταν μία περίσσεια χλωριούχου βαρίου προστίθεται σε 20 g του ιδίου μίγματος όξινου διαλύματος, 4,66 g του ιζήματος πέφτουν. Βρείτε τα κλάσματα μάζας των οξέων στο μείγμα.
12. Όλα τα υδροχλώριο που ελήφθησαν από 100 g μίγματος ΚΟΙ και ΚΝΟ3 διαλύθηκαν σε 71,8 cm3 νερού. Όταν ψύχονται 100 g του ίδιου μείγματος αλάτων, παραμένουν 93,6 g στερεού υπολείμματος. Βρείτε το κλάσμα μάζας υδροχλωρίου στο νερό.
13. Με διαβίβαση 2 m 3 αέρα (NU) μέσω διαλύματος Ca (OH) 2, ελήφθησαν 3 g ίζημα άλατος ανθρακικού οξέος. Βρείτε τον όγκο και το κλάσμα μάζας του CO 2 στον αέρα.
14. Το διοξείδιο του άνθρακα διέρχεται μέσω εναιωρήματος που περιέχει 50 g CaC03. Η αντίδραση έφερε 8,96 dm3 αέριο (NU). Ποια είναι η μάζα του CaCO 3 που παραμένει στην στερεά φάση;
15. Όταν προστίθεται νερό στο CaO, η μάζα του αυξήθηκε κατά 30%. Ποιο μέρος του CaO (σε μάζα%) σβήστηκε;
16. Οξείδιο του μολύβδου (II) βάρους 18,47 g θερμάνθηκε σε ένα ρεύμα υδρογόνου. Μετά την αντίδραση, η μάζα του προκύπτοντος μολύβδου και του οξειδίου που δεν αντέδρασε ήταν 18.07 g. Ποια είναι η μάζα του οξειδίου του μολύβδου που δεν αντιδρά;
17. Το μονοξείδιο του άνθρακα διέρχεται από το οξείδιο του σιδήρου (III) όταν θερμαίνεται. Η μάζα του στερεού καταλοίπου μετά την αντίδραση είναι 2 g μικρότερη από την αρχική μάζα οξειδίου του σιδήρου. Ποιος όγκος CO έλαβε η αντίδραση (είναι το οξείδιο πλήρως μειωμένο);
18. Υπάρχει 8,96 dm 3 (NU) ενός μείγματος Ν2, CO2 και SO2 με σχετική πυκνότητα υδρογόνου 25. Αφού περάσει μέσω περίσσειας διαλύματος ΚΟΗ, ο όγκος του μείγματος μειώθηκε κατά 4 φορές. Βρείτε τους όγκους αερίων στο αρχικό μείγμα.
19. Σε δύο ποτήρια υπάρχουν 100 g διαλύματος HC1 με κλάσμα μάζας 2,5%. Σε ένα ποτήρι προστέθηκαν 10 g CaC03, στην άλλη - 8.4 g MgC03. Πώς θα διαφέρει η μάζα των γυαλιών μετά την αντίδραση;
20. Ποιος όγκος (NU) διοξειδίου του θείου πρέπει να διέρχεται μέσω 200 cm3 διαλύματος με 0,1% κατά μάζα κλάσμα ΝαΟΗ και πυκνότητα 1 g / cm3 για να ληφθεί όξινο άλας;
21. Ποια είναι η μέγιστη ποσότητα διοξειδίου του άνθρακα (διοξείδιο του άνθρακα) που μπορεί να απορροφήσει 25 cm3 διαλύματος με κλάσμα μάζας 25% NaOH και πυκνότητα 1,1 g / cm3;
22. Ποιος είναι ο ελάχιστος όγκος του διαλύματος με κλάσμα μάζας 20% KOH και πυκνότητα 1,19 g / cm3 που μπορεί να απορροφήσει όλο το διοξείδιο του άνθρακα που παράγεται με την πλήρη μείωση 23,2 g μαγνητίτη με μονοξείδιο του άνθρακα;
23. Ποια είναι η ελάχιστη μάζα ΚΟΗ που πρέπει να αντιδράσει με 24,5 g ορθοφωσφορικού οξέος, ώστε το προϊόν να είναι μόνο δισόξινο φωσφορικό κάλιο;
24. Ποια είναι η ελάχιστη μάζα Ca (OH) 2 για προσθήκη σε 16 g διαλύματος δισανθρακικού ασβεστίου με κλάσμα μάζας 5% άλατος για να ληφθεί ένα μέσο άλας;
25. Ποια μάζα φωσφορικού καλίου θα πρέπει να προστεθεί σε διάλυμα που περιέχει 12,25 g H3PO4, έτσι ώστε μετά από αυτό το διάλυμα να περιέχει μόνο δισόξινο φωσφορικό κάλιο;
26. Το διάλυμα περιείχε 56,1 g μίγματος ανθρακικών ασβεστίου και μαγνησίου σε εναιώρημα. Για να μετατραπούν σε υδρογονάνθρακες, χρησιμοποίησαν όλο το διοξείδιο του άνθρακα που παράγεται από την καύση 7 dm 3 (NU) αιθανίου. Βρείτε τη μάζα ανθρακικού ασβεστίου στο αρχικό μείγμα.
27. Για να μετατραπούν 9,5 g μίγματος υδρογονανθρακικού και δισοξειδίου του νατρίου σε μέσον άλας, χρειάζονται 10 cm3 διαλύματος με κλάσμα μάζας ΝαΟΗ 27,7% και πυκνότητα 1,3 g / cm3. Βρείτε τη μάζα φωσφορικού υδρογόνου στο μείγμα.
28. Δια διαβιβάσεως διοξειδίου του άνθρακος διαμέσου ενός διαλύματος που περιέχει 6 g Ν & ΟΗ, ελήφθησαν 9,5 g ενός μίγματος οξέος και μέσου άλατος. Βρείτε την ποσότητα του διοξειδίου του άνθρακα που καταναλώνετε.
29. Αφού περάσαμε 11,2 dm 3 (NU) C02 μέσω του διαλύματος ΚΟΗ, ελήφθησαν 57,6 g μίγματος οξέων και μέσου αλάτων. Βρείτε τη μάζα του μέσου αλατιού.
30. Ποια μάζα ορθοφωσφορικού οξέος πρέπει να εξουδετερωθεί για να ληφθούν 1,2 g διϋδρο- και 4,26 g όξινου φωσφορικού νατρίου;
31. Στο διάλυμα θειικού οξέος προστέθηκε ΝαΟΗ για να ληφθούν 3,6 g υδροθειϊκού οξέος και 2,84 g θειικού νατρίου. Προσδιορίστε τις χημικές ποσότητες οξέος και αλκαλίων που έχουν αντιδράσει.
32. Αφού πέρασε το υδροχλώριο διαμέσου 200 cm3 διαλύματος ΝβΟΗ με κλάσμα μάζας 10% και πυκνότητα 1,1 g / cm3, το κλάσμα μάζας ΝαΟΗ στο προκύπτον διάλυμα μειώθηκε κατά το ήμισυ. Προσδιορίστε το κλάσμα μάζας του NaCl στο προκύπτον διάλυμα.
33. Διαλυτοποίηση 14,4 g ενός μείγματος χαλκού και του οξειδίου του (II) κατανάλωσε 48,5 g ενός διαλύματος με ένα κλάσμα μάζας ΗΝΟ 3 80%. Βρείτε τα κλάσματα μάζας χαλκού και οξειδίου στο αρχικό μείγμα.
34. Μάζα οξειδίου του νατρίου 6,2 g διαλύθηκε σε 100 cm3 νερού και ελήφθη το διάλυμα Νο. Τότε προστέθηκε υδροχλωρικό οξύ με κλάσμα μάζας 10% μέχρις ότου το μέσο κατέστη ουδέτερο και ελήφθη το διάλυμα Νο 2. Προσδιορίστηκε :
1) κλάσματα μάζας ουσιών σε διαλύματα Νο. 1, 2,
2) τη μάζα του διαλύματος του HC1, η οποία πήγε για να εξουδετερώσει τον αριθμό 1 του διαλύματος.
35. 3 g ψευδαργύρου αλληλεπιδρούν με 18,69 cm3 διαλύματος ΗΟΙ με κλάσμα μάζας 14,6% και πυκνότητα 1,07 g / cm3. Όταν θερμαίνεται, το προκύπτον αέριο διέρχεται από ζεστό CuO που ζυγίζει 4 g. Ποια είναι η μάζα του χαλκού που λαμβάνεται;
36. Το αέριο που απελευθερώνεται μετά την κατεργασία του υδριδίου του ασβεστίου με περίσσεια νερού, παραλείπεται έναντι FeO. Ως αποτέλεσμα, η μάζα οξειδίου μειώθηκε κατά 8 g. Βρείτε τη μάζα CaH 2 που έχει υποστεί επεξεργασία με νερό.
37. Κατά τη διαπύρωση του δείγματος CaCO3, η μάζα του μειώθηκε κατά 35,2%. Τα στερεά προϊόντα αντίδρασης διαλύθηκαν σε περίσσεια υδροχλωρικού οξέος για να ληφθεί 0.112 dm 3 (NU) αερίου. Προσδιορίζεται η μάζα του αρχικού δείγματος ανθρακικού ασβεστίου.
38. Το νιτρικό χαλκό αποσυντέθηκε και το προκύπτον οξείδιο του χαλκού (II) μειώθηκε πλήρως με υδρογόνο. Τα προκύπτοντα προϊόντα διήλθαν μέσω ενός σωλήνα με Ρ2Ο5 και η μάζα του σωλήνα μετά αυξήθηκε κατά 3,6 g. Ποιος είναι ο ελάχιστος όγκος θειικού οξέος με κλάσμα μάζας 88% και πυκνότητα 1,87 g / cm3 που απαιτείται για τη διάλυση που αποκτάται στο πείραμα χαλκός και ποια είναι η μάζα του αποσυντιθέμενου αλατιού;
39. Κατά την απορρόφηση του μονοξειδίου του αζώτου (IV) με περίσσεια διαλύματος ΚΟΗ στο κρύο απουσία οξυγόνου, ελήφθησαν 40,4 g ΚΝΟ3. Ποια ουσία εξακολουθεί να σχηματίζεται και ποια είναι η μάζα της;
40. Για να εξουδετερωθούν 400 g διαλύματος που περιέχει υδροχλωρικό και υδροχλωρικό οξύ θειικό οξύ, κατανάλωσε 287 cm3 διαλύματος υδροξειδίου του νατρίου με κλάσμα μάζας 10% και πυκνότητα 1,115 g / cm3. Εάν προστεθεί περίσσεια διαλύματος χλωριούχου βαρίου σε 100 g του αρχικού διαλύματος, θα πέσουν 5.825 g ίζημα. Προσδιορίστε τα κλάσματα μάζας των οξέων στο αρχικό διάλυμα.
41. Μετά τη διοχέτευση διοξειδίου του άνθρακα διαμέσου ενός διαλύματος υδροξειδίου του νατρίου, ελήφθησαν 13,7 g μίγματος μέσου και όξινων αλάτων. Για να μετατραπούν σε χλωριούχο νάτριο, χρειάζονται 75 g υδροχλωρικού οξέος με κλάσμα μάζας HCl 10%. Βρείτε τον όγκο του διοξειδίου του άνθρακα που απορροφάται.
42. Ένα μείγμα υδροχλωρικού και θειικού οξέος με συνολική μάζα 600 g διαλύματος με τα ίδια κλάσματα μάζας οξέων κατεργάστηκε με περίσσεια διττανθρακικού νατρίου και ελήφθησαν 32,1 dm3 αερίου (Ν °). Βρείτε το κλάσμα μάζας των οξέων στο αρχικό μείγμα.
43. Για την εξουδετέρωση 1 dm3 διαλύματος ΝθΟΗ καταναλώθηκαν 66,66 cm3 διαλύματος HNO3 με κλάσμα μάζας 63% και πυκνότητα 1,5 g / cm3. Ποιος όγκος διαλύματος θειικού οξέος με κλάσμα μάζας 24,5% και πυκνότητα 1,2 g / cm3 θα χρειαζόταν για την εξουδετέρωση της ίδιας ποσότητας αλκαλίων;
44. Σε ποια αναλογία όγκου πρέπει να ληφθεί διάλυμα θειικού οξέος με κλάσμα μάζας 5% και πυκνότητα 1,03 g / cm3 και διάλυμα υδροξειδίου του βαρίου με κλάσμα μάζας 5% και πυκνότητα 1,1 g / cm3 για πλήρη εξουδετέρωση; Φανταστείτε την απάντηση ως το πηλίκο του όγκου του αλκαλικού διαλύματος στο όξινο διάλυμα.
45. Υπολογίστε τον ελάχιστο όγκο διαλύματος αμμωνίας με πυκνότητα 0,9 g / cm3 και κλάσμα μάζας 25%, που είναι απαραίτητο για την πλήρη απορρόφηση διοξειδίου του άνθρακα που λαμβάνεται με την αποσύνθεση 0,5 kg φυσικού ασβεστόλιθου με κλάσμα μάζας ανθρακικού ασβεστίου ίσο με 92%.
46. Για την πλήρη μετατροπή 2,92 g μίγματος υδροξειδίου του νατρίου και ανθρακικού νατρίου σε χλωριούχο, απαιτούνται 1,344 dm 3 υδροχλωρίου (NU). Βρείτε τη μάζα ανθρακικού νατρίου στο μείγμα.
47. Σε 25 g διαλύματος θειικού χαλκού (II) με κλάσμα μάζας 16% προστέθηκε ποσότητα διαλύματος υδροξειδίου του νατρίου με κλάσμα μάζας 16%. Το σχηματισθέν ίζημα διηθήθηκε, μετά το οποίο το διήθημα ήταν αλκαλικό. Για να εξουδετερωθεί πλήρως το διήθημα, χρειάστηκαν 25 cm3 διαλύματος θειικού οξέος με μοριακή συγκέντρωση 0,1 mol / dm3 του διαλύματος. Υπολογίζεται η μάζα του προστιθέμενου διαλύματος υδροξειδίου του νατρίου.
48. Η ουσία που ελήφθη με πλήρη αναγωγή CuO με μάζα 15,8 g υδρογόνου με όγκο 11,2 dm 3 (NU) διαλύθηκε με θέρμανση σε πυκνό θειικό οξύ. Ποιος είναι ο όγκος του αερίου (NU) που απελευθερώνεται ως αποτέλεσμα της αντίδρασης;
49. Για την πλήρη εξουδετέρωση 50 cm3 υδροχλωρικού οξέος με κλάσμα μάζας ΗΟΙ 20% και πυκνότητα 1,10 g / cm3, χρησιμοποιήθηκε διάλυμα υδροξειδίου του καλίου με κλάσμα μάζας ΚΟΗ 20%. Ποια είναι η χημική ποσότητα νερού που περιέχεται στο προκύπτον διάλυμα;
50. Το αέριο που λαμβάνεται με τη διέλευση μιας περίσσειας CO2 πάνω από 0,84 g θερμού άνθρακα, αποστέλλεται στην αντίδραση με 14,0 g θερμαινόμενου οξειδίου του χαλκού (II). Ποιος όγκος διαλύματος νιτρικού οξέος με κλάσμα μάζας 63% και πυκνότητα 1,4 g / cm3 είναι απαραίτητος για την πλήρη διάλυση της ουσίας που προέκυψε κατά την τελευταία αντίδραση;
51. Όταν φρύξαμε σε σταθερό βάρος νιτρικού χαλκού (II), το βάρος του αλατιού μειώθηκε κατά 6,5 g. Ποιο βάρος αλάτων αποσυντέθηκε;
52. Όταν χρησιμοποιήθηκε περίσσεια υδροχλωρικού οξέος, απελευθερώθηκαν 6,72 dm3 (NW) αερίου σε ένα μείγμα αλουμινίου με ένα άγνωστο μονοσθενές μέταλλο και η μάζα του μίγματος μειώθηκε κατά το ήμισυ. Όταν κατεργάσθηκε το υπόλειμμα με αραιό νιτρικό οξύ, απελευθερώθηκε 0,373 dm 3 (NU) ΝΟ. Προσδιορίστε άγνωστο μέταλλο.
53. Η μάζα του δείγματος κιμωλίας είναι 105 g και η χημική ποσότητα του στοιχείου οξυγόνου στη σύνθεσή του είναι 1 mol. Προσδιορίστε το κλάσμα μάζας του CaCO3 στο δείγμα κιμωλίας (το οξυγόνο περιλαμβάνεται μόνο στη σύνθεση του ανθρακικού ασβεστίου).
54. Στην αλληλεπίδραση του οξειδίου του θείου (VI) με νερό, ελήφθη ένα διάλυμα με κλάσμα μάζας θειικού οξέος 25%. Όταν στο διάλυμα αυτό προστέθηκε περίσσεια Ba (OH) 2, κατατέθηκε ένα ίζημα που ζυγίζει 29,13 g. Ποιες μάζες S03 και H20 δαπανήθηκαν για το σχηματισμό ενός διαλύματος οξέος;
55. Όταν διήλθε το SO2 μέσω 200 g ενός διαλύματος με κλάσμα μάζας ΝαΟΗ 16%, σχηματίστηκε ένα μίγμα αλάτων, περιλαμβανομένων 41,6 g ενός όξινου άλατος. Ποια είναι η μάζα θείου που περιέχει προσμείξεις κατά 4,5% κατά βάρος, χρησιμοποιήθηκε για να ληφθεί S02 Ποιο είναι το βάρος του μεσαίου αλατιού;
56. Η αλληλεπίδραση με 80 g διαλύματος Ca (NO3) 2 έλαβε 50 g διαλύματος Na2CO3. Η καταβύθιση διαχωρίστηκε, ενώ την επεξεργάστηκε με περίσσεια υδροχλωρικού οξέος, απελευθερώθηκε 2,24 dm 3 (NU) αερίου. Ποια είναι τα κλάσματα μάζας των αλάτων στις αρχικές λύσεις; Ποιο είναι το κλάσμα μάζας του νιτρικού νατρίου στο διάλυμα μετά το διαχωρισμό του ιζήματος;
57. Όταν ο ψευδάργυρος αλληλεπιδρά με θειικό οξύ, σχηματίζεται 10 dm 3 (NU) μίγματος S02 και H2S με σχετική πυκνότητα αργού 1,51. Ποια είναι η ποσότητα χημικού διαλύματος ψευδαργύρου; Ποιο είναι το κλάσμα μάζας του SO 2 στο μείγμα αερίων;
58. Δείγμα μίγματος πριονιδιού ψευδαργύρου και αλουμινίου με συνολική μάζα 11 g διαλύθηκε σε περίσσεια αλκαλικού διαλύματος. Προσδιορίστε την ποσότητα (NU) του απελευθερούμενου αερίου, εάν το κλάσμα μάζας ψευδαργύρου στο μείγμα είναι 30%.
59. Το υδροξείδιο του νατρίου βάρους 4,0 g αλείφεται με υδροξείδιο αργιλίου βάρους 9,8 g. Υπολογίζεται η μάζα του ληφθέντος μετάλλουλαμινικού νατρίου.
60. Κατά την επεξεργασία 10 g μίγματος χαλκού και αλουμινίου με πυκνό νιτρικό οξύ στο θερμοκρασία δωματίου απελευθερώθηκε 2,24 dm 3 αέριο (NU). Ποιος όγκος (NU) αερίου θα απελευθερωθεί κατά την επεξεργασία της ίδιας μάζας μίγματος με περίσσεια διαλύματος ΚΟΗ;
61. Ένα κράμα χαλκού και αργιλίου βάρους 20 g υποβλήθηκε σε επεξεργασία με περίσσεια αλκαλίων, το αδιάλυτο υπόλειμμα διαλύθηκε σε πυκνό νιτρικό οξύ. Το λαμβανόμενο άλας απομονώθηκε, πυρώθηκε σε σταθερό βάρος και ελήφθησαν 8 g στερεού υπολείμματος. Προσδιορίστε τον όγκο του εξαντλημένου διαλύματος NaOH με κλάσμα μάζας 40% και πυκνότητα 1,4 g / cm 3).
62. Ένα μίγμα από αλουμίνιο και οξείδιο μετάλλου (II) (μη αμφοτερικό οξείδιο) που ζυγίζει 39 g υποβλήθηκε σε επεξεργασία με περίσσεια διαλύματος ΚΟΗ, το εκπεμπόμενο αέριο καίγεται για να ληφθούν 27 g νερού. Το αδιάλυτο υπόλειμμα διαλύθηκε πλήρως σε 25,2 cm3 διαλύματος με κλάσμα μάζας ΗΟΙ 36,5% και πυκνότητα 1,19 g / cm3). Προσδιορίστε το οξείδιο.
63. Ένα μείγμα τσιπ ψευδαργύρου και χαλκού υποβλήθηκε σε επεξεργασία με περίσσεια διαλύματος ΚΟΗ, ενώ απελευθερώθηκε ένα αέριο 2,24 dm 3 (NU). Για την πλήρη χλωρίωση του ίδιου δείγματος μετάλλου, απαιτήθηκε χλώριο με όγκο 8,96 dm 3 (NU). Υπολογίζεται το κλάσμα μάζας του ψευδαργύρου στο δείγμα.
64. Ένα μείγμα πριονιδίων από σίδηρο, αλουμίνιο και μαγνήσιο με μάζα 49 g υποβλήθηκε σε επεξεργασία με περίσσεια αραιού H2S04, λαμβάνοντας έτσι 1.95 mol αέριου. Ένα άλλο τμήμα του ιδίου μείγματος που ζυγίζει 4,9 g υποβλήθηκε σε επεξεργασία με περίσσεια αλκαλικού διαλύματος · ελήφθη 1,68 dm 3 (NU) αερίου. Βρείτε τη μάζα των μετάλλων στο μείγμα.
65. Ποια είναι η μάζα του ιζήματος που σχηματίζεται όταν συγχωνεύονται διαλύματα που περιέχουν 10 g ΝαΟΗ και 13.6 g ZnCl2;
66. Υπάρχουν δύο μέρη του μείγματος Al, Mg, Fe, Zn, το ίδιο σε γραμμομοριακή σύνθεση, το καθένα ζυγίζει 7.4 g. Ένα τμήμα διαλύθηκε σε υδροχλωρικό οξύ και ελήφθησαν 3.584 dm3 αερίου (NU), το άλλο σε διάλυμα αλκαλίων και Λαμβάνεται 2,016 dm 3 αέριο (NU). Είναι γνωστό ότι και στα δύο μίγματα υπάρχουν 3 άτομα Ζη ανά άτομο Α1. Βρείτε τη μάζα των μετάλλων στο μείγμα.
67. Ένα μίγμα χαλκού, μαγνησίου και αργιλίου βάρους 1 g υποβλήθηκε σε επεξεργασία με περίσσεια υδροχλωρικού οξέος. Το διάλυμα διηθήθηκε, προστέθηκε περίσσεια διαλύματος ΝθΟΗ στο διήθημα. Το ίζημα διαχωρίστηκε και φρύχθηκε σε σταθερή μάζα 0,2 γρ. Το υπόλειμμα, το οποίο αδιάλυτο μετά από κατεργασία με υδροχλωρικό οξύ, πυρώθηκε στον αέρα και ελήφθησαν 0,8 γρ μαύρης ουσίας. Βρείτε το κλάσμα μάζας αλουμινίου στο μείγμα.
68. Όταν θερμαίνεται σε ένα ρεύμα κράματος οξυγόνου ψευδαργύρου, μαγνησίου και χαλκού, η μάζα του μίγματος αυξάνεται κατά 9,6 γρ. Το προϊόν διαλύεται μερικώς σε αλκάλιο και 40 κ.εκ. διαλύματος με κλάσμα μάζας ΚΟΗ 40% και πυκνότητα 1,4 γρ. / Εκ. Είναι αναγκαία για τη διάλυση 3 Για την αντίδραση με το ίδιο τμήμα του κράματος απαιτούνται 0,7 mol ΗΟΙ. Βρείτε χημικές ποσότητες μετάλλων στο κράμα.
69. Ένα κράμα χαλκού και ψευδαργύρου βάρους 5 g υποβλήθηκε σε επεξεργασία με περίσσεια διαλύματος ΝαΟΗ. Κατόπιν το στερεό υπόλειμμα διαχωρίστηκε και κατεργάστηκε με πυκνό ΗΝΟ3, το άλας που ελήφθη με τον τρόπο αυτό απομονώθηκε, πυρώθηκε μέχρι σταθερού βάρους και ελήφθησαν 2,5 g στερεού υπολείμματος. Προσδιορίστε τη μάζα των μετάλλων στο κράμα.
70. Ένα κράμα χαλκού και αλουμινίου βάρους 12,8 g υποβλήθηκε σε επεξεργασία με περίσσεια υδροχλωρικού οξέος. Το μη διαλυμένο υπόλειμμα διαλύθηκε σε πυκνό νιτρικό οξύ, το προκύπτον διάλυμα εξατμίστηκε, το ξηρό υπόλειμμα πυρώθηκε σε σταθερό βάρος και ελήφθησαν 4 g στερεού. Προσδιορίστε το κλάσμα μάζας του χαλκού στο κράμα.
71. Σε ποια αναλογία μάζας θα πρέπει να ληφθούν δύο μερίδια του Α1, έτσι ώστε όταν προστεθεί κάποιος στο διάλυμα αλκαλίου και το άλλο να ισορροπηθούν ίσες ποσότητες υδρογόνου στο υδροχλωρικό οξύ α;
72. Κατά την επεξεργασία ενός μίγματος αλουμινίου και οξειδίου του χαλκού (II) με περίσσεια διαλύματος ΚΟΗ απελευθερώθηκε 6.72 dm 3 (NU) αερίου και με διάλυση του ιδίου τμήματος του μίγματος σε πυκνό HNO3 σε θερμοκρασία δωματίου, λήφθηκαν 75.2 g άλατος. Βρείτε τη μάζα του αρχικού μείγματος ουσιών.
73. Ποια μάζα οξειδίου χαλκού (II) μπορεί να αποκατασταθεί με υδρογόνο που λαμβάνεται με αντίδραση μιας περίσσειας αλουμινίου με 139,87 cm3 διαλύματος με 40% ΝθΟΗ και πυκνότητα 1,43 g / cm3.
74. Με την πλήρη οξείδωση 7.83 g του κράματος δύο μετάλλων, σχηματίστηκαν 14.23 g οξειδίων, κατά τη διάρκεια των οποίων η περίσσεια αλκαλίων παρέμεινε αδιάλυτη σε 4.03 g ιζήματος. Προσδιορίστε την ποιοτική σύνθεση των μετάλλων που σχηματίζουν το κράμα, εάν τα κατιόντά τους έχουν οξειδωτική κατάσταση +2 και +3 και η μοριακή αναλογία των οξειδίων είναι 1: 1 (υποθέστε ότι το οξείδιο του μετάλλου με την κατάσταση οξείδωσης +3 έχει αμφοτερικές ιδιότητες).
75. Δύο τμήματα αλουμινίου, που έχουν την ίδια μάζα, διαλύθηκαν: μία σε διάλυμα υδροξειδίου του καλίου και η άλλη σε υδροχλωρικό οξύ. Πώς οι όγκοι των εξελιγμένων αερίων (nos) σχετίζονται μεταξύ τους;
76. Ένα κράμα χαλκού με αργίλιο βάρους 1.000 g υποβλήθηκε σε επεξεργασία με περίσσεια αλκαλικού διαλύματος, το αδιάλυτο ίζημα διαλύθηκε σε νιτρικό οξύ, κατόπιν το διάλυμα εξατμίστηκε, το υπόλειμμα υποβλήθηκε σε φρύξη σε σταθερό βάρος. Η μάζα του νέου υπολείμματος είναι 0,398 g. Ποια είναι η μάζα των μετάλλων στο κράμα;
77. Ένα κράμα ψευδαργύρου και χαλκού βάρους 20 g υποβλήθηκε σε επεξεργασία με περίσσεια διαλύματος ΝαΟΗ με κλάσμα μάζας 30% και πυκνότητα 1,33 g / cm3. Το στερεό υπόλειμμα απομονώθηκε και κατεργάστηκε με μια περίσσεια ενός συμπυκνωμένου διαλύματος ΗΝΟ3. Το άλας που σχηματίστηκε κατά τη διάρκεια αυτής της διαδικασίας απομονώθηκε και φρύχθηκε σε σταθερό βάρος. Η μάζα του στερεού υπολείμματος ήταν 10,016 g. Υπολογίζονται τα κλάσματα μάζας των μετάλλων στο κράμα και ο όγκος του αλκαλικού διαλύματος που καταναλώνεται.
78. Ένα κράμα χαλκού και αλουμινίου βάρους 2 g υποβλήθηκε σε επεξεργασία με περίσσεια αλκαλικού διαλύματος. Το υπόλειμμα διηθήθηκε, πλύθηκε, διαλύθηκε σε ΗΝΟ 3, το διάλυμα εξατμίστηκε και πυρώθηκε μέχρι σταθερού βάρους. Η μάζα του υπολείμματος μετά την φρύξη ήταν 0,736 g. Υπολογίζονται τα κλάσματα μάζας των μετάλλων στο κράμα.
79. Η χλωρίωση ενός μείγματος σιδήρου, χαλκού και αλουμινίου απαιτεί 8,96 dm 3 χλωρίου (NU) και η αλληλεπίδραση του ίδιου δείγματος με υδροχλώριο απαιτεί 5,6 dm 3 (NU). Όταν αλληλεπιδρούν με την ίδια μάζα μείγματος μετάλλων με αλκάλια, απελευθερώνεται 1,68 dm 3 (NU) αερίου. Βρείτε χημικές ποσότητες μετάλλων στο μείγμα.
80. Υδρίδιο του καλίου βάρους 5,0 g διαλύθηκε σε νερό με όγκο 80 cm3 και προστέθηκε αλουμίνιο με βάρος 0,81 g στο προκύπτον διάλυμα. Βρείτε τα κλάσματα μάζας των ουσιών στο προκύπτον διάλυμα με ακρίβεια έως και χιλιοστά του ποσοστού.
ΚΑΤΑΛΟΓΟΣ ΛΟΓΟΤΕΧΝΙΑΣ
1. Barannik, V.P. Σύγχρονη ρωσική ονοματολογία ανόργανων ενώσεων / V.P. Barannik // Journal of the All-Union Chemical Society. D.I. Μεντελλέεφ. - 1983. - Τόμος XXVIII. - σελ. 9-16.
2. Wroblewski, Α.Ι. Χημικός προσομοιωτής / Α.Ι. Wroblewski. - 2η έκδοση, Pererab. και προσθέστε. - Minsk: Krasiko-Print, 2007. - 624 σελ.
3. Glinka, N.L. Καθήκοντα και ασκήσεις γενικής χημείας: μελέτες. εγχειρίδιο για τα πανεπιστήμια / εκδ. V.A. Rabinovich and Η.Μ. Ρούμπινα. - M .: Integral-Press, 2004. - 240 σελ.
4. Lidin, R.A. Καθήκοντα γενικά και ανόργανη χημεία: μελέτες. εγχειρίδιο για σπουδαστές ανώτερων. μελέτες. institutions / R.A. Lidin, V.A. Milk, L.L. Andreeva; από ed. R.A. Λίντινα. - Μ .: ΒΛΑΔΟΣ, 2004. - 383 σελ.
5. Lidin, R.A. Θεμελιώδη στοιχεία της ονοματολογίας των ανόργανων ουσιών / R.A. Lidin [et αϊ]; από ed. B.D. Stepina. - Μ.: Chemistry, 1983. - 112 ρ.
6. Stepin, B.D. Εφαρμογή των κανόνων IUPAC στην ονοματολογία ανόργανων ενώσεων στα ρωσικά / B.D. Stepin, R.A. Lidin // Εφημερίδα της Ολικής Ένωσης Χημικών Εταιρειών. D.I. Μεντελλέεφ. - 1983. - Τόμος XXVIII. - σελ. 17-20.
| Εισαγωγή .............................................................................. Γενικοί κανόνες για το φάσμα των ανόργανων ουσιών ............ .. Οξείδια ....................................... .................................... Βασικά οξείδια .................................................................. ... Οξείδια οξέων ....................................... ............................ Αμφοτερικά οξείδια ............................................................... .. Απόκτηση οξειδίων .................................................................. Ασκήσεις για ανεξάρτητη εργασία σε Το θέμα "Οξείδια" ............................................................. Οξέα ............................................................................... Ασκήσεις για ανεξάρτητη εργασία με θέμα "Οξέα" .................................................................. Λόγοι ............................................................ ......... .. Ασκήσεις για ανεξάρτητη εργασία με θέμα "Ιδρύματα" ................................................................ Αλάτια ..................................................................................... Ασκήσεις για ανεξάρτητη εργασία με θέμα "Άλατα" .......................................................... Γενετική σχέση μεταξύ κατηγοριών ανόργανων ενώσεων .......................................... ............... .. Ασκήσεις για ανεξάρτητη εργασία με θέμα «Γενετική σύνδεση μεταξύ κατηγοριών ανόργανων ενώσεων» ...................................................... Πειραματικά πειράματα με θέμα «Κύριες κατηγορίες ανόργανων ενώσεων ............... ......... .. Καθήκοντα διευθέτησης ..................................................................... Αναφορές ...................................................... |
εκπαιδευτικό: να καθορίσει την έννοια της "γενετικής σειράς", "γενετική σύνδεση"? διδάσκουν πώς να δημιουργήσουν γενετικές σειρές στοιχείων (μέταλλα και μη μέταλλα), για να διαμορφώσουν τις εξισώσεις αντίδρασης που αντιστοιχούν στις γενετικές σειρές. Ελέγχει πώς εξομοιώνεται η γνώση των χημικών ιδιοτήτων των οξειδίων, οξέων, αλάτων, βάσεων.
αναπτύσσοντας: αναπτύσσουν την ικανότητα να αναλύουν, να συγκρίνουν, να συνοψίζουν και να εξαγάγουν συμπεράσματα, να συνθέτουν τις εξισώσεις των χημικών αντιδράσεων.
εκπαιδευτικό : να προωθήσουν το σχηματισμό μιας επιστημονικής κοσμοθεωρίας.
2. Παροχή τάξεων: τους πίνακες "Περιοδικό σύστημα", "Πίνακας διαλυτότητας", "Σειρά δραστηριοτήτων μετάλλων", οδηγίες για μαθητές, εργασίες για τη δοκιμή γνώσεων.
3. Τάξη εκτέλεσης:
3.1. Μετωπική έρευνα.
3.2. Η λύση των καθηκόντων.
3.3. Εκτελέστε εργασίες επαλήθευσης στις επιλογές.
4. Διάταξη αναφοράς:
4.1. Γράψτε το θέμα και τους στόχους του πρακτικού μαθήματος.
4.2. Καταγράψτε την επίλυση προβλημάτων.
4.3. Λύστε τη δική σας εκδοχή της ανεξάρτητης εργασίας, την απόφαση να γράψετε σε ένα σημειωματάριο και να μεταβείτε στο δάσκαλο για έλεγχο.
Πρόοδος εργασίας
1. Μετωπική συνομιλία σχετικά με:
Τι είναι μια γενετική σύνδεση;
Γενετικές συνδέσεις - αυτές είναι οι συνδέσεις μεταξύ διαφορετικών κατηγοριών με βάση τις αλληλομετατροπές τους.
Τι είναι μια γενετική σειρά;
Γενετική σειρά - μια σειρά ουσιών - εκπρόσωποι διαφορετικών τάξεων, οι οποίες είναι ενώσεις ενός χημικού στοιχείου, που συνδέονται με ενδομετατροπές και αντανακλούν τις μεταβολές αυτών των ουσιών. Η βάση αυτών των σειρών είναι το ίδιο στοιχείο.
Ποιοι τύποι γενετικών σειρών κατανέμονται συνήθως;
Μεταξύ των μετάλλων υπάρχουν δύο τύποι σειρών:
α) Μια γενετική σειρά στην οποία το αλκάλιο δρα ως βάση. Αυτή η σειρά μπορεί να αναπαρασταθεί χρησιμοποιώντας τους ακόλουθους μετασχηματισμούς:
μέταλλο → βασικό οξείδιο → αλκάλιο → αλάτι
για παράδειγμα, η γενετική σειρά του καλίου K → K 2 O → KOH → KCl
β) Η γενετική σειρά, όπου η βάση είναι μια αδιάλυτη βάση, τότε η σειρά μπορεί να εκπροσωπείται ως μια αλυσίδα μετασχηματισμών:
μέταλλο → οξείδιο βάσης → αλάτι → αδιάλυτη βάση → οξείδιο βάσης → μέταλλο
για παράδειγμα: Cu - CuO - CuCl2 - Cu (OH) 2 - CuO - Cu
Μεταξύ των μη-μετάλλων είναι επίσης δυνατή η διάκριση δύο τύπων σειρών:
α) Η γενετική σειρά των μη-μετάλλων, όπου το διαλυτό οξύ δρα ως σύνδεσμος στη σειρά. Η αλυσίδα των μετασχηματισμών μπορεί να αναπαρασταθεί ως εξής: μη-μέταλλο → όξινο οξείδιο → διαλυτό οξύ → άλας.
Για παράδειγμα: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
β) Γενετική σειρά μη-μετάλλων, όπου αδιάλυτο οξύ: μη μέταλλο → όξινο οξείδιο → άλας → οξύ → οξείδιο οξέος → μη μέταλλο ενεργεί ως σύνδεσμος στη σειρά
Για παράδειγμα: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Εκτέλεση εργασιών για επιλογές:
| Επιλογή 1 | Επιλογή 2 |
|
I: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
Επιλογή II: Na2S04, NaOH, Na, Na2O2, Na2O
Εργασία: καταγράψτε μια βαθμιαία μετάβαση από ασβέστιο σε ανθρακικό ασβέστιο και προετοιμάστε μια έκθεση σχετικά με τη χρήση οποιουδήποτε άλατος στην ιατρική (χρησιμοποιώντας επιπλέον βιβλιογραφία).
Οδηγίες για πρακτικό μάθημα
Γενετική σχέση μεταξύ των κύριων κατηγοριών ανόργανων ουσιών.
Στόχοι: να καθορίσει την έννοια της "γενετικής σειράς", "γενετική σύνδεση"? να μάθουν να κάνουν γενετικές σειρές στοιχείων (μέταλλα και μη μέταλλα), να συνθέτουν τις εξισώσεις αντίδρασης που αντιστοιχούν στις γενετικές σειρές. επαναλάβετε τις ιδιότητες των οξειδίων, οξέων, αλάτων, βάσεων.
Πρόοδος εργασίας
Γράψτε τους ορισμούς των εννοιών:
Γενετική σχέση - __________________________________________
Γενετική σειρά - ___________________________________________
Μια γενετική σειρά μετάλλων στα οποία το αλκάλιο λειτουργεί ως βάση. μπορεί να αντιπροσωπεύεται γενικά: μέταλλο → βασικό οξείδιο → άλκαλι → άλας. Κάντε αυτή τη σειρά χρησιμοποιώντας κάλιο. Γράψτε τις εξισώσεις αντιδράσεων, με τις οποίες μπορείτε να ολοκληρώσετε αυτή την αλυσίδα μετασχηματισμών.
Η γενετική σειρά των μη-μετάλλων, όπου το διαλυτό οξύ δρα ως σύνδεσμος στη σειρά μπορεί να αναπαρασταθεί ως εξής: μη-μέταλλο → όξινο οξείδιο → διαλυτό οξύ → άλας. Κάντε αυτή τη σειρά χρησιμοποιώντας φωσφόρο. Γράψτε τις εξισώσεις αντιδράσεων, με τις οποίες μπορείτε να ολοκληρώσετε αυτή την αλυσίδα μετασχηματισμών.
Γενετική σειρά, όπου η βάση είναι αδιάλυτη βάση μπορεί να αναπαρασταθεί από την αλυσίδα μετασχηματισμών: μέταλλο → βασικό οξείδιο → αλάτι → αδιάλυτη βάση → βασικό οξείδιο → μέταλλο. Κατασκευάστε αυτή τη σειρά χρησιμοποιώντας χαλκό. Γράψτε τις εξισώσεις αντιδράσεων, με τις οποίες μπορείτε να ολοκληρώσετε αυτή την αλυσίδα μετασχηματισμών.
Η γενετική σειρά των μη-μετάλλων, όπου το αδιάλυτο οξύ λειτουργεί ως σύνδεσμος στη σειρά μπορεί να αναπαρασταθεί από την αλυσίδα μετασχηματισμών: μη-μέταλλο → όξινο οξείδιο → άλας → οξύ → οξείδιο οξέος → μη μέταλλο. Κατασκευάστε αυτή τη σειρά χρησιμοποιώντας πυρίτιο. Γράψτε τις εξισώσεις αντιδράσεων, με τις οποίες μπορείτε να ολοκληρώσετε αυτή την αλυσίδα μετασχηματισμών.
Εκτελέστε εργασίες για επιλογές:
| Επιλογή 1 | Επιλογή 2 |
|
1. Επιλέξτε τους τύπους οξειδίων στην έκδοση σας, εξηγήστε την επιλογή σας, με βάση τη γνώση των χαρακτηριστικών της σύνθεσης αυτής της κατηγορίας ενώσεων. Καλέστε τους.
2. Στη στήλη του τύπου της παραλλαγής σας, βρείτε τους τύπους οξέων και εξηγήστε την επιλογή σας με βάση την ανάλυση της σύνθεσης αυτών των ενώσεων.
3. Προσδιορίστε τα σθένη των υπολειμμάτων οξέος στην σύνθεση οξέων.
4. Επιλέξτε τύπους αλάτων και ονομάστε τους.
5. Συμπληρώστε τους τύπους των αλάτων, τα οποία μπορούν να σχηματιστούν με μαγνήσιο και οξέα της παραλλαγής σας. Γράψτε τα, ονομάστε τα.
6. Στη στήλη του τύπου της παραλλαγής σας, βρείτε τους τύπους βάσης και εξηγήστε την επιλογή σας με βάση την ανάλυση της σύνθεσης αυτών των ενώσεων.
7. Στην παραλλαγή σας, επιλέξτε τους τύπους των ουσιών με τις οποίες μπορεί να αντιδράσει ένα διάλυμα ορθοφωσφορικού οξέος (υδροχλωρικό, θειικό). Κάντε τις κατάλληλες εξισώσεις αντίδρασης.
9. Μεταξύ των τύπων της επιλογής σας, επιλέξτε τύπους ουσιών που μπορούν να αλληλεπιδρούν μεταξύ τους. Κάντε τις κατάλληλες εξισώσεις αντίδρασης.
10. Κάντε μια αλυσίδα γενετικών δεσμών ανόργανων ενώσεων, οι οποίες θα περιλαμβάνουν μια ουσία, ο τύπος της οποίας δίνεται στην έκδοση σας στο νούμερο ένα.
Από αυτές τις ουσίες δημιουργεί μια γενετική γραμμή χρησιμοποιώντας όλους τους τύπους. Γράψτε τις εξισώσεις αντίδρασης με τις οποίες μπορείτε να ολοκληρώσετε αυτή την αλυσίδα μετασχηματισμών:
Εγώ επιλογή: ZnS04, Ζη, ΖηΟ, Ζη, Ζη (ΟΗ) 2
ΙΙεπιλογή: Na2S04, NaOH, Na, Na2O2, Na2O
Εργασία: καταγράψτε μια βαθμιαία μετάβαση από ασβέστιο σε ανθρακικό ασβέστιο και προετοιμάστε μια έκθεση σχετικά με τη χρήση οποιουδήποτε άλατος στην ιατρική (χρησιμοποιώντας επιπλέον βιβλιογραφία).
