Χημικός τύπος θειικού οξέος. Θειικό οξύ: χημικές ιδιότητες, παρασκευή
H2SO3, ασθενές διβασικό οξύ. Σε ελεύθερη μορφή δεν διατίθεται, υπάρχει σε λύσεις νερού. Θειώδες θειικό οξύ ... Μεγάλο Εγκυκλοπαιδικό Λεξικό
Θειικό οξύ - (H2S03) ασθενές διβασικό οξύ. Υπάρχει μόνο σε υδατικά διαλύματα. Άλατα S. έως. Εφαρμόζεται στο χαρτί χαρτοπολτού και στη βιομηχανία τροφίμων. Βλέπε επίσης οξέα και ανυδρίτες ... Ρωσική εγκυκλοπαίδεια για την προστασία της εργασίας
θειικό οξύ - - [A.S. Goldberg. Αγγλικό ρωσικό λεξικό ενέργειας. 2006] Θέματα ενέργειας εν γένει EN θειώδες οξύ ... Οδηγός Τεχνικού Μεταφραστή
H2SO3, ασθενές διβασικό οξύ. Σε ελεύθερη μορφή δεν διατίθεται, υπάρχει σε λύσεις νερού. Θειώδες θειικό οξύ. * * * Θειικό οξύ, θειικό οξύ, H2SO3, ασθενές διβασικό οξύ. Το δωρεάν δεν έχει επιλεγεί, ... ... Εγκυκλοπαιδικό λεξικό
θειικό οξύ - σουλφονιτοκαταστευτικά σκευάσματα Τρίτης χημικής μορφής H2SO3 προϊόντα: αγγλικά. σουλφονώδη όξινη ρούσα. θειϊκό οξύ ryšiai: sinonimas - vandenilio trioksosulfatas (2-) ... Chemijos terminų aiškinamasis žodynas
H2SO3, ασθενές διβασικό οξύ, που αντιστοιχεί στον βαθμό οξείδωσης του θείου +4. Γνωστή μόνο σε αραιά υδατικά διαλύματα. Οι σταθερές διάστασης: Κ1 = 1,6 · 10 2, Κ2 = 1,0 · 107 (18 ° C). Δίνει δύο σειρές αλάτων: φυσιολογικά θειώδη και ξινό ... ... Μεγάλη Σοβιετική Εγκυκλοπαίδεια
H2SO3, ασθενές διβασικό οξύ. Στην ελεύθερη μορφή δεν επισημαίνεται, υπάρχει στα ύδατα. p rah. Άλατα S. k. Sulfites ... Φυσική επιστήμη. Εγκυκλοπαιδικό λεξικό
Βλέπε Θείο ... Εγκυκλοπαιδικό λεξικό της FA Brockhaus και Ι.Α. Εφρόνα
Το διοξείδιο του θείου (διοξείδιο) σχηματίζεται με την καύση του θείου στον αέρα ή το οξυγόνο. Λαμβάνεται επίσης με τη διαπύρωση στον αέρα ("καύση") σουλφιδίων μετάλλων, για παράδειγμα, πυριτικών σιδήρων:
Σύμφωνα με αυτή την αντίδραση, το διοξείδιο του θείου λαμβάνεται συνήθως στη βιομηχανία (για άλλες βιομηχανικές μεθόδους απόκτησης cm, 9 § 131).
Το διοξείδιο του θείου είναι ένα άχρωμο αέριο ("διοξείδιο του θείου") με αιχμηρό καυτό θείο. Συσσωρεύεται εύκολα σε ένα άχρωμο υγρό που βράζει. Όταν το υγρό εξατμίζεται, υπάρχει μια ισχυρή μείωση της θερμοκρασίας (πριν).
Το διοξείδιο του θείου είναι εξαιρετικά διαλυτό σε νερό (περίπου 40 όγκοι σε 1 όγκο νερού σε). ταυτόχρονα, λαμβάνει χώρα εν μέρει η αντίδραση με νερό και σχηματίζεται θειώδες οξύ:
Έτσι, το διοξείδιο του θείου είναι ανυδρίτης του θειικού οξέος. Όταν θερμαίνεται, η διαλυτότητα μειώνεται και η ισορροπία μετατοπίζεται προς τα αριστερά. σταδιακά απελευθερώνεται από το διάλυμα όλο το διοξείδιο του θείου.
Το μόριο είναι κατασκευασμένο παρόμοια με το μόριο του όζοντος. Οι πυρήνες των ατόμων που το αποτελούν σχηματίζουν ένα τρίγωνο ισοσκελής:
Εδώ, το άτομο θείου, όπως το κεντρικό άτομο οξυγόνου στο μόριο του όζοντος, βρίσκεται στην κατάσταση α-υβριδοποίησης και η γωνία είναι κοντά. Προσανατολισμένη κάθετα στο επίπεδο του μορίου, το τροχιακό του ατόμου θείου δεν συμμετέχει στον υβριδισμό. Λόγω αυτών των τροχιακών και, παρομοίως προσανατολισμένων, τροχιακών των ατόμων οξυγόνου, σχηματίζεται ένας τριών κεντρικός δεσμός. το ζεύγος ηλεκτρονίων που το φέρει ανήκει και στα τρία άτομα του μορίου.
Το διοξείδιο του θείου χρησιμοποιείται για την παραγωγή θειικού οξέος και επίσης (σε πολύ μικρότερες ποσότητες) για το λεύκανση του άχυρου, του μαλλιού, του μεταξιού και ως απολυμαντικού (για την καταστροφή των μυκήτων σε υπόγεια, κελάρια, βαρέλια κρασιού, δεξαμενές ζύμωσης).
Το θειικό οξύ είναι μια πολύ εύθραυστη ένωση. Είναι γνωστό μόνο σε υδατικά διαλύματα. Όταν προσπαθεί να απομονώσει το θειώδες οξύ, αποσυντίθεται σε νερό. Για παράδειγμα, όταν το πυκνό θειικό οξύ επενεργεί σε θειώδες νάτριο, το διοξείδιο του θείου απελευθερώνεται αντί του θειώδους οξέος:
Το διάλυμα θειικού οξέος πρέπει να προστατεύεται από τον αέρα, διαφορετικά, απορροφώντας οξυγόνο από τον αέρα, οξειδώνεται αργά προς θειικό οξύ:
Το θειικό οξύ είναι ένας καλός αναγωγικός παράγοντας. Για παράδειγμα, αποκαθίστανται ελεύθερα αλογόνα από αλογονίδια υδρογόνου:
![]()
Ωστόσο, όταν αλληλεπιδρά με ισχυρούς αναγωγικούς παράγοντες, το θειικό οξύ μπορεί να παίξει το ρόλο ενός οξειδωτικού παράγοντα. Έτσι, η αντίδρασή του με υδρόθειο προχωρά κυρίως σύμφωνα με την εξίσωση:
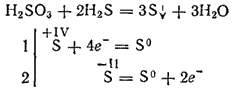
Δεδομένου ότι είναι διβασικό, το θειώδες οξύ σχηματίζει δύο σειρές αλάτων. Τα μεσαία άλατά του ονομάζονται θειώδη άλατα, όξινα άλατα - υδροθειώδη.
Όπως το οξύ, τα θειώδη και τα υδροθειώδη είναι αναγωγικοί παράγοντες. Όταν οξειδώνονται, λαμβάνονται άλατα θειικού οξέος.
Τα θειώδη άλατα των πλέον δραστικών μετάλλων κατά τη διάρκεια της φρύξης αποσυντίθενται με το σχηματισμό σουλφιδίων και θειικών αλάτων (αντίδραση αυτοοξειδώσεως - αυτο-αναγωγή):
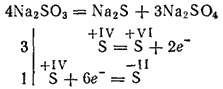
Τα θειώδη κάλιο και νάτριο χρησιμοποιούνται για τη λεύκανση ορισμένων υλικών στη βιομηχανία κλωστοϋφαντουργίας για τη βαφή υφασμάτων, στη φωτογραφία. Το διάλυμα (αυτό το άλας υπάρχει μόνο σε διάλυμα) χρησιμοποιείται για την επεξεργασία του ξύλου στον λεγόμενο πολτό θειώδους άκρου, από τον οποίο παράγεται χαρτί.
Το θειώδες οξύ είναι ικανό να αντιδράσει με το οξυγόνο. Αυτό σχηματίζει θειικό οξύ. Η αντίδραση αυτή διαρκεί πολύ και είναι δυνατή μόνο εάν παραβιαστούν οι κανόνες αποθήκευσης. Το θειικό οξύ έχει τόσο οξειδωτικές όσο και αναγωγικές ιδιότητες. Με τη βοήθειά του μπορείτε να πάρετε οξέα αλογόνου. Ένα υδατικό διάλυμα όταν αντιδρά με χλώριο σχηματίζει υδροχλωρικό και θειικό οξύ.
Όταν αντιδρά με ισχυρούς αναγωγικούς παράγοντες, το θειώδες οξύ παίζει το ρόλο ενός οξειδωτικού παράγοντα. Μία από αυτές τις ουσίες είναι το υδρόθειο, ένα αέριο με πολύ δυσάρεστη οσμή. Σε αλληλεπίδραση με ένα υδατικό διάλυμα θειικού οξέος, σχηματίζει θείο και νερό. Τα άλατα θειικού οξέος έχουν επίσης μειωτικές ιδιότητες. Διαιρούνται σε θειώδη και υδροθειώδη. Οι αντιδράσεις οξειδώσεως αυτών των αλάτων παράγουν θειικό οξύ.
Παραγωγή θειικού οξέος
Το θειικό οξύ σχηματίζεται μόνο με την αλληλεπίδραση του διοξειδίου του θείου και του νερού. Ανάγκη να πάρει ξινό αέριο. Αυτό μπορεί να γίνει με χαλκό και θειικό οξύ. Γυρίστε προσεκτικά το πυκνό θειικό οξύ μέσα στο σωλήνα και ρίξτε ένα κομμάτι χαλκού μέσα σε αυτό. Ζεσταίνετε το σωλήνα με μια λυχνία.
Ως αποτέλεσμα της θέρμανσης, σχηματίζεται θειικό χαλκό (θειικό χαλκό), νερό και διοξείδιο του θείου, το οποίο με τη βοήθεια ενός ειδικού σωλήνα πρέπει να φέρεται στον κώνο με καθαρό νερό. Με αυτόν τον τρόπο, μπορεί να ληφθεί θειικό οξύ.
Θυμηθείτε ότι το διοξείδιο του θείου είναι επιβλαβές για τον άνθρωπο. Προκαλεί ζημιά στον αεραγωγό, απώλεια της όρεξης και πονοκέφαλο. Η παρατεταμένη εισπνοή μπορεί να προκαλέσει λιποθυμία. Όταν εργάζεστε μαζί του, χρειάζεται προσοχή.
Χρήση θειικού οξέος
Το θειικό οξύ έχει αντισηπτικές ιδιότητες. Χρησιμοποιείται στην απολύμανση των επιφανειών, τη ζύμωση των κόκκων. Μπορεί να χρησιμοποιηθεί για τη λεύκανση ορισμένων ουσιών που αποσυντίθενται όταν αντιδρούν με ισχυρά οξειδωτικά (για παράδειγμα, χλώριο). Τέτοιες ουσίες περιλαμβάνουν το μαλλί, το μετάξι, το χαρτί και κάποιες άλλες. Οι αντιβακτηριδιακές του ιδιότητες χρησιμοποιούνται για την αποφυγή της ζύμωσης του κρασιού σε βαρέλια. Έτσι, ένα ευγενές ποτό μπορεί να αποθηκευτεί για πολύ καιρό, αποκτώντας μια ευγενή γεύση και μοναδικό άρωμα.
Το θειικό οξύ χρησιμοποιείται στην κατασκευή χαρτιού. Η προσθήκη αυτού του οξέος περιλαμβάνεται στην τεχνολογία παραγωγής θειώδους πολτού. Στη συνέχεια επεξεργάζεται με διάλυμα υδροθειώδους ασβεστίου για να δεσμεύσει τις ίνες μεταξύ τους.
