Σχέδιο της δομής του πυριτίου. Δομή κελύφους ηλεκτρονίων
Ατομική δομή Θέση σε PS: Περίοδος ΙΙΙ. ομάδα IV, που οδηγεί. Φόρτιση πυρήνα: +14 Si; Σχετική ατομική μάζα: Ar (Si) = 28 Ατομική δομή: p = 14, e = 14, η = = 14 Ηλεκτρονικός τύπος: + 14 Si 2e, 8e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
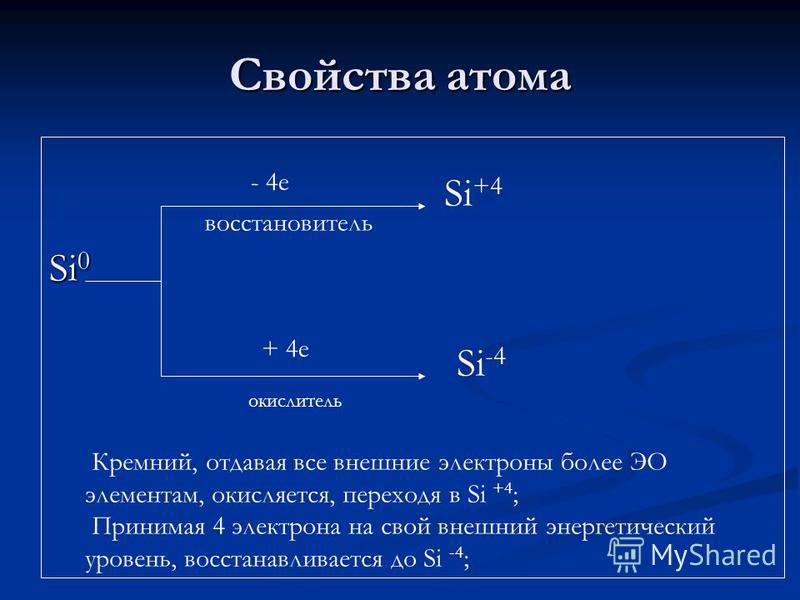
Ατομικές ιδιότητες Si e αναγωγικός παράγοντας + 4 e οξειδωτής Si + 4 Si-Silicon, που δίνει όλα τα εξωτερικά ηλεκτρόνια σε περισσότερα στοιχεία EO, οξειδώνεται, περνώντας στο Si + 4? Λαμβάνοντας 4 ηλεκτρόνια στο εξωτερικό επίπεδο ενέργειας, μειώνεται στο Si-4.

Φυσικές ιδιότητες του πυριτίου Το πυρίτιο είναι μη μεταλλικό, υπάρχει σε κρυσταλλική και άμορφη κατάσταση. Το κρυσταλλικό πυρίτιο είναι μια ουσία γκρίζου χάλυβα με μεταλλική λάμψη, πολύ σκληρή αλλά εύθραυστη. Άμορφο πυρίτιο - καφέ σκόνη. ρ = 2,33 g / cm3. t pl. = C; t kip. = C;

Κρυστάλλινη δομή πυριτίου Α πυρήνα κρυστάλλου πυριτίου είναι ένας κυβικός προσανατολισμένος προς το κέντρο διαμάντι τύπου. Αλλά λόγω του μεγαλύτερου μήκους δεσμού μεταξύ Si-Si, η σκληρότητα του πυριτίου είναι σημαντικά μικρότερη από εκείνη του διαμαντιού. Το πυρίτιο είναι εύθραυστο, μόνο όταν θερμαίνεται πάνω από το C.

Ηλεκτροφυσικές ιδιότητες Στοιχειακό πυρίτιο Το στοιχειακό πυρίτιο είναι ένας τυπικός ημιαγωγός. τυπικό ημιαγωγό. Οι ηλεκτροφυσικές ιδιότητες του κρυσταλλικού πυριτίου επηρεάζονται σε μεγάλο βαθμό από ιχνοστοιχεία που περιέχονται σε αυτό. Για την απόκτηση μονών κρυστάλλων πυριτίου με αγωγιμότητα οπών, προστίθενται πρόσθετα στοιχείων της 3ης ομάδας βορίου, αλουμινίου, γαλλίου και ινδίου στο πυρίτιο, με ηλεκτρονική αγωγιμότητα της προσθήκης στοιχείων της 5ης ομάδας φωσφόρου, αρσενικού ή αντιμονίου.


Flint Flint, αυτό το Flint, αυτή η άσχημη και πολύ άσχημη και πολύ ανθεκτική πέτρα, ανθεκτική πέτρα, έθεσε τα θεμέλια για μια πέτρινη αρχή της πέτρινης εποχής - τον αιώνα - τον αιώνα εργαλεία φτιαγμένα με πέτρα. εργαλεία φλογών. Υπάρχουν δύο λόγοι: - ο επιπολασμός και η διαθεσιμότητα πυριτίου, - η επικράτηση και η διαθεσιμότητα πυριτίου, - την ικανότητα να σχηματίζουν αιχμηρές ακμές κοπής όταν χτυπηθούν · - την ικανότητα να σχηματίζουν αιχμηρές ακμές κοπής όταν χτυπηθούν ·




Ξέρετε ότι .. Η μέθοδος για την απόκτηση του πυριτίου στην καθαρή του μορφή αναπτύχθηκε από τον Nikolai Nikolayevich Beketov. Το πυρίτιο στη Ρωσία παράγεται σε εργοστάσια: Kamensk - Uralsky (Περιφέρεια Sverdlovsk). Kamensk - Uralsky (Περιφέρεια Sverdlovsk) Shelekh (Περιφέρεια Ιρκούτσκ). Shelekh (περιοχή Ιρκούτσκ).

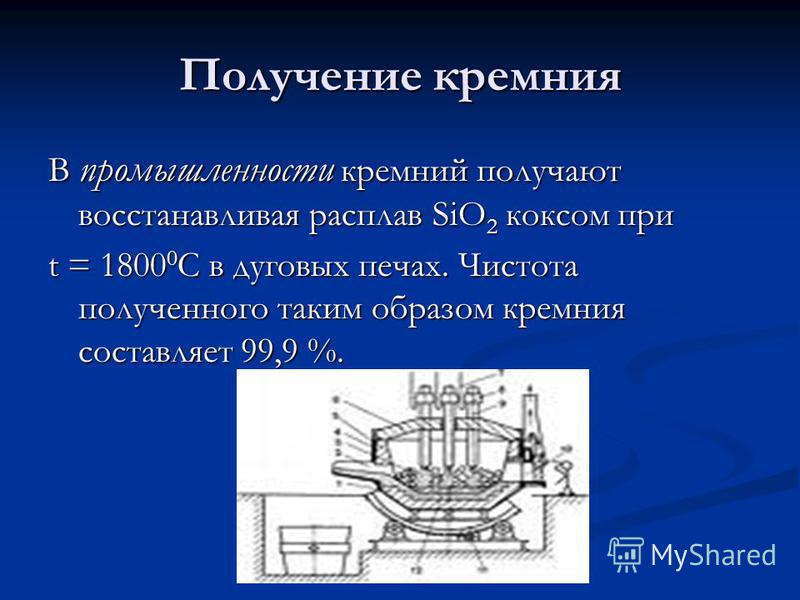
Παραγωγή πυριτίου Στη βιομηχανία, το πυρίτιο λαμβάνεται μειώνοντας το τήγμα του SiO 2 με τον οπτάνθρακα στο t = C σε κλίβανοι τόξου. Η καθαρότητα του πυριτίου που λαμβάνεται με τον τρόπο αυτό είναι 99,9%.
Απόκτηση πυριτίου Εργαστηριακή μέθοδος παραγωγής: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Χημικές ιδιότητες του πυριτίου Όταν θερμαίνεται στους 400 - C, το πυρίτιο αντιδρά με οξυγόνο για να σχηματίσει διοξείδιο του πυριτίου: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
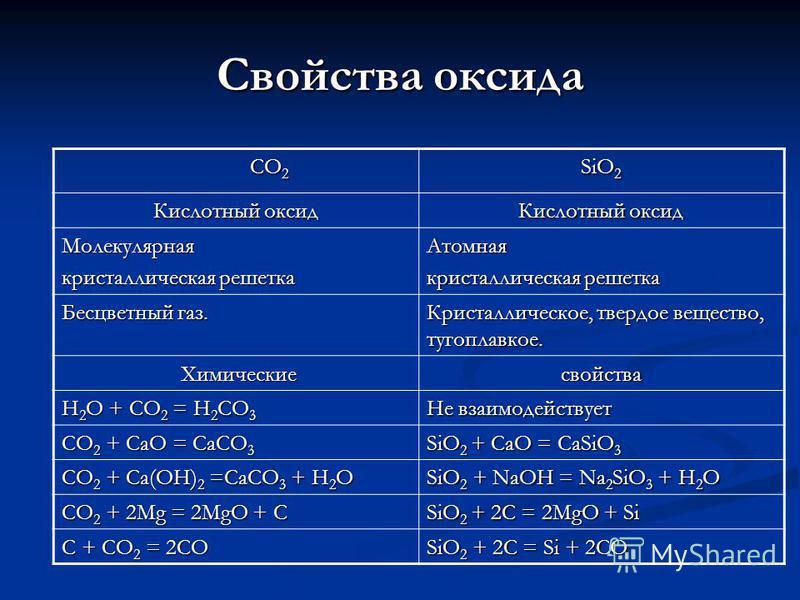
Ιδιότητες του CO 2 CO 2 SiO 2 οξείδιο Οξείδιο του οξέος Μοριακό κρυσταλλικό πλέγμα Ατομικό άχρωμο αέριο. Κρυσταλλική, συμπαγής, ανθεκτική. Χημικές Χημικές Ιδιότητες H 2 O + CO 2 = H 2 CO 3 Δεν αντιδρά CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = 2 SiO 3 + Η 2Ο C02 + 2Mg = 2MgO + C SiO2 + 2C = 2MgO + SiC + C02 = 2CO SiO2 + 2C = Si + 2CO
Ιδιότητες των οξέων H 2 CO 3 H 2 SiO 3 Διβασικό, περιέχον οξυγόνο, ασθενές, εύθραυστο, δεδομένου ότι πτήση. Διβασικό, περιέχον οξυγόνο, ασθενές, αδιάλυτο στο νερό. Λήψη: CO 2 + H 2 O = H 2 CO 3 Λήψη: SiO 2 + H 2 O = δεν μπορεί Ασταθής, εύθραυστη αποσυντίθεται όταν στέκεται ή θερμαίνεται: H2CO3 = CO2 + H2O Δεν μπορεί να επιλεχθεί στην καθαρή του μορφή, γιατί αποσυντίθεται όταν θερμαίνεται: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Μικρή έκλυση αερίου __________

Καρβονικά οξέα πυριτικών οξέων - ανθρακικά άλατα. - υδρογονάνθρακες · - πυριτικά · - πυριτικά · Τα ανθρακικά έχουν όλες τις ιδιότητες των αλάτων, είναι ισχυροί ηλεκτρολύτες, αποστασιοποιούνται πλήρως σε ιόντα (διαλυτά στο νερό). Μόνο άλατα αλκαλιμετάλλων είναι διαλυτά, τα υπόλοιπα σχηματίζουν αδιάλυτα ή καθόλου άλατα (Al +3, Cr +3, Ag +).
![]()



Βιολογικός ρόλος Η σημαντικότερη ένωση πυριτίου, SiO 2, είναι απαραίτητη για τη ζωή των φυτών και των ζώων. Χάρη σε αυτόν, τα καλάμια, τα καλάμια Χάρη σε αυτόν, τα καλάμια, τα καλάμια και τα αλογοουρά στέκονται σταθερά σαν τα ξιφολόγχη. και τα αλογοουρά στέκονται σφιχτά, όπως τα ξιφολόγχη. Τα κοφτερά φύλλα των ριζοδέζων κόβονται όπως τα κοφτά φύλλα των ριζών που κόβονται σαν μαχαίρια, τα μπουλόνια σε μαχαίρια με κουρευτικά πεδία, τα μπουλόνια σε κούρεμα κουρσάκια όπως βελόνες και οι μίσχοι των σιτηρών κολλάνε σαν βελόνες και οι μίσχοι των δημητριακών είναι τόσο ισχυροί που δεν επιτρέπουν τόσο ισχυρή μην αφήνετε το πεδίο στα πεδία να πέφτει από τη βροχή και το αιολικό πεδίο στα πεδία για να περάσει από τη βροχή και τον άνεμο


Το πυρίτιο είναι ένα ιχνοστοιχείο που περιέχεται συνεχώς στο ανθρώπινο σώμα. Η μεγαλύτερη ποσότητα περιέχεται στους λεμφαδένες, τον συνδετικό ιστό της αορτής, την τραχεία, τα μαλλιά και το δέρμα. Το πυρίτιο χρειάζεται για την κατασκευή επιθηλιακών κυττάρων. Το πυρίτιο είναι ένα ιχνοστοιχείο που περιέχεται συνεχώς στο ανθρώπινο σώμα. Η μεγαλύτερη ποσότητα περιέχεται στους λεμφαδένες, τον συνδετικό ιστό της αορτής, την τραχεία, τα μαλλιά και το δέρμα. Το πυρίτιο χρειάζεται για την κατασκευή επιθηλιακών κυττάρων. Το πυρίτιο διαδραματίζει σημαντικό ρόλο στη διαδικασία της ορυκτοποίησης των οστών. απαραίτητη για τη διατήρηση της ελαστικότητας του αρτηριακού τοιχώματος, έχει θετική επίδραση στο ανοσοποιητικό σύστημα και επιβραδύνει τη διαδικασία γήρανσης στους ιστούς του ανθρώπινου σώματος. Η μέση περιεκτικότητα πυριτίου στο αίμα είναι 8,25 mg / ημέρα. Με την ηλικία, το επίπεδό του στο σώμα μειώνεται, έτσι στους ηλικιωμένους, η ανάγκη για πυρίτιο τείνει να αυξάνεται. Βελτιώστε την απορρόφηση του πυριτίου από το σώμα την παρουσία ασβεστίου, μαγνησίου, μαγγανίου και καλίου. Το πυρίτιο διαδραματίζει σημαντικό ρόλο στη διαδικασία της ορυκτοποίησης των οστών. απαραίτητη για τη διατήρηση της ελαστικότητας του αρτηριακού τοιχώματος, έχει θετική επίδραση στο ανοσοποιητικό σύστημα και επιβραδύνει τη διαδικασία γήρανσης στους ιστούς του ανθρώπινου σώματος. Η μέση περιεκτικότητα πυριτίου στο αίμα είναι 8,25 mg / ημέρα. Με την ηλικία, το επίπεδό του στο σώμα μειώνεται, έτσι στους ηλικιωμένους, η ανάγκη για πυρίτιο τείνει να αυξάνεται. Βελτιώστε την απορρόφηση του πυριτίου από το σώμα την παρουσία ασβεστίου, μαγνησίου, μαγγανίου και καλίου.

Ο βιολογικός ρόλος του πυριτίου περιλαμβάνεται επίσης στη σύνθεση των κατώτερων ζωντανών οργανισμών - διατόμων και ακτινωτών - των πιο ευαίσθητων σβώλων της ζωντανής ύλης, που δημιουργούν τους αξεπέραστους σκελετούς ομορφιάς τους από σίλικα. Το πυρίτιο αποτελεί επίσης μέρος των κατώτερων ζωντανών οργανισμών - διατόμων και ακτινοδιαγνωστών - των πιο ευαίσθητων σβώλων της ζωντανής ύλης, που δημιουργούν την αξεπέραστη ομορφιά τους στους σκελετούς του πυριτίου. Διατομές Radiolaria Αυτοέλεγχος 1. Ποιο είναι το μέρος του πυριτίου στο περιοδικό σύστημα: α) 2 περίοδος, 4 og. β) 3 περίοδο, 3 γρ. κεφάλαιο. γ) 3 περίοδο, 4 γρ. κεφάλαιο) 2 περίοδο, 4 γρ. β) 3 περίοδο, 3 γρ. κεφάλαιο. γ) 3 περίοδο, 4 γρ. κεφάλαιο. 2. Πλέγμα πυριτίου: α) ιοντικό, β) ατομική. γ) μοριακό. α) ιονικό, β) ατομική. γ) μοριακό. 3. Σύμφωνα με τον επιπολασμό της φύσης του πυριτίου ... στοιχείο: α) πρώτα? β) το δεύτερο. γ) το τρίτο. α) το πρώτο. β) το δεύτερο. γ) το τρίτο. 4. Το πυρίτιο αντιδρά με: α) μέταλλα, υδρογόνο, αλογόνα, α) μέταλλα, υδρογόνο, αλογόνα, β) μέταλλα, αλογόνα, εύκολα διαλυτά σε αλκάλια, β) μέταλλα, αλογόνα, εύκολα διαλυτά σε αλκάλια, γ) οξείδια, οξέα, μη μέταλλα. γ) οξείδια, οξέα, μη μέταλλα. 5. Άλατα πυριτικού οξέος: α) πυριτίδια. β) υδροπυριτικά · γ) πυριτικά · α) πυριτίδια · β) υδροπυριτικά · γ) πυριτικά ·

Πυριτίου.
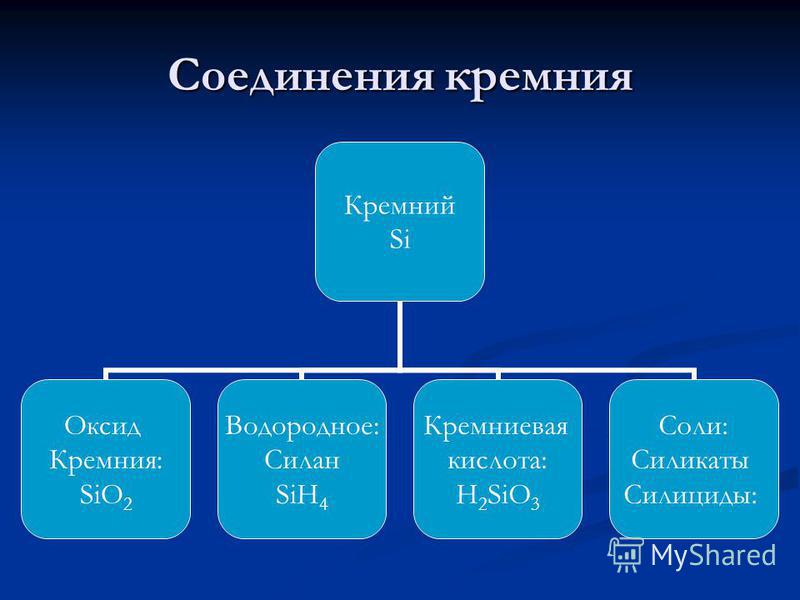
Πυριτίου - ένα στοιχείο της κύριας ομάδας υποομάδας IV της τρίτης περιόδου του περιοδικού συστήματος χημικών στοιχείων DI Mendeleev, με ατομικό αριθμό 14, ατομική μάζα: 28.0855. Στις ενώσεις, συνήθως εμφανίζει βαθμό οξείδωσης +4 (σθένος IV) και πολύ σπάνια +3, +2, και +1 (σθένος, αντιστοίχως, III, II και Ι). Στον περιοδικό πίνακα, το πυρίτιο Mendeleev βρίσκεται στην ομάδα IVA (A-υποδηλώνει ότι αυτή είναι η κύρια υποομάδα) (στην ομάδα άνθρακα), στην τρίτη περίοδο. Nemetall . Δηλωμένο με σύμβολο Si(lat Σιλικόνιο). Σε ελεύθερη μορφή - καφέ σκόνη ή ανοιχτόχρωμο συμπαγές υλικό με μεταλλική λάμψη. Δομή δικτυώματος: κυβικά, διαμάντια.
Κύρια κατάσταση: + 14 Si 14 ε 1s 2 2s 2 2p 6 3s 2 3p 2, p-στοιχείο.
2. Φυσικές ιδιότητες.
Το κρυσταλλικό πυρίτιο είναι μια σκούρα γκρι ουσία με λαμπερό χάλυβα. Η δομή του πυριτίου είναι παρόμοια με τη δομή του διαμαντιού. Στον κρύσταλλο του, κάθε άτομο περιβάλλεται από τετραεδρικές τέσσερις άλλες και συνδέεται μαζί τους με έναν ομοιοπολικό δεσμό, ο οποίος είναι πολύ ασθενέστερος από ό, τι μεταξύ των ατόμων άνθρακα σε ένα διαμάντι. Σε έναν κρύσταλλο πυριτίου, ακόμη και υπό κανονικές συνθήκες, καταστρέφονται μερικοί από τους ομοιοπολικούς δεσμούς. Επομένως, έχει ελεύθερα ηλεκτρόνια, τα οποία προκαλούν μικρή ηλεκτρική αγωγιμότητα. Όταν ο φωτισμός και η θέρμανση αυξάνουν τον αριθμό των σπασμένων δεσμών, αυτό σημαίνει ότι ο αριθμός των ελεύθερων ηλεκτρονίων αυξάνεται και η ηλεκτρική αγωγιμότητα αυξάνεται. Έτσι θα πρέπει να εξηγήσει τις ιδιότητες ημιαγωγών του πυριτίου.
Το πυρίτιο είναι πολύ εύθραυστο, η πυκνότητά του είναι 2,33 g / cm3. Όπως ο άνθρακας, αναφέρεται σε πυρίμαχες ουσίες.
Το πυρίτιο αποτελείται από τρία σταθερά ισότοπα: 2814Si (92,27%), 2914Si (4,68%) και 3014Si (3,05%).
3. Να είστε στη φύση.
Τις περισσότερες φορές στη φύση, το πυρίτιο βρίσκεται στη μορφή σίλικα - ενώσεις με βάση το διοξείδιο του πυριτίου (IV) SiO2 (περίπου 12% της μάζας του φλοιού της γης). Τα κύρια ορυκτά και τα πετρώματα που σχηματίζονται από το διοξείδιο του πυριτίου είναι η άμμος (ποτάμι και χαλαζία), ο χαλαζίας και ο χαλαζίτης, η πυρίτιδα και ο άστριος. Τα φυσικά πυριτικά έχουν πολύπλοκη σύνθεση και δομή. Εδώ είναι η σύνθεση μερικών φυσικών πυριτικών:
ü άστριο K 2 O × Al 2 O 3 × 6SiO 2,
ü αμίαντος 3MgO × 2SiO 2 × 2H 2 O,
ü μίκρο K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü καολινίτη 3Αl 2O 3 × 2SiO 2 × 2H 2 O.
Η δεύτερη πιο κοινή ομάδα στη φύση των ενώσεων πυριτίου είναι πυριτικά άλατα και αργιλιοπυριτικά
Αναφέρονται απλά γεγονότα για την εύρεση καθαρού πυριτίου στη φυσική μορφή.
4. Χημικές ιδιότητες του πυριτίου και των ενώσεών του.
Με χημικές ιδιότητες, το πυρίτιο, όπως ο άνθρακας, είναι μη μεταλλικό, αλλά η μη μεταλλικότητά του είναι λιγότερο έντονη, δεδομένου ότι έχει μεγαλύτερη ατομική ακτίνα. Δεδομένου ότι τα άτομα πυριτίου έχουν 4 ηλεκτρόνια στην εξωτερική ενεργειακή στάθμη, η κατάσταση οξείδωσης και των 4 και +4 είναι χαρακτηριστική του πυριτίου (είναι γνωστή μια ένωση πυριτίου, όπου ο βαθμός οξείδωσης είναι +2).
Το πυρίτιο υπό κανονικές συνθήκες είναι μάλλον αδρανές, το οποίο πρέπει να εξηγείται από τη δύναμη του κρυσταλλικού πλέγματος. Απευθύνεται σε απευθείας επικοινωνία μόνο με φθόριο:
Οξέα (εκτός από το μείγμα υδροφθορικού HF και νιτρικού HNO 3)το πυρίτιο δεν δρα. Ωστόσο, διαλύεται σε υδροξείδια αλκαλικών μετάλλων, σχηματίζοντας πυριτικό άλας και υδρογόνο:
Από τις δύο αλλοτροπικές τροποποιήσεις του πυριτίου, του κρυσταλλικού και του άμορφου, το άμορφο πυρίτιο είναι πιο χημικά ενεργό. Αντιδρά με οξυγονωμένο όταν θερμαίνεται, σχηματίζοντας Si02:
καθώς και με όλους αλογόναγια παράδειγμα:
![]()
Σε υψηλή θερμοκρασία το πυρίτιο συνδέεται με άνθρακασχηματίζοντας το SiC Carborundum:
Το Carborundum έχει ένα διαμαντόμορφο κρυσταλλικό πλέγμα, στο οποίο κάθε άτομο πυριτίου περιβάλλεται από τέσσερα άτομα άνθρακα και αντίστροφα και οι ομοιοπολικοί δεσμοί είναι πολύ ισχυροί, όπως στο διαμάντι. Ως εκ τούτου, στη σκληρότητα είναι κοντά στο διαμάντι. Οι πέτρες λείανσης και οι τροχοί λείανσης κατασκευάζονται από καρβίδιο του πυριτίου.
Μαγνήσιο πυριτιοκτόνο. Σε αντιδράσεις με ενεργά μέταλλα, που εμφανίζονται με το σχηματισμό του πυριτίδια, Το πυρίτιο δρα ως οξειδωτικό μέσο:
Σε υψηλές θερμοκρασίες, το πυρίτιο ανακτά πολλά μέταλλα από τα οξείδια τους (!!!)
Σιλάνη Κάτω από τη δράση του υδροχλωρικού οξέος σε πυριτίδια, η απλούστερη ένωση υδρογόνου του πυριτίου είναι το σιλάνιο SiH 4:
Το σιλάνιο είναι ένα δηλητηριώδες αέριο με δυσάρεστη οσμή, που αναφλέγεται στον αέρα (!!!):
Οξείδιο του πυριτίου (IV).Το οξείδιο του πυριτίου (IV) καλείται επίσης σίλικα. Είναι μια στερεά πυρίμαχη ουσία. (σημείο τήξης 1700 ° C) διαδεδομένη στη φύση με δύο μορφές:
1) κρυσταλλική πυριτία - με τη μορφή ορυκτού του χαλαζία και των ποικιλιών του (κρυστάλλινα πετρώματα, χαλκηδόνια, αχάτη, ιάσιρ, πυρίτιο). ο χαλαζίας αποτελεί τη βάση των άμμων χαλαζία που χρησιμοποιούνται ευρέως στην κατασκευή και στη βιομηχανία πυριτικών.
2) άμορφο πυρίτιο - με τη μορφή της σύνθεσης οξειδίου του οσπίου SiO 2 × n Η2Ο; Οι γήινες μορφές του άμορφου πυριτίου είναι διατομίτης, τρίπολη (γη φουσκώματος). Ένα παράδειγμα τεχνητής άμορφης άνυδρης πυριτίας είναι το διοξείδιο του πυριτίου, το οποίο λαμβάνεται από μεταπυριτικό νάτριο:
Το σίλικα ζελ έχει ανεπτυγμένη επιφάνεια και κατά συνέπεια απορροφά την υγρασία καλά. .
Σε 1710 ° λειώνουν χαλαζία. Με την ταχεία ψύξη της τετηγμένης μάζας σχηματίζεται γυαλί χαλαζία . Έχει πολύ χαμηλό συντελεστή διαστολής, έτσι ώστε το γυαλί χαλαζία να μην σπάει όταν ψύχεται γρήγορα το νερό. Τα γυάλινα εργαστήρια και τα όργανα επιστημονικής έρευνας κατασκευάζονται από γυαλί χαλαζία.
Ο απλούστερος τύπος οξειδίου του πυριτίου (IV) S02 είναι παρόμοιος με τον τύπο μονοξειδίου του άνθρακα (IV) CO 2. Εν τω μεταξύ, οι φυσικές τους ιδιότητες είναι πολύ διαφορετικές (SiO 2 - στερεό, CO 2 - αέριο). Η διαφορά αυτή εξηγείται από τη δομή των κρυσταλλικών πλεγμάτων. Το C0 2 κρυσταλλώνεται στο μοριακό πλέγμα, SiO2 - στο ατομικό. Η δομή του SiO2 σε μια επίπεδη εικόνα μπορεί να αναπαρασταθεί ως εξής:
Ο αριθμός συντονισμού ενός ατόμου άνθρακα στο στερεό CO2 είναι 2 και το πυρίτιο στο Si02 είναι 4. Κάθε άτομο πυριτίου περικλείεται σε ένα τετράεδρο με 4 άτομα οξυγόνου. Την ίδια στιγμή, το άτομο πυριτίου βρίσκεται στο κέντρο και τα άτομα οξυγόνου βρίσκονται στις κορυφές του τετραεδριού . Ολόκληρο το κομμάτι πυριτίας μπορεί να θεωρηθεί ως ένας κρύσταλλος του οποίου ο τύπος είναι (Si02) n. Αυτή η δομή του οξειδίου του πυριτίου (IV) καθορίζει την υψηλή σκληρότητα και την ανθεκτικότητα του .
Οι χημικές ιδιότητες του οξειδίου του πυριτίου (IV) SiO 2 αναφέρονται σε όξινα οξέα. Όταν συντηχθούν με στερεά αλκάλια, βασικά οξείδια και ανθρακικά, σχηματίζονται άλατα πυριτικού οξέος:
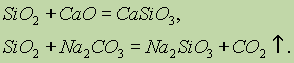
Μόνο το υδροφθορικό οξύ αλληλεπιδρά με το οξείδιο του πυριτίου (IV):
Αυτή η αντίδραση χρησιμοποιείται για τη χάραξη γυαλιού. .
Το πυρίτιο (IV) δεν διαλύεται στο νερό και δεν αλληλεπιδρά χημικά με αυτό. (!!!) Συνεπώς, το πυριτικό οξύ λαμβάνεται εμμέσως με δράση με ένα οξύ σε διάλυμα πυριτικού καλίου ή νατρίου:
Στην περίπτωση αυτή, το πυριτικό οξύ (ανάλογα με τη συγκέντρωση των αρχικών διαλυμάτων άλατος και οξέος) μπορεί να ληφθεί τόσο ως ζελατινώδης μάζα που περιέχει νερό όσο και ως κολλοειδές διάλυμα (sol).
Πυριτικό οξύ. Το SiO2 είναι ο ανυδρίτης ενός αριθμού πυριτικών οξέων, η σύνθεση του οποίου μπορεί να εκφραστεί από τον γενικό τύπο: xSiO 2 × yH 2 O, όπου x και y - ακέραιοι αριθμοί:
1) χ = 1, γ = 1: Si02 χ Η20, δηλ. H2Si03 - μεταπυριτικό οξύ.
2) χ = 1, γ = 2: Si02 * 2Η2Ο, δηλ. Η4Si04- ορθο-πυριτικό οξύ.
3) x = 2, γ = 1: 2SiO2 χ Η20, δηλ. H2Si205 - διμεθακρυνικό οξύ.
Το πυριτικό οξύ κατασκευάζεται από τετραεδρικές δομικές μονάδες (σε κάθε τέτοια μονάδα, το άτομο πυριτίου βρίσκεται στο κέντρο του τετραεδρικού και υπάρχουν άτομα οξυγόνου στις κορυφές). Οι δομικές συνδέσεις, που ενώνουν τις αλυσίδες, σχηματίζουν πιο σταθερά οξέα πολυσιλικόνης:
Η σύνθεση τέτοιων ενώσεων μπορεί να εκφραστεί με τον τύπο (Η2Si03) η. Ωστόσο, συνήθως το πυριτικό οξύ αντιπροσωπεύεται από τον τύπο H2SiO3. H2SiO3 - το οξύ είναι πολύ αδύναμο, ελάχιστα διαλυτό στο νερό. Όταν θερμαίνεται εύκολα αποσυντίθεται όπως το ανθρακικό οξύ:
Όλα τα πυριτικά οξέα είναι πολύ αδύναμα (ασθενέστερα από τον άνθρακα).
Πυριτικά άλατα. Τα άλατα όλων των πυριτικών οξέων καλούνταιπυριτικά άλατα, αν και, κατά κανόνα, στην εκπαιδευτική βιβλιογραφία, τα πυριτικά άλατα υποδηλώνουν άλατα μεθακλικιλικού οξέος. Η σύνθεσή τους αντιπροσωπεύεται συνήθως από τον τύπο με τη μορφή ενώσεων των οξειδίων των στοιχείων. Για παράδειγμα, το πυριτικό ασβέστιο CaSiO 3 μπορεί να εκφραστεί ως: CaO × SiO 2.
Τα πυριτικά άλατα της σύνθεσης R20 × nSi02, όπου R20-οξείδια νατρίου ή καλίου , καλούνται διαλυτό γυαλί , α τα συγκεντρωμένα υδατικά διαλύματα τους - υγρό γυαλί . Το γυαλί σόδας του νατρίου είναι το πιο σημαντικό..
Όταν στέκεται στον αέρα, τα διαλύματα πυριτικών αλάτων αναπτύσσονται θολά, δεδομένου ότι το διοξείδιο του άνθρακα (IV) στον αέρα μετατοπίζει το πυριτικό οξύ από τα άλατά του:
Το πυριτικό οξύ είναι πρακτικά αδιάλυτο στο νερό - αυτή η ιδιότητα χρησιμοποιείται ως ποιοτική αντίδραση στο ιόν SiO3 2-.
Τα πυριτικά άλατα λαμβάνονται με τήξη πυριτίας με αλκάλια ή ανθρακικά άλατα:
5. Ανακάλυψη του ιόντος SiO 3 2. (Δεν μπορώ να βρω τίποτα ...)
6. Ο ρόλος των ενώσεων πυριτίου στον σχηματισμό του εδάφους και στη δασοκομία.
Τα πυριγενή πετρώματα είναι αρκετά σταθερά στη σύνθεσή τους και περιέχουν κυρίως ενώσεις πυριτίου, αλουμινίου, σιδήρου, αλκαλίων, μαγνησίου και ασβεστίου. Σύμφωνα με την περιεκτικότητα σε Si02, τα πυριγενή πετρώματα χωρίζονται σε τέσσερις ομάδες: όξινα (\u003e 65%), μεσαία (52-65%), βασικά (40-52%) και υπεραστικά (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Όξινα πυρωμένα πετρώματα- γρανίτες, pegmatites, ryolites, dacite και άλλοι - συνήθως έχουν ένα ελαφρύ και καφέ χρώμα με έντονα κρυστάλλους χαλαζία, άστριο, μαρμαρυγία. Η περιεκτικότητα σε SiO 2 είναι υψηλή (πάνω από 65%) με σημαντική ποσότητα καλίου και νατρίου. Ταυτόχρονα, το μικρό σίδηρο, το ασβέστιο και το μαγνήσιο είναι αμελητέα. Τα εδάφη σε όξινα πυριγενή πετρώματα, για παράδειγμα, σε γρανίτες, διαφέρουν κατά τα αρχικά στάδια της αντοχής στις καιρικές συνθήκες με ευθρυπτότητα, χαλίκι χαρακτήρα του αρχικού υλικού. Όταν ζυμώνουν υπό υγρές συνθήκες, χάνουν εύκολα στοιχεία αλκαλικών γαιών, ως αποτέλεσμα των οποίων το έδαφος σε τέτοια υποβαθμισμένα υποστρώματα (έκλουση πετρωμάτων) είναι εξαιρετικά φτωχές, ελάχιστα γόνιμες.
Κύρια πυριγενή πετρώματα -βασάλτη, gabbro, κλπ., κατά κανόνα, έχουν ένα σκοτεινό (μαύρο) χρώμα. Χαρακτηρίζονται από χαμηλότερη περιεκτικότητα σε SiO 2 σε σύγκριση με όξινα πετρώματα. Τα κύρια πυριγενή πετρώματα είναι σχετικά πλούσια σε ενώσεις σιδήρου, μαγγανίου, χρωμίου, κοβαλτίου, ψευδαργύρου, τιτανίου, νικελίου, χαλκού. Τα προϊόντα των καιρικών συνθηκών αποκτούν γρήγορα έναν χαρακτήρα πηλού, διατηρούν μια αλκαλική και ουδέτερη αντίδραση για μεγάλο χρονικό διάστημα και διακρίνονται από μια αυξημένη περιεκτικότητα σε χούμο και αργιλώδη ορυκτά. Το έδαφος σε τέτοιους βράχους είναι πιο γόνιμο.
Εκτός από τα όξινα και βασικά είδη βρίσκονται συχνά πυριγενείς πετρώματα μεταβατικού τύπου(μεσαία) - παρεμβατικά πετρώματα της ομάδας του διορίτη και των ανακουφιστικών ομολόγων τους - ανδεσίτες. Συνεπώς, τα εδάφη αυτών των πετρωμάτων αποκτούν χαρακτηριστικά παρόμοια με εκείνα που περιορίζονται σε όξινα ή βασικά πετρώματα. Πολύ λιγότερο κοινό υπερβολικές φυλές:περιδοτίτες και πικρίτες, οι οποίοι έχουν τη μικρότερη περιεκτικότητα σε SiO2.
Μεταμορφωμένα βράχια -μεταβατικά μεταξύ των τεράστιων κρυσταλλικών και ιζηματογενών πετρωμάτων. Οι αρχαίοι ιζηματογενείς βράχοι κάτω από καταδύσεις, υψηλή πίεση και θερμοκρασίες μεταμορφώνονται, σχηματίζοντας γνώσεις, σερπεντινίτες, μάρμαρο, χαλαζίτες, σχιστόλιθο. Τα γνέσια είναι ιδιαίτερα παρόμοια σε σύνθεση με γρανίτες. Τα εδάφη που σχηματίζονται σε τέτοια πετρώματα έχουν παρόμοια χαρακτηριστικά με τα εδάφη των ίδιων των όξινων πυριγενών βράχων.
Χλώριο.
1. Η θέση του αλουμινίου στον πίνακα D. I. Mendeleev. Η δομή του ατόμου, που εκδηλώνεται βαθμός οξείδωσης.
Χλώριο - ένα στοιχείο της κύριας υποομάδας της ομάδας VII, η 3η περίοδος, με ατομικό αριθμό 17. Σημειώνεται με το σύμβολο Cl (lat. Chlorum). Χημικά ενεργός μη μεταλλικά . Συμπεριλαμβάνεται στην ομάδα αλογόνου .
Απλή χλώριο ουσία υπό κανονικές συνθήκες - το δηλητηριώδες αέριο κιτρινωπό πράσινο χρώμα είναι βαρύτερο από τον αέρα, με έντονη οσμή . Μορφοδιατομικό μόριο χλωρίου (τύπος CI 2).
Κύρια κατάσταση: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-στοιχείο. Άρθρα: -1 +1 +3 +5 +7.
Η δομή του κελύφους ηλεκτρονίων.
Στο επίπεδο σθένος του ατόμου χλωρίου περιέχει 1 μη ζευγαρωμένο ηλεκτρόνιο : 1s 2 2s 2 2p 6 3s 2 3p 5, οπότε το σθένος του 1 για ένα άτομο χλωρίου είναι πολύ σταθερό. Λόγω της παρουσίας στο άτομο του χλωρίου των μη κατειλημμένων τροχιακών d-subblevel, το άτομο χλωρίου μπορεί να παρουσιάζει άλλους βαθμούς οξείδωσης. Σχέδιο σχηματισμού διεγερμένων καταστάσεων του ατόμου:
Είναι επίσης γνωστές ενώσεις χλωρίου στις οποίες το άτομο χλωρίου επιδεικνύει τυπικά σθένος 4 και 6, για παράδειγμα Cl02 και Cl206. Ωστόσο, αυτές οι ενώσεις είναι ρίζες, δηλαδή, έχουν ένα μη ζευγαρωμένο ηλεκτρόνιο.
2. Φυσικές ιδιότητες.
Υπό κανονικές συνθήκες, το χλώριο είναι ένα κίτρινο-πράσινο αέριο με ασφυκτική οσμή. Ορισμένες από τις φυσικές του ιδιότητες παρουσιάζονται παρακάτω.
Πυκνότητα: 3.214 g / l, λίτρων - στους -35 ° C - 1.557, τηλεόραση. σε -105 ° C - 1,9 g / cm3.
Σημείο τήξεως: 172,2 Κ
Σημείο ζέσεως: 238,6 K
Θερμότητα σύντηξης: 6,41 kJ / mol
Θερμότητα εξάτμισης: 20,41 kJ / mol.
Το αέριο χλωρίου είναι σχετικά εύκολα υγροποιημένο. Ξεκινώντας με πίεση 0,8 MPa (8 ατμόσφαιρες), το χλώριο θα είναι υγρό ήδη σε θερμοκρασία δωματίου. Όταν ψύχεται σε θερμοκρασία -34 ° C, το χλώριο γίνεται επίσης υγρό σε κανονική ατμοσφαιρική πίεση. Το υγρό χλώριο είναι ένα κίτρινο-πράσινο υγρό με πολύ υψηλή διαβρωτική δράση (λόγω της υψηλής συγκέντρωσης μορίων). Με την αύξηση της πίεσης, μπορείτε να επιτύχετε την ύπαρξη υγρού χλωρίου μέχρι θερμοκρασίας +144 ° C (κρίσιμη θερμοκρασία) σε κρίσιμη πίεση 7,6 MPa. Από την άποψη της ηλεκτρικής αγωγιμότητας, το υγρό χλώριο λαμβάνει χώρα μεταξύ των ισχυρότερων μονωτών: διεξάγει ρεύμα σχεδόν δις φορές περισσότερο από το αποσταγμένο νερό και 10-22 φορές χειρότερο από το ασήμι. Η ταχύτητα του ήχου στο χλώριο είναι περίπου ενάμισι φορές μικρότερη από ό, τι στον αέρα.
3. Να είστε στη φύση.
Στη φύση, υπάρχουν δύο ισότοπα χλωρίου 35Cl και 37Cl. Το χλώριο είναι το πιο κοινό αλογόνο στο φλοιό της γης. . Το χλώριο είναι πολύ ενεργό - συνδέεται άμεσα με σχεδόν όλα τα στοιχεία του περιοδικού συστήματος. Ως εκ τούτου, στη φύση, βρίσκεται μόνο με τη μορφή ενώσεων στη σύνθεση των ορυκτών:
ü halite NaCl,
ü sylvina KCl,
ü Sylvinite KCl · NaCl,
ü δισχοφίτη MgCl2 · 6H2O,
ü καρναλλίτη KCl · MgCl2 · 6H2O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
Τα μεγαλύτερα αποθέματα χλωρίου περιέχονται σε άλατα, νερά, θάλασσες και ωκεανούς (η περιεκτικότητα σε θαλάσσιο νερό είναι 19 g / l). Το χλώριο αντιπροσωπεύει το 0,024% του συνολικού αριθμού ατόμων στο φλοιό της γης. clarke number (αριθμοί που εκφράζουν τη μέση περιεκτικότητα των χημικών στοιχείων στο φλοιό της γης, την υδροσφαίρια, τη Γη, τα διαστημικά σώματα, τα γεωχημικά ή κοσμοχημικά συστήματα, κλπ., σε σχέση με τη συνολική μάζα αυτού του συστήματος, εκφράζεται σε% ή g / kg). χλώριο - 0,017%. Το ανθρώπινο σώμα περιέχει 0,25% χλωριούχα ιόντα κατά βάρος. Στους ανθρώπους και τα ζώα, το χλώριο βρίσκεται κυρίως στα διακυτταρικά υγρά (συμπεριλαμβανομένου του αίματος) και παίζει σημαντικό ρόλο στη ρύθμιση των ωσμωτικών διεργασιών, καθώς και σε διαδικασίες που σχετίζονται με το έργο των νευρικών κυττάρων.
4. Χημικές ιδιότητες του χλωρίου και των ενώσεών του. Λαμβάνοντας χλώριο.
Η δομή του ατόμου πυριτίου. Si. +14. Ενθουσιασμένη κατάσταση. Ε. 3d. 3ρ. 3s. Ε. 3d. 3ρ. 3s. 1s 2s 2ρ 3δ 3ρ. 2e 8e 4e. 2. 2. 6. 2. 2.
Εικόνα 3 της παρουσίασης "Silicon" σε μαθήματα χημείας με θέμα το "πυρίτιο"Διαστάσεις: 960 x 720 εικονοστοιχεία, μορφή: jpg. Για να κατεβάσετε μια δωρεάν εικόνα για ένα μάθημα χημείας, κάντε δεξί κλικ στην εικόνα και κάντε κλικ στην επιλογή "Αποθήκευση εικόνας ως ...". Για να εμφανίσετε τις εικόνες στο μάθημα, μπορείτε επίσης να κατεβάσετε μια δωρεάν παρουσίαση του "Silicon.ppt" με όλες τις εικόνες σε ένα zip-archive. Μέγεθος αρχείου - 562 KB.
Λήψη παρουσίασηςΠυριτίου
"Σιλικόνη και οι ενώσεις του" - Η δομή και οι ιδιότητες των ατόμων. Ημιαγωγός. t τήξη (Si) = 1415 ° C, t τήξη (διαμάντι) = 3730 ° C. Λήψη πυριτίου. Η ανακάλυψη του πυριτίου. Περιλαμβάνεται επίσης στη σύνθεση φυτών και ζώων. Οι φυσικές ιδιότητες του πυριτίου. Ως εκ τούτου, το τούβλο είναι κεραμικά, και τα κεραμίδια και θραύσματα του αρχαίου ελληνικού αμφορέα είναι επίσης κεραμικά. Στόχοι: Οι χημικές ιδιότητες του πυριτίου.
"Ενώσεις πυριτίου" - πυρίτιο και ενώσεις του. Χημικές ιδιότητες του SiO2. Σιλάνη Λαμβάνοντας πυριτικό οξύ. Ιδιότητες πυριτίου. Οξείδιο του πυριτίου. Φυσικά πυριτικά άλατα. Οξειδωτική κατάσταση Rhinestone Topaz. Λαμβάνοντας πυρίτιο στο εργαστήριο. Όντας στη φύση. Κρυστάλλινα πλέγματα. Η ανακάλυψη του πυριτίου. Αμέθυστος. Λήψη πυριτίου.
"Ισότοπα πυριτίου" - Διαχωρισμός ισοτόπων πυριτίου. Παραγωγή πολυκρυσταλλικού πυριτίου. Προοπτικές για τη χρήση μονοϊσοτοπικού πυριτίου. Ισοτοπική αραίωση όταν αναπτύσσεται ένας μόνος κρύσταλλος από χωνευτήριο χαλαζία. Παραγωγή σπόρων μονοκρυστάλλων. Εξάρτηση της θέσης του μέγιστου της ζώνης Raman στην ατομική μάζα.
"Μάθημα πυριτίου" - Ποια από τα πιο σημαντικά χημικά στοιχεία στη διαβίωση και τη μη διαβίωση; Οξείδια άνθρακα και πυριτίου. Η ουσία είναι διαφανής. Στην εκδήλωση μη μεταλλικών και μεταλλικών ιδιοτήτων. Συνοψίζοντας την αντανάκλαση. Τελική δοκιμή. Οξείδια άνθρακα και υδροξείδια του πυριτίου; Η κατάσταση της συνάθροισης: α) υγρό, β) αέριο, γ) στερεό.
Το "πυρίτιο" - το πυρίτιο είναι μια απλή ουσία. Φυσικές ιδιότητες. Οξείδιο του πυριτίου (IV). Πυριτίδια Σημασία για ζωντανούς οργανισμούς. Αλληλεπίδραση με μέταλλα. Αλληλεπίδραση με μη μέταλλα. Καρβίδιο του πυριτίου. Το πυρίτιο στη φύση. Πυριτίου. Προϊόντα πυριτικής βιομηχανίας. Ένας από τους τύπους φυσικών ενώσεων πυριτίου είναι τα πυριτικά άλατα.
"Άνθρακας και πυρίτιο" - Οξείδιο του πυριτίου (IV). Στοιχεία της ομάδας IV της κύριας υποομάδας. Τοξικότητα. 7. Ενδιαφέρον για τον άνθρακα. Πυριτικά άλατα. Ολισθήστε με την αφή. Το Diamond είναι η πιο σκληρή φυσική ουσία. Χημικές ιδιότητες Περισσότερο από το 99% του άνθρακα στην ατμόσφαιρα έχει τη μορφή διοξειδίου του άνθρακα. Καρβίδια. 6. Εφαρμογή. Ένα από τα πιο μαλακά από τα στερεά.
Υπάρχουν συνολικά 6 παρουσιάσεις.
