Φυσικές ιδιότητες του sio2. Οξυγόνες ενώσεις. Σιλικόνη (II) SiO
Οξείδιο του πυριτίου (II) SiO. Στη φύση, δεν συμβαίνει, αλλά μπορεί να ληφθεί από την αντίδραση:
SiO2 + Si → 2SiO.
Υπό κανονική πίεση, η εξάχνωση του μονοξειδίου του πυριτίου αρχίζει περίπου στους 1200 ° C (όταν τα αρχικά υλικά πρακτικά δεν εξατμίζονται ακόμα). Σε ζεύγη, το SiO είναι μια μεμονωμένη ένωση. Η ενέργεια διαχωρισμού των στοιχείων είναι 789 kJ / mol. Η μετατροπή σε στερεή κατάσταση μπορεί να επιτευχθεί μόνο με ταχεία ψύξη ("σβέση") της αέριας φάσης. Διαφορετικά, η διάλυση από την εξίσωση έχει χρόνο να περάσει:
2 SiO = Si02 + Si.
Το μονοξείδιο του πυριτίου οξειδώνεται αργά με ατμοσφαιρικό οξυγόνο και διαλύεται εύκολα σε αλκάλια για να σχηματιστούν άλατα πυριτικού οξέος και απελευθέρωση υδρογόνου. Είναι εύκολα ηλεκτρισμένη από τριβή, αποκτώντας ένα ισχυρό αρνητικό φορτίο.
Οξείδιο του πυριτίου (IV) Si02.Το οξείδιο του πυριτίου (IV) ονομάζεται επίσης πυριτία. Είναι μια στερεά πυρίμαχη ουσία. (σημείο τήξεως 1700 ° C)διαδεδομένη στη φύση με δύο μορφές: 1) κρυσταλλική πυριτία - με τη μορφή ορυκτού του χαλαζία και των ποικιλιών του (κρυστάλλινα πετρώματα, χαλκηδόνια, αχάτη, ιάσιρ, πυρίτιο). ο χαλαζίας αποτελεί τη βάση των άμμων χαλαζία που χρησιμοποιούνται ευρέως στην κατασκευή και στη βιομηχανία πυριτικών. 2) άμορφο πυρίτιο - με τη μορφή της σύνθεσης οξειδίου του πηκτώματος SiO2 nΗ2Ο; Οι γήινες μορφές του άμορφου πυριτίου είναι διατομίτης, τρίπολη (γη φουσκώματος). Ένα παράδειγμα τεχνητής άμορφης άνυδρης πυριτίας είναι το διοξείδιο του πυριτίου, το οποίο λαμβάνεται από μεταπυριτικό νάτριο:
Το σίλικα ζελ έχει ανεπτυγμένη επιφάνεια και συνεπώς απορροφά καλά την υγρασία.
Σε 1710 ° λειώνουν χαλαζία. Με την ταχεία ψύξη της τηγμένης μάζας σχηματίζεται γυαλί χαλαζία. Έχει πολύ χαμηλό συντελεστή διαστολής, έτσι ώστε το γυαλί χαλαζία να μην σπάει όταν ψύχεται γρήγορα το νερό. Τα γυάλινα εργαστήρια και τα όργανα επιστημονικής έρευνας κατασκευάζονται από γυαλί χαλαζία.
Η δομή του SiO2 σε μια επίπεδη εικόνα μπορεί να αναπαρασταθεί ως εξής:
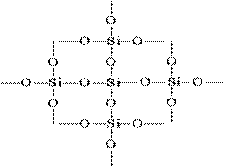
Κάθε άτομο πυριτίου περικλείεται σε ένα τετράεδρο με 4 άτομα οξυγόνου. Σε αυτή την περίπτωση, το άτομο πυριτίου βρίσκεται στο κέντρο και τα άτομα οξυγόνου βρίσκονται στις κορυφές του τετραεδριού. Ολόκληρο το κομμάτι πυριτίας μπορεί να θεωρηθεί ως ένας κρύσταλλος του οποίου ο τύπος είναι (Si02) n. Μια τέτοια δομή οξειδίου του πυριτίου (IV) καθορίζει την υψηλή σκληρότητα και την ανθεκτικότητα.
Οι χημικές ιδιότητες του οξειδίου του πυριτίου (IV) SiO 2 αναφέρονται σε όξινα οξέα. Όταν συντηχθούν με στερεά αλκάλια, βασικά οξείδια και ανθρακικά, σχηματίζονται άλατα πυριτικού οξέος:
Μόνο το υδροφθορικό οξύ αλληλεπιδρά με το οξείδιο του πυριτίου (IV) (χάραξη με γυαλί):
SiO2 + HF - SiF4 + Η2Ο
Το οξείδιο του πυριτίου (IV) δεν διαλύεται στο νερό και δεν αλληλεπιδρά χημικά με αυτό. Ως εκ τούτου, το πυριτικό οξύ λαμβάνεται έμμεσα, για παράδειγμα, με υδρόλυση:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 ορθοσιλικό οξύ.
Το H4SiO4 είναι διαλυτό, όταν θερμαίνεται ή στέκεται, διεξάγεται διαδικασία πολυμερισμού:
2Η4SiO4 → Η2Ο + Η6Si207 διορθοκρεμνικό οξύ.
2Η6Si2O7 → H20 + H10Si4O13 τετραοροτριμιλιικό οξύ.
Κλείνει το δαχτυλίδι:
Η 10 Si 4O 13 → H 2O + (H 2SiO 3) 4 τετραμεθακιλικό οξύ.
Σε αυτή την περίπτωση, το πυριτικό οξύ (ανάλογα με τη συγκέντρωση των αρχικών διαλυμάτων άλατος και οξέος) μπορεί να ληφθεί τόσο υπό τη μορφή ζελατινώδους μάζας που περιέχει νερό όσο και υπό τη μορφή κολλοειδούς διαλύματος (sol). Η σύνθεση του ληφθέντος πυριτικού οξέος εξαρτάται από τα αρχικά υλικά και τις συνθήκες παρασκευής. Όλα τα πυριτικά οξέα είναι πολύ αδύναμα (ασθενέστερα από τον άνθρακα).
Εάν το ανθρακικό οξύ σε ένα διάλυμα απελευθερώνει πυριτικό οξύ από τα άλατά του, τότε η αντίστροφη αντίδραση εμφανίζεται κατά τη διάρκεια της φρύξης. Η πρώτη οφείλεται στη χαμηλότερη αντοχή (βαθμός διάστασης) πυριτικού οξέος, η δεύτερη - η χαμηλότερη μεταβλητότητα όταν θερμαίνεται.
Όταν θερμαίνονται πολυπυριτικά οξέα και η βαθμιαία αφυδάτωση τους μπορεί να ληφθεί πρόστιμο SiO 2, το οποίο καλείται σιλικαζέλ . Απορροφά το νερό καλά, το τοποθετώ σε συσκευές για να αποφευχθεί η οξείδωση των δαπανηρών στοιχείων.
Γερμανία υποομάδα
Ge (+4) Sn (+2, +4) Pb(+2) - ανθεκτικές καταστάσεις οξείδωσης
Γερμάνιο είχε προβλεφθεί από Mendeleev το 1871 και άνοιξε το 1886. κασσίτερος και ο μόλυβδος είναι μεταξύ των πιο μακράς γνωστά στοιχεία της ανθρωπότητας: οι Αιγύπτιοι ήταν σε θέση να μύριζε μεταλλεύματα τους από περισσότερους από 3000 χρόνια π.Χ.. ε Στην Ινδία, το μόλυβδο έγινε γνωστό περίπου 2500 χρόνια, και το καλοκαίρι 1500 χρόνια π.Χ. ε Χυτοσίδηρος κασσίτερος που παράγεται στην αρχαία Κίνα.
Παραλαβή.Οι φυσικές ενώσεις του γερμανίου μετατρέπονται σε GeO 2 και ανάγονται με υδρογόνο:
GeO2 + H2t → Ge + H2O σε θερμοκρασίες περίπου 1000 ° C.
Το κασσίτερο προέρχεται από φυσικό ορυκτό κασσιρίτης(Sn02):
SnO 2 + C → Sn + CO.
Το απλούστερο σύστημα για τη μείωση του βιομηχανικού μολύβδου βασίζεται σε δύο διαδοχικές αντιδράσεις:
PbS + O2 → SO2 + PbO Γαλένα(PbS) καίγεται και στη συνέχεια μειώνεται με άνθρακα:
PbO + C → CO + Pb.
Εφαρμογή.Και τα τρία στοιχεία είναι πολύ σημαντικά για τη σύγχρονη τεχνολογία. Ορισμένες ενώσεις κασσιτέρου και μολύβδου έχουν επίσης σημαντική χρήση. Τα παράγωγα μόλυβδου είναι εξαιρετικά τοξικά.
Το γερμάνιο είναι ένας τυπικός ημιαγωγός (τύπου n με πλάτος bandgap 0,75 eV) και βρίσκει διάφορες χρήσεις στην ηλεκτροτεχνική. Χρησιμοποιείται ευρύτερα για την κατασκευή των ανορθωτών εναλλασσόμενου ρεύματος.. Αυτή η εφαρμογή βασίζεται στην μονοπολική αγωγιμότητα που προκύπτει από την επαφή μεταξύ του καθαρού γερμάνιου και του κράματος του γερμανίου με το ίνδιο. Το ρεύμα (ροή ηλεκτρονίων) περνά σε μια τέτοια εγκατάσταση πρακτικά μόνο από το γερμάνιο στο κράμα, αλλά όχι αντίστροφα. Οι ανορθωτές γερμανίου χαρακτηρίζονται από εξαιρετικά υψηλή απόδοση (περίπου 98%) και πολύ μεγάλη (με σωστή λειτουργία) διάρκεια ζωής. Το κύριο μειονέκτημα αυτών των ανορθωτών είναι η ευαισθησία τους στη θέρμανση - πάνω από τους 70 ° C, η αποδοτικότητά τους πέφτει γρήγορα.
Σημαντική περιοχή χρήσης Η Γερμανία είναι μια υπέρυθρη οπτική, δεδομένου ότι οι ακτίνες με μήκος κύματος άνω των 2 μικρών, πρακτικά δεν καθυστερούν. Αντίθετα, στο φως και κοντά σε αυτό κυμαίνεται (0,2 - 2 μικρά), το γερμάνιο απορροφά εντατικά την ενέργεια. Εάν μια γυαλιστερή μεταλλική επιφάνεια (η οποία αποθηκεύει θερμότητα καλά, αλλά δεν θερμαίνεται καλά) καλύπτεται με ταινία γερμανίου, τότε η επιφάνεια θερμαίνεται πολύ περισσότερο από ό, τι χωρίς μια μεμβράνη. Έχει αναφερθεί ότι σε ένα βαρέλι που παρασκευάζεται με αυτόν τον τρόπο κάτω από τη δράση του ηλιακού φωτός, μπορεί να ληφθεί βραστό νερό.
Το κασσίτερο χρησιμοποιείται κυρίως για το σίδερο με σκοπό την προστασία του από τη σκουριά. (λευκοσίδηρος για τη βιομηχανία κονσερβοποίησης). Το πάχος τέτοιων επικαλύψεων κασσίτερου είναι πολύ μικρό - της τάξης των μικρών. Με τη μορφή λεπτών φύλλων (λεγόμενων Stannioles), ο κασσίτερος καταναλώνεται για την κατασκευή πυκνωτών στην ηλεκτρική βιομηχανία . Ο μόλυβδος χρησιμοποιείται για την κατασκευή πλακών μπαταριών, πλακών ηλεκτρικών καλωδίων, βλήματος και πυροβολισμών, για προστασία από τις ακτίνες Χ και τις ακτίνες-γ, καθώς και από τη χημική βιομηχανία (αγωγούς κ.λπ.). Πολύ μεγάλες ποσότητες κασσιτέρου και μολύβδου δαπανώνται για την κατασκευή ορισμένων τεχνικά σημαντικών κραμάτων.
Το πιο σημαντικό από αυτά είναι η διάφορα χάλκινο (κράματα Cu και Sn) για φέρουν κράματα (Babbitt μέταλλο, βασίζεται σε κοινώς παρασκευάζονται Pb ή Sn-περιέχουν και επίσης Sb και Cu), κράματα εκτύπωση (5-30% Sn, 10-20% Sb, το υπόλοιπο είναι Pb) και η συνηθισμένη "μαλακή" συγκόλληση (30-70% Sn, 70-30% Pb). Μπορεί συχνά να αντικατασταθεί από ένα φθηνότερο κράμα 90% Pb, 6% Sn, 4% Sb. Μεγάλη σημασία έχουν τα κράματα για έδρανα με κατά προσέγγιση σύνθεση 98% Pb, 1% Ca, 1% Na.
Το διοξείδιο του πυριτίου (σίλικα, σίλικα) είναι μια ουσία που αποτελείται από άχρωμους κρυστάλλους με υψηλή αντοχή, σκληρότητα και ανθεκτικότητα. Το διοξείδιο του πυριτίου είναι ανθεκτικό στα οξέα και δεν αλληλεπιδρά με το νερό. Με την αύξηση της θερμοκρασίας αντίδρασης, η ουσία αλληλεπιδρά με αλκάλια, διαλύεται σε υδροφθορικό οξύ, είναι ένα εξαιρετικό διηλεκτρικό.
Στη φύση, σίλικα διανέμονται αρκετά ευρέως: κρυσταλλικό οξείδιο του πυριτίου που παριστάνεται ορυκτά όπως το Jasper, αχάτη (λεπτή-κρυσταλλική ένωση σίλικα), ορεία κρύσταλλος (μεγάλοι κρύσταλλοι της ουσίας), χαλαζίας (ελεύθερο διοξείδιο του πυριτίου), χαλκηδόνιος, αμέθυστος, Morion, τοπάζι (χρωματισμένα κρύσταλλοι πυριτία).
Υπό φυσιολογικές συνθήκες (σε φυσική θερμοκρασία περιβάλλοντος και πίεση), υπάρχουν τρεις κρυσταλλικές τροποποιήσεις διοξειδίου του πυριτίου - τριδυμίτη, χαλαζία και κριστοβαλίτη. Όταν η θερμοκρασία αυξάνεται, το διοξείδιο του πυριτίου μετατρέπεται αρχικά σε coesite, και στη συνέχεια σε stishovite (ένα ορυκτό που βρέθηκε το 1962 σε έναν κρατήρα μετεωρίτη). Σύμφωνα με μελέτες, είναι stishovit, ένα παράγωγο του διοξειδίου του πυριτίου, που ευθυγραμμίζει ένα μεγάλο μέρος του μανδύα της Γης.
Ο χημικός τύπος της ουσίας - SiO 2
Παρασκευή πυριτίας
Το διοξείδιο του πυριτίου λαμβάνεται με βιομηχανικές μεθόδους για χαλαζία εργοστάσια παραγωγής καθαρού συμπυκνώματος χαλαζία, το οποίο στη συνέχεια χρησιμοποιείται στη χημική και ηλεκτρονική βιομηχανία, στην παραγωγή των οπτικών, πληρωτικά για χρώματα και προϊόντα από καουτσούκ, την κατασκευή κοσμημάτων, κ.λπ. Το φυσικό διοξείδιο του πυριτίου, διαφορετικά ονομάζεται σίλικα, χρησιμοποιείται ευρέως στην κατασκευή (σκυρόδεμα, άμμος, ηχομόνωση και υλικά θερμομόνωσης).
Η σύνθεση του διοξειδίου του πυριτίου με συνθετική μέθοδο διεξάγεται με τη δράση οξέων σε πυριτικό νάτριο, σε μερικές περιπτώσεις σε άλλα διαλυτά πυριτικά άλατα ή με τη μέθοδο πήξης κολλοειδούς πυριτίας υπό την επίδραση ιόντων. Επιπλέον, το διοξείδιο του πυριτίου παράγεται με την οξείδωση του πυριτίου με οξυγόνο σε θερμοκρασία περίπου 500 βαθμών Κελσίου.
Εφαρμογή διοξειδίου του πυριτίου
Τα υλικά που περιέχουν πυρίτιο χρησιμοποιούνται ευρέως τόσο στον τομέα των υψηλής τεχνολογίας όσο και στην καθημερινή ζωή. Το διοξείδιο του πυριτίου χρησιμοποιείται στην κατασκευή γυαλιού, κεραμικών, προϊόντων σκυροδέματος, λειαντικών υλικών, καθώς και σε ραδιοεξοπλισμό, υπερηχητικές εγκαταστάσεις, αναπτήρες κλπ. Σε συνδυασμό με ορισμένα συστατικά, το διοξείδιο του πυριτίου χρησιμοποιείται στην κατασκευή καλωδίων οπτικών ινών.
Το μη πορώδες άμορφο διοξείδιο του πυριτίου χρησιμοποιείται επίσης στη βιομηχανία τροφίμων ως πρόσθετο, καταχωρημένο υπό τον αριθμό Ε551, αποτρέποντας τη συσσώρευση και τη συσσωμάτωση του κύριου προϊόντος. Διοξείδιο  η τροφή με πυρίτιο χρησιμοποιείται στη φαρμακευτική βιομηχανία ως ένζυμο εντεροσώματος, στην παρασκευή οδοντόπαστας. Η ουσία βρίσκεται σε τσιπς, κροτίδες, καλαμπόκι, στιγμιαία καφέ κλπ.
η τροφή με πυρίτιο χρησιμοποιείται στη φαρμακευτική βιομηχανία ως ένζυμο εντεροσώματος, στην παρασκευή οδοντόπαστας. Η ουσία βρίσκεται σε τσιπς, κροτίδες, καλαμπόκι, στιγμιαία καφέ κλπ.
Silica Harm
Επιβεβαιώθηκε επισήμως ότι η ουσία του διοξειδίου του πυριτίου διέρχεται από τη γαστρεντερική οδό αμετάβλητη, μετά την οποία αφαιρείται εντελώς από το σώμα. Σύμφωνα με 15ετή μελέτη από γάλλους ειδικούς, η κατανάλωση πόσιμου νερού υψηλής αλουμίνας μειώνει τον κίνδυνο εμφάνισης της νόσου του Alzheimer κατά 10%.
Έτσι, οι πληροφορίες σχετικά με τους κινδύνους του διοξειδίου του πυριτίου, που είναι μια χημικά αδρανής ουσία, είναι ψευδείς: το συμπλήρωμα διατροφής E551, που καταναλώνεται από το στόμα, είναι απολύτως ασφαλές για την υγεία.
SiO Silicon οξείδιο 2 - στερεό, πολύ πυρίμαχα ουσία (σημείο τήξεως 1700 ° C), ευρέως διαδεδομένα στη φύση, όπου βρίσκεται κυρίως στη μορφή του ορυκτού χαλαζία και χριστοβαλίτη και τριδυμίτης.
Στις συνήθεις θερμοκρασίες, ο χαλαζίας είναι μια σταθερή τροποποίηση, με αυξημένες θερμοκρασίες παρατηρούνται πολυμορφικοί μετασχηματισμοί:
Το πυριτικό άλας όλων των τροποποιήσεων με τη μορφή μονομερούς δεν υπάρχει. είναι πάντα πολυμερές και "χτισμένο" από τετράεδρα σχηματίζοντας ένα πολύ ισχυρό ατομικό πλέγμα
Κάθε άτομο πυριτίου σε (SiO2) n κρύσταλλοι περιβάλλεται τετραεδρικά από τέσσερα άτομα οξυγόνου, καθένα από τα οποία γεφυρώνεται. Μέσα από ένα κοινό άτομο οξυγόνου, τετράεδρα σε διαφορετικές γωνίες δεσμεύουν το ένα το άλλο, σχηματίζοντας ένα συνεχές τρισδιάστατο πλέγμα. η αμοιβαία διάταξη των τετραεδρών στο διάστημα καθορίζει μία ή άλλη τροποποίηση του διοξειδίου του πυριτίου.
Σε διαφορετικές τροποποιήσεις της πυκνότητας δεσμού πυριτίου ποικίλλει. Αυτό επηρεάζει το μέγεθος των γωνιών Si-O-Si και των αποστάσεων Si-O, για παράδειγμα, η γωνία δεσμού Si-O-Si σε διάφορες τροποποιήσεις του διοξειδίου του πυριτίου κυμαίνεται από 120 έως 180 °. Οι μεταβάσεις από χαλαζία-τριδύμητη-κρυσταλλοφυλή συνοδεύονται από θραύση και μετασχηματισμό δεσμών, οι οποίες μπορούν να εμφανιστούν μόνο σε υψηλές θερμοκρασίες.
Χαλαζία Συχνά βρίσκεται στη φύση με τη μορφή εξαιρετικά καλά σχηματισμένων κρυστάλλων, μερικές φορές μεγάλου μεγέθους. Οι κρύσταλλοι σχηματίζονται από τετράεδρα διατεταγμένα σε σπειροειδή μορφή γύρω από τον κεντρικό άξονα, με τη μορφή σπειροειδούς. Στον ίδιο κρύσταλλο, η διεύθυνση της έλικας μπορεί να είναι αντίθετη. Τέτοιοι κρύσταλλοι είναι οπτικά ισομερή. Περιστρέφουν το επίπεδο πόλωσης του φωτός και μπορούν να είναι δεξιά και αριστερά. Αυτά και άλλα κρύσταλλα διαφέρουν ως θέμα από την κατοπτρική τους εικόνα.
Το χαλαζία χρησιμοποιείται σε διάφορους τομείς της επιστήμης και της τεχνολογίας και οι κρύσταλλοι του καλλιεργούνται συχνά τεχνητά. Μερικοί τύποι χαλαζία είναι ειδικά ονόματα. Διαφανείς άχρωμοι κρύσταλλοι ονομάζονται βράχοι κρυστάλλων. Υπάρχουν επίσης χρωματιστές ποικιλίες χαλαζία: χαλαζία ροζ, βιολετί (αμέθυστος), σκούρο καφέ (καπνιστή τοπάς), πράσινη (χρυσοπράση) κλπ. Η κρυσταλλική τροποποίηση του χαλαζία με μείγματα άλλων ουσιών ονομάζεται χαλκηδόνια. Οι ποικιλίες της χαλκηδόνας είναι αχάτης, ιάσπερος και άλλοι. Οι πετρώδες κρύσταλλοι και οι χρωματιστές ποικιλίες χαλαζία χρησιμοποιούνται ως πολύτιμοι και ημιπολύτιμοι λίθοι.
Τριμιμίτης εμφανίζεται σε ηφαιστειακά πετρώματα, αλλά σε πολύ μικρές ποσότητες. Γνωστή τριδύτης και μετεωρίτης.
Ο κρυσταλλοειδής στη φύση μερικές φορές βρίσκεται υπό μορφή μικρών κρυστάλλων ενσωματωμένων στη λάβα, όπως το τριδύμιτο. Ο τριμιδίτης και ο κριστοβαλίτης έχουν μια πιο "χαλαρή" δομή από τον χαλαζία. Έτσι, η πυκνότητα του κρυστοβαλίτη, του τριδυμίτη και του χαλαζία είναι 2,32. 2,26 και 2,65 g / cm3, αντιστοίχως.
Το τήγμα πυριτίου με αργή ψύξη σχηματίζει εύκολα άμορφο γυαλί χαλαζία. Το πυρίτιο με τη μορφή γυαλιού βρίσκεται επίσης στη φύση. Η πυκνότητα του άμορφου γυαλιού είναι 2,20 g / cm3 - χαμηλότερη από αυτή όλων των κρυσταλλικών τροποποιήσεων. Το γυαλί χαλαζία έχει έναν ελαφρύ συντελεστή θερμοκρασίας διαστολής, επομένως, χρησιμοποιείται για την παρασκευή γυάλινων αντικειμένων εργαστηρίου ανθεκτικών στις ξαφνικές μεταβολές της θερμοκρασίας.
Όλες οι τροποποιήσεις του διοξειδίου του πυριτίου στο νερό είναι πρακτικά αδιάλυτες (σε θερμοκρασία 25 ° C, η διαλυτότητα του χαλαζία είναι 7, κριστοβαλίτης - 12, τριδυμίτης - 16, χαλαζία - 83 mg / l). Επομένως, υπό κανονικές συνθήκες, μόνο τα αλκαλικά διαλύματα και το υδροφθορικό οξύ δρουν πάνω τους:
Si02 + 2KO = K2SiO3 + H20, (1)
Si02 + 4HF = SiF4 + 2Η2Ο. (2)
Η τελευταία αντίδραση χρησιμοποιείται στην "χάραξη" του γυαλιού.
Η προστιθέμενη σίλικα αντιδρά με βασικά οξείδια, αλκάλια (αντίδραση (1)) και ανθρακικά για σχηματισμό πυριτικών:
SiO2 + CaO = CaSi03, (3)
Si02 + Na2C03 = Na2Si03 + C02. (4)
Οι αντιδράσεις (3) και (4) αποτελούν τη βάση της βιομηχανικής παραγωγής διαφόρων γυαλιών, καθώς και του τσιμέντου. Έτσι, η σύνθεση συνήθους υάλου (για παράδειγμα, παράθυρο, για την κατασκευή πιάτων) εκφράζεται με τον τύπο Na2O. CaO. 6SiO2. Ένα τέτοιο γυαλί παράγεται με τήξη ενός μείγματος σόδα, άμμου και ασβεστόλιθου. Η διαδικασία διεξάγεται σε θερμοκρασία ~ 1400 ° C μέχρι την πλήρη απομάκρυνση αερίων:
Na2CO3 + CaC03 + 6SiO2 = Na2O. CaO. 6SiO2 + 2CO2.
Για ειδικές ποιότητες γυαλιού - ανθεκτικών, "άθραυστο" - κατά το μαγείρεμα, προσθέστε οξείδια βαρίου, μολύβδου, βόριο. Για να ληφθούν έγχρωμα γυαλιά, εισάγονται επίσης διάφορα πρόσθετα, για παράδειγμα, η προσθήκη οξειδίου του κοβαλτίου Co 2 O 3 δίνει ένα μπλε χρώμα, οξείδιο του χρωμίου Cr2O3 - πράσινο, διοξείδιο του μαγγανίου MnO 2 - ροζ.
SiO οξείδιο 2 είναι σειρά ανυδρίτης πυριτικού οξέος, η σύνθεση των οποίων μπορεί να εκφραστεί από τον γενικό τύπο hSiO ∙ 2 yH 2 O, όπου x και y - ακέραιοι: 1) x = 1, y = 1: SiO 2. Η2ΟΗ, δηλ. H2Si03 - μετα-σιλικόν οξύ · 1) χ = 1, γ = 2: Si02. 2Η20, δηλ. ορθο-πυριτικό οξύ. 1) χ = 2, γ = 1: 2Si02. Η2ΟΗ, δηλ. H2Si2O5 - bimeta πυριτικό οξύ.
Τα οξέα των οποίων τα μόρια περιέχουν περισσότερα από ένα μόρια SiO2 ανήκουν στο πολυσιλικό.
Το απλούστερο των πυριτικών οξέων είναι το H2SiO3, το οποίο συχνά ονομάζεται απλά πυρίτιο, και τα άλατά του είναι πυριτικά. Από πυριτικά άλατα, μόνο πυριτικά άλατα νατρίου και καλίου είναι διαλυτά στο νερό, τα υπόλοιπα πυριτικά άλατα είναι ανθεκτικά, αδιάλυτα στο νερό ουσίες.
Πυριτικό λύσεις γίνει θολό κατά την παραμονή στον αέρα, όπως είναι στην η CO 2 εκτοπίζει το πυριτικό οξύ από τα άλατά του (H 2 SiO 3 ασθενέστερη σταθερά διαστάσεως ανθρακικού οξέος του H 2 SiO 3 κατά το πρώτο στάδιο είναι ίσο με K 1 = 2.2 10 -10. ).
Το H2SiO3 είναι πρακτικά αδιάλυτο στο νερό - η ιδιότητα αυτή χρησιμοποιείται ως ποιοτική αντίδραση για την ανίχνευση πυριτικών ιόντων:
Na2SiO3 + C02 + Η2O = Na2CO3 + H2SiO3 ↓.
Πυριτικά άλατα λαμβάνονται με τήξη SiO2 με αλκάλια ή ανθρακικά άλατα.
Τα συμπυκνωμένα διαλύματα πυριτικών νατρίου και καλίου ονομάζονται υγρό γυαλί, έχουν έντονα αλκαλική αντίδραση λόγω του ότι είναι πολύ υδρολυμένα:
K2SiO3 + H2O2KON + H2SiO3 ↓.
Υγρό γυαλί χρησιμοποιείται, για παράδειγμα, για την κατασκευή κόλλας, αδιάβροχα υφάσματα.
Το τσιμέντο χρησιμοποιείται ευρέως στην κατασκευή ως συνδετικό υλικό, το οποίο όταν αναμειγνύεται με το νερό σκληραίνει. Συνήθως, το τσιμέντο παράγεται σε μεγάλους περιστροφικούς κλιβάνους όπου τα διάφορα πυριτικά ψήνονται και αλέθονται (σε θερμοκρασία -1000 ° C).
Υπάρχουν όμως διάφοροι τύποι τσιμέντου, ωστόσο, υπό όρους είναι δυνατή η διάκριση δύο τύπων τσιμέντου σύμφωνα με την αρχή του "κυλιόμενου" τους - κοινού τσιμέντου και τσιμέντου Portland. Η διαδικασία "ρύθμισης" συμβατικού τσιμέντου αποτελούμενου από πυριτικό ασβέστιο, συμβαίνει λόγω του σχηματισμού ανθρακικού ασβεστίου λόγω διοξειδίου του άνθρακα στον αέρα:
Cao. SiO2 + C02 + Η2Ο = CaC03 ↓ + H2Si03 ↓.
Κατά τη ρύθμιση του τσιμέντου Portland δεν εμπλέκεται διοξείδιο του άνθρακα στη διαδικασία και η υδρόλυση πυριτικών αλάτων συμβαίνει με τον επακόλουθο σχηματισμό αδιάλυτων κρυσταλλικών ενυδατωμένων:
Ca3SiO5 + Η2Ο = Ca2SiO4 + Ca (OH) 2,
Ca2SiO4 + 4H2O = Ca2SiO4. 4H2O ↓.
· Καρβίδια και πυριτίδια
· Οι ενώσεις άνθρακα και πυριτίου με μέταλλα - καρβίδια και πυριτίδια, εκτός από τις θεωρούμενες αντιδράσεις, λαμβάνονται επίσης από την αλληλεπίδραση του πυριτίου με υδρίδια μετάλλων, για παράδειγμα:
· 2CaH2 + Si = Ca2Si + 2H2.
· Όλες αυτές οι αντιδράσεις λαμβάνουν χώρα σε υψηλές θερμοκρασίες. Μεταξύ των καρβιδίων εκπέμπουν τα λεγόμενα "μεθανίδια" και "ακετυλένιο". Τα πρώτα θεωρούνται ως παράγωγα μεθανίου που περιέχουν άνθρακα σε κατάσταση οξείδωσης -4 (Be2C, Al4C3), το δεύτερο - ως παράγωγα ακετυλενίου με βαθμό οξείδωσης άνθρακα -1 (Li2C2, Ag2C2, Cu2C2 , CAC 2). Τα ακετυλικά άλατα αργύρου και χαλκού (Ι) μπορούν εύκολα να ληφθούν περνώντας ακετυλένιο μέσω διαλύματος αμμωνίας οξείδιο αργύρου ή χλωριούχου χαλκού (Ι). Τα περισσότερα μεθανίδια και ακετυλικά αντιδρούν ενεργά με νερό (ειδικά με οξέα), απελευθερώνοντας τους αντίστοιχους υδρογονάνθρακες:
· СаС2 + 2Η2Ο = Ca (ΟΗ) 2 + C2H2,
· Al4C3 + 12H20 = 4Al (OH) 3 ↓ + 3CH4,
· Ag2C2 + 2HCl = 2AgCl ↓ + C2H2.
· Σε αντίθεση με τα καρβίδια, μόνο τα πυριτίδια των μετάλλων αλκαλίων ή αλκαλικών γαιών αλληλεπιδρούν με νερό και οξέα, παράγοντας την απλούστερη ένωση υδρογόνου μονοσιλάνιο πυριτίου, που συχνά αποκαλείται απλά σιλάνιο SiH 4:
· Ca2Si + 4HCl = 2CaCl2 + SiH4.
· Το σιλάνιο είναι ένα άχρωμο αέριο που έχει τη μυρωδιά μούχλας, αυθόρμητα εύφλεκτο στον αέρα, καύση σε SiO 2 και νερό:
· SiH4 + 2O2 = Si02 + 2H2O.
· Οι αλκάλες πολύ εύκολα αποσυνθέτουν το σιλάνιο από την εξίσωση:
· SiH4 + 2KON + Η2O = K2SiO3 + 4H2,
· Το νερό υδρολύει επίσης σιλάνιο, αλλά πολύ πιο αργό:
· SiH4 + 2H2O = Si02 + 4H2.
· Όταν θερμαίνεται πάνω από 400 ° C χωρίς πρόσβαση σε αέρα, το σιλάνιο αποσυντίθεται σε πυρίτιο και υδρογόνο (μία από τις μεθόδους παραγωγής πυριτίου):
· SiH4 = Si + 2Η2.
· Εκτός από το μονοσιλάνιο, είναι επίσης γνωστό το δισιλάνιο Si2H6, το τρισιλάνιο Si3H8, το τετρασιλάνιο Si 4H 10, κλπ. Στην μεμονωμένη κατάσταση, οι ενώσεις απομονώθηκαν μόνο μέχρι και το Si6H14 συμπεριλαμβανομένου. Όλες αυτές οι ενώσεις ανήκουν στην ομόλογη σειρά σιλανίων, στην οποία αντιστοιχεί ο γενικός τύπος Si n Η2 + 2. Όπως τα αλκάνια, τα σιλάνια είναι άχρωμα, τα πρώτα μέλη της ομόλογης σειράς είναι αέρια υπό κανονικές συνθήκες, τα ακόλουθα είναι υγρά. Η χημική δραστηριότητα των σιλανίων και των υδρογονανθράκων είναι διαφορετική: σε αντίθεση με τα επαρκώς αδρανή αλκάνια, όλα τα αντιδραστικά σιλάνια. Αυτό οφείλεται στη χαμηλότερη συγγένεια πυριτίου για το υδρογόνο σε σύγκριση με τον άνθρακα και στην πολύ υψηλή συγγένεια του πυριτίου για το οξυγόνο. Επιπλέον, οι δεσμοί Si-Si είναι λιγότερο ανθεκτικοί από τους Ο-Ο δεσμούς. Σε αντίθεση με τον δεσμό C - H, ο δεσμός Si - H έχει έναν πιο ιοντικό χαρακτήρα.
· Η ενέργεια των ομολόγων Si-E και CE.
· Η χαμηλή ισχύς του δεσμού Si-Si οφείλεται στο οριοθετημένο της ομόλογης σειράς σιλανίων.
· Μεταξύ των καρβιδίων και των πυριτοκτόνων, ένα ιδιαίτερο μέρος καταλαμβάνεται από SiC carborundum, το οποίο μπορεί να ονομαστεί και καρβίδιο του πυριτίου και πυριτοκτόνο άνθρακα. Το Carborundum έχει υψηλό σημείο τήξης λόγω της διαμαντοειδούς δομής του. η σκληρότητα του είναι κοντά σε εκείνη του διαμαντιού. Χημικά, το SiC είναι πολύ σταθερό.
· Η έννοια των κολλοειδών διαλυμάτων
Στη φύση και την τεχνολογία, συχνά υπάρχουν διασκορπισμένα συστήματα στα οποία μια ουσία κατανέμεται ομοιόμορφα ως σωματίδια μέσα σε μια άλλη ουσία.
Στα διασκορπισμένα συστήματα υπάρχει μια διεσπαρμένη φάση - μια λεπτή διαιρεμένη ουσία και ένα μέσο διασποράς - μια ομοιογενής ουσία στην οποία κατανέμεται η διεσπαρμένη φάση. Τα συστήματα διασποράς περιλαμβάνουν συνηθισμένα (αληθή) διαλύματα, κολλοειδή διαλύματα, καθώς και εναιωρήματα και γαλακτώματα. Διαφέρουν μεταξύ τους πρωτίστως σε μεγέθη σωματιδίων, δηλαδή στον βαθμό διασποράς (θρυμματισμό).
Συστήματα με μέγεθος σωματιδίων μικρότερο από 1 nm είναι αληθή διαλύματα που αποτελούνται από μόρια διαλυτών ή ιόντα. Πρέπει να θεωρηθούν ως ένα σύστημα ενιαίας φάσης. Συστήματα με μεγέθη σωματιδίων μεγαλύτερα των 100 nm είναι συστήματα χονδροειδούς διασποράς - αιωρήματα και γαλακτώματα.
Τα αιωρήματα είναι διασκορπισμένα συστήματα στα οποία η διασκορπισμένη φάση είναι στερεό και το μέσο διασποράς είναι ένα υγρό και το στερεό είναι πρακτικά αδιάλυτο στο υγρό.
Τα γαλακτώματα είναι διασκορπισμένα συστήματα στα οποία τόσο η διεσπαρμένη φάση όσο και το μέσο διασποράς είναι υγρά που δεν είναι αμοιβαία αναμίξιμα. Ένα παράδειγμα ενός γαλακτώματος είναι το γάλα, στο οποίο μικρές σφαίρες λίπους επιπλέουν σε ένα υγρό.
Τα αιωρήματα και τα γαλακτώματα είναι διφασικά συστήματα.
Τα κολλοειδή διαλύματα είναι υψηλής διασποράς συστήματα δύο φάσεων που αποτελούνται από ένα μέσο διασποράς και μια διεσπαρμένη φάση και οι γραμμικές διαστάσεις των σωματιδίων του τελευταίου βρίσκονται στην περιοχή από 1 έως 100 nm. Όπως μπορεί να φανεί, τα κολλοειδή διαλύματα με μέγεθος σωματιδίων είναι ενδιάμεσα μεταξύ πραγματικών διαλυμάτων και αιωρημάτων και γαλακτωμάτων. Τα κολλοειδή σωματίδια συνήθως αποτελούνται από μεγάλο αριθμό μορίων ή ιόντων.
Τα κολλοειδή διαλύματα ονομάζονται επίσης κολλοειδή διαλύματα. Λαμβάνονται με μεθόδους διασποράς και συμπύκνωσης. Η διασπορά εκτελείται πιο συχνά χρησιμοποιώντας ειδικά "κολλοειδή μύλους". Στη μέθοδο συμπύκνωσης, τα κολλοειδή σωματίδια σχηματίζονται συνδυάζοντας άτομα ή μόρια σε συσσωματώματα. Κατά τη διάρκεια πολλών χημικών αντιδράσεων, συμβαίνει συμπύκνωση και σχηματίζονται συστήματα υψηλής διασποράς (καθίζηση, υδρόλυση, αντιδράσεις μείωσης οξείδωσης κ.λπ.).
1 nm - νανομέτρου (1 nm = 10-9 m).
Σε αντίθεση με τα αληθή διαλύματα, οι sinds χαρακτηρίζονται από το φαινόμενο Tyndall, δηλαδή τη διασπορά του φωτός από τα κολλοειδή σωματίδια. Όταν ένας κώνος φωτός εμφανίζεται μέσα από μια δέσμη φωτός, εμφανίζεται σε ένα σκοτεινό δωμάτιο. 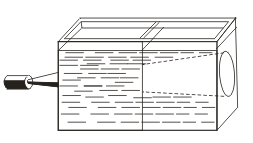 . Έτσι, μπορείτε να αναγνωρίσετε αν αυτή η λύση είναι κολλοειδή ή αληθινή.
. Έτσι, μπορείτε να αναγνωρίσετε αν αυτή η λύση είναι κολλοειδή ή αληθινή.
Μία από τις σημαντικές ιδιότητες των κολώνων είναι ότι τα σωματίδια τους έχουν ηλεκτρικά φορτία του ίδιου σημείου. Λόγω αυτού, δεν συγχωνεύονται σε μεγαλύτερα σωματίδια και δεν καθιζάνουν. Ταυτόχρονα, τα σωματίδια ορισμένων κολλοειδών, για παράδειγμα, μετάλλων, σουλφιδίων, πυριτικών και κασσιτερικών οξέων, έχουν αρνητικό φορτίο, ενώ άλλα, για παράδειγμα υδροξείδια, οξείδια μετάλλων, έχουν θετικό φορτίο. Η εμφάνιση ενός φορτίου εξηγείται από την προσρόφηση ιόντων από το διάλυμα από κολλοειδή σωματίδια.
Για να καταβυθιστεί ένα κολλοειδές διάλυμα, είναι απαραίτητο τα σωματίδια του να συμπυκνωθούν σε μεγαλύτερα συσσωματώματα. Ο συνδυασμός των σωματιδίων σε μεγαλύτερα συσσωματώματα ονομάζεται πήξη και η καθίζηση τους υπό την επίδραση της βαρύτητας ονομάζεται καθίζηση.
Συνήθως συμβαίνει πήξη όταν προσθέτετε στα διαλύματα: 1) ηλεκτρολύτη, 2) άλλο κολλοειδές διάλυμα του οποίου τα σωματίδια έχουν αντίθετο φορτίο και 3) όταν θερμαίνεται.
