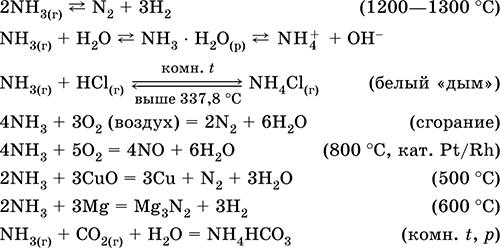
Θείο. Σουλφίδιο του υδρογόνου και σουλφίδια
4.doc
240Θείο. Σουλφίδιο του υδρογόνου, σουλφίδια, υδροσουλφίδια. Οξείδια του θείου (IV) και (VI). Θειικό οξύ και θειικό οξύ και τα άλατά τους. Εστέρες θειικού οξέος. Θειοθειικό νάτριο
4.1. Θείο
Το θείο είναι ένα από τα λίγα χημικά στοιχεία που έχουν χρησιμοποιήσει οι άνθρωποι για αρκετές χιλιετίες. Είναι ευρέως κατανεμημένο στη φύση και βρίσκεται τόσο στην ελεύθερη κατάσταση (φυσικό θείο) όσο και στις ενώσεις. Τα ορυκτά που περιέχουν θείο μπορούν να χωριστούν σε δύο ομάδες - σουλφίδια (πυρίτες, λάμπες, ανδρεικέλες) και θειικά άλατα. Το εγγενές θείο βρίσκεται σε μεγάλες ποσότητες στην Ιταλία (νησί της Σικελίας) και στις ΗΠΑ. Στην ΚΑΚ, οι φυσικές αποθέσεις θείου απαντώνται στην περιοχή του Βόλγα, στα κράτη της Κεντρικής Ασίας, στην Κριμαία και σε άλλες περιοχές.
Τα ανόργανα άλατα της πρώτης ομάδας περιλαμβάνουν το PbS με υπεριώδη ακτινοβολία, το χαλκό Shine Cu 2 S, το ασήμι γυαλιστερό - Ag 2 S, το ZnS snc - ZnS, το κάδμιο snag - CdS, πυρίτης ή σίδηρος πυρίτης - FeS 2, χαλκοπυρίτης - CuFeS 2, cinnabar - HgS.
Τα ορυκτά της δεύτερης ομάδας περιλαμβάνουν τον γύψο CaSO4H2O, το mirabilite (άλας Glauber) - Na2S0410H2O και το κιζέτη - MgS04H2O.
Το θείο βρίσκεται στα ζώα και στα φυτά, ως τμήμα των πρωτεϊνικών μορίων. Οι οργανικές ενώσεις θείου βρίσκονται στο πετρέλαιο.
Να πάρει
1. Όταν το θείο λαμβάνεται από φυσικές ενώσεις, για παράδειγμα, από πυριτικό θείο, θερμαίνεται σε υψηλές θερμοκρασίες. Ο πυρίτης του θείου αποσυντίθεται για να σχηματίσει σίδηρο (II) σουλφίδιο και θείο:
2. Το θείο μπορεί να ληφθεί με οξείδωση του υδρόθειου από την έλλειψη οξυγόνου από την αντίδραση:
2Η2SΟ2 = 2S2Η2Ο
3. Σήμερα, η ανάκτηση θείου με τη μείωση του διοξειδίου του θείου SO2 από διοξείδιο του άνθρακα είναι ένα κοινό παραπροϊόν στην τήξη μετάλλων από θειούχα ορυκτά:
SO2C = C02S
4. Τα απόβλητα των μεταλλουργικών κλιβάνων και των φούρνων οπτανθρακοποίησης περιέχουν ένα μείγμα διοξειδίου του θείου και υδρόθειου. Αυτό το μίγμα περνάει σε υψηλή θερμοκρασία πάνω από τον καταλύτη:
H2S02 = 2Η2Ο3S
^ Φυσικές ιδιότητες
Το θείο είναι ένα σκληρό, εύθραυστο λεμόνι κίτρινο χρώμα. Είναι πρακτικά αδιάλυτο στο νερό, αλλά είναι καλά διαλυτό σε CS2 ανιλίνη σε διθειάνθρακα και μερικούς άλλους διαλύτες.
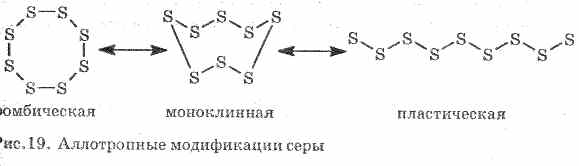
Η κακή συμπεριφορά παράγει θερμότητα και ηλεκτρικό ρεύμα. Το θείο σχηματίζει αρκετές αλλοτροπικές τροποποιήσεις:
1 . ^ Ρομβικό θείο (τα πιο σταθερά), οι κρύσταλλοι έχουν τη μορφή οκταεδρών.
Όταν θερμαίνεται το θείο, αλλάζει το χρώμα και το ιξώδες του: αρχικά σχηματίζεται ανοιχτό κίτρινο και στη συνέχεια καθώς η θερμοκρασία αυξάνεται, σκουραίνει και γίνεται τόσο ιξώδης ώστε να μην ρέει έξω από το σωλήνα, με περαιτέρω θέρμανση, το ιξώδες πέφτει πάλι και στους 444,6 ° C θέρες .
2. ^ Μονοκλινικό θείο - τροποποίηση με τη μορφή σκούρων κίτρινων βελόνων, που λαμβάνονται με βραδεία ψύξη του τηγμένου θείου.
3. Πλαστικό θείοσχηματίζεται εάν το θείο που θερμαίνεται μέχρι βρασμού χύνεται σε κρύο νερό. Εύκολα τεντωμένο σαν καουτσούκ (βλέπε εικ. 19).
Το φυσικό θείο αποτελείται από ένα μίγμα τεσσάρων σταθερών ισοτόπων: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Χημικές ιδιότητες
Ένα άτομο θείου, που έχει ατελές εξωτερικό επίπεδο ενέργειας, μπορεί να συνδέσει δύο ηλεκτρόνια και να παρουσιάσει ένα βαθμό
Οξείδωση -2. Το θείο παρουσιάζει μια τέτοια κατάσταση οξείδωσης σε ενώσεις με μέταλλα και υδρογόνο (Na2S, H2S). Κατά την ανάκρουση ή την εξάντληση των ηλεκτρονίων στο άτομο του πιο ηλεκτροαρνητικού στοιχείου, ο βαθμός οξείδωσης του θείου μπορεί να είναι 2, 4, 6.
Το θείο είναι σχετικά αδρανές στο κρύο, αλλά με την αύξηση της θερμοκρασίας αυξάνεται η αντιδραστικότητα του. 1. Με τα μέταλλα, το θείο εμφανίζει οξειδωτικές ιδιότητες. Όταν αυτές οι αντιδράσεις σχηματίζουν σουλφίδια (με χρυσό, πλατίνα και ιρίδιο δεν αντιδρά): Fe S = FeS
2. Υπό κανονικές συνθήκες, το θείο δεν αντιδρά με υδρογόνο και στους 150-200 ° C εμφανίζεται μια αναστρέψιμη αντίδραση:
3. Σε αντιδράσεις με μέταλλα και με υδρογόνο, το θείο συμπεριφέρεται ως τυπικός οξειδωτικός παράγοντας και παρουσία ισχυρών οξειδωτικών παραγόντων παρουσιάζει μειωτικές ιδιότητες.
S 3F 2 = SF 6 (δεν αντιδρά με ιώδιο)
4. Η καύση του θείου στο οξυγόνο προχωρά στους 280 ° C και στον αέρα στους 360 ° C. Αυτό σχηματίζει ένα μίγμα SO2 και SO3:
S02 = SO2 2S3O2 = 2SO3
5. Όταν θερμαίνεται χωρίς αέρα, το θείο συνδυάζεται άμεσα με φωσφόρο, άνθρακα, που εμφανίζει οξειδωτικές ιδιότητες:
2P 3S = P 2S 3 2S C = CS 2
6. Όταν αλληλεπιδρά με σύνθετες ουσίες, το θείο συμπεριφέρεται κυρίως ως αναγωγικός παράγοντας:
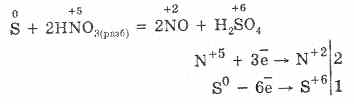
7. Το θείο είναι ικανό για αντιδράσεις δυσαναλογίας. Έτσι, όταν βράζει σκόνη θείου με αλκάλια, σχηματίζονται σουλφίδια και σουλφίδια:
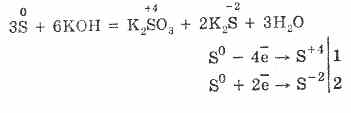
Εφαρμογή
Το θείο χρησιμοποιείται ευρέως στη βιομηχανία και τη γεωργία. Περίπου το ήμισυ της παραγωγής της καταναλώνεται για να παράγει θειικό οξύ. Το θείο χρησιμοποιείται για τον βουλκανισμό του καουτσούκ: στην περίπτωση αυτή, το λάστιχο μετατρέπεται σε καουτσούκ.
Με τη μορφή θείου (λεπτή σκόνη) το θείο χρησιμοποιείται για την καταπολέμηση των ασθενειών του αμπελώνα και του βαμβακιού. Χρησιμοποιείται για την απόκτηση πυρίτιδας, αγώνων, φωτεινών συνθέσεων. Στην ιατρική, παρασκευασμένη αλοιφή θείου για τη θεραπεία δερματικών παθήσεων.
4.2. Σουλφίδιο του υδρογόνου, σουλφίδια, υδροσουλφίδια
Το υδρόθειο είναι ένα ανάλογο του νερού. Ηλεκτρονική φόρμουλα
Δείχνει ότι δύο ρ-ηλεκτρόνια του εξωτερικού επιπέδου του ατόμου θείου εμπλέκονται στο σχηματισμό δεσμών Η-δ-Η. Το μόριο H2S έχει ένα γωνιακό σχήμα, επομένως είναι πολικό.
^ Όντας στη φύση
Το σουλφίδιο του υδρογόνου βρίσκεται στη φύση στα ηφαιστειακά αέρια και στα νερά ορισμένων ορυκτών πηγών, όπως το Πιατιγκόρσκ, το Matsesta. Δημιουργείται από τη διάσπαση οργανικών ουσιών που περιέχουν θείο από διάφορα κατάλοιπα ζώων και φυτών. Αυτό εξηγεί τη χαρακτηριστική δυσάρεστη οσμή των λυμάτων, των βόθρων και των χώρων υγειονομικής ταφής.
Να πάρει
1. Το σουλφίδιο του υδρογόνου μπορεί να ληφθεί με απευθείας σύνδεση θείου με υδρογόνο με θέρμανση:
2. Αλλά συνήθως λαμβάνεται από τη δράση αραιού υδροχλωρικού ή θειικού οξέος σε σουλφίδιο σιδήρου (III):
Η αντίδραση αυτή συχνά εκτελείται στη συσκευή Kipp.
^ Φυσικές ιδιότητες
Υπό κανονικές συνθήκες, το υδρόθειο είναι ένα άχρωμο αέριο με ισχυρή χαρακτηριστική οσμή από σάπια αυγά. Πολύ δηλητηριώδης, η εισπνοή δεσμεύει την αιμοσφαιρίνη, προκαλώντας παράλυση, η οποία είναι ανθυγιεινή.
Ko οδηγεί στο θάνατο. Σε χαμηλές συγκεντρώσεις, λιγότερο επικίνδυνες. Είναι απαραίτητο να συνεργαστείτε μαζί του σε ερμάρια εξάτμισης ή με ερμητικά κλειστές συσκευές. Η επιτρεπτή περιεκτικότητα του H 2 S στις εγκαταστάσεις παραγωγής είναι 0,01 mg ανά 1 λίτρο αέρα.
Το σουλφίδιο του υδρογόνου είναι σχετικά καλά διαλυτό σε νερό (στους 20 ° C διαλύονται 2.5 όγκοι υδρόθειου σε 1 όγκο νερού).
Ένα διάλυμα υδρόθειου στο νερό ονομάζεται νερό υδρόθειου ή υδρόθειο οξύ (ανιχνεύει τις ιδιότητες ενός ασθενούς οξέος).
^ Χημικές ιδιότητες
1, Όταν θερμαίνεται έντονα, το υδρόθειο σχεδόν αποσυντίθεται πλήρως για να σχηματίσει θείο και υδρογόνο.
2. Το αέριο υδρόθειο καίει στον αέρα με μπλε φλόγα με σχηματισμό οξειδίου του θείου (IV) και νερού:
2Η2S3Ο2 = 2S02Η2O
Με έλλειψη οξυγόνου σχηματίζονται θείο και νερό: 2Η2SΟ2 = 2S2Η2Ο
3. Το σουλφίδιο του υδρογόνου είναι ένας αρκετά ισχυρός αναγωγικός παράγοντας. Αυτή η σημαντική χημική ιδιότητα μπορεί να εξηγηθεί ως εξής. Σε ένα διάλυμα H2S, είναι σχετικά εύκολο να δώσουμε ηλεκτρόνια σε μόρια οξυγόνου αέρα:
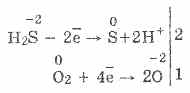
Ταυτόχρονα, το οξυγόνο στον αέρα οξειδώνει το υδρόθειο προς το θείο, γεγονός που καθιστά το υδρόθειο νερό θολό:
2Η2SΟ2 = 2Sηs 2Η2Ο
Αυτό εξηγεί το γεγονός ότι το υδρόθειο δεν συσσωρεύεται σε πολύ μεγάλες ποσότητες στη φύση όταν διασπάται η οργανική ύλη - το οξυγόνο από τον αέρα το οξειδώνει σε ελεύθερο θείο.
4, Υδρογονο θειούχο αντιδρά δυνατά με διαλύματα αλογόνου, για παράδειγμα:
H 2 S I 2 = 2 H 2 S Sulfur απελευθερώνεται και το διάλυμα ιωδίου γίνεται αποχρωματισμένο.
5. Διάφοροι οξειδωτές αντιδρούν έντονα με υδρόθειο: υπό τη δράση του νιτρικού οξέος, σχηματίζεται ελεύθερο θείο.
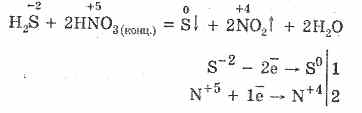
6. Ένα διάλυμα υδρόθειου είναι όξινο λόγω της διάστασης:
H 2 S ½ HS - HS - H S - 2
Το πρώτο στάδιο συνήθως επικρατεί. Είναι ένα πολύ ασθενές οξύ: ασθενέστερο από το οξύ άνθρακα, το οποίο συνήθως μετατοπίζει το H2S από σουλφίδια.
Θειούχα και υδροσουλφίδια
Το υδροφθορικό οξύ, ως διβασικό, σχηματίζει δύο σειρές αλάτων:
Μέσα σουλφίδια (Na2S);
Ξηρά - υδροσουλφίδια (NaHS).
Αυτά τα άλατα μπορούν να ληφθούν: με την αλληλεπίδραση υδροξειδίων με υδρόθειο: 2NaOHH2S = Na2S2H2O
Η άμεση αλληλεπίδραση θείου με μέταλλα:
Η αντίδραση ανταλλαγής αλάτων με H2S ή μεταξύ αλάτων:
Pb (ΝΟ3) 2Νa2S = PbS ^ 2NaNO3
CuS04H2S = CuSysH2SO4Cu2H2S = CuSnH2H
Τα υδροσουλφίδια είναι σχεδόν όλα διαλυτά στο νερό.
Τα σουλφίδια των μετάλλων αλκαλίων και αλκαλικών γαιών είναι επίσης εύκολα διαλυτά στο νερό, άχρωμα.
Τα σουλφίδια βαρέων μετάλλων είναι πρακτικά αδιάλυτα ή ελαφρώς διαλυτά στο νερό (FeS, MnS, ZnS). Μερικά από αυτά δεν διαλύονται σε αραιά οξέα (CuS, PbS, HgS).
Ως άλατα ασθενούς οξέος, τα σουλφίδια σε υδατικά διαλύματα υδρολύονται σε μεγάλο βαθμό. Για παράδειγμα, σουλφίδια αλκαλιμετάλλων, όταν διαλύονται σε νερό, έχουν αλκαλική αντίδραση:
Na2SN0NaNaHS NaOH
Όλα τα σουλφίδια, όπως το ίδιο το υδρόθειο, είναι ισχυροί αναγωγικοί παράγοντες:
3PbS-28HN5O3 (παρ.) = 3PbS6O4 4H2O8N2O
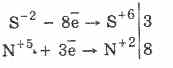
Μερικά σουλφίδια έχουν ένα χαρακτηριστικό χρώμα: CuS και PbS - μαύρο, CdS - κίτρινο, ZnS - λευκό, MnS - ροζ, SnS - καφέ, Al2S3 - πορτοκαλί. Η ποιοτική ανάλυση των κατιόντων βασίζεται στις διαφορετικές διαλυτότητες των σουλφιδίων και στα διαφορετικά χρώματα πολλών από αυτά.
^ 4.3. Οξείδιο του θείου (IV) και θειικό οξύ
Το οξείδιο του θείου (IV) ή το διοξείδιο του θείου, υπό φυσιολογικές συνθήκες, είναι ένα άχρωμο αέριο με οξεία ασφυκτική οσμή. Όταν ψύχεται στους -10 ° C, υγροποιείται σε ένα άχρωμο υγρό.
Να πάρει
1. Υπό εργαστηριακές συνθήκες, το οξείδιο του θείου (IV) λαμβάνεται από άλατα θειούχου οξέος με τη δράση ισχυρών οξέων πάνω τους:
Na2S03H2SO4 = Na2S04S02 H2O2NaHSO3H2SO4 = Na2SO4S02 2H2O2HSO - 3 2H = 2SO2 2H2O
2. Επίσης το διοξείδιο του θείου σχηματίζεται από την αλληλεπίδραση του πυκνού θειικού οξέος όταν θερμαίνεται με μέταλλα χαμηλής δραστικότητας:
Cu2H2S04 = CuSO4S02 2H2O
Cu 4H 2SO 2-4 = Cu2S02-24SO2 2H2O
3. Το οξείδιο του θείου (IV) σχηματίζεται επίσης όταν το θείο καίγεται στον αέρα ή το οξυγόνο:
4. Σε βιομηχανικές συνθήκες, το SO 2 λαμβάνεται με φρύξη με πυρίτη με FeS 2 ή θειούχα ορυκτά μη σιδηρούχων μετάλλων (μείγμα ψευδαργύρου ZnS, μολύβδου PbS κ.λπ.):
4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Ο δομικός τύπος του μορίου SO2:
Τέσσερα άτομα θείου και τέσσερα ηλεκτρόνια από δύο άτομα οξυγόνου συμμετέχουν στον σχηματισμό δεσμών στο μόριο S02. Η αμοιβαία απόρριψη των ζευγών ηλεκτρονίων σύνδεσης και το μοναδικό ζεύγος ηλεκτρονίων θείου δίνει στο μόριο ένα γωνιακό σχήμα.
Χημικές ιδιότητες
1. Το οξείδιο του θείου (IV) παρουσιάζει όλες τις ιδιότητες των οξειδίων του οξέος:
Αντίδραση νερού
Αλληλεπίδραση με αλκάλια
Αλληλεπίδραση με βασικά οξείδια.
2. Το οξείδιο του θείου (IV) χαρακτηρίζεται από μειωμένες ιδιότητες:
S 4 O 2 O 0 2 ₂ 2 S 6 O -2 3 (παρουσία καταλύτη, όταν θερμαίνεται)
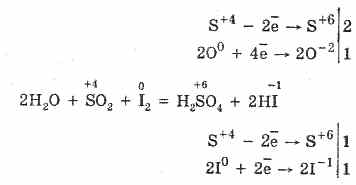
Αλλά παρουσία ισχυρών αναγωγικών παραγόντων, το S02 συμπεριφέρεται ως οξειδωτικό μέσο:
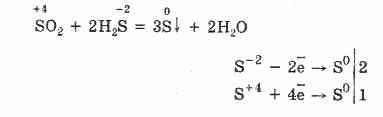
Η οξειδοαναγωγική δυαδικότητα του οξειδίου του θείου (IV) εξηγείται από το γεγονός ότι το θείο έχει μία κατάσταση οξείδωσης 4 σε αυτό και επομένως μπορεί να οξειδωθεί στο S6 και λαμβάνοντας 4 ηλεκτρόνια μπορεί να μειωθεί σε S °. Η εκδήλωση αυτών ή άλλων ιδιοτήτων εξαρτάται από τη φύση του αντιδραστικού συστατικού.
Το οξείδιο του θείου (IV) είναι εξαιρετικά διαλυτό σε νερό (40 όγκοι S02 διαλύονται σε 1 όγκο στους 20 ° C). Στην περίπτωση αυτή σχηματίζεται θειώδες οξύ που υπάρχει μόνο σε υδατικό διάλυμα:
SO2H2OgH2SO3
Η αντίδραση είναι αναστρέψιμη. Σε υδατικό διάλυμα, το οξείδιο του θείου (IV) και το θειώδες οξύ βρίσκονται σε χημική ισορροπία, η οποία μπορεί να μετατοπιστεί. Με τη δέσμευση του H2S03 (εξουδετέρωση του οξέος
Εσείς) η αντίδραση προχωρά προς την κατεύθυνση του σχηματισμού θειώδους οξέος. όταν απομακρύνεται το S02 (διοχετεύοντας διαμέσου ενός διαλύματος αζώτου ή θέρμανσης), η αντίδραση προχωρά προς τα αρχικά υλικά. Το διάλυμα θειικού οξέος περιέχει πάντα οξείδιο του θείου (IV), το οποίο του προκαλεί αιχμηρή οσμή.
Το θειικό οξύ έχει όλες τις ιδιότητες των οξέων. Σε διάλυμα διαχωρίζεται σε βήματα:
Η2SO3. HSO - 3 HSO - 3. HSO 2 - 3
Θερμικά ασταθής, πτητική. Το θειικό οξύ, ως διβασικό, σχηματίζει δύο τύπους αλάτων:
Μέση θειώδη άλατα (Na2SO3);
Ξηρό - υδροθειώδες (NaHSO 3).
Τα θειώδη άλατα σχηματίζονται όταν το αλκάλιο εξουδετερώνεται εξ ολοκλήρου από το οξύ:
H2S03.2NaOH = Na2S03H2O
Οι υδροθειώδεις ενώσεις λαμβάνονται με έλλειψη αλκαλίων:
H2S03 NaOH = NaHS03H2O
Το θειικό οξύ και τα άλατά του διαθέτουν τόσο οξειδωτικές όσο και αναγωγικές ιδιότητες, η οποία καθορίζεται από τη φύση του εταίρου της αντίδρασης.
1. Έτσι, κάτω από τη δράση των θειώδους οξυγόνου οξειδώνονται σε θειικά:
2Na2S4O3O02 = 2Na2S6O -24
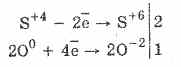
Η οξείδωση του θείου με βρωμίδιο και υπερμαγγανικό κάλιο προχωρά ακόμα πιο εύκολα:
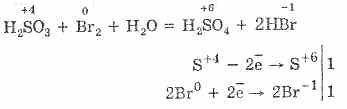
5Η2S4Ο3 2ΚΜη 7Ο4 = 2Η2S6Ο4 2Μη2S6Ο4Κ2S6Ο4Η2Ο
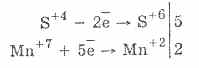
2. Υπό την παρουσία ισχυρότερων αναγωγικών παραγόντων, τα θειώδη άλατα παρουσιάζουν οξειδωτικές ιδιότητες:
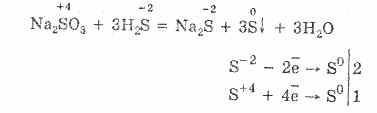
Σχεδόν όλα τα υδροθειώδη άλατα και τα θειώδη αλκαλικά μέταλλα διαλύονται από άλατα θειούχου οξέος.
3. Δεδομένου ότι το H2S03 είναι ασθενές οξύ, η δράση οξέων σε θειώδη και υδροθειώδη άλατα έχει ως αποτέλεσμα την απελευθέρωση του S02. Αυτή η μέθοδος χρησιμοποιείται συνήθως όταν λαμβάνεται SO 2 σε εργαστηριακές συνθήκες:
NaHSO3H2S04 = Na2S04S02 Η2Ο
4. Υδατοδιαλυτά θειώδη άλατα υποβάλλονται εύκολα σε υδρόλυση, ως αποτέλεσμα της οποίας η συγκέντρωση των ιόντων ΟΗ αυξάνεται στο διάλυμα:
Na2S03NonNaHS03 NaOH
Εφαρμογή
Το οξείδιο του θείου (IV) και το θειώδες οξύ αποχρωματίζουν πολλές βαφές, σχηματίζοντας μαζί τους άχρωμες ενώσεις. Το τελευταίο μπορεί να αποσυντεθεί ξανά όταν θερμαίνεται ή στο φως, με αποτέλεσμα να αποκατασταθεί το χρώμα. Ως εκ τούτου, το αποτέλεσμα λεύκανσης των SO2 και H2S3 είναι διαφορετικό από το φαινόμενο λεύκανσης του χλωρίου. Συνήθως, θείο (IV) rxid λευκαντικά μαλλί, μετάξι και άχυρο.
Το οξείδιο του θείου (IV) σκοτώνει πολλούς μικροοργανισμούς. Ως εκ τούτου, για να καταστρέψουν τους μύκητες μούχλας, καπνίζουν πρώτες κελάρια, κελάρια, βαρέλια κρασιού, κλπ. Χρησιμοποιείται επίσης για τη μεταφορά και την αποθήκευση φρούτων και μούρων. Σε μεγάλες ποσότητες, το οξείδιο του θείου IV) χρησιμοποιείται για την παραγωγή θειικού οξέος.
Μια σημαντική εφαρμογή είναι η λύση του υδροθειώδους ασβεστίου CaHSO 3 (θειώδες υγρό), το οποίο χρησιμοποιείται για τη κατεργασία χαρτοπολτού και χαρτοπολτού.
^ 4.4. Οξείδιο του θείου (VI). Θειικό οξύ
Το οξείδιο του θείου (VI) (βλέπε πίνακα 20) είναι ένα άχρωμο υγρό που στερεοποιείται σε θερμοκρασία 16.8 ° C σε μια στερεή κρυσταλλική μάζα. Αφαιρεί πολύ υγρασία, σχηματίζοντας θειικό οξύ: SO 3 H 2 O = H 2 SO 4
Πίνακας 20. Ιδιότητες των οξειδίων του θείου
Η διάλυση των οξειδίων του θείου (VI) σε νερό συνοδεύεται από την απελευθέρωση σημαντικής ποσότητας θερμότητας.
Το οξείδιο του θείου (VI) είναι πολύ διαλυτό σε πυκνό θειικό οξύ. Ένα διάλυμα SO3 σε ένα άνυδρο οξύ ονομάζεται oleum. Oleums μπορεί να περιέχει έως και 70% SO 3.
Να πάρει
1. Το οξείδιο του θείου (VI) λαμβάνεται με οξείδωση διοξειδίου του θείου με οξυγόνο παρουσία καταλυτών σε θερμοκρασία 450 ° C (βλέπε Παραγωγή θειικού οξέος):
2SO2O2 = 2S03
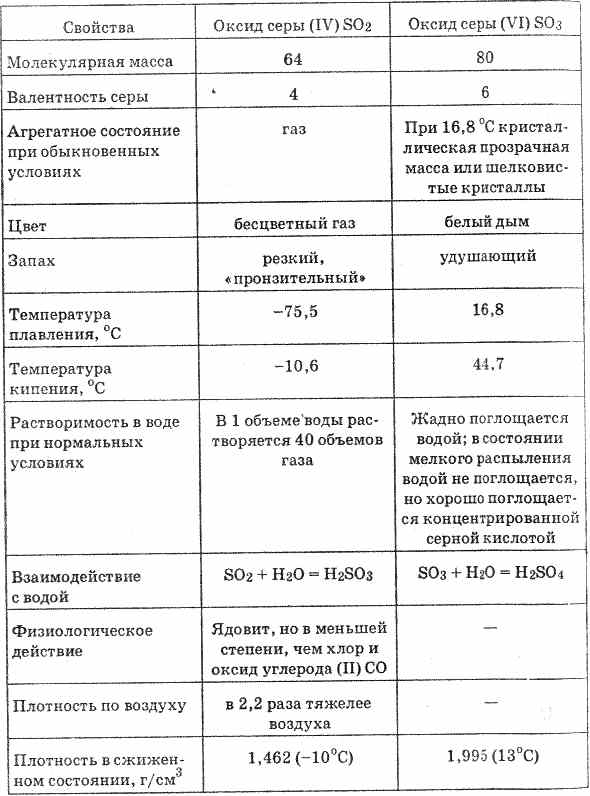
2. Ένας άλλος τρόπος για την οξείδωση του SO2 σε SO 3 είναι η χρήση οξειδίου του νιτρικού (IV) ως οξειδωτικού παράγοντα:
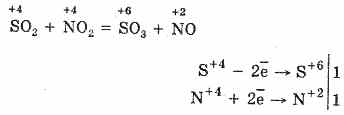
Το προκύπτον μονοξείδιο του αζώτου (II) όταν αλληλεπιδρά με το ατμοσφαιρικό οξυγόνο μετατρέπεται εύκολα και γρήγορα σε νιτρικό οξείδιο (IV): 2NO2 = 2NO2
Το οποίο μπορεί και πάλι να χρησιμοποιηθεί στην οξείδωση του SO2. Συνεπώς, το ΝΟ2 δρα ως φορέας οξυγόνου. Αυτή η μέθοδος οξειδώσεως του S02 προς SO3 ονομάζεται νιτρώδες. Το μόριο του S03 έχει το σχήμα ενός τριγώνου στο κέντρο του οποίου
Το άτομο θείου βρίσκεται:
Μια τέτοια δομή οφείλεται στην αμοιβαία απόρριψη των ζευγών ηλεκτρονίων σύνδεσης. Ένα άτομο θείου έδωσε έξι εξωτερικά ηλεκτρόνια για το σχηματισμό τους.
Χημικές ιδιότητες
1. SO 3 - τυπικό όξινο οξείδιο.
2. Το οξείδιο του θείου (VI) έχει τις ιδιότητες ενός ισχυρού οξειδωτικού παράγοντα.
Εφαρμογή
Το οξείδιο του θείου (VI) χρησιμοποιείται για την παραγωγή θειικού οξέος. Η πιο σημαντική είναι η μέθοδος επικοινωνίας απόκτησης
Θειικό οξύ. Με αυτή τη μέθοδο, μπορείτε να πάρετε το H2SO4 οποιασδήποτε συγκέντρωσης, καθώς και το αλεύρι. Η διαδικασία αποτελείται από τρία στάδια: λήψη SO 2. οξείδωση του S02 έως S03. λήψη H2S04.
Το SO 2 λαμβάνεται με την καύση πυριτικού FeS 2 σε ειδικούς κλιβάνους: 4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Για να επιταχυνθεί το ψήσιμο, το πυρίτη είναι προ-αλεσμένο και για την πληρέστερη καύση του θείου, εισάγεται σημαντικά περισσότερος αέρας (οξυγόνο) από τον απαιτούμενο από την αντίδραση. Το αέριο που εξέρχεται από τον κλίβανο αποτελείται από οξείδιο του θείου (IV), οξυγόνο, άζωτο, ενώσεις αρσενικού (από ακαθαρσίες σε πυρίτες) και υδρατμούς. Ονομάζεται αέριο ψησίματος.
Το αέριο ψησίματος υφίσταται λεπτομερή καθαρισμό, καθώς ακόμη και μια μικρή περιεκτικότητα σε ενώσεις αρσενικού, καθώς και η σκόνη και η υγρασία, δηλητηριάζουν τον καταλύτη. Το αέριο καθαρίζεται από ενώσεις αρσενικού και σκόνη, διοχετεύεται μέσω ειδικών ηλεκτροστατικών κατακρημνιστών και πύργου πλύσης. η υγρασία απορροφάται από πυκνό θειικό οξύ σε πύργο ξήρανσης. Το καθαρισμένο αέριο που περιέχει οξυγόνο θερμαίνεται σε έναν εναλλάκτη θερμότητας έως 450 ° C και εισέρχεται στη συσκευή επαφής. Μέσα στη συσκευή επαφής υπάρχουν ράφια πλέγματος γεμισμένα με καταλύτη.
Προηγουμένως, ως καταλύτης χρησιμοποιήθηκε λεπτώς συνθλιμμένη μεταλλική πλατίνα. Στη συνέχεια, αντικαταστάθηκε από ενώσεις βαναδίου - οξείδιο του βαναδίου (V) V 2 O 5 ή βανταϋλο θειικό VOSO 4, το οποίο είναι φθηνότερο από το λευκόχρυσο και αργότερα δηλητηριασμένο.
Η αντίδραση της οξείδωσης του S02 σε S03 είναι αναστρέψιμη:
2SO2O2 2S03
Η αύξηση της περιεκτικότητας σε οξυγόνο στο αέριο διαπύρωσης αυξάνει την απόδοση του οξειδίου του θείου (VI): σε θερμοκρασία 450 ° C, συνήθως φθάνει το 95% ή περισσότερο.
Το σχηματιζόμενο οξείδιο του θείου (VI) στη συνέχεια τροφοδοτείται με μια μέθοδο αντίθετου ρεύματος σε έναν πύργο απορρόφησης, όπου απορροφάται από πυκνό θειικό οξύ. Καθώς κορεσθεί, σχηματίζεται πρώτα άνυδρο θειικό οξύ, και στη συνέχεια το έλαιο. Στο μέλλον, το έλαιο αραιώνεται σε θειικό οξύ 98% και παραδίδεται στους καταναλωτές.
Ο δομικός τύπος του θειικού οξέος:
^ Φυσικές ιδιότητες
Το θειικό οξύ είναι ένα βαρύ, άχρωμο, ελαιώδες υγρό που κρυσταλλώνεται στους 10,4 ° C σχεδόν διπλά ( = 1,83 g / cm 3) είναι βαρύτερο από το νερό, άοσμο, μη πτητικό. Εξαιρετικά υγροσκοπικό. Η υγρασία απορροφάται με την απελευθέρωση μεγάλων ποσοτήτων θερμότητας, έτσι ώστε να μην μπορείτε να ρίχνετε νερό στο πυκνό θειικό οξύ - θα υπάρξει μια εκτόξευση οξέος. Για το
Το θειικό οξύ πρέπει να προστεθεί στο νερό σε μικρές ποσότητες.
Το άνυδρο θειικό οξύ διαλύει έως 70% οξείδιο του θείου (VI). Όταν θερμαίνεται, απομακρύνεται το SO 3 μέχρι να σχηματιστεί διάλυμα με κλάσμα μάζας H2S04 98,3%. Το άνυδρο H2S04 σχεδόν δεν εκτελεί ηλεκτρικό ρεύμα.
^ Χημικές ιδιότητες
1. Αναμιγνύεται με νερό σε οποιαδήποτε αναλογία και σχηματίζει υδρίτες διαφορετικής σύνθεσης:
Η2SΟ4Η2Ο, Η2SΟ4Η2Ο, Η2SΟ4Η2Ο, Η2SΟ4 4Η2Ο, Η2SΟ4 6.5Η2Ο
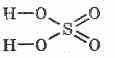
2. Συμπυκνωμένο θειικό οξύ ανθραίνει οργανική ύλη - ζάχαρη, χαρτί, ξύλο, ίνες, απομακρύνοντας από αυτά τα στοιχεία του νερού:
C12H22O11H2S04 = 12CΗ2SΟ411Η2Ο
Ο σχηματισμένος άνθρακας εν μέρει αλληλεπιδρά με το οξύ:
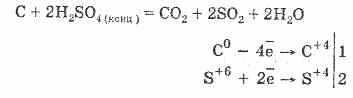
Η αφυδάτωση αερίου βασίζεται στην απορρόφηση του νερού από το θειικό οξύ.
Ως ισχυρό μη πτητικό οξύ, το H2S04 αντικαθιστά άλλα οξέα από ξηρά άλατα:
NaNO3H2S04 = NaHS04HNO3
Εντούτοις, αν προστίθεται H2S04 σε διαλύματα αλατιού, δεν υπάρχει μετατόπιση οξέος.
H 2 SO 4 - ισχυρό διβασικό οξύ: H 2 SO 4 H HSO 4 HSO - 4 H SO 2 2- 4
Έχει όλες τις ιδιότητες των μη πτητικών ισχυρών οξέων.
Το αραιωμένο θειικό οξύ χαρακτηρίζεται από όλες τις ιδιότητες των μη οξειδωτικών οξέων. Συγκεκριμένα: αλληλεπιδρά με μέταλλα που βρίσκονται στην ηλεκτροχημική σειρά της τάσης των μετάλλων μέχρι το υδρογόνο:
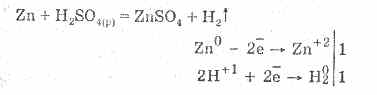
Η αλληλεπίδραση με τα μέταλλα οφείλεται στη μείωση των ιόντων υδρογόνου.
6. Το πυκνό θειικό οξύ είναι ένας ενεργός παράγοντας οξειδώσεως. Όταν θερμαίνεται, οξειδώνει τα περισσότερα μέταλλα, συμπεριλαμβανομένων εκείνων της ηλεκτροχημικής σειράς τάσεων μετά το υδρογόνο, δεν αντιδρά μόνο με πλατίνα και χρυσό. Ανάλογα με τη δραστηριότητα του μετάλλου, τα προϊόντα μείωσης μπορούν να είναι S-2, S ° και S4.
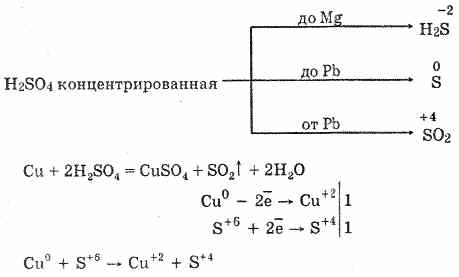
Στο κρύο, το πυκνό θειικό οξύ δεν αλληλεπιδρά με τέτοια ισχυρά μέταλλα όπως το αλουμίνιο, ο σίδηρος και το χρώμιο. Αυτό οφείλεται στην παθητικοποίηση των μετάλλων. Αυτό το χαρακτηριστικό χρησιμοποιείται ευρέως όταν μεταφέρεται σε δοχείο σιδήρου.
Ωστόσο, όταν θερμαίνεται:
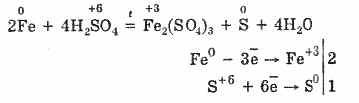
Έτσι, το πυκνό θειικό οξύ αλληλεπιδρά με μέταλλα λόγω της μείωσης των ατόμων που σχηματίζουν οξύ.
Μια ποιοτική αντίδραση στο θειικό ιόν SO 2-4 είναι ο σχηματισμός ενός λευκού κρυσταλλικού ιζήματος BaS04, αδιάλυτο σε νερό και οξέα:
SO 2 4 Ba 2 BaSO 4
Εφαρμογή
Το θειικό οξύ είναι το πιο σημαντικό προϊόν της κύριας χημικής βιομηχανίας που ασχολείται με την παραγωγή μη-
Οργανικά οξέα, αλκάλια, άλατα, ανόργανα λιπάσματα και χλώριο.
Για μια ποικιλία εφαρμογών το θειικό οξύ κατατάσσεται πρώτο μεταξύ των οξέων. Η μεγαλύτερη ποσότητα καταναλώνεται για τη λήψη φωσφορικών και αζωτούχων λιπασμάτων. Ως μη πτητικό, χρησιμοποιείται θειικό οξύ για την παραγωγή άλλων οξέων - υδροχλωρικό, υδροφθορικό, φωσφορικό και οξικό.
Πολλά από αυτά προορίζονται για τον καθαρισμό των πετρελαϊκών προϊόντων - βενζίνης, κηροζίνης, λιπαντικών ελαίων - από επιβλαβείς ακαθαρσίες. Στη μηχανολογία, το θειικό οξύ καθαρίζει την μεταλλική επιφάνεια από οξείδια πριν από την επίστρωση (επιμετάλλωση με νικέλιο, επικάλυψη χρωμίου, κλπ.). Το θειικό οξύ χρησιμοποιείται στην κατασκευή εκρηκτικών, τεχνητών ινών, βαφών, πλαστικών και πολλών άλλων. Χρησιμοποιείται για την πλήρωση των μπαταριών.
Τα άλατα θειικού οξέος είναι σημαντικά.
^ Θειικό νάτριοΤο Na2S04 κρυσταλλώνεται από υδατικά διαλύματα με τη μορφή ενός ένυδρου Na2S0410H2O, το οποίο ονομάζεται άλας Glauber. Χρησιμοποιείται στην ιατρική ως καθαρτικό. Το άνυδρο θειικό νάτριο χρησιμοποιείται στην παρασκευή σόδας και γυαλιού.
^ Θειικό αμμώνιο(NH4) 2SO4 - λίπασμα αζώτου.
Θειικό κάλιοK 2 SO 4 - λίπασμα ποτάσας.
Θειικό ασβέστιο Το CaSO 4 βρίσκεται στη φύση με τη μορφή του ανόργανου CaSO4 2H2O του γύψου. Όταν θερμαίνεται στους 150 ° C, χάνει λίγο από το νερό και πηγαίνει σε ένα ένυδρο άλας 2CaSO4H2O, που ονομάζεται καμένος γύψος ή αλάβαστρο. Όταν αναμιγνύεται με νερό σε μάζα πάστας, ο αλαβάστής σκληραίνει ξανά μετά από κάποιο χρονικό διάστημα, μετατρέποντας το σε CaSO4 2H2O. Ο γύψος χρησιμοποιείται ευρέως στην κατασκευή (σοβάς).
^ Θειικό μαγνήσιοΤο MgS04 βρίσκεται στο θαλασσινό νερό, προκαλώντας την πικρή του γεύση. Ο κρυσταλλικός ένυδρος, που ονομάζεται πικρό άλας, χρησιμοποιείται ως καθαρτικό.
Vitriol- τεχνική ονομασία των κρυσταλλικών ένυδρων μορφών των θειικών μετάλλων Fe, Cu, Zn, Ni, Co (τα αφυδατωμένα άλατα δεν είναι υαλώδη). Θειικό χαλκόΤο CuSO4 5H2O είναι μια μπλε τοξική ουσία. Τα φυτά ψεκάζονται με αραιωμένο διάλυμα και σπόροι σπέρνονται πριν από τη σπορά. Σιδήρου βιτριόληςΤο FeSO4 7H2O είναι μια ανοιχτό πράσινη ουσία. Χρησιμοποιείται για τον έλεγχο παρασίτων φυτών, μελανιών, ορυκτών χρωμάτων κλπ. Θειικός ψευδάργυροςΤο ZnSO 4 7H 2 O χρησιμοποιείται στην παραγωγή ορυκτών μελανιών, στην sittoprechatanii, medicine.
^ 4.5. Εστέρες θειικού οξέος. Θειοθειικό νάτριο
Οι εστέρες του θειικού οξέος περιλαμβάνουν θειικά διαλκυλεστέρα (RO2) S02. Αυτά είναι υγρά με υψηλή θερμοκρασία βρασμού. χαμηλότερη διαλυτή στο νερό. παρουσία αλκάλεως, σχηματίζεται αλκοόλη και άλατα θειικού οξέος. Τα κατώτερα διαλκυλοθειικά είναι αλκυλιωτικοί παράγοντες.
Θειικό διαιθύλιο(C2H5) 2S04. Σημείο τήξεως -26 ° C, σημείο βρασμού 210 ° C, διαλυτό σε αλκοόλες, αδιάλυτο στο νερό. Λήφθηκε από την αλληλεπίδραση θειικού οξέος με αιθανόλη. Είναι ο παράγοντας αιθυλίωσης στην οργανική σύνθεση. Διεισδύει στο δέρμα.
Διμεθυλοθειικό(CH3) 2S04. Σημείο τήξεως -26.8 ° C, σημείο ζέσεως 188.5 ° C. Διαλυτό σε αλκοόλες, κακά σε νερό. Αντιδρά με αμμωνία απουσία διαλύτη (με έκρηξη). Θείο ορισμένες αρωματικές ενώσεις, όπως εστέρες φαινόλης. Λαμβάνεται με αλληλεπίδραση 60% oleum με μεθανόλη στους 150 ° C. Είναι ένας μεθυλιωτικός παράγοντας στην οργανική σύνθεση. Καρκινογόνο, επηρεάζει τα μάτια, το δέρμα, τα αναπνευστικά όργανα.
^ Θειοθειικό νάτριο Na2S2O3
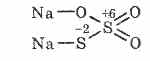
Άλας θειοθειικού οξέος στο οποίο δύο άτομα θείου έχουν διαφορετικές καταστάσεις οξείδωσης: 6 και -2. Κρυσταλλική ουσία, καλά διαλυτή στο νερό. Διατίθεται υπό μορφή κρυσταλλικού Na2S2O3 5H2O, κοινώς αναφερόμενο ως υποθειώδες. Λήφθηκε από την αλληλεπίδραση θειώδους νατρίου με θείο κατά τη διάρκεια του βρασμού:
Na2S03S = Na2S203
Όπως το θειοθειικό οξύ, είναι ένας ισχυρός αναγωγικός παράγοντας, οξειδώνεται εύκολα με χλώριο σε θειικό οξύ:
Na2S2O3 4Cl2 5Η2O = 2Η2SΟ4 2ΝaCl6ΗCl
Η χρήση θειοθειικού νατρίου για απορρόφηση χλωρίου (στις πρώτες μάσκες αερίων) βασίστηκε στην αντίδραση αυτή.
Ελαφρώς διαφορετική οξείδωση εμφανίζει ασθενές οξειδωτικό μέσο θειοθειικού νατρίου. Αυτό σχηματίζει άλατα του τετραθειονικού οξέος, για παράδειγμα:
2Na2S2O3I2 = Na2S4O6 2NaI
Το θειοθειϊκό νάτριο είναι ένα παραπροϊόν στην παραγωγή NaHSO 3, βαφών θείου, στον καθαρισμό βιομηχανικών αερίων από το θείο. Χρησιμοποιείται για την απομάκρυνση ιχνών χλωρίου μετά από λεύκανση υφασμάτων, για την εξαγωγή αργύρου από μεταλλεύματα. είναι ένα σταθεροποιητικό στη φωτογραφία, ένα αντιδραστήριο ιωδιομετρίας, ένα αντίδοτο για δηλητηρίαση με αρσενικές ενώσεις, υδράργυρο, έναν αντιφλεγμονώδη παράγοντα.
Το θείο του χημικού στοιχείου βρίσκεται στην ομάδα VIA, περίοδος 3 PSCE. Στο εξωτερικό στρώμα ηλεκτρονίων του ατόμου θείου υπάρχουν 6 ηλεκτρόνια. Παρουσιάζοντας τις ιδιότητες του οξειδωτικού παράγοντα στο σχηματισμό ουσιών με μέταλλα και υδρογόνο, το θείο αποκτά την κατάσταση οξείδωσης -2 (παίρνει 2 ηλεκτρόνια).
Στη σύνθεση των ενώσεων που περιέχουν οξυγόνο, το θείο εμφανίζει καταστάσεις οξείδωσης +4 και +6. Έτσι, το θείο χαρακτηρίζεται από καταστάσεις οξείδωσης -2. 0; +4. +6.
Στη φύση, το θείο βρίσκεται στην φυσική του κατάσταση και στη σύνθεση ορυκτών. Για παράδειγμα, το θείο περιέχει γυαλιστερό μόλυβδο (το κύριο συστατικό είναι το σουλφίδιο του μολύβδου PbS) και η στιλπνότητα χαλκού (το κύριο συστατικό είναι το σουλφίδιο του χαλκού Cu 2 S).
Το θείο σχηματίζει μερικές απλές ουσίες - αλλοτροπικές τροποποιήσεις. Το θρυμμένο θείο είναι πιο σταθερό σε θερμοκρασία δωματίου (Σχήμα 1). Αυτή η ουσία αποτελείται από μόρια S8. Το θρυμμικό θείο είναι κίτρινο και τήκεται σε θερμοκρασία + 112,8 ° C.
Το Σχ. 1. Ρομβική τροποποίηση του θείου
Όταν θερμαίνεται, το ρομβικό θείο μετατρέπεται σταδιακά σε μια παχύρρευστη σκούρα καφέ μάζα. Αυτή είναι μια άλλη αλλοτροπική τροποποίηση θείου - πλαστικού θείου. Το πλαστικό θείο αποτελείται από γραμμικά μόρια θείου S n.
Το θείο σε χημικές αντιδράσεις με μέταλλα και υδρογόνο παίζει το ρόλο ενός οξειδωτικού παράγοντα. Ο βαθμός οξείδωσης μειώνεται από 0 σε -2. Στην αντίδραση με οξυγόνο, το θείο δρα ως αναγωγικός παράγοντας, αυξάνοντας τον βαθμό οξείδωσης από 0 σε +4.
Εξετάστε παραδείγματα αλληλεπιδράσεων που αφορούν το θείο.
Όταν το θείο αλληλεπιδρά με το υδρογόνο, σχηματίζεται υδρόθειο:
Όταν ο ψευδάργυρος αλληλεπιδρά με θείο, σχηματίζεται σουλφίδιο ψευδαργύρου:
Το θείο καίει σε οξυγόνο με το σχηματισμό οξειδίου του θείου (IV) (Εικόνα 2):

Το Σχ. 2. Θέρμανση του θείου στο οξυγόνο
Εξετάστε τις ιδιότητες των ενώσεων θείου με κατάσταση οξείδωσης "-2". Τέτοιες ενώσεις περιλαμβάνουν υδρόθειο και σουλφίδια - άλατα οξέος υδρόθειου.
Το σουλφίδιο του υδρογόνου είναι ένα αέριο με τη μυρωδιά των σάπιων αυγών. Καίει στον αέρα. Επιπλέον, με έλλειψη και περίσσεια οξυγόνου, η καύση προχωρά διαφορετικά.
Σε μια περίσσεια οξυγόνου, το όξινο θειώδες καίει για να σχηματίσει οξείδιο του θείου (IV) και νερό:
2Η2S + 3Ο2 = 2S02 + 2Η2Ο.
Με έλλειψη οξυγόνου, συμβαίνει ατελή καύση υδρόθειου με την απελευθέρωση θείου: 2Η2S + 02 = 2S + 2Η2Ο.
Το σουλφίδιο του υδρογόνου είναι ιδιαίτερα διαλυτό στο νερό. Το προκύπτον διάλυμα είναι ένα ασθενές όξινο θειούχο οξύ. Τα άλατα υδροθείου ονομάζονται σουλφίδια. Το υδροφθορικό οξύ και τα υδατοδιαλυτά σουλφίδια εισέρχονται σε αντιδράσεις ανταλλαγής.
Η αλληλεπίδραση του οξίνου υδρόθειου και του χλωριούχου χαλκού (II) σχηματίζει αδιάλυτο σουλφίδιο του χαλκού (II) και υδροχλωρικό οξύ: H2S + CuCl2 = CuS + 2HCl.
Όταν το σουλφίδιο του καλίου αλληλεπιδρά με νιτρικό ψευδάργυρο, σχηματίζονται ιζήματα θειούχου ψευδαργύρου και νιτρικό κάλιο: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Αναφορές
- Orzhekovsky Ρ.Α. Συλλογή καθηκόντων και ασκήσεων στη χημεία: 9η τάξη: στο βιβλίο P.A. Orzhekovsky και άλλοι. "Χημεία. Βαθμός 9 / Ρ.Α. Orzhekovsky, Ν.Α. Titov, F.F. Χέγκελ - Μ.: AST: Astrel, 2007. (σελ. 91-97)
- Orzhekovsky Ρ.Α. Χημεία: 9η τάξη: μελέτες. για γενική εικόνα. ιδρύματος / Ρ.Α. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak - Μ.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky Ρ.Α. Χημεία: 9η τάξη: μελέτες για γενικά. ιδρύματος / Ρ.Α. Orzhekovsky, L.M. Meshcheryakova, Μ.Μ. Shalashov. - Μ.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Χημεία: neorgan. χημεία Οργάνου Χημεία: μελέτες. για 9 cl. / G.E. Rudzitis, F.G. Feldman. - M .: Εκπαίδευση, Μόσχα Εγχειρίδια OJSC, 2009.
- Khomchenko I.D. Συλλογή καθηκόντων και ασκήσεων στη χημεία του γυμνασίου. - Μ.: RIA "Νέο κύμα": Εκδότης Umerenkov, 2008.
- Εγκυκλοπαίδεια για παιδιά. Τόμος 17. Χημεία / Κεφάλαιο. ed. V.A. Volodin, Ved. επιστημονική ed. Ι. Leenson. - Μ.: Avanta +, 2003.
- Μια ενιαία συλλογή ψηφιακών εκπαιδευτικών πόρων (εμπειρίες βίντεο για το θέμα) ().
- Ηλεκτρονική έκδοση του περιοδικού "Χημεία και ζωή" ().
Εργασία στο σπίτι
- γ. 136 Νο 3; p.140 №№ 2-4 από το βιβλίο P.A. Orzhekovsky "Chemistry: 9th grade" / Ρ.Α. Orzhekovsky, L.M. Meshcheryakova, Μ.Μ. Shalashov. - Μ.: Astrel, 2013.
Σουλφίδια (από ευρύ θείο, θείο - θείο)
ενώσεις θείου με περισσότερα ηλεκτροθετικά στοιχεία. μπορούν να θεωρηθούν ως άλατα οξέος υδρόθειου (βλέπε Σουλφιδικό οξύ υδρογόνου) H 2 S. Υπάρχουν δύο σειρές C: ο μέσος (κανονικός) του γενικού τύπου M 2 S και το οξύ (υδροσουλφίδια) του γενικού τύπου MHS, όπου το Μ είναι μονοσθενές μέταλλο. Τα αλκαλικά μέταλλα είναι άχρωμα, διαλυτά στο νερό. Τα υδατικά διαλύματα τους είναι πολύ υδρολυμένα και αλκαλικά. Υπό τη δράση των αραιών οξέων εκπέμπουν H2S Γ. Τα μέταλλα αλκαλικών γαιών είναι άχρωμα, ελαφρώς διαλυτά στο νερό. Το H 2 S εκπέμπεται σε υγρό αέρα. Άλλες ιδιότητες είναι παρόμοιες με τα μέταλλα αλκαλίων S. Τόσο αυτοί όσο και άλλοι S. είναι εύκολα οξειδωμένοι σε θειικά άλατα. Γ. Τα βαρέα μέταλλα είναι πρακτικά αδιάλυτα στο νερό. Σχεδόν όλα είναι μαύρα ή μαύρα-καφέ (με εξαίρεση το λευκό ZnS, ροζ MnS, κίτρινο CdS, πορτοκαλί κόκκινο Sb 2 S 3, κίτρινο SnS 2). Η άνιση αναλογία C. προς τα οξέα και το C. ammonium χρησιμοποιείται στη χημική ανάλυση. Ι.Κ. Μαλίνα.
Μεγάλη Σοβιετική Εγκυκλοπαίδεια. - Μ .: Σοβιετική Εγκυκλοπαίδεια. 1969-1978 .
Δείτε τι "Σουλφίδια" υπάρχουν σε άλλα λεξικά:
Οι ενώσεις του θείου με μέταλλα και μερικά μη μέταλλα. Τα θειούχα μέταλλα είναι άλατα υδρόθειου οξέος H2S: μέσου (για παράδειγμα, Na2S) και όξινων ή υδροσουλφιδίων (NaHS). Με την καύση φυσικών θειούχων, λαμβάνονται μη σιδηρούχα μέταλλα και SO2. Σουλφίδια φωσφόρου και ... ... Μεγάλο Εγκυκλοπαιδικό Λεξικό
Σύγχρονη Εγκυκλοπαίδεια
Σουλφίδια - ΣΟΥΛΦΙΔΕΣ, ανόργανα σουλφίδια ενώσεων θείου με μέταλλα και μερικά μη μέταλλα. Περιλαμβάνονται σε θειούχα ορυκτά. που χρησιμοποιούνται ως φωσφόροι (για παράδειγμα, CdS, ZnS). Θειούχο μολυβδαίνιο, στερεά λιπαντικά τιτανίου. Σουλφίδια φωσφόρου ... ... Εικονογραφημένο εγκυκλοπαιδικό λεξικό
- (νέα ευρ., από το λατινικό θείο θείου). Ενώσεις κάποιου σώματος με θείο, που αντιστοιχούν σε οξείδια ή οξέα. Λεξικό των ξένων λέξεων που περιλαμβάνονται στη ρωσική γλώσσα. Chudinov, ΑΝ, 1910. SULFIDES Novolatinsk., From Lat. θείο, θείο. Σύνδεση ... ... Λεξικό ξένων λέξεων της ρωσικής γλώσσας
1. Φυσικές ενώσεις θείου από μέταλλα και μερικά μη-μέταλλα. Στο χημικό σχέση θεωρούνται ως άλατα υδροθείου H2S. Ορισμένα στοιχεία σχηματίζουν πολυσουλφίδια με θείο, τα οποία είναι άλατα του πολυσουλφορούχου οξέος H2Sx. Το κύριο ... Γεωλογική εγκυκλοπαίδεια
Σουλφίδια - - ενώσεις θείου με μέταλλα και μερικά μη μέταλλα, άλατα μετάλλων σουλφιδίων του υδρόθειου οξέος H2S. [Λεξικό ορολογίας για σκυρόδεμα και οπλισμένο σκυρόδεμα. FSUE "SIC" Κατασκευή "NIIZHB και σταθμός A. A. Gvozdeva του μετρό, Μόσχα, 2007. 110 σελίδες] ... ... Εγκυκλοπαίδεια όρων, ορισμών και επεξηγήσεων δομικών υλικών
SULPHES, s, u σουλφίδιο, α, σύζυγος (spec.) Χημικές ενώσεις θείου με μέταλλα και ορισμένα μη μέταλλα. Οργανικά με Φυσικά s. | adj θειούχο, oh, oh. Λεξικό Ozhegova. S.I. Ozhegov, Ν.Υυ. Shvedov. 1949 1992 ... Λεξικό Ozhegova
Τα σουλφίδια, R2S (R αρωματική ρίζα), επιτυγχάνονται εύκολα με την προσθήκη στάγδην ενός διαλύματος διαζωικών αλάτων στα 60 ... Εγκυκλοπαίδεια Brockhaus και Efron
ΣΟΥΛΦΙΔΕΣ - (1) στην ανόργανη χημεία, τέτοιες ενώσεις στοιχείων με θείο, στις οποίες τα άτομα θείου έχουν κατάσταση οξείδωσης 2. Σε χημικές. σχέση θεωρούνται ως άλατα ασθενούς οξέος υδρόθειου (υδατικό διάλυμα H2S). Πολλοί S. είναι φυσικοί ... ... Μεγάλη Πολυτεχνική Εγκυκλοπαίδεια
Ω; mn (μονάδες θειούχου, και m.). [από lat. θείο θείο] Chem. Οι ενώσεις του θείου με μέταλλα και μερικά μη μέταλλα. C. τιτάνιο. Οργανικά με Φυσικά s. (τάξη ορυκτών). ◁ Σουλφίδιο, th, oh. Με μικτά μείγματα. Από μεταλλεύματα μεταλλεύματος. * * * σουλφίδια των ενώσεων θείου ... Εγκυκλοπαιδικό λεξικό
- (από το θειικό θείο θείου) μια κλάση χημικών ενώσεων που είναι μεταλλικές ενώσεις (καθώς και ένας αριθμός μη-μετάλλων Β, Si, P, As) με θείο (S), όπου έχει μια κατάσταση οξείδωσης -2. Μπορούν να θεωρηθούν ως άλατα υδρόθειου ... ... Wikipedia
Βιβλία
- Καταθέσεις ουρανίου του τύπου διαφωνίας στο Phanerozoic, Andrei Borisovich Khalezov. Τα χαρακτηριστικά των κοιτασμάτων ουρανίου στις δομές του ποταμού παλαιο-κοιλάδας στις επιφάνειες των διαρθρωτικών και στρωματογραφικών διαφωνιών θεωρούνται στο παράδειγμα τριών περιοχών της περιοχής της Ουράλ με διαφορετικές ...
Θείο - Το στοιχείο της 3ης περιόδου και η ομάδα VIA του περιοδικού συστήματος, αριθμός σειράς 16, αναφέρεται χαλκογόνα. Ο ηλεκτρονικός τύπος του ατόμου [10 Ne] 3s 2 3p 4, χαρακτηριστικές καταστάσεις οξείδωσης 0, -II, + IV και + VI, η κατάσταση S VI θεωρείται σταθερή.
Στάδιο οξείδωσης θείου:
Η ηλεκτρεναρτικότητα του θείου είναι 2,60, χαρακτηρίζεται από μη μεταλλικές ιδιότητες. Στις ενώσεις υδρογόνου και οξυγόνου περιέχεται σε διάφορα ανιόντα, σχηματίζει οξυγονούχες οξέα και τα άλατά τους, δυαδικές ενώσεις.
Στη φύση - δέκατη πέμπτη χημικό στοιχείο επικράτησης (το έβδομο μεταξύ των μη-μετάλλων). Βρίσκεται στην ελεύθερη (φυσική) και σχετική μορφή. Ένα ζωτικό στοιχείο για τους υψηλότερους οργανισμούς.
Sulphur S. Απλή ουσία. Κρυσταλλικό κίτρινο (α-ρομβικό και β-μονοκλινικό,
σε 95,5 ° C) ή άμορφο (πλαστικό). Στις θέσεις πλέγματος υπάρχουν μόρια S8 (μη επίπεδες κύκλοι τύπου "κορώνας"), το άμορφο θείο αποτελείται από αλυσίδες S n. Η ουσία χαμηλής τήξης, το ιξώδες του υγρού διέρχεται από ένα μέγιστο στους 200 ° C (το κενό των μορίων S8, η συνένωση των αλυσίδων S n) Σε ένα ζεύγος - μόρια S8, S6, S4, S2. Στους 1500 ° C, εμφανίζεται μονοατομικό θείο (σε χημικές εξισώσεις για απλότητα, κάθε θείο αντιπροσωπεύεται ως S).
Το θείο δεν διαλύεται στο νερό και υπό κανονικές συνθήκες δεν αντιδρά με αυτό, είναι καλά διαλυτό στο διθειάνθρακα CS 2.
Το θείο, ιδιαίτερα σε σκόνη, έχει υψηλή δραστικότητα όταν θερμαίνεται. Αντιδρά ως οξειδωτικό μέσο με μέταλλα και μη μέταλλα:
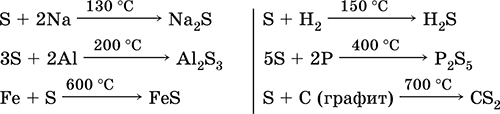
τι γίνεται αναγωγικό παράγοντα - με φθόριο, οξυγόνο και οξέα (όταν βράζει):
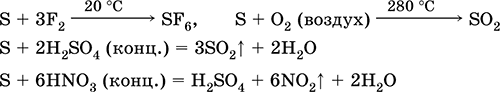
Το θείο υφίσταται καταστροφή σε αλκαλικά διαλύματα:
3S 0 + 6ΚΟΗ (συμπ.) = 2Κ2S-II + K2SVV03 + 3Η2Ο
Σε υψηλές θερμοκρασίες (400 ° C) το θείο μετατοπίζει το ιώδιο από ιωδιούχο υδρογόνο:
S + 2ΗI (g) = Ι2 + Η2S,
αλλά στη λύση η αντίδραση πηγαίνει προς την αντίθετη κατεύθυνση:
I 2 + H 2 S (ρ) = 2 HI + S ↓
Να πάρει: στο βιομηχανία (που χρησιμοποιεί υδρατμούς), που απελευθερώνεται κατά την αποθείωση των προϊόντων αεριοποίησης άνθρακα.
Το θείο χρησιμοποιείται για τη σύνθεση χρωμάτων διθειούχου άνθρακα, θειικού οξέος, θειούχων (vat), στη βουλκανισμό του καουτσούκ, ως μέσο προστασίας φυτών από ωίδιο και για τη θεραπεία δερματικών παθήσεων.
Υδροθειικό H2S Οξύ ελεύθερο οξύ. Άχρωμο αέριο με ασφυκτική οσμή, βαρύτερο από τον αέρα. Το μόριο έχει τη δομή ενός διπλού-ατελούς τετραέδρου [:: S (H) 2]
(sp 3 - υβριδισμός, η γωνία υποδοχής H - S - H απέχει πολύ από τετραεδρική). Ασταθής όταν θερμανθεί πάνω από 400 ° C. Είναι ελαφρώς διαλυτό στο νερό (2,6 l / 1 l H2O στους 20 ° C), ένα κορεσμένο διάλυμα είναι δεκαμοριακό (0,1 Μ, "νερό υδρόθειου"). Ένα πολύ ασθενές οξύ σε διάλυμα πρακτικά δεν διασπάται στο δεύτερο στάδιο σε S2-ιόντα (η μέγιστη συγκέντρωση S 2-равна είναι 1 10-13 mol / l). Όταν στέκεται στον αέρα, το διάλυμα γίνεται θολό (αναστολέας - σακχαρόζη). Εξουδετερώνεται με αλκάλια, όχι εντελώς - με ένυδρη αμμωνία. Ισχυρό αναγωγικό μέσο. Εισέρχεται σε αντιδράσεις ανταλλαγής ιόντων. Σουλφιδικός παράγοντας, κατακρημνίζεται από ένα διάλυμα διαφορετικά χρωματισμένων σουλφιδίων με πολύ χαμηλή διαλυτότητα.
Ποιοτικές αντιδράσεις - καθίζηση σουλφιδίων, καθώς και ατελή καύση H2S με σχηματισμό μιας κίτρινης απόθεσης θείου σε ένα ψυχρό αντικείμενο που εισάγεται στη φλόγα (σπάτουλα από πορσελάνη). Ένα υποπροϊόν πετρελαίου ραφιναρίσματος, φυσικό αέριο και φούρνο οπτανθρακοποίησης.
Χρησιμοποιείται στην παραγωγή θειούχων, ανόργανων και οργανικών ενώσεων που περιέχουν θείο ως αναλυτικό αντιδραστήριο. Εξαιρετικά δηλητηριώδες. Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
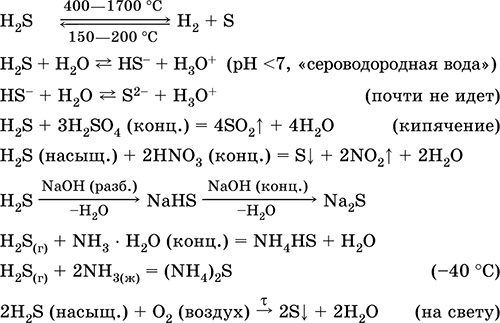

Να πάρει: στο βιομηχανία - άμεση σύνθεση:
Η2 + S = Η2S(150-200 ° C)
ή με θέρμανση του θείου με παραφίνη.
στο εργαστήρια - εκτόπιση σουλφιδίων με ισχυρά οξέα
FeS + 2ΗCl (συμπ.) = FeCl2 + Η2S
ή πλήρη υδρόλυση δυαδικών ενώσεων:
Al2S3 + 6H2O = 2Al (OH) 3 ↓ + 3 Η2S
Νάτριο θειούχο Na2S Άλας χωρίς οξυγόνο. Λευκό, πολύ υγροσκοπικό. Λιώνει χωρίς αποσύνθεση, θερμικά σταθερό. Είναι καλά διαλυτό στο νερό, υδρολυμένο με ανιόν, δημιουργεί ένα πολύ αλκαλικό μέσο σε διάλυμα. Όταν στέκεται στον αέρα, το διάλυμα καθίσταται θολό (κολλοειδές θείο) και μετατρέπεται σε κίτρινο (βαφή πολυσουλφιδίου). Τυπικός αναγωγικός παράγοντας. Προσδίδει θείο. Εισέρχεται σε αντιδράσεις ανταλλαγής ιόντων.
Ποιοτικές αντιδράσεις επί του ιόντος S 2 - εναπόθεση διαφόρων χρωματισμένων μεταλλικών σουλφιδίων, των οποίων τα MnS, FeS, ZnS αποσυντίθενται σε ΗΟ.
Χρησιμοποιείται στην παραγωγή χρωμάτων θείου και κυτταρίνης, για την απομάκρυνση των τριχών από δέρματα κατά τη δέψη δερμάτων, ως αντιδραστήριο στην αναλυτική χημεία.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
Na2S + 2ΗCl (αποσ.) = 2NaCl + H2S
Na2S + 3Η2SΟ4 (πυκνό) = SO2 + S + 2Η2Ο + 2ΝaHSΟ4 (έως 50 ° C)
Na2S + 4HNO3 (συμπ.) = 2ΝΟ + S ↓ + 2Η2Ο + 2ΝaΝΟ3 (60 ° C)
Na2S + H2S (sat) = 2NaHS
Na2S (t) + 202 = Na2S04 (πάνω από 400 ° C)
Na2S + 4H2O2 (συμπ.) = Na2S04 + 4H2O
S2 + M2 + = MnS (το σώμα) ↓; FeS (μαύρο) ↓; ZnS (λευκό) ↓
S2 + 2Ag + = Ag2S (μαύρο) ↓
S2 + M2 + = CdS (κίτρινο) ↓; PbS, CuS, HgS (μαύρο) ↓
3S 2 + 2Bi 3+ = Bi 2 S 3 (corr. - μαύρο) ↓
3S 2 + 6Η2Ο + 2Μ3 + = 3Η2S + 2Μ (ΟΗ) 3 ↓ (Μ = ΑΙ, Cr)
Να πάρει στο βιομηχανία - φρύξη του ορυκτού mirabilite Na2S0410H2O παρουσία μειωτικών παραγόντων:
Na2S04 + 4H2 = Na2S + 4Η2Ο (500 ° C, catFe203)
Na2S04 + 4C (οπτάνθρακας) = Na2S + 4CO (800-1000 ° C)
Na2S04 + 4CO = Na2S + 4CO2 (600-700 ° C)
Σουλφίδιο αργιλίου Al 2 S 3. Άλας χωρίς οξυγόνο. Λευκό, ο δεσμός Al - S είναι κατά κύριο λόγο ομοιοπολικό. Λιώνει χωρίς αποσύνθεση υπό υπερβολική πίεση Ν2, είναι εύκολα εξαγνισμένο. Οξειδώνεται στον αέρα όταν φλεγεί. Πλήρως υδρολυμένο με νερό, δεν καθιζάνει από το διάλυμα. Αποσυντίθεται με ισχυρά οξέα. Χρησιμοποιείται ως στερεή πηγή καθαρού υδρόθειου. Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
Al2S3 + 6H2O = 2Al (OH) 3 ↓ + 3Η2S (καθαρό)
ΑΙ2δ3 + 6ΗΟΙ (αποσ.) = 2AlCl3 + 3Η2S
Al2S3 + 24HNO3 (συμπ.) = Al2 (SO4) 3 + 24NO2 + 12H2O (100 ° C)
2Al2S3 + 9O2 (αέρας) = 2Al2O3 + 6S02 (700-800 ° C)
Να πάρει: αλληλεπίδραση αλουμινίου με τηγμένο θείο απουσία οξυγόνου και υγρασίας:
2Al + 3S = AL 2 S 3(150-200 ° C)
Σίδηρο (II) σουλφίδιο FeS. Άλας χωρίς οξυγόνο. Μαύρο και γκρι με μια πράσινη απόχρωση, πυρίμαχο, αποσυντίθεται όταν θερμαίνεται σε κενό. Στην υγρή κατάσταση είναι ευαίσθητο στο οξυγόνο στον αέρα. Αδιάλυτο στο νερό. Δεν καθιζάνει κατά τον κορεσμό των διαλυμάτων αλάτων σιδήρου (II) με υδρόθειο. Αποσυντίθεται με οξέα. Χρησιμοποιείται ως πρώτη ύλη στην παραγωγή σιδήρου, μια σταθερή πηγή υδροθείου.
Η ένωση της σύνθεσης σιδήρου (III) του Fe2S3 δεν είναι γνωστή (δεν έχει ληφθεί).
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
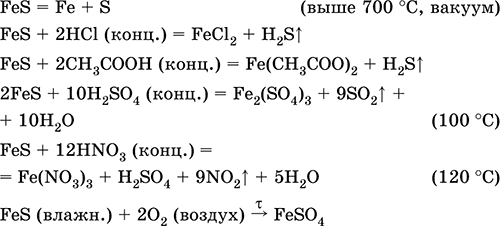
Λήψη:
Fe + S = Φες (600 ° C)
Fe2O3 + Η2 + 2Η2S = 9 Φες + 3Η20 (700-1000 ° C)
FeCl2 + 2NH4 HS (g) = Φες ↓ + 2ΝΗ4Cl + Η2S
Σίδερο δισουλφίδιο FeS 2. Δυαδική σύνδεση. Έχει τη ιοντική δομή Fe2 + (-S-S-) 2-. Σκούρο κίτρινο, θερμικά σταθερό, αποσυντίθεται κατά την ανάφλεξη. Αδιάλυτο στο νερό, δεν αντιδρά με αραιωμένα οξέα, αλκάλια. Αποικοδομείται από όξινους οξειδωτικούς παράγοντες, ψημένους στον αέρα. Χρησιμοποιείται ως πρώτη ύλη στην παραγωγή σιδήρου, θείου και θειικού οξέος, καταλύτη στην οργανική σύνθεση. Στη φύση - μεταλλεύματα ορυκτών πυρίτη και μαρκασίτης.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
FeS2 = FeS + S (πάνω από 1170 ° C, κενό)
2FeS 2 + 14H2SO4 (πυκνό, βουνό) = Fe2 (SO4) 3 + 15SO2 + 14H2O
FeS2 + 18HNO3 (συμπ.) = Fe (ΝΟ3) 3 + 2Η2SΟ4 + 15ΝΟ2 + 7Η2Ο
4FeS 2 + 11Ο 2 (αέρας) = 8SO2 + 2Fe2O3 (800 ° C, φρύξη)
Υδροσουλφίδιο αμμωνίου NH4 HS. Άλας οξέος χωρίς οξυγόνο. Λευκό, λιωμένο υπό πίεση. Εξαιρετικά πτητικές, θερμικά ασταθείς. Οξειδώνει στον αέρα. Είναι καλά διαλυτό στο νερό, υδρολυμένο από κατιόν και ανιόν (επικρατεί), δημιουργεί ένα αλκαλικό περιβάλλον. Το διάλυμα γίνεται κίτρινο στον αέρα. Αποικοδομείται από οξέα, σε κορεσμένο διάλυμα προσθέτει θείο. Τα αλκάλεα δεν εξουδετερώνονται, το μεσαίο άλας (NH4) 2S δεν υπάρχει στη λύση (για συνθήκες απόκτησης του μεσαίου αλατιού, βλέπε τίτλο "H 2 S"). Χρησιμοποιείται ως συστατικό των κατασκευαστών φωτογραφιών, ως αναλυτικό αντιδραστήριο (κατακρημνιστής θειούχων).
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
NH4 HS = NH3 + H2S (πάνω από 20 ° C)
NH4 HS + HCl (αποσ.) = ΝΗ4ΟΙ + Η2S
NH4 HS + 3ΗΝΟ3 (συμπ.) = S ↓ + 2ΝΟ2 + ΝΗ4ΝΟ3 + 2Η2Ο
2ΝΗ4 HS (κεκορεσμένο Η2S) + 2CuS04 = (NH4) 2S04 + H2S04 + 2CuS ↓
Να πάρει: κορεσμός συμπυκνωμένου διαλύματος NH3 με υδρόθειο:
NH3H2O (συμπ.) + Η2S (g) = NH4 HS + Η2Ο
Στην αναλυτική χημεία, ένα διάλυμα που περιέχει ίσες ποσότητες NH4 HS και NH3H2 θεωρείται συμβατικά ως ένα διάλυμα (ΝΗ4) 2S και ο μέσος τύπος άλατος χρησιμοποιείται στην επισήμανση των εξισώσεων αντίδρασης, αν και το σουλφίδιο του αμμωνίου υδρολύεται πλήρως σε νερό σε NH4 HS και ΝΗ 3 Η2Ο.
Διοξείδιο του θείου. Θειώδη
Διοξείδιο του θείου SO 2. Οξείδιο οξέος. Άχρωμο αέριο με έντονη οσμή. Το μόριο έχει τη δομή ενός ατελούς τριγώνου [: S (O) 2] (sp 2 - υβριδισμός), περιέχει σ, π - δεσμούς S = O. Εύκολα υγροποιημένο, θερμικά σταθερό. Είναι διαλυτό σε νερό (~ 40 l / 1 l H2O στους 20 ° C). Δημιουργεί ένα πολυένυδρο με τις ιδιότητες ενός αδύναμου οξέος, τα προϊόντα των διαχωριστικών ιόντων HSO 3 και SO 3 2-. Ion HSO 3 - έχει δύο ταυτομερείς μορφές - συμμετρική (μη όξινο) με τη δομή του τετραεδριού (sp 3 - υβριδοποίηση), η οποία κυριαρχεί στο μείγμα, και ασύμμετρη (όξινο) με τη δομή ενός ατελούς τετραέδρου [: S (O) 2 (OH)] (sp3 - υβριδοποίηση). Το ιόν SO3 2- είναι επίσης τετραεδρικό [: S (O) 3].
Αντιδρά με αλκάλια, ένυδρη αμμωνία. Τυπικός αναγωγικός παράγοντας, ασθενής οξειδωτικός παράγοντας.
Ποιοτική αντίδραση - αποχρωματισμός του κίτρινου-καφέ "νερού ιωδίου". Ενδιάμεση για την παραγωγή θειωδών και θειικού οξέος.
Χρησιμοποιείται για το λεύκανση μαλλιού, μετάξι και άχυρο, συντήρηση και αποθήκευση φρούτων, ως απολυμαντικό, αντιοξειδωτικό, ψυκτικό. Δηλητηριώδης.
Η ένωση H2S03 (θειώδες οξύ) δεν είναι γνωστή (δεν υπάρχει).
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
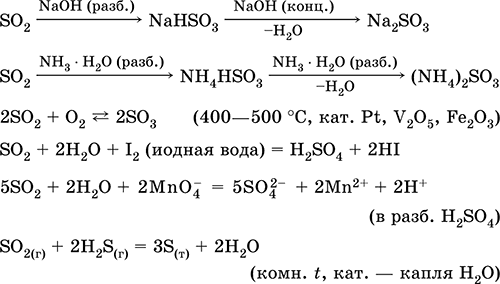
Διαλυτοποίηση σε νερό και όξινες ιδιότητες:
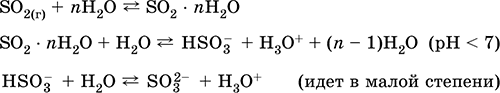
Να πάρει: στη βιομηχανία - καύση θείου σε αέρα εμπλουτισμένο με οξυγόνο και, σε μικρότερο βαθμό, φρύξη θειούχων μεταλλευμάτων (αέριο που συνδέεται με SO 2 κατά τη φρύξη του πυρίτη):
S + O2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, ψήσιμο)
στο εργαστήριο - η μετατόπιση θειωδών με θειικό οξύ:
BaSO3 (t) + H2S04 (συμπ.) = BaS04 + S02 + Η2Ο
Θειώδες νάτριο Na2SO3. Αλατούχο Λευκό Όταν θερμαίνεται στον αέρα αποσυντίθεται χωρίς τήξη, τήκεται υπό υπερπίεση αργού. Στην υγρή κατάσταση και σε διάλυμα ευαίσθητο στο οξυγόνο στον αέρα. Είναι διαλυτό στο νερό, υδρολυμένο με ανιόν. Αποσυντίθεται με οξέα. Τυπικός αναγωγικός παράγοντας.
Ποιοτική αντίδραση επί του ιόντος SO3 2- - σχηματισμού λευκού ιζήματος θειώδους βαρίου, το οποίο μεταφέρεται στο διάλυμα με ισχυρά οξέα (HCl, HNO3).
Χρησιμοποιείται ως αντιδραστήριο στην αναλυτική χημεία, ένα συστατικό των φωτογραφικών λύσεων, ένα εξουδετερωτικό του χλωρίου στην λεύκανση των υφασμάτων.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
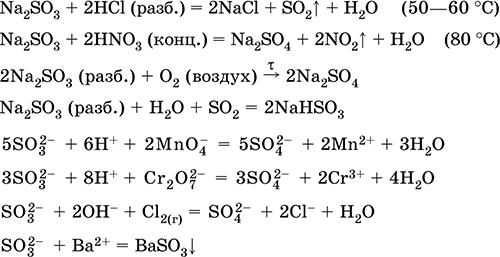
Λήψη:
Na2CO3 (συμπ.) + SO2 = Na2SO3 + C02
Θειικό οξύ. Θειικά
Θειικό οξύ H2S04. Οξικό οξύ. Άχρωμο υγρό, πολύ ιξώδες (λιπαρό), πολύ υγροσκοπικό. Το μόριο έχει μια παραμορφωμένη τετραεδρική δομή τετ (sp 3 gib υβριδισμός), περιέχει ομοιοπολικούς σ - δεσμούς S - OH και σπ - δεσμούς S = O. Το ιόν SO4 2- έχει σωστά τετραεδρική δομή. Έχει ευρύ φάσμα θερμοκρασιών της κατάστασης υγρού (~ 300 μοίρες). Όταν θερμαίνεται πάνω από 296 ° C αποσυντίθεται μερικώς. Αποστάζεται ως αζεοτροπικό μίγμα με νερό (το κλάσμα μάζας του οξέος είναι 98,3%, το σημείο βρασμού είναι 296-340 ° C), αποσυντίθεται πλήρως με ισχυρότερη θέρμανση. Απεριόριστη μίξη με νερό (με ισχυρή exo-Αποτελεσματικότητα). Ισχυρό οξύ σε διάλυμα, εξουδετερωμένο με αλκάλια και ένυδρη αμμωνία. Μετατρέπει μέταλλα σε θειικά άλατα (με περίσσεια συμπυκνωμένου οξέος υπό κανονικές συνθήκες, σχηματίζονται διαλυτά υδροθειώδη άλατα), αλλά τα μέταλλα Be, Bi, Co, Fe, Mg και Nb παθητικοποιούνται στο συμπυκνωμένο οξύ και δεν αντιδρούν μαζί του. Αντιδρά με βασικά οξείδια και υδροξείδια, αποσυνθέτει άλατα ασθενών οξέων. Αδύναμο οξειδωτικό σε αραιό διάλυμα (λόγω του HI), ισχυρό - σε συμπυκνωμένο διάλυμα (λόγω του S VI). Καλά διαλύει το SO 3 και αντιδρά με αυτό (σχηματίζεται ένα βαρύ ελαιώδες υγρό - oleum περιέχει H2S2O7).
Ποιοτική αντίδραση σε SO 4 2-ιόν - καθίζηση λευκού θειικού βαρίου BaS04 (το ίζημα δεν μετατρέπεται σε διάλυμα υδροχλωρικού και νιτρικού οξέος, σε αντίθεση με το λευκό ίζημα του BaSO 3).
Χρησιμοποιείται στην παραγωγή θειικών και άλλων θειικών ενώσεων, ανόργανων λιπασμάτων, εκρηκτικών, βαφών και φαρμάκων, σε οργανική σύνθεση, για το «άνοιγμα» (πρώτου σταδίου επεξεργασίας) βιομηχανικών μεταλλευμάτων και μεταλλευμάτων, για διύλιση πετρελαιοειδών, ηλεκτρόλυση νερού, ηλεκτρολύτη μπαταριών μολύβδου . Δηλητηριώδες, προκαλεί εγκαύματα στο δέρμα. Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
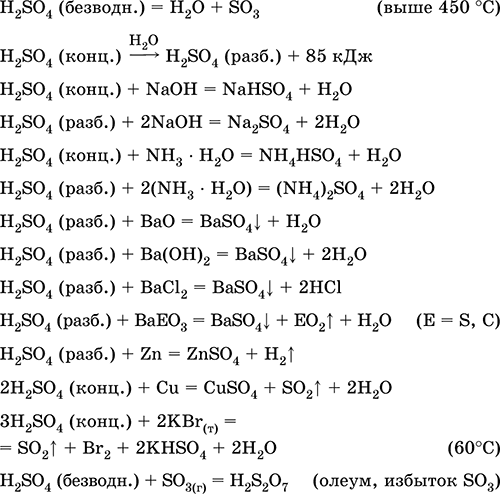
Να πάρει στο βιομηχανία:
α) σύνθεση SO 2 από θείο, θειούχα ορυκτά, υδρόθειο και θειικά ορυκτά:
S + O 2 (αέρα) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (αέρα) = 8 SO 2 + 2Fe2O3 (800 ° C, ψήσιμο)
2Η2S + 3O2 (g) = 2 SO 2 + 2Η2Ο (250-300 ° C)
CaSO4 + C (οπτάνθρακας) = CaO + SO 2 + CO (1300-1500 ° C)
β) τη μετατροπή του S02 σε S03 στην συσκευή επαφής:
γ) σύνθεση πυκνού και άνυδρου θειικού οξέος:
Η2Ο (Συλλ. H2S04) + SO3 = H2S04(πυκνό, άνυδρο)
(η απορρόφηση του SO 3 από καθαρό νερό με την παραγωγή H2S04 δεν πραγματοποιείται λόγω της ισχυρής θέρμανσης του μείγματος και της ανάστροφης αποσύνθεσης του H2S04, βλ. παραπάνω).
δ) σύνθεση oleum - μείγμα άνυδρου H2S04, H2S2O7 δισαρικού οξέος και περίσσειας S03. Το διαλυμένο SO 3 εξασφαλίζει το νερό χωρίς νερό (το H2S04 σχηματίζεται αμέσως όταν εισέρχεται νερό), γεγονός που του επιτρέπει να μεταφέρεται με ασφάλεια σε χαλύβδινες δεξαμενές.
Θειικό νάτριο Na2SO4. Αλατούχο Λευκό, υγροσκοπικό. Λιώνει και βράζει χωρίς αποσύνθεση. Σχηματίζει κρυσταλλικό ένυδρο (ορυκτό mirabilite) εύκολα να χάσει το νερό. τεχνικό όνομα Το αλάτι του Glauber. Είναι διαλυτό στο νερό, όχι υδρολυμένο. Αντιδρά με H2S04 (συμπ.), SO3. Αποκατασταθεί με υδρογόνο, οπτάνθρακα όταν θερμαίνεται. Εισέρχεται σε αντιδράσεις ανταλλαγής ιόντων.
Χρησιμοποιείται στην κατασκευή γυαλιού, κυτταρίνης και ορυκτών χρωμάτων, ως φάρμακο. Περιέχεται σε άλμη αλατούχων λιμνών, ιδίως στον Κόλπο Καρά-Μπογκάζζ-Γκολ της Κασπίας Θάλασσας.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
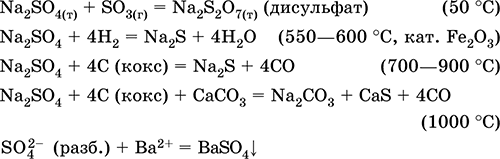
Υδροθειϊκό κάλιο KHSO4. Άλας οξίνου άλατος. Λευκό, υγροσκοπικό, αλλά δεν σχηματίζει κρυσταλλικά ένυδρα. Όταν θερμαίνεται λιώνει και αποσυντίθεται. Είναι καλά διαλυτό στο νερό, το ανιόν υφίσταται διαχωρισμό σε διάλυμα, το μέσο διαλύματος είναι έντονα οξύ. Εξουδετερώνεται με αλκάλια.
Χρησιμοποιείται ως συστατικό των ροών στη μεταλλουργία, ένα αναπόσπαστο μέρος των ορυκτών λιπασμάτων.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
2KHSO4 = K2S04 + H2S04 (έως 240 ° C)
2KHSO4 = Κ2S2Ο7 + Η2Ο (320-340 ° C)
KHSO4 (αρ.) + ΚΟΗ (συμπ.) = K2S04 + Η2Ο KHSO4 + KCl = K2S04 + HCl (450-700 ° C)
6KHSO4 + Μ2Ο3 = 2ΚΜ (SO4) 2 + 2Κ2SΟ4 + 3Η2Ο (350-500 ° C, Μ = ΑΙ, Cr)
Να πάρει: επεξεργασία θειικού καλίου στο κρύο (με περισσότερο από 60%) θειικό οξύ
K2SO4 + H2S04 (συμπ.) = 2 KHSO 4
Θειικό ασβέστιο CaSO4. Αλατούχο Λευκό, πολύ υγροσκοπικό, ανθεκτικό, αποσυντίθεται όταν φλεγεί. Το φυσικό CaSO 4 βρίσκεται υπό τη μορφή ενός πολύ κοινού ορυκτού γύψο CaSO4 2H2O. Στους 130 ° C, ο γύψος χάνει λίγο νερό και μπαίνει καμένο γύψο2CaS04H2O (τεχνική ονομασία αλάβαστρο). Ο πλήρως αφυδατωμένος (200 ° C) γύψος αποκρίνεται στο ορυκτό ανυδρίτηςCaSO4. Είναι ελαφρώς διαλυτό σε νερό (0,206 g / 100 g Η2Ο στους 20 ° C), η διαλυτότητα μειώνεται όταν θερμαίνεται. Αντιδρά με H2S04 (συμπ.). Ανάκτηση από τον οπτάνθρακα κατά τη σύντηξη. Καθορίζει το μεγαλύτερο μέρος της "σταθερής" σκληρότητας του γλυκού νερού (για περισσότερες λεπτομέρειες βλέπε 9.2).
Οι εξισώσεις των πιο σημαντικών αντιδράσεων: 100-128 ° C
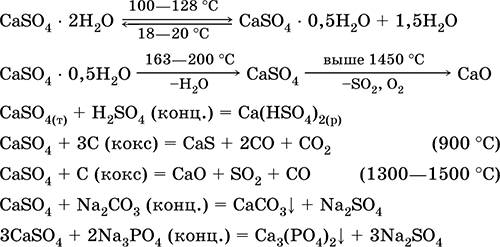
Χρησιμοποιείται ως πρώτη ύλη στην παραγωγή SO2, H2S04 και (NH4) 2S04, ως ροή στη μεταλλουργία, χαρτί πλήρωσης. Το συνδετικό κονίαμα που παρασκευάζεται από καμμένο γύψο "ρυθμίζει" ταχύτερα από το μείγμα με βάση Ca (OH) 2. Σκλήρυνση παρέχεται από τη σύνδεση του νερού, το σχηματισμό του γύψου με τη μορφή της πέτρας μάζας. Ο γύψινος γύψος χρησιμοποιείται για την κατασκευή γύψου, αρχιτεκτονικών και διακοσμητικών μορφών και προϊόντων, διαχωριστικών τοίχων και πινάκων και πέτρινων δαπέδων.
Θειικό κάλιο αλουμινίου KA1 (SO4) 2. Διπλό άλας οξολίου. Λευκό, υγροσκοπικό. Με ισχυρή θερμότητα αποσυντίθεται. Σχηματίζει κρυσταλλικό ένυδρο - αλουμίνας καλίου στυπτηρία. Μέτρια διαλυτή στο νερό, υδρολυμένη από κατιόν αργιλίου. Αντιδρά με αλκάλια, ένυδρη αμμωνία.
Χρησιμοποιείται ως μέσο πρόσφυσης στα βαφικά υφάσματα, το δέρμα μαυρίσματος, το πηκτικό στον καθαρισμό του γλυκού νερού, ένα συστατικό των συνθέσεων χάρτου και ένα εξωτερικό αιμοστατικό παράγοντα στην ιατρική και την κοσμετολογία. Αποτελείται από την συν-κρυστάλλωση των θειικών αλάτων αλουμινίου και καλίου.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
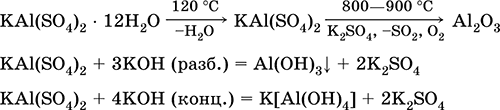
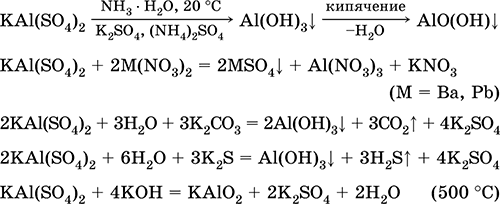
Θειικό χρωμικό (III) - κάλιο KCr (SO4) 2. Διπλό άλας οξολίου. Κόκκινο (ένυδρο σκούρο μωβ, τεχνική ονομασία στυπτηρία καλίου). Όταν θερμαίνεται αποσυντίθεται χωρίς τήξη. Είναι εύκολα διαλυτό στο νερό (το γκρίζο-μπλε χρώμα του διαλύματος αντιστοιχεί στο aquacomplex 3+), υδρολύεται από το κατιόν του χρωμίου (III). Αντιδρά με αλκάλια, ένυδρη αμμωνία. Αδύνατο οξειδωτικό και αναγωγικό μέσο. Εισέρχεται σε αντιδράσεις ανταλλαγής ιόντων.
Ποιοτικές αντιδράσεις σε Cr 3+ μείωση ιόντων σε Cr2 + ή οξείδωση σε κίτρινο CrO4 2-.
Χρησιμοποιείται ως παράγοντας μαυρίσματος για δέρμα, ένα βαμβάκι σε βαφές υφασμάτων, ένα αντιδραστήριο σε μια φωτογραφία. Δημιουργείται από την συν-κρυστάλλωση του χρωμίου (III) και των θειικών καλίου. Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
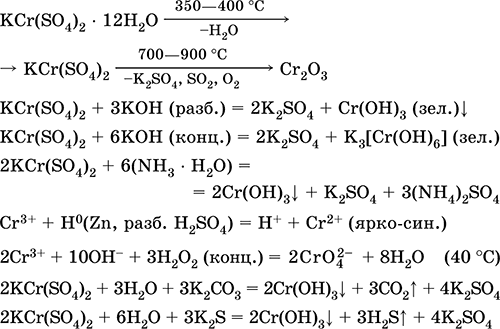
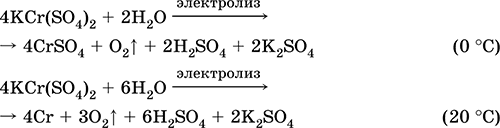
Θειικό μαγγάνιο (II) MnS04. Αλατούχο Λευκό, όταν πυρωθεί, λιώσει και αποσυντίθεται. Κρυσταλλικό ένυδρο MnSO 4 5H 2 O - κόκκινο - ροζ, τεχνική ονομασία μαγγάνιο vitriol. Είναι διαλυτό στο νερό, το ανοιχτό ροζ (σχεδόν άχρωμο) χρώμα του διαλύματος αντιστοιχεί στο aquacomplex 2+. υδρολύεται με κατιόν. Αντιδρά με αλκάλια, ένυδρη αμμωνία. Ο ασθενής αναγωγικός παράγοντας αντιδρά με τυπικούς (ισχυρούς) οξειδωτικούς παράγοντες.
Ποιοτικές αντιδράσεις στο ιόν Mn2 + - μια αγωγιμότητα με το ιόν MnO 4 και την εξαφάνιση του ιώδους χρώματος του τελευταίου, την οξείδωση του Mn2 + σε MnO 4 και την εμφάνιση ενός ιώδους χρώματος.
Χρησιμοποιείται για να ληφθούν Mn, MnO2 και άλλες ενώσεις μαγγανίου, ως μικροθρεπτικό και αναλυτικό αντιδραστήριο.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
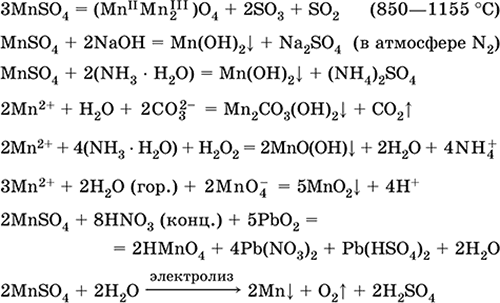
Λήψη:
2Mn02 + 2H2S04 (συμπ.) = 2 MnSO4 + 02 + 2Η2Ο (100 ° C)
Θειικό σίδηρο (II) FeSO4. Αλατούχο Λευκό (ένυδρο ανοιχτό πράσινο, τεχνική ονομασία σιδήρου vitriol),υγροσκοπικό. Διασπάται όταν θερμαίνεται. Είναι διαλυτό στο νερό, σε μικρό βαθμό υδρολύεται από κατιόν. Ταχέως οξειδώνονται σε διάλυμα με οξυγόνο στον αέρα (το διάλυμα γίνεται κίτρινο και γίνεται νεφελώδες). Αντιδρά με όξινους οξειδωτικούς παράγοντες, αλκάλια, ένυδρη αμμωνία. Τυπικός αναγωγικός παράγοντας.
Χρησιμοποιείται ως συστατικό ανόργανων χρωμάτων, ηλεκτρολυτών σε ηλεκτρολυτικές επιφάνειες, συντηρητικών ξύλου, μυκητοκτόνων, φαρμάκων κατά της αναιμίας. Στο εργαστήριο, πιο συχνά λαμβάνεται ως το διπλό άλας Fe (NH4) 2 (SO4) 2 6Η 2 O ( αλάτι mora) πιο ανθεκτικό στον αέρα.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
![]()
Λήψη:
Fe + H2S04 (αποσ.) = FeSO4+ Η2
FeCO3 + H2S04 (παρ.) = FeSO4 + C02 + Η2Ο
7.4. Μη-μέταλλα ομάδας VA
Άζωτο Αμμωνία
Άζωτο - ένα στοιχείο της 2ης περιόδου και η ομάδα VA του περιοδικού συστήματος, σειριακός αριθμός 7. Τύπος ατομικού ηλεκτρονίου [2 He] 2s 2 2p 3, χαρακτηριστικές καταστάσεις οξείδωσης 0, -III, + III και + V, λιγότερο συχνά + II, + IV και άλλοι. Η κατάσταση N v θεωρείται σχετικά σταθερή.
Κλίμακα οξείδωσης αζώτου:
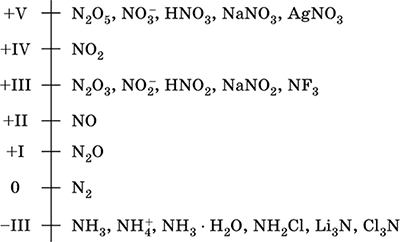
Το άζωτο έχει υψηλή ηλεκτραρνητικότητα (3,07), το τρίτο μετά από F και O. Εμφανίζει τυπικές μη μεταλλικές (όξινες) ιδιότητες. Δημιουργεί διάφορα οξυγονούχα οξέα, άλατα και δυαδικές ενώσεις, καθώς και το κατιόν αμμωνίου NH4 + και τα άλατά του.
Στη φύση - δέκατη έβδομη χημικό στοιχείο επικράτησης (ένατο μεταξύ των μη-μετάλλων). Ένα ζωτικό στοιχείο για όλους τους οργανισμούς.
Άζωτο Ν2. Απλή ουσία. Αποτελείται από μη πολικά μόρια με πολύ σταθερό σππ - δεσμό N ≡ N, γεγονός που εξηγεί τη χημική αδράνεια του αζώτου υπό κανονικές συνθήκες. Ένα άχρωμο, άοσμο αέριο που συμπυκνώνεται σε ένα άχρωμο υγρό (σε αντίθεση με το Ο 2).
Το κύριο συστατικό του αέρα: 78,09% κατ 'όγκο, 75,52% κατά βάρος. Από υγρό αέρα, το άζωτο βράζει πάνω από το οξυγόνο O 2. Είναι ελαφρώς διαλυτό στο νερό (15,4 ml / 1 l H2O στους 20 ° C), η διαλυτότητα του αζώτου είναι μικρότερη από εκείνη του οξυγόνου.
Σε θερμοκρασία δωματίου, το Ν2 αντιδρά μόνο με λίθιο (σε υγρή ατμόσφαιρα), σχηματίζοντας νιτρίδιο του λιθίου Li 3 N, συντίθενται νιτρίδια άλλων στοιχείων με ισχυρή θέρμανση:
Ν2 + 3Mg = Mg3N2 (800 ° C)
Σε ηλεκτρική εκκένωση, το Ν2 αντιδρά με φθόριο και σε πολύ μικρό βαθμό με οξυγόνο:
Μια αναστρέψιμη αντίδραση για την παραγωγή αμμωνίας λαμβάνει χώρα στους 500 ° C, υπό πίεση μέχρι 350 ατμόσφαιρες και αναγκαστικά με την παρουσία καταλύτη (Fe / F2O3 / FeO, στο εργαστήριο Pt):
Σύμφωνα με την αρχή Le Chatelier, πρέπει να σημειωθεί αύξηση της απόδοσης αμμωνίας με αύξηση της πίεσης και μείωση της θερμοκρασίας. Ωστόσο, ο ρυθμός αντίδρασης σε χαμηλές θερμοκρασίες είναι πολύ χαμηλός, οπότε η διαδικασία διεξάγεται στους 450-500 ° C, επιτυγχάνοντας απόδοση αμμωνίας 15%. Το N2 και το Η2 που δεν αντέδρασαν επιστρέφουν στον αντιδραστήρα και έτσι αυξάνουν τον βαθμό αντίδρασης.
Το άζωτο είναι χημικά παθητικό σε σχέση με τα οξέα και τα αλκάλια, δεν υποστηρίζει την καύση.
Να πάρει στο βιομηχανία - κλασματική απόσταξη υγρού αέρα ή απομάκρυνση του οξυγόνου από τον αέρα με χημικά μέσα, για παράδειγμα με την αντίδραση 2C (οπτάνθρακας) + 02 = 2CO με θέρμανση. Σε αυτές τις περιπτώσεις, παράγεται άζωτο, το οποίο περιέχει επίσης ακαθαρσίες ευγενών αερίων (κυρίως αργόν).
Στο εργαστήρια μικρές ποσότητες χημικώς καθαρού αζώτου μπορούν να ληφθούν με συνδυασμένη αντίδραση με μέτρια θέρμανση:
Ν-ΙΙΙΗ4ΝΙΙ2θ (t) = Ν2Ο + 2Η2Ο (60-70 ° C)
NH4Cl (ρ) + ΚΝΟ2 (ρ) = Ν2Ο + KCl + 2Η2Ο (100 ° C)
Χρησιμοποιείται για τη σύνθεση αμμωνίας, νιτρικού οξέος και άλλων προϊόντων που περιέχουν άζωτο, ως αδρανούς περιβάλλοντος για χημικές και μεταλλουργικές διεργασίες και αποθήκευση εύφλεκτων ουσιών.
Αμμωνία ΝΗ 3. Δυαδική ένωση, ο βαθμός οξείδωσης του αζώτου είναι - III. Άχρωμο αέριο με απότομη χαρακτηριστική οσμή. Το μόριο έχει τη δομή ενός ατελούς τετραέδρου [: Ν (Η) 3]] (sp3 gib-υβριδοποίηση). Η παρουσία αζώτου στο μόριο ΝΗ3 ενός ζεύγους δότη ηλεκτρονίων σε ένα 3-υβριδικό τροχιακό προκαλεί μια χαρακτηριστική αντίδραση προσθήκης του κατιόντος υδρογόνου με τον σχηματισμό ενός κατιόντος αμμωνίου NH4 +. Υγροποιείται κάτω από πίεση σε θερμοκρασία δωματίου. Στην υγρή κατάσταση συνδέεται λόγω δεσμών υδρογόνου. Θερμικά ασταθής. Είναι διαλυτό στο νερό (περισσότερο από 700 l / 1 l H2O στους 20 ° C). η αναλογία στο κορεσμένο διάλυμα είναι = 34% κατά μάζα και = 99% κατ 'όγκο, ρΗ = 11,8.
Πολύ αντιδραστικό, επιρρεπές σε αντιδράσεις προσθήκης. Εμφανίζεται σε οξυγόνο, αντιδρά με οξέα. Παρουσιάζει μείωση (λόγω Ν-ΙΙΙ) και οξείδωσης (λόγω των ιδιοτήτων ΗΙ). Αποξηραμένα μόνο με οξείδιο του ασβεστίου.
Ποιοτικές αντιδράσεις - ο σχηματισμός λευκού "καπνού" σε επαφή με αέριο HCl, μαυρίσματος του χαρτιού που έχει υγρανθεί με διάλυμα Hg2 (NO3) 2.
Ενδιάμεσο προϊόν στη σύνθεση των HNO 3 και των αλάτων αμμωνίου. Χρησιμοποιείται στην κατασκευή σόδας, αζωτούχων λιπασμάτων, βαφών, εκρηκτικών, η υγρή αμμωνία είναι ψυκτικό. Δηλητηριώδης.
Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
Να πάρει: στο εργαστήρια - εκτόπιση αμμωνίας από άλατα αμμωνίου όταν θερμαίνεται με ανθρακικό νάτριο (NaOH + CaO):
ή βρασμού ενός υδατικού διαλύματος αμμωνίας, ακολουθούμενη από ξήρανση του αερίου.
Στο βιομηχανία η αμμωνία συντίθεται από άζωτο (βλέπε) με υδρογόνο. Παράγεται από τη βιομηχανία είτε σε υγροποιημένη μορφή είτε σε μορφή συμπυκνωμένου υδατικού διαλύματος με την τεχνική ονομασία νερό αμμωνίας.
Ενυδατωμένη αμμωνία NH3H2O. Διαμοριακή ένωση. Λευκό, στο κρυσταλλικό πλέγμα είναι μόρια ΝΗ3 και Η2Ο, δεσμευμένα από έναν αδύναμο δεσμό υδρογόνου H3N ... HON. Παρουσιάζεται σε ένα υδατικό διάλυμα αμμωνίας, μια ασθενής βάση (τα προϊόντα της διάστασης - το κατιόν ΝΗ4 - και το ανιόν ΟΗ -). Το κατιόν αμμωνίου έχει τακτική π-τετραεδρική δομή (sp 3 - υβριδισμός). Θερμικά ασταθής, αποσυντίθεται εντελώς με βρασμό του διαλύματος. Εξουδετερωμένο από ισχυρά οξέα. Δείχνει ότι μειώνονται οι ιδιότητες (λόγω του Ν III) σε ένα συμπυκνωμένο διάλυμα. Εισέρχεται στην αντίδραση ανταλλαγής ιόντων και συμπλοκοποίησης.
Ποιοτική αντίδραση - ο σχηματισμός λευκού "καπνού" σε επαφή με αέριο HCl.
Χρησιμοποιείται για να δημιουργηθεί ένα ασθενές αλκαλικό μέσο σε διάλυμα, κατά τη διάρκεια της καθίζησης των αμφοτερικών υδροξειδίων.
Το διάλυμα 1Μ αμμωνίας περιέχει κυρίως ένυδρο NH3H2O και μόνο 0,4% ιόντα NH4 + και OH - (λόγω της διάστασης του ένυδρου). Συνεπώς, το ιοντικό "υδροξείδιο αμμωνίου ΝΗ4ΟΗ" πρακτικά δεν περιέχεται στο διάλυμα, δεν υπάρχει τέτοια ένωση στο στερεό ένυδρο άλας. Οι εξισώσεις των πιο σημαντικών αντιδράσεων:
NH3H2O (συμπ.) = ΝΗ3 + Η2Ο (βράζει με ΝαΟΗ)
NH3H2O + HCl (αποσ.) = ΝΗ4ΟΙ + Η2Ο
3 (NH3H2O) (πυκνό) + CrCl3 = Cr (OH) 3 + + NH3Cl
8 (NH3H2O) (συμπ.) + 3Βγ2 (ρ) = Ν2 + 6ΝΗ4Βγ + 8Η2Ο (40-50 ° C)
2 (ΝΗ3Η2Ο) (πυκνό) + 2ΚΜηΟ4 = Ν2 + 2ΜηΟ2 2 + 4Η2Ο + 2ΚΟΝ
4 (NH3H2O) (συμπ.) + Ag2O = 2ΟΗ + 3Η2Ο
4 (ΝΗ3Η2Ο) (πυκνό) + Cu (ΟΗ) 2 + (ΟΗ) 2 + 4Η2Ο
6 (ΝΗ3Η2Ο) (πυκνό) + NiCI2 = Cl2 + 6Η2Ο
Το αραιωμένο διάλυμα αμμωνίας (3-10% - χρόνος) καλείται συχνά υγρή αμμωνία (το όνομα εφευρέθηκε από τους αλχημιστές) και το συμπυκνωμένο διάλυμα (18,5-25%) νερό αμμωνίας (που παράγεται από τη βιομηχανία).
