सिलिकॉन की उच्च सांद्रता। तुम्हे पता है कैसै
प्रोसेसर? पिसोक? और आपके पास शब्द संघों के साथ क्या है? या शायद सिलिकॉन वैली?
जैसे कि वह नहीं था, आज हम सिलिकॉन के साथ चिपके हुए हैं, और यदि आपको यह जानने की आवश्यकता है कि सी क्या है और आप क्यों खाते हैं, तो मैं एक बिल्ली के लिए पूछता हूं।
प्रवेश
विशेष "नैनोमटेरियल्स" में मास्को विश्वविद्यालयों में से एक का छात्र होने के नाते, मैं आपको हमारे ग्रह के सबसे महत्वपूर्ण रासायनिक तत्वों के साथ, प्रिय पाठक जानना चाहता हूं। मैं लंबे समय से कुछ चुन रहा हूं, चारकोल या सिलिकॉन, और फिर भी मैंने खुद सी का उपयोग करने का फैसला किया है, ताकि किसी भी आधुनिक गैजेट का दिल खुद पर आधारित हो, ताकि आप इतना शानदार ढंग से कह सकें। मैं अपने विचारों को बेहद सरल और सुलभ बनाने की कोशिश करूँगा, इस सामग्री को लिखने के बाद, मैंने इसे मुख्य रूप से नौसिखियों पर सहेजा है, लेकिन अधिक से अधिक लोग इसे cicava से बाहर निकाल सकते हैं, इसलिए मैं यह कहना चाहूंगा कि लेख हितों के विस्तार के लिए विशेष रूप से लिखा गया था, स्को। तो चलिए शुरू करते हैं।
सिलिकियम
सिलिकॉन (लेट। सिलिकियम), सी, मेंडेलीव आवधिक प्रणाली के IV समूह का रासायनिक तत्व; परमाणु संख्या 14, परमाणु भार 28.086।
प्रकृति में, तत्व को तीन स्थिर समस्थानिकों द्वारा दर्शाया गया है: 28Si (92.27%), 29Si (4.68%) और 30Si (3.05%)।
मोटाई (एन.एस.) 2.33 ग्राम/सेमी?
गलनांक 1688 K

चूर्ण सी
ऐतिहासिक प्रमाण
सिलिकन की पहाड़ियाँ, विस्तृत भूमि, पाषाण युग के लोगों के रास्ते। पत्थर के हजारों स्प्रैट थे और पत्थर का पानी। Zastosuvannya spoluk सिलिकॉन, उनके प्रसंस्करण से जुड़ा हुआ है - एक गोदाम की तैयारी - लगभग 3000 ईसा पूर्व शुरू हुई। ई. (पुराना मिस्र). पहले घर में सिलिकॉन - ऑक्साइड SiO2 (सिलिका) का उपयोग किया जाता था। 18वीं शताब्दी में, सिलिका को एक साधारण शरीर के साथ इंजेक्ट किया गया और "भूमि" (जो इसके नाम पर प्रयोग किया जाता है) में ले जाया गया। Skladnіst स्थापित सिलिका के एक गोदाम में। आई. बर्जेलियस। उसी vpershe में, 1825 में, सिलिकॉन फ्लोराइड SiF4 से प्राथमिक सिलिकॉन को हटाकर, शेष धातु पोटेशियम की जगह। नए तत्व को "सिलिशियम" (अव्य। सिलेक्स - फ्लिंट) नाम दिया गया था। रूसी नाम vvіv G. I. 1834 आरओसी पर हेस।

ध्वनि ध्वनि के गोदाम में प्रकृति में विस्तार के सिलिकॉन चाप
प्रकृति में सिलिकॉन का विस्तार करना
पृथ्वी की पपड़ी में चौड़ाई के लिए, सिलिकॉन एक अन्य (खट्टा के बाद) तत्व है, स्थलमंडल में इसका औसत 29.5% (द्रव्यमान के पीछे) है। पृथ्वी की छाल, सिलिकॉन ग्रे, की वही प्राथमिक भूमिका है, जो प्राणी की सांसारिक दुनिया के चारकोल की तरह है। सिलिकॉन की भू-रसायन के लिए, यह महत्वपूर्ण है, विशेष रूप से, कि योगो और खट्टा के बीच की कड़ी महत्वपूर्ण है। लिथोस्फीयर के 12% के करीब खनिज क्वार्ट्ज और विभिन्न किस्मों के रूप में सिलिका SiO2 बन जाता है। लिथोस्फीयर का 75% विभिन्न सिलिकेट्स और एलुमिनोसिलिकेट्स (पोलोवा, अभ्रक, एम्फीबोल तोशो) से बना है। सिलिका द्वारा प्रतिस्थापित किए जा सकने वाले खनिजों की कुल संख्या 400 से अधिक है।
सिलिकॉन की भौतिक शक्ति
मुझे लगता है कि यह विशेष रूप से वार्टो नहीं है, बस इतना ही शारीरिक शक्तिमेरी मुफ्त पहुंच है, लेकिन मैं सबसे आम लोगों की सूची दूंगा।
क्वथनांक 2600 ° С
Dovgokhvilovyh ІCh-promenіv के लिए सिलिकॉन प्रोज़ोरियम
ढांकता हुआ पैठ 11.7
मोह्स सिलिकॉन कठोरता 7.0
मैं कहना चाहता हूं कि सिलिकॉन प्रवृत्त सामग्री, स्मारक प्लास्टिक विरूपण 800 डिग्री सेल्सियस से अधिक तापमान पर शुरू होता है।
सिलिकॉन एक कंडक्टर है, वही शराब हम बहुत सारे ज़स्तोसुवन्न्या को जानते हैं। सिलिकॉन की विद्युत शक्ति घर में रह सकती है।
रासायनिक शक्ति।
यह यहाँ समृद्ध है, यह आश्चर्यजनक है, कोई कह सकता है, लेकिन मैं सबसे प्रसिद्ध पर ठोकर खा रहा हूँ। सी (कार्बन के समान) की अलमारियों में 4-वैलेंट।
सिलिकॉन zavdyak की सतह पर, ऑक्साइड गलाने ऊंचे तापमान पर हवा के लिए स्थिर है। एसिड में, यह 400 डिग्री सेल्सियस पर ऑक्सीकरण करता है, सिलिकॉन ऑक्साइड (IV) SiO2 को भंग कर देता है।
सिलिकॉन एसिड के लिए प्रतिरोधी है और नाइट्रिक और हाइड्रोफ्लोरिक एसिड के साथ मिश्रित होने की संभावना कम है, पानी को देखने से गर्म घास के मैदानों में आसानी से पहचाना जाता है।
सिलिकॉन अम्लीय सिलेन के 2 समूह बनाते हैं - सिलोक्सेन और सिलोक्सेनियम। सिलिकॉन 1000 डिग्री सेल्सियस से ऊपर के तापमान पर नाइट्रोजन के साथ प्रतिक्रिया करता है। यह रासायनिक उद्योग के साथ-साथ अग्निशामक यंत्रों के उत्पादन के लिए एक मूल्यवान सामग्री है। उच्च कठोरता, साथ ही थर्मल और रासायनिक प्रतिरोध, सिलिकॉन कार्बाइड (सिलिकॉन कार्बाइड SiC) और बोरॉन (SiB3, SiB6, SiB12) फर्श के साथ व्यवहार किया जाता है।
ओट्रीमन्या सिलिकॉन
मुझे लगता है कि tse naytsіkavіsha भाग, यहाँ रिपोर्ट है।
परती प्रकार की मान्यता विभाजित है:
1.
सिलिकॉन इलेक्ट्रॉनिक शक्ति(टी.जेड. इलेक्ट्रॉनिक सिलिकॉन"") - दीवार के पीछे 99.999% से अधिक मिश्रित सिलिकॉन से सबसे बड़ा सिलिकॉन सिलिकॉन, सिलिकॉन इलेक्ट्रॉनिक क्षमता का विद्युत समर्थन लगभग 0.001 से 150 ओम सेमी के अंतराल में बदला जा सकता है, लेकिन यदि समर्थन का मूल्य दिया गया है घर में, यह क्रिस्टल हाउस में पूरी तरह से सुरक्षित सीढ़ी है, इलेक्ट्रिक ओपिर की नर्सरी के कार्यों की देखभाल करना चाहता है, रिंग आउट, अस्वीकार्य।
2.
सिलिकॉन सोनी गुणवत्ता(t.z. "sonyachny Silicon") - 99.99% प्रति फाइबर से अधिक मिश्रित सिलिकॉन से सिलिकॉन, जिसका उपयोग फोटोइलेक्ट्रिक कन्वर्टिंग डिवाइस (सोनिक बैटरी) के उत्पादन के लिए किया जाता है।

3.
तकनीकी सिलिकॉन- शुद्ध से कार्बोथर्मिक नवीकरण की विधि द्वारा ली गई सिलिकॉन पॉलीक्रिस्टलाइन संरचना के ब्लॉक क्वार्ट्ज चीख़; 98% सिलिकॉन के साथ कवर, मुख्य घर कोयला है, इसे उच्च मात्रा में प्रकाश तत्वों - बोरान, फास्फोरस, एल्यूमीनियम के साथ प्रसारित किया जाता है; मुख्य रूप से पॉलीक्रिस्टलाइन सिलिकॉन के कब्जे के लिए विकराल रूप से उपयोग किया जाता है।
तकनीकी शुद्धता (95-98%) के सिलिकॉन में ग्रेफाइट इलेक्ट्रोड के बीच प्रेरित सिलिका SiO2 के विद्युत विस्फोट होते हैं। शुद्ध और विशेष रूप से शुद्ध सिलिकॉन प्राप्त करने की nap_v_dnikovoї tehnіko razrobleno विधि के विकास के साथ लिंक पर। शुद्ध vih_dnih स्पोलुक सिलिकॉन के आगे के संश्लेषण के लिए, z yakikh vityagyat silіkі vіdnovlennya vіdnovlennya аbo termіchnogo razkladannya।
पॉलीक्रिस्टलाइन सिलिकॉन ("पॉलीसिलिकॉन") - सिलिकॉन का सबसे शुद्ध रूप, जो व्यावसायिक रूप से व्यवहार्य है, - एक उत्पाद जिसका उपयोग क्लोराइड और फ्लोराइड विधियों द्वारा तकनीकी सिलिकॉन के शुद्धिकरण के लिए किया जाता है और मोनो- और मल्टी-क्रिस्टलीय के उत्पादन के लिए विजयी होता है सिलिकॉन।
परंपरागत रूप से, पॉलीक्रिस्टलाइन सिलिकॉन को तकनीकी सिलिकॉन से हटा दिया जाता है, जिससे योग को साइलेन के नल (मोनोसिलेन, क्लोरोसिलेन, फ्लोरोसिलेन) में स्थानांतरित किया जा सकता है, जो साइलेन्स के एक आक्रामक तल के साथ होता है, जो परिवर्तित सिलने की सुधारित शुद्धि और धातु सिलिकॉन के लिए सिलने का नवीनीकरण होता है। .
शुद्ध सिलिकॉन कंडक्टर दो प्रकार से प्राप्त होते हैं: polycrystalline(जस्ता या पानी के साथ SiCl4 या SiHCl3 का सुदृढीकरण, SiI4 और SiH4 का थर्मल विस्तार) और monocrystalline(क्रूसिबल-फ्री ज़ोन पिघलने और पिघले हुए सिलिकॉन से एकल क्रिस्टल की "घुमावदार" - Czochralsky विधि)।

यहाँ आप सिलिकॉन को कंपन करने के लिए Czochralski विधि का उपयोग कर सकते हैं।
Czochralski विधि- क्रिस्टल स्कूल ऑफ क्रिस्टल क्रिस्टल (अबो क्लीख क्रिस्टल) के रोस्प्लाव के लिए खिखानिख वाइटागोवनी वोगोर विड विनो वेल ग्रेट गैस्टर्स की विरोशचुवन्न्या विधि।
ज़स्तोसुवन्न्या सिलिकॉन
विशेष रूप से मिश्रित सिलिकॉन का व्यापक रूप से विद्युत कंडक्टर (ट्रांजिस्टर, थर्मिस्टर्स, पावर वाइब्रेटर, थायरिस्टर्स; सोनी फोटोकल्स जो अंतरिक्ष यान में उपयोग किए जाते हैं, साथ ही साथ सभी प्रकार की चीजों) की तैयारी के लिए एक सामग्री के रूप में उपयोग किया जाता है।
1 से 9 माइक्रोन के आकार में लंबे बालों से बदलने के लिए सिलिकॉन प्रोसोरिया के टुकड़े, इसे इन्फ्रारेड ऑप्टिक्स में रखा जा सकता है।
सिलिकॉन अलग हो सकता है और zastosuvannya के सभी क्षेत्र, जो विस्तार कर रहे हैं। धातु विज्ञान में सी
vikoristovuetsya पिघली हुई धातुओं से खट्टापन (डीऑक्सीडेशन) हटाने के लिए।
सिलिकॉन गोदामहॉल और रंगीन धातुओं की बड़ी संख्या में मिश्र धातु।
जंग के प्रतिरोध को बढ़ाने के लिए ध्वनि सिलिकॉन मिश्र धातु, उनकी लिवर शक्ति में सुधार और यांत्रिक शक्ति में वृद्धि; अधिक zmistі सिलिकॉन के साथ प्रोटीन kryhkіst को विक्लिक कर सकता है।
सबसे महत्वपूर्ण मिश्र धातु, तांबा और एल्यूमीनियम मिश्र धातु हैं, जिनका उपयोग बेल्ट का बदला लेने के लिए किया जा सकता है।
सिलिका को ग्लास, सीमेंट, सिरेमिक, इलेक्ट्रिकल और अन्य औद्योगिक गैल्यूज़ द्वारा संसाधित किया जाता है।
एकल इलेक्ट्रॉनिक उपकरणों (उदाहरण के लिए, आपके कंप्यूटर का प्रोसेसर) और सिंगल-चिप माइक्रोक्रिस्किट के निर्माण के लिए सिलिकॉन की सफाई महत्वपूर्ण है।
शुद्ध सिलिकॉन, शुद्ध सिलिकॉन के लिए उपयोग किया जाता है, क्रिस्टलीय सिलिकॉन के रूप में धातुकर्म सिलिकॉन की शुद्धि सोनी ऊर्जा के लिए मुख्य कच्चा माल है।
सिंगल-क्रिस्टल सिलिकॉन - इलेक्ट्रॉनिक्स और सोनी पावर इंजीनियरिंग की क्रीम का उपयोग गैस लेज़रों के दर्पण बनाने के लिए किया जाता है।

सिलिकॉन की सफाई और योग का एक उत्पाद
शरीर में सिलिकॉन
शरीर में सिलिकॉन विभिन्न स्पोलुकों की आंखों में पाया जाता है, जो कठोर कंकाल भागों और ऊतकों की रोशनी में प्रमुख रैंक में भाग लेते हैं। सिलिकॉन में विशेष रूप से समृद्ध समुद्री शैवाल (उदाहरण के लिए, डायटोमेसियस शैवाल) और जीव (उदाहरण के लिए, सिलिकॉन-हॉर्न स्पंज, रेडिओलारिया) के डेक जमा कर सकते हैं, जो समुद्र के तल पर समुद्र के समय सिलिकॉन ऑक्साइड के जमाव से कठोर हो जाते हैं। (चतुर्थ)। ठंडे समुद्रों और झीलों में, बायोजेनिक खच्चर, सिलिकॉन से भरपूर, अधिक महत्वपूर्ण हैं, उष्णकटिबंधीय समुद्रों में - सिलिकॉन की कम सामग्री वाले वापिंग खच्चर। स्थलीय विकास के बीच में घास, सेज, ताड़ के पेड़ और हॉर्सटेल बहुत सारे सिलिकॉन जमा करते हैं। बैकबोन प्राणियों में, सिलिकॉन (IV) ऑक्साइड के बजाय, राख नदियों में 0.1-0.5%। क्षारीय में सिलिकॉन अभिव्यक्तियों की सबसे बड़ी संख्या में खुश कपड़ा, निरकाह, पिद्द्लंकोवी तिजोरी। पूरक आहार में, लोगों के पास 1 ग्राम तक सिलिकॉन होता है। हवा में सिलिकॉन (IV) ऑक्साइड के अधिक मात्रा में सेवन से व्यक्ति की लीजेनिया में इसका सेवन होता है जो बीमारी का कारण बनता है - सिलिकोसिस।
विस्नोवोक
खैर, हर चीज से, अगर आपने अंत तक पढ़ा है और थोड़ा सा प्रवेश किया है, तो आप सफलता के थोड़े करीब हैं। मैं spodіvayus लिख रहा हूँ, मैं कुछ नहीं के लिए लिख रहा हूँ और pіst vouchsafed to hoch komu। सम्मान के लिए।
सिलिकॉन। (सिलिशियम), सी - रसायन। तत्वों की आवधिक प्रणाली के समूह का तत्व IV; पर। एन। 14, पर. एम. 28.086. क्रिस्टलीय सिलिकॉन-डार्क ग्रे स्पीच एक रेज़िनस शीन के साथ। ज्यादातर मामलों में, ऑक्सीकरण की डिग्री का पता चलता है - 4, +2 और +4। प्राकृतिक सिलिकॉन स्थिर आइसोटोप 28Si (92.28%), 29Si (4.67%) और 30Si (3.05%) से बना है। 4.5 सेकंड, 2.62 साल और 700 साल के रिवर्स क्षय की अवधि के साथ रेडियोधर्मी आइसोटोप 27Si, 31Si और 32Si की वापसी। पहली बार 1811 फ्रेंच में देखा गया। रसायनज्ञ और भौतिक विज्ञानी जे. एल. गे-लुसाक और फ्रेंच। केमिस्ट एल जे तेनार, लेकिन 1823 में कम पहचान हैं स्वीडन, रसायनशास्त्री और खनिज विज्ञानी जे. वाई. बर्जेलियस।
पृथ्वी की पपड़ी में चौड़ाई के लिए (27.6%), सिलिकॉन-अन्य (खट्टा के बाद) तत्व। जानना महत्वपूर्ण है। सिलिका Si02 और अन्य खट्टे भाषणों (सिलिकेट्स, एलुमिनोसिलिकेट्स, आदि) के रूप में। सर्वोत्तम दिमाग के लिए, एक स्थिर नैपकिन संशोधन स्थापित किया गया है, जिसमें हीरे की तरह एक चेहरा-केंद्रित क्यूबिक संरचना है, जिसकी अवधि = 5.4307 A. आंतरायिक पैठ 2.35 A. चौड़ाई 2.328 gcm है। उच्च दबाव (120-150 kbar) के साथ बड़े तारों और धातु संशोधनों पर जाएं। धातु संशोधन-सुपरकंडक्टर 6.7 K के एक संक्रमण तापमान के साथ। बढ़ते दबाव के साथ, गलनांक 1415 ± 3 ° C से 1 बार के दबाव में 810 ° C से 15,104 बार (पाइप के ताप के नुकसान बिंदु) के दबाव में घट जाता है। , धातु टार)। ). जब पिघलाया जाता है, तो अंतर-परमाणु बंधों की समन्वय संख्या और धातुकरण में वृद्धि होती है। शॉर्ट-रेंज ऑर्डर का अनाकार सिलिकिक चरित्र, जो दुर्लभ के करीब, दृढ़ता से निर्मित वॉल्यूम-केंद्रित क्यूबिक संरचना दिखाता है। डेबिवेस्काया टी-आरए 645 के। कोफ के करीब है। चरम कानून के अनुसार टी-आरआई बदलने के साथ तापमान रैखिक विस्तार बदलता है, टी-आरआई 100 से कम शराब नकारात्मक हो जाती है, टी-आरआई 80 के न्यूनतम (-0.77 10 -6) डिग्री -1 तक पहुंच जाती है; t-rі 310 K वाइन में 2.33 10-6 डिग्री-1 और t-rі 1273 K-4.8 10 डिग्री-1 है। संलयन की ऊष्मा 11.9 किलो कैलोरी/जी-परमाणु; tkіp.3520 के।
पिघलने के तापमान पर उच्च बनाने की क्रिया और वाष्पीकरण की गर्मी 110 और 98.1 किलो कैलोरी/जी-परमाणु है। सिलिकॉन की तापीय चालकता और विद्युत चालकता क्रिस्टल की शुद्धता और संपूर्णता में निहित होती है। Zі rostannyam t-ri coef। शुद्ध K की तापीय चालकता धीरे-धीरे बढ़ती है (t-ri 35 K पर 8.4 cal/cm X X sec deg तक), और फिर बदलती है, t-ri vіdpovidno 300 और 1200 K पर 0.36 और 0.06 cal/cm sec deg तक पहुंचती है। एन्थैल्पिया, एन्ट्रॉपी और ताप क्षमता K. मानक दिमाग में, यह 770 कैलोरी/जी-परमाणु, 4.51 और 4.83 कैलोरी/जी-परमाणु - डिग्री के बराबर है। सिलिकॉन प्रतिचुंबकीय, ठोस की चुंबकीय संवेदनशीलता (-1.1 · 10 -7 mu/g) और दुर्लभ (-0.8 · 10 -7 mu/g)। सिलिकॉन टी-री में कमजोर रूप से जमा होता है। पिघलने के तापमान पर सतह ऊर्जा, मोटाई और दुर्लभ K की कीनेमेटिक चिपचिपाहट 737 erg/cm2, 2.55 g/cm3 और 3 · 10 m2/sec हो जाती है। t-p 0 से 1.08 u - t-p 300 K पर 1.15 ev की फेंस्ड ज़ोन चौड़ाई वाला एक विशिष्ट क्रिस्टलीय सिलिकॉन कंडक्टर। कमरे के तापमान पर, गीले-ले जाने वाले आवेशों की सांद्रता 1.4 10 10 सेमी - 3 के करीब है;
सिलिकॉन की प्रकृति और घरों की एकाग्रता के साथ-साथ क्रिस्टल की पूर्णता के कारण गिरने की शक्ति। Otrimannya napіvprovіdnikovogo Do के लिए रिंग करें। पी- और एन-टाइप योग के संचालन के साथ, वे तत्व IIIb (बोरोन, एल्यूमीनियम, गैलियम) और Vb (फास्फोरस, मिश्याक, सुरमा, बिस्मथ) उपसमूह के साथ संयुक्त होते हैं, जो स्वीकर्ता के लिए पानी का उत्तराधिकार बनाते हैं और प्रांतस्था के पास दाता क्षेत्र, रोस्टाश vicorist की मिश्र धातु के लिए, उन अन्य तत्वों (उदाहरण के लिए) को आकार दिया जाता है। glybokі rivnі, yakі obumovlyuyut दफनाना और nosesіїv आरोपों का पुनर्संयोजन। Tse आपको उच्च इलेक्ट्रो वाली सामग्री लेने की अनुमति देता है। समर्थन (1010 ओम सेमी t-rі 80 K पर) मामूली पहनने के आरोपों के आधार की छोटी तुच्छता, जो विभिन्न आउटबिल्डिंग की संख्या में वृद्धि के लिए महत्वपूर्ण है। गुणक सिलिकॉन के साथ थर्मोइलेक्ट्रिक पावर को केवल टी-री और घर के स्थान पर जमा किया जाना है, zbіlshyuyuchi zі zrostannym elektroopor (p = 0.6 ओम - सेमी, a = 103 माइक्रोवोल्ट्स / ओला)। सिलिकॉन की ढांकता हुआ प्रवेश (vіd 11 से 15) गोदाम और मोनोक्रिस्टल की संपूर्णता में कमजोर रूप से जमा होता है। सिलिकॉन की ऑप्टिकल क्लेइंग के नियम शुद्धता, एकाग्रता और जीवन में दोषों की प्रकृति के साथ-साथ दीर्घायु में परिवर्तन के कारण बहुत बदल गए हैं।
इलेक्ट्रोमैग्नेटिक कोलीवन की अप्रत्यक्ष क्लेइंग का घेरा 1.09 यूरो के करीब है, डायरेक्ट क्लेइंग - 3.3 यूरो तक। फ्रैक्चर (एन-इक) के जटिल संकेतक के पैरामीटर के स्पेक्ट्रम के दृश्य क्षेत्र में, घर की सतह पर झूठ बोलना पहले से ही संभव है। विशेष रूप से शुद्ध करें। (परλ \u003d 5461 ए और टी-री 293 के) एन \u003d 4.056 और के \u003d 0.028। इलेक्ट्रॉनिक्स का रोबोट आउटपुट 48 यूरो के करीब है। सिलिकॉन प्रवृत्ति। मूस के लिए योगो कठोरता (t-ra 300 K) - 7; एचबी = 240; एचवी वाई \u003d 103; मैं = 1250 किग्रा/मिमी2; मानदंडों का मापांक, लोच (पॉलीक्रिस्टल) 10890 किग्रा/मिमी2। क्रिस्टल की गहराई में लेटने के लिए खनिज के बीच: योनि पर, गहराई 7 से 14 है; कोफ। कठोरता 0.325 1066 सेमी2/किग्रा।
कमरे के तापमान पर, सिलिकॉन व्यावहारिक रूप से गैस-जैसे (सहित) और ठोस अभिकर्मकों, krіm lіv के साथ परस्पर क्रिया नहीं करता है। टी-आरआई को स्थानांतरित करते समय, धातुओं और गैर-धातुओं के साथ सक्रिय संपर्क होता है। Zocrema, जो SiC कार्बाइड (तापमान 1600 K पर), Si3N4 नाइट्राइड (तापमान 1300 K पर), फॉस्फाइड SiP (तापमान 1200 K पर) और आर्सेनाइड Si As, SiAS2 (तापमान 1000 K पर) को घोलता है। 700 K के तापमान पर खट्टा प्रतिक्रिया के साथ, Si02 डाइऑक्साइड शमन, हलोजन के साथ - SiF4 फ्लोराइड (300 K से अधिक के तापमान पर), SiCl4 क्लोराइड (500 K से अधिक के तापमान पर), SiBr4 ब्रोमाइड (तापमान पर) 700 K) नोडाइड SiI4 (mp 1000 पर)। कई अन्य लोगों के साथ गहन प्रतिक्रिया। धातु, ची रसायन के लिए उनके प्रतिस्थापन में ठोस अंतर स्थापित करना। आधा - सिलिसाइड्स पर। ठोस गुलाब की सघनता के क्षेत्र रोसेट की प्रकृति के आधार पर होते हैं (उदाहरण के लिए, निमेचिन 0 से 100% तक, 15% तक की गिरावट में, अल्फा ज़िरकोनियम में 0.1% से कम)।
ठोस सिलिकॉन में धातुओं और गैर-धातुओं के बीच का अंतर काफी कम होता है और प्रतिगामी लगता है। किन सरहदों के साथ, एक घर के बजाय, दो पर क्या किया जा रहा है। बहुत गहरा नहीं, अधिकतम तक पहुँचें ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 सेमी) क्षेत्र टी-आर vіd 1400 से 1600 K. गहरे rіvenny vіdznyayutsya वाले घर थोड़े छोटे rozchinnіstyu (vіd 1015 सेलेनियम के लिए और 5 10 16 zalіza के लिए निकल के लिए 7 10 17 तक और मिडी के लिए 10 18 सेमी -3)। एक दुर्लभ स्टील में, सिलिकॉन सामान्य धातुओं से घिरा नहीं होता है, अक्सर गर्मी के महान दर्शन होते हैं। शुद्ध सिलिकॉन एक तकनीकी उत्पाद से तैयार किया जाता है 99% Si में - 0.03% Fe, Al में Co), इलेक्ट्रिक भट्टियों में क्वार्ट्ज और कोयले के साथ तड़का लगाया जाता है। वहां (सम_शी हाइड्रोक्लोरिक और सिरचानॉय, और फिर फ्लोराइड-पानी और सिरचानॉय) घरों में एक नई सांस के साथ शुरू करें, जिसके बाद उत्पाद (99.98%) को हटा दिया जाता है, क्लोरीन के साथ इलाज किया जाता है। संश्लेषण आसवन द्वारा शुद्ध किया जाता है।
सिलिकॉन कंडक्टर का उपयोग SiCl4 क्लोराइड (या SiHCl3) के साथ पानी या SiH4 हाइड्राइड के थर्मल विस्तार में किया जाता है। मोनोक्रिस्टल के अवशिष्ट शुद्धिकरण और पीसने को क्रूसिबललेस ज़ोन चिकनी विधि या Czochralsky विधि द्वारा विशेष रूप से शुद्ध ग्रेवी (1010-1013 सेमी -3 तक घर में) cf\u003e 10 3 ओम सेमी की खुराक को ध्यान में रखते हुए किया जाता है। आवश्यक घरों की संख्या। इस तरह से आप 2-4 व्यास और 3-10 सेमी लंबाई वाली बेलनाकार क्रीम तैयार करें।विशेष के लिए। उद्देश्य और भी अधिक मोनोक्रिस्टल का उत्पादन करना है। अम्लीय स्टील्स और मिश्र धातुओं के साथ-साथ प्रकाश योजक जैसे विकोरस लवण से तकनीकी सिलिकॉन और विशेष रूप से योगो मिश्र। विशेष रूप से शुद्ध ज़राज़की सिंगल-क्रिस्टल के।, विभिन्न तत्वों के साथ डोप किया गया, विभिन्न निम्न-वर्तमान (ज़ोक्रेमा, थर्मोइलेक्ट्रिक, रेडियो, प्रकाश-और फोटोटेक्निकल) और उच्च-वर्तमान (कंपन, परिवर्तित) अनुलग्नकों के आधार के रूप में उपयोग किया जाता है।
सिलिकियम और सिलिकॉन
सिलिकॉन को गैर-धातुओं में लाया जाता है, और 4 इलेक्ट्रॉन समान ऊर्जा स्तर पर हो सकते हैं। Vіddavati їх, ऑक्सीकरण चरण + 4 दिखा सकता है और इलेक्ट्रॉनों को जोड़ सकता है, ऑक्सीकरण चरण दिखा रहा है - 4। हालांकि, कार्बन की तुलना में सिलिकॉन में इलेक्ट्रॉनों को जोड़ने की क्षमता काफी कम है। सिलिकॉन परमाणुओं में एक बड़ा दायरा, कम कार्बन परमाणु हो सकते हैं।
प्रकृति का सिलिकॉन का ज्ञान .
प्रकृति में एक्सटेंशन का सिलिकॉन आर्क। द्रव्यमान के 26% से अधिक गिरावट का हिस्सा पृथ्वी खसरा. वाइन की चौड़ाई के लिए, दूसरी जगह (खट्टा होने के बाद) बैठें। Vіdmіnu vіd vіd uglec C vіlny stіnі vіrіdі नहीं zustrichaetsya पर। विभिन्न रासायनिक रचनाओं के गोदाम में प्रवेश करें, मुख्य रूप से सिलिकॉन ऑक्साइड (IV) के विभिन्न संशोधन और सिलिकिक एसिड (सिलिकेट) के लवण।
सिलिकॉन के साथ जुनून .
तकनीकी शुद्धता (95 - 98%) के औद्योगिक ग्रेड सिलिकॉन में SiO का प्रभुत्व है 2 भूनने के दौरान बिजली के ओवन में कोक:
SiO 2 + 2C \u003d Si + 2CO
SiO 2 + 2Mg \u003d Si + 2MgO
इस प्रकार घरों से भूरे रंग का अक्रिस्टलीय सिलिकॉन चूर्ण लिया जाता है। पिघलने वाली धातुओं (जेएन, अल) से पुन: क्रिस्टलीकरण को क्रिस्टल मिल में स्थानांतरित किया जा सकता है।
सिलिकॉन टेट्राक्लोराइड, उच्च शुद्धता का भी, सिलिकॉन टेट्राक्लोराइड SiCl के लिए 1000 ° C पर उपयोग किया जाता हैजिंक के 4 जोड़े:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
वह सफाई योग विशेष विधियों से करते हैं।
भौतिक रासायनिक शक्तिसिलिकॉन।
शुद्ध क्रिस्टलीय सिलिकॉन - कोमल और कठोर, पिलपिला ढलान। हीरे की तरह, इसमें सहसंयोजक प्रकार के बंधन के साथ एक घन क्रिस्टल जाली होती है। योगो पिघलने बिंदु 1423 डिग्री सेल्सियस। सबसे बड़े दिमाग के लिए, सिलिकॉन निष्क्रिय तत्व, जो केवल फ्लोरीन के साथ प्रतिक्रिया करता है, लेकिन गर्म होने पर, विभिन्न रासायनिक प्रतिक्रियाओं में प्रवेश करता है।
योगो vikoristovuyut napіvprovіdnikovіy tehnіtsі के लिए एक मूल्यवान सामग्री के रूप में। शराब के अन्य संवाहकों के साथ जोड़ा गया, यह पतला एसिड के खिलाफ एक महत्वपूर्ण प्रतिरोध और 300 डिग्री सेल्सियस तक एक महान विद्युत प्रतिरोध द्वारा प्रतिष्ठित है। गर्मी प्रतिरोधी, एसिड प्रतिरोधी और उपकरण स्टील्स, चवुन्स और समृद्ध अन्य मिश्र धातुओं के लिए धातु विज्ञान में भी तकनीकी सिलिकॉन और फेरोसिलिकॉन विकोरिस्ट।
सिलिकॉन धातुओं के साथ रसायन, सिलिसाइड्स कहा जाता है, जब मैग्नीशियम के साथ गर्म किया जाता है, तो मैग्नीशियम सिलिसाइड भंग हो जाता है:
सी + 2 एमजी = एमजी 2 सी
उस प्रभुत्व की संरचना के पीछे धातुओं के सिलिसाइड कार्बाइड की भविष्यवाणी करते हैं, इसलिए धातु की तरह के कार्बाइड की तरह धातु की तरह के सिलिकेट, बड़ी कठोरता, उच्च गलनांक, गर्म विद्युत चालकता द्वारा प्रतिष्ठित होते हैं।
बिजली की भट्टियों में कोक के साथ सुमिश पिस्कु को तलते समय, सिलिकॉन कार्बाइड और कार्बन को सिलिकॉन कार्बाइड, या कार्बोरंडम के साथ मिलाया जाता है:
SiO2 + 3C = SiC + 2CO
कार्बोरंडम एक दुर्दम्य, बारलेस हार्ड स्पीच, एक मूल्यवान अपघर्षक और ऊष्मा सामग्री है। कार्बोरंडम, याक आई, माє परमाणु क्रिस्टलीय ग्रैटी। स्वच्छ स्टेशन पर एक इंसुलेटर होता है, लेकिन घर की उपस्थिति में यह कंडक्टर बन जाता है।
सिलिकॉन याक मैं , दो ऑक्साइड को घोलता है: सिलिकॉन ऑक्साइड (II) SiO और सिलिकॉन ऑक्साइड (IV) SiO 2 . सिलिकॉन ऑक्साइड (IV) एक कठिन दुर्दम्य भाषण है, जो मुक्त देश में प्रकृति में व्यापक रूप से फैला हुआ है। Tse रासायनिक रूप से स्थिर भाषण, जो केवल फ्लोरीन और गैस जैसे फ्लोरीन के साथ पानी या हाइड्रोफ्लोरिक एसिड में परस्पर क्रिया करता है:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
सीधे प्रतिक्रियाओं की ओर इशारा करते हुए इस तथ्य से समझाया गया है कि सिलिकॉन में फ्लोरीन के लिए एक बड़ी चंचलता हो सकती है। इसके अलावा, सिलिकॉन टेट्राफ्लोराइड एक उड़ने वाला भाषण है।
Tekhnіtsі prozoriya SiO पर 2 एक स्थिर दुर्दम्य क्वार्ट्ज स्लैब की तैयारी के लिए vykorovuyut, जैसा कि पराबैंगनी परिवर्तन को याद करता है, विस्तार का एक बड़ा गुणांक हो सकता है, जो तापमान में महत्वपूर्ण परिवर्तन दिखाता है। सिलिकॉन ऑक्साइड (द्वितीय) त्रिपोली maє महान सरंध्रता का अनाकार संशोधन। डायनामाइट (नाक विबुखोवो भाषण) और इतने पर कंपन के लिए एक गर्मी और ध्वनि इन्सुलेटर के रूप में योगो vikoristovuyut। कंपन ध्वनि में सिलिकॉन (IV) ऑक्साइड मुख्य में से एक है रोजमर्रा की सामग्री. यह आग और एसिड प्रतिरोधी सामग्री, स्टील, धातु विज्ञान में प्रवाह की तरह और इतने पर के उत्पादन में विकोरस है।
आण्विक सूत्रों के अनुसार कार्बन ऑक्साइड (IV) तथा सिलिकन ऑक्साइड (IV) की रासायनिक एवं भौतिक शक्ति का मिलान करना आसान होता है, इनकी शक्ति समान होती है रासायनिक गोदाम z'ednan raznі। यह क्यों समझाया गया है कि सिलिकॉन ऑक्साइड (IV) सिर्फ SiO अणुओं से नहीं बनता है 2 , जैसे कि їх सहयोगी, उनमें से कुछ में सिलिकॉन के परमाणु खट्टे के परमाणुओं द्वारा एक साथ जुड़ जाते हैं। सिलिकॉन (चतुर्थ) ऑक्साइड (SiO 2 )एन। छवि її वर्ग पर:
डी। आई की आवधिक प्रणाली के IV समूह (IVA समूह) के प्रमुख उपसमूह के तत्वों का एक अन्य प्रतिनिधि। मेंडेलीव - सिलिकॉन सी।
प्रकृति में, एसिड की चौड़ाई के लिए सिलिकॉन एक अन्य रासायनिक तत्व है। योगो स्पोलुक से पृथ्वी की पपड़ी अधिक से अधिक त्रैमासिक रूप से मुड़ी हुई है। सबसे व्यापक रूप से फैला हुआ सिलिकॉन सिलिकॉन ऑक्साइड (IV) SiO2 है, अन्य नाम सिलिका है। प्रकृति में, वाइन खनिज क्वार्ट्ज (छोटा 158), इस तरह की एक समृद्ध विविधता - गिर्स्की क्रिस्टल, और प्रसिद्ध बकाइन रूप - नीलम, साथ ही अगेट, ओपल, जैस्पर, चेलेडोनी, कारेलियन के रूप में बनाई जाती है। virobnі और नशीला पत्थर। सिलिकॉन (चतुर्थ) ऑक्साइड भी उल्लेखनीय और क्वार्ट्ज रेत से बना है।

मल। 158.
डोलोमाइट में बीच-बीच में क्वार्ट्ज क्रिस्टल
सिलिकॉन ऑक्साइड (IV) पर आधारित तीन अलग-अलग खनिज (चकमक पत्थर, चेलेडोनी और अन्य) पहले लोगतैयार znaradya pracі। वही चकमक पत्थर, जो एक पत्थर की तुलना में अगोचर और संकरा नहीं है, एक पत्थर के कोब को बिछाता है - vіtsі kremіnyh znaryad pratsі (चित्र। 159)। इसके दो कारण हैं: चकमक पत्थर की चौड़ाई और उपलब्धता, साथ ही किनारों के कितने नुकीले भवनों का निर्माण।

मल। 159.
Znaryadya पत्थर vіku
सिलिकॉन के लिए एक अन्य प्रकार की प्राकृतिक सामग्री सिलिकेट है। उनमें एलुमिनोसिलिकेट्स की सबसे बड़ी चौड़ाई है (यह समझा गया था कि ये सिलिकेट्स एल्यूमीनियम रासायनिक तत्व को बदल सकते हैं)। एल्युमिनोसिलिकेट्स में ग्रेनाइट मिलाया जाता है, अलग देखेंमिट्टी, अभ्रक सिलिकेट, जो एल्यूमीनियम का बदला नहीं लेता है, उदाहरण के लिए, एस्बेस्टस, जिसका उपयोग आतिशबाजी बनाने के लिए किया जाता है।
सिलिकॉन ऑक्साइड (IV) SiO2 उत्पादकों और प्राणियों के जीवन के लिए आवश्यक है। वाइन रोज़लिन के तने और जीवों के घूंघट (चित्र। 160) देते हैं। आप के लिए Zavdyaks, कतारें, कतारें और हॉर्सटेल खड़े मिट्ज्नो, बैगनेट्स की तरह, गोस्टर लीफिंग सेज कट, चाकू की तरह, ढलान वाले मैदान पर ठूंठ, सिर की तरह, और मिट्जना के मैट पर अनाज के डंठल, जो कॉर्नफील्ड्स को झूठ बोलने की अनुमति नहीं देते हैं जंगल और हवा में खेतों। लुस्का रिब, कोमा के गोले, क्रिल मेटेलिक्स, पिरया पटाहिव में जीवों के ऊन, ऑस्केल्की स्माइट सिलिका हैं।

मल। 160.
सिलिकन (IV) ऑक्साइड रोजलिन के तनों और प्राणियों के दम घुटने वाले वक्रों को खनिजता प्रदान करता है
Z'ednannya सिलिकॉन किसी व्यक्ति के बालों और नाखूनों को चिकनाई और कोमलता देता है।
सिलिकॉन निचले जीवित जीवों के गोदाम में प्रवेश करने के लिए - डायटम और रेडिओलेरियन, जीवित पदार्थ के सबसे निचले स्तन, जैसे कि सिलिका के साथ कंकाल की सुंदरता के पीछे उनकी खामियों का निर्माण (चित्र। 161)।
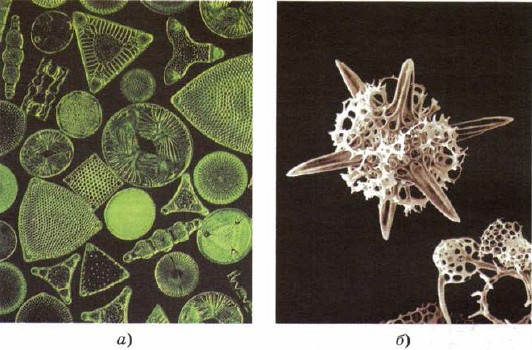
मल। 161.
डायटम (ए) और रेडिओलेरियन (बी) के कंकाल सिलिका से बने होते हैं
सिलिकॉन का प्रभुत्व. आप सोनी बैटरी के साथ एक माइक्रोकैलकुलेटर का उपयोग कर रहे हैं, और इसलिए क्रिस्टलीय सिलिकॉन के बारे में एक सूचना है। Tse napіvprovіdnik। Vіdmіnu vіd metalіv पर, pіdvishennyam तापमान yogo elektroprovіdnіst zbіshuєtsya। उपग्रहों, अंतरिक्षयानों, स्टेशनों और दाहा बुदिन्किव (छोटा 162) पर वे सोनी बैटरी स्थापित करते हैं जो सोनी ऊर्जा को बिजली में परिवर्तित करती हैं। बदबू napіvprovіdnikіv के क्रिस्टल और पहले काले चकमक पत्थर पर काम करती है। सिलिकॉन फोटोकल्स को क्लेड सोनी ऊर्जा के 10% तक बिजली में परिवर्तित किया जा सकता है।

मल। 162.
दाहू बूथ के लिए नींद की बैटरी
सिलिकॉन अम्लता पर जलने के लिए, आपको सिलिकॉन ऑक्साइड (IV) से संतुष्ट करता है:
![]()
गैर-धातु होने के कारण, गर्म होने पर, सिलिकोन धातुओं के साथ सिलिसाइड समाधान के साथ विलीन हो जाता है, उदाहरण के लिए:
![]()
सिलिकाइड्स आसानी से पानी या एसिड के साथ फैलते हैं, जब आप गैस की तरह पानी की तरह सिलिकॉन - सिलेन देखते हैं:
कार्बोहाइड्रेट की सतह पर, सतह पर सिलेन आत्म-संलग्न होता है और घुलित सिलिकॉन ऑक्साइड (IV) और पानी से जलता है:
सिलेन और मीथेन सीएच 4 के बीच बढ़ी हुई प्रतिक्रिया को इस तथ्य से समझाया गया है कि सिलिकॉन परमाणु का विस्तार कार्बन पर कम है, इसलिए सी-एच रासायनिक बांड छोटे हैं, सी-एच बांड कम हैं।
सिलिकेट और पानी बनाने, घास के मैदानों के केंद्रित पानी के परिवर्तन के साथ सिलिकॉन इंटरप्ले:
सिलिकॉन के पास सिलिकॉन ऑक्साइड (IV) मैग्नीशियम या कार्बन के समान है:
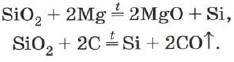
सिलिकॉन ऑक्साइड (IV), या सिलिकॉन डाइऑक्साइड, या सिलिका SiO 2 याक CO 2 є अम्लीय ऑक्साइड है। हालाँकि, CO2 की सतह पर, एक आणविक, लेकिन एक परमाणु, क्रिस्टल जाली है। उसके लिए SiO2 कठिन और दुर्दम्य भाषण है। सिलिकिक एसिड - सिलिकेट्स के भंग लवण के साथ घास के मैदानों के साथ उच्च तापमान पर पानी के एसिड, हाइड्रोफ्लोरिक क्रीम और मुसब्बर में वाइन भिन्न नहीं होते हैं:
सिलिका का उपयोग धातु ऑक्साइड या कार्बोनेट के साथ मिश्र धातु सिलिकॉन ऑक्साइड (IV) के लिए भी किया जा सकता है:
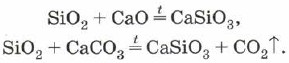
सोडियम सिलिकेट और पोटैशियम को रिटेल स्लैब कहा जाता है। च जलापूर्ति- सिलिकेट गोंद का उपयोग करना अच्छा होता है।
सिलिक एसिड H 2 SiO 3 (चित्र। 163):
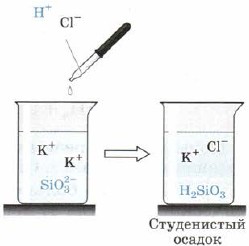
मल। 163. सिलिकेट-आयन की अम्ल प्रतिक्रिया
साथ ही, H2SiO3 भी एक दुर्बल अम्ल है। यह पानी में असंगत है और घेराबंदी के मलबे को देखते हुए प्रतिक्रियात्मक उथल-पुथल से बाहर निकलता है, जो कभी-कभी अंतर की पूरी मात्रा को संकुचित करता है, इसे एक ठोस द्रव्यमान में बदल देता है, मैं जेली, जेली में जाता हूं। मासी को लटकाते समय, एक अत्यधिक झरझरा भाषण - सिलिका जेल स्थापित होता है, जो व्यापक रूप से अन्य भाषणों की मिट्टी - मिट्टी के रूप में उपयोग किया जाता है।
प्रयोगशाला प्रमाणपत्र संख्या 40
सिलिकिक एसिड का कब्ज़ा और शक्ति का वह प्रमाण
सिलिकॉन इंजेक्शन. आप पहले से ही जानते हैं कि सिलिकॉन का उपयोग प्रवाहकीय सामग्री, साथ ही एसिड प्रतिरोधी मिश्र धातुओं के उत्पादन के लिए किया जाता है। जब उच्च तापमान पर क्वार्ट्ज रेत को ऊन के साथ जोड़ा जाता है, तो सिलिकॉन कार्बाइड SiC घुल जाता है, जो केवल हीरे के लिए उपलब्ध होता है। इसलिए, rіztsіv metalorіzalnyh verstatіv को तेज करने और महंगे पत्थर को चमकाने के लिए जरूरी है।
पिघले हुए क्वार्ट्ज से, विभिन्न रासायनिक क्वार्ट्ज व्यंजन तैयार किए जाते हैं, जो उच्च तापमान का सामना कर सकते हैं और ठंडा होने पर नहीं फटते हैं।
Z'ednannya सिलिकॉन є सीमेंट के लिए गोदाम के ताना-बाना का आधार।
Zvichayne त्रुटि गोदाम हो सकती है, जिसे सूत्र Na 2 O CaO 6SiO 2 द्वारा व्यक्त किया जा सकता है। योगो को विशेष स्टोविंग ओवन में फ्यूज्ड सुमिश सोडा, वाप्न्याक और पिस्का के साथ जीता जाता है।
Vіdmіnna चावल skla - zdatnіst rozm'yakshuvatisya यह पिघला हुआ स्टील प्रफुल्लित है कि क्या यह एक रूप है, क्योंकि यह गोदाम पकड़े जाने पर सहेजा जाता है। जिसके आधार पर बर्तन बनते हैं और दूसरे बर्तन बनते हैं।
Dodatkovі yakosti sklu विभिन्न योजक देते हैं। तो, लेड ऑक्साइड की शुरूआत एक क्रिस्टल-स्पष्ट रंग में कम हो जाती है, क्रोमियम ऑक्साइड हरे रंग का हो जाता है, कोबाल्ट ऑक्साइड नीला हो जाता है, आदि (चित्र। 164)।

मल। 164.
रंग गोदाम से उत्पाद
स्कोलो लोगों के सबसे पुराने विजेताओं में से एक है। पहले से ही 3-4 साल। इस कारण से मिस्र, सीरिया, फिनीकी और काला सागर में युद्ध छिड़ गया।
स्कोलो - एक ही सामग्री remіsnikіv से कम नहीं है, बल्कि कलाकार भी हैं। गुरु पूर्णता के उच्चतम स्तर पर पहुंच गए प्राचीन रोम, जैसे कि वे अपने मोज़ाइक के रंग ढलान और काम को दूर करने में सक्षम थे।

मल। 165.
नोट्रे डेम कैथेड्रल, चार्ट्रेस की सना हुआ ग्लास खिड़कियों पर रंगीन कांच
एक महान संग्रहालय के obov'yazkovymi विशेषताओं के साथ गोदाम से कला का काम करता है, और चर्च की रंगीन कांच की खिड़कियां, मोज़ेक पैनल - इस के उज्ज्वल चूतड़ (चित्र। 165)। रूसी एकेडमी ऑफ साइंसेज की सेंट पीटर्सबर्ग शाखा के एक परिसर में, पीटर I, विजयी एम। वी। लोमोनोसोव (चित्र। 166) का मोज़ेक चित्र है।

मल। 166.
पीटर I का मोज़ेक चित्र
भीड़भाड़ वाले इलाके काफी बड़े हैं। त्से विकोन, प्लायशकोव, लैम्पोव, डेज़रकलने स्क्लो; ऑप्टिकल ढलान - ऐपिस से लेकर कैमरा ग्लास तक; अप्रभेद्य ऑप्टिकल उपकरणों के लेंस - सूक्ष्मदर्शी से दूरबीन तक।
दूसरी सबसे महत्वपूर्ण सामग्री, सिलिकॉन पर आधारित कोटिंग्स, सीमेंट है। योगो का उपयोग बेकिंग क्ले और वेप के लिए विशेष ओवन में किया जाता है जो लपेटे जाते हैं।
यदि सीमेंट के पाउडर को पानी में मिला दिया जाए तो सीमेंट मजबूती से स्थापित नहीं होता है, अन्यथा इसे अलार्म क्लॉक कहा जाता है, सीमेंट रोजचिन, जो धीरे-धीरे सख्त होता है। सीमेंट, या कुचले हुए पत्थर में कंक्रीट मिलाते समय, कंक्रीट को टॉप कोट की तरह हटा देना चाहिए। कंक्रीट की भौतिकता बढ़ रही है, ताकि एक नया फ्रेम नए में पेश किया जा सके - कच्चा कंक्रीट बाहर आता है, जिसमें से पैनल की दीवारें, ओवरलैप्स के ब्लॉक, फर्मी पुल आदि बनाए जाते हैं।
गोदाम सीमेंट के उत्पादन में लगा हुआ है सिलिकेट उद्योग. वॉन सिलिकेट सिरेमिक - सेग्लू, पोर्सिलेन (छोटा 167), फ़ाइयेंस और उनसे माल भी बनाता है।

मल। 167.
चीनी मिट्टी की किस्में
Vіdkrittya सिलिकॉन. भले ही प्राचीन समय में लोग सिलिकॉन के उपयोग में व्यापक रूप से विजयी थे, फिर भी सिलिकॉन को पहली बार 1824 में स्वीडिश रसायनज्ञ जे. वाई. बर्जेलियस द्वारा छीन लिया गया था। हालांकि, नए चकमक पत्थर से 12 साल पहले, जे. गे-लुसाक और एल. टेनार्ड को ले जाया गया था, एले विन दुज़े ज़ब्रुदनेनी घर।
लैटिन नाम सिलिकम लैटिन शब्द सिलेक्स-फ्लिंट से अपना कोब लेता है। रूसी नाम "सिलिकॉन" अखरोट क्रेमनोस जैसा दिखता है - "स्केल, स्केल"।
नए शब्द जो समझते हैं
- सिलिकॉन के प्राकृतिक स्रोत: सिलिका, क्वार्ट्ज और अन्य किस्में, सिलिका, एलुमिनोसिलिकेट, अभ्रक।
- सिलिकॉन का जैविक महत्व।
- सिलिकॉन का प्रभुत्व: napіvprovіdnikovі, खट्टा, धातु, घास के मैदान के साथ परस्पर क्रिया।
- सिलेन।
- सिलिकॉन (चतुर्थ) ऑक्साइड। योग बुडोवा और शक्ति: घास के मैदान, मूल आक्साइड, कार्बोनेट और मैग्नीशियम के साथ बातचीत।
- सिलिकिक एसिड और її लवण। रोजचिन स्लो।
- Zastosuvannya सिलिकॉन और योगो आधा।
- स्कोलो।
- सीमेंट।
दिन का नाम दें
अक्सर प्रकृति में, सिलिकॉन सिलिका की तरह दिखने में पाया जाता है - सिलिकॉन डाइऑक्साइड (IV) SiO2 (पृथ्वी के खसरा द्रव्यमान का लगभग 12%) पर आधारित एक आधार। सिलिकॉन डाइऑक्साइड से बुझने वाले मुख्य खनिज और चट्टानें श्रृंखला (समृद्ध और क्वार्ट्ज), क्वार्ट्ज और क्वार्टजाइट, चकमक पत्थर, पोलोवस्पर हैं। प्रकृति में चौड़ाई के लिए सिलिका और एलुमिनोसिलिकेट को दूसरे से जोड़ दिया जाता है।
यह एक-एक करके अपने मूल स्वरूप में शुद्ध सिलिकॉन के महत्व के तथ्य पर ध्यान देता है।
Otrimannya
मैग्नीशियम के साथ कुरकुरे सफेद पिस्कु (सिलिकॉन डाइऑक्साइड) तलने पर सिलिकॉन निकलेगा:
S i O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \rightarrow \ 2MgO+Si)))आप किस पर बसते हैं अनाकार सिलिकॉन , ब्राउन पाउडर कैसा दिख सकता है।
उद्योग में, शाफ्ट प्रकार के अयस्क-थर्मल भट्टियों में लगभग 1800 डिग्री सेल्सियस के तापमान पर कोक के साथ SiO2 को पिघलाकर सिलिकॉन तकनीकी शुद्धता प्राप्त की जाती है। ऐसे ग्रेड द्वारा हटाए गए सिलिकॉन की शुद्धता 99.9% तक पहुंच सकती है (मुख्य घर कोयला, धातु हैं)।
आप घरों से सिलिकॉन की शुद्धि से दूर जा सकते हैं।
- प्रयोगशाला वाशरूम में शुद्धिकरण मैग्नीशियम सिलिसाइड एमजी 2 सी के ललाट कब्जे के मार्ग से किया जा सकता है। हमने गैस जैसी मोनोसिलीन SiH 4 को हटाने के लिए अतिरिक्त हाइड्रोक्लोरिक या ऑक्टिक एसिड के लिए मैग्नीशियम सिलिसाइड दिया। मोनोसिलेन को सुधार, सोखना और अन्य तरीकों से शुद्ध किया जाता है, और फिर लगभग 1000 डिग्री सेल्सियस के तापमान पर सिलिकॉन और पानी पर रखा जाता है।
- सिलिकॉन के गैर-मध्यवर्ती क्लोरीनीकरण के माध्यम से एक औद्योगिक पैमाने पर सिलिकॉन का शुद्धिकरण किया जाता है। इसके साथ, गोदाम SiCl 4, SiHCl 3 और SiH 2 Cl 2 की आधी तह भंग हो जाती है। च भिन्न प्रकार सेघर को साफ करें (एक नियम के रूप में, आसवन और अनुपातहीनता द्वारा) और अंतिम चरण में 900 से 1100 डिग्री सेल्सियस के तापमान पर शुद्ध पानी डालें।
- सिलिकॉन शोधन के लिए सस्ती, स्वच्छ और अधिक कुशल औद्योगिक प्रौद्योगिकियां विकसित की जा रही हैं। 2010 के लिए उनसे पहले सिलिकॉन के शुद्धिकरण के लिए विकराल फ्लोरीन (क्लोरीन की जगह) के लिए प्रौद्योगिकियों को पेश करना संभव है; प्रौद्योगिकियां जो आसवन को सिलिकॉन मोनोऑक्साइड में स्थानांतरित करती हैं; सना हुआ ग्लास घरों पर आधारित प्रौद्योगिकियां जो अंतर-क्रिस्टल सीमाओं पर ध्यान केंद्रित करती हैं।
अंतिम सिलिकॉन पर Vmіst domіshok को प्रति द्रव्यमान 10 -8 -10 -6% तक कम किया जा सकता है। पॉलीक्रिस्टलाइन सिलिकॉन लेख में शुद्ध सिलिकॉन के पोषण पर अधिक रिपोर्ट की समीक्षा की गई है।
मिकोला, मिकोलायोविच बेकेटोव द्वारा विखंडन के शुद्ध रूप में सिलिकॉन प्राप्त करने की विधि।
शारीरिक शक्ति
सिलिकॉन क्रिस्टल जाली हीरे की तरह क्यूबिक फेस-केंद्रित है, पैरामीटर a = 0.54307 एनएम (पर उच्च वाइससिलिकॉन में अन्य बहुरूपी संशोधनों को हटा दें), लेकिन एक बंधन में Si-Si परमाणुओं के बीच एक बड़े बंधन के माध्यम से zv'azku एस-एससिलिकॉन की कठोरता हीरे की तुलना में काफी कम होती है। सिलिकॉन क्रैकिंग, केवल 800 डिग्री सेल्सियस पर गर्म होने पर, यह प्लास्टिक भाषण बन जाता है। Infrachervonogo viprominyuvannya s dozhini khvili 1.1 माइक्रोन के लिए प्रोज़ोरी। आवेश में नाक की गीली सघनता 5.81 10 15 m-3 (300 K के तापमान के लिए) है।
इलेक्ट्रोफिजिकल पावर
एकल-क्रिस्टल रूप में प्राथमिक सिलिकॉन एक अप्रत्यक्ष-अंतराल कंडक्टर है। बाड़ क्षेत्र की चौड़ाई पर कमरे का तापमानभंडारण 1.12 eV, और T \u003d 0 K - 1.21 eV पर। सामान्य दिमाग के लिए सिलिकॉन में गीले आवेश वाहकों की सांद्रता 1.5·10 · 10 सेमी -3 के करीब हो जाती है।
क्रिस्टलीय सिलिकॉन की इलेक्ट्रोट्रोफिक शक्ति पर, एक महान प्रवाह घरों का निर्माण करता है जो अंधेरे में घूमते हैं। एक गहरी चालकता के साथ सिलिकॉन क्रिस्टल निकालने के लिए, समूह III के तत्वों के परमाणुओं को सिलिकॉन, जैसे बोरॉन, एल्यूमीनियम, गैलियम और इंडियम में पेश करें। सिलिकॉन से इलेक्ट्रॉनिक चालकता के साथ सिलिकॉन से क्रिस्टल निकालने के लिए, परमाणुओं को पेश करें तत्व वी-їग्रुपी, जैसे फॉस्फोरस, मिश्यक, सुरमा।
जब इलेक्ट्रॉनिक उपकरणों को सिलिकॉन के आधार पर इकट्ठा किया जाता है, तो सतह की गेंद को सामग्री (दसियों माइक्रोन तक) से जोड़ना महत्वपूर्ण होता है, इसलिए क्रिस्टल की सतह की गुणवत्ता को सिलिकॉन की इलेक्ट्रोस्टैटिक शक्ति में जोड़ा जा सकता है और, जाहिर है, तैयार उपकरण की शक्ति पर। कुछ उपकरणों की असेंबली के दौरान, vicorous जोड़ा जाता है, सतह के संशोधन पर लागू होता है, उदाहरण के लिए, सतह को विभिन्न रासायनिक एजेंटों और її oprominennya के साथ सिलिकॉन के साथ लेपित किया जाता है।
रासायनिक शक्ति
कार्बन परमाणुओं के समान, सिलिकॉन परमाणुओं की विशेषता एसपी 3-ऑर्बिटल्स के संकरण द्वारा होती है। संकरण के संबंध में, शुद्ध क्रिस्टलीय सिलिकॉन हीरा जैसे अनाज बनाता है, जिसमें सिलिकॉन चॉटिवेंट होता है। साथ ही, सिलिकॉन ध्वनि भी खुद को +4 या -4 के ऑक्सीकरण राज्य के साथ एक चॉटिवेंट तत्व के रूप में प्रकट करती है। उदाहरण के लिए, सिलिकॉन ऑक्साइड (द्वितीय) - SiO के लिए ज़ुस्ट्रीचायुत्स द्विसंयोजक आधा सिलिकॉन।
सामान्य दिमाग के लिए, सिलिकॉन रासायनिक रूप से निष्क्रिय है और सक्रिय रूप से केवल गैस जैसी फ्लोरीन के साथ प्रतिक्रिया करता है, जिसके साथ वाष्पशील सिलिकॉन टेट्राफ्लोराइड SiF4 घुल जाता है। सिलिकॉन की ऐसी "निष्क्रियता" सिलिकॉन डाइऑक्साइड की नैनोसाइज्ड बॉल की सतह के निष्क्रिय होने के कारण होती है, जो खट्टा, बार-बार पानी (जल वाष्प) की उपस्थिति में नकारात्मक रूप से बस जाती है।
विघटित SiO 2 डाइऑक्साइड के साथ अम्लीकरण, प्रक्रिया सतह पर डाइऑक्साइड बॉल की मात्रा में वृद्धि के साथ होती है, ऑक्सीकरण प्रक्रिया की स्थिरता परमाणु एसिड और क्रायोप्रेज़र्वेशन डाइऑक्साइड के प्रसार द्वारा सीमित होती है।
जब 400-500 डिग्री सेल्सियस से अधिक के तापमान पर गर्म किया जाता है, तो सिलिकॉन क्लोरीन, ब्रोमीन और आयोडीन के साथ प्रतिक्रिया करता है - आसानी से वाष्पशील टेट्राहैलाइड्स SiHal 4 को अपनाने के साथ और संभवतः, एक तह गोदाम में हल हो जाता है।
पानी के साथ सिलिकॉन एक मध्य के बिना प्रतिक्रिया नहीं करता है, लेकिन पानी के सिलिकॉन के साथ - Si n H 2n + 2 सूत्र के साथ सिलेन - एक अप्रत्यक्ष पथ है। मोनोसिलीन SiH 4 (योगो को अक्सर सिलेन कहा जाता है) एसिड के साथ धातु सिलिकाइड्स की बातचीत में देखा जाता है, उदाहरण के लिए:
C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \rightarrow \ 2CaCl_(2)+SiH_(4)\) ) ऊपर की ओर तीर)))SiH 4 silane, जो इस प्रतिक्रिया में घुल जाता है, घरों और अन्य silanes, zokrem, Si 2 H 6 disilane और Si 3 H 8 trisilane का बदला लेता है, सिलिकॉन परमाणुओं के लिए कुछ लांस में, एकल बांड द्वारा एक साथ बंधे (-Si -Si-Si- ) .
सिलिकॉन 1000 ° C के करीब तापमान पर नाइट्रोजन और बोरान के साथ प्रतिक्रिया करता है, नाइट्राइड Si 3 N 4 को भंग करता है और थर्मल और रासायनिक रूप से स्थिर बोराइड SiB 3, SiB 6 और SiB 12।
1000 डिग्री सेल्सियस से ऊपर के तापमान पर, सिलिकॉन का उपयोग करना संभव है जो आवर्त सारणी के निकटतम एनालॉग है - कार्बन - सिलिकॉन कार्बाइड SiC (कार्बोरंडम), जो उच्च कठोरता और कम रासायनिक गतिविधि की विशेषता है। कार्बोरंडम व्यापक रूप से एक अपघर्षक सामग्री के रूप में उपयोग किया जाता है। इसके साथ, हालांकि, सिलिकॉन (1415 डिग्री सेल्सियस) की पिघलने से तीन घंटे के लिए कोयले के साथ संपर्क किया जा सकता है, आइसोस्टैटिक प्रेसिंग के सिंटर किए गए ठीक-दाने वाले ग्रेफाइट के बड़े टुकड़ों को ध्यान में रखते हुए, व्यावहारिक रूप से बदलते नहीं हैं और बाकी के साथ हस्तक्षेप नहीं करते हैं।
चौथे समूह (जीई, एसएन, पीबी) के निचले तत्व सिलिकॉन, साथ ही साथ अन्य धातुओं में अनोखे हैं। जब सिलिकॉन और धातुओं के साथ गरम किया जाता है, तो उनके आधे गोले, सिलिसाइड्स बन सकते हैं। सिलिसाइड्स को दो समूहों में विभाजित किया जा सकता है: आयनिक-सहसंयोजक (पोखर, पोखर-पृथ्वी धातुओं और मैग्नीशियम प्रकार Ca 2 Si, Mg 2 Si और in) और धातु-जैसे (संक्रमणकालीन धातुओं के सिलिसाइड्स)। एसिड के कमजोर पड़ने के तहत सक्रिय धातुओं के सिलिकेट रखे जाते हैं; धातु की तरह के सिलिसाइड्स में एक उच्च गलनांक (2000 ° C तक) होता है। धातु जैसे सिलिसाइड गोदामों का सबसे अधिक उपयोग किया जाता है मुझेसी, मुझे 3Si2, मुझे 2 सी 3 , मुझे 5 सी 3 आई मुझेसी 2। धातु जैसे सिलिसाइड रासायनिक रूप से निष्क्रिय होते हैं, उच्च तापमान पर खट्टेपन के प्रतिरोधी होते हैं।
यह ध्यान रखना विशेष रूप से महत्वपूर्ण है कि सिलिकॉन यूटेक्टिक राशि को सील करता है, जो फेरोसिलिकॉन सिरेमिक की सीलिंग के लिए सामग्री के स्पाइकिंग (फ्यूजिंग) की अनुमति देता है जो तापमान पर सील और सिलिकॉन के पिघलने के तापमान से कम होता है।
1200 ° C से ऊपर के तापमान पर सिलिकॉन में SiO 2 मिलाने पर, सिलिकॉन ऑक्साइड (II) - SiO घुल जाता है। सिलिकॉन विधियों द्वारा क्रिस्टल के उत्पादन द्वारा इस प्रक्रिया को लगातार समर्थन दिया जाता है
1811 में विज़न में सबसे आगे सिलिकॉन। J.Gay-Lussac और L.Tenar जब पोटेशियम धातु के ऊपर सिलिकॉन फ्लोराइड के वाष्प गुजरते हैं, तो उनके द्वारा प्रोटीन को एक तत्व के रूप में वर्णित नहीं किया जाता है। 1823 में स्वीडिश रसायनशास्त्री जे. बर्जेलियस उच्च तापमान पर धातु पोटेशियम के साथ पोटेशियम नमक K 2 SiF 6 के प्रसंस्करण के दौरान उनके द्वारा हटाए गए सिलिकॉन का विवरण देते हुए। नए तत्व को "सिलिशियम" (अव्य। सिलेक्स - फ्लिंट) नाम दिया गया था। रूसी नाम "सिलिकॉन" 1834 में रूसी रसायनज्ञ हरमन इवानोविच हेस द्वारा पेश किया गया था। अन्य ग्रीक के अनुवाद पर। krmnoz- कुट, पर्वत।
प्रकृति में ज्ञान, ओट्रीमन्या:
प्रकृति में, सिलिकॉन एक अलग गोदाम में कंपन डाइऑक्साइड और सिलिकेट्स में पाया जाता है। प्राकृतिक सिलिकॉन डाइऑक्साइड क्वार्ट्ज के रूप में अधिक महत्वपूर्ण है, अन्य खनिजों का उपयोग करना चाहते हैं - क्रिस्टोबलाइट, ट्राइडिमाइट, व्हेल, कौसाइट। अनाकार सिलिका समुद्र और महासागरों के तल पर डायटम जमा में जमा हो जाती है - ये जमाव SiO 2 के साथ बसे, डायटम और अन्य सिलिअट्स के गोदाम में प्रवेश करते हैं।
विल्नी सिलिकॉन का उपयोग मैग्नीशियम खस्ता सफेद पिस्कु के साथ भूनने के लिए किया जा सकता है, जिसे रासायनिक गोदाम के लिए सिलिकॉन ऑक्साइड SiO 2 + 2Mg = 2MgO + Si से साफ किया जा सकता है। उद्योग में, चाप भट्टियों में लगभग 1800 ° C के तापमान पर कोक के साथ SiO2 को पिघलाकर सिलिकॉन तकनीकी शुद्धता प्राप्त की जाती है। इस रैंक द्वारा प्राप्त सिलिकॉन की शुद्धता 99.9% तक पहुंच सकती है (मुख्य घर कोयला, धातु हैं)।
शारीरिक शक्तियाँ:
अनाकार सिलिकॉन एक भूरे रंग के पाउडर की तरह लग सकता है, जिसकी मोटाई 2.0 ग्राम / सेमी 3 से अधिक घनी होती है। क्रिस्टलीय सिलिकॉन - गहरे भूरे, चमकदार क्रिस्टलीय भाषण, क्रिस्टलीकृत और कठोर, हीरे में क्रिस्टलीकृत होते हैं। यह एक विशिष्ट कंडक्टर है (बिजली का संचालन करना बेहतर है, कम इन्सुलेटर टाइप रबर, और कंडक्टर के लिए उच्चतर - मध्य)। सिलिकॉन क्रैकिंग, केवल 800 डिग्री सेल्सियस पर गर्म होने पर, यह प्लास्टिक भाषण बन जाता है। Cіkavo, scho siliceous prosorium to infrachervony viprominyuvannya, जिसकी शुरुआत लंबी हवा 1.1 माइक्रोन से होती है।
रासायनिक शक्ति:
रासायनिक रूप से सिलिकॉन कम सक्रिय। कमरे के तापमान पर, केवल गैस की तरह फ्लोरीन के साथ प्रतिक्रिया करता है, वाष्पशील सिलिकॉन टेट्राफ्लोराइड SiF4 इस तापमान पर घुल जाता है। जब 400-500 डिग्री सेल्सियस के तापमान पर गर्म किया जाता है, तो सिलिकॉन घुले हुए डाइऑक्साइड के साथ एसिड के साथ प्रतिक्रिया करता है, क्लोरीन, ब्रोमीन और आयोडीन के साथ - भंग आसानी से वाष्पशील टेट्राहैलाइड्स SiHal 4 के साथ। 1000 ° C के करीब तापमान पर, सिलिकॉन नाइट्राइड Si 3 N 4 को बोरॉन के साथ भंग करने के लिए नाइट्रोजन के साथ प्रतिक्रिया करता है - तापीय और रासायनिक रूप से स्थिर बोराइड SiB 3, SiB 6 और SiB 12। जलीय सिलिकॉन के साथ, यह बिना किसी अड़चन के प्रतिक्रिया नहीं करता है।
सिलिकॉन के साथ नक़्क़ाशी के लिए, हाइड्रोफ्लोरिक और नाइट्रिक एसिड का योग सबसे अधिक व्यापक रूप से उपयोग किया जाता है।
घास के मैदानों के लिए सेट करें।
सिलिकॉन को +4 या -4 के ऑक्सीकरण चरण की विशेषता है।
सबसे महत्वपूर्ण क्षेत्र:
सिलिकॉन डाइऑक्साइड, SiO2- (सिलिकॉन एनहाइड्राइड) ...
...
सिलिकिक एसिड- कमजोर, अस्पष्ट, utvoryuyuyutsya सिलिकेट के आकार में एसिड जोड़ने पर एक जेल (जिलेटिन जैसी भाषण) जैसा दिखता है। H 4 SiO 4 (ऑर्थो-सिलिकॉन) और H 2 SiO 3 (मेटा-सिलिकॉन, या सिलिकॉन) केवल गर्म और सूखे होने पर अलग-अलग और अपरिवर्तनीय रूप से SiO 2 में परिवर्तित होने के लिए जाने जाते हैं। प्रवेश करने के लिए ठोस झरझरा उत्पाद - सिलिका जेलसतह पर खोला जा सकता है और गैसों के एक adsorbent, एक सुखाने एजेंट, एक उत्प्रेरक और एक पहनने वाले उत्प्रेरक के रूप में vicorous।
सिलिकेट- अच्छे के सिलिकिक एसिड के लवण (सोडियम और पोटेशियम के क्रिम सिलिकेट) पानी में घुलनशील नहीं होते हैं। शक्ति।
झरने- कार्बोहाइड्रेट के अनुरूप, सिलानी, आधे-अधूरे मन से, सिलिकॉन के कुछ परमाणुओं में एक बंधन के साथ, ताकतयक्ष्चो परमाणु सिलिकॉन z'єdnаnі podvіyny zv'yazkom। लांस और किल्ट्स्य का उपयोग कार्बोहाइड्रेट के समान ही किया जाता है। सभी शक्तियाँ स्व-नियोजित हो सकती हैं, पुनरावृत्ति के साथ सुमिश की तरंगें बना सकती हैं और पानी के साथ आसानी से प्रतिक्रिया कर सकती हैं।
ज़स्तोसुवन्न्या:
सिलिकॉन की सबसे महत्वपूर्ण मात्रा एल्यूमीनियम, तांबे और मैग्नीशियम के आवेदन के लिए मिश्र धातुओं के चयन के लिए और फेरोसिलिसाइड्स के चयन के लिए जानी जाती है, जो स्टील्स और हीटिंग उपकरण के चयन के लिए महत्वपूर्ण हो सकती है। सिलिकॉन क्रिस्टल zastosovuyut सोनी बैटरीऔर napіvprovіdnikovih outbuilds - ट्रांजिस्टर और डायोड। सिलिकॉन तेल, तेल, प्लास्टिक और सिंथेटिक रबड़ के साथ धुंधला होने वाले ऑर्गोसिलिकॉन स्लैब, या सिलोक्सेन के उत्पादन के लिए सिरोविना के रूप में भी काम करता है। अकार्बनिक स्लगसिलिकॉन विकोरिस्ट का उपयोग सिरेमिक और स्टील की तकनीक में एक इन्सुलेट सामग्री और p'ezocrystals के रूप में किया जाता है
कुछ जीवों के लिए, सिलिकॉन एक महत्वपूर्ण बायोजेनिक तत्व है। रोजलिन और कंकाल - प्राणियों पर सहायक झोपड़ियों के गोदाम में प्रवेश करें। समुद्री जीव - डायटम, शैवाल, रेडिओलारिया, स्पंज - सिलिकॉन के बड़े क्षेत्रों में केंद्रित हैं। बहुत अच्छी संख्याहॉर्सटेल और अनाज सिलिकॉन के साथ ध्यान केंद्रित करते हैं, पहले काले में - बांस और चावल जैसे पिड्रोडिन, उनमें से - चावल बोना। बदला लेने के लिए एक व्यक्ति के M'yazova ऊतक (1-2) 10 -2% सिलिकॉन, हड्डी के ऊतक - 17 10 -4%, रक्त - 3.9 मिलीग्राम / एल। हालाँकि, आज एक व्यक्ति के शरीर में 1 ग्राम तक सिलिकॉन का सेवन किया जा सकता है।
एंटोनोव एस.एम., टोमिलिन के.जी.
एचएफ टूमेन स्टेट यूनिवर्सिटी, 571 समूह।
