गैर-धातुओं के उदाहरणों की आनुवंशिक श्रृंखला। पदार्थों के वर्गों के बीच आनुवंशिक संबंध - ज्ञान का हाइपरमार्केट
साधारण पदार्थों, ऑक्साइड, ठिकानों, अम्लों और लवणों के बीच एक आनुवंशिक संबंध है, अर्थात् उनके पारस्परिक संक्रमण (परिवर्तन) की संभावना।
उदाहरण के लिए, सरल पदार्थ - ऑक्सीजन के साथ बातचीत के परिणामस्वरूप कैल्शियम ऑक्साइड में बदल जाता है: 2Ca + O 2 = 2CaO।
कैल्शियम ऑक्साइड जब पानी के साथ बातचीत करता है तो कैल्शियम हाइड्रॉक्साइड CaO + H 2 O = Ca (OH) 2, और बाद वाला, जब एसिड के साथ इंटरैक्ट करता है, तो नमक में बदल जाता है: Ca (OH) 2 + H 2 SO 4 = CaSO 4 / 2H 2 O.
इन परिवर्तनों को योजना द्वारा दर्शाया जा सकता है:
सीए → सीएओ → सीए (ओएच) २ → सीएएसओ ४
एक समान योजना को गैर-धातु के लिए लिखा जा सकता है, उदाहरण के लिए, सल्फर:
एस → एसओ 3 → एच 2 एसओ 4 → सीएएसओ 4
तो, एक ही नमक विभिन्न तरीकों से प्राप्त किया जाता है।
अकार्बनिक यौगिकों और सरल पदार्थों के अन्य वर्गों के लिए नमक से रिवर्स संक्रमण भी संभव है:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 Na + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (तांबा की कमी)
अकार्बनिक यौगिकों के वर्गों के बीच एक समान संबंध, दूसरे के पदार्थों से एक वर्ग के पदार्थों के उत्पादन के आधार पर, आनुवंशिक कहा जाता है।
अकार्बनिक यौगिकों के मुख्य वर्गों (चित्रा देखें) की आनुवंशिक योजना में जटिल यौगिकों के गुण परिलक्षित होते हैं। यह दो मुख्य लाइनों के साथ अकार्बनिक पदार्थ के विकास के चरणों को दर्शाता है, जिसमें विशिष्ट धातु से लेकर विशिष्ट गैर-धातुएं विपरीत गुण हैं।
धातुएँ जिनके परमाणु की रासायनिक संपत्ति इलेक्ट्रॉनों और गैर-धातुओं को दान करने की क्षमता है, जिनमें से मुख्य रासायनिक गुण गुणों में एक दूसरे के विपरीत इलेक्ट्रॉनों को संलग्न करने के लिए उनके परमाणुओं की क्षमता है। पदार्थों की संरचना की जटिलता के साथ, ये विरोधी प्रवृत्ति दिखाई देती हैं।
सबसे कम ऑक्सीकरण राज्य में विशिष्ट धातु और संक्रमण तत्व मूल ऑक्साइड बनाते हैं, और विशिष्ट गैर-धातु और उच्च ऑक्सीकरण राज्य में संक्रमण तत्व उनके गुणों में एसिड ऑक्साइड के विपरीत होते हैं।
साधारण पदार्थ
उभयधर्मी
गैर धातु
बुनियादी ऑक्साइड
उभयधर्मी
अम्लीय
आधार
उभयधर्मी
हाइड्रॉक्साइड
अकार्बनिक यौगिकों के मुख्य वर्गों की आनुवंशिक योजना
पदार्थों की संरचना की आगे की जटिलता के साथ, हाइड्रॉक्साइड्स का निर्माण होता है, आधार के आधार पर ऑक्साइड और एसिड के अनुरूप एसिड ऑक्साइड। गुणों और एसिड पर विपरीत आधार सक्रिय रूप से एक दूसरे के साथ प्रतिक्रिया करते हैं, जिससे लवण बनता है। विपरीतताओं का अंतःक्रिया प्रतिक्रिया की प्रेरक शक्ति है। इसलिए, बुनियादी और अम्लीय ऑक्साइड, कुर्सियां और एसिड सक्रिय रूप से एक दूसरे के साथ बातचीत करते हैं, और दो अम्लीय ऑक्साइड या दो बुनियादी ऑक्साइड बातचीत नहीं करते हैं, क्योंकि उनके गुण करीब हैं।
इस प्रकार, एक जटिल यौगिक के गुणों को उसके घटक तत्वों के गुणों के आधार पर निर्धारित किया जाता है। इन गुणों के परिवर्तन के मुख्य पैटर्न निम्नलिखित अनुप्रयोगों (तालिका 6) में संक्षेप हैं।
1. क्रम संख्या में वृद्धि के साथ अवधियों में, तत्वों के गुण धातु से अधातु में बदल जाते हैं। बाहरी स्तर पर इलेक्ट्रॉनों की संख्या बढ़ जाती है, तत्व के ऑक्सीकरण की डिग्री बढ़ जाती है, परमाणु और आयन की त्रिज्या कम हो जाती है, इलेक्ट्रॉन के लिए आयनीकरण ऊर्जा और आत्मीयता बढ़ जाती है। इसके अनुसार, मूल कम हो जाता है और ऑक्साइड और हाइड्रॉक्साइड के अम्लीय गुण बढ़ जाते हैं।
2. मुख्य उपसमूहों में, तत्व की परमाणु संख्या में वृद्धि के साथ, आक्साइड और हाइड्रॉक्साइड के मूल गुणों में वृद्धि होती है। अनुक्रम संख्या में वृद्धि के साथ पक्ष समूहों के तत्वों के लिए, गुणों में एक अधिक जटिल परिवर्तन विशेषता है। सबसे पहले, धातु के गुणों को बढ़ाया जाता है और फिर कम किया जाता है।
3. सक्रिय धातु ऑक्साइड और हाइड्रॉक्साइड्स के साथ दृढ़ता से स्पष्ट बुनियादी गुणों के अनुरूप हैं। सबसे सक्रिय धातुएं क्षार और क्षारीय पृथ्वी हैं। वे पानी में घुलनशील ऑक्साइड और मजबूत घुलनशील आधार बनाते हैं - क्षार।
4. कम सक्रिय धातु (सभी लेकिन क्षारीय और क्षारीय-पृथ्वी) कमजोर आधार बनाते हैं, जो पानी में घुलना मुश्किल है:
Cu (OH) 2, Fe (OH) 3।
5. दृढ़ता से स्पष्ट अम्लीय गुणों के साथ ऑक्साइड और हाइड्रॉक्साइड सक्रिय गैर-धातुओं के अनुरूप हैं।
6. एम्फोटेरिक धातुएं एम्फ़ोटेरिक ऑक्साइड और हाइड्रॉक्साइड बनाती हैं।
7. यदि कोई तत्व ऑक्सीकरण के विभिन्न डिग्री का प्रदर्शन करता है, तो विभिन्न गुणों वाले ऑक्साइड और हाइड्रॉक्साइड इसके अनुरूप होते हैं।
विषय: सामान्य संबंध बीटा धातुओं और गैर-धातुओं और उनके यौगिक। 9 वीं कक्षा
उद्देश्य: शैक्षिक: "आनुवंशिक श्रृंखला", "आनुवंशिक संबंध" की अवधारणा को मजबूत करने के लिए; आनुवंशिक श्रृंखला के अनुरूप प्रतिक्रिया समीकरण बनाने के लिए तत्वों (धातुओं और गैर-धातुओं) की आनुवंशिक श्रृंखला बनाना सिखाने के लिए; जाँचें कि ज्ञान कैसे सीखा जाता है रासायनिक गुण आक्साइड, एसिड, लवण, आधार; विकासशील: निष्कर्षों का विश्लेषण, तुलना, संक्षेप और ड्रा करने की क्षमता विकसित करना, रासायनिक प्रतिक्रियाओं के समीकरण बनाना; शैक्षिक: एक वैज्ञानिक विश्वदृष्टि के गठन को बढ़ावा देने के लिए।
कक्षाएं प्रदान करना: टेबल "आवधिक प्रणाली", "घुलनशीलता की तालिका", "धातु गतिविधि की श्रृंखला", छात्रों के लिए निर्देश, ज्ञान के परीक्षण के लिए कार्य।
प्रगति: 1) संगठन। पल
2) डी / एस की जाँच करें
3) नई सामग्री का अध्ययन करें
4) बन्धन
5) डी / सी
1) ऑर्ग। पल। आपका स्वागत है।
2) डी / एस की जाँच करें।
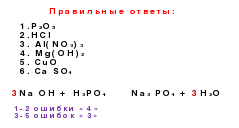
जेनेटिक कनेक्शन विभिन्न वर्गों के बीच उनके अंतर्संबंधों के आधार पर कनेक्शन होते हैं।
अकार्बनिक पदार्थों की कक्षाओं को जानने के बाद, धातुओं और गैर-धातुओं की आनुवंशिक श्रृंखला बनाना संभव है। इन श्रृंखलाओं का आधार एक ही तत्व है।
धातुओं में दो प्रकार की पंक्तियाँ हैं:
1
। एक आनुवंशिक श्रृंखला जिसमें क्षार एक आधार के रूप में कार्य करता है। इस श्रृंखला को निम्नलिखित परिवर्तनों का उपयोग करके दर्शाया जा सकता है:धातु → मूल ऑक्साइड → क्षार → नमक
उदाहरण के लिए, के → के
2 ओ → कोह → कोक्2
। आनुवंशिक श्रृंखला, जहां आधार एक अघुलनशील आधार है, फिर श्रृंखला को परिवर्तनों की श्रृंखला के रूप में दर्शाया जा सकता है:धातु → बेस ऑक्साइड → नमक → अघुलनशील आधार →
→मूल ऑक्साइड → धातु
उदाहरण के लिए, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
। गैर-धातुओं की आनुवंशिक श्रृंखला, जहां घुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है। परिवर्तनों की श्रृंखला को निम्नानुसार दर्शाया जा सकता है:गैर-धातु → एसिड ऑक्साइड → घुलनशील अम्ल → नमक
उदाहरण के लिए, पी → पी
2 हे 5 → एच 3 पीओ 4 → ना 3 पीओ 42
। गैर-धातुओं की आनुवंशिक श्रृंखला, जहां अघुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है:गैर-धातु → एसिड ऑक्साइड → नमक → एसिड →
→एसिड ऑक्साइड → गैर-धातु
उदाहरण के लिए
सी→ SiO 2 → ना 2 SiO 3 → एच 2 SiO 3 → SiO 2 → सी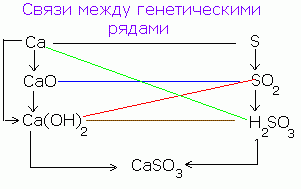
ललाट पर बातचीत:
जेनेटिक कनेक्शन क्या है? जेनेटिक कनेक्शन विभिन्न वर्गों के बीच उनके अंतर्संबंधों के बीच संबंध होते हैं। जेनेटिक सीरीज़ क्या होती है?
जेनेटिक श्रृंखला - पदार्थों की एक श्रृंखला - विभिन्न वर्गों के प्रतिनिधि, जो एक रासायनिक तत्व के यौगिक होते हैं, इंटरकनेक्टर्स द्वारा जुड़े होते हैं और इन पदार्थों के परिवर्तनों को दर्शाते हैं। इन श्रृंखलाओं का आधार एक ही तत्व है।
किस प्रकार की आनुवंशिक श्रृंखला को प्रतिष्ठित किया जा सकता है? धातुओं में, दो प्रकार की श्रृंखलाओं को अलग किया जा सकता है:
a) एक आनुवंशिक श्रृंखला जिसमें क्षार एक आधार के रूप में कार्य करता है। इस श्रृंखला को निम्नलिखित परिवर्तनों का उपयोग करके दर्शाया जा सकता है:
धातु → मूल ऑक्साइड → क्षार → नमक
उदाहरण के लिए, पोटेशियम K → K की आनुवंशिक श्रृंखला
2 ओ → कोह → कोक्बी) आनुवंशिक श्रृंखला, जहां आधार एक अघुलनशील आधार है, फिर श्रृंखला को परिवर्तनों की श्रृंखला के रूप में दर्शाया जा सकता है:
धातु → बेस ऑक्साइड → नमक → अघुलनशील आधार → बेस ऑक्साइड → धातु
उदाहरण के लिए: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cuगैर-धातुओं के बीच दो प्रकार की पंक्तियों को अलग करना भी संभव है:
क) गैर-धातुओं की आनुवंशिक श्रृंखला, जहां घुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है। परिवर्तनों की श्रृंखला को निम्नानुसार दर्शाया जा सकता है: गैर-धातु → एसिड ऑक्साइड → घुलनशील अम्ल → नमक।
उदाहरण के लिए: P → P
2 हे 5 → एच 3 पीओ 4 → ना 3 पीओ 4बी) गैर-धातुओं की आनुवंशिक पंक्ति, जहां अघुलनशील एसिड: गैर-धातु → एसिड ऑक्साइड → नमक → एसिड → एसिड ऑक्साइड → गैर-धातु श्रृंखला में एक कड़ी के रूप में कार्य करता है।
उदाहरण के लिए: Si → SiO
2 → ना 2 SiO 3 → एच 2 SiO 3 → SiO 2 → सीविकल्पों के लिए कार्यों का निष्पादन:
1. अपने संस्करण में ऑक्साइड फ़ार्मुलों का चयन करें, अपनी पसंद की व्याख्या करें, यौगिकों के इस वर्ग की संरचना की विशेषताओं के ज्ञान के आधार पर। उन्हें बुलाओ।
2. अपने संस्करण के सूत्र कॉलम में, एसिड फ़ार्मुलों को ढूंढें और इन यौगिकों की संरचना के विश्लेषण के आधार पर अपनी पसंद की व्याख्या करें।
3. एसिड संरचना में एसिड के अवशेषों की वैधता निर्धारित करें।
4. नमक के फार्मूले चुनें और उन्हें नाम दें।
5. लवण के सूत्र बनाएं, जो आपके वैरिएंट के मैग्नीशियम और एसिड के साथ बन सकते हैं। उन्हें नीचे लिखें, इसे नाम दें।
6. अपने संस्करण के सूत्र कॉलम में, आधार सूत्र खोजें और इन यौगिकों की संरचना के विश्लेषण के आधार पर अपनी पसंद की व्याख्या करें।
7. अपने वैरिएंट में, उन पदार्थों के फार्मूले चुनें जिनके साथ फॉस्फोरिक एसिड (हाइड्रोक्लोरिक, सल्फ्यूरिक) का घोल प्रतिक्रिया कर सकता है। उचित प्रतिक्रिया समीकरण बनाएं।
9. अपनी पसंद के फॉर्मूले के बीच, ऐसे पदार्थों के फॉर्मूले चुनें जो आपस में बातचीत कर सकें। उचित प्रतिक्रिया समीकरण बनाएं।
10. अकार्बनिक यौगिकों के आनुवंशिक बांडों की एक श्रृंखला बनाएं, जिसमें एक पदार्थ शामिल होगा, जिसका सूत्र आपके संस्करण में नंबर एक पर दिया गया है।
विकल्प 1
विकल्प 2
CaO
HNO
3Fe (OH)
3एन
2 हेZn (सं।)
3 ) 2Cr (OH)
3एच
2 अतः 3एच
2 एसPBO
LiOH
एजी
3 पीओ 4पी
2 हे 5NaOH
जेडएनओ
सीओ
2BaCl
2एचसीएल
एच
2 सीओ 3एच
2 अतः 4CuSO
4सभी फॉर्मूलों का उपयोग करके इन पदार्थों का उपयोग करके एक आनुवंशिक रेखा बनाएं। प्रतिक्रिया समीकरण लिखें जिसके साथ आप परिवर्तनों की इस श्रृंखला को पूरा कर सकते हैं:
मैं विकल्प: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : द्वितीय विकल्प:ना 2 अतः 4, NaOH, ना, ना 2 हे 2 , ना 2 हे४) बन्धन १।
अल→ अल 2 हे 3 → AlCl 3 → अल( ओह) 3 → अल 2 हे 32.
पी→ पी 2 हे 5 → एच 3 पीओ 4 → ना 3 पीओ 4 → सीए 3 ( पीओ 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (सं।) 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 हे 5 → HNO 3 → फ़े (सं।) 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) होमवर्क:
कैल्शियम से कैल्शियम कार्बोनेट के क्रमिक संक्रमण को चार्ट करें और दवा में किसी भी नमक के उपयोग पर एक रिपोर्ट तैयार करें (अतिरिक्त साहित्य का उपयोग करके)।

धातुओं के बीच, दो प्रकार की पंक्तियों को प्रतिष्ठित किया जा सकता है: 1. आनुवंशिक श्रृंखला, जिसमें क्षार एक आधार के रूप में कार्य करता है। इस श्रृंखला को निम्नलिखित परिवर्तनों द्वारा दर्शाया जा सकता है: धातु-- मूल ऑक्साइड - क्षार - नमक, उदाहरण के लिए, पोटेशियम K - K 2 O - KOH - KCl की आनुवंशिक श्रृंखला।

2. एक आनुवंशिक श्रृंखला, जहां एक अघुलनशील आधार एक आधार के रूप में कार्य करता है, तो श्रृंखला को परिवर्तनों की श्रृंखला के रूप में दर्शाया जा सकता है: धातु - मूल ऑक्साइड - नमक - अघुलनशील आधार - मूल ऑक्साइड - धातु। Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu आनुवंशिक श्रृंखला तांबे की "\u003e Cu तांबे की एक आनुवंशिक श्रृंखला है"\u003e "शीर्षक =" (! LANG: 2. आनुवंशिक श्रृंखला, जहां आधार एक अघुलनशील आधार है, फिर श्रृंखला को परिवर्तनों की एक श्रृंखला के रूप में दर्शाया जा सकता है: धातु - बेस ऑक्साइड - नमक - अघुलनशील आधार-- मूल ऑक्साइड धातु है। Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. एक आनुवंशिक श्रृंखला, जहां एक अघुलनशील आधार एक आधार के रूप में कार्य करता है, तो श्रृंखला को परिवर्तनों की श्रृंखला के रूप में दर्शाया जा सकता है: धातु - मूल ऑक्साइड - नमक - अघुलनशील आधार - मूल ऑक्साइड - धातु। Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
गैर-धातुओं के बीच दो प्रकार की पंक्तियों को अलग करना भी संभव है: 1. गैर-धातुओं की आनुवंशिक श्रृंखला, जहां घुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है। परिवर्तनों की श्रृंखला को निम्नानुसार दर्शाया जा सकता है: गैर-धातु - एसिड ऑक्साइड - घुलनशील एसिड - -सोल। पी-- पी 2 ओ 5 - एच 3 पीओ 4 - ना 3 पीओ 4. फॉस्फोरस जेनेटिक रेंज

अकार्बनिक यौगिकों के वर्गों के बीच एक आनुवंशिक लिंक है। सरल पदार्थों से आप जटिल और इसके विपरीत प्राप्त कर सकते हैं। एक वर्ग के यौगिकों से, आप दूसरे वर्ग के यौगिक प्राप्त कर सकते हैं।
अकार्बनिक यौगिकों की कक्षाओं के बीच सरलीकृत आनुवंशिक संबंध निम्न योजना द्वारा दर्शाए जा सकते हैं:
गैर-धातुओं के लिए ऐसे परिवर्तनों के अनुक्रम को निम्नलिखित योजना द्वारा दर्शाया जा सकता है: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(सौन) ३ पीओ ४
विशिष्ट धातुओं के लिए आप परिवर्तनों की निम्नलिखित श्रृंखला बना सकते हैं:
बा → बाओ → बा (ओएच) २ → बाओ ४
उन धातुओं के लिए जिनके ऑक्साइड और हाइड्रॉक्साइड्स एम्फ़ोटेरिक (सेमीमेटल्स) हैं, निम्नलिखित परिवर्तन किए जा सकते हैं:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3।
कक्षाओं के बीच लिंक:
1. धातु, अधातु→ नमक।
धातुओं और गैर-धातुओं की सीधी बातचीत के साथ, ऑक्सीजन-मुक्त एसिड (हलाइड्स, सल्फाइड) के लवण बनते हैं:
2Na + C1 2 = 2NaCl
ये यौगिक स्थिर होते हैं और गर्म होने पर विघटित नहीं होते हैं।
2. मूल ऑक्साइड, एसिड ऑक्साइड→ नमक।
सीएओ + सीओ 2 = सीएसीओ 3;
ना २ ओ + एसओ ३ = ना २ एसओ ४।
3. बेस, एसिड→ नमक।
यह एक बेअसर प्रतिक्रिया के माध्यम से किया जाता है:
2NOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
हे - + एच + → एच 2 ओ;
Mg (OH) 2 + 2HC1 = MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O
4. धातु→ बुनियादी ऑक्साइड।
अधिकांश धातुएं आक्साइड बनाने के लिए ऑक्सीजन के साथ सहभागिता करती हैं:
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3।
सोना, चांदी, प्लैटिनम और अन्य महान धातु ऑक्सीजन के साथ बातचीत नहीं करते हैं, ऐसे धातुओं के ऑक्साइड अप्रत्यक्ष रूप से प्राप्त होते हैं।
5. अधातु→ एसिड ऑक्साइड।
गैर-धातु (हैलोजेन और नोबल गैसों के अपवाद के साथ) ऑक्सीजन के साथ बातचीत करते हैं, ऑक्साइड बनाते हैं:
4P + 5O 2 = 2P 2 O 5;
एस + ओ 2 = एसओ 2।
6. मूल ऑक्साइड→ आधार।
पानी के साथ सीधा संपर्क क्षार और क्षारीय-पृथ्वी धातुओं (क्षार) के केवल हाइड्रॉक्साइड प्राप्त किया जा सकता है:
ना 2 ओ + एच 2 ओ = 2 नोहा;
काओ + एच 2 ओ = सीए (ओएच) 2।
शेष आधार अप्रत्यक्ष रूप से प्राप्त होते हैं।
7. एसिड ऑक्साइड→ एसिड।
एसिड आक्साइड पानी के साथ प्रतिक्रिया करके अम्ल बनाता है:
एसओ 3 + एच 2 ओ = एच 2 एसओ 4;
आर 2 ओ 5 + 3 एच 2 ओ = 2 एच 3 पीओ 4।
अपवाद SiO 2 है, जो पानी के साथ प्रतिक्रिया नहीं करता है।
8. गैस, एसिड ऑक्साइड→ नमक।
क्षार अम्लीय आक्साइड के साथ मिलकर लवण बनाते हैं:
2NOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + एसओ 3 = एसओ 4 2- + एच 2 ओ;
Ca (OH) 2 + СO 2 = CaCO 3 Н + Н 2 O,
सीए 2+ + 2 एचओ + + सीओ 2 → सीएसीओ 3 O + एच 2 ओ।
9. अम्ल, मूल आक्साइड→ नमक।
धातु ऑक्साइड एसिड में घुलते हैं, लवण बनाते हैं:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HCl = 2NaCl + H 2 O,
ना 2 ओ + 2 एच + = 2 एन + + एच 2 ओ।
10. मैदान→ बुनियादी ऑक्साइड।
अघुलनशील ठिकानों और LiOH के गर्म होने पर विघटित होते हैं:
2 एलआईओएच = ली 2 ओ + एच 2 ओ;
Cu (OH) 2 = CuO + H 2 O
11. अम्ल→ एसिड ऑक्साइड।
अस्थिर ऑक्सीजन युक्त एसिड गर्म होने पर विघटित हो जाता है (H 2 SiO 3) और यहां तक कि बिना गर्म किए (H 2 CO 3, HCl3)। इसी समय, कई एसिड गर्मी (एच 2 एसओ 4, एच 3 पीओ 4) के प्रतिरोधी हैं।
H 2 SiO 3 = H 2 O + SiO 2;
एच 2 सीओ 3 = एच 2 ओ + सीओ 2।
12. धातु ऑक्साइड→ धातुओं।
कुछ भारी धातु ऑक्साइड धातु और ऑक्सीजन को विघटित कर सकते हैं:
2HgO = 2Hg + O 2।
इसके अलावा, धातुओं को कम करने वाले एजेंटों की मदद से संबंधित ऑक्साइड से प्राप्त किया जाता है:
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3;
फे 2 ओ 3 + 3 एच 2 = 2 एफ + 3 एच 2 ओ।
13. एसिड ऑक्साइड→ गैर धातु।
अधिकांश गैर-धातु ऑक्साइड गर्म होने पर विघटित नहीं होते हैं। गैर-धातु और ऑक्सीजन केवल कुछ अस्थिर ऑक्साइड (हलोजन ऑक्साइड) का विघटन करते हैं।
कुछ गैर-धातुओं को संबंधित आक्साइड से कमी करके प्राप्त किया जाता है:
SiO 2 + 2Mg = 2MgO + Si।
14. लवण, क्षार → आधार।
अघुलनशील क्षार इसी अम्लों के विलयन पर क्षार की क्रिया द्वारा प्राप्त होते हैं:
CuSO 4 + 2NOH = Cu (OH) 2 Na + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 OH;
FeCl 2 + 2KOH = Fe (OH) 2 2K + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 OH।
15. लवण, अम्ल → अम्ल।
घुलनशील लवण एसिड के साथ प्रतिक्रिया करते हैं (दबाव श्रृंखला के अनुसार) यदि परिणाम एक कमजोर या अस्थिर एसिड है:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 3,
SiO 3 2- + 2H + → H 2 SiO 3 2;
NaCl (TV) + H 2 SO 4 (k) = NaHSO 4 + HCl।
16. साल्ट→ बुनियादी ऑक्साइड, एसिड ऑक्साइड।
कुछ ऑक्सीजन युक्त एसिड (नाइट्रेट, कार्बोनेट) के लवण गर्म होने पर विघटित हो जाते हैं:
सीएसीओ 3 = सीएओ + सीओ 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2।
टॉपिक पर काम करता है टॉपिक पर काम करता है "इनरोलॉजिकल कम्पोनेंट्स का सामान्य संबंध
1. नीचे सूचीबद्ध पदार्थों को नाम दें, उन्हें अकार्बनिक यौगिकों की कक्षाओं में वितरित करें: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 ओ 7, फे (ओएच) 2, पी 2 ओ 5, एचएफ, एमएनओ 2।
2. नीचे सूचीबद्ध पदार्थों से एक चरण में हाइड्रॉक्साइड (अम्ल या क्षार) प्राप्त करना संभव है: तांबा, आयरन ऑक्साइड (P), बेरियम ऑक्साइड, नाइट्रोजन ऑक्साइड (P), नाइट्रोजन ऑक्साइड (V), सिलिकॉन ऑक्साइड, कॉपर सल्फेट, पोटेशियम क्लोराइड , पोटेशियम, मैग्नीशियम कार्बोनेट।
3. उपरोक्त सूची से संबंधित पदार्थों के सूत्र नीचे लिखें: 1) ऑक्साइड; 2) मैदान; 3) एसिड; 4) लवण:
CO 2, NaOH, HCl, SO 3, CuSO 4, NaNO 3, KCl, H 2 SO 4, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3।
4. पदार्थों के नाम: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MIOO 4) ) 2, सीओ, एचआई। संकेत दें कि प्रत्येक पदार्थ किस वर्ग का है।
5. निम्नलिखित पदार्थों के आणविक सूत्र लिखिए और बताइए कि प्रत्येक पदार्थ किस वर्ग का है:
1) तांबा (II) हाइड्रोक्साइड कार्बोनेट;
2) नाइट्रोजन ऑक्साइड (वी);
3) निकल (II) हाइड्रॉक्साइड;
4) बेरियम हाइड्रोजन फॉस्फेट;
5) पेरोक्लोरिक एसिड;
6) क्रोमियम (III) हाइड्रोक्साइड;
7) पोटेशियम क्लोरेट;
8) हाइड्रोजन सल्फाइड एसिड;
९) सोडियम जिंक।
6. कनेक्शन के बीच प्रतिक्रियाओं का उदाहरण दें:
1) सरल पदार्थ-गैर-धातु;
2) सरल पदार्थ और ऑक्साइड;
3) ऑक्साइड;
4) जटिल पदार्थ जो ऑक्साइड नहीं हैं;
5) धातु और गैर-धातु;
6) तीन पदार्थ।
7. निम्नलिखित में से कौन सा पदार्थ प्रतिक्रिया कर सकता है:
1) कार्बन मोनोऑक्साइड (IV): HCl, O 2, NO 2, KOH, H 2 O;
2) मैग्नीशियम ऑक्साइड: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) लोहा (II) हाइड्रॉक्साइड: KCl, HCl, KOH, O 2, H 2 O, HNO 3;
4) हाइड्रोजन क्लोराइड: Zn, MgO, ZnCl 2, HNO 3, Ca (OH) 2, Cu, (ZnOH) Cl।
8. क्या निम्नलिखित पदार्थों के बीच बातचीत संभव है?
1) कार्बन मोनोऑक्साइड (IV) और पोटेशियम हाइड्रॉक्साइड;
2) पोटेशियम हाइड्रोसल्फेट और कैल्शियम हाइड्रॉक्साइड;
3) कैल्शियम फॉस्फेट और सल्फ्यूरिक एसिड;
4) कैल्शियम हाइड्रॉक्साइड और सल्फर ऑक्साइड (IV);
5) सल्फ्यूरिक एसिड और पोटेशियम हाइड्रॉक्साइड;
6) कैल्शियम बाइकार्बोनेट और फॉस्फोरिक एसिड;
7) सिलिका और सल्फ्यूरिक एसिड;
8) जिंक ऑक्साइड और फॉस्फोरस ऑक्साइड (V)।
समीकरण लिखिए संभव प्रतिक्रियाएंउन स्थितियों को निर्दिष्ट करें जिनमें वे होते हैं। यदि प्रतिक्रियाएं विभिन्न पदार्थों को जन्म दे सकती हैं, तो इंगित करें कि उनके आचरण की स्थितियों में क्या अंतर है।
9. निम्नलिखित पदार्थों को प्राप्त करने के लिए प्रतिक्रियाओं के समीकरण दें: सोडियम ऑर्थोफोस्फेट (4 तरीके), पोटेशियम सल्फेट (7 तरीके), जस्ता हाइड्रॉक्साइड।
10. सोडा (सोडियम कार्बोनेट) के उत्पादन के लिए तरीकों में से एक सोडियम एल्यूमिनेट पर पानी और कार्बन मोनोऑक्साइड (IV) की क्रिया है। प्रतिक्रिया समीकरण बनाएं।
11. वह गुणांक को बदल रहा है, प्रतिक्रिया उत्पादों को लिखें:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + बा (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NOH →
5) पी 2 ओ 5 + 6NOH →
6) P 2 O 5 + 2NOH →
12. विभिन्न प्रकार के लवण प्राप्त करने के लिए प्रतिक्रियाओं के समीकरण बनाएं:
1) एसओ 2 + बा (ओएच) 2 → (मध्यम और एसिड लवण),
2) A1 2 O 3 + H 2 O + HNO 3 → (मध्यम नमक, मूल लवण),
3) ना 2 ओ + एच 2 एस → (मध्यम और एसिड लवण),
4) एसओ 3 + सा (ओएच) 2 → (मध्यम और मूल लवण),
5) काओ + एच 2 ओ + पी 2 ओ 5 → (मूल नमक, एसिड लवण)।
13. प्रतिक्रिया समीकरणों को पूरा करें:
काओ + ए 1 2 ओ 3 → सीएएचपीओ 4 + सीए (ओएच) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
ए 1 2 ओ 3 + एचसीएलओ 4 → सीए (एचसीओ 3) 2 + एचसीएल →
Mn 2 O 7 + KOH → ZnS + H 2 S →
सं 2 + सीए (ओएच) 2 → सीएएसओ 4 + एच 2 एसओ 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (अपर्याप्त) →
AlCl 3 + NaOH (कमी) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (अधिक) →
AlC1 3 + NaOH (अधिकता) → Ca (AlO 2) 2 + HCl (अधिकता) →
14. प्रतिक्रिया समीकरणों को लिखें, जिनकी मदद से निम्नलिखित परिवर्तन किए जा सकते हैं:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgO 4
5) सीए → सीएओ → सीए (ओएच) 2 → सीएसीओ 3 → सीए (एचसीओ 3) 2 → सीओ 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NarrO 2 → Cr 2 O 3 + K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) अल → अल 2 ओ 3 → अल 2 (एसओ 4) 3 → अल (एचएसओ 4) 3 → अल (ओएच) 3 → डी।
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) सीएओ → सीए (ओएच) 2 → सीए (एनओ 3) 2 → सीए (एनओ 2) 2 → हनो 2 → नाओनो 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) एसओ 2 → एच 2 एसओ 3 → केएचएसओ 3 → के 2 एसओ 3 → केएचएसओ 3 → एसओ 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) → → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 + K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → अल (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → ORC1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → अल (OH) 3 → Z2Cl 2 →
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZOO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) एल्युमिनियम सल्फेट → एल्युमिनियम क्लोराइड → एल्युमिनियम नाइट्रेट → एल्युमिनियम ऑक्साइड → पोटैशियम एलुमिनियम → एल्युमिनियम हाइड्रोक्साइड → एल्युमिनियम हाइड्रोक्साइड → एल्युमिनियम क्लोराइड।
41) ना → नाओह → ना ३ पीओ ४ → नानो ३ → ह्नो ३ → एन २ ओ ५
42) BaCO 3 → बा (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaCO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) बेरियम → बेरियम हाइड्रोक्साइड → बेरियम बाइकार्बोनेट → बेरियम क्लोराइड → बेरियम कार्बोनेट → बेरियम क्लोराइड → बेरियम हाइड्रोक्साइड
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) एस → एसओ 2 → के 2 एसओ 3 → केएचएसओ 3 → के 2 एसओ 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) केटी 2 ओ 5 → एच 3 पीओ 4 → सीएएचपीओ 4 → सीए (एच 2 पीओ 4) 2 → सीए 3 (पीओ 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
५ ९) केएचएसओ ३ → सीएएसओ ३ → सीए (एचएसओ ३) २ → एसओ २ → के २ एसओ ४
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) अल → अलक्ले 3 → अल (ओएच) 3 → ए 1 2 ओ 3 → अल (ओएच) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) अल → अल (ओएच) 3 → ए 1 2 (एसओ 4) 3 → ए 1 2 ओ 3 → अल (ओएच) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) ना 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) अल → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) एनएच 3 → एनएच 4 सी 1 → एनएच 3 O एच 2 ओ → एनएच 4 एचसीओ 3 → एनएच 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) कोह → केएचसीओ 3 → के 2 सीओ 3 → सीओ 2 → सीए (एचसीओ 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) एच 3 पीओ 4 → एनएच 4 एच 2 पीओ 4 → (एनएच 4) 2 एचपीओ 4 → ना 3 पीओ 4 → सीए 3 (पीओ 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) सीए → सीए (ओएच) 2 → सीए (एचसीओ 3) 2 → सीएओ → सीएसीएल 2
125) एनएच 3 2 एच 2 ओ → एनएच 4 सी 1 → एनएच 3 → एनएच 4 एचसीओ 3 → (एनएच 4) 2 सीओ 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 CO H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) अल (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
टॉपिक पर "मुख्य घटक के मुख्य वर्ग"
अनुभव १।उदासीनता प्रतिक्रियाएँ।
क) एक मजबूत एसिड और एक मजबूत आधार की बातचीत।
एक चीनी मिट्टी के बरतन पकवान में 2 एन हाइड्रोक्लोरिक एसिड समाधान के 5 मिलीलीटर डालो और इसे करने के लिए 2 एन सोडियम हाइड्रोक्साइड समाधान dropwise जोड़ें। एक कांच की छड़ के साथ समाधान हिलाओ और लिटमस पर इसके प्रभाव का परीक्षण करें, लिटमस परीक्षण के समाधान की एक बूंद को स्थानांतरित करें। तटस्थ प्रतिक्रिया प्राप्त करना आवश्यक है (नीला और लाल लिटमस पेपर रंग नहीं बदलता है)। सूखापन के परिणामस्वरूप समाधान को भाप दें। क्या गठन हुआ था? आणविक और आयनिक प्रतिक्रिया समीकरण लिखिए।
बी) एक कमजोर एसिड और एक मजबूत आधार की बातचीत।
एक ट्यूब में एक क्षारीय समाधान के 2 मिलीलीटर डालो और समाधान तटस्थ होने तक एसिटिक एसिड का एक समाधान जोड़ें। आणविक और आयनिक प्रतिक्रिया समीकरण लिखिए। बताएं कि संतुलन आयन प्रतिक्रिया, जिसमें एक कमजोर इलेक्ट्रोलाइट (एसिटिक एसिड) भाग लेता है, पानी के अणुओं के गठन की ओर बढ़ जाता है।
अनुभव २। एम्फ़ोटेरिक हाइड्रॉक्साइड्स।
प्रयोगशाला में उपलब्ध अभिकर्मकों से, जस्ता हाइड्रोक्साइड का एक अवक्षेप प्राप्त करते हैं। प्राप्त अवक्षेप को हिलाएं और इसकी छोटी मात्रा को 2 ट्यूबों में डालें। एक घोल में हाइड्रोक्लोरिक एसिड घोल मिलाएं, दूसरे में - सोडियम हाइड्रोक्साइड घोल (अतिरिक्त)। क्या मनाया जाता है? आणविक और आयनिक रूप में संबंधित प्रतिक्रियाओं के समीकरण लिखिए।
अनुभव ३।नमक के रासायनिक गुण।
a) विरल रूप से घुलनशील पदार्थ के निर्माण के साथ नमक के घोल की पारस्परिक क्रिया।
ट्यूब में सोडियम कार्बोनेट समाधान के 2 मिलीलीटर डालो और एक सफेद अवक्षेप बनने तक बेरियम क्लोराइड समाधान जोड़ें। रासायनिक प्रतिक्रिया समीकरण को आयनिक और आणविक रूप में लिखें। अवक्षेप दो भागों में विभाजित है। एक ट्यूब में सल्फ्यूरिक एसिड का घोल डालें, और दूसरे में सोडियम हाइड्रोक्साइड। एसिड और क्षार में अवक्षेप की घुलनशीलता के बारे में एक निष्कर्ष निकालें।
ख) एक वाष्पशील यौगिक बनाने के लिए एसिड के साथ नमक समाधान की सहभागिता।
ट्यूब में सोडियम कार्बोनेट समाधान के 2 मिलीलीटर डालो और हाइड्रोक्लोरिक एसिड समाधान की एक छोटी मात्रा जोड़ें। क्या मनाया जाता है? आयनिक और आणविक रूप में रासायनिक प्रतिक्रिया समीकरण लिखें।
ग) वाष्पशील यौगिक के गठन के साथ क्षार के साथ नमक के समाधान की सहभागिता।
ट्यूब में कुछ अमोनियम नमक का एक छोटा सा घोल डालें, उबलते हुए सोडियम हाइड्रॉक्साइड घोल की 1-2 मिलीलीटर मात्रा डालें। एक गीला लाल लिटमस परीक्षण करने के लिए प्रतिक्रिया मिश्रण के साथ एक परखनली में। क्या मनाया जाता है? स्पष्टीकरण दें। प्रतिक्रिया समीकरण लिखें।
जी ) नमक का हिस्सा होने वाली धातु की तुलना में अधिक सक्रिय धातुओं के साथ लवण की सहभागिता।
ठीक सैंडपेपर के साथ लोहे (स्टील) नाखून को साफ करें। फिर इसे कॉपर सल्फेट के घोल में डुबोएं। कुछ समय बाद, नाखून की सतह पर तांबे की रिहाई का निरीक्षण करें। आयनिक और आणविक रूप में संबंधित प्रतिक्रिया समीकरण लिखें।
अनुभव ४।मूल और अम्लीय लवण प्राप्त करना।
a) लेड हाइड्रॉक्सोकार्बोनेट की तैयारी।
लीड (II) एसीटेट घोल में थोड़ा सा लेड (II) ऑक्साइड मिलाएं और मिश्रण को कुछ मिनटों तक उबालें। ठंडा समाधान तलछट से निकल जाता है और कार्बन डाइऑक्साइड की एक धारा इसके माध्यम से पारित हो जाती है। क्या मनाया जाता है? फिल्टर पेपर की चादरों के बीच अवक्षेप को छानें और सुखाएं। लीड हाइड्रॉक्सोकार्बोनेट के परिणामस्वरूप अवक्षेप के रंग और प्रकृति को चिह्नित करें। प्रतिक्रिया समीकरण लिखें। प्राप्त नमक का एक ग्राफिक फॉर्मूला बनाएं।
बी) मैग्नीशियम बाइकार्बोनेट की तैयारी।
कुछ मैग्नीशियम नमक के बहुत अधिक पतला समाधान में सोडियम कार्बोनेट का एक छोटा सा समाधान जोड़ें। कौन सा पदार्थ अवक्षेपित करता है? कार्बन डाइऑक्साइड के साथ तलछट के साथ संतृप्त समाधान। अवक्षेप के क्रमिक विघटन का निरीक्षण करें। ऐसा क्यों हो रहा है? प्रतिक्रिया समीकरण लिखें।
अनुभव ५।जटिल नमक मिल रहा है।
a) जटिल cation के साथ यौगिकों का निर्माण।
कॉपर (II) क्लोराइड घोल के 2-3 मिलीलीटर के साथ एक ट्यूब में अमोनिया ड्रॉपवाइज का घोल डालें, जब तक कि कॉपर (II) हाइड्रॉक्साइड अवक्षेपित नहीं हो जाता, और तब तक अमोनिया के घोल में अतिरिक्त घोल डालें। परिणामी समाधान के रंग के साथ आयनों सी 2+ के रंग की तुलना करें। किस आयन की उपस्थिति रंग के समाधान का कारण बनती है? जटिल यौगिक प्राप्त करने के लिए प्रतिक्रिया समीकरण लिखिए।
बी) एक जटिल आयनों के साथ यौगिकों का गठन।
पारा के 1-2 मिलीलीटर (II) नाइट्रेट के घोल में ड्रॉपवाइज पोटैशियम आयोडाइड का पतला घोल मिला कर HgI 2 का एक अवक्षेप तैयार करें। तब तक पोटेशियम आयोडाइड घोल की एक अतिरिक्त मात्रा डालें जब तक कि अवक्षेप भंग न हो जाए। एक जटिल नमक प्राप्त करने की प्रतिक्रियाओं को लिखें।
अनुभव 6।डबल साल्ट (पोटेशियम फिटकरी) तैयार करना।
इस उद्देश्य के लिए पर्याप्त रूप से बड़े चीनी मिट्टी के बरतन कप लेते हुए, अल 2 (SO 4) 3 ∙ 18H 2 O का 7.5 ग्राम वजन और 50 मिली पानी में घोलें। प्रतिक्रिया समीकरण की गणना करें और प्रतिक्रिया के लिए आवश्यक पोटेशियम सल्फेट के द्रव्यमान का वजन करें। पोटेशियम सल्फेट का एक गर्म संतृप्त समाधान तैयार करें और इसे सरगर्मी करते हुए एल्यूमीनियम सल्फेट के समाधान के साथ एक चीनी मिट्टी के बरतन पकवान में डालें। पोटेशियम फिटकरी के क्रिस्टल के नुकसान के थोड़ी देर बाद निरीक्षण करें। ठंडा करने और क्रिस्टलीकरण करने के बाद, माँ शराब को बंद करें, फ़िल्टर पेपर की चादरों के बीच फिटकिरी के क्रिस्टल को सूखें और परिणामस्वरूप क्रिस्टल का वजन करें। उपज प्रतिशत की गणना करें।
SETTLEMENT TASKS
1. तांबे के 16 ग्राम (II) सल्फेट के घोल से हाइड्रोजन सल्फाइड की अधिकता को पार करके, 1.92 ग्राम अवक्षेप प्राप्त किया गया। उपयोग किए गए घोल में कॉपर सल्फेट के बड़े अंश और उपभोग किए गए हाइड्रोजन सल्फाइड की मात्रा का पता लगाएं।
2. तांबे के 291 सेमी 3 से सल्फाइड के रूप में तांबे की पूरी वर्षा के लिए (II) सल्फेट समाधान 10% के बड़े पैमाने के साथ, 17.6 ग्राम लोहे (II) सल्फाइड के साथ हाइड्रोक्लोरिक एसिड की अधिकता से प्रतिक्रिया करके प्राप्त गैस का उपयोग किया गया था। मूल कॉपर सल्फेट घोल का घनत्व ज्ञात कीजिए।
3. पतला सल्फ्यूरिक एसिड के साथ के 2 एस समाधान की बातचीत के दौरान जारी गैस को सीसा (II) नाइट्रेट समाधान की अधिकता से पारित किया जाता है। परिणामी अवशेष में द्रव्यमान 71.7 ग्राम है। सल्फ्यूरिक एसिड के अभिकारित विलयन का आयतन ज्ञात करें, यदि इसका घनत्व 1.176 g / cm 3 है, और द्रव्यमान अंश 25% है।
4. कॉपर (II) सल्फेट युक्त 8 ग्राम के घोल में 4.68 ग्राम सोडियम सल्फाइड युक्त घोल डाला गया। अवक्षेप को फ़िल्टर्ड किया गया था, छानना वाष्पित हो गया था। वाष्पीकरण के बाद छानने में पदार्थों के द्रव्यमान का निर्धारण करें और तांबा सल्फाइड के द्रव्यमान का वेग।
5. कुछ लोहे (II) सल्फाइड का इलाज हाइड्रोक्लोरिक एसिड की अधिकता से किया गया था। 25% के बड़े अंश के साथ NaOH समाधान के 12.5 सेमी 3 के साथ प्रतिक्रिया में परिणामी गैस और 1.28 ग्राम / सेमी 3 के घनत्व ने एक एसिड नमक का गठन किया। लोहे के मूल सल्फाइड का द्रव्यमान ज्ञात कीजिए।
6. 176 ग्राम वजन वाले आयरन (II) सल्फाइड का इलाज हाइड्रोक्लोरिक एसिड की अधिकता से किया गया था, और परिणामस्वरूप गैस को अतिरिक्त हवा में जला दिया गया था। 40% के एक बड़े अंश और 1.4 g / cm 3 के घनत्व के साथ KOH समाधान की किस मात्रा को दहन से उत्पन्न गैस को पूरी तरह से बेअसर करने की आवश्यकता है?
7. जब तकनीकी जीराइट के 100 ग्राम को भूनते हैं, तो उन्होंने एक गैस प्राप्त की, जो 25% के बड़े अंश के साथ NaOH समाधान के 400 सेमी 3 को पूरी तरह से बेअसर कर देती है और 1.28 ग्राम / सेमी 3 का घनत्व होता है। पाइराइट में अशुद्धियों के द्रव्यमान अंश का निर्धारण करें।
8. लोहे, लोहे के ऑक्साइड (II) और आयरन ऑक्साइड (III) के मिश्रण के 2 ग्राम को HC1 समाधान के 16 सेमी 3 को 20% के बड़े पैमाने पर अंश और 1.09 ग्राम / सेमी 3 के घनत्व के साथ जोड़ा गया था। अतिरिक्त एसिड को बेअसर करने के लिए, यह NaOH समाधान के 10.8 सेमी 3 को 1.05 ग्राम / सेमी 3 के 10% घनत्व के एक बड़े अंश के साथ ले गया। मिश्रण में पदार्थों के द्रव्यमान का पता लगाएं यदि जारी हाइड्रोजन की मात्रा 224 सेमी 3 (एनयू) है।
9. 10.5 ग्राम के द्रव्यमान के साथ Ca (OH) 2, CaCO 3 और BaSO 4 का मिश्रण होता है। जब मिश्रण को अतिरिक्त हाइड्रोक्लोरिक एसिड के साथ इलाज किया गया था, तो गैस के 672 सेमी 3 (IU) को छोड़ा गया था, और एक द्रव्यमान के साथ एसिड का 71.2 ग्राम प्रतिक्रिया व्यक्त की गई थी। 10% की हिस्सेदारी। मिश्रण में पदार्थों का द्रव्यमान निर्धारित करें।
10. बेरियम क्लोराइड, कैल्शियम कार्बोनेट और सोडियम बाइकार्बोनेट का मिश्रण है। जब इस मिश्रण के 10 ग्राम को पानी में घोल दिया जाता है, तो अघुलनशील अवशेष 3.5 ग्राम के बराबर होता है। प्रारंभिक मिश्रण के 20 ग्राम को शांत करने पर, इसका द्रव्यमान 5.2 ग्राम कम हो जाता है। प्रारंभिक मिश्रण में पदार्थों के द्रव्यमान अंशों का पता लगाएं।
11. इसमें सल्फ्यूरिक और नाइट्रिक एसिड दोनों युक्त घोल होता है। इस समाधान के 10 ग्राम को पूरी तरह से बेअसर करने के लिए, KOH समाधान के 12.5 सेमी 3 को 19% के बड़े पैमाने पर और 1.18 ग्राम / सेमी 3 के घनत्व के साथ सेवन किया जाता है। जब एसिड के घोल के 20 ग्राम में बेरियम क्लोराइड की अतिरिक्त मात्रा डाली जाती है, तो 4.66 ग्राम अवक्षेप गिर जाता है। मिश्रण में एसिड के द्रव्यमान अंशों का पता लगाएं।
12. केसी 1 और केएनओ 3 के मिश्रण के 100 ग्राम से प्राप्त सभी हाइड्रोजन क्लोराइड, 71.8 सेमी 3 पानी में भंग कर दिया गया था। लवण के समान मिश्रण के 100 ग्राम को शांत करते समय, 93.6 ग्राम ठोस अवशेष रहते हैं। पानी में हाइड्रोजन क्लोराइड के बड़े अंश का पता लगाएं।
13. Ca (OH) 2 के घोल के माध्यम से 2 m 3 हवा (NU) पास करके, कार्बोनिक एसिड नमक का 3 ग्राम प्राप्त किया गया। हवा में CO 2 का आयतन और द्रव्यमान अंश ज्ञात कीजिए।
14. कार्बन डाइऑक्साइड को सीएसीओ 3 के 50 ग्राम वाले निलंबन से गुजारा जाता है। प्रतिक्रिया 8.96 डीएम 3 गैस (एनयू) आई। ठोस चरण में सीएसीओ 3 का द्रव्यमान कितना बचा है?
15. सीएओ में पानी डालते समय, इसका द्रव्यमान 30% बढ़ गया। सीएओ (मास% में) का कौन सा हिस्सा बुझ गया था?
16. हाइड्रोजन की एक धारा में लेड (II) ऑक्साइड का वजन 18.47 ग्राम था। प्रतिक्रिया के बाद, परिणामी सीसा और अप्रयुक्त ऑक्साइड का द्रव्यमान 18.07 ग्राम था। लीड ऑक्साइड का द्रव्यमान क्या प्रतिक्रिया नहीं करता है?
17. कार्बन मोनोऑक्साइड को गर्म होने पर लोहे (III) ऑक्साइड से गुजारा जाता है। प्रतिक्रिया के बाद ठोस अवशेष का द्रव्यमान लोहे के ऑक्साइड के प्रारंभिक द्रव्यमान से 2 ग्राम कम है। सीओ की प्रतिक्रिया की मात्रा क्या है (ऑक्साइड पूरी तरह से कम हो गया है)?
18. हाइड्रोजन 25 के सापेक्ष घनत्व के साथ N 2, CO 2 और SO 2 के मिश्रण का 8.96 dm 3 (NU) है। KOH समाधान की अधिकता से गुजरने के बाद, मिश्रण की मात्रा 4 गुना कम हो गई। मूल मिश्रण में गैसों की मात्रा ज्ञात कीजिए।
19. दो ग्लास में 2.5% के बड़े अंश के साथ 100 ग्राम HC1 घोल है। एक ग्लास में CaCO 3 का 10 ग्राम जोड़ा गया, दूसरे में - MgCO 3 का 8.4 ग्राम। प्रतिक्रिया के बाद चश्मे का द्रव्यमान कैसे अलग होगा?
20. NaOH के 0.1% द्रव्यमान अंश और 1 ग्राम / सेमी 3 के घनत्व के साथ एक घोल के 200 सेमी 3 के माध्यम से सल्फर डाइऑक्साइड की कितनी मात्रा (एनयू) को पारित किया जाना चाहिए?
21. कार्बन डाइऑक्साइड की अधिकतम मात्रा (कार्बन डाइऑक्साइड) 25% 3 Na Na के 25% द्रव्यमान अंश और 1.1 g / cm 3 के घनत्व के साथ 25 सेमी 3 को क्या अवशोषित कर सकती है?
22. 20% केओएच के द्रव्यमान अंश और 1.19 ग्राम / सेमी 3 के घनत्व के साथ समाधान की न्यूनतम मात्रा क्या है जो कार्बन मोनोऑक्साइड के साथ मैग्नेटाइट के 23.2 ग्राम की कमी के साथ उत्पादित सभी कार्बन डाइऑक्साइड को अवशोषित कर सकती है?
23. KOH का न्यूनतम द्रव्यमान क्या है जिसे 24.5 ग्राम ऑर्थोफोस्फोरिक एसिड के साथ प्रतिक्रिया करनी चाहिए ताकि केवल पोटेशियम डाइहाइड्रोजेन फॉस्फेट उत्पाद हो?
24. मध्यम नमक प्राप्त करने के लिए 5% नमक के बड़े अंश के साथ 16% कैल्शियम बाइकार्बोनेट घोल में Ca (OH) 2 का न्यूनतम द्रव्यमान क्या है?
25. एच 3 पीओ 4 के 12.25 ग्राम वाले समाधान में पोटेशियम हाइड्रोजन फॉस्फेट का कितना द्रव्यमान जोड़ा जाना चाहिए ताकि इसके बाद समाधान में केवल पोटेशियम डाइहाइड्रोफॉस्फेट शामिल हो?
26. विलयन में 56.1 ग्राम कैल्शियम और मैग्नीशियम कार्बोनेट का मिश्रण होता है। उन्हें हाइड्रोकार्बन में बदलने के लिए, उन्होंने इथेन के 7 डीएम 3 (एनयू) को जलाकर उत्पादित कार्बन डाइऑक्साइड के सभी खर्च किए। प्रारंभिक मिश्रण में कैल्शियम कार्बोनेट का द्रव्यमान ज्ञात कीजिए।
27. सोडियम हाइड्रो- और डाइहाइड्रोजन फॉस्फेट के मिश्रण के 9.5 ग्राम को मध्यम नमक में परिवर्तित करने के लिए, 27.7% के NaOH के बड़े अंश के साथ घोल का 10 सेमी 3 और 1.3 ग्राम / सेमी 3 का घनत्व आवश्यक है। मिश्रण में हाइड्रोजन फॉस्फेट का द्रव्यमान ज्ञात कीजिए।
28. NaOH के 6 ग्राम वाले समाधान के माध्यम से कार्बन डाइऑक्साइड को पारित करके, एसिड और मध्यम लवण के मिश्रण का 9.5 ग्राम प्राप्त किया गया था। भस्म कार्बन डाइऑक्साइड की मात्रा ज्ञात कीजिए।
29. KOH समाधान के माध्यम से 11.2 डीएम 3 (एनयू) सीओ 2 पास करने के बाद, एसिड और मध्यम लवण के मिश्रण के 57.6 ग्राम प्राप्त किए गए थे। मध्यम नमक का द्रव्यमान ज्ञात कीजिए।
30. डायहाइड्रो के 1.2 ग्राम और सोडियम हाइड्रोजन फॉस्फेट के 4.26 ग्राम प्राप्त करने के लिए ऑर्थोफोस्फोरिक एसिड के किस द्रव्यमान को बेअसर किया जाना चाहिए?
31. NaOH को सल्फ्यूरिक एसिड के घोल में जोड़ा गया और 3.6 ग्राम हाइड्रोसल्फेट और 2.84 ग्राम सोडियम सल्फेट मिला। एसिड और क्षार की रासायनिक मात्रा निर्धारित करते हैं जो प्रतिक्रिया करता है।
32. NaOH समाधान के 200 सेमी 3 के माध्यम से हाइड्रोजन क्लोराइड को 10% के बड़े पैमाने पर और 1.1 ग्राम / सेमी 3 के घनत्व के साथ पारित करने के बाद, परिणामस्वरूप समाधान में NaOH का द्रव्यमान अंश आधे से कम हो गया। परिणामी समाधान में NaCl के बड़े अंश का निर्धारण करें।
33. तांबे और उसके ऑक्साइड (II) के मिश्रण के 14.4 ग्राम को घोलने से 80% HNO 3 द्रव्यमान अंश के साथ 48.5 ग्राम घोल मिलता है। प्रारंभिक मिश्रण में तांबा और ऑक्साइड के द्रव्यमान अंशों का पता लगाएं।
34. 6.2 ग्राम वजन वाले सोडियम ऑक्साइड को पानी के 100 सेमी 3 में भंग कर दिया गया था और समाधान नंबर 1 प्राप्त किया गया था। फिर 10% के बड़े पैमाने पर हाइड्रोक्लोरिक एसिड को इस समाधान में जोड़ा गया था जब तक कि माध्यम तटस्थ नहीं हो जाता, और समाधान नंबर 2 प्राप्त किया गया था। :
1) समाधान नंबर 1, 2 में पदार्थों के द्रव्यमान अंश;
2) समाधान HC1 का द्रव्यमान, जो समाधान नंबर 1 को बेअसर करने के लिए गया था।
35. जस्ता का 3 ग्राम एचसी 1 समाधान के 18.69 सेमी 3 के साथ 14.6% के बड़े पैमाने पर अंश और 1.07 ग्राम / सेमी 3 के घनत्व के साथ बातचीत करता है। गर्म होने पर, परिणामस्वरूप गैस को गर्म CuO के ऊपर 4 जी वजन किया जाता है। तांबे का द्रव्यमान किससे प्राप्त होता है?
36. FeO के ऊपर अतिरिक्त पानी के साथ कैल्शियम हाइड्राइड के उपचार के बाद गैस को छोड़ा गया। नतीजतन, ऑक्साइड का द्रव्यमान 8 ग्राम कम हो गया। पानी के साथ इलाज किए गए सीएएच 2 के द्रव्यमान का पता लगाएं।
37. सीएसीओ 3 नमूने के कैल्सीनेशन के दौरान, इसका द्रव्यमान 35.2% कम हो गया। गैस के 0.112 डीएम 3 (एनयू) प्राप्त करने के लिए ठोस प्रतिक्रिया उत्पादों को हाइड्रोक्लोरिक एसिड की अधिकता में भंग कर दिया गया था। कैल्शियम कार्बोनेट के मूल नमूने के द्रव्यमान का निर्धारण करें।
38. कॉपर नाइट्रेट विघटित हो गया था, और परिणामस्वरूप तांबा (II) ऑक्साइड हाइड्रोजन द्वारा पूरी तरह से कम हो गया था। परिणामी उत्पाद पी 2 ओ 5 के साथ एक ट्यूब से गुजरे, और उसके बाद ट्यूब का द्रव्यमान 3.6 ग्राम बढ़ गया। 88% द्रव्यमान वाले सल्फ्यूरिक एसिड की न्यूनतम मात्रा क्या है और प्रयोग में प्राप्त असंतोष के लिए 1.87 ग्राम / सेमी 3 की घनत्व की आवश्यकता है। तांबा और विघटित नमक का द्रव्यमान क्या है?
39. ऑक्सीजन की अनुपस्थिति में ठंड में KOH समाधान की अधिकता से नाइट्रिक ऑक्साइड (IV) के अवशोषण पर, 40.4 केएनओ 3 प्राप्त हुए। अभी भी कौन सा पदार्थ बनता है और उसका द्रव्यमान क्या है?
40. नमक युक्त एक घोल के 400 ग्राम को बेअसर करने के लिए और सल्फ्यूरिक एसिड, 10% के बड़े पैमाने पर सोडियम हाइड्रॉक्साइड समाधान के 287 सेमी 3 का सेवन किया और 1,115 ग्राम / सेमी 3 का घनत्व। यदि बेरियम क्लोराइड का एक अतिरिक्त समाधान प्रारंभिक समाधान के 100 ग्राम में जोड़ा जाता है, तो 5.825 ग्राम अवक्षेप से बाहर हो जाएगा। प्रारंभिक समाधान में एसिड के द्रव्यमान अंशों का निर्धारण करें।
41. सोडियम हाइड्रोक्साइड के घोल के माध्यम से कार्बन डाइऑक्साइड को पारित करने के बाद, मध्यम और एसिड लवण के मिश्रण का 13.7 ग्राम प्राप्त किया गया था। सोडियम क्लोराइड में बदलने के लिए, 10% के एचसीएल के एक बड़े अंश के साथ 75 ग्राम हाइड्रोक्लोरिक एसिड की आवश्यकता होती है। कार्बन अवशोषित की मात्रा ज्ञात कीजिए।
42. एसिड के समान द्रव्यमान अंशों के साथ 600 ग्राम समाधान के कुल द्रव्यमान के साथ हाइड्रोक्लोरिक और सल्फ्यूरिक एसिड का मिश्रण सोडियम बाइकार्बोनेट की अधिकता के साथ इलाज किया गया था और 32.1 डीएम 3 गैस प्राप्त की गई थी (एन ओ।)। प्रारंभिक मिश्रण में एसिड का द्रव्यमान अंश ज्ञात कीजिए।
43. NaOH समाधान के 1 डीएम 3 को बेअसर करने के लिए, एचएनओ 3 समाधान के 66.66 सेमी 3 को 63% के बड़े पैमाने पर और 1.5 ग्राम / सेमी 3 के घनत्व के साथ सेवन किया गया था। क्षार के समान मात्रा को बेअसर करने के लिए 24.5% द्रव्यमान वाले सल्फ्यूरिक एसिड समाधान की मात्रा और 1.2 g / cm 3 के घनत्व की क्या आवश्यकता होगी?
44. किस अनुपात में सल्फ्यूरिक एसिड का 5% के बड़े अंश और 1.03 ग्राम / सेमी 3 के घनत्व के साथ और बेरियम हाइड्रॉक्साइड के 5% के बड़े पैमाने पर घोल और 1.1 जी / सेमी के घनत्व का एक समाधान पूर्ण निराकरण के लिए लेना चाहिए? एसिड समाधान पर क्षार समाधान की मात्रा के भागफल के रूप में उत्तर की कल्पना करो।
45. 0.9 ग्राम / सेमी 3 की घनत्व और 25% के द्रव्यमान अंश के साथ अमोनिया घोल की न्यूनतम मात्रा की गणना करें, जो कि 0.5% प्राकृतिक चूना पत्थर को कैल्शियम कार्बोनेट के बड़े पैमाने पर 92% के बराबर के साथ कार्बन डाइऑक्साइड के पूर्ण अवशोषण के लिए आवश्यक है।
46. सोडियम हाइड्रॉक्साइड और सोडियम कार्बोनेट के मिश्रण को क्लोराइड के 2.92 ग्राम के पूर्ण रूपांतरण के लिए, हाइड्रोजन क्लोराइड (एनयू) के 1.344 डीएम 3 की आवश्यकता होती है। मिश्रण में सोडियम कार्बोनेट का द्रव्यमान ज्ञात कीजिए।
47. तांबे के 25 ग्राम (II) सल्फेट के घोल के 16% द्रव्यमान अंश के साथ 16% द्रव्यमान वाले सोडियम हाइड्रॉक्साइड घोल की मात्रा को जोड़ा गया। गठित अवक्षेप को फ़िल्टर किया गया था, जिसके बाद छानना क्षारीय था। छानना पूरी तरह से बेअसर करने के लिए, 0.1 mol / dm 3 के घोल एकाग्रता के साथ सल्फ्यूरिक एसिड के एक समाधान के 25 सेमी 3 की आवश्यकता थी। जोड़ा सोडियम हाइड्रॉक्साइड समाधान के द्रव्यमान की गणना करें।
48. 15.2 ग्रा। हाइड्रोजन के 11.8 डीएम 3 (एनयू) की मात्रा के साथ 15.8 ग्राम हाइड्रोजन के द्रव्यमान के साथ CuO की पूर्ण कमी के साथ प्राप्त पदार्थ को केंद्रित सल्फ्यूरिक एसिड में गर्म करके भंग कर दिया गया था। प्रतिक्रिया के परिणामस्वरूप गैस (NU) का कौन सा आयतन छोड़ा गया था?
49. हाइड्रोक्लोरिक एसिड के 50 सेमी 3 के 20% के बड़े पैमाने पर अंश और 1.10 ग्राम / सेमी 3 के घनत्व के साथ पूर्ण विक्षोभ के लिए, 20% के केओएच के बड़े पैमाने पर पोटेशियम हाइड्रॉक्साइड के समाधान का उपयोग किया गया था। परिणामी घोल में निहित पानी की रासायनिक मात्रा क्या है?
50. गर्म कोयले के 0.84 ग्राम से अधिक सीओ 2 से अधिक गुजरने से प्राप्त होने वाली गैस को 14.0 ग्राम गर्म तांबा (II) ऑक्साइड के साथ प्रतिक्रिया के लिए भेजा जाता है। 63% के द्रव्यमान अंश और 1.4 ग्राम / सेमी 3 के घनत्व के साथ नाइट्रिक एसिड के समाधान की मात्रा को अंतिम प्रतिक्रिया में प्राप्त पदार्थ को पूरी तरह से भंग करने की आवश्यकता है?
51. जब तांबे (II) नाइट्रेट के निरंतर द्रव्यमान तक कैलक्लाइंड किया जाता है, तो नमक का द्रव्यमान 6.5 ग्राम कम हो जाता है। नमक का द्रव्यमान किसने विघटित किया था?
52. जब हाइड्रोक्लोरिक एसिड की अधिकता का उपयोग किया गया था, तो अज्ञात मोनोक्वालेंट धातु के साथ एल्यूमीनियम के मिश्रण पर गैस का 6.72 डीएम 3 (एनडब्ल्यू) जारी किया गया था, और मिश्रण का द्रव्यमान आधा कर दिया गया था। जब अवशेषों को तनु नाइट्रिक एसिड के साथ उपचारित किया जाता है, तो 0.373 dm 3 (NU) NO छोड़ा जाता था। अज्ञात धातु की पहचान करें।
53. चाक नमूने का द्रव्यमान 105 ग्राम है, और इसकी संरचना में ऑक्सीजन तत्व की रासायनिक मात्रा 1 मोल है। चाक नमूने में सीएसीओ 3 के द्रव्यमान अंश का निर्धारण करें (ऑक्सीजन केवल कैल्शियम कार्बोनेट की संरचना में शामिल है)।
54. पानी के साथ सल्फर ऑक्साइड (VI) की परस्पर क्रिया में, 25% सल्फ्यूरिक एसिड के एक बड़े अंश के साथ एक समाधान प्राप्त किया गया था। जब इस घोल में बा (OH) 2 की अधिकता डाली गई, तो 29.13 ग्राम का एक उप-भाग जमा किया गया था। एसओ 3 और एच 2 ओ के किस अम्ल को एक अम्ल विलयन के निर्माण पर खर्च किया गया था?
55. जब 16% NaOH के द्रव्यमान अंश के साथ घोल के 200 ग्राम के माध्यम से SO 2 गुजरता है, तो लवण का एक मिश्रण का गठन किया गया था, जिसमें 41.6 ग्राम एसिड नमक शामिल था। वजन से 4.5% अशुद्धियों वाले सल्फर के द्रव्यमान का उपयोग SO 2 प्राप्त करने के लिए किया गया था? मध्यम नमक का वजन कितना है?
56. Na 2 CO 3 समाधान के 50 ग्राम का उपयोग Ca (NO 3) 2 समाधान के 80 ग्राम के साथ प्रतिक्रिया करने के लिए किया गया था। वर्षा को अलग किया गया, जबकि हाइड्रोक्लोरिक एसिड की अधिकता के साथ इसे संसाधित करते हुए, गैस का 2.24 डीएम 3 (एनयू) जारी किया गया था। प्रारंभिक समाधानों में लवण के द्रव्यमान अंश क्या हैं? वेग को अलग करने के बाद समाधान में सोडियम नाइट्रेट का द्रव्यमान अंश क्या है?
57. जब जस्ता सल्फ्यूरिक एसिड के साथ बातचीत करता है, तो एसओ 2 और एच 2 एस के मिश्रण का 10 डीएम 3 (एनयू) 1.51 के आर्गन के सापेक्ष घनत्व के साथ बनता है। जिंक की रासायनिक मात्रा क्या है? गैस मिश्रण में SO 2 का द्रव्यमान अंश क्या है?
58. 11 ग्राम के कुल द्रव्यमान के साथ जस्ता और एल्यूमीनियम चूरा के मिश्रण का एक नमूना क्षार समाधान की एक अतिरिक्त मात्रा में भंग कर दिया गया था। जारी गैस का आयतन (NU) निर्धारित करें, अगर मिश्रण में जिंक का द्रव्यमान अंश 30% है।
59. सोडियम हाइड्रोक्साइड का वजन 4.0 ग्राम एल्युमीनियम हाइड्रॉक्साइड के साथ 9.8 ग्राम होता है। प्राप्त सोडियम मेटाल्यूमिनेट के द्रव्यमान की गणना करें।
60. कॉपर और एल्युमीनियम के मिश्रण के 10 ग्राम प्रसंस्करण पर केंद्रित नाइट्रिक एसिड के साथ कमरे का तापमान जारी 2.24 डीएम 3 गैस (नग)। KOH समाधान की अधिकता के साथ मिश्रण के समान द्रव्यमान को संसाधित करते समय गैस का कौन सा आयतन (NU) छोड़ा जाएगा?
61. 20 ग्राम वजन वाले तांबे और एल्यूमीनियम के एक मिश्र धातु को क्षार की अधिकता के साथ इलाज किया जाता था, केंद्रित नाइट्रिक एसिड में घुलित अवशेषों को भंग कर दिया गया था। प्राप्त नमक को अलग किया गया था, निरंतर वजन तक शांत किया गया था, और ठोस अवशेषों का 8 ग्राम प्राप्त किया गया था। 40% के एक बड़े अंश और 1.4 ग्राम / सेमी 3 के घनत्व के साथ भस्म NaOH समाधान की मात्रा निर्धारित करें।
62. एल्यूमीनियम और धातु ऑक्साइड (II) (गैर-एम्फोटेरिक ऑक्साइड) के मिश्रण का वजन 39 ग्राम था जो एक अतिरिक्त केओएच समाधान के साथ इलाज किया गया था, उत्सर्जित गैस को 27 ग्राम पानी प्राप्त करने के लिए जला दिया गया था। 36.5% के HC1 के बड़े पैमाने और 1.19 ग्राम / सेमी 3 के घनत्व के साथ एक समाधान के 25.2 सेमी 3 में विघटित अवशेषों को पूरी तरह से भंग कर दिया गया था। ऑक्साइड का निर्धारण करें।
63. जस्ता और तांबे के चिप्स के मिश्रण का इलाज KOH समाधान की अधिकता के साथ किया गया था, जबकि 2.24 डीएम 3 (एनयू) की एक गैस जारी की गई थी। धातुओं के एक ही नमूने के पूर्ण क्लोरीनीकरण के लिए, 8.96 डीएम 3 (एनयू) की मात्रा वाले क्लोरीन की आवश्यकता थी। नमूने में जस्ता के द्रव्यमान अंश की गणना करें।
64. 49 ग्राम के द्रव्यमान के साथ लोहे, एल्यूमीनियम और मैग्नीशियम के चूरा का मिश्रण अतिरिक्त पतला एच 2 एसओ 4 के साथ इलाज किया गया था, इस प्रकार 1.95 मोल गैस प्राप्त हुई। 4.9 ग्राम वजन वाले इसी मिश्रण के एक अन्य भाग को क्षार घोल की अधिकता से उपचारित किया गया; गैस का 1.68 dm 3 (NU) प्राप्त किया गया। मिश्रण में धातुओं का द्रव्यमान ज्ञात कीजिए।
65. NaOH के 10 g और ZnCl 2 के 13.6 g युक्त विलयनों को मिलाने पर बनी तलछट का द्रव्यमान क्या है?
66. अल, Mg, Fe, Zn के मिश्रण के दो भाग हैं, दाढ़ रचना में एक ही, प्रत्येक का वजन 7.4 ग्राम है। एक भाग हाइड्रोक्लोरिक एसिड में भंग किया गया था और 3.584 dm 3 गैस (NU) प्राप्त किया गया था, दूसरा क्षार घोल में और। प्राप्त 2.016 डीएम 3 गैस (नग)। यह ज्ञात है कि दोनों मिश्रणों में ए 1 परमाणु प्रति 3 जेड परमाणु हैं। मिश्रण में धातुओं का द्रव्यमान ज्ञात कीजिए।
67. 1 ग्राम तांबा, मैग्नीशियम और एल्यूमीनियम का मिश्रण हाइड्रोक्लोरिक एसिड की अधिकता से इलाज किया गया था। इस घोल को छान लिया गया, NaOH घोल की अधिकता को छानना में मिला दिया गया। परिणामस्वरूप अवक्षेप को अलग कर दिया गया और 0.2 ग्राम के निरंतर द्रव्यमान को शांत कर दिया गया। जिस अवशेष को हाइड्रोक्लोरिक एसिड के साथ उपचार के बाद भंग नहीं किया गया था, उसे हवा में कैलक्लाइंड किया गया था और एक काले पदार्थ का 0.8 ग्राम प्राप्त किया गया था। मिश्रण में एल्यूमीनियम का द्रव्यमान अंश ज्ञात कीजिए।
68. जब ऑक्सीजन की धारा में गर्म किया जाता है, तो जस्ता, मैग्नीशियम और तांबे की एक मिश्र धातु, मिश्रण का द्रव्यमान 9.6 ग्राम बढ़ जाता है। उत्पाद आंशिक रूप से क्षार में भंग हो जाता है, और KOH के 40% के बड़े पैमाने पर अंश के साथ 40 सेमी 3 और 1.4 ग्राम / सेमी के घनत्व के लिए आवश्यक है। 3। मिश्र धातु के समान भाग के साथ प्रतिक्रिया के लिए, 0.7 mol HC1 की आवश्यकता होती है। मिश्र धातु में धातुओं की रासायनिक मात्रा ज्ञात कीजिए।
69. 5 ग्राम वजन वाले तांबे के एक मिश्र धातु को NaOH समाधान की अधिकता के साथ इलाज किया गया था। फिर ठोस अवशेषों को अलग किया गया और केंद्रित एचएनओ 3 के साथ इलाज किया गया, इस प्रकार प्राप्त नमक अलग-थलग हो गया, निरंतर वजन तक शांत हो गया और एक ठोस अवशेष का 2.5 ग्राम प्राप्त हुआ। मिश्र धातु में धातुओं का द्रव्यमान ज्ञात कीजिए।
70. तांबे और एल्यूमीनियम के 12.8 ग्राम वजन के एक मिश्र धातु को हाइड्रोक्लोरिक एसिड की अधिकता के साथ इलाज किया गया था। घुलित अवशेषों को केंद्रित नाइट्रिक एसिड में भंग कर दिया गया था, जिसके परिणामस्वरूप समाधान को वाष्पित किया गया था, सूखे अवशेषों को निरंतर वजन तक शांत किया गया था और 4 जी ठोस प्राप्त किए गए थे। मिश्र धातु में तांबे के द्रव्यमान अंश का निर्धारण करें।
71. किस द्रव्यमान के अनुपात में A1 के दो भाग लेने चाहिए, ताकि एक को क्षार के घोल में और दूसरे को समान मात्रा में हाइड्रोजन को हाइड्रोक्लोरिक एसिड में छोड़ा जाए?
72. जब KOH समाधान की अधिकता के साथ एल्यूमीनियम और तांबे (II) ऑक्साइड के मिश्रण को संसाधित करते हैं, तो गैस का 6.72 डीएम 3 (एनयू) जारी किया गया था, और मिश्रण के समान हिस्से को कमरे के तापमान पर HNO 3 में भंग करके, 75.2 ग्राम नमक प्राप्त किया गया था। पदार्थों के प्रारंभिक मिश्रण का द्रव्यमान ज्ञात कीजिए।
73. नाइओह के 40% द्रव्यमान अंश और 1.43 ग्राम / सेमी 3 के घनत्व के साथ एक समाधान के 139.87 सेमी 3 के साथ एल्यूमीनियम की अधिकता से प्राप्त हाइड्रोजन द्वारा तांबा (II) ऑक्साइड के किस द्रव्यमान को बहाल किया जा सकता है?
74. दो धातुओं के मिश्र धातु के 7.83 ग्राम के पूर्ण ऑक्सीकरण के दौरान, 14.23 ग्राम आक्साइड का गठन किया गया था, जिसके उपचार के दौरान क्षार की एक अतिरिक्त मात्रा 4.03 ग्राम तलछट तक नहीं रही। मिश्रधातु बनाने वाली धातुओं की गुणात्मक संरचना का निर्धारण करें, यदि उनके उद्धरणों में +2 और +3 का ऑक्सीकरण राज्य है, और आक्साइड का मोलर अनुपात 1: 1 है (मान लें कि +3 के ऑक्सीकरण राज्य के साथ एक धातु ऑक्साइड एम्फ़ोटेरिक गुण है)।
75. एक ही द्रव्यमान वाले एल्यूमीनियम के दो हिस्से, भंग हो गए थे: एक पोटेशियम हाइड्रॉक्साइड के घोल में, दूसरा हाइड्रोक्लोरिक एसिड में। विकसित गैसों (नोस) के खंड एक-दूसरे से कैसे संबंधित हैं?
76. एल्यूमीनियम के साथ तांबे के एक मिश्र धातु का वजन 1,000 ग्राम था जिसे क्षार समाधान की अधिकता के साथ इलाज किया गया था, नाइट्रिक एसिड में अनिच्छुक अवक्षेप को भंग कर दिया गया था, फिर समाधान को वाष्पित किया गया था, अवशेषों को निरंतर वजन तक शांत किया गया था। नए अवशेषों का द्रव्यमान 0.398 ग्राम के बराबर है। मिश्र धातु में धातुओं का द्रव्यमान क्या है?
77. 20 ग्राम वजन वाले जस्ता और तांबे के एक मिश्र धातु को 30% के बड़े अंश और 1.33 ग्राम / सेमी 3 के घनत्व के साथ NaOH समाधान की अधिकता के साथ इलाज किया गया था। ठोस अवशेषों को अलग किया गया और HNO 3 के एक केंद्रित समाधान की अधिकता के साथ इलाज किया गया। इस प्रक्रिया के दौरान गठित नमक को पृथक किया गया था और निरंतर द्रव्यमान को शांत किया गया था। ठोस अवशेषों का द्रव्यमान 10.016 ग्राम था। मिश्रधातु में धातुओं के द्रव्यमान अंशों की गणना करें और क्षार की मात्रा का सेवन करें।
78. तांबे और एल्यूमीनियम के 2 ग्राम वजन के एक मिश्र धातु को क्षार विलयन की अधिकता से उपचारित किया जाता था। अवशेषों को फ़िल्टर किया गया, धोया गया, HNO 3 में भंग कर दिया गया, समाधान को वाष्पित किया गया और निरंतर वजन तक शांत किया गया। कैल्सीनेशन के बाद अवशेषों का द्रव्यमान 0.736 ग्राम था। मिश्रधातु में धातुओं के द्रव्यमान अंशों की गणना करें।
79. लोहे, तांबे और एल्यूमीनियम के मिश्रण के क्लोरीनीकरण के लिए क्लोरीन (एनयू) के 8.96 डीएम 3 की आवश्यकता होती है, और हाइड्रोजन क्लोराइड के साथ एक ही नमूने की बातचीत के लिए 5.6 डीएम 3 (एनयू) की आवश्यकता होती है। क्षार के साथ धातुओं के समान द्रव्यमान के साथ बातचीत करते समय, गैस का 1.68 डीएम 3 (एनयू) निकलता है। मिश्रण में धातुओं की रासायनिक मात्रा ज्ञात कीजिए।
80. 5.0 ग्राम वजन वाले पोटेशियम हाइड्राइड को 80 सेमी 3 की मात्रा के साथ पानी में भंग कर दिया गया था और 0.81 ग्राम वजन वाले एल्यूमीनियम को समाधान में पेश किया गया था। परिणामस्वरूप प्रतिशत के सटीकता के साथ प्रतिशत के पदार्थों के द्रव्यमान अंशों का पता लगाएं।
साहित्य की सूची
1. बारनिक, वी.पी. अकार्बनिक यौगिकों के आधुनिक रूसी नामकरण / वी.पी. ऑल-यूनियन केमिकल सोसाइटी के जर्नल बारनिक //। डि मेंडलीव। - 1983. - वॉल्यूम। XXVIII। - पी। 9–16।
2. व्रॉब्ल्वस्की, ए.आई. रसायन विज्ञान के सिम्युलेटर / ए.आई. Wroblewski। - दूसरा संस्करण। पेरेरब। और जोड़ें। - मिन्स्क: कर्सिको-प्रिंट, 2007. - 624 पी।
3. ग्लिंका, एन.एल. सामान्य रसायन विज्ञान में कार्य और अभ्यास: अध्ययन। विश्वविद्यालयों / एड के लिए मैनुअल। वीए राबिनोविच और एच.एम. रुबीना। - एम .: इंटीग्रल-प्रेस, 2004. - 240 पी।
4. लिडिन, आर.ए. सामान्य और अकार्बनिक रसायन विज्ञान में कार्य: अध्ययन। उच्चतर छात्रों के लिए भत्ता। प्रोक। संस्थान / आर.ए. लिडिन, वी.ए. दूध, एल.एल. एंड्रीव; एड द्वारा। आरए Lidin। - एम .: वीएलएडोस, 2004. - 383 पी।
5. लिडिन, आर.ए. अकार्बनिक पदार्थों के मूल तत्व नामकरण / R.А. लिडिन [एट अल।]; एड द्वारा। BD Stepin। - एम ।: रसायन विज्ञान, 1983। - 112 पी।
6. स्टेपिन, बी.डी. रूसी / B.D में अकार्बनिक यौगिकों के नामकरण पर IUPAC नियमों का अनुप्रयोग। स्टेपिन, आर.ए. लिडिन // जर्नल ऑफ ऑल-यूनियन केमिकल सोसाइटी। डि मेंडलीव। - 1983. - वॉल्यूम। XXVIII। - पी। 17–20।
| परिचय ………………………………………………………………………… अकार्बनिक पदार्थों की सीमा के लिए सामान्य नियम ………… .. ऑक्साइड .. …………………………… …………………………………… …… …… ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………। ............................ एम्फ़ोटेरिक ऑक्साइड ……………………………………………………… .. ऑक्साइड प्राप्त करना …………………………………………………………………………………………………………………… ..त्युत पर स्वतंत्र कार्य पर अभ्यास विषय "ऑक्साइड" ... ...................................................................... एसिड ………………………………………………………………। इस विषय पर स्वतंत्र कार्य के लिए अभ्यास "एसिड" ………………………………………………………………………………………………………………………………………………। ……… .. “फ़ाउंडेशन” विषय पर स्वतंत्र कार्य के लिए अभ्यास। ………………………………………………………। लवण …………………………………………………………………… विषय "साल्ट्स" पर स्वतंत्र कार्य के लिए अभ्यास ... ..................................................................................... अकार्बनिक यौगिकों के वर्गों के बीच आनुवंशिक संबंध ... ... ... ... ... ... ... ... …………… .. “अकार्बनिक यौगिकों की कक्षाओं के बीच आनुवंशिक संबंध” विषय पर स्वतंत्र काम के लिए अभ्यास… ………………………………………………………………………… .. विषय पर प्रायोगिक प्रयोगों “……… ..” ……… .. निपटान कार्य ……………………………………………………………………………………………………………………………………………। |
शिक्षा: "आनुवंशिक श्रृंखला" की अवधारणा को ठीक करने के लिए, "आनुवंशिक संबंध"; आनुवंशिक श्रृंखला के अनुरूप प्रतिक्रिया समीकरण बनाने के लिए तत्वों (धातुओं और गैर-धातुओं) की आनुवंशिक श्रृंखला बनाना सिखाने के लिए; जाँचें कि ऑक्साइड, एसिड, लवण, क्षार के रासायनिक गुणों के ज्ञान को कैसे आत्मसात किया जाता है;
विकासशील: विश्लेषण, तुलना, संक्षेप और निष्कर्ष निकालने, रासायनिक प्रतिक्रियाओं के समीकरण बनाने की क्षमता विकसित करना;
शिक्षात्मक : वैज्ञानिक विश्वदृष्टि के गठन को बढ़ावा देना।
2. कक्षाएं प्रदान करना: तालिकाओं "आवधिक प्रणाली", "घुलनशीलता तालिका", "धातु गतिविधि श्रृंखला", छात्रों के लिए निर्देश, ज्ञान के परीक्षण के लिए कार्य।
3. प्रदर्शन का आदेश:
3.1। ललाट सर्वेक्षण।
3.2। कार्यों का हल।
3.3। विकल्पों पर सत्यापन कार्य करें।
4. रिपोर्ट लेआउट:
4.1। व्यावहारिक पाठ के विषय और उद्देश्यों को लिखें।
4.2। रिकॉर्ड समस्या हल करना।
4.3। स्वतंत्र कार्य के अपने स्वयं के संस्करण को हल करें, एक नोटबुक में लिखने और समीक्षा के लिए शिक्षक को पास करने का निर्णय।
कार्य की प्रगति
1. ललाट पर बातचीत:
आनुवंशिक संबंध क्या है?
आनुवंशिक संबंध - ये विभिन्न वर्गों के बीच, उनके अंतर्संबंधों के आधार पर संबंध हैं।
आनुवंशिक श्रृंखला क्या है?
आनुवंशिक पंक्ति पदार्थों के एक नंबर - विभिन्न वर्गों के प्रतिनिधि, जो एक रासायनिक तत्व के यौगिक होते हैं, इंटरकनेक्टर्स द्वारा जुड़े होते हैं और इन पदार्थों के परिवर्तनों को दर्शाते हैं। इन श्रृंखलाओं का आधार एक ही तत्व है।
आमतौर पर किस प्रकार की आनुवंशिक श्रृंखला आवंटित की जाती है?
धातुओं में दो प्रकार की पंक्तियाँ हैं:
a) एक आनुवंशिक श्रृंखला जिसमें क्षार एक आधार के रूप में कार्य करता है। इस श्रृंखला को निम्नलिखित परिवर्तनों का उपयोग करके दर्शाया जा सकता है:
धातु → मूल ऑक्साइड → क्षार → नमक
उदाहरण के लिए, पोटेशियम K → K 2 O → KOH → KCl की आनुवंशिक श्रृंखला
बी) आनुवंशिक श्रृंखला, जहां आधार एक अघुलनशील आधार है, फिर श्रृंखला को परिवर्तनों की श्रृंखला के रूप में दर्शाया जा सकता है:
धातु → बेस ऑक्साइड → नमक → अघुलनशील आधार → बेस ऑक्साइड → धातु
उदाहरण के लिए: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
गैर-धातुओं के बीच दो प्रकार की पंक्तियों को अलग करना भी संभव है:
क) गैर-धातुओं की आनुवंशिक श्रृंखला, जहां घुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है। परिवर्तनों की श्रृंखला को निम्नानुसार दर्शाया जा सकता है: गैर-धातु → एसिड ऑक्साइड → घुलनशील अम्ल → नमक।
उदाहरण के लिए: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
बी) गैर-धातुओं की आनुवंशिक पंक्ति, जहां अघुलनशील एसिड: गैर-धातु → एसिड ऑक्साइड → नमक → एसिड → एसिड ऑक्साइड → गैर-धातु श्रृंखला में एक कड़ी के रूप में कार्य करता है।
उदाहरण के लिए: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
विकल्पों के लिए कार्यों का निष्पादन:
| विकल्प 1 | विकल्प 2 |
|
मैं विकल्प: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
विकल्प II: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
होमवर्क: कैल्शियम से कैल्शियम कार्बोनेट के क्रमिक संक्रमण को चार्ट करें और दवा में किसी भी नमक के उपयोग पर एक रिपोर्ट तैयार करें (अतिरिक्त साहित्य का उपयोग करके)।
व्यावहारिक सबक के लिए निर्देश
अकार्बनिक पदार्थों के मुख्य वर्गों के बीच आनुवंशिक संबंध।
उद्देश्य: "आनुवंशिक श्रृंखला" की अवधारणा को ठीक करने के लिए, "आनुवंशिक संबंध"; आनुवंशिक श्रृंखला के अनुरूप प्रतिक्रिया समीकरण बनाने के लिए तत्वों (धातुओं और गैर-धातुओं) की आनुवंशिक श्रृंखला बनाना सीखें; ऑक्साइड, एसिड, लवण, क्षार के गुणों को दोहराएं।
कार्य की प्रगति
अवधारणाओं की परिभाषाएँ लिखें:
आनुवंशिक संबंध - __________________________________________
आनुवंशिक पंक्ति - ___________________________________________
धातुओं की एक आनुवंशिक श्रृंखला जिसमें क्षार एक आधार के रूप में कार्य करता है। सामान्य रूप से दर्शाया जा सकता है: धातु → मूल ऑक्साइड → क्षार → नमक। पोटेशियम का उपयोग करके इस श्रृंखला को बनाएं। प्रतिक्रिया समीकरण लिखें जिसके साथ आप परिवर्तनों की यह श्रृंखला बना सकते हैं।
गैर-धातुओं की आनुवंशिक श्रृंखला, जहां घुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है निम्नानुसार प्रतिनिधित्व किया जा सकता है: गैर-धातु → एसिड ऑक्साइड → घुलनशील एसिड → नमक। फास्फोरस का उपयोग करके इस श्रृंखला को बनाएं। प्रतिक्रिया समीकरण लिखें जिसके साथ आप परिवर्तनों की यह श्रृंखला बना सकते हैं।
आनुवंशिक पंक्ति, जहां आधार अघुलनशील आधार है परिवर्तनों की श्रृंखला द्वारा दर्शाया जा सकता है: धातु → मूल ऑक्साइड → नमक → अघुलनशील आधार → मूल ऑक्साइड → धातु। इस श्रृंखला को तांबे का उपयोग करके बनाएं। प्रतिक्रिया समीकरण लिखें जिसके साथ आप परिवर्तनों की यह श्रृंखला बना सकते हैं।
गैर-धातुओं की आनुवंशिक श्रृंखला, जहां अघुलनशील एसिड श्रृंखला में एक कड़ी के रूप में कार्य करता है परिवर्तनों की एक श्रृंखला द्वारा प्रतिनिधित्व किया जा सकता है: गैर-धातु → एसिड ऑक्साइड → नमक → एसिड → एसिड ऑक्साइड → गैर-धातु। सिलिकॉन का उपयोग करके इस श्रृंखला का निर्माण करें। प्रतिक्रिया समीकरण लिखें जिसके साथ आप परिवर्तनों की यह श्रृंखला बना सकते हैं।
विकल्पों के लिए कार्य करें:
| विकल्प 1 | विकल्प 2 |
|
1. अपने संस्करण में ऑक्साइड फ़ार्मुलों का चयन करें, अपनी पसंद की व्याख्या करें, यौगिकों के इस वर्ग की संरचना की विशेषताओं के ज्ञान के आधार पर। उन्हें बुलाओ।
2. अपने संस्करण के सूत्र कॉलम में, एसिड फ़ार्मुलों को ढूंढें और इन यौगिकों की संरचना के विश्लेषण के आधार पर अपनी पसंद की व्याख्या करें।
3. एसिड संरचना में एसिड के अवशेषों की वैधता निर्धारित करें।
4. नमक के फार्मूले चुनें और उन्हें नाम दें।
5. लवण के सूत्र बनाएं, जो आपके वैरिएंट के मैग्नीशियम और एसिड के साथ बन सकते हैं। उन्हें नीचे लिखें, इसे नाम दें।
6. अपने संस्करण के सूत्र कॉलम में, आधार सूत्र खोजें और इन यौगिकों की संरचना के विश्लेषण के आधार पर अपनी पसंद की व्याख्या करें।
7. अपने वैरिएंट में उन पदार्थों के फार्मूले चुनें जिनके साथ फॉस्फोरिक एसिड (हाइड्रोक्लोरिक, सल्फ्यूरिक) का घोल प्रतिक्रिया कर सकता है। उचित प्रतिक्रिया समीकरण बनाएं।
9. अपनी पसंद के फॉर्मूले के बीच, ऐसे पदार्थों के फॉर्मूले चुनें जो आपस में बातचीत कर सकें। उचित प्रतिक्रिया समीकरण बनाएं।
10. अकार्बनिक यौगिकों के आनुवंशिक बांडों की एक श्रृंखला बनाएं, जिसमें एक पदार्थ शामिल होगा, जिसका सूत्र आपके संस्करण में नंबर एक पर दिया गया है।
सभी फॉर्मूलों का उपयोग करके इन पदार्थों का उपयोग करके एक आनुवंशिक रेखा बनाएं। प्रतिक्रिया समीकरण लिखें जिसके साथ आप परिवर्तनों की इस श्रृंखला को पूरा कर सकते हैं:
मैं विकल्प: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
द्वितीयविकल्प: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
होमवर्क: कैल्शियम से कैल्शियम कार्बोनेट के क्रमिक संक्रमण को चार्ट करें और दवा में किसी भी नमक के उपयोग पर एक रिपोर्ट तैयार करें (अतिरिक्त साहित्य का उपयोग करके)।
