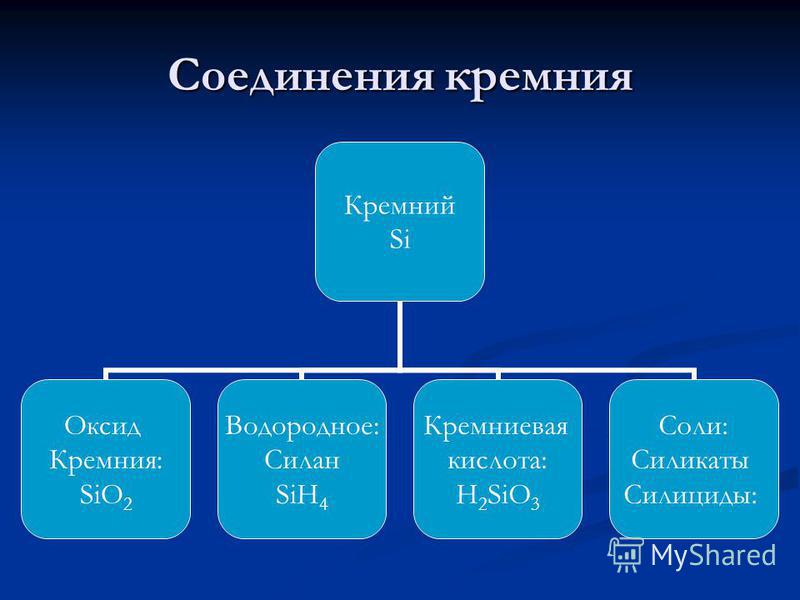
सिलिकॉन की संरचना की योजना। इलेक्ट्रॉन खोल संरचना
पीएस में परमाणु संरचना की स्थिति: अवधि III; समूह IV, अग्रणी; कर्नेल चार्ज: +14 सी; सापेक्ष परमाणु द्रव्यमान: Ar (Si) = 28 परमाणु संरचना: p = 14, e = 14, n = 14 इलेक्ट्रॉनिक सूत्र: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
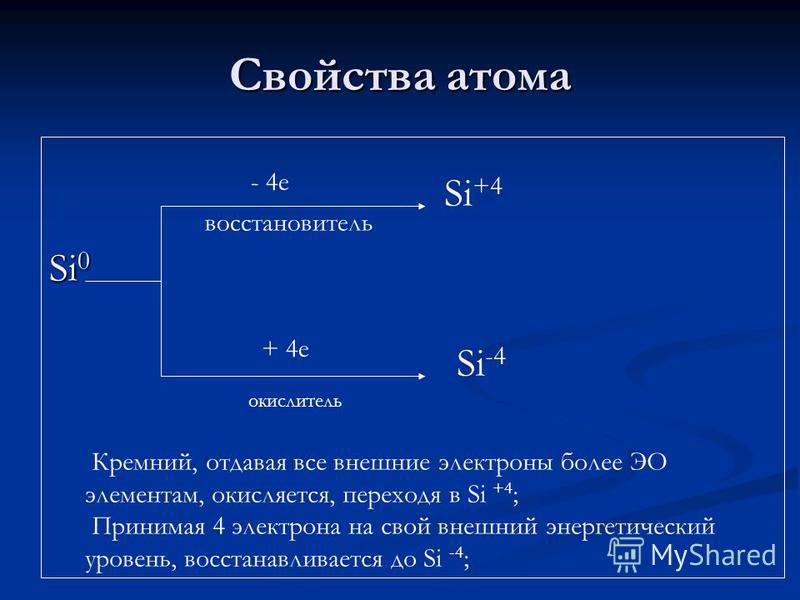
परमाणु गुण Si e कम करने वाले एजेंट + 4 e ऑक्सीडाइज़र Si + 4 Si -4 सिलिकॉन, सभी बाहरी इलेक्ट्रॉनों को अधिक EO तत्वों को देते हुए ऑक्सीकरण किया जाता है, जो Si + 4 में गुजरता है; 4 इलेक्ट्रॉनों को अपने बाहरी ऊर्जा स्तर पर ले जाना, यह Si-4 तक कम हो जाता है;

सिलिकॉन सिलिकॉन के भौतिक गुण एक गैर-धातु है, यह एक क्रिस्टलीय और अनाकार अवस्था में मौजूद है। क्रिस्टलीय सिलिकॉन एक धात्विक-इस्पात पदार्थ है जिसमें एक धातु चमक होती है, बहुत कठोर लेकिन नाजुक। अनाकार सिलिकॉन - ब्राउन पाउडर। पी = 2.33 ग्राम / सेमी 3; t pl। = सी; t किप। = सी;

सिलिकॉन की क्रिस्टल संरचना सिलिकॉन का एक क्रिस्टल जाली एक घन चेहरा केंद्रित हीरा प्रकार है। लेकिन सी - सी के बीच लंबे समय तक बंधन की वजह से, सिलिकॉन की कठोरता हीरे की तुलना में काफी कम है। सिलिकॉन नाजुक है, केवल जब सी के ऊपर गरम किया जाता है।

इलेक्ट्रोफिजिकल गुण एलिमेंटल सिलिकॉन एलिमेंटल सिलिकॉन एक विशिष्ट अर्धचालक है। ठेठ अर्धचालक। क्रिस्टलीय सिलिकॉन के इलेक्ट्रोफिजिकल गुण इसमें निहित अशुद्धियों से बहुत प्रभावित होते हैं। छेद चालकता के साथ सिलिकॉन के एकल क्रिस्टल प्राप्त करने के लिए, बोरान, एल्यूमीनियम, गैलियम और इंडियम के 3 जी समूह के तत्वों के एडिटिव्स को फॉस्फोरस, आर्सेन या एंटीमनी के 5 वें समूह के तत्वों के अतिरिक्त की इलेक्ट्रॉनिक चालकता के साथ सिलिकॉन में पेश किया जाता है।


फ्लिंट फ्लिंट, इस फ्लिंट, इस बदसूरत और बहुत बदसूरत और बहुत टिकाऊ पत्थर, टिकाऊ पत्थर, ने पत्थर की उम्र की शुरुआत के लिए एक नींव रखी - सदी - चकमक काम करने वाले उपकरणों की सदी। चकमक उपकरण इसके दो कारण हैं: - सिलिकॉन की व्यापकता और उपलब्धता; - सिलिकॉन की व्यापकता और उपलब्धता; - जब काटने के लिए तेज धार बनाने की क्षमता; - जब काटने के लिए तेज धार बनाने की क्षमता;




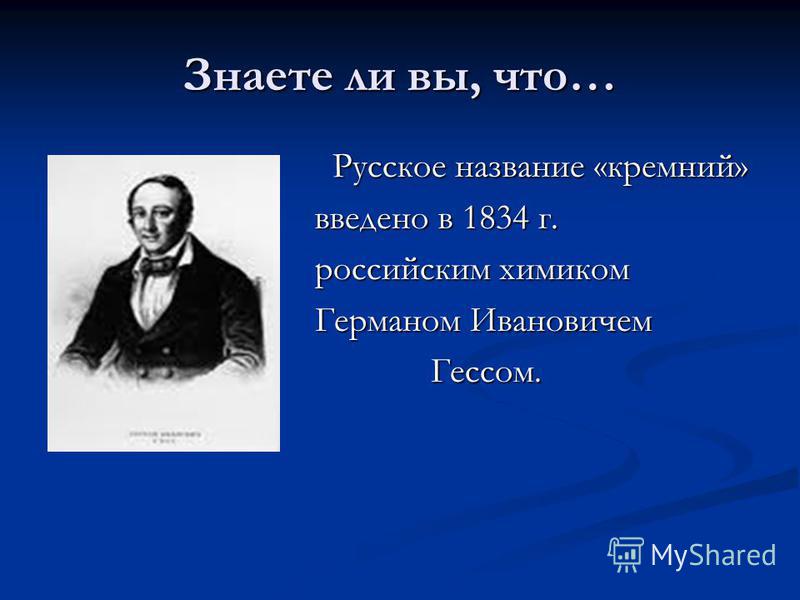
क्या आप जानते हैं कि .. अपने शुद्ध रूप में सिलिकॉन प्राप्त करने की विधि निकोलाई निकोलाइविच बेकेटोव द्वारा विकसित की गई थी। रूस में सिलिकॉन कारखानों में उत्पादित किया जाता है: कामेन्स्क - उरलस्की (सेवरडलोव्स्क क्षेत्र)। कमेंस्क - उरलस्की (सेवरडलोव्स्क क्षेत्र) शेल्ख (इरकुत्स्क क्षेत्र)। शेल्ख (इरकुत्स्क क्षेत्र)।

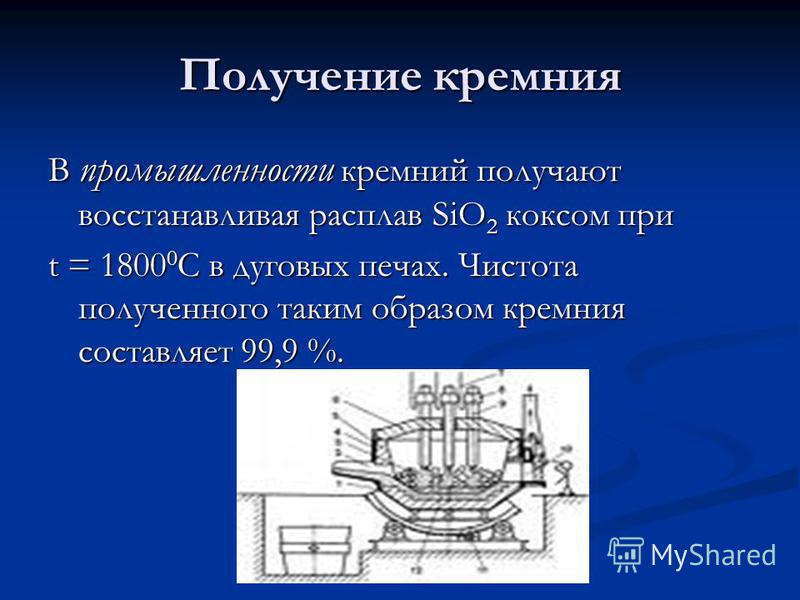
सिलिकॉन का उत्पादन उद्योग में, सिलिकॉन को चाप भट्टियों में t = C पर कोक द्वारा SiO 2 के पिघल को कम करके प्राप्त किया जाता है। इस प्रकार प्राप्त सिलिकॉन की शुद्धता 99.9% है।
सिलिकॉन प्रयोगशाला उत्पादन विधि प्राप्त करना: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


सिलिकॉन के रासायनिक गुण जब 400 - C तक गर्म हो जाते हैं, तो सिलिकॉन ऑक्सीजन के साथ प्रतिक्रिया करके सिलिकॉन डाइऑक्साइड बनाता है: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
सीओ 2 सीओ 2 एसआईओ 2 ऑक्साइड एसिड ऑक्साइड आण्विक क्रिस्टल लैटिस परमाणु रंगहीन गैस के गुण। क्रिस्टलीय, ठोस, दुर्दम्य। रासायनिक रासायनिक गुण H 2 O + CO 2 = H 2 CO 3 CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO + NaOH = Na प्रतिक्रिया नहीं करता है 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
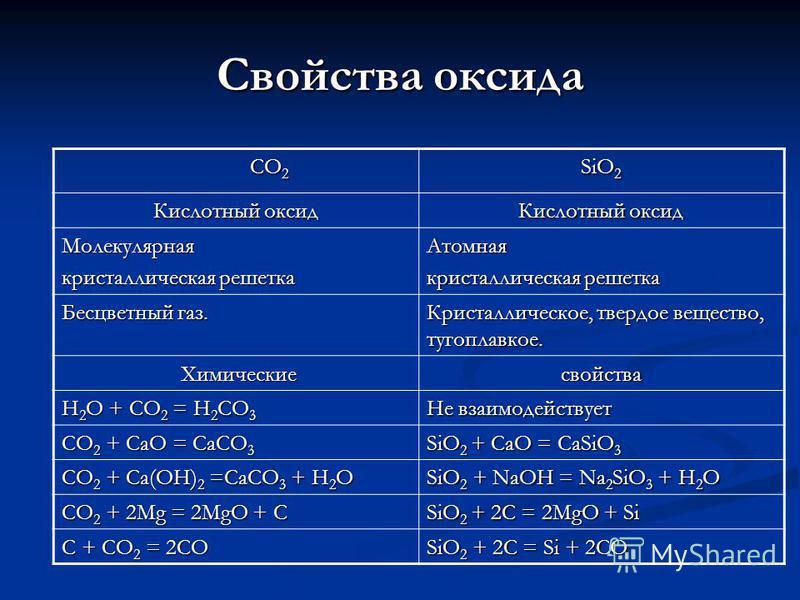
एसिड के गुण एच 2 सीओ 3 एच 2 एसआईओ 3 डिबासिक, ऑक्सीजन युक्त, कमजोर, नाजुक, तब से बल्ला। Dibasic, ऑक्सीजन युक्त, पानी में कमजोर, अघुलनशील। प्राप्त करना: CO 2 + H 2 O = H 2 CO 3 प्राप्त करना: SiO 2 + H 2 O = खड़े या गर्म होने पर अस्थिर, नाजुक, विघटित नहीं हो सकता: H 2 CO 3 = CO 2 + H 2 O अपने शुद्ध रूप में नहीं चुने जा सकते, क्योंकि गर्म होने पर विघटित होता है: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 लघु गैस विकास __________

सिलिकिक एसिड कार्बोनिक एसिड - कार्बोनेट; - हाइड्रोकार्बन; - सिलिकेट्स; - सिलिकेट्स; कार्बोनेट में लवण के सभी गुण होते हैं, मजबूत इलेक्ट्रोलाइट्स होते हैं, पूरी तरह से आयनों में घुल जाते हैं (पानी में घुलनशील)। केवल क्षार धातु के लवण घुलनशील होते हैं, अन्य अघुलनशील होते हैं या लवण नहीं बनाते हैं (Al +3, Cr +3, Ag +)।
![]()



जैविक भूमिका सबसे महत्वपूर्ण सिलिकॉन यौगिक, SiO 2, पौधे और पशु जीवन के लिए आवश्यक है। उसके लिए धन्यवाद, नरकट, नरकट उसके लिए धन्यवाद, नरकट, नरकट और घोड़े की नाल के समान मजबूती से खड़े होते हैं। और घोड़े की नाल तंग की तरह खड़े हो जाते हैं। शार्प सेज की पत्तियाँ कट जाती हैं जैसे शार्प सेज की कटियाँ चाकू की तरह कट जाती हैं, एक मैग्ड फील्ड चाकू पर स्टबल, एक मैग्ड फील्ड स्टिक्स पर स्टबल, सुइयों की तरह स्टिक और अनाज की डंठल की डंठल की तरह डंठल और अनाज के डंठल इतने मजबूत होते हैं कि वे इतना मजबूत नहीं होने देते हैं बारिश और हवा से खेतों में बारिश और हवा के झोंके से खेतों को गिरने न दें


सिलिकॉन एक ट्रेस तत्व है जो लगातार मानव शरीर में निहित होता है। इसकी सबसे बड़ी राशि लिम्फ नोड्स, महाधमनी के संयोजी ऊतक, ट्रेकिआ, बाल और त्वचा में निहित है। उपकला कोशिकाओं के निर्माण के लिए सिलिकॉन की आवश्यकता होती है। सिलिकॉन एक ट्रेस तत्व है जो लगातार मानव शरीर में निहित होता है। इसकी सबसे बड़ी राशि लिम्फ नोड्स, महाधमनी के संयोजी ऊतक, ट्रेकिआ, बाल और त्वचा में निहित है। उपकला कोशिकाओं के निर्माण के लिए सिलिकॉन की आवश्यकता होती है। हड्डी के खनिजकरण की प्रक्रिया में सिलिकॉन एक महत्वपूर्ण भूमिका निभाता है; धमनी दीवार की लोच बनाए रखने के लिए आवश्यक, प्रतिरक्षा प्रणाली पर सकारात्मक प्रभाव पड़ता है और मानव शरीर के ऊतकों में उम्र बढ़ने की प्रक्रिया को धीमा कर देता है। रक्त में सिलिकॉन की औसत सामग्री 8.25 मिलीग्राम / दिन है। उम्र के साथ, शरीर में इसका स्तर कम हो जाता है, इसलिए बुजुर्ग लोगों में, सिलिकॉन की आवश्यकता बढ़ जाती है। शरीर द्वारा कैल्शियम, मैग्नीशियम, मैंगनीज और पोटेशियम की उपस्थिति से सिलिकॉन के अवशोषण में सुधार। हड्डी के खनिजकरण की प्रक्रिया में सिलिकॉन एक महत्वपूर्ण भूमिका निभाता है; धमनी दीवार की लोच बनाए रखने के लिए आवश्यक, प्रतिरक्षा प्रणाली पर सकारात्मक प्रभाव पड़ता है और मानव शरीर के ऊतकों में उम्र बढ़ने की प्रक्रिया को धीमा कर देता है। रक्त में सिलिकॉन की औसत सामग्री 8.25 मिलीग्राम / दिन है। उम्र के साथ, शरीर में इसका स्तर कम हो जाता है, इसलिए बुजुर्ग लोगों में, सिलिकॉन की आवश्यकता बढ़ जाती है। शरीर द्वारा कैल्शियम, मैग्नीशियम, मैंगनीज और पोटेशियम की उपस्थिति से सिलिकॉन के अवशोषण में सुधार।

सिलिकॉन की जैविक भूमिका को निचले जीवित जीवों की संरचना में भी शामिल किया गया है - डायटम और रेडियोलेरियन - जीवित पदार्थ की सबसे नाजुक गांठ, जो सिलिका से बने उनके नायाब सौंदर्य कंकाल बनाते हैं। सिलिकॉन निचले जीवित जीवों का भी हिस्सा है - डायटम और रेडियोलेरियन - जीवित पदार्थ की सबसे नाजुक गांठ, जो सिलिका कंकालों की उनकी नायाब सुंदरता बनाते हैं। डायटमस रेडिओलारिया स्व-नियंत्रण 1. आवधिक प्रणाली में सिलिकॉन का स्थान क्या है: ए) 2 अवधि, 4 ओग। बी) 3 अवधि, 3 जीआर। अध्याय। ग) 3 अवधि, 4 जीआर। अध्याय) 2 अवधि, 4 जीआर। बी) 3 अवधि, 3 जीआर। अध्याय। ग) 3 अवधि, 4 जीआर। अध्याय। 2. सिलिकॉन जाली: ए) आयनिक; बी) परमाणु; ग) आणविक; ए) आयनिक; बी) परमाणु; ग) आणविक; 3. सिलिकॉन की प्रकृति में व्यापकता के अनुसार ... तत्व: ए) पहले; बी) दूसरा; ग) तीसरा; ए) पहला; बी) दूसरा; ग) तीसरा; 4. सिलिकॉन के साथ प्रतिक्रिया करता है: ए) धातु, हाइड्रोजन, हैलोजन; a) धातु, हाइड्रोजन, हैलोजन; बी) धातु, हैलोजन, आसानी से क्षार में घुलनशील; बी) धातु, हैलोजन, आसानी से क्षार में घुलनशील; सी) ऑक्साइड, एसिड, गैर-धातु। सी) ऑक्साइड, एसिड, गैर-धातु। 5. सिलिकिक एसिड लवण: ए) सिलिकिस; बी) हाइड्रोसिलिकेट्स; ग) सिलिकेट्स; ए) सिलिकाइड; बी) हाइड्रोसिलिकेट्स; ग) सिलिकेट्स;

सिलिकॉन।
सिलिकॉन - रासायनिक तत्वों डीआई मेंडेलीव की आवधिक प्रणाली की तीसरी अवधि के समूह के मुख्य उपसमूह IV का एक तत्व, परमाणु संख्या 14 के साथ, परमाणु द्रव्यमान: 28.0855। यौगिकों में, यह आमतौर पर +4 (वैलेंस IV) के ऑक्सीकरण की डिग्री और बहुत कम +3, +2, और +1 (क्रमशः, III, II और I) प्रदर्शित करता है। आवर्त सारणी में, मेंडेलीव सिलिकॉन समूह IVA में स्थित है (ए-इंगित करता है कि यह मुख्य उपसमूह है) (कार्बन समूह में), तीसरी अवधि में। नांमेटल । प्रतीक द्वारा निरूपित सी(lat। silicium)। मुक्त रूप में - भूरे पाउडर या हल्के भूरे रंग की कॉम्पैक्ट सामग्री के साथ एक धातु की चमक। जालीदार संरचना: घन, हीरा।
मुख्य अवस्था: + 14 सी 14 ई 1s 2 2s 2 2p 6 3s 2 3p 2, p- तत्व।
2. भौतिक गुण।
क्रिस्टलीय सिलिकॉन एक स्टील ग्रे के साथ एक गहरे भूरे रंग का पदार्थ है। सिलिकॉन की संरचना हीरे की संरचना के समान है। इसके क्रिस्टल में, प्रत्येक परमाणु टेट्राहेड्रल चार अन्य से घिरा हुआ है और उनके साथ एक सहसंयोजक बंधन द्वारा जुड़ा हुआ है, जो एक हीरे में कार्बन परमाणुओं के बीच की तुलना में बहुत कमजोर है। एक सिलिकॉन क्रिस्टल में, सामान्य परिस्थितियों में भी, कुछ सहसंयोजक बंधन नष्ट हो जाते हैं। इसलिए, इसमें मुक्त इलेक्ट्रॉन होते हैं, जो एक छोटी विद्युत चालकता का कारण बनते हैं। जब प्रकाश और हीटिंग टूटे हुए बांडों की संख्या को बढ़ाते हैं, जिसका अर्थ है कि मुक्त इलेक्ट्रॉनों की संख्या बढ़ जाती है और विद्युत चालकता बढ़ जाती है। तो सिलिकॉन के अर्धचालक गुणों की व्याख्या करनी चाहिए।
सिलिकॉन बहुत नाजुक है, इसका घनत्व 2.33 ग्राम / सेमी 3 है। कोयले की तरह, दुर्दम्य पदार्थों को संदर्भित करता है।
सिलिकॉन में तीन स्थिर समस्थानिक होते हैं: 2814Si (92.27%), 2914Si (4.68%), और 3014Si (3.05%)।
3. स्वभाव में होना।
ज्यादातर प्रकृति में, सिलिकॉन रूप में पाया जाता है सिलिका - सिलिकॉन डाइऑक्साइड (IV) SiO2 (पृथ्वी की पपड़ी के द्रव्यमान का लगभग 12%) पर आधारित यौगिक। सिलिकॉन डाइऑक्साइड द्वारा बनाए गए मुख्य खनिज और चट्टानें रेत (नदी और क्वार्ट्ज), क्वार्ट्ज और क्वार्टजाइट, चकमक पत्थर, और तलछट हैं। प्राकृतिक सिलिकेट्स की एक जटिल संरचना और संरचना होती है। यहाँ कुछ प्राकृतिक सिलिकेट्स की संरचना है:
ü फेल्डस्पार K 2 O × Al 2 O 3 × 6SiO 2,
ü अभ्रक 3MgO × 2SiO 2 × 2H 2 O,
ü mica K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü kaolinite 3Al 2 O 3 × 2SiO 2 × 2H 2 O।
सिलिकॉन यौगिकों की प्रकृति में दूसरा सबसे आम समूह है सिलिकेट और alumino-सिलिकेट।
देशी रूप में शुद्ध सिलिकॉन खोजने के एकल तथ्य नोट किए गए हैं।
4. सिलिकॉन और उसके यौगिकों के रासायनिक गुण।
रासायनिक गुणों के अनुसार, सिलिकॉन, कार्बन की तरह, एक गैर-धातु है, लेकिन इसकी गैर-धातुता कम स्पष्ट है, चूंकि इसमें एक बड़ा परमाणु त्रिज्या है। चूंकि सिलिकॉन परमाणुओं में बाहरी ऊर्जा स्तर पर 4 इलेक्ट्रॉन होते हैं, इसलिए -4 और +4 दोनों का ऑक्सीकरण राज्य सिलिकॉन की विशेषता है (एक सिलिकॉन यौगिक ज्ञात है, जहां इसकी ऑक्सीकरण की डिग्री +2 है)।
सामान्य परिस्थितियों में सिलिकॉन बल्कि निष्क्रिय है, जिसे इसके क्रिस्टल जाली की ताकत से समझाया जाना चाहिए। यह सीधे तौर पर केवल साथ बातचीत करता है एक अधातु तत्त्व:
एसिड (हाइड्रोफ्लोरिक एचएफ और नाइट्रिक एचएनओ 3 के मिश्रण को छोड़कर)सिलिकॉन अभिनय नहीं करता है। हालांकि, यह क्षार धातु हाइड्रॉक्साइड में घुल जाता है, जो सिलिकेट और हाइड्रोजन बनाता है:
सिलिकॉन, क्रिस्टलीय और अनाकार, अनाकार सिलिकॉन के दो आवंटन संशोधनों में से रासायनिक अधिक सक्रिय है। वह के साथ प्रतिक्रिया करता है ऑक्सीजन के साथ गर्म होने पर, SiO 2 बनाना:
साथ ही साथ सभी के साथ हैलोजनउदाहरण के लिए:
![]()
उच्च तापमान पर सिलिकॉन जोड़ता है कार्बन के साथकार्बोरंडम SiC का गठन:
कार्बोरंडम में हीरे की तरह का क्रिस्टल जाली होता है, जिसमें प्रत्येक सिलिकॉन परमाणु चार कार्बन परमाणुओं से घिरा होता है और इसके विपरीत, और सहसंयोजक बंधन बहुत मजबूत होते हैं, जैसे हीरे में। इसलिए, कठोरता में यह हीरे के करीब है। पीस पत्थर और पीस पहियों सिलिकॉन कार्बाइड से बना रहे हैं।
मैग्नीशियम सिलिकेट। सक्रिय धातुओं के साथ प्रतिक्रिया में, के गठन के साथ घटित होता है सिलिसाइड, सिलिकॉन एक ऑक्सीकरण एजेंट के रूप में कार्य करता है:
उच्च तापमान पर, सिलिकॉन अपने आक्साइड से कई धातुओं को ठीक करता है। (!!!)
Silane। सिलिकाइड पर हाइड्रोक्लोरिक एसिड की कार्रवाई के तहत, सिलिकॉन का सबसे सरल हाइड्रोजन यौगिक साइहेन सीएच 4 है:
सिलेन एक जहरीली गैस है जिसमें एक अप्रिय गंध, हवा में आत्म-प्रज्वलित होती है (!!!):
सिलिकॉन ऑक्साइड (IV)।सिलिकॉन ऑक्साइड (IV) भी कहा जाता है सिलिका. यह एक ठोस दुर्दम्य पदार्थ है। (गलनांक) 1700 ° से) प्रकृति में दो रूपों में व्यापक:
1) क्रिस्टलीय सिलिका - क्वार्ट्ज और इसकी किस्मों के खनिज के रूप में (रॉक क्रिस्टल, चेल्सीडोनी, अगेट, जैस्पर, चकमक पत्थर); क्वार्ट्ज निर्माण और सिलिकेट उद्योग में व्यापक रूप से उपयोग किए जाने वाले क्वार्ट्ज रेत का आधार बनता है;
2) अनाकार सिलिका - ओपल खनिज संरचना SiO 2 × के रूप में n एच 2 ओ; अनाकार सिलिका के मिट्टी के रूप डायटोमाइट, ट्रिपोली (इन्फ्यूसोरियल अर्थ) हैं; कृत्रिम अनाकार निर्जल सिलिका का एक उदाहरण सिलिका जेल है, जो सोडियम मेटासिलिकेट से प्राप्त होता है:
सिलिका जेल की एक विकसित सतह होती है और इसलिए यह नमी को अच्छी तरह से अवशोषित करती है। .
1710 डिग्री क्वार्ट्ज पर पिघला देता है। पिघला हुआ द्रव्यमान के तेजी से ठंडा होने के साथ बनता है क्वार्ट्ज ग्लास । इसमें विस्तार का बहुत कम गुणांक होता है, जिससे पानी के तेजी से ठंडा होने पर गर्म क्वार्ट्ज ग्लास नहीं फटता है। प्रयोगशाला कांच के बने पदार्थ और वैज्ञानिक अनुसंधान के लिए उपकरण क्वार्ट्ज ग्लास से बने हैं।
सिलिकॉन ऑक्साइड (IV) SO 2 का सबसे सरल सूत्र कार्बन मोनोऑक्साइड (IV) CO 2 के सूत्र के समान है। इस बीच, उनके भौतिक गुण बहुत अलग हैं (SiO 2 - ठोस, CO 2 - गैस)। यह अंतर क्रिस्टल लैटिस की संरचना के कारण है। C0 2 आणविक जाली में SiO 2 क्रिस्टलीकृत होता है - परमाणु में। एक प्लानर छवि में SiO 2 की संरचना को निम्नानुसार दर्शाया जा सकता है:
ठोस सीओ 2 में एक कार्बन परमाणु की समन्वय संख्या 2 है, और SiO 2 में सिलिकॉन 4 है। प्रत्येक सिलिकॉन परमाणु 4 ऑक्सीजन परमाणुओं के एक टेट्राहेड्रॉन में संलग्न है। उसी समय, सिलिकॉन परमाणु केंद्र में होता है, और ऑक्सीजन परमाणु टेट्राहेड्रोन के कोने पर स्थित होते हैं । सिलिका के पूरे टुकड़े को एक क्रिस्टल माना जा सकता है जिसका सूत्र (SiO 2) n है। सिलिकॉन ऑक्साइड (IV) की यह संरचना इसकी उच्च कठोरता और अपवर्तनीयता को निर्धारित करती है .
सिलिकॉन ऑक्साइड (IV) SiO 2 के रासायनिक गुण एसिड ऑक्साइड को संदर्भित करते हैं। ठोस क्षार, मूल आक्साइड और कार्बोनेट के साथ इसे फ्यूज करने पर, सिलिकिक एसिड लवण बनता है:
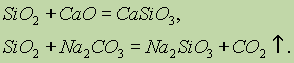
सिलिकॉन ऑक्साइड (IV) के साथ केवल हाइड्रोफ्लोरोइक एसिड इंटरैक्ट करता है:
इस प्रतिक्रिया का उपयोग कांच को खोदने के लिए किया जाता है। .
सिलिकॉन (IV) पानी में नहीं घुलता है और इसके साथ रासायनिक बातचीत नहीं करता है। (!!!) इसलिए, पोटेशियम या सोडियम सिलिकेट के घोल पर एसिड के साथ क्रिया करके अप्रत्यक्ष रूप से सिलिकिक एसिड प्राप्त किया जाता है:
इस मामले में, सिलिकिक एसिड (नमक और एसिड के प्रारंभिक समाधानों की एकाग्रता के आधार पर) एक जिलेटिनस द्रव्यमान वाले पानी के रूप में और कोलाइडल समाधान (सोल) के रूप में दोनों प्राप्त किया जा सकता है।
सिलिकिक एसिड। SiO 2 सिलिकिक एसिड की एक संख्या का एनहाइड्राइड है, जिसकी रचना सामान्य सूत्र द्वारा व्यक्त की जा सकती है: xSiO 2 × yH 2 O, जहाँ x और y - पूर्णांकों:
1) x = 1, y = 1: SiO 2 × H 2 O, अर्थात H 2 SiO 3 - मेटासिलिक एसिड;
2) x = 1, y = 2: SiO 2 × 2H 2 O, अर्थात H 4 SiO 4 - ऑर्थोसिलिक एसिड;
3) एक्स = 2, y = 1: 2SiO 2 × H 2 O, अर्थात H 2 Si 2 O 5 - बायमेट्रिक एसिड।
सिलिकिक एसिड टेट्राहेड्रल संरचनात्मक इकाइयों (ऐसी प्रत्येक इकाई में, सिलिकॉन परमाणु टेट्राहेड्रोन के केंद्र में है, और शीर्ष में ऑक्सीजन परमाणु हैं) से बनाया गया है। संरचनात्मक लिंक, जंजीरों में एकजुट होकर, अधिक स्थिर पॉलीसिलिकॉन एसिड बनाते हैं:
ऐसे यौगिकों की संरचना सूत्र (एच 2 SiO 3) एन द्वारा व्यक्त की जा सकती है। हालांकि, आमतौर पर सिलिकिक एसिड को सूत्र एच 2 SiO 3 द्वारा दर्शाया जाता है। एच 2 SiO 3 - एसिड बहुत कमजोर है, पानी में थोड़ा घुलनशील है। जब कार्बोनिक एसिड की तरह गर्म आसानी से विघटित होता है:
सभी सिलिकिक एसिड बहुत कमजोर (कोयले की तुलना में कमजोर) होते हैं।
सिलिकेट। सभी सिलिकिक एसिड के लवण को कहा जाता हैसिलिकेट, हालांकि, एक नियम के रूप में, शैक्षिक साहित्य में, मेथिलिक एसिड के लवण को दर्शाता है। उनकी रचना आमतौर पर तत्वों के ऑक्साइड के यौगिकों के रूप में सूत्र द्वारा दर्शायी जाती है। उदाहरण के लिए, कैल्शियम सिलिकेट CaSiO 3 के रूप में व्यक्त किया जा सकता है: CaO × SiO 2।
रचना R 2 O × nSiO 2 के सिलिकेट्स, जहां R 2 O - सोडियम या पोटेशियम के ऑक्साइड , कहा जाता है घुलनशील गिलास , और उनका केंद्रित जलीय घोल - तरल ग्लास . सोडियम सोडा ग्लास सबसे महत्वपूर्ण है।.
जब हवा में खड़े होते हैं, सिलिकेट्स के घोल में वृद्धि होती है, क्योंकि हवा में कार्बन डाइऑक्साइड (IV) अपने लवण से सिलिकिक एसिड को विस्थापित करता है:
सिलिकिक एसिड पानी में व्यावहारिक रूप से अघुलनशील है - इस गुण का उपयोग आयन SiO 3 2- गुणात्मक प्रतिक्रिया के रूप में किया जाता है।
सिलिकेट को अल्कली या कार्बोनेट के साथ सिलिका में मिलाया जाता है:
5. आयन SiO 3 2 की खोज। (मुझे कुछ नहीं मिला ...)
6. मिट्टी के निर्माण और वानिकी में सिलिकॉन यौगिकों की भूमिका।
आग्नेय चट्टानें अपनी संरचना में काफी स्थिर होती हैं और इनमें मुख्य रूप से सिलिकॉन, एल्यूमीनियम, लोहा, क्षार, मैग्नीशियम और कैल्शियम के यौगिक होते हैं। Si0 2 सामग्री के अनुसार, आग्नेय चट्टानों को चार समूहों में विभाजित किया गया है: अम्लीय (\u003e 65%), मध्यम (52-65%), मूल (40-52%) और पराबैंगनी (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
एसिड आग्नेय चट्टानें- ग्रेनाइट, पेगमाटाइट्स, रिओलाइट्स, डसाइट और अन्य - आमतौर पर क्वार्ट्ज, फेल्डस्पार, माइका के स्पष्ट क्रिस्टल के साथ एक हल्का और भूरा रंग होता है। पोटेशियम और सोडियम की एक महत्वपूर्ण मात्रा के साथ उनमें SiO 2 सामग्री उच्च (65% से अधिक) है। इसी समय, थोड़ा लोहा, और कैल्शियम और मैग्नीशियम नगण्य हैं। अम्लीय आग्नेय चट्टानों पर मिट्टी, उदाहरण के लिए, ग्रेनाइट पर, स्रोत सामग्री के भुरभुराहट, बजरी चरित्र द्वारा अपक्षय के शुरुआती चरणों में भिन्न होती है। जब आर्द्र परिस्थितियों में मौसम होता है, तो वे आसानी से क्षारीय-पृथ्वी तत्वों को खो देते हैं, जिसके परिणामस्वरूप ऐसे मौसमी सब्सट्रेट (चट्टानों के एलुवियम) पर मिट्टी बेहद खराब, खराब उपजाऊ होती है।
मुख्य आग्नेय चट्टानें -बेसाल्ट, गैब्रो, आदि, एक नियम के रूप में, एक गहरा (काला) रंग है। उन्हें अम्लीय चट्टानों की तुलना में कम SiO 2 सामग्री की विशेषता है। मुख्य आग्नेय चट्टानें लोहे, मैंगनीज, क्रोमियम, कोबाल्ट, जस्ता, टाइटेनियम, निकल, तांबे के यौगिकों में अपेक्षाकृत समृद्ध हैं। उनके अपक्षय के उत्पाद काफी जल्दी एक मिट्टी के पात्र को प्राप्त करते हैं, एक क्षारीय और लंबे समय तक तटस्थ प्रतिक्रिया बनाए रखते हैं, और ह्यूमस और मिट्टी के खनिजों की एक बढ़ी हुई सामग्री द्वारा प्रतिष्ठित होते हैं। ऐसी चट्टानों पर मिट्टी अधिक उपजाऊ होती है।
अम्लीय और बुनियादी प्रजातियों के अलावा अक्सर पाए जाते हैं संक्रमणकालीन प्रकार की आग्नेय चट्टानें(मध्यम) - डायराइट समूह की घुसपैठ की चट्टानें और उनके प्रवाहकीय प्रतिरूप - andesites। तदनुसार, इन चट्टानों पर मिट्टी अम्लीय या बुनियादी चट्टानों तक ही सीमित है। बहुत कम आम है पराबैंगनी नस्लों:पेरिडोटाइट्स और पिक्राइट्स, जिनमें सबसे कम SiO 2 सामग्री है।
मेटामॉर्फिक चट्टानें -विशाल क्रिस्टलीय और तलछटी चट्टानों के बीच संक्रमणकालीन। डाइविंग, उच्च दबाव और तापमान के तहत प्राचीन तलछटी चट्टानें उल्कापिंड बनती हैं, जो कि गनीस, सर्पेंटाइट, संगमरमर, क्वार्टजाइट्स, शेल बनाती हैं। ग्रेनाइट्स की रचना में विशेष रूप से Gneisses समान हैं। ऐसी चट्टानों पर बनने वाली मिट्टी में स्वयं अम्लीय आग्नेय चट्टानों पर मिट्टी के समान विशेषताएं होती हैं।
क्लोरीन।
1. टेबल डि मेंडेलीव में एल्यूमीनियम की स्थिति। परमाणु की संरचना, ऑक्सीकरण की प्रकट डिग्री।
क्लोरीन - VII समूह के मुख्य उपसमूह का एक तत्व, 3 अवधि, परमाणु संख्या 17 के साथ। यह प्रतीक सीएल (अक्षांश। क्लोरम) द्वारा दर्शाया गया है। रासायनिक रूप से सक्रिय नांमेटल . हलोजन समूह में शामिल .
सामान्य परिस्थितियों में सरल पदार्थ क्लोरीन - जहरीली गैस पीले-हरे रंग की हवा से तेज गंध के साथ भारी होती है . डायटोमिक क्लोरीन अणु (सूत्र Cl 2)।
मुख्य राज्य: +17 सीएल 17e1s 2 2s 2 2p 6 3s 2 3p 5, पी-एलिमेंट। कला: -1 +1 +3 +5 +7.
इलेक्ट्रॉन खोल की संरचना।
क्लोरीन परमाणु के वैलेंस स्तर पर होता है 1 अप्रकाशित इलेक्ट्रॉन : 1s 2 2s 2 2p 6 3s 2 3p 5, इसलिए क्लोरीन परमाणु के लिए 1 की वैधता बहुत स्थिर है। अनुपचारित डी-सुब्बल ऑर्बिटल्स के क्लोरीन परमाणु में मौजूद होने के कारण, क्लोरीन परमाणु ऑक्सीकरण के अन्य डिग्री का प्रदर्शन कर सकता है। परमाणु के उत्साहित राज्यों के गठन की योजना:
क्लोरीन यौगिकों को भी जाना जाता है जिसमें क्लोरीन परमाणु औपचारिक रूप से वैलेंस 4 और 6 को प्रदर्शित करता है, उदाहरण के लिए क्लो 2 और क्ल 2 परमाणु 6। हालांकि, ये यौगिक कट्टरपंथी हैं, अर्थात्, उनके पास एक अप्रकाशित इलेक्ट्रॉन है।
2. भौतिक गुण।
सामान्य परिस्थितियों में, क्लोरीन एक पीले-हरे रंग की गैस है जिसमें घुटन की गंध होती है। इसके कुछ भौतिक गुणों को नीचे प्रस्तुत किया गया है।
घनत्व: 3.214 g / l, liq। - at -35 ° C - 1.557, TV। at -105 0 С- 1.9 g / सेमी 3।
गलनांक: 172.2 K
क्वथनांक: 238.6 K
संलयन की ऊष्मा: 6.41 kJ / मोल
वाष्पीकरण की गर्मी: 20.41 kJ / मोल।
क्लोरीन गैस द्रवीभूत करने के लिए अपेक्षाकृत आसान है। 0.8 एमपीए (8 वायुमंडल) के दबाव से शुरू होकर, क्लोरीन कमरे के तापमान पर पहले से ही तरल हो जाएगा। जब °34 ° C के तापमान पर ठंडा किया जाता है, तो क्लोरीन भी सामान्य वायुमंडलीय दबाव में तरल हो जाता है। तरल क्लोरीन एक पीला-हरा तरल होता है जिसमें बहुत अधिक संक्षारक प्रभाव होता है (अणुओं की उच्च एकाग्रता के कारण)। दबाव को बढ़ाते हुए, आप 7.6 MP के महत्वपूर्ण दबाव में +144 ° C (महत्वपूर्ण तापमान) तक तरल क्लोरीन के अस्तित्व को प्राप्त कर सकते हैं। विद्युत चालकता के संदर्भ में, तरल क्लोरीन सबसे मजबूत इंसुलेटर के बीच होता है: यह आसुत जल की तुलना में लगभग एक अरब गुना अधिक खराब होता है, और चांदी की तुलना में 10 22 गुना खराब होता है। क्लोरीन में ध्वनि की गति हवा की तुलना में लगभग डेढ़ गुना कम है।
3. स्वभाव में होना।
प्रकृति में, क्लोरीन 35 सीएल और 37 सीएल के दो समस्थानिक हैं। पृथ्वी की पपड़ी में क्लोरीन सबसे आम हैलोजन है। । क्लोरीन बहुत सक्रिय है - यह सीधे आवधिक प्रणाली के लगभग सभी तत्वों से जुड़ता है। इसलिए, प्रकृति में, यह खनिजों की संरचना में केवल यौगिकों के रूप में पाया जाता है:
ü हलित NaCl,
ü सिल्विना केसीएल,
ü sylvinite KCl · NaCl,
ü बिसोफाइट MgCl 2 · 6H 2 O,
ü कारनेलाइट KCl · MgCl 2 · 6H 2 O,
ü केनाइट KCl · MgSO 4 · 3H 2 O
क्लोरीन का सबसे बड़ा भंडार लवण, जल, समुद्र और महासागरों में समाहित है (समुद्र के पानी में सामग्री 19 ग्राम / लीटर है)। पृथ्वी की पपड़ी में परमाणुओं की कुल संख्या का 0.024% क्लोरीन होता है; क्लार्क संख्या (इस प्रणाली के कुल द्रव्यमान के सापेक्ष पृथ्वी की पपड़ी, जलमंडल, पृथ्वी, अंतरिक्ष निकाय, भू-रासायनिक या ब्रह्मांड रासायनिक प्रणालियों आदि में रासायनिक तत्वों की औसत सामग्री को व्यक्त करने वाली संख्या। इसे% या g / kg में व्यक्त किया जाता है।) क्लोरीन - 0.017%। मानव शरीर में वजन से 0.25% क्लोरीन आयन होते हैं। मनुष्यों और जानवरों में, क्लोरीन मुख्य रूप से अंतरकोशिकीय तरल पदार्थ (रक्त सहित) में पाया जाता है और आसमाटिक प्रक्रियाओं के विनियमन में महत्वपूर्ण भूमिका निभाता है, साथ ही साथ तंत्रिका कोशिकाओं के काम से जुड़ी प्रक्रियाओं में भी।
4. क्लोरीन और इसके यौगिकों के रासायनिक गुण। क्लोरीन प्राप्त करना।
सिलिकॉन परमाणु की संरचना। सी। 14। उत्तेजित अवस्था। ई। 3 डी। 3p। 3s। ई। 3 डी। 3p। 3s। 1s 2s 2p 3s 3p। 2 ई 8 ई 4 ई। 2. 2. 6. 2. 2।
प्रस्तुति "सिलिकॉन" के चित्र 3 "सिलिकॉन" विषय पर रसायन विज्ञान के पाठआयाम: 960 x 720 पिक्सल, प्रारूप: jpg। एक रसायन विज्ञान सबक के लिए एक मुफ्त छवि डाउनलोड करने के लिए, छवि पर राइट-क्लिक करें और "छवि को सहेजें ..." पर क्लिक करें। पाठ में चित्रों को दिखाने के लिए, आप सभी चित्रों के साथ मुफ्त में "Silicon.ppt" की प्रस्तुति को एक ज़िप-संग्रह में डाउनलोड कर सकते हैं। पुरालेख का आकार - 562 KB।
डाउनलोड प्रस्तुतिसिलिकॉन
"सिलिकॉन और इसके यौगिक" - परमाणुओं की संरचना और गुण। सेमीकंडक्टर। t melt (Si) = 1415? C, t melt (Diamond) = 3730? C? सिलिकॉन प्राप्त करना। सिलिकॉन की खोज। पौधों और जानवरों की संरचना में भी शामिल है। सिलिकॉन के भौतिक गुण। इसलिए, ईंट सिरेमिक है, और प्राचीन ग्रीक एम्फ़ोरा की टाइलें और टुकड़े भी सिरेमिक हैं। उद्देश्य: सिलिकॉन के रासायनिक गुण।
"सिलिकॉन यौगिक" - सिलिकॉन और इसके यौगिक। SiO2 के रासायनिक गुण। Silane। सिलिकिक एसिड प्राप्त करना। सिलिकॉन गुण। सिलिकॉन ऑक्साइड। प्राकृतिक सिलिकेट। ऑक्सीकरण अवस्था स्फटिक। पुखराज। प्रयोगशाला में सिलिकॉन प्राप्त करना। प्रकृति में होना। क्रिस्टल लट्टे। सिलिकॉन की खोज। अमेथिस्ट। सिलिकॉन प्राप्त करना।
"सिलिकॉन आइसोटोप" - सिलिकॉन आइसोटोप का पृथक्करण। पॉलीक्रिस्टलाइन सिलिकॉन का उत्पादन। मोनोइसोटोपिक सिलिकॉन के उपयोग की संभावनाएं। एक क्वार्ट्ज क्रूसिबल से एकल क्रिस्टल बढ़ने पर आइसोटोपिक कमजोर पड़ना। एकल क्रिस्टल बीज का उत्पादन। परमाणु द्रव्यमान पर रमन बैंड की अधिकतम की स्थिति की निर्भरता।
"सिलिकॉन लेसन" - जीवित और निर्जीव प्रकृति में सबसे महत्वपूर्ण रासायनिक तत्व कौन से हैं? कार्बन और सिलिकॉन के ऑक्साइड। पदार्थ पारदर्शी होता है। गैर-धात्विक और धात्विक गुणों के प्रकट होने पर। प्रतिबिंब को समेटना। अंतिम परीक्षण। कार्बन और सिलिकॉन हाइड्रॉक्साइड के ऑक्साइड? एकत्रीकरण की स्थिति: ए) तरल, बी) गैस, सी) ठोस।
"सिलिकॉन" - सिलिकॉन एक सरल पदार्थ है। भौतिक गुण। सिलिकॉन ऑक्साइड (IV)। Silicides। जीवों के लिए अर्थ। धातुओं के साथ बातचीत। गैर-धातुओं के साथ बातचीत। सिलिकॉन कार्बाइड। प्रकृति में सिलिकॉन। सिलिकॉन। सिलिकेट उद्योग के उत्पाद। प्राकृतिक सिलिकॉन यौगिकों के प्रकार में से एक सिलिकेट है।
"कार्बन और सिलिकॉन" - सिलिकॉन ऑक्साइड (IV)। मुख्य उपसमूह के समूह IV के तत्व। विषाक्तता। 7. कार्बन के बारे में दिलचस्प। सिलिकेट। स्पर्श करने के लिए पर्ची। हीरा सबसे कठोर प्राकृतिक पदार्थ है। रासायनिक गुण वातावरण में 99% से अधिक कार्बन डाइऑक्साइड के रूप में है। Carbides। 6. आवेदन। ठोस पदार्थों में सबसे नरम है।
कुल 6 प्रस्तुतियाँ हैं।
