Alta concentración de silicio. Sabes como
¿Procesador? Pisok? ¿Y qué tienes con la palabra asociaciones? ¿O tal vez Silicon Valley?
Por si no fuera, con el silicón nos estamos pegando hoy, y si necesitas saber, qué es Si y por qué comes, te pido un gato.
Entrada
Siendo estudiante de una de las universidades de Moscú en la especialidad “Nanomateriales”, quiero conocerte, querido lector, con los elementos químicos más importantes de nuestro planeta. He estado eligiendo algo durante mucho tiempo, carbón o silicona, y sin embargo, he decidido usar Si yo mismo, de modo que el corazón de cualquier dispositivo moderno se base en él mismo, por lo que puede decirse tan espléndidamente. Intentaré que mis pensamientos sean extremadamente simples y accesibles. Habiendo escrito este material, lo guardé, principalmente para novatos, pero cada vez más personas pueden obtenerlo de cicave, por lo que me gustaría decir que el artículo fue escrito. exclusivamente para expandir intereses, lo que se atascó. Y así empecemos.
silicio
Silicio (lat. Silicium), Si, elemento químico del grupo IV del sistema periódico de Mendeliev; número atómico 14, peso atómico 28.086.
En la naturaleza, el elemento está representado por tres isótopos estables: 28Si (92,27%), 29Si (4,68%) y 30Si (3,05%).
Grosor (n.s.) 2,33 g/cm?
Punto de fusión 1688 K

Si en polvo
Prueba histórica
Colinas de Silicio, amplias tierras, bulevares de gentes de la edad de piedra. Había miles de espadines de piedra y el riego de la piedra. Zastosuvannya spoluk Silicon, vinculado con su procesamiento, - la preparación de un almacén - comenzó alrededor del 3000 a. E. (Antiguo Egipto). Anteriormente en la casa, se usaba silicio: óxido SiO2 (sílice). En el siglo XVIII se inyectaba sílice con un cuerpo simple y se llevaba a las "tierras" (que se usa en su nombre). Skladnіst a un almacén de sílice que haya instalado І. I. Berzelius. En el mismo vpershe, en 1825, después de haber eliminado el silicio elemental del fluoruro de silicio SiF4, reemplazando el potasio metálico restante. El nuevo elemento se denominó "silicio" (lat. silex - pedernal). Nombre ruso vvіv G. I. Hess en 1834 rocío.

Arco de silicona de extensiones en la naturaleza en el almacén del sonido sónico
Expansión de silicio en la naturaleza
Para la anchura en la corteza terrestre, el Silicio es otro elemento (después del agrio), su promedio en la litosfera es del 29,5% (detrás de la masa). La corteza de la tierra, gris Silicio, tiene el mismo papel principal, como el carbón de la luz terrenal de la criatura. Para la geoquímica del silicio, es importante, en particular, que el vínculo entre yogo y sour sea importante. Cerca del 12% de la litosfera se convierte en sílice SiO2 en forma de cuarzo mineral y diversas variedades. El 75% de la litosfera se compone de varios silicatos y aluminosilicatos (polova, mica, anfíbol toshcho). El número total de minerales, que pueden ser reemplazados por sílice, supera los 400.
Poder físico del silicio
Creo que no es especialmente varto, eso es todo. Poder físico Tengo acceso gratuito, pero enumeraré los más comunes.
Punto de ebullición 2600 °C
Prozorio de silicio para dovgokhvilovyh ІCh-promenіv
Penetración dieléctrica 11.7
Dureza de silicio de Mohs 7.0
Me gustaría decir que el material tendinoso de silicio, la deformación plástica conmemorativa comienza a temperaturas superiores a 800°C.
El silicio es un conductor, el mismo vino que conocemos mucho de zastosuvannya. La energía eléctrica del silicio puede estar en la casa.
Poder químico.
Es rico aquí, es increíble, se podría decir, pero me estoy tropezando con el más famoso. En los estantes de Si (similar al carbono) 4-valente.
En la superficie del zavdyak de silicio, la fundición de óxido es estable al viento a temperaturas elevadas. En ácido, se oxida a 400 °C, disolviendo el óxido de silicio (IV) SiO2.
El silicio es resistente a los ácidos y es menos probable que se mezcle con los ácidos nítrico y fluorhídrico, se distinguen fácilmente en los prados cálidos de ver el agua.
El silicio forma 2 grupos de silanos ácidos: siloxano y siloxenio. El silicio reacciona con el nitrógeno a temperaturas superiores a 1000 °C. es un material valioso para la industria química, así como para la producción de extintores de incendios. Alta dureza, así como resistencia térmica y química, se tratan con pisos de carburo de silicio (carburo de silicio SiC) y boro (SiB3, SiB6, SiB12).
Silicio Otrimanya
Creo que tse naytsіkavіsha parte, aquí está el informe.
El tipo de barbecho de reconocimiento se divide:
1.
Potencia electrónica de silicio(tz silicio electronico"") - el silicio más silíceo fuera de la niebla de silicio más del 99,999% detrás de la pared, el soporte eléctrico de la calidad electrónica del silicio se puede cambiar en el intervalo de aproximadamente 0,001 a 150 ohm cm, pero con el cual el valor del soporte tiene la culpa buti cuenta con una casa todo incluido, para que te puedas meter en el cristal de la casa de otros, queriendo encargarte de las tareas de la guardería del opir eléctrico, sonar, inaceptable.
2.
Silicona calidad sony(t.z. "sonyachny silicon") - silicio de silicio mixto en más del 99,99% por fibra, que se utiliza para la producción de dispositivos de conversión fotoeléctrica (baterías sónicas).

3.
Silicio técnico- bloques de estructura policristalina de silicio, tomados por el método de renovación carbotérmica de puro chirrido de cuarzo; cubra con 98% de silicio, la casa principal es carbón, está ventilada con una gran cantidad de elementos ligeros: boro, fósforo, aluminio; utilizado principalmente indirectamente para la posesión de silicio policristalino.
El silicio de pureza técnica (95-98%) posee descargas eléctricas de sílice inspirada SiO2 entre electrodos de grafito. En el enlace con el desarrollo del método nap_v_dnikovoї tehnіko razrobleno para obtener silicio puro y especialmente puro. En aras de la síntesis directa de silicio vih_dnih spoluk puro, z yakikh vityagyat silіkі vіdnovlennya vіdnovlennya аbo termіchnogo razkladannya.
Silicio policristalino ("polisilicio") - la forma más pura de silicio, que es comercialmente viable, - un producto que se utiliza para la purificación de silicio técnico por métodos de cloruro y fluoruro y es victorioso para la producción de mono y multicristalino silicio.
Tradicionalmente, el silicio policristalino se elimina del silicio técnico mediante la transferencia del yoga a grifos de silano (monosilano, clorosilano, fluorosilano) con un fondo ofensivo de silanos, que se asientan, rectifican, purifican el silano convertido y restauran el silano a silicio metálico. .
Los conductores de silicio puro se obtienen en dos tipos: policristalino(refuerzo de SiCl4 o SiHCl3 con zinc o agua, expansión térmica de SiI4 y SiH4) y monocristalino(Fusión en zona libre de crisol y "bobinado" de un solo cristal de silicio fundido - el método Czochralsky).

Aquí puedes usar el método Czochralski para hacer vibrar el silicio.
método czochralski- el método de hacer vibrar los cristales con un camino de enrollar la colina en el aire en la superficie de la gran obligación de derretirse con la iniciación de la mazorca de cristalización con el camino de llevar el cristal semilla (o una gran cantidad de cristales ) de una estructura dada y orientación cristalográfica en contacto con una superficie libre fundida.
Silicio Zastosuvannya
El silicio especialmente aleado se usa ampliamente como material para la preparación de conductores eléctricos (transistores, termistores, vibradores de potencia, tiristores; fotocélulas sony que se usan en naves espaciales, así como muchas cosas de todo tipo).
Fragmentos de prosoria de silicio para el cambio de pelos largos en el tamaño de 1 a 9 micras, se pueden colocar en óptica infrarroja.
El silicio puede ser diferente y todas las áreas de zastosuvannya, que se están expandiendo. En metalurgia Si
vikoristovuetsya para la eliminación de la acidez (desoxidación) de los metales fundidos.
Silicio depósito una gran cantidad de aleaciones de la sala y metales de color.
Aleaciones sanas de Silicio para aumentar la resistencia a la corrosión, mejorar su poder livar y aumentar la resistencia mecánica; prote con un mayor zmistі Silicon can viklikati kryhkіst.
Los más importantes son las aleaciones, las aleaciones de cobre y aluminio, que se pueden utilizar para vengar cinturones.
La sílice se procesa con vidrio, cemento, cerámica, electricidad y otros galuzes industriales.
La limpieza de silicio es importante para la fabricación de dispositivos electrónicos individuales (por ejemplo, el procesador de su computadora) y microcircuitos de un solo chip.
El silicio puro, utilizado para el silicio puro, la purificación del silicio metalúrgico como silicio cristalino es la principal materia prima para Sony Energy.
Silicio monocristalino: la flor y nata de la electrónica y la ingeniería eléctrica de Sony se utiliza para fabricar espejos de láseres de gas.

Limpieza de silicona y un producto de yoga
Silicio en el cuerpo
El silicio en el cuerpo se encuentra en los ojos de varios spoluks, que participan en el rango principal en la iluminación de partes y tejidos esqueléticos duros. Particularmente rico en silicio puede acumular deaks de algas (por ejemplo, algas diatomeas) y criaturas (por ejemplo, esponjas de cuerno de silicio, radiolaria), que en el momento del océano en el fondo del océano se endurecen por depósitos de óxido de silicio (IV). En mares y lagos fríos, las mulas biogénicas, ricas en silicio, son más importantes, en los mares tropicales, las mulas de vapeo con bajo contenido de silicio. Hierbas, juncos, palmeras y colas de caballo acumulan mucho silicio en medio de los crecimientos terrestres. En las criaturas de la columna vertebral, en lugar de óxido de silicio (IV), en los ríos de ceniza 0.1-0.5%. En el mayor número de manifestaciones de silicio en el alcalino tela feliz, nirkah, bóveda pidshlunkovy. En una dieta complementaria, las personas tienen hasta 1 g de silicio. Con una alta ingesta de óxido de silicio (IV) en el aire, se consume en la legenia de una persona que causa enfermedad: silicosis.
Visnovok
Bueno, de todo, si has leído hasta el final y has penetrado un poco, entonces estás un poco más cerca del éxito. Me escapé, escribo no por nada y me dignó hoch komu. por respeto
SILICIO. (silicio), Si - chem. elemento IV del grupo del sistema periódico de elementos; en. norte. 14, en. m.28.086. Habla de silicio cristalino gris oscuro con un brillo resinoso. En la mayoría de los casos, se revela el grado de oxidación: 4, +2 y +4. El silicio natural está formado por isótopos estables 28Si (92,28%), 29Si (4,67%) y 30Si (3,05%). Retiro de isótopos radiactivos 27Si, 31Si y 32Si con periodos de decaimiento inverso de 4,5 segundos, 2,62 años y 700 años. visto por primera vez en 1811 francés. químico y físico J. L. Gay-Lussac y French. químico L. J. Tenar, pero hay menos identificaciones en 1823 Sueco, químico y mineralogista J. Ya. Berzelius.
Para la anchura en la corteza terrestre (27,6%), silicio-otro (después de agrio) elemento. Saber es importante. en forma de sílice Si02 y otros ácidos ácidos (silicatos, aluminosilicatos, etc.). Para las mejores mentes, se establece una modificación de servilleta estable, que tiene una estructura cúbica centrada en las caras como un diamante, con un período de a = 5,4307 A. La penetración intermitente es de 2,35 A. El ancho es de 2,328 gcm. Con una presión alta (120-150 kbar) vaya a los cables más grandes y modificaciones metálicas. Modificación de metal-superconductor con una temperatura de transición de 6,7 K. Al aumentar la presión, el punto de fusión disminuye de 1415 ± 3 °C a una presión de 1 bar a 810 °C a una presión de 15 104 bar rara). ). Cuando se funde, hay un aumento en el número de coordinación y metalización de los enlaces interatómicos. Carácter silícico amorfo del orden de corto alcance, que muestra una estructura cúbica centrada en el volumen fuertemente creada, casi rara. Debievskaya t-ra está cerca de 645 K. Coef. la expansión lineal de la temperatura cambia con el cambio de t-ri de acuerdo con la ley extrema, menor que t-ri 100 Para el vino se vuelve negativo, alcanzando el mínimo (-0.77 10 -6) grados -1 en t-ri 80 K; en t-rі 310 K el vino es 2.33 10-6 grados-1, y en t-rі 1273 K-4.8 10 grados-1. Calor de fusión 11,9 kcal/g-átomo; tkіp.3520 K.
El calor de sublimación y evaporación a la temperatura de fusión es de 110 y 98,1 kcal/g-átomo. La conductividad térmica y la conductividad eléctrica del silicio radican en la pureza y la minuciosidad de los cristales. Zі rostannyam t-ri coef. la conductividad térmica del K puro aumenta gradualmente (hasta 8,4 cal/cm X X seg en t-ri 35 K), y luego cambia, alcanzando 0,36 y 0,06 cal/cm seg en t-ri vіdpovidno 300 y 1200 K. Entalpia, entropía y capacidad calorífica K. En mentes estándar, es igual a 770 cal/g-átomo, 4,51 y 4,83 cal/g-átomo - deg. Silicio diamagnético, susceptibilidad magnética de sólido (-1,1 10 -7 mu/g) y raro (-0,8 10 -7 mu/g). El silicio se deposita débilmente en t-ri. La energía superficial, el espesor y la viscosidad cinemática de la rara K. a la temperatura de fusión se convierten en 737 erg/cm2, 2,55 g/cm3 y 3 10 m2/seg. Un conductor de silicio cristalino típico con un ancho de zona delimitada de 1,15 ev en t-p 0 a 1,08 u - en t-p 300 K. A temperatura ambiente, la concentración de cargas húmedas es cercana a 1,4 x 10 10 cm - 3;
El poder de caída del silicio debido a la naturaleza y concentración de las casas, así como a la perfección del cristal. Anillo para otrimannya napіvprovіdnikovogo Do. con la conducción del yoga de tipo r y n, se combinan con los elementos IIIb (boro, aluminio, galio) y el subgrupo Vb (fósforo, mish'yak, antimonio, bismuto), que crean sukupnіst vіdpovіdno para el receptor y el donante. , roztashovannyh cerca de los cordones de las zonas. Para la aleación de vicorist, esos otros elementos (por ejemplo,) tienen esa forma. glybokі rivnі, yakі obumovlyuyut enterrar y recombinar los cargos de nariz. Tse te permite tomar materiales con alta electro. soporte (1010 ohm cm a t-rі 80 K) esa pequeña trivialidad de la base de cargas menores de desgaste, que es importante para el aumento en el número de diferentes dependencias. Coeficiente la energía termoeléctrica con silicio solo debe depositarse en el t-ri y en el lugar de la casa, zbіlshyuyuchi zі zrostannym elektroopor (en p = 0.6 ohm - cm, a = 103 microvoltios / granizo). La penetración dieléctrica del silicio (de 11 a 15) se deposita débilmente en el almacén y la minuciosidad de los monocristales. Las leyes de la arcilla óptica del silicio cambian mucho debido al cambio en la pureza, la concentración y la naturaleza de los defectos en la vida, así como la longevidad.
El cordón de arcilla indirecta de kolivan electromagnético está cerca de 1,09 euros, arcilla directa - hasta 3,3 euros. En la región visible del espectro de los parámetros del indicador complejo de fractura (n - ik), ya es posible yacer en la superficie de la casa. Para Do especialmente puro. (enλ \u003d 5461 A y t-re 293 K) n \u003d 4.056 y k \u003d 0.028. La salida del robot de electrónica roza los 48 euros. Tendencia de silicona. Dureza Yogo (t-ra 300 K) para Moos - 7; HB = 240; HV y \u003d 103; I = 1250 kgf/mm2; módulo de normas, elasticidad (policristal) 10890 kgf/mm2. Entre la mineralidad a acostarse en la profundidad del cristal: en la virgen, la profundidad es de 7 a 14; coef. Rigidez 0,325 1066 cm2/kg.
A temperatura ambiente, el silicio prácticamente no interactúa con reactivos similares a gases (incluidos) y sólidos, krіm lіv. Cuando se mueve t-ri, hay una interacción activa con metales y no metales. Zocrema, que disuelve carburo de SiC (a temp. 1600 K), nitruro de Si3N4 (a temp. 1300 K), fosfuro SiP (a temp. 1200 K) y arseniuro Si As, SiAS2 (a temp. 1000 K). Con reacción ácida a una temperatura de 700 K, apagando el dióxido de Si02, con halógenos: fluoruro de SiF4 (a una temperatura de más de 300 K), cloruro de SiCl4 (a una temperatura de más de 500 K), bromuro de SiBr4 (a una temperatura de 700 K) yo nodo SiI4 (a pf 1000). Reaccionando intensamente con muchos otros. metales, estableciéndose sólidas diferencias en su sustitución por chi chem. en la mitad - siliciuros. Las áreas de concentración de homogeneidad de rosas sólidas ocurren dependiendo de la naturaleza de la roseta (por ejemplo, Nimechchin en 0 a 100%, en otoño hasta 15%, en alfa circonio menos de 0.1%).
La diferencia entre metales y no metales en el silicio sólido es significativamente menor y suena retrógrada. Con lo que bordea, en lugar de una casa, lo que se está haciendo en Do. no muy profundo, alcance el máximo ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 cm) área t-r de 1400 a 1600 K. Casas con rіvenny vіdznyayutsya un poco más pequeño rozchinnіstyu (1015 para selenio y 5 10 16 para zalіza hasta 7 10 17 para níquel y 10 18 cm-3 para midi). Al ser un acero raro, el silicio no está rodeado de metales comunes, a menudo con grandes visiones de calor. El silicio puro se prepara a partir de un producto técnico 99% Si і - 0,03% Fe, Al і Co), templado con cuarzo y carbón en hornos eléctricos. Comience con un nuevo aliento a las casas (sum_shy clorhídrico y sirchanoy, y luego fluoruro de agua y sirchanoy), después de lo cual se retira el producto (99,98%), se trata con cloro. Las síntesis se purifican por destilación.
El conductor de silicio se usa en combinación con cloruro de SiCl4 (o SiHCl3) en agua o expansión térmica de hidruro de SiH4. La purificación residual y la molienda de monocristales se lleva a cabo con un método suave de zona sin crisol o por el método Czochralsky, teniendo en cuenta especialmente la salsa pura (en la casa hasta 1010-1013 cm-3) cf\u003e 10 3 ohm cm.iv en que entrar dosificación del número de viviendas necesarias. Así se preparan cremas cilíndricas de 2-4 cm de diámetro y 3-10 cm de largo, para especiales. El propósito es producir aún más monocristales. Silicio técnico y especialmente aleaciones de aceros viricosos y aleaciones, así como aditivos ligeros. Se sabe que el K. monocristalino de zrazki particularmente puro, dopado con varios elementos, se utiliza como base de varios accesorios de baja corriente (zocrema, termoeléctrico, radio, luz y fototécnica) y alta corriente (vibración, conversión).
Silicio y silicio
El silicio se lleva a los no metales y 4 electrones pueden estar en el mismo nivel de energía. Vіn can vіddavati їх, mostrando la etapa de oxidación + 4 y agregar electrones, mostrando la etapa de oxidación - 4. Sin embargo, la capacidad de agregar electrones al silicio es significativamente menor, inferior al carbono. Los átomos de silicio pueden tener un radio más grande, átomos de carbono más bajos.
El conocimiento de la naturaleza del silicio. .
Arco de silicona de extensiones en la naturaleza. por її parte de la caída pon más del 26% de la masa sarampión de la tierra. Por la anchura de los vinos, reposar en otro lugar (después del agrio). En el vіdmіnu vimos uglec C vіlny stіnі vіrіdі not zustrichaetsya. Entran al almacén de varias composiciones químicas, principalmente varias modificaciones de óxido de silicio (IV) y sales de ácidos silícicos (silicatos).
Obsesión por el silicio .
El silicio de grado industrial de pureza técnica (95 - 98 %) está dominado por SiO 2 coque en hornos eléctricos durante el tostado:
SiO 2 + 2C \u003d Si + 2CO
SiO2 + 2Mg \u003d Si + 2MgO
De esta forma, se toma de las casas polvo de silicio amorfo de color marrón. La recristalización de metales fundidos (Zn, Al) se puede transferir a un molino de cristal.
El tetracloruro de silicio, incluso de alta pureza, se utiliza a 1000°C para el tetracloruro de silicio SiCl 4 pares de zinc:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
ese yogo de limpieza siguiendo métodos especiales.
Físico poder quimico silicio.
El silicio cristalino puro - tenditnaya y la cuesta dura, flácida. Como un diamante, tiene una red cristalina cúbica con un tipo de enlace covalente. Yogo punto de fusión 1423 °C. Para las mentes más grandes, un elemento inactivo de silicio, que solo reacciona con el flúor, pero cuando se calienta, entra en diversas reacciones químicas.
Yogo vikoristovuyut como un material valioso para napіvprovіdnikovіy tehnіtsі. Combinado con otros conductores de vino, se distingue por una importante resistencia a los ácidos diluidos y una gran resistencia eléctrica hasta los 300 °C. Silicio técnico y ferrosilicio vicorista también en metalurgia para aceros resistentes al calor, resistentes a los ácidos y para herramientas, chavuns y otras aleaciones ricas.
Con metales de silicio químicas, Llamados siliciuros, cuando se calientan con magnesio, el siliciuro de magnesio se disuelve:
Si + 2Mg = Mg 2 Si
Los siliciuros de metales detrás de la estructura de ese dominio predicen carburos, por lo que los siliciuros similares a metales, al igual que los carburos similares a metales, se distinguen por su gran dureza, alto punto de fusión y conductividad eléctrica caliente.
Al freír sumish pisku con coque en hornos eléctricos, el carburo de silicio y el carbón se mezclan con carburo de silicio o carborundum:
SiO2 + 3C = SiC + 2CO
El carborundum es un discurso duro refractario, sin barras, un valioso material abrasivo y térmico. Carborundum, yak i, maє grati cristalino atómico. En la estación limpia hay un aislante, pero en presencia de la casa, se convierte en conductor.
Yak de silicona i , disuelve dos óxidos: óxido de silicio (II) SiO y óxido de silicio (IV) SiO 2 . El óxido de silicio (IV) es un discurso refractario duro, de naturaleza muy extendida en el país libre. Tse habla químicamente estable, que interactúa solo con flúor y flúor gaseoso en agua o ácido fluorhídrico:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Apuntando directamente a las reacciones se explica por el hecho de que el silicio puede tener una gran esporidicidad al flúor. Además, el tetrafluoruro de silicio es un discurso volador.
En tekhnіtsі prozoriya SiO 2 vykorovuyut para la preparación de una losa de cuarzo refractario estable, ya que amablemente pierde el cambio ultravioleta, puede tener un gran coeficiente de expansión, que muestra los cambios significativos en la temperatura. La modificación amorfa del óxido de silicio (II) tripoli tiene una gran porosidad. Yogo vikoristovuyut como aislante térmico y acústico para dinamita vibrante (discurso de vibukhovo de nariz), etc. El óxido de silicio (IV) en un sonido vibrante es uno de los principales materiales cotidianos. Es virtuoso en la producción de materiales resistentes al fuego y al ácido, acero, como un fundente en metalurgia, etc.
De acuerdo con las fórmulas moleculares, el poder químico y físico del óxido de carbono (IV) y el óxido de silicio (IV) es fácil de tratar, cuyo poder de estos es similar en almacén de productos químicos z'ednan raznі. ¿Por qué se explica que el óxido de silicio (IV) se forma no solo a partir de moléculas de SiO 2 , como los asociados s їх, en algunos de ellos los átomos de silicio están unidos por los átomos de ácido. Óxido de silicio (IV) (SiO 2 )norte. Imagen її en la plaza:
Otro representante de los elementos del subgrupo cabeza del grupo IV (grupo IVA) del Sistema Periódico de D. I. Mendeliev - silicio Si.
En la naturaleza, el silicio es otro elemento químico de la anchura del ácido. La corteza terrestre se pliega cada vez más trimestralmente a partir de yogo spoluk. El silicio más difundido es el óxido de silicio (IV) SiO 2, el otro nombre es sílice. En la naturaleza, los vinos se elaboran con el mineral cuarzo (pequeño 158), una rica variedad de este tipo - cristal girsky, y también la famosa forma lila - amatista, así como ágata, ópalo, jaspe, calcedonia, cornalina, en forma de virobnі y piedras intoxicantes. El óxido de silicio (IV) también se compone de una notable arena de cuarzo.

Mal. 158.
Cristales de cuarzo intercalados en dolomita
Tres minerales diferentes a base de óxido de silicio (IV) (pedernal, calcedonia y otros) primeras personas preparó znaraddya pracі. El mismo pedernal, que pasa desapercibido y no es más estrecho que una piedra, coloca la mazorca de una piedra - vіtsі kremіnyh znaryad pratsі (Fig. 159). Hay dos razones para esto: la amplitud y la disponibilidad de pedernal, así como la construcción de edificios con los bordes afilados.

Mal. 159.
Znaryaddya piedra vіku
Otro tipo de materiales naturales para el silicio es el silicato. Entre ellos se encuentran los mayores anchos de aluminosilicatos (se entendió que estos silicatos pueden reemplazar al elemento químico aluminio). El granito se agrega a los aluminosilicatos, ver diferente arcilla, mica. Silicato, que no venga al aluminio, por ejemplo, asbesto, que se utiliza para fabricar fuegos artificiales.
El óxido de silicio (IV) SiO 2 es necesario para la vida de los cultivadores y las criaturas. Los vinos dan los tallos de roslin y zahisnymi velos de criaturas (Fig. 160). Zavdyaki yomu colas, colas y colas de caballo se colocan mitzno, como bagnets, gostre hojeando juncias cortadas, como cuchillos, rastrojos en un campo inclinado, como una cabeza, y tallos de cereales en el suelo de una mitzna, que no permiten campos de maíz en los campos. acostarse en una tabla y viento. Costilla de Luska, conchas de coma, krill meteliks, pir'ya ptahiv en lana de criaturas de mіtsnі, oskіlki smite silica.

Mal. 160.
El óxido de silicio (IV) da mineralidad a los tallos de roslin y a las asfixiantes curvas de las criaturas
El silicio Z'ednannya da suavidad y suavidad al cabello y las uñas de una persona.
Silicio para entrar y llegar al almacén de los organismos vivos inferiores: diatomeas y radiolarios, los senos más bajos de la materia viva, como si crearan sus imperfecciones detrás de la belleza del esqueleto con sílice (Fig. 161).
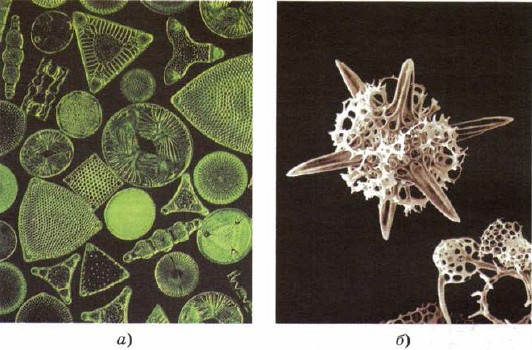
Mal. 161.
Los esqueletos de diatomeas (a) y radiolarios (b) están compuestos de sílice
El dominio del silicio. Está utilizando una microcalculadora con una batería de Sony, por lo que hay un aviso sobre el silicio cristalino. Tse napіvprovіdnik. En el vіdmіnu vid metaliv, z pіdvishennyam temperatura yogo elektroprovіdnіst zbіshuєtsya. En satélites, naves espaciales, estaciones y dahah budinkiv (pequeño 162) instalan baterías Sony que convierten la energía Sony en electricidad. El hedor funciona con cristales de napіvprovіdnikіv, y en el primer pedernal negro. Las fotocélulas de silicio se pueden convertir en electricidad hasta un 10% de la energía de Sony arcillosa.

Mal. 162.
Batería soñolienta para cabina dahu
Silicio para quemar en la acidez, satisfizándote con óxido de silicio (IV):
![]()
Al ser no metálico, cuando se calienta, el silicio se fusiona con los metales con soluciones de siliciuro, por ejemplo:
![]()
Los siliciuros se esparcen fácilmente con agua o ácidos, cuando se ve un silicio similar al agua similar a un gas - silano:
En la superficie de los carbohidratos, el silano en la superficie se autoengancha y se quema con óxido de silicio disuelto (IV) y agua:
El aumento de la reacción entre el silano y el metano CH 4 se explica por el hecho de que la expansión del átomo de silicio es más grande, más baja en el carbono, por lo que los enlaces químicos Si-H son más pequeños, los enlaces C-H son más bajos.
Interacción de silicio con cambios de agua concentrados de prados, haciendo silicato y agua:
El silicio posee, similar al óxido de silicio (IV) magnesio o carbono:
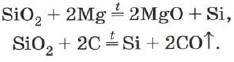
Óxido de silicio (IV), o dióxido de silicio, o sílice SiO 2 yak en CO 2 є óxido ácido. Sin embargo, en la superficie del CO2, hay una red cristalina molecular, pero atómica. A que el SiO 2 es duro y refractario al habla. Los vinos no se diferencian en los ácidos del agua, la crema hidrofluorídica y el aloe a altas temperaturas con los prados con sales disueltas de ácido silícico - silicatos:
La sílice también se puede utilizar para alear óxido de silicio (IV) con óxidos metálicos o carbonatos:
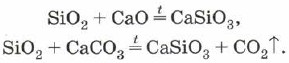
Los silicatos de sodio y potasio se denominan losas de venta al por menor. Їх suministro de agua- Es bueno usar pegamento de silicato.
Ácido silícico H 2 SiO 3 (Fig. 163):
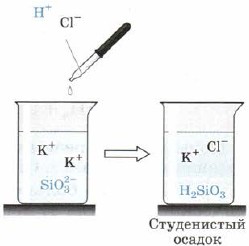
Mal. 163. Reacción ácida a iones de silicato.
Además, H2SiO3 también es un ácido débil. Es incoherente en el agua y cae del tumulto reaccionario al mirar la escoria del asedio, que a veces comprime todo el volumen de la diferencia, transformándolo en una masa sólida, voy a la jalea, jalea. Al colgar masi, se establece un discurso altamente poroso: gel de sílice, que se usa ampliamente como adsorbente: arcilla de otros discursos.
Certificado de Laboratorio No. 40
Posesión de ácido silícico y esa reivindicación del poder
inyección de silicio. Ya sabes que el silicio se utiliza para la producción de materiales conductores, así como aleaciones resistentes a los ácidos. Cuando la arena de cuarzo se fusiona con lana a altas temperaturas, se disuelve el carburo de silicio SiC, que solo está disponible para el diamante. Por lo tanto, es necesario vicoratear para afilar metalorіzalnyh verstatіv y pulir piedra costosa.
A partir del cuarzo fundido, se preparan varios platos de cuarzo químico, que pueden soportar altas temperaturas y no se agrietan cuando están fríos.
Z'ednannya silicon є la base para la deformación del almacén al cemento.
El error de Zvichayne puede almacenarse, que se puede expresar mediante la fórmula Na 2 O CaO 6SiO 2. Yogo se gana en hornos especiales con soda sumish fusionada, vapnyak y piska.
Vіdmіnna rice skla - zdatnіst rozm'yakshuvatisya en el oleaje de acero fundido, ya sea una forma, ya que se guarda cuando se captura el almacén. Sobre la base de la cual se hacen los utensilios y se hacen los demás artículos.
Dodatkovі yakosti sklu da diferentes aditivos. Así, la introducción de óxido de plomo se reduce a un color cristalino, el óxido de cromo se vuelve de color verde, el óxido de cobalto es azul, etc. (Fig. 164).

Mal. 164.
Productos del almacén de color
Sklo es uno de los enólogos más antiguos del pueblo. Ya 3-4 tejos. Por este motivo, estalló la guerra en Egipto, Siria, Finiki y el Mar Negro.
Sklo: el mismo material no es menos que remіsnikіv, pero también artistas. El maestro alcanzó el más alto nivel de perfección. antigua roma, como si fueran capaces de quitarle la vertiente de color y trabajo a sus mosaicos.

Mal. 165.
Vidrio coloreado en las vidrieras de la Catedral de Notre Dame, Chartres
Crear obras de arte desde el almacén con obov'yazkovymi atributos de un gran museo, y coloridas vidrieras de la iglesia, paneles de mosaico - colillas brillantes de este (Fig. 165). En una de las instalaciones de la sucursal de San Petersburgo de la Academia Rusa de Ciencias, hay un retrato en mosaico de Pedro I, victorioso M. V. Lomonosov (Fig. 166).

Mal. 166.
Retrato en mosaico de Pedro I
Las áreas de congestión son bastante grandes. Tse vikonne, plyashkove, lampov, dzerkalne sklo; pendiente óptica: desde oculares hasta anteojos para cámaras; lentes de dispositivos ópticos indistinguibles, desde microscopios hasta telescopios.
El segundo material más importante, los revestimientos a base de silicio, es el cemento. Yogo se usa para hornear arcilla y vaporizar en hornos especiales que están envueltos.
Si el polvo de cemento se mezcla con agua, entonces el cemento no está firmemente establecido, de lo contrario, como se llama despertadores, cemento rozchin, que es más duro paso a paso. Al agregar concreto al cemento o piedra triturada, el concreto debe quitarse como una capa superior. La materialidad del hormigón va creciendo, de modo que en el nuevo se introduce un nuevo marco - sale el hormigón colado, del que se hacen las paredes del panel, bloques de solapes, puentes fermi, etc.
El almacén se dedica a la producción de cemento. industria del silicato. Vaughn también produce cerámica de silicato: ceglu, porcelana (pequeña 167), fayenza y artículos de ellos.

Mal. 167.
Variedades de porcelana
Vіdkrittya silicio. Aunque en la antigüedad la gente obtuvo una amplia victoria en el uso del silicio, el silicio en sí mismo fue eliminado por primera vez en 1824 por el químico sueco J. Ya. Berzelius. Sin embargo, 12 años antes del nuevo pedernal, se llevaron a J. Gay-Lussac y L. Tenard, ale vin duzhe zabrudneniy houses.
El nombre latino silicum toma su mazorca de la palabra latina silex-flint. El nombre ruso "silicio" se asemeja a la nuez kremnos - "skel, skel".
Nuevas palabras que entienden
- Fuentes naturales de silicio: sílice, cuarzo y otras variedades, sílice, aluminosilicato, amianto.
- Importancia biológica del silicio.
- El dominio del silicio: napіvprovіdnikovі, interacción con ácidos, metales, prados.
- silano.
- Óxido de silicio (IV). Yoga Budova y potencia: interacción con praderas, óxidos básicos, carbonatos y magnesio.
- Ácido silícico y sales її. Rozchinne solo.
- Zastosuvannya silicio y yogo mitad.
- Sklo.
- Cemento.
nombra el día
La mayoría de las veces en la naturaleza, el silicio se encuentra en una apariencia similar a la sílice, una base basada en dióxido de silicio (IV) SiO 2 (alrededor del 12% de la masa de sarampión de la tierra). Los principales minerales y rocas que se apagan con dióxido de silicio son la cadena (rica y cuarzo), cuarzo y cuarcita, pedernal, polov_spar. La sílice y el aluminosilicato se pliegan entre sí por el ancho en la naturaleza.
Se anota uno por uno el hecho de la importancia del silicio puro en su apariencia nativa.
Otrimannya
Saldrá silicio al freír pisku blanco crocante (dióxido de silicio) con magnesio:
S yo O 2 + 2 METRO gramo → 2 METRO gramo O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \rightarrow \ 2MgO+Si)))cuando te establezcas silicio amorfo , lo que puede parecer polvo marrón.
En la industria, la pureza técnica del silicio se obtiene fundiendo SiO 2 con coque a una temperatura de aproximadamente 1800 ° C en hornos térmicos de mineral del tipo de eje. La pureza del silicio eliminado por tal grado puede alcanzar el 99,9% (las casas principales son carbón, metal).
Puede alejarse de la purificación de silicio de las casas.
- La purificación en los baños de laboratorio puede realizarse por un camino de posesión frontal de siliciuro de magnesio Mg 2 Si. Le dimos siliciuro de magnesio a los ácidos clorhídrico u óctico adicionales para eliminar el monosilano SiH 4 similar a un gas. El monosilano se purifica mediante rectificación, sorción y otros métodos, y luego se coloca sobre silicio y agua a una temperatura de aproximadamente 1000 °C.
- La purificación del silicio a escala industrial se lleva a cabo por un camino de cloración no intermedia del silicio. Con esto se disuelven los semipliegues del depósito SiCl 4, SiHCl 3 y SiH 2 Cl 2 . Їх de una manera diferente limpiar la casa (por regla general, por destilación y desproporción) y en la etapa final agregar agua pura a temperaturas de 900 a 1100 °C.
- Se están desarrollando tecnologías industriales más baratas, limpias y eficientes para la purificación del silicio. Para 2010 ante ellos es posible introducir tecnologías para la purificación de silicio con flúor vicario (en sustitución del cloro); tecnologías que transfieren la destilación al monóxido de silicio; tecnologías basadas en casas de vidrieras que se centran en los límites entre cristales.
Vmіst domіshok en el silicio finalizado se puede reducir a 10 -8 -10 -6% por masa. Más informes sobre la nutrición del silicio puro se revisan en el artículo Silicio policristalino.
El método de obtención de silicio en forma pura de fragmentación por Mikola, Mikolayovich Beketov.
Poder físico
La red cristalina de silicio es cúbica centrada en las caras como el diamante, parámetro a = 0.54307 nm (a tornillo de banco alto eliminar otras modificaciones polimórficas al silicio), pero a través de un enlace más grande entre los átomos de Si-Si en un enlace con un enlace zv'azku S-S la dureza del silicio es significativamente menor que la del diamante. Silicio crepitante, solo cuando se calienta a 800°C, se convierte en habla plástica. En prozory para infrachervonogo viprominyuvannya s dozhini khvili 1.1 micras. La concentración húmeda de la nariz en la carga es de 5,81 × 10 15 m-3 (para una temperatura de 300 K).
Poder electrofísico
El silicio elemental en forma monocristalina es un conductor de separación indirecta. El ancho del área cercada en temperatura ambiente almacenamiento 1.12 eV, y en T \u003d 0 K - 1.21 eV. La concentración de portadores de carga húmedos en silicio para mentes normales se acerca a 1,5 · 10 10 cm −3 .
Sobre el poder electrotrófico del silicio cristalino, una gran afluencia construye casas que deambulan en la oscuridad. Para extraer cristales de silicio con una conductividad profunda, se introducen en el silicio átomos de elementos del grupo III, como boro, aluminio, galio e indio. Para extraer cristales de silicio con conductividad electrónica a silicio, introduzca átomos elementos V-ї groupi, como fósforo, mish'yak, surma.
Cuando los dispositivos electrónicos se ensamblan a base de silicio, es importante adherir la bola de superficie al material (hasta decenas de micras), para que la calidad de la superficie del cristal se pueda agregar al poder electrostático del silicio y, aparentemente, en el poder de la herramienta terminada. En el curso del ensamblaje de ciertos dispositivos, se agrega vicorous, se aplica a la modificación de la superficie, por ejemplo, la superficie se recubre con silicona con varios agentes químicos y її oprominennya.
poder quimico
Al igual que los átomos de carbono, los átomos de silicio se caracterizan por la hibridación sp 3 de los orbitales. En el enlace con la hibridación, el silicio cristalino puro produce granos similares a diamantes, en los que el silicio es covalente. Al mismo tiempo, el sonido del silicio también se manifiesta como un elemento covalente con un estado de oxidación de +4 o -4. Zustrichayutsya medio silicio bivalente, por ejemplo, óxido de silicio (II) - SiO.
Para las mentes normales, el silicio es químicamente inactivo y reacciona activamente solo con flúor gaseoso, con el cual se disuelve el tetrafluoruro de silicio volátil SiF4. Tal “inactividad” del silicio se debe a la pasivación de la superficie de la bola nanométrica de dióxido de silicio, que se asienta negativamente en presencia de agua ácida, una y otra vez (vapor de agua).
acidificación con el dióxido de SiO 2 disuelto, el proceso va acompañado de un aumento en el volumen de la bola de dióxido en la superficie, la estabilidad del proceso de oxidación está limitada por la difusión del ácido atómico y el dióxido de crioconservación.
Cuando se calienta a una temperatura de más de 400-500 ° C, el silicio reacciona con cloro, bromo y yodo, con la adopción de tetrahaluros fácilmente volátiles SiHal 4 y, posiblemente, haluros en un almacén plegado.
Con agua, el silicio sin un medio no reacciona, pero con agua, el silicio (silanos con la fórmula Si n H 2n + 2) posee un camino indirecto. El monosilano SiH 4 (yogo a menudo se denomina simplemente silano) se observa en la interacción de siliciuros metálicos con ácidos, por ejemplo:
C un 2 S yo + 4 H C l → 2 C un C l 2 + S yo H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \rightarrow \ 2CaCl_(2)+SiH_(4)\ ) flecha arriba)))El silano SiH 4, que se disuelve en esta reacción, vende casas y otros silanos, zokrem, Si 2 H 6 disilano y Si 3 H 8 trisilano, en algunas lancetas para átomos de silicio, unidos entre sí por enlaces simples (- Si -Si-Si- ) .
El silicio reacciona con el nitrógeno y el boro a temperaturas cercanas a los 1000 °C, disolviendo el nitruro Si 3 N 4 y los boruros SiB 3, SiB 6 y SiB 12 térmica y químicamente estables.
A temperaturas superiores a 1000 ° C, es posible utilizar silicio que es el análogo más cercano a la tabla periódica - carbono - carburo de silicio SiC (carborundo), que se caracteriza por una alta dureza y baja actividad química. El carborundo es ampliamente utilizado como material abrasivo. Con esto, sin embargo, la fusión del silicio (1415 °C) puede ponerse en contacto durante tres horas con el carbón a la vista de los grandes trozos de grafito de grano fino sinterizado de prensado isostático, prácticamente sin cambiar y sin interferir con el resto.
Los elementos inferiores del cuarto grupo (Ge, Sn, Pb) no están recubiertos de silicio, al igual que la mayoría de los demás metales. Cuando se calienta con silicio y metales, se pueden formar sus semicapas, siliciuros. Los siliciuros se pueden subdividir en dos grupos: iónico-covalentes (siliciuros de charco, charco-tierra y magnesio tipo Ca 2 Si, Mg 2 Si e in) y similares a metales (siliciuros de metales de transición). Los siliciuros de metales activos se disponen bajo la dilución de ácidos; Los siliciuros similares a metales tienen un alto punto de fusión (hasta 2000 °C). Los almacenes de siliciuro de tipo metálico se utilizan con mayor frecuencia A mí Si, A mí 3Si2, A mí 2 si 3 , A mí 5 si 3 yo A mí Si 2 . Los siliciuros similares a metales son químicamente inertes, resistentes a la acidez a altas temperaturas.
Es especialmente importante señalar que el silicio sella la suma eutéctica, que permite el spiking (fusión) de materiales para el sellado de cerámicas de ferrosilicio a temperaturas sensiblemente inferiores a la temperatura de fusión del sello y el silicio.
Al agregar SiO 2 al silicio a temperaturas superiores a 1200 ° C, se disuelve el óxido de silicio (II) - SiO. Este proceso se apoya constantemente en la producción de cristales por métodos de silicio.
Silicio a la vanguardia de las visiones en 1811. J.Gay-Lussac y L.Tenar al pasar vapores de fluoruro de silicio sobre potasio metálico, no describen las proteínas como un elemento. químico sueco J. Berzelius en 1823 dando una descripción del silicio removido por él durante el procesamiento de la sal de potasio K 2 SiF 6 con potasio metálico a alta temperatura. El nuevo elemento se denominó "silicio" (lat. silex - pedernal). El nombre ruso "silicio" fue introducido en 1834 por el químico ruso Herman Ivanovich Hess. En la traducción de otro griego. krhmnoz- Kut, montaña.
Conocimiento en la naturaleza, otrimannya:
En la naturaleza, el silicio se encuentra en dióxido vibrante y silicatos en un almacén diferente. El dióxido de silicio natural es más importante en forma de cuarzo, queriendo usar otros minerales: cristobalita, tridimita, ballena, cousite. La sílice amorfa se acumula en los depósitos de diatomeas en el fondo de los mares y océanos; estos depósitos se asentaron con SiO 2 y entraron en el almacén de diatomeas y otros ciliados.
El silicio de Vilniy se puede usar para tostar con magnesio un pisku blanco crujiente, que para un almacén químico se puede limpiar con óxido de silicio SiO 2 + 2Mg = 2MgO + Si. En la industria, la pureza técnica del silicio se obtiene fundiendo SiO 2 con coque a una temperatura de unos 1800 °C en hornos de arco. La pureza del silicio obtenido por tal rango puede alcanzar el 99,9% (las casas principales son carbón, metal).
Poderes físicos:
El silicio amorfo puede parecer un polvo marrón, cuyo espesor es más denso 2,0 g / cm 3. Silicio cristalino - gris oscuro, brillante habla cristalina, cristalizado y duro, cristaliza en diamantes. Este es un conductor típico (es mejor conducir electricidad, caucho de tipo aislante más bajo y más alto para un conductor - medio). Silicio crepitante, solo cuando se calienta a 800°C, se convierte en habla plástica. Cіkavo, scho siliceous prosorium a infrachervony viprominyuvannya, comenzando con un viento largo de 1,1 micras.
Poder químico:
Químicamente silicio de baja actividad. A temperatura ambiente, solo reacciona con flúor gaseoso, el tetrafluoruro de silicio volátil SiF 4 se disuelve a esta temperatura. Cuando se calienta a una temperatura de 400-500 ° C, el silicio reacciona con ácido con dióxido disuelto, con cloro, bromo y yodo, con tetrahaluros SiHal 4 fácilmente volátiles disueltos. A temperaturas cercanas a 1000 ° C, el silicio reacciona con nitrógeno para disolver nitruro Si 3 N 4 con boro - boruro térmica y químicamente estable SiB 3, SiB 6 y SiB 12. Con agua el silicio no reacciona sin intermediario.
Para el grabado con silicio, la suma de los ácidos fluorhídrico y nítrico es la más utilizada.
Instalado en los prados.
El silicio se caracteriza por un paso de oxidación de +4 o -4.
Los campos más importantes:
Dióxido de silicio, SiO 2- (anhídrido de silicio) ...
...
Ácidos silícicos- débil, indistinto, utvoryuyuyutsya cuando se agrega ácido al tamaño del silicato que parece un gel (habla similar a la gelatina). Solo se sabe que H 4 SiO 4 (ortosilicio) y H 2 SiO 3 (metasilicio o silicio) varían y se convierten irrevocablemente en SiO 2 cuando se calientan y se secan. Producto sólido poroso para entrar - gel de sílice puede abrirse en la superficie y ser viscoso como adsorbente de gases, agente desecante, catalizador y catalizador de desgaste.
silicato- Las sales de los ácidos silícicos del bien (crym silicatos de sodio y potasio) no son solubles en agua. fuerza.
Cascadas- análogos de carbohidratos, silani, a medias, en algunos átomos de silicio con un enlace simple, fortaleza yakscho atom silicon z'єdnаnі podvіyny zv'yazkom. Las lanzas y kiltsya se usan de manera similar a los carbohidratos. Todos los poderes pueden ser autónomos, hacer vibraciones de sumish con repetición y reaccionar fácilmente con el agua.
Zastosuvannya:
La cantidad más significativa de silicio se conoce para la selección de aleaciones para la aplicación de aluminio, cobre y magnesio, y para la selección de ferosilicidas, que pueden ser importantes para la selección de aceros y equipos de calefacción. Cristales de silicio zastosovuyut baterias sony y napіvprovіdnikovih dependencias - transistores y diodos. El silicio también sirve como syrovina para la producción de losas de organosilicio, o siloxanos, que se tiñen con aceite, aceite, plásticos y cauchos sintéticos. Babosas inorgánicas el vicorista de silicio se utiliza en la tecnología de la cerámica y el acero, como material aislante y p'ezocrystals
Para algunos organismos, el silicio es un elemento biogénico importante. Entre al almacén de las cabañas de apoyo en el roslin y el esqueleto, en las criaturas. Los organismos marinos (diatomeas, algas, radiolarios, esponjas) se concentran en grandes áreas de silicio. Grandes números las colas de caballo y los cereales se concentran con silicio, en el primer negro - Bambú y Pidrodins parecidos al arroz, entre ellos - la siembra de arroz. M'yazova tejido de una persona a la venganza (1-2) 10 -2% de silicio, tejido óseo - 17 10 -4%, sangre - 3,9 mg / l. Sin embargo, hoy en día se puede ingerir hasta 1 g de silicio en el cuerpo de una persona.
Antonov SM, Tomilin K.G.
HF Universidad Estatal de Tyumen, grupo 571.
