Esquema de la estructura de silicio. Estructura de concha electronica
Posición de la estructura atómica en PS: Período III; grupo IV, líder; Carga del kernel: +14 Si; Masa atómica relativa: Ar (Si) = 28 Estructura atómica: p = 14, e = 14, n = = 14 Fórmula electrónica: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
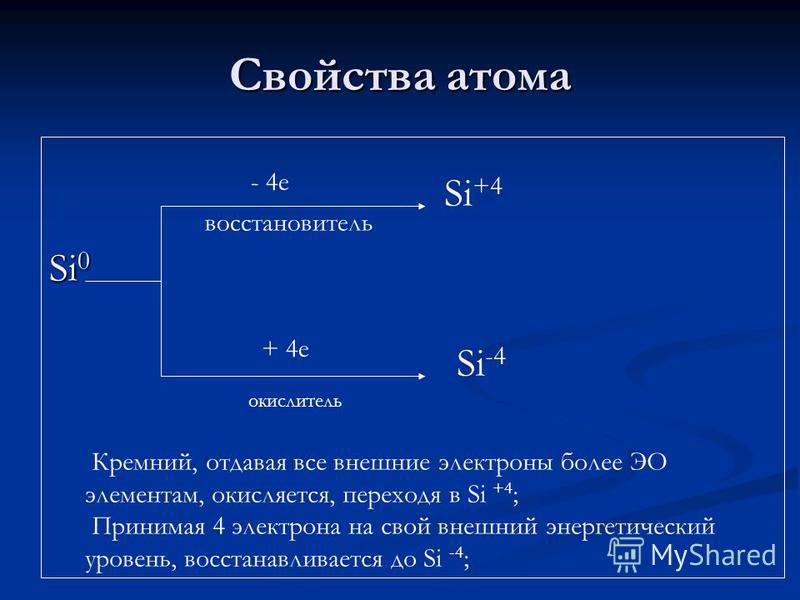
Propiedades atómicas Agente reductor de Si e + 4 e oxidante Si + 4 Si -4 El silicio, que proporciona todos los electrones externos a más elementos EO, se oxida y pasa a Si + 4; Llevando 4 electrones a su nivel de energía externa, se reduce a Si-4;

Propiedades físicas del silicio El silicio es un no metal, existe en un estado cristalino y amorfo. El silicio cristalino es una sustancia de acero grisáceo con un brillo metálico, muy duro pero frágil. Silicio amorfo - polvo marrón. p = 2,33 g / cm 3; t pl = C; t kip. = C;

Estructura cristalina de silicio Una red cristalina de silicio es un tipo de diamante cúbico centrado en la cara. Pero debido a la mayor longitud de unión entre Si - Si, la dureza del silicio es significativamente menor que la del diamante. El silicio es frágil, solo cuando se calienta por encima de C.

Electro propiedades físicas Silicio elemental El silicio elemental es un semiconductor típico. Semiconductor típico. Las propiedades electrofísicas del silicio cristalino están muy influenciadas por las impurezas traza que contiene. Para obtener monocristales de silicio con conductividad tipo p, se introducen en el silicio aditivos de elementos del 3er grupo de boro, aluminio, galio e indio, con conductividad electrónica del aditivo. elementos V Grupos de fósforo, arsénico o antimonio.


Flint Flint, este Flint, esta piedra fea y muy fea y muy duradera, piedra duradera, sentó las bases para un comienzo de piedra de la Edad de Piedra: el siglo, el siglo de las herramientas de trabajo de pedernal. herramientas de pedernal. Hay dos razones: - la prevalencia y la disponibilidad de silicio; - la prevalencia y disponibilidad de silicio; - la capacidad de formar bordes cortantes afilados cuando se astilla; - la capacidad de formar bordes cortantes afilados cuando se astilla;




¿Sabe que ...? El método para obtener silicio en su forma pura fue desarrollado por Nikolai Nikolayevich Beketov. El silicio en Rusia se produce en fábricas: Kamensk - Uralsky (región de Sverdlovsk). Kamensk - Uralsky (región de Sverdlovsk) Shelekh (región de Irkutsk). Shelekh (región de Irkutsk).

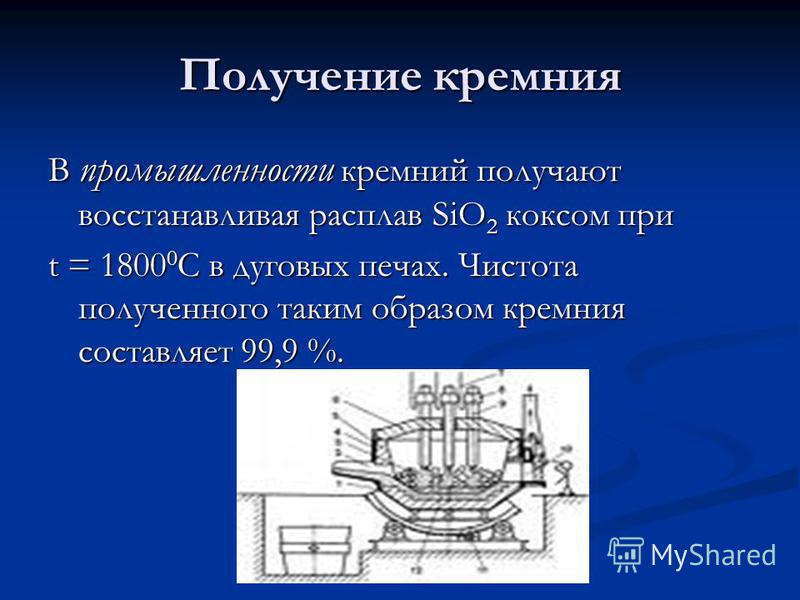
Producción de silicio En la industria, el silicio se obtiene reduciendo la masa fundida de SiO 2 mediante coque a t = C en hornos de arco. La pureza del silicio así obtenido es del 99,9%.
Obtención del método de producción de laboratorio de silicio: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Propiedades químicas del silicio Cuando se calienta a 400 ° C, el silicio reacciona con el oxígeno para formar dióxido de silicio: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
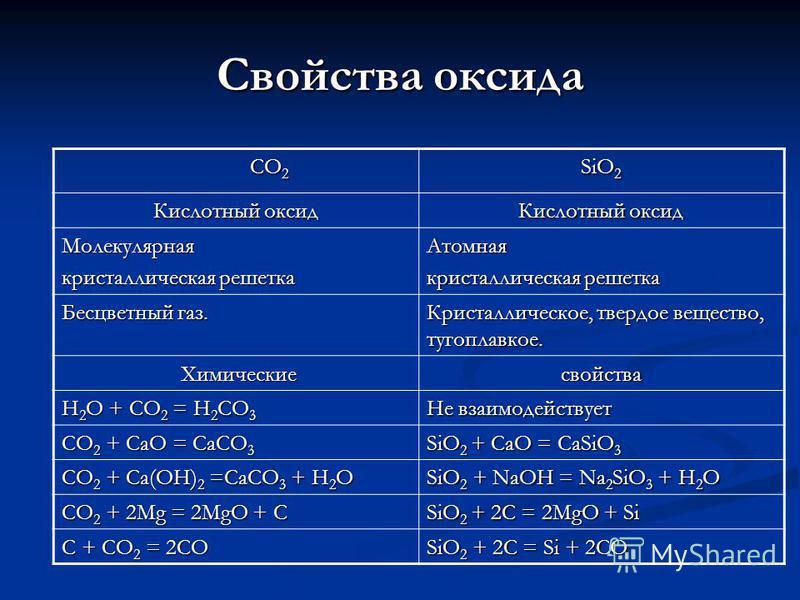
Propiedades del CO 2 CO 2 SiO 2 óxido Óxido Ácido molecular Cristal atómico Gas incoloro. Cristalino, sólido, refractario. Químico Propiedades químicas H 2 O + CO 2 = H 2 CO 3 No reacciona CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Propiedades de los ácidos H 2 CO 3 H 2 SiO 3 Dibásico, que contiene oxígeno, débil, frágil, ya que volando Dibásico, que contiene oxígeno, débil, insoluble en agua. Recibiendo: CO 2 + H 2 O = H 2 CO 3 Recibiendo: SiO 2 + H 2 O = no Inestable, frágil, se descompone cuando está de pie o caliente: H 2 CO 3 = CO 2 + H 2 O No se puede seleccionar en su forma pura, porque se descompone cuando se calienta: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Evolución menor de gas __________

Ácidos carbónicos del ácido silícico - Carbonatos; - hidrocarburos; - silicatos; - silicatos; Los carbonatos tienen todas las propiedades de las sales, son electrolitos fuertes, se disocian completamente en iones (solubles en agua). Solo las sales de metales alcalinos son solubles, las otras forman insolubles o no forman sales en absoluto (Al +3, Cr +3, Ag +).
![]()



Papel biológico El compuesto de silicio más importante, el SiO 2, es esencial para la vida animal y vegetal. Gracias a él, cañas, cañas Gracias a él, cañas, cañas y colas de caballo permanecen firmes como bayonetas. y las colas de caballo están firmes, como las bayonetas. Hojas afiladas afiladas cortadas como hojas afiladas afiladas cortadas como cuchillos, rastrojos en cuchillos cortados en el campo, rastrojos en cortadores cortados en el campo como agujas, y tallos de cereales pegados como agujas, y los tallos de los cereales son tan fuertes que no permiten tan fuerte que no permita que el campo en los campos caiga de la lluvia y el campo de viento en los campos para ir de la lluvia y el viento


El silicio es un oligoelemento que está constantemente contenido en el cuerpo humano. Su mayor cantidad está contenida en los ganglios linfáticos, el tejido conectivo de la aorta, la tráquea, el cabello y la piel. El silicio es necesario para construir células epiteliales. El silicio es un oligoelemento que está constantemente contenido en el cuerpo humano. Su mayor cantidad está contenida en los ganglios linfáticos, el tejido conectivo de la aorta, la tráquea, el cabello y la piel. El silicio es necesario para construir células epiteliales. El silicio juega un papel importante en el proceso de mineralización ósea; Es necesario para mantener la elasticidad de la pared arterial, tiene un efecto positivo en el sistema inmunológico y retarda el proceso de envejecimiento en los tejidos del cuerpo humano. El contenido promedio de silicio en la sangre es de 8.25 mg / día. Con la edad, su nivel en el cuerpo disminuye, por lo que en las personas mayores, la necesidad de silicio tiende a aumentar. Mejorar la absorción de silicio por parte del organismo ante la presencia de calcio, magnesio, manganeso y potasio. El silicio juega un papel importante en el proceso de mineralización ósea; Es necesario para mantener la elasticidad de la pared arterial, tiene un efecto positivo en el sistema inmunológico y retarda el proceso de envejecimiento en los tejidos del cuerpo humano. El contenido promedio de silicio en la sangre es de 8.25 mg / día. Con la edad, su nivel en el cuerpo disminuye, por lo que en las personas mayores, la necesidad de silicio tiende a aumentar. Mejorar la absorción de silicio por parte del organismo ante la presencia de calcio, magnesio, manganeso y potasio.

El papel biológico del silicio también se incluye en la composición de los organismos vivos inferiores (diatomeas y radiolarios), los bultos más delicados de la materia viva, que crean sus esqueletos de belleza insuperables hechos de sílice. El silicio también forma parte de los organismos vivos inferiores, las diatomeas y los radiolarios, los bultos más delicados de materia viva, que crean su belleza insuperable de esqueletos de sílice. Diatomeas Radiolaria Autocontrol 1. ¿Cuál es el lugar del silicio en el sistema periódico: a) 2 períodos, 4 og. b) 3 periodos, 3 gr. capitulo c) 3 periodos, 4 gr. capítulo) 2 punto, 4 gr. b) 3 periodos, 3 gr. capitulo c) 3 periodos, 4 gr. capitulo 2. Red de silicio: a) iónica; b) atómico; c) molecular; a) iónico; b) atómico; c) molecular; 3. Según la prevalencia en la naturaleza del silicio ... Elemento: a) primero; b) el segundo; c) el tercero; a) la primera; b) el segundo; c) el tercero; 4. El silicio reacciona con: a) metales, hidrógeno, halógenos; a) metales, hidrógeno, halógenos; b) metales, halógenos, fácilmente solubles en álcalis; b) metales, halógenos, fácilmente solubles en álcalis; c) óxidos, ácidos, no metales. c) óxidos, ácidos, no metales. 5. Sales de ácido silícico: a) siliciuros; b) hidrosilicatos; c) silicatos; a) siliciuros; b) hidrosilicatos; c) silicatos;

Silicio
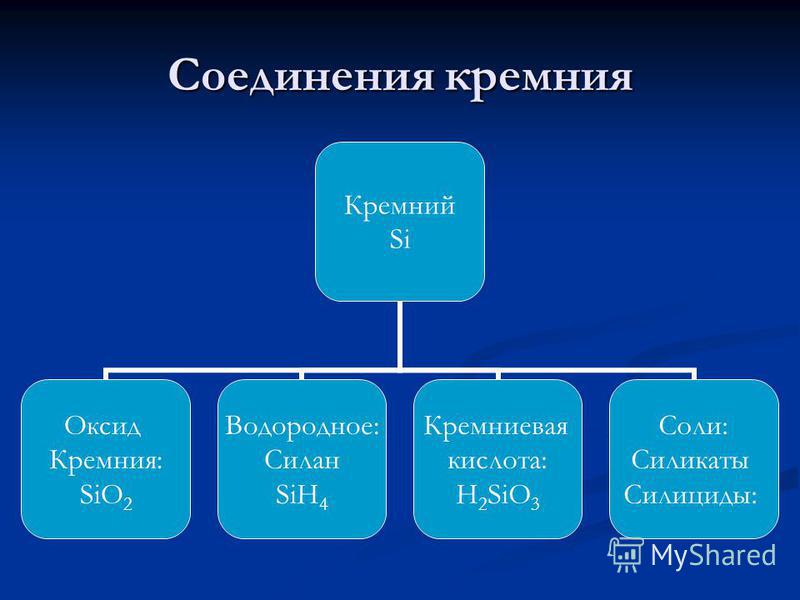
Silicio - un elemento del grupo principal del subgrupo IV del 3er período del sistema periódico de elementos químicos DI Mendeleev, con número atómico 14, masa atómica: 28.0855. En los compuestos, usualmente exhibe un grado de oxidación de +4 (valencia IV) y muy raramente +3, +2 y +1 (valencias, respectivamente, III, II e I). En la tabla periódica, el silicio Mendeleev se encuentra en el grupo IVA. (A-indica que este es el subgrupo principal) (en el grupo carbono), en el tercer período. Nemetall . Denotado por el símbolo Si(latitud Siliconio). En forma libre - polvo marrón o material compacto gris claro con un brillo metálico. Estructura de celosía: cúbico, diamante.
Estado principal: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-elemento.
2. Propiedades físicas.
El silicio cristalino es una sustancia gris oscura con un brillo de acero. La estructura del silicio es similar a la estructura del diamante. En su cristal, cada átomo está rodeado por otros cuatro tetraédricos y está conectado con ellos por un enlace covalente, que es mucho más débil que entre los átomos de carbono en un diamante. En un cristal de silicio, incluso en condiciones normales, algunos de los enlaces covalentes se destruyen. Por lo tanto, tiene electrones libres, que causan una pequeña conductividad eléctrica. Cuando la iluminación y la calefacción aumentan el número de enlaces rotos, lo que significa que la cantidad de electrones libres aumenta y la conductividad eléctrica aumenta. Así deberían explicar las propiedades semiconductoras del silicio.
El silicio es muy frágil, su densidad es de 2,33 g / cm3. Al igual que el carbón, se refiere a sustancias refractarias.
El silicio consta de tres isótopos estables: 2814Si (92.27%), 2914Si (4.68%) y 3014Si (3.05%).
3. Estar en la naturaleza.
Más a menudo en la naturaleza, el silicio se encuentra en la forma sílice - compuestos basados en dióxido de silicio (IV) SiO2 (aproximadamente el 12% de la masa de la corteza terrestre). Los principales minerales y rocas formadas por el dióxido de silicio son arena (río y cuarzo), cuarzo y cuarcita, pedernal y feldespato. Los silicatos naturales tienen una composición y estructura complejas. Aquí está la composición de algunos silicatos naturales:
ü feldespato K 2 O × Al 2 O 3 × 6SiO 2,
ü amianto 3MgO × 2SiO 2 × 2H 2 O,
ü mica K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü caolinita 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
El segundo grupo más común en la naturaleza de los compuestos de silicio es silicatos y aluminosilicatos
Se señalan hechos únicos de encontrar silicio puro en la forma nativa.
4. Propiedades químicas del silicio y sus compuestos.
Por propiedades quimicas el silicio, al igual que el carbono, es un no metal, pero su no metal es menos pronunciado, Ya que tiene un radio atómico mayor. Dado que los átomos de silicio tienen 4 electrones en el nivel de energía exterior, el estado de oxidación de -4 y +4 es característico del silicio (se conoce un compuesto de silicio, donde su grado de oxidación es +2).
El silicio en condiciones normales es bastante inerte, lo que debería explicarse por la resistencia de su red cristalina. Sólo interactúa directamente con flúor:
Los ácidos (excepto la mezcla de HF hidrofluórico y HNO 3 nítrico)El silicio no actúa. Sin embargo, se disuelve en hidróxidos de metales alcalinos, formando silicato e hidrógeno:
De las dos modificaciones alotrópicas del silicio, cristalino y amorfo, el silicio amorfo es más químicamente activo. El reacciona con con oxigeno cuando se calienta, formando SiO 2:
así como con todo halógenospor ejemplo:
![]()
A alta temperatura conexiones de silicona con carbonoformando el carborundum SiC:
El carborundum tiene una red cristalina similar a un diamante, en la que cada átomo de silicio está rodeado por cuatro átomos de carbono y viceversa, y los enlaces covalentes son muy fuertes, como en el diamante. Por lo tanto, en dureza está cerca del diamante. Las piedras de afilar y las muelas están hechas de carburo de silicio.
Silicide de magnesio. En reacciones con metales activos, se producen con la formación de siliciuros, El silicio actúa como un agente oxidante:
A altas temperaturas, el silicio recupera muchos metales de sus óxidos. (!!!)
Silano Bajo la acción del ácido clorhídrico sobre siliciuros, el compuesto de hidrógeno más simple de silicio es el silano SiH4:
El silano es un gas venenoso con un olor desagradable, autoinflamable en el aire (!!!):
Óxido de silicio (IV).El óxido de silicio (IV) también se llama sílice. Es una sustancia sólida refractaria. (punto de fusión 1700 ° C) De carácter generalizado en dos formas:
1) sílice cristalina - en forma de mineral de cuarzo y sus variedades (cristal de roca, calcedonia, ágata, jaspe, pedernal); El cuarzo forma la base de las arenas de cuarzo ampliamente utilizadas en la construcción y industria del silicato;
2) sílice amorfa - en la forma de la composición mineral opal SiO 2 × n H2O; Las formas terrestres de sílice amorfa son diatomita, trípoli (tierra infusorial); Un ejemplo de sílice anhidra amorfa artificial es el gel de sílice, que se obtiene a partir del metasilicato de sodio:
El gel de sílice tiene una superficie desarrollada y, por lo tanto, absorbe bien la humedad. .
A 1710 ° se derrite el cuarzo.. Con el rápido enfriamiento de la masa fundida se forma. vidrio de cuarzo . Tiene un coeficiente de expansión muy bajo, por lo que el vidrio de cuarzo caliente no se agrieta cuando el agua se enfría rápidamente. La cristalería de laboratorio y los instrumentos para la investigación científica están hechos de vidrio de cuarzo.
La fórmula más simple de óxido de silicio (IV) SO 2 es similar a la fórmula del monóxido de carbono (IV) CO 2. Mientras tanto, sus propiedades físicas son muy diferentes (SiO 2 - sólido, CO 2 - gas). Esta diferencia se explica por la estructura de las redes cristalinas. C0 2 cristaliza en la red molecular, SiO 2 - en el atómico. La estructura de SiO 2 en una imagen plana se puede representar de la siguiente manera:
El número de coordinación de un átomo de carbono en CO2 sólido es 2, y el silicio en SiO2 es 4. Cada átomo de silicio está encerrado en un tetraedro de 4 átomos de oxígeno. Al mismo tiempo, el átomo de silicio está en el centro y los átomos de oxígeno están ubicados en los vértices del tetraedro. . La pieza completa de sílice se puede considerar como un cristal cuya fórmula es (SiO 2) n. Esta estructura de óxido de silicio (IV) determina su alta dureza y refractariedad. .
Propiedades químicas del óxido de silicio (IV) SiO 2 se refiere a los óxidos ácidos. Cuando se fusiona con álcalis sólidas, óxidos básicos y carbonatos, se forman sales de ácido silícico:
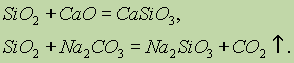
Sólo el ácido fluorhídrico interactúa con el óxido de silicio (IV):
Esta reacción se utiliza para grabar vidrio. .
El silicio (IV) no se disuelve en el agua. y no interactúa químicamente con él. (!!!) Por lo tanto, el ácido silícico se obtiene indirectamente al actuar con un ácido en una solución de silicato de potasio o sodio:
En este caso, el ácido silícico (dependiendo de la concentración de las soluciones iniciales de sal y ácido) se puede obtener tanto en forma de una masa gelatinosa que contiene agua, como en forma de una solución coloidal (sol).
Ácido silícico. SiO 2 es el anhídrido de varios ácidos silícicos, cuya composición puede expresarse mediante la fórmula general: xSiO 2 × yH 2 O, donde x e y - enteros
1) x = 1, y = 1: SiO 2 × H 2 O, es decir, H 2 SiO 3 - ácido metasilícico;
2) x = 1, y = 2: SiO 2 × 2H 2 O, es decir, H 4 SiO 4 - ácido ortosilícico;
3) x = 2, y = 1: 2SiO 2 × H 2 O, es decir, H 2 Si 2 O 5 - ácido bimetacrínico.
El ácido silícico se construye a partir de unidades estructurales tetraédricas (en cada una de dichas unidades, el átomo de silicio está en el centro del tetraedro, y hay átomos de oxígeno en la parte superior). Los enlaces estructurales, que se unen en cadenas, forman ácidos de polisilicio más estables:
La composición de dichos compuestos se puede expresar mediante la fórmula (H 2 SiO 3) n. Sin embargo, normalmente el ácido silícico está representado por la fórmula H 2 SiO 3. H 2 SiO 3: el ácido es muy débil, poco soluble en agua. Cuando se calienta fácilmente se descompone como el ácido carbónico:
Todos los ácidos silícicos son muy débiles (más débiles que el carbón).
Silicatos. Las sales de todos los ácidos silícicos se llaman.silicatosAunque, como norma, en la literatura educativa, los silicatos implican sales de ácido metacilícico. Su composición suele estar representada por la fórmula en forma de compuestos de óxidos de elementos. Por ejemplo, el silicato de calcio CaSiO 3 se puede expresar como: CaO × SiO 2.
Los silicatos de la composición R 2 O x nSiO 2, donde R 2 O - óxidos de sodio o potasio , son llamados vidrio soluble , un sus soluciones acuosas concentradas vidrio liquido . El vidrio de soda sódica es el más importante..
Al permanecer en el aire, las soluciones de silicatos crecen turbias, ya que el dióxido de carbono (IV) del aire desplaza el ácido silícico de sus sales:
El ácido silícico es prácticamente insoluble en agua; esta propiedad se utiliza como reacción cualitativa al ion SiO 3 2-.
Los silicatos se obtienen mediante la fusión de sílice con álcalis o carbonatos:
5. Descubrimiento del ion SiO 3 2. (No puedo encontrar nada ...)
6. El papel de los compuestos de silicio en la formación de suelos y silvicultura.
Las rocas ígneas son bastante estables en su composición y contienen principalmente compuestos de silicio, aluminio, hierro, álcalis, magnesio y calcio. Según el contenido de SiO2, las rocas ígneas se dividen en cuatro grupos: ácido (\u003e 65%), medio (52-65%), básico (40-52%) y ultrabásico (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Rocas ígneas ácidas- granitos, pegmatitas, riolitas, dacita y otros - por lo general tienen un color claro y marrón con cristales pronunciados de cuarzo, feldespato, mica. El contenido de SiO 2 en ellos es alto (más del 65%) con una cantidad significativa de potasio y sodio. Al mismo tiempo, poco hierro, y calcio y magnesio son despreciables. Los suelos en rocas ígneas ácidas, por ejemplo, en granitos, difieren en las primeras etapas de la meteorización por la friabilidad, el carácter de grava del material de origen. Cuando se los resiste en condiciones húmedas, pierden fácilmente elementos alcalinotérreos, como resultado de lo cual el suelo en dichos sustratos meteorizados (eluvio de las rocas) es extremadamente pobre, poco fértil.
Rocas ígneas principales -el basalto, el gabro, etc., como regla general, tienen un color oscuro (al negro). Se caracterizan por un menor contenido de SiO 2 en comparación con las rocas ácidas. Las principales rocas ígneas son relativamente ricas en compuestos de hierro, manganeso, cromo, cobalto, zinc, titanio, níquel, cobre. Los productos de su intemperización adquieren rápidamente un carácter arcilloso, conservan una reacción alcalina y neutra durante mucho tiempo y se distinguen por un mayor contenido de humus y minerales arcillosos. El suelo en tales rocas es más fértil.
Además de las especies ácidas y básicas se encuentran a menudo. rocas ígneas de tipo transicional(medio) - rocas intrusivas del grupo diorita y sus contrapartes efusivas - andesitas. En consecuencia, los suelos en estas rocas adquieren características similares a aquellas confinadas a rocas ácidas o básicas. Mucho menos comun razas ultrabásicas:peridotitas y picrites, que tienen el contenido más bajo de SiO 2.
Rocas metamórficas -Transición entre rocas masivas cristalinas y sedimentarias. Las antiguas rocas sedimentarias bajo buceo, alta presión y temperaturas son metamorfoseadas, formando gneises, serpentinitas, mármoles, cuarcitas, pizarra. Los gneises son particularmente similares en composición a los granitos. Los suelos que se forman en tales rocas tienen características similares a los suelos en las propias rocas ígneas ácidas.
El cloro
1. La posición de aluminio en la mesa DI Mendeleev. La estructura del átomo, manifestó grado de oxidación.
Cloro - un elemento del subgrupo principal del grupo VII, el 3er período, con el número atómico 17. Se denota con el símbolo Cl (lat. Chlorum). Químicamente activo no metal . Incluido en el grupo halógeno. .
Cloro sustancia simple en condiciones normales - El gas venenoso de color verde amarillento es más pesado que el aire, con un fuerte olor. . Molécula de cloro diatómico (fórmula Cl 2).
Estado principal: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-elemento. Art.: -1 +1 +3 +5 +7.
La estructura de la capa de electrones.
En el nivel de valencia del átomo de cloro contiene 1 electrón no pareado : 1s 2 2s 2 2p 6 3s 2 3p 5, por lo que la valencia de 1 para un átomo de cloro es muy estable. Debido a la presencia en el átomo de cloro de los orbitales de subnivel d no ocupados, el átomo de cloro puede presentar otros grados de oxidación. Esquema de formación de estados excitados del átomo:
También se conocen compuestos de cloro en los que el átomo de cloro exhibe formalmente la valencia 4 y 6, por ejemplo ClO 2 y Cl 2 O 6. Sin embargo, estos compuestos son radicales, es decir, tienen un electrón no pareado.
2. Propiedades físicas.
En condiciones normales, el cloro es un gas amarillo verdoso con un olor sofocante. Algunas de sus propiedades físicas se presentan a continuación.
Densidad: 3,214 g / l, liq. - a -35 ° C - 1.557, TV. a -105 0 С- 1.9 g / cm 3.
Punto de fusión: 172.2 K
Punto de ebullición: 238.6 K
Calor de fusión: 6.41 kJ / mol
Calor de evaporación: 20.41 kJ / mol.
El gas de cloro es relativamente fácil de licuar. Comenzando con una presión de 0.8 MPa (8 atmósferas), el cloro ya estará líquido a temperatura ambiente. Cuando se enfría a una temperatura de -34 ° C, el cloro también se vuelve líquido a la presión atmosférica normal. El cloro líquido es un líquido de color verde amarillo con un alto efecto corrosivo (debido a una alta concentración de moléculas). Al aumentar la presión, puede lograr la existencia de cloro líquido hasta una temperatura de +144 ° C (temperatura crítica) a una presión crítica de 7.6 MPa. En términos de conductividad eléctrica, el cloro líquido se encuentra entre los aisladores más fuertes: conduce la corriente casi mil millones de veces peor que el agua destilada y 10 22 veces peor que la plata. La velocidad del sonido en el cloro es aproximadamente una vez y media menos que en el aire.
3. Estar en la naturaleza.
En la naturaleza, hay dos isótopos de cloro 35 Cl y 37 Cl. El cloro es el halógeno más común en la corteza terrestre. . El cloro es muy activo. - Se conecta directamente con casi todos los elementos del sistema periódico. Por lo tanto, en la naturaleza, se encuentra solo en forma de compuestos en la composición de minerales:
ü halita NaCl,
ü sylvina KCl,
ü silvinita KCl · NaCl,
ü bischofita MgCl 2 · 6H 2 O,
ü carnalita KCl · MgCl 2 · 6H 2 O,
ü Cainita KCl · MgSO 4 · 3H 2 O.
Las mayores reservas de cloro se encuentran en sales, aguas, mares y océanos (el contenido en agua de mar es de 19 g / l). El cloro representa el 0.024% del número total de átomos en la corteza terrestre; número de clarke (números que expresan el contenido promedio de elementos químicos en la corteza terrestre, la hidrosfera, la Tierra, los cuerpos espaciales, los sistemas geoquímicos o cósmicos, etc., relativos a la masa total de este sistema. Se expresa en% o g / kg.) cloro - 0.017%. El cuerpo humano contiene 0,25% de iones de cloro en peso. En humanos y animales, el cloro se encuentra principalmente en los fluidos intercelulares (incluida la sangre) y desempeña un papel importante en la regulación de los procesos osmóticos, así como en los procesos asociados con el trabajo de las células nerviosas.
4. Propiedades químicas del cloro y sus compuestos. Obtención de cloro.
La estructura del átomo de silicio. Si +14. Estado emocionado. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Imagen 3 de la presentación "Silicon". A las clases de química sobre el tema del "silicio".Dimensiones: 960 x 720 píxeles, formato: jpg. Para descargar una imagen gratuita para una lección de química, haga clic derecho en la imagen y haga clic en "Guardar imagen como ...". Para mostrar las imágenes de la lección, también puede descargar una presentación gratuita de "Silicon.ppt" con todas las imágenes en un archivo zip. Tamaño del archivo - 562 KB.
Descargar presentacionSilicio
"El silicio y sus compuestos" - La estructura y propiedades de los átomos. Semiconductor t fusión (Si) = 1415 ° C, t fusión (diamante) = 3730 ° C. Obtención de silicio. El descubrimiento del silicio. Incluido también en la composición de plantas y animales. Las propiedades físicas del silicio. Por lo tanto, el ladrillo es cerámica, y los azulejos y fragmentos de ánforas griegas antiguas también son cerámicas. Objetivos: Las propiedades químicas del silicio.
"Compuestos de silicio" - El silicio y sus compuestos. Propiedades químicas del SiO2. Silano Obtención de ácido silícico. Propiedades del silicio. Óxido de silicio. Silicatos naturales. Estado de oxidación Rhinestone Topacio Obtención de silicona en el laboratorio. Estando en la naturaleza. Rejillas de cristal. El descubrimiento del silicio. La amatista Obtención de silicio.
"Isótopos de silicio" - Separación de isótopos de silicio. Producción de silicio policristalino. Perspectivas para el uso del silicio monoisotópico. Dilución isotópica al cultivar un solo cristal a partir de un crisol de cuarzo. Producción de semilla monocristalina. Dependencia de la posición del máximo de la banda Raman en la masa atómica.
"Lección de silicio": ¿Cuál de los elementos químicos más importantes en la naturaleza viva y no viva? Óxidos de carbono y silicio. La sustancia es transparente. Sobre la manifestación de propiedades no metálicas y metálicas. Resumiendo el reflejo. Pruebas finales. ¿Óxidos de carbono e hidróxidos de silicio? El estado de agregación: a) líquido, b) gas, c) sólido.
"Silicio" - El silicio es una sustancia simple. Propiedades físicas. Óxido de silicio (IV). Siliciuros Significado para los organismos vivos. Interacción con metales. Interacción con no metales. Carburo de silicio. Silicio en la naturaleza. Silicio Productos de la industria del silicato. Uno de los tipos de compuestos naturales de silicio es silicatos.
"Carbono y silicio" - Óxido de silicio (IV). Elementos del grupo IV del subgrupo principal. Toxicidad 7. Interesante sobre el carbono. Silicatos. Deslízate al tacto. El diamante es la sustancia natural más dura. Propiedades quimicas Más del 99% del carbono en la atmósfera está en forma de dióxido de carbono. Carburos 6. Aplicación. Uno de los más suaves entre los sólidos.
Hay 6 presentaciones en total.
