Fórmula química del ácido sulfúrico. Ácido sulfúrico: propiedades químicas, preparación.
H2SO3, ácido dibásico débil. En forma libre no se asigna, existe en soluciones de agua. Los sulfitos de ácido sulfúrico ... Gran Diccionario Enciclopédico
Acido sulfurico - (H2SO3) ácido dibásico débil. Existe solo en soluciones acuosas. Sales S. a. Sulfitos. Aplicado en la industria de papel y celulosa. Ver también la sección Ácidos y anhídridos. Enciclopedia rusa sobre protección laboral
ácido sulfúrico - - [A.S. Goldberg. Diccionario de energía ruso inglés. 2006] Temas de energía en general EN ácido sulfuroso ... Guía del traductor técnico
H2SO3, ácido dibásico débil. En forma libre no se asigna, existe en soluciones de agua. Sulfitos de ácido sulfúrico. * * * Ácido sulfúrico, ácido sulfúrico, H2SO3, ácido dibásico débil. Gratis no está seleccionado, ... ... Diccionario enciclopedico
ácido sulfúrico - sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: angl. ácido sulfuroso rus. Ácido sulfúrico ryšiai: sinonimas - vandenilio trioksosulfatas (2–) ... Chemijos terminų aiškinamasis žodynas
H2SO3, ácido dibásico débil, correspondiente al grado de oxidación del azufre +4. Conocido solo en soluciones acuosas diluidas. Las constantes de disociación: K1 = 1.6 · 10 2, K2 = 1.0 · 10 7 (18 ° C). Da dos filas de sales: Sulfitos normales y amargos ... ... Gran enciclopedia soviética
H2SO3, ácido dibásico débil. En la forma libre no se destaca, existe en las aguas. p rah Sales S. K. Sulfitos ... Ciencias naturales Diccionario enciclopedico
Ver Azufre ... Diccionario enciclopédico de FA Brockhaus y I.A. Efrona
El dióxido de azufre (dióxido) se forma al quemar azufre en el aire u oxígeno. También se obtiene calcinando en el aire ("quema") sulfuros de metales, por ejemplo, piritas de hierro:
Según esta reacción, el dióxido de azufre se obtiene generalmente en la industria (para otros métodos industriales de obtención de cm, 9 § 131).
El dióxido de azufre es un gas incoloro ("dióxido de azufre") con una capa de azufre caliente. Se condensa fácilmente en un líquido incoloro que hierve. Cuando el líquido se evapora, hay una fuerte disminución de la temperatura (antes).
El dióxido de azufre es altamente soluble en agua (aproximadamente 40 volúmenes en 1 volumen de agua); al mismo tiempo, la reacción con el agua tiene lugar parcialmente y se forma ácido sulfuroso:
Por lo tanto, el dióxido de azufre es anhídrido de ácido sulfúrico. Cuando se calienta, la solubilidad disminuye y el equilibrio se desplaza hacia la izquierda; gradualmente, todo el dióxido de azufre se libera de la solución nuevamente.
La molécula se construye de manera similar a la molécula de ozono. Los núcleos de sus átomos constituyentes forman un triángulo isósceles:
Aquí, el átomo de azufre, como el átomo de oxígeno central en la molécula de ozono, está en el estado de hibridación α y el ángulo está cerca. Orientado perpendicularmente al plano de la molécula, el orbital del átomo de azufre no participa en la hibridación. Debido a esto, los orbitales y, de manera similar, los orbitales de los átomos de oxígeno, se forma un enlace de tres centros; el par de electrones que lo lleva pertenece a los tres átomos de la molécula.
El dióxido de azufre se usa para producir ácido sulfúrico y también (en cantidades mucho más pequeñas) para blanquear la paja, la lana, la seda y como desinfectante (para la destrucción de hongos de moho en sótanos, bodegas, barriles de vino, tanques de fermentación).
El ácido sulfúrico es un compuesto muy frágil. Se conoce solo en soluciones acuosas. Cuando se trata de aislar el ácido sulfuroso, se desintegra en agua. Por ejemplo, cuando el ácido sulfúrico concentrado actúa sobre el sulfito de sodio, se libera dióxido de azufre en lugar de ácido sulfúrico:
La solución de ácido sulfúrico debe protegerse del aire, de lo contrario, al absorber oxígeno del aire, se oxida lentamente a ácido sulfúrico
El ácido sulfúrico es un buen agente reductor. Por ejemplo, los halógenos libres son restaurados a los haluros de hidrógeno:
![]()
Sin embargo, al interactuar con agentes reductores fuertes, el ácido sulfúrico puede desempeñar el papel de un agente oxidante. Entonces, su reacción con el sulfuro de hidrógeno procede principalmente de acuerdo con la ecuación:
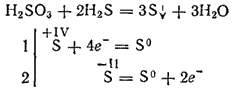
Al ser dibásico, el ácido sulfuroso forma dos filas de sales. Sus sales medias se llaman sulfitos, sales ácidas - hidrosulfitos.
Al igual que el ácido, los sulfitos y los hidrosulfitos son agentes reductores. Cuando se oxidan, se obtienen sales de ácido sulfúrico.
Los sulfitos de los metales más activos durante la calcinación se descomponen con la formación de sulfuros y sulfatos (reacción de autooxidación - autodestrucción):
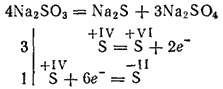
Los sulfitos de potasio y sodio se utilizan para blanquear algunos materiales en la industria textil para teñir telas, en fotografía. La solución (esta sal solo existe en la solución) se utiliza para procesar la madera en la llamada pulpa de sulfito, de la que luego se obtiene el papel.
El ácido sulfuroso es capaz de reaccionar con el oxígeno. Esto forma ácido sulfúrico. Esta reacción lleva mucho tiempo y solo es posible si se violan las reglas de almacenamiento. El ácido sulfúrico tiene propiedades oxidantes y reductoras. Con su ayuda podrás obtener ácidos halógenos. Una solución acuosa al reaccionar con cloro forma ácido clorhídrico y sulfúrico.
Cuando reacciona con agentes reductores fuertes, el ácido sulfuroso desempeña el papel de un agente oxidante. Una de estas sustancias es el sulfuro de hidrógeno, un gas con un olor muy desagradable. Interactuando con una solución acuosa de ácido sulfúrico, forma azufre y agua. Las sales de ácido sulfúrico también tienen propiedades reductoras. Se dividen en sulfitos e hidrosulfitos. Las reacciones de oxidación de estas sales producen ácido sulfúrico.
Producción de ácido sulfúrico.
El ácido sulfúrico se forma solo por la interacción del dióxido de azufre y el agua. Necesidad de obtener gas amargo. Esto se puede hacer con cobre y ácido sulfúrico. Vierta suavemente el ácido sulfúrico concentrado en el tubo y arroje un trozo de cobre en él. Calentar el tubo con una lámpara de espíritu.
Como resultado del calentamiento, se forma sulfato de cobre (sulfato de cobre), agua y dióxido de azufre, que con la ayuda de un tubo especial se deben llevar al cono con agua clara. De esta manera, se puede obtener ácido sulfúrico.
Recuerde que el dióxido de azufre es perjudicial para los seres humanos. Causa daño a las vías respiratorias, pérdida de apetito y dolor de cabeza. La inhalación prolongada puede causar desmayos. Cuando trabaje con él necesita precaución.
Uso de ácido sulfúrico.
El ácido sulfúrico tiene propiedades antisépticas. Se utiliza en la desinfección de superficies, fermentación de grano. Se puede usar para blanquear algunas sustancias que se descomponen cuando reaccionan con oxidantes fuertes (por ejemplo, cloro). Tales sustancias incluyen lana, seda, papel y algunas otras. Sus propiedades antibacterianas se utilizan para evitar la fermentación del vino en barrica. Por lo tanto, la bebida noble se puede almacenar durante mucho tiempo, adquiriendo un sabor noble y un aroma único.
El ácido sulfúrico se utiliza en la fabricación de papel. La adición de este ácido se incluye en la tecnología de producción de pulpa de sulfito. Luego se trata con una solución de hidrosulfito de calcio para unir las fibras.
