Series genéticas de ejemplos no metálicos. Relación genética entre clases de sustancias - Hipermercado del conocimiento.
Existe una conexión genética entre sustancias simples, óxidos, bases, ácidos y sales, es decir, la posibilidad de su transición mutua (transformación).
Por ejemplo, sustancia simple: el calcio como resultado de la interacción con el oxígeno se convierte en óxido: 2Ca + O 2 = 2CaO.
El óxido de calcio cuando interactúa con el agua forma hidróxido de calcio CaO + H 2 O = Ca (OH) 2, y este último, cuando interactúa con un ácido, se convierte en una sal: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
Estas transformaciones pueden ser representadas por el esquema:
Ca → CaO → Ca (OH) 2 → CaSO 4
Se puede escribir un esquema similar para azufre no metálico, por ejemplo:
S → SO 3 → H 2 SO 4 → CaSO 4
Entonces, la misma sal se obtiene de varias maneras.
La transición inversa de la sal a otras clases de compuestos inorgánicos y sustancias simples también es posible:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (reducción de cobre)
Una relación similar entre las clases de compuestos inorgánicos, basada en la producción de sustancias de una clase a partir de las sustancias de otra, se llama genética.
Las propiedades de los compuestos complejos se reflejan en el esquema genético de las principales clases de compuestos inorgánicos (ver figura). Refleja las etapas de desarrollo de la materia inorgánica en dos líneas principales, desde los metales típicos hasta los no metales típicos con propiedades opuestas.
Metales cuya propiedad química de un átomo es la capacidad de donar electrones, y no metales, cuya principal propiedad química es la capacidad de sus átomos para unir electrones opuestos entre sí en propiedades. Con la complicación de la composición de sustancias, estas tendencias opuestas continúan apareciendo.
Los metales típicos y los elementos de transición en el estado de oxidación más bajo forman los óxidos básicos, y los elementos no metálicos y de transición típicos en el estado de alta oxidación forman óxidos de ácido opuestos en sus propiedades.
Sustancias simples
Anfótero
No metales
Óxidos básicos
Anfótero
Ácido
Terrenos
Anfótero
hidróxidos
Esquema genético de las principales clases de compuestos inorgánicos.
Con la complicación adicional de la composición de sustancias, se forman hidróxidos, los óxidos de base correspondientes a la base y los óxidos de ácido correspondientes al ácido. Bases opuestas en las propiedades y los ácidos reaccionan activamente entre sí, formando sales. La interacción de los opuestos es la fuerza impulsora de la reacción. Por lo tanto, los óxidos básicos y ácidos, las bases y los ácidos interactúan activamente entre sí, y dos óxidos ácidos o dos óxidos básicos no interactúan, ya que sus propiedades son cercanas.
Por lo tanto, las propiedades de un compuesto complejo se determinan en función de las propiedades de sus elementos constituyentes. Los principales patrones de cambio de estas propiedades se resumen en las siguientes aplicaciones (Tabla 6).
1. En períodos con un aumento en el número de serie, las propiedades de los elementos cambian de metálico a no metálico. El número de electrones en el nivel externo aumenta, el grado de oxidación del elemento aumenta, el radio del átomo y el ion disminuye, la energía de ionización y la afinidad por el electrón aumentan. De acuerdo con esto, la base disminuye y las propiedades ácidas de los óxidos e hidróxidos aumentan.
2. En los subgrupos principales, con un aumento en el número atómico del elemento, aumentan las propiedades básicas de los óxidos e hidróxidos. Para los elementos de los grupos laterales con un aumento en el número de secuencia, es característico un cambio más complejo en las propiedades. Primero, las propiedades metálicas se mejoran y luego se reducen.
3. Los metales activos corresponden a óxidos e hidróxidos con propiedades básicas fuertemente pronunciadas. Los metales más activos son los alcalinos y alcalinotérreos. Forman óxidos solubles en agua y bases solubles fuertes - álcalis.
4. Los metales poco activos (excepto los alcalinos y los alcalinotérreos) forman bases débiles, que son difíciles de disolver en el agua:
Cu (OH) 2, Fe (OH) 3.
5. Los óxidos e hidróxidos con propiedades ácidas fuertemente pronunciadas corresponden a los no metales activos.
6. Los metales anfóteros forman óxidos e hidróxidos anfóteros.
7. Si un elemento exhibe diferentes grados de oxidación, entonces los óxidos e hidróxidos con diferentes propiedades le corresponden.
Tema: CONEXIÓN GENÉTICA ENTRE metales y no metales y sus compuestos. Noveno grado
Objetivos: educativos: consolidar el concepto de "serie genética", "conexión genética"; enseñar a hacer series genéticas de elementos (metales y no metales), a componer las ecuaciones de reacción correspondientes a las series genéticas; verifica cómo se aprende el conocimiento propiedades quimicas óxidos, ácidos, sales, bases; desarrollo: desarrollar la capacidad de analizar, comparar, resumir y sacar conclusiones, conformar las ecuaciones de las reacciones químicas; Educativo: promover la formación de una cosmovisión científica.
Proporcionar clases: tablas "Sistema periódico", "Tabla de solubilidad", "Serie de actividades de metales", instrucciones para los alumnos, tareas para evaluar los conocimientos.
Progreso: 1) Org. el momento
2) Compruebe d / s
3) Estudiar nuevo material.
4) Cierre
5) D / C
1) org. el momento Saludos
2) Compruebe d / s.
Las conexiones genéticas son conexiones entre diferentes clases basadas en sus interconversiones.
Conociendo las clases de sustancias inorgánicas, es posible componer la serie genética de metales y no metales. La base de estas series es el mismo elemento.
Entre los metales hay dos tipos de filas:
1
. Una serie genética en la que el álcali actúa como base. Esta serie se puede representar usando las siguientes transformaciones:metal → óxido básico → álcali → sal
Por ejemplo, K → K
2 O → KOH → KCl2
. La serie genética, donde la base es una base insoluble, la serie puede representarse como una cadena de transformaciones:metal → base oxido → sal → base insoluble →
→óxido básico → metal
Por ejemplo, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. La serie genética de no metales, donde el ácido soluble actúa como un enlace en la serie. La cadena de transformaciones se puede representar de la siguiente manera:no metal → óxido de ácido → ácido soluble → sal
Por ejemplo, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. La serie genética de no metales, donde el ácido insoluble actúa como un enlace en la serie:no metálico → óxido de ácido → sal → ácido →
→óxido de ácido → no metal
Por ejemplo
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si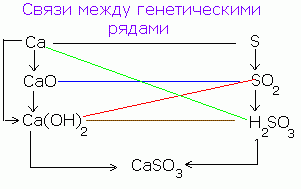
Conversación frontal sobre:
¿Qué es una conexión genética? Las conexiones genéticas son conexiones entre diferentes clases basadas en sus interconversiones. ¿Qué es una serie genética?
Serie genética - una serie de sustancias - representantes de diferentes clases, que son compuestos de un elemento químico, conectados por interconversiones y que reflejan las transformaciones de estas sustancias. La base de estas series es el mismo elemento.
¿Qué tipos de series genéticas se pueden distinguir? Entre los metales, se pueden distinguir dos tipos de series:
a) Una serie genética en la que el álcali actúa como base. Esta serie se puede representar usando las siguientes transformaciones:
metal → óxido básico → álcali → sal
por ejemplo, la serie genética de potasio K → K
2 O → KOH → KClb) La serie genética, donde la base es una base insoluble, entonces la serie puede representarse como una cadena de transformaciones:
metal → base de óxido → sal → base insoluble → base de óxido → metal
por ejemplo: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuEntre los no metales también es posible distinguir dos tipos de filas:
a) La serie genética de no metales, donde el ácido soluble actúa como un enlace en la serie. La cadena de transformaciones se puede representar de la siguiente manera: no metal → óxido de ácido → ácido soluble → sal.
Por ejemplo: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Fila genética de no metales, donde el ácido insoluble: no metal → óxido de ácido → sal → ácido → óxido de ácido → no metal actúa como un enlace en la serie
Por ejemplo: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiEjecución de tareas por opciones:
1. Elija las fórmulas de óxido en su versión, explique su elección, basándose en el conocimiento de las características de la composición de esta clase de compuestos. Llamalos
2. En la columna de fórmulas de su versión, busque las fórmulas ácidas y explique su elección basándose en el análisis de la composición de estos compuestos.
3. Determine las valencias de los residuos ácidos en la composición ácida.
4. Elegir fórmulas de sal y nombrarlas.
5. Componga las fórmulas de sales, que se pueden formar con magnesio y ácidos de su variante. Anótalos, nómbralos.
6. En la columna de fórmulas de su versión, busque las fórmulas básicas y explique su elección basándose en el análisis de la composición de estos compuestos.
7. En su variante, elija las fórmulas de sustancias con las que pueda reaccionar la solución de ácido fosfórico (clorhídrico, sulfúrico). Haz las ecuaciones de reacción apropiadas.
9. Entre las fórmulas de su elección, elija fórmulas de sustancias que puedan interactuar entre sí. Haz las ecuaciones de reacción apropiadas.
10. Haga una cadena de enlaces genéticos de compuestos inorgánicos, que incluirá una sustancia, cuya fórmula se da en su versión en el número uno.
Opción 1
Opcion 2
Cao
Hno
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 Así que 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 O 5NaOH
Zno
CO
2BaCl
2HCl
H
2 CO 3H
2 Así que 4Cuso
4Haz una línea genética usando estas sustancias usando todas las fórmulas. Escribe las ecuaciones de reacción con las que puedes lograr esta cadena de transformaciones:
Opción I: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opción:Na 2 Así que 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Sujeción1.
Al→ Al 2 O 3 → AlCl 3 → Al( Oh) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Tarea:
traza una transición gradual de calcio a carbonato de calcio y prepara un informe sobre el uso de cualquier sal en medicina (usando literatura adicional).

Entre los metales, se pueden distinguir dos tipos de filas: 1. Series genéticas, en las que el álcali actúa como una base. Esta serie se puede representar mediante las siguientes transformaciones: metal - óxido básico - álcali - sal, por ejemplo, las series genéticas de potasio K - K 2 O - KOH - KCl.

2. Una serie genética, donde una base insoluble actúa como una base, entonces la serie puede representarse como una cadena de transformaciones: metal - óxido básico - sal - base insoluble - óxido básico - metal. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu serie genética de cobre "\u003e Cu es una serie genética de cobre"\u003e "title =" (! LANG: 2. Serie genética, donde la base es una base insoluble, luego la serie puede representarse como una cadena de transformaciones: metal - base óxido - sal - base insoluble - el óxido básico es el metal. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. Una serie genética, donde una base insoluble actúa como una base, entonces la serie puede representarse como una cadena de transformaciones: metal - óxido básico - sal - base insoluble - óxido básico - metal. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Entre los no metales también es posible distinguir dos tipos de filas: 1. La serie genética de no metales, donde el ácido soluble actúa como un enlace en la serie. La cadena de transformaciones se puede representar de la siguiente manera: no metal - óxido de ácido - ácido soluble - -sol. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Rango genético del fósforo

Existe un vínculo genético entre las clases de compuestos inorgánicos. De las sustancias simples se pueden obtener complejas y viceversa. A partir de compuestos de una clase, puede obtener compuestos de otra clase.
La relación genética simplificada entre clases de compuestos inorgánicos se puede representar mediante el siguiente esquema:
La secuencia de tales transformaciones para no metales se puede representar mediante el siguiente esquema: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Para metales típicos puedes realizar la siguiente cadena de transformaciones:
Ba → BaO → Ba (OH) 2 → BaSO 4
Para metales cuyos óxidos e hidróxidos son anfóteros (semimetales), se pueden llevar a cabo las siguientes transformaciones:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
Enlaces entre clases:
1. Metales, no metales→ sal.
Con la interacción directa de metales y no metales, se forman sales de ácidos libres de oxígeno (haluros, sulfuros):
2Na + C1 2 = 2NaCl
Estos compuestos son estables y no se descomponen cuando se calientan.
2. Óxidos básicos, óxidos ácidos.→ sal.
CaO + CO 2 = CaCO 3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Bases, ácidos.→ sal.
Se realiza a través de una reacción de neutralización:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H2O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Metales→ Los óxidos básicos.
La mayoría de los metales interactúan con el oxígeno para formar óxidos:
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
El oro, la plata, el platino y otros metales nobles no interactúan con el oxígeno, los óxidos de dichos metales se obtienen indirectamente.
5. No metales→ óxidos de ácido.
Los no metales (con la excepción de los halógenos y gases nobles) interactúan con el oxígeno, formando óxidos:
4P + 5O 2 = 2P 2 O 5;
S + O 2 = SO 2.
6. Óxidos básicos.→ motivos
La interacción directa con el agua se puede obtener solo hidróxidos de metales alcalinos y alcalinotérreos (álcali):
Na2O + H2O = 2NaOH;
CaO + H 2 O = Ca (OH) 2.
Los motivos restantes se obtienen indirectamente.
7. Óxidos de ácido→ acido
Los óxidos de ácido reaccionan con el agua para formar los ácidos correspondientes:
SO3 + H2O = H2SO4;
R 2 O 5 + 3H 2 O = 2H 3 PO 4.
La excepción es el SiO 2, que no reacciona con el agua.
8. Bases, óxidos de ácido.→ sal.
Los álcalis interactúan con los óxidos ácidos para formar sales:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2- + H 2 O;
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Ácidos, óxidos básicos.→ sal.
Los óxidos metálicos se disuelven en ácidos, formando sales:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HCl = 2NaCl + H 2 O,
Na 2 O + 2H + = 2Na + + H 2 O.
10. Terrenos→ Los óxidos básicos.
Las bases insolubles y el LiOH se descomponen cuando se calientan:
2LiOH = Li2O + H2O;
Cu (OH) 2 = CuO + H 2 O.
11. acidos→ óxidos de ácido.
Los ácidos inestables que contienen oxígeno se descomponen cuando se calientan (H2OO3) e incluso sin calentamiento (H2O3, HClO). Al mismo tiempo, varios ácidos son resistentes al calor (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = H 2 O + SiO 2;
H 2 CO 3 = H 2 O + CO 2.
12. Óxidos metálicos.→ metales
Algunos óxidos de metales pesados se pueden descomponer en metales y oxígeno:
2HgO = 2Hg + O 2.
Además, los metales se obtienen de los óxidos correspondientes con la ayuda de agentes reductores:
3MnO2 + 4Al = 3Mn + 2Al2O3;
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. Óxidos de ácido→ no metales
La mayoría de los óxidos no metálicos no se descomponen cuando se calientan. El no metal y el oxígeno solo descomponen algunos óxidos inestables (óxidos de halógeno).
Algunos no metales se obtienen por reducción de los óxidos correspondientes:
SiO 2 + 2Mg = 2MgO + Si.
14. Sales, bases → bases.
Las bases insolubles se obtienen por la acción del álcali sobre las soluciones de los ácidos correspondientes:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2.
15. Sales, ácidos → ácidos.
Las sales solubles reaccionan con los ácidos (de acuerdo con las series de presión) si el resultado es un ácido más débil o volátil:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (TV) + H2SO4 (k) = NaHSO4 + HCl.
16. Sales→ Óxidos básicos, óxidos ácidos.
Las sales de algunos ácidos que contienen oxígeno (nitratos, carbonatos) se descomponen cuando se calientan:
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
EJERCICIOS PARA EL TRABAJO INDEPENDIENTE SOBRE EL TEMA "RELACIÓN GENÉTICA ENTRE CLASES DE COMPUESTOS INORGÁNICOS"
1. Nombre las sustancias enumeradas a continuación, distribúyalas en las clases de compuestos inorgánicos: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2. De las sustancias enumeradas a continuación es posible obtener hidróxido (ácido o base) en una etapa: cobre, óxido de hierro (P), óxido de bario, óxido de nitrógeno (P), óxido de nitrógeno (V), óxido de silicio, sulfato de cobre, cloruro de potasio , carbonato de potasio, magnesio.
3. De la lista anterior, escriba las fórmulas de sustancias relacionadas con: 1) óxidos; 2) motivos; 3) ácidos; 4) sales:
CO 2, NaOH, HCl, SO 3, CuSO 4, NaNO 3, KCl, H 2 SO 4, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3.
4. Nombre las sustancias: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Indique a qué clase pertenece cada sustancia.
5. Escriba las fórmulas moleculares de las siguientes sustancias e indique a qué clase pertenece cada sustancia:
1) hidrocarburo de cobre (II);
2) óxido nítrico (V);
3) hidróxido de níquel (II);
4) hidrógeno fosfato de bario;
5) ácido perclórico;
6) hidróxido de cromo (III);
7) clorato de potasio;
8) ácido de sulfuro de hidrógeno;
9) zincato de sodio.
6. Da ejemplos de las reacciones de la conexión entre:
1) sustancias simples no metálicas;
2) sustancia simple y óxido;
3) óxidos;
4) sustancias complejas que no son óxidos;
5) metal y no metal;
6) Tres sustancias.
7. Cual de las siguientes sustancias puede reaccionar:
1) monóxido de carbono (IV): HCl, O2, NO2, KOH, H2O;
2) óxido de magnesio: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) hidróxido de hierro (II): KCl, HCl, KOH, O2, H2O, HNO3;
4) cloruro de hidrógeno: Zn, MgO, ZnCl2, HNO3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. ¿Es posible la interacción entre las siguientes sustancias?
1) monóxido de carbono (IV) e hidróxido de potasio;
2) hidrosulfato de potasio e hidróxido de calcio;
3) fosfato de calcio y ácido sulfúrico;
4) hidróxido de calcio y óxido de azufre (IV);
5) ácido sulfúrico e hidróxido de potasio;
6) bicarbonato de calcio y ácido fosfórico;
7) sílice y ácido sulfúrico;
8) óxido de zinc y óxido de fósforo (V).
Escribe las ecuaciones de posibles reacciones, especifica las condiciones en que ocurren. Si las reacciones pueden conducir a sustancias diferentes, indique cuál es la diferencia en las condiciones de su conducta.
9. Indique las ecuaciones de las reacciones para obtener las siguientes sustancias: ortofosfato de sodio (4 maneras), sulfato de potasio (7 formas), hidróxido de zinc.
10. Uno de los métodos para producir soda (carbonato de sodio) es la acción del agua y el monóxido de carbono (IV) sobre el aluminato de sodio. Componga las ecuaciones de reacción.
11. Al cambiar los coeficientes, escriba los productos de reacción:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Haz las ecuaciones de reacciones para recibir diferentes tipos de sales:
1) SO2 + Ba (OH) 2 → (medio y sales ácidas),
2) A1 2 O 3 + H 2 O + HNO 3 → (sal media, sales básicas),
3) Na 2 O + H 2 S → (medio y sales ácidas),
4) SO 3 + Sa (OH) 2 → (sales medias y básicas),
5) CaO + H 2 O + P 2 O 5 → (sal básica, sales ácidas).
13. Completa las ecuaciones de reacción:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (insuficiente) →
AlCl 3 + NaOH (deficiente) → (FeOH) Cl + NaHS →
AlCl3 + NaOH → Na2ZnO2 + H2SO4 (exceso) →
AlC1 3 + NaOH (en exceso) → Ca (AlO 2) 2 + HCl (en exceso) →
14. Escriba las ecuaciones de reacción, con la ayuda de las cuales se pueden realizar las siguientes transformaciones:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaSrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO4 → ZnCl2 → Zn (OH) 2 → Na2 → Zn (NO3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) sulfato de aluminio → cloruro de aluminio → nitrato de aluminio → óxido de aluminio → aluminato de potasio → hidróxido de aluminio → hidróxido de aluminio → cloruro de aluminio.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) bario → hidróxido de bario → bicarbonato de bario → cloruro de bario → carbonato de bario → cloruro de bario → hidróxido de bario
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO3 → Na2CO3 → NaCl → NaHSO4 → Na2SO4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH3 → NH4C1 → NH3 = H2O → NH4HCO3 → NH3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl2 → FeCl3 → Fe2O3 → Fe (OH) 3 → Fe (NO3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO2 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
EXPERIENCIAS EXPERIMENTALES EN EL TEMA "CLASES PRINCIPALES DE COMPUESTOS INORGANICOS"
EXPERIENCIA 1.Reacciones de neutralización.
a) La interacción de un ácido fuerte y una base fuerte.
Vierta 5 ml de solución de ácido clorhídrico 2 N en un plato de porcelana y agregue gota a gota una solución de hidróxido de sodio 2 N. Revuelva la solución con una varilla de vidrio y pruebe su efecto sobre el tornasol, transfiriendo una gota de la solución a la prueba de tornasol. Es necesario lograr una reacción neutral (el papel de tornasol azul y rojo no cambia de color). Evaporar la solución resultante a sequedad. ¿Qué se formó? Escribir ecuaciones de reacción moleculares e iónicas.
b) La interacción de un ácido débil y una base fuerte.
Vierta 2 ml de una solución alcalina en un tubo y agregue una solución de ácido acético hasta que la solución sea neutra. Escribir ecuaciones de reacción moleculares e iónicas. Explique por qué la reacción de los iones de equilibrio, en la que participa un electrolito débil (ácido acético), se desplaza hacia la formación de moléculas de agua.
EXPERIENCIA 2. Hidróxidos anfóteros.
De los reactivos disponibles en el laboratorio, obtener un precipitado de hidróxido de zinc. Agite el precipitado obtenido y vierta pequeñas cantidades en 2 tubos. A una solución agregue solución de ácido clorhídrico, a la otra solución de hidróxido de sodio (exceso). ¿Qué se observa? Escribe las ecuaciones de las reacciones correspondientes en forma molecular e iónica.
EXPERIENCIA 3.Propiedades químicas de las sales.
a) La interacción de las soluciones salinas con la formación de una sustancia poco soluble.
Vierta 2 ml de solución de carbonato de sodio en el tubo y agregue solución de cloruro de bario hasta que se forme un precipitado blanco. Escribe la ecuación de la reacción química en forma iónica y molecular. El precipitado se divide en dos partes. Vierta una solución de ácido sulfúrico en uno de los tubos, e hidróxido de sodio en el otro. Hacer una conclusión sobre la solubilidad del precipitado en ácidos y álcalis.
b) Interacción de la solución de sal con ácidos para formar un compuesto volátil.
Vierta 2 ml de solución de carbonato de sodio en el tubo y agregue un pequeño volumen de solución de ácido clorhídrico. ¿Qué se observa? Escribe las ecuaciones de la reacción química en forma iónica y molecular.
c) Interacción de soluciones salinas con álcalis con la formación de un compuesto volátil.
Vierta un poco de solución de sal de amonio en el tubo, agregue 1-2 ml de solución de hidróxido de sodio y caliente hasta que hierva. En un tubo de ensayo con la mezcla de reacción para hacer una prueba de tornasol rojo húmedo. ¿Qué se observa? Dar una explicacion Escribe las ecuaciones de reacción.
g ) Interacciones de sales con metales más activos que el metal que forma parte de la sal.
Limpie la uña de hierro (acero) con papel de lija fino. Luego sumérjalo en una solución de sulfato de cobre. Después de algún tiempo, observe la liberación de cobre en la superficie de la uña. Escribe la ecuación de reacción correspondiente en forma iónica y molecular.
EXPERIENCIA 4.Obtención de sales básicas y ácidas.
a) Preparación del hidrocarburo de plomo.
Agregue un poco de óxido de plomo (II) a la solución de acetato de plomo (II) y hierva la mezcla durante unos minutos. La solución enfriada se drena del sedimento y una corriente de dióxido de carbono se pasa a través de él. ¿Qué se observa? Filtrar el precipitado y secar entre las hojas de papel de filtro. Marque el color y la naturaleza del precipitado resultante de hidroxocarbonato de plomo. Escribe las ecuaciones de reacción. Hacer una fórmula gráfica de la sal obtenida.
b) Preparación de bicarbonato de magnesio.
A una solución muy altamente diluida de algo de sal de magnesio agregue una pequeña solución de carbonato de sodio. ¿Qué sustancia precipita? Solución saturada con sedimento con dióxido de carbono. Observar la disolución gradual del precipitado. ¿Por qué sucede esto? Escribe las ecuaciones de reacción.
EXPERIENCIA 5.Obtención de sales complejas.
a) Formación de compuestos con catión complejo.
Agregue una solución de amoníaco gota a gota a un tubo con 2-3 ml de solución de cloruro de cobre (II) hasta que se forme un precipitado de hidróxido de cobre (II), y luego agregue un exceso de solución de amoníaco hasta que el precipitado se disuelva. Compare el color de los iones si 2+ con el color de la solución resultante. ¿La presencia de cuáles iones hacen que la solución se coloree? Escribe la ecuación de reacción para obtener el compuesto complejo.
b) Formación de compuestos con un anión complejo.
A 1-2 ml de solución de nitrato de mercurio (II), agregue gota a gota una solución diluida de yoduro de potasio para formar un precipitado de HgI 2. Luego vierta un exceso de solución de yoduro de potasio hasta que se disuelva el precipitado. Escribe las reacciones de obtener una sal compleja.
EXPERIENCIA 6.Preparación de sales dobles (alumbre de potasio).
Se pesan 7,5 g de Al 2 (SO 4) 3 ∙ 18H 2 O y se disuelven en 50 ml de agua, tomando una taza de porcelana suficientemente grande para este fin. Calcule la ecuación de reacción y pese la masa de sulfato de potasio necesaria para la reacción. Prepare una solución saturada caliente de sulfato de potasio y viértala en un plato de porcelana con una solución de sulfato de aluminio mientras agita. Observa al cabo de un rato la pérdida de cristales de alumbre potásica. Después del enfriamiento y la cristalización, elimine el licor madre, seque los cristales de alumbre entre las hojas de papel de filtro y pese los cristales resultantes. Calcula el porcentaje de rendimiento.
TAREAS DE ACUERDO
1. Al pasar un exceso de sulfuro de hidrógeno a través de 16 g de solución de sulfato de cobre (II), se obtuvieron 1,92 g de precipitado. Encuentre la fracción de masa de sulfato de cobre en la solución usada y el volumen de sulfuro de hidrógeno consumido.
2. Para la precipitación completa de cobre en forma de sulfuro a partir de 291 cm 3 de solución de sulfato de cobre (II) con una fracción de masa del 10%, se utilizó gas obtenido al hacer reaccionar 17.6 g de sulfuro de hierro (II) con un exceso de ácido clorhídrico. Encuentra la densidad de la solución de sulfato de cobre original.
3. El gas liberado durante la interacción de la solución de K 2 S con ácido sulfúrico diluido se pasa a través de un exceso de solución de nitrato de plomo (II). El residuo resultante tiene una masa de 71.7 g. Encuentre el volumen de la solución reaccionada de ácido sulfúrico, si su densidad es 1.176 g / cm 3, y la fracción de masa es del 25%.
4. A una solución que contenía 8 g de sulfato de cobre (II), se agregó una solución que contenía 4,68 g de sulfuro de sodio. El precipitado se filtró, el filtrado se evaporó. Determine la masa de sustancias en el filtrado después de la evaporación y la masa del precipitado de sulfuro de cobre.
5. Parte del sulfuro de hierro (II) se trató con un exceso de ácido clorhídrico. El gas resultante en la reacción con 12,5 cm 3 de solución de NaOH con una fracción de masa del 25% y una densidad de 1,28 g / cm 3 formó una sal ácida. Encuentra la masa del sulfuro de hierro original.
6. El sulfuro de hierro (II) que pesaba 176 g se trató con un exceso de ácido clorhídrico y el gas resultante se quemó con aire en exceso. ¿Qué volumen de solución de KOH con una fracción de masa del 40% y una densidad de 1,4 g / cm 3 es necesario para neutralizar completamente el gas producido durante la combustión?
7. Al tostar 100 g de pirita técnica, obtuvieron un gas que neutralizó completamente 400 cm 3 de solución de NaOH con una fracción de masa del 25% y una densidad de 1.28 g / cm 3. Determinar la fracción de masa de impurezas en pirita.
8. A 2 g de una mezcla de hierro, óxido de hierro (II) y óxido de hierro (III) se agregaron 16 cm 3 de solución de HCl con una fracción de masa del 20% y una densidad de 1,09 g / cm 3. Para neutralizar el exceso de ácido, tomó 10.8 cm 3 de solución de NaOH con una fracción de masa de 10% de densidad de 1.05 g / cm 3. Encuentre las masas de las sustancias en la mezcla si el volumen de hidrógeno liberado es 224 cm 3 (NU).
9. Hay una mezcla de Ca (OH) 2, CaCO 3 y BaSO 4 con una masa de 10,5 g. Cuando la mezcla se trató con exceso de ácido clorhídrico, se liberaron 672 cm 3 (UI) de gas y 71,2 g del ácido reaccionaron con una masa. Cuota del 10%. Determinar la masa de sustancias en la mezcla.
10. Hay una mezcla de cloruro de bario, carbonato de calcio y bicarbonato de sodio. Cuando se disuelven 10 g de esta mezcla en agua, el residuo insoluble es igual a 3.5 g. Al calcinar 20 g de la mezcla inicial, su masa disminuye en 5.2 g. Encuentre las fracciones de masa de sustancias en la mezcla inicial.
11. Hay una solución que contiene ácidos sulfúrico y nítrico. Para neutralizar completamente 10 g de esta solución, se consumen 12,5 cm 3 de solución de KOH con una fracción de masa del 19% y una densidad de 1,18 g / cm 3. Cuando se agrega un exceso de cloruro de bario a 20 g de la misma mezcla de solución ácida, caen 4,66 g de precipitado. Encuentra las fracciones en masa de ácidos en la mezcla.
12. Todo el cloruro de hidrógeno, obtenido a partir de 100 g de una mezcla de KCl y KNO3, se disolvió en 71,8 cm3 de agua. Al calcinar 100 g de la misma mezcla de sales, quedan 93,6 g de residuo sólido. Encuentra la fracción de masa de cloruro de hidrógeno en el agua.
13. Al pasar 2 m 3 de aire (NU) a través de una solución de Ca (OH) 2, se obtuvieron 3 g de precipitado de sal de ácido carbónico. Encuentra el volumen y la fracción de masa de CO 2 en el aire.
14. El dióxido de carbono se pasa a través de una suspensión que contiene 50 g de CaCO3. La reacción vino de 8,96 dm3 de gas (NU). ¿Cuál es la masa de CaCO 3 que queda en la fase sólida?
15. Al agregar agua a CaO, su masa aumentó en un 30%. ¿Qué parte de CaO (en masa%) se extinguió?
16. El óxido de plomo (II) que pesaba 18,47 g se calentó en una corriente de hidrógeno. Después de la reacción, la masa del plomo resultante y el óxido sin reaccionar fue de 18.07 g. ¿Cuál es la masa de óxido de plomo que no reaccionó?
17. El monóxido de carbono se pasa a través del óxido de hierro (III) cuando se calienta. La masa del residuo sólido después de la reacción es 2 g menos que la masa inicial de óxido de hierro. ¿Cuál es la cantidad de CO reaccionado (el óxido se reduce completamente)?
18. Hay 8.96 dm 3 (NU) de una mezcla de N 2, CO 2 y SO 2 con una densidad relativa de hidrógeno 25. Luego de pasarla a través de un exceso de solución de KOH, el volumen de la mezcla disminuyó 4 veces. Encuentra los volúmenes de gases en la mezcla original.
19. En dos vasos hay 100 g de solución de HC1 con una fracción de masa del 2.5%. En un vaso se agregaron 10 g de CaCO3, en el otro - 8.4 g de MgCO3. ¿En qué se diferenciará la masa de gafas después de la reacción?
20. ¿Qué volumen (NU) de dióxido de azufre se debe pasar a través de 200 cm 3 de una solución con una fracción de masa de NaOH al 0,1% y una densidad de 1 g / cm 3 para obtener una sal ácida?
21. ¿Cuál es la cantidad máxima (dióxido de carbono) de dióxido de carbono que puede absorber 25 cm 3 de una solución con una fracción de masa de NaOH al 25% y una densidad de 1.1 g / cm 3?
22. ¿Cuál es el volumen mínimo de la solución con una fracción en masa de 20% de KOH y una densidad de 1.19 g / cm 3 que puede absorber todo el dióxido de carbono producido con la reducción total de 23.2 g de magnetita con monóxido de carbono?
23. ¿Cuál es la masa mínima de KOH que se debe hacer reaccionar con 24.5 g de ácido ortofosfórico para que solo el dihidrógeno fosfato de potasio sea el producto?
24. ¿Cuál es la masa mínima de Ca (OH) 2 para agregar a 16 g de solución de bicarbonato de calcio con una fracción en masa de sal al 5% para obtener una sal media?
25. ¿Qué masa de hidrógeno fosfato de potasio se debe agregar a una solución que contenga 12.25 g de H 3 PO 4 para que después de esto la solución contenga solo dihidrofosfato de potasio?
26. La solución contenía 56,1 g de una mezcla de carbonatos de calcio y magnesio en suspensión. Para convertirlos en hidrocarburos, gastaron todo el dióxido de carbono producido al quemar 7 dm 3 (NU) de etano. Encuentra la masa de carbonato de calcio en la mezcla inicial.
27. Para convertir 9.5 g de una mezcla de fosfato de sodio y dihidrógeno en una sal mediana, se necesitan 10 cm 3 de una solución con una fracción de NaOH del 27.7% y una densidad de 1.3 g / cm 3. Encuentra la masa de fosfato de hidrógeno en la mezcla.
28. Al pasar dióxido de carbono a través de una solución que contiene 6 g de NaOH, se obtuvieron 9,5 g de una mezcla de sales ácidas y medias. Encuentra el volumen de dióxido de carbono consumido.
29. Después de pasar 11,2 dm3 (NU) CO2 a través de la solución de KOH, se obtuvieron 57.6 g de una mezcla de ácido y sales medias. Encuentra la masa de sal media.
30. ¿Qué masa de ácido ortofosfórico debe neutralizarse para obtener 1.2 g de dihidro y 4.26 g de hidrógeno fosfato de sodio?
31. Se añadió NaOH a la solución de ácido sulfúrico y se obtuvieron 3,6 g de hidrosulfato y 2,84 g de sulfato de sodio. Determine las cantidades químicas del ácido y álcali que han reaccionado.
32. Después de pasar el cloruro de hidrógeno a través de 200 cm 3 de una solución de NaOH con una fracción de masa del 10% y una densidad de 1,1 g / cm 3, la fracción de masa de NaOH en la solución resultante disminuyó a la mitad. Determine la fracción de masa de NaCl en la solución resultante.
33. Disolver 14.4 g de una mezcla de cobre y su óxido (II) consumió 48.5 g de una solución con una fracción de masa de HNO 3 del 80%. Encuentra las fracciones en masa de cobre y óxido en la mezcla inicial.
34. Se disolvió óxido de sodio con un peso de 6,2 g en 100 cm 3 de agua y se obtuvo la solución No. 1. Luego se añadió a esta solución ácido clorhídrico con una fracción de masa del 10% hasta que el medio se volvió neutro y se obtuvo la solución No. 2. Determine :
1) fracciones en masa de sustancias en las soluciones No. 1, 2;
2) la masa de la solución HC1, que fue para neutralizar la solución número 1.
35. 3 g de zinc interactúan con 18,69 cm3 de solución de HCl con una fracción de masa del 14,6% y una densidad de 1,07 g / cm3. Cuando se calienta, el gas resultante se pasa sobre CuO caliente que pesa 4 g. ¿Cuál es la masa de cobre que se obtiene?
36. El gas liberado después del tratamiento de hidruro de calcio con exceso de agua se pasó sobre FeO. Como resultado, la masa de óxido disminuyó en 8 g. Encuentre la masa de CaH 2 tratada con agua.
37. Durante la calcinación de la muestra de CaCO 3, su masa disminuyó en un 35,2%. Los productos de reacción sólidos se disolvieron en un exceso de ácido clorhídrico para obtener 0,112 dm 3 (NU) de gas. Determinar la masa de la muestra original de carbonato de calcio.
38. El nitrato de cobre se descompuso y el óxido de cobre (II) resultante se redujo completamente con hidrógeno. Los productos resultantes pasaron a través de un tubo con P 2 O 5, y la masa del tubo aumentó en 3.6 g. ¿Cuál es el volumen mínimo de ácido sulfúrico con una fracción de masa del 88% y una densidad de 1.87 g / cm 3 necesaria para la disolución obtenida en el experimento? ¿El cobre y cuál es la masa de sal descompuesta?
39. Tras la absorción de óxido nítrico (IV) por un exceso de solución de KOH en frío en ausencia de oxígeno, se obtuvieron 40,4 g de KNO 3. ¿Qué sustancia todavía se forma y cuál es su masa?
40. Para neutralizar 400 g de una solución que contiene sal y ácido sulfúrico, consumió 287 cm 3 de solución de hidróxido de sodio con una fracción de masa del 10% y una densidad de 1,115 g / cm 3. Si se agrega un exceso de solución de cloruro de bario a 100 g de la solución inicial, se caerán 5.825 g de precipitado. Determinar las fracciones en masa de ácidos en la solución inicial.
41. Después de pasar el dióxido de carbono a través de una solución de hidróxido de sodio, se obtuvieron 13,7 g de una mezcla de medio y sales ácidas. Para convertirlos en cloruro de sodio, se necesitan 75 g de ácido clorhídrico con una fracción de HCl en masa del 10%. Encuentra el volumen de carbono absorbido.
42. Se trató una mezcla de ácidos clorhídrico y sulfúrico con una masa total de 600 g de solución con las mismas fracciones en masa de ácidos con un exceso de bicarbonato de sodio y 32.1 dm 3 de gas (No). Encuentra la fracción de masa de ácidos en la mezcla inicial.
43. Para neutralizar 1 dm 3 de solución de NaOH, se consumieron 66,66 cm 3 de solución de HNO 3 con una fracción de masa del 63% y una densidad de 1,5 g / cm 3. ¿Qué volumen de solución de ácido sulfúrico con una fracción de masa del 24,5% y una densidad de 1,2 g / cm 3 se requeriría para neutralizar la misma cantidad de álcali?
44. ¿En qué proporción de volumen se debe tomar una solución de ácido sulfúrico con una fracción de masa del 5% y una densidad de 1,03 g / cm 3 y una solución de hidróxido de bario con una fracción de masa del 5% y una densidad de 1,1 g / cm 3 para una neutralización completa? Imagine la respuesta como el cociente del volumen de la solución alcalina en la solución ácida.
45. Calcule el volumen mínimo de solución de amoníaco con una densidad de 0,9 g / cm 3 y una fracción en masa del 25%, lo que es necesario para la absorción completa del dióxido de carbono obtenido al descomponer 0,5 kg de piedra caliza natural con una fracción en masa de carbonato de calcio igual al 92%.
46. Para la conversión completa de 2.92 g de una mezcla de hidróxido de sodio y carbonato de sodio en cloruro, se requieren 1.344 dm3 de cloruro de hidrógeno (NU). Encuentra la masa de carbonato de sodio en la mezcla.
47. A 25 g de una solución de sulfato de cobre (II) con una fracción de masa del 16% se le añadió una cantidad de solución de hidróxido de sodio con una fracción de masa del 16%. El precipitado formado se filtró, después de lo cual el filtrado fue alcalino. Para neutralizar completamente el filtrado, se requirieron 25 cm 3 de una solución de ácido sulfúrico con una concentración molar de 0.1 mol / dm 3 de solución. Calcule la masa de la solución de hidróxido de sodio agregado.
48. La sustancia obtenida con la reducción completa de CuO con una masa de 15.8 g de hidrógeno con un volumen de 11.2 dm 3 (NU) se disolvió calentando en ácido sulfúrico concentrado. ¿Qué volumen de gas (NU) se liberó como resultado de la reacción?
49. Para la neutralización completa de 50 cm 3 de ácido clorhídrico con una fracción en masa de HCl del 20% y una densidad de 1,10 g / cm 3, se utilizó una solución de hidróxido de potasio con una fracción en masa de KOH del 20%. ¿Cuál es la cantidad química de agua contenida en la solución resultante?
50. El gas obtenido al pasar un exceso de CO2 sobre 0,84 g de carbón caliente, se envía a la reacción con 14,0 g de óxido de cobre (II) calentado. ¿Qué volumen de una solución de ácido nítrico con una fracción de masa del 63% y una densidad de 1,4 g / cm 3 es necesaria para disolver completamente la sustancia obtenida en la última reacción?
51. Cuando se calcinó a una masa constante de nitrato de cobre (II), la masa de sal disminuyó en 6,5 g. ¿Qué masa de sal se descompuso?
52. Cuando se usó un exceso de ácido clorhídrico, se liberaron 6,72 dm3 (NW) de gas sobre una mezcla de aluminio con un metal monovalente desconocido, y la masa de la mezcla se redujo a la mitad. Al tratar el residuo con ácido nítrico diluido, se liberaron 0.373 dm3 (NU) NO. Identificar metal desconocido.
53. La masa de la muestra de tiza es de 105 g, y la cantidad química del elemento oxígeno en su composición es de 1 mol. Determine la fracción de masa de CaCO 3 en la muestra de tiza (el oxígeno se incluye solo en la composición del carbonato de calcio).
54. En la interacción del óxido de azufre (VI) con agua, se obtuvo una solución con una fracción en masa de ácido sulfúrico del 25%. Cuando se agregó un exceso de Ba (OH) 2 a esta solución, se depositó un precipitado de 29.13 g. ¿Qué masas de SO3 y H2O se gastaron en la formación de una solución ácida?
55. Al pasar SO 2 a través de 200 g de una solución con una fracción en masa de NaOH del 16%, se formó una mezcla de sales, que incluye 41.6 g de una sal ácida. ¿Cuál es la masa de azufre que contiene 4,5% de impurezas en peso, se utilizó para obtener SO 2? ¿Cuál es el peso de la sal mediana?
56. Se utilizaron 50 g de solución de Na 2 CO 3 para reaccionar con 80 g de solución de Ca (NO 3) 2. La precipitación se separó, mientras se procesaba con un exceso de ácido clorhídrico y se liberaron 2,24 dm 3 (NU) de gas. ¿Cuáles son las fracciones en masa de sales en las soluciones iniciales? ¿Cuál es la fracción de masa de nitrato de sodio en la solución después de separar el precipitado?
57. Cuando el zinc interactúa con el ácido sulfúrico, se forman 10 dm 3 (NU) de una mezcla de SO 2 y H 2 S con una densidad relativa de argón de 1.51. ¿Cuál es la cantidad química de zinc disuelto? ¿Cuál es la fracción de masa de SO 2 en la mezcla de gases?
58. Se disolvió una muestra de una mezcla de aserrín de zinc y aluminio con una masa total de 11 g en un exceso de solución alcalina. Determine el volumen (NU) del gas liberado, si la fracción de masa de zinc en la mezcla es del 30%.
59. Hidróxido de sodio que pesa 4.0 g aleado con hidróxido de aluminio que pesa 9.8 g Calcule la masa del metaaluminato de sodio obtenido.
60. Cuando se procesan 10 g de una mezcla de cobre y aluminio con ácido nítrico concentrado a temperatura ambiente liberado 2.24 dm 3 gas (nep). ¿Qué volumen (NU) de gas se liberará cuando se procese la misma masa de la mezcla con un exceso de solución de KOH?
61. Una aleación de cobre y aluminio que pesaba 20 g se trató con un exceso de álcali, el residuo no disuelto se disolvió en ácido nítrico concentrado. La sal obtenida se aisló, se calcinó a peso constante y se obtuvieron 8 g de un residuo sólido. Determine el volumen de la solución de NaOH consumida con una fracción de masa del 40% y una densidad de 1,4 g / cm 3).
62. Una mezcla de aluminio y óxido metálico (II) (óxido no anfótero) que pesaba 39 g se trató con un exceso de solución de KOH, el gas emitido se quemó para obtener 27 g de agua. El residuo no disuelto se disolvió completamente en 25,2 cm 3 de una solución con una fracción en masa de HCl del 36,5% y una densidad de 1,19 g / cm 3). Determinar el óxido.
63. Una mezcla de virutas de zinc y cobre se trató con un exceso de solución de KOH, mientras que se liberó un gas de 2,24 dm3 (NU). Para la cloración completa de la misma muestra de metales, se requirió cloro con un volumen de 8.96 dm 3 (NU). Calcule la fracción de masa de zinc en la muestra.
64. Una mezcla de aserrín de hierro, aluminio y magnesio con una masa de 49 g se trató con un exceso de H2SO4 diluido, obteniendo así 1,95 mol de gas. Otra porción de la misma mezcla que pesaba 4,9 g se trató con un exceso de solución alcalina; se obtuvieron 1,68 dm3 (NU) de gas. Encuentra la masa de metales en la mezcla.
65. ¿Cuál es la masa de sedimento que se forma al fusionar soluciones que contienen 10 g de NaOH y 13.6 g de ZnCl 2?
66. Hay dos porciones de la mezcla de Al, Mg, Fe, Zn, la misma en la composición molar, cada una pesa 7,4 g, una porción se disolvió en ácido clorhídrico y se obtuvieron 3,584 dm 3 de gas (NU), la otra en solución alcalina y Recibió 2.016 dm 3 de gas (nep). Se sabe que en ambas mezclas hay 3 átomos de Zn por átomo A1. Encuentra la masa de metales en la mezcla.
67. Una mezcla de cobre, magnesio y aluminio que pesaba 1 g se trató con un exceso de ácido clorhídrico. La solución se filtró, se añadió un exceso de solución de NaOH al filtrado. El precipitado resultante se separó y se calcinó a una masa constante de 0,2 g.El residuo que no se disolvió después del tratamiento con ácido clorhídrico se calcinó en aire y se obtuvieron 0,8 g de una sustancia negra. Encuentra la fracción de masa de aluminio en la mezcla.
68. Cuando se calienta en una corriente de oxígeno, una aleación de zinc, magnesio y cobre, la masa de la mezcla aumenta en 9.6 g. El producto se disuelve parcialmente en álcali, y 40 cm 3 de una solución con una fracción de KOH del 40% y una densidad de 1.4 g / cm es necesario para la disolución. 3 Para la reacción con la misma porción de la aleación, se necesitan 0.7 mol HC1. Encuentra cantidades químicas de metales en la aleación.
69. Se trató una aleación de cobre con zinc que pesaba 5 g con un exceso de solución de NaOH. Luego, el residuo sólido se separó y se trató con HNO 3 concentrado, se aisló la sal así obtenida, se calcinó a peso constante y se obtuvieron 2,5 g de un residuo sólido. Determinar la masa de metales en la aleación.
70. Una aleación de cobre y aluminio que pesaba 12,8 g se trató con un exceso de ácido clorhídrico. El residuo no disuelto se disolvió en ácido nítrico concentrado, la solución resultante se evaporó, el residuo seco se calcinó a peso constante y se obtuvieron 4 g de sólido. Determinar la fracción de masa de cobre en la aleación.
71. ¿En qué proporción de masa deberían tomarse dos porciones de A1, de modo que cuando se agrega una a la solución de álcali y la otra a cantidades iguales de hidrógeno se liberan en el ácido clorhídrico?
72. Al procesar una mezcla de aluminio y óxido de cobre (II) con un exceso de solución de KOH, se liberaron 6.72 dm 3 (NU) de gas, y disolviendo la misma porción de la mezcla en HNO 3 concentrado a temperatura ambiente, se obtuvieron 75.2 g de sal. Encuentra la masa de la mezcla inicial de sustancias.
73. ¿Qué masa de óxido de cobre (II) se puede restaurar con el hidrógeno obtenido haciendo reaccionar un exceso de aluminio con 139.87 cm 3 de una solución con una fracción de masa de NaOH del 40% y una densidad de 1.43 g / cm 3?
74. Durante la oxidación completa de 7.83 g de la aleación de dos metales, se formaron 14.23 g de óxidos, durante el tratamiento de los cuales un exceso de álcali permaneció sin disolver 4.03 g de sedimento. Determine la composición cualitativa de los metales que forman la aleación, si sus cationes tienen un estado de oxidación de +2 y +3, y la relación molar de óxidos es de 1: 1 (suponga que un óxido de metal con un estado de oxidación de +3 tiene propiedades anfóteras).
75. Se disolvieron dos porciones de aluminio con la misma masa: una en una solución de hidróxido de potasio y la otra en ácido clorhídrico. ¿Cómo se relacionan entre sí los volúmenes de gases liberados?
76. Una aleación de cobre con aluminio que pesaba 1.000 g se trató con un exceso de solución alcalina, el precipitado no disuelto se disolvió en ácido nítrico, luego la solución se evaporó, el residuo se calcinó hasta peso constante. La masa del nuevo residuo es igual a 0.398 g. ¿Cuál es la masa de metales en la aleación?
77. Una aleación de zinc y cobre que pesaba 20 g se trató con un exceso de solución de NaOH con una fracción de masa del 30% y una densidad de 1,33 g / cm 3. El residuo sólido se aisló y se trató con un exceso de una solución concentrada de HNO 3. La sal formada durante este proceso se aisló y calcinó a masa constante. La masa del residuo sólido fue de 10,016 g. Calcule las fracciones en masa de metales en la aleación y el volumen de solución alcalina consumida.
78. Una aleación de cobre y aluminio que pesaba 2 g se trató con un exceso de solución alcalina. El residuo se filtró, se lavó, se disolvió en HNO3, la solución se evaporó y se calcinó a peso constante. La masa del residuo después de la calcinación fue 0.736 g. Calcule las fracciones en masa de metales en la aleación.
79. La cloración de una mezcla de hierro, cobre y aluminio requiere 8,96 dm 3 de cloro (NU), y la interacción de la misma muestra con cloruro de hidrógeno requiere 5,6 dm 3 (NU). Al interactuar con la misma masa de una mezcla de metales con álcali, se liberan 1.68 dm 3 (NU) de gas. Encuentra cantidades químicas de metales en la mezcla.
80. Se disolvió hidruro de potasio con un peso de 5,0 g en agua con un volumen de 80 cm 3 y se introdujo aluminio con un peso de 0,81 g. Encuentre las fracciones en masa de las sustancias en la solución resultante con una precisión de hasta milésimas de porcentaje.
LISTA DE LITERATURA
1. Barannik, V.P. Nomenclatura rusa moderna de compuestos inorgánicos / V.P. Barannik // Revista de la All-Union Chemical Society. D.I. Mendeleev. - 1983. - Vol. XXVIII. - Pág. 9-16.
2. Wroblewski, A.I. Simulador de química / A.I. Wroblewski. - 2ª ed., Pererab. y añadir. - Minsk: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Tareas y ejercicios en química general: estudios. Manual para universidades / ed. V.A. Rabinovich y H.M. Rubí - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Tareas en química general e inorgánica: estudios. subsidio para estudiantes de mayor nivel. estudios instituciones / R.A. Lidin, V.A. Leche, L.L. Andreeva; por ed. R.A. Lidina. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. Fundamentos de la nomenclatura de sustancias inorgánicas / R.А. Lidin [et al.]; por ed. B.D. Stepina - M.: Química, 1983. - 112 p.
6. Stepin, B.D. Aplicación de las normas de la IUPAC sobre la nomenclatura de compuestos inorgánicos en ruso / B.D. Stepin, R.A. Lidin // Revista de la All-Union Chemical Society. D.I. Mendeleev. - 1983. - Vol. XXVIII. - Pág. 17-20.
| Introducción …………………………………………………………………… Reglas generales para el rango de sustancias inorgánicas ………… .. Óxidos ………………………………… ……………………………… Óxidos básicos ………………………………………………………… ... Óxidos de ácido ………………………………… ………………………. Óxidos anfóteros ……………………………………………………… .. Obtención de óxidos ………………………………………………………… Ejercicios para el trabajo independiente en El tema “Óxidos” ……………………………………………………. Ácidos ……………………………………………………………………. Ejercicios para el trabajo independiente sobre el tema "Ácidos" ...................................................................... Motivos ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ……… .. Ejercicios de trabajo independiente sobre el tema “Fundamentos” ………………………………………………………. Sales …………………………………………………………………………. Ejercicios para el trabajo independiente sobre el tema "Sales" ............................................................. ... ... conexión genética entre clases de compuestos inorgánicos ... ... ... ... ... ... ... ... ... ... ... ... …………… .. Ejercicios para trabajo independiente sobre el tema “Relación genética entre clases de compuestos inorgánicos” …………………………………………… Experimentos experimentales sobre el tema “Clases principales de compuestos inorgánicos …………… ……… .. Tareas de liquidación …………………………………………………………… Referencias …………………………………………………… |
educativa para arreglar el concepto de "serie genética", "conexión genética"; enseñar a hacer series genéticas de elementos (metales y no metales), a componer las ecuaciones de reacción correspondientes a las series genéticas; comprobar cómo se asimila el conocimiento de las propiedades químicas de los óxidos, ácidos, sales, bases;
desarrollando: desarrollar la capacidad de analizar, comparar, resumir y sacar conclusiones, componer las ecuaciones de las reacciones químicas;
educativa : Promover la formación de una cosmovisión científica.
2. Proporcionar clases: tablas “Sistema periódico”, “Tabla de solubilidad”, “Serie de actividades de metales”, instrucciones para los alumnos, tareas para evaluar los conocimientos.
3. Orden de cumplimiento:
3.1. Encuesta frontal.
3.2. La solución de tareas.
3.3. Realizar trabajos de verificación de opciones.
4. Diseño del informe:
4.1. Escribe el tema y objetivos de la lección práctica.
4.2. Registro de resolución de problemas.
4.3. Resuelva su propia versión de trabajo independiente, la decisión de escribir en un cuaderno y pasar al maestro para su revisión.
Progreso del trabajo
1. Conversación frontal sobre:
¿Qué es una conexión genética?
Conexiones geneticas - Estas son conexiones entre diferentes clases, basadas en sus interconversiones.
¿Qué es una serie genética?
Fila genetica - una serie de sustancias - representantes de diferentes clases, que son compuestos de un elemento químico, conectados por interconversión y que reflejan las transformaciones de estas sustancias. La base de estas series es el mismo elemento.
¿Qué tipos de series genéticas se suelen asignar?
Entre los metales hay dos tipos de filas:
a) Una serie genética en la que el álcali actúa como base. Esta serie se puede representar usando las siguientes transformaciones:
metal → óxido básico → álcali → sal
por ejemplo, la serie genética de potasio K → K 2 O → KOH → KCl
b) La serie genética, donde la base es una base insoluble, entonces la serie puede representarse como una cadena de transformaciones:
metal → base de óxido → sal → base insoluble → base de óxido → metal
por ejemplo: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Entre los no metales también es posible distinguir dos tipos de filas:
a) La serie genética de no metales, donde el ácido soluble actúa como un enlace en la serie. La cadena de transformaciones se puede representar de la siguiente manera: no metal → óxido de ácido → ácido soluble → sal.
Por ejemplo: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Fila genética de no metales, donde el ácido insoluble: no metal → óxido de ácido → sal → ácido → óxido de ácido → no metal actúa como un enlace en la serie
Por ejemplo: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Ejecución de tareas por opciones:
| Opción 1 | Opcion 2 |
|
Opción I: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opción II: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Tarea de casa traza una transición gradual de calcio a carbonato de calcio y prepara un informe sobre el uso de cualquier sal en medicina (usando literatura adicional).
Instrucciones para la lección práctica.
Relación genética entre las principales clases de sustancias inorgánicas.
Objetivos: para arreglar el concepto de "serie genética", "conexión genética"; aprender a hacer series genéticas de elementos (metales y no metales), para componer las ecuaciones de reacción correspondientes a las series genéticas; Repetir las propiedades de los óxidos, ácidos, sales, bases.
Progreso del trabajo
Anote las definiciones de los conceptos:
Relacion genetica - __________________________________________
Fila genetica ___________________________________________
Una serie genética de metales en la que el álcali actúa como base. Se puede representar en general: metal → óxido básico → álcali → sal. Haz esta serie utilizando potasio. Escribe las ecuaciones de reacción con las que puedes hacer esta cadena de transformaciones.
La serie genética de no metales, donde el ácido soluble actúa como un enlace en la serie. se puede representar de la siguiente manera: no metal → óxido de ácido → ácido soluble → sal. Haz esta serie utilizando fósforo. Escribe las ecuaciones de reacción con las que puedes hacer esta cadena de transformaciones.
Fila genética, donde la base es base insoluble. puede representarse por una cadena de transformaciones: metal → óxido básico → sal → base insoluble → óxido básico → metal. Hacer esta serie utilizando cobre. Escribe las ecuaciones de reacción con las que puedes hacer esta cadena de transformaciones.
La serie genética de no metales, donde el ácido insoluble actúa como un enlace en la serie. puede representarse por una cadena de transformaciones: no metal → óxido de ácido → sal → ácido → óxido de ácido → no metal. Construye esta serie utilizando silicio. Escribe las ecuaciones de reacción con las que puedes hacer esta cadena de transformaciones.
Realizar tareas para las opciones:
| Opción 1 | Opcion 2 |
|
1. Elija las fórmulas de óxido en su versión, explique su elección, basándose en el conocimiento de las características de la composición de esta clase de compuestos. Llamalos
2. En la columna de fórmulas de su versión, busque las fórmulas ácidas y explique su elección basándose en el análisis de la composición de estos compuestos.
3. Determine las valencias de los residuos ácidos en la composición ácida.
4. Seleccione las fórmulas de sal y nombrelas.
5. Componga las fórmulas de sales, que se pueden formar con magnesio y ácidos de su variante. Escríbelos, llámalos.
6. En la columna de fórmulas de su versión, busque las fórmulas básicas y explique su elección basándose en el análisis de la composición de estos compuestos.
7. En su variante, elija las fórmulas de sustancias con las que pueda reaccionar la solución de ácido fosfórico (clorhídrico, sulfúrico). Haz las ecuaciones de reacción apropiadas.
9. Entre las fórmulas de su elección, elija fórmulas de sustancias que puedan interactuar entre sí. Haz las ecuaciones de reacción apropiadas.
10. Haga una cadena de enlaces genéticos de compuestos inorgánicos, que incluirá una sustancia, cuya fórmula se da en su versión en el número uno.
Haz una línea genética usando estas sustancias usando todas las fórmulas. Escribe las ecuaciones de reacción con las que puedes lograr esta cadena de transformaciones:
Yo opción: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIopcion: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Tarea de casa traza una transición gradual de calcio a carbonato de calcio y prepara un informe sobre el uso de cualquier sal en medicina (usando literatura adicional).
