Reaksionet ekuivalente, të cilat karakterizojnë fuqinë e acidit klorhidrik të holluar. Lista e ekzaminimeve për të ushqyerit nga disiplina
Sipërfaqja Pochorninya e pikturave të vjetra, të pikturuara nga olynyi farbs, në magazinë, të cilat përfshijnë bilil plumbi (PbCO3), i lidhur me deklaratat e sulfurit të plumbit hekuri (II) përmes shfaqjes së ujit në atmosferë. Nëse e mbuloni sipërfaqen me peroksid uji, atëherë reaksioni vendoset me sulfat plumbi (II) me ngjyrë të bardhë:
PbS + 4H2 O2 = PbSO4 + 4H2 O.
Në mënyrë të tillë për të rivendosur fotot e vjetra, të pikturuara nga farbs olynyi.
Zasosuvannya kisnyu dhe sirki
Zona e ruajtjes së ushqimit përfaqësohet nga një foshnjë 61.
lejojnë vikoristovuvati yogo për infeksionin pini ujë ujërat e huaja të zeza industriale; si dezinfektues në mjekësi. Ozoni do të jetë fitimtar si rezultat i derdhjes.
Verërat për prodhimin e acidit alkoolik, përgatitjen e sirnikëve, zjarret e Bengalit, luftën me nxënësit e shkollave të shtetit Silskoy dhe për të ndihmuar fëmijët me sëmundje. Syrka te njohe ruajtjen e gumit, barvnikut dhe pigmenteve, fibrave copa, luminoforeve dhe in.
I vogël. 61. Zasosuvannya sisnyu

Për thartirën në pjesën e parë, hapat më karakteristikë të oksidimit janë –2, atomet e squfurit, seleniumi dhe teluru janë hapat e oksiduar –2, +2, +4 dhe +6.
Oksidimi i fuqisë dhe i thartirës manifestohen në reagimet e tyre me metalet, ujin dhe veprat, jometalet.
Furnizimi dhe furnizimi me energji elektrike
1. Ruani formulat spoluk kisnyu s kalієm, kaltsієm dhe alumіnієm. Prezantoni hapat e një elementi të lëkurës të oksiduar dhe quajeni atë një ditë.
2. Mbroni pjesën më të madhe të syrkës nga sulfuri i aluminit.
3. Emri "kissen" - oxygenium do të thotë "scho roozhuє acid". Shkruani formulat kimike acidet vіdomih për ju, në magazinë e të cilave për të hedhur elementin. Emërtoni acidet.
4. Çfarë modifikimesh alotropike dini? Çfarë erërash vijnë nga një lloj gjëje?
5. Kisen, që thithet nga njerëzit, humbet me hemoglobinën e gjakut. Me sa duket, masa e hemoglobinës prej 1 g jepet me vëllim (n.u.) 1.35 cm 3. Në vend të hemoglobinës në gjakun e njerëzve të shëndetshëm 140 g/dm3. Vëllimi i gjakut Zagalny - 6 dm3. Mbroni kiminë e thartirës, pasi mund të vareni nga gjaku i njerëzve.
6. Fraksioni masiv i visnaznitit të acidit klorhidrik në intervalin, i prerë kur shpërndahet uji në vëllim (n.u.) 8,96 dm 3 në ujë me masoyu 500 g.
7. Performanca Razstavte në skemat fyese Reaksionet bazë okside:
a) H2 S + Cl2 + H2 O → H2 SO4 + HCl; b) H2 S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
Kanë reaksionet e lëkurës të oksidohen dhe të mbizotërojnë.
§ 39. Kisnevmіsnі spoluki sіrki
Kanë Faza e oksidimit s'єdnannyakh s sirka viyavlyaє+4 dhe +6.
Serca (IV) oksid. Acid i pastër
Oksid gri (IV) - SO2 (gaz i pastër) - një gaz pa bar me një erë karakteristike të athët, që shfaqet gjatë ujit të nxehtë:
S + O2 = t SO2.

Disa nga ata që gjetën ngecjen ishin të lidhura me venat e yndyrshme me gurë që mund të digjen. Yak duke shkruar historianin e lashtë Pliniy Sr. nga shekulli I deri në tingull. Kjo do të thotë, "erërat e zjarrit të zjarrit mund të ruajnë të gjitha llojet e hijeshave dhe të largojnë çdo forcë të papastër". Fuqia dezinfektuese dhe baktericidale e oksidit të serumit (IV) do të bëhet e egër në të njëjtën kohë. Gazi i bardhë përdoret në procesin e përpunimit të perimeve, frutave dhe frutave për të parandaluar kalbjen e tyre.
Shkarkimi i gazit të pastër pranë ujit (deri në 40 vëllime SO2 për 1 vëllim uji) - nestiyka, bazë e dyfishtë acid sircle yaka isnu tilki in roschini:
SO2 + H2 O H2 SO3.
Acidi i pastër është një acid i dobët, në dallimet e ujit shpesh shkëputet nga deklaratat e joneve hidrosulfit dhe sulfit:
H + + HSO -, | - H + + SO 2–. |
||||
Acidi i pastër është një fuqi kimike, zagalny për acidet: ndërveprimi me oksidet bazë, bazat, hyrja në shkëmbimin e reaksionit me kripërat e acideve më të ulëta, zorem, vitisnya nga kripërat, acidi i dobët:
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
Oksid serki (VI)
Oksidi Serca (VI) është i pranishëm, oksidi oksidues i serumit (IV) është i pranishëm në prani të një katalizatori në temperatura afër 500 C:
t, mace.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
Për mendjet ekstravagante, oksidi serky (VI) SO3 është një burim shterpë uji, i cili, në temperatura nën 17 ° C, shndërrohet në një fjalë kristalore. Ky është një oksid tipik acid, i cili, në lidhje me ujin, shndërron një acid të fortë acidik:
SO3 + H2 O = H2 SO4.
Acidi Sircana
Një formulë grafike është një model i një molekule të acidit sulfurik dhe synon pak 62.
I vogël. 62. Formula grafike dhe modeli i një molekule të acidit klorhidrik
Kanë çështjet e mbarështimit acidi sirkan- elektrolit i fortë,
і її disosіatsіyu rrotullohen si kjo:
H2 SO4 → 2Н + + SO4 2–.
Fuqia fizike e acidit klorhidrik
Acidi Сірчана - i rëndësishëm (forca 1.83 g / cm3), me vaj, pa bar, pa erë. Vaughn do të shkojë në ujë në çdo lloj shikimi.
Procesi i përcaktimit të H2SO4 me një sasi kimike 1 mol mbivendoset në sasinë 92 kJ nxehtësie, e cila mund të përshtatet në vlerat e efekteve termike në reaksionet kimike. Vizualizimi i një sasie të madhe nxehtësie gjatë bashkëveprimit të acidit klorhidrik dhe ujit është dëshmi e krijimit të mikrosferave me dy fjalë hidrate të tipit H2 SO4 n H2 O.
Për shembull, H2 SO4 · H2 O; H2SO4 2H2O; H2 SO4 3H2 O etj.
acidi i ri dhe uji e lejojnë atë të përdoret si një agjent i fuqishëm transportues uji, për shembull, për tharjen e gazrave.
Zhvillimi i shumave në rastin e përhapjes së acidit klorhidrik në ujë mund të mbikëqyret në formën e briketave. Të kujtohesh ju nuk mund të shtoni ujë në acid
shumë, e ndjekur nga një përzierje e pandërprerë e tretësirës, derdhni acidin në ujë.
Autoritetet e gëzuara acid citrik. Sulfati
Sulfati. Acid sirkani i holluar gjithçka është karakteristike për acidet e fuqisë: shkëmbimi me metalet, të cilat qëndrojnë midis mesit të aktivitetit dhe ujit; s oksidet amfoterike bazë, s bazat dhe kripërat. Në përgjithësi, ka soli: e mesme - sulfat, për shembull K 2 SO 4 і acid -
hidrosulfat, për shembull KHSO4.
Shumica e sulfateve dhe hidrosulfateve deponohen mirë nga uji, shumë prej tyre janë të miratuara kristalet... Kristal Deyaki të kripërave të acidit klorhidrik dhe quhen vitriol: vitriol agrumesh CuSO4 ∙ 5H2 O, vitriol i bardhë FeSO4 ∙ 7H2 O dhe ін.
Për përkeqësimin e acidit organik dhe kripërave në nivelet e ujit, është e mundur të zhvillohen një shumëllojshmëri kripërash:
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2 + + SO4 2– = BaSO4 ↓.
Si rezultat i reagimit, do të ketë rrethime të bariumit sulfat.
Inspektimi laboratorik 6
Receta e autoriteteve kimike të acidit sirkanoik të holluar
Janë pesë epruveta që do të përdoren: metal (zink apo edhe metal në dridhjen e matësit), oksid bazë, hidroksid natriumi, karbonat natriumi, klorur natriumi. Hidhni një pikë fenolftaleinë hidroksidit të natriumit dhe jepni një pikë me pika. Hidhni 1-2 cm3 shurup të holluar në një provëz të lëkurës. (Uvaga! Reagimi me oksidin kryesor është në kundërshtim me rregullin, për të përshpejtuar mbingarkimin me gjysmën e alkoolit.)
Cfare po ben? Cilat janë shenjat për të sinjalizuar për tejkalimin e reaksioneve kimike? Magazinoni reaksionet kimike në pamjen molekulare dhe jonike. Po reaksionet oksidativo-vidnovnoy që keni kryer? Për të bërë një shënim për fuqinë kimike të acidit sirkanoik të holluar.
Acidi sirkan i koncentruar• agjent i fortë oksidues, jo i holluar. Me bashkëveprimin e acidit sirkanoik të koncentruar
nuk shihet asnjë metal.
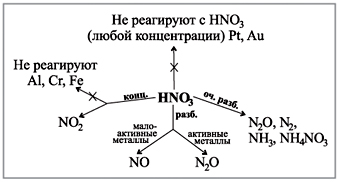
Z metalet, të cilat qëndrojnë pranë aktivitetit të ujit (përveç arit dhe platinit), reagimi kundër oksidit të aprovuar të serky (IV) SO 2 :
Cu + 2H2 SO4 (konc) = t CuSO4 + SO2 + 2H2 O.
Në reaksionin me metalet, të cilat janë në intervalin e aktivitetit deri në ujë, përqendrimi i acidit mund të përqendrohet në oksidin e ujit (IV) SO2, uji S ose uji H2S është një formë mbizotëruese e aktivitetit të metali dhe rrjedha e reaksionit. Për shembull:
4Zn + 5H2 SO4 (fin) = t 4ZnSO4 + H2 S + 4H2 O.
Nagadaєmo, scho zalizo, alumini dhe deyakі іnshi hodhën që mendjet e liga të kullosin me acid sirchan të përqendruar.
Acidi i përqendruar syrchana është i mirë për ndërveprim me fjalë të thjeshta me jometale, për shembull, me syrkoy:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Palosja oksiduese e bagatos spoluks organike, acid sirchan obgorta papir, pëlhurë, dru, odyag që shkiru. Kjo ndodh me acidin e koncentruar të sirkanit të trebës.
Acidi i koncentruar sirkhan është i dobishëm për heqjen e acideve dhe kripërave të paqëndrueshme. Për shembull:
NaCl (TV) + H2 SO4 (konc) = t NaНSO4 + HCl.
Në Republikën e Bilorus sirchan, acidi qarkullon nga TVSH "Gomel Khimichny Plant", TVSH "Grodno Azot".
Zonat e acidit të pijshëm
The Smell i prezantohet pak 63.
I vogël. 63. Stagnimi i acidit citrik
Acidi Сірчана H2 SO4 - është i rëndësishëm, pa ridin vajor pa erë.
Acidi syrkan hollohet së bashku me metalet, të cilat qëndrojnë midis aktivitetit dhe ujit; s oksidet e metaleve; Bazat; nga kripërat.
Kur bashkëveproni me acidin dhe metalet e përqendruar, uji nuk mund të shihet.
Për përkeqësimin e acidit organik dhe kripërave në nivelet e ujit, është e keqe të formulohen kripërat e bariumit.
Furnizimi dhe furnizimi me energji elektrike
1. Shkruani formulat për oksidet dhe acidet acide të squfurit. Tregojuni atyre shkallën e oksidimit të atomeve të ujit.
2. Kërkoni masën e sirkut, e cila digjet në thartë, pasi në një mal shihni 29,69 kJ nxehtësi. A ishte një sasi e vogël e oksidit të sirkës (VI) që e morët? Efekti termik i reaksionit të shuarjes së zjarrit bëhet 296.9 kJ / mol.
3. Tabela gërryese e kripës, acideve dhe bazave në ujë, shtoni 2 reaksione të barabarta të acidit klorhidrik të holluar dhe kripërave. Shkruani emrin
v viglyada molekulare dhe jonike.
4. Mbroni masën me atë sasi kimike të shufrës sulfate, e cila krijohet kur hollohet me acid klorhidrik për tretësirën e nitrateve, me një bar prej 200 g, fraksioni masiv i Ba (NO 3) 2 për çdo rrugë 10%.
5. Ju lutemi referojuni tekstit të paragrafit në bazë të reaksionit, i cili karakterizon fuqinë kimike të acidit klorhidrik të përqendruar. Filloni fazat e oksidimit të atomeve të ujit në vend. Në reagimin e lëkurës, është një agjent oksidues.
6. Vëllimi i fortë i acidit klorhidrik të përqendruar (= 1,83 g / cm 3) me një pjesë masive të H2 SO4 98%, tretësira e nevojshme për një masë prej 6,4 r?
7. Rritja e efikasitetit të skemave për fillimin e reaksioneve kryesore oksidative:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2 S + HClO → K2SO4 + HCl.
Në reagimin e lëkurës, është një agjent oksidues.
§ 40. Të kuptuarit e mënyrës sesi produkti ka një reaksion kimik
Kimia, e ruajtur në përputhje me ligjin e ruajtjes së masës së të folurit, lejon kryerjen e produktit të reaksionit razrahunki, zokryuvat massu, obsyag chihichnuyu. Në praktikë, shumë reagime janë të kundërta, një pjesë e të folurit përfshihet në rezultatet e avullimit, zgjidhjes ose miratimit të nënprodukteve. Ky produkt reagimi duhet të pohohet të jetë më i vogël, ka pak për të parë përpara zhvillimit të një reagimi të barabartë. Në një renditje të tillë, nëse teorikisht pranojmë peshën e produktit për reaksion të barabartë, ose nëse sasia kimike e produktit është 100%, atëherë në procesin real të kalimit te produkti do të jetë më pak se 100%.
Fillimi i reagimit ndaj produktit të reaksionit është shkronja e alfabetit grek (tsya) dhe shfaqet në pjesët e të njëjtit.
Lloji i produktit të një reaksioni kimik është një vlerë që është e shtrenjtë për një produkt (vëllim, sasi kimike) të një produkti që në të vërtetë është shkëputur nga një produkt (për një produkt, një sasi kimike), e llogaritur për reaksionin
Në të gjitha rastet, do të dihet se më e rëndësishmja për produktin e reaksionit kimik. Për shembull, kur vidomo, për reaksionin e oksidit të oksiduar të serky (IV) ndaj oksidit të serkës (VI)
2SO2 + O2 2SO3
vikhid të bëhet 80% (ose 0,8), që do të thotë, rreth oksidit të grisë (IV) me peshë 64 g (vëllimi 22,4 dm3, sasia kimike 1 mol) dhe oksidi i pranueshëm i grisë (VI) me një pesha jo 80 g (vëllimi 22,4 dm3, sasia kimike 1 mol), dhe masa 80 g ∙ 0,8 = 64 g (vëllimi 17,9 dm3, sasia kimike
Nga vlera e mallrave në procesin e botës reale, ekziston nevoja për të futur operacione dhe operacione shtesë.
Është e lehtë të shihet fotografia e lidhjes së rruzares nga koncepti i "kalimit në produktin e reagimit".
stok 1. Si rezultat i kriposjes së pijeve gri me masë 48 g, hiqet oksidi i squfurit (IV) me vëllim 28,6 dm3. Shikoni produktin e reagimit.
m (S) = 48 g | 1. Vizualisht një numër i vogël farash, |
||||
V praktike (SO2) = 28,6 dm3 | hyri në reagim: | ||||
Znj) | |||||
(SO2) =? | n (S) | ||||
ZNJ) | 32 g / mol |
||||
2. Reaksioni në magazinë i oksidit të serkës (IV): S + O2 = SO2.
3. Ne e dimë sasinë teorike të oksidit serky (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Kuptimi i hyrjes në produktin e një reaksioni kimik |
4. Ne e dimë analizën teorike të oksidit serky (IV):
V teori (SO2) = n teori (SO2) V m = 1,5 mol 22,4 mol / dm3 = 33,6 dm3.
5. Rozrakhumo vikhid ndaj produktit të reagimit:
Përgjigje: Përgjigja ndaj ilaçit është 85%.
Shtojca 2. Përcaktoni masën e FeS2, e cila kërkohet për heqjen e oksidit serky (IV) me vëllim 8,96 dm3, në mënyrë që produkti i reaksionit të bëhet 90%.
V (SO2) = 8,96 dm3 | 1. Shkëmbimi teorik vizualisht i rëndësishëm i oksidit serky (IV): |
|||||||||||
(SO2) = 90% | V praktikë | V praktikë | ||||||||||
m (FeS2) =? | Yjet V teori = | |||||||||||
teoria V | ||||||||||||
Vtheor (SO2) = | Praktika V (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Ne e dimë sasinë teorike kimike të oksidit gri (IV): |
||||||||||||
teoria n (SO 2) | Teoria V (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3 / mol |
||||||||||||
3. Reagimi i magazinës ndaj oksidit të sirkës (IV) dhe sasisë kimike të piritit që duhet t'i jepet vipalit:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Për shkak të peshës së piritit, i cili është i nevojshëm për vipalin: m (FeS2) = 0,2 mol · 120 g / mol = 24 g.
Sugjerim: për respektimin e oksidit të sirkës (IV), është e nevojshme të merret një masë prej 24 g.

Lloji i produktit të një reaksioni kimik është një vlerë që është e shtrenjtë për një produkt (osuare, sasi kimike) të një produkti të prerë në të vërtetë në një produkt (kullim, një produkt kimik) i llogaritur për një reaksion. Kthehuni në pjesë të odinitsi chi vidsotkah.
Furnizimi dhe furnizimi me energji elektrike
1. Pse një përgjigje praktike ndaj një produkti reagimi duhet të quhet më pak, teorikisht mbulim sigurimi më i ulët për një përgjigje të barabartë?
2. Me reaksionin e ujit me një kimi uji, 1 mol, uji vendoset në një sasi kimike prej 0,85 mol. Shikoni produktin e reagimit.
3. Si rezultat i bashkëveprimit të klorurit me një peshë prej 200 g nga një acid klorhidrik, precipitimi i sulfatit me një peshë prej 100 g.
4. Kërkoni një vëllim (n.u.) dhe një sasi kimike të oksidit gri (IV), e cila krijohet me një farë të djegur prej 64 g, pasi produkti i reaksionit është 75%.
5. Llogaritni masën e ujit të djegur, nëse sasia e oksidit gri (IV) shkurtohet me vëllim (n.u.) 89,6 dm 3 duhet të bëhet 80% e teorikisht të mundshme.
6. Me sa duket, oksidi vikhid i serky (VI), i prerë gjatë oksidit të oksiduar të serky (IV),
rruga 85%. Me anë të masës, vëllimit (n.o.) dhe sasisë kimike të oksidit serki (IV), që ka hyrë në reaksion, kur oksidi i serkut (VI) hiqet me një vëllim (n.u.) 2,24 dm3.
7. Fillimisht, filloni fraksionin masiv të kripës në roskini, i prerë kur distilohet nga masa 3,2 g, në acidet shurupi në masën 192 g, nëse rezultati i produktit të reaksionit bëhet 85%.
§ 41. Azoti dhe fosfori
Azoti N dhe fosfori P kalbet në sistemin periodik të grupit VA. Në të gjithë grupin e sistemeve periodike, janë futur Mis'yak As, surma Sb dhe bismut Bi. Azoti dhe fosfori є me jometalet, sjellin mish'jakun dhe surmën te metalet, dhe smutin te metalet.
Budova atomіv atë fazë të oksidimit
Elementet atomike të grupit VA kanë nga 5 elektrone secili për nivelin më të rëndësishëm të energjisë;
7 N ↓ | 15P ↓ |
Zavdannya.
- Chim viklikana është një ndryshim i tillë? Me çfarë fuqie duhet të futet dikromati në shumën e kromit për pjatën?
- Hidhni 5-6 pika dikromat kalciumi në një provëz dhe 3 pika acid klorhidrik. Shtoni 2 pika jodur në kaliyu dhe shtoni 10 pika ujë në vend të provëzave. Transferoni një pjesë të vogël me një stilolaps në epruvetën në vend që të shtoni një pikë niseshte. Chi zm_nilosya zabarvlennya niseshte? Per cfare? Rivnyannya OVR dhe metoda elektronike vzvnyannya.
- Karakteristika fillestare e elementit 15 R. Fuqia e modifikimeve alotropike ndaj fosforit. Shkëmbimi i fosforit me fjalë të thjeshta dhe të palosshme.
Farmacia ka oksid merkuri (II) që ngec si një antiseptik më i ulët për gatim pomadat, si të fitoni shumë hidroksid natriumi të holluar në bazë të kripërave të merkurit.
Zavdannya.
1. Shkruani një reagim specifik ndaj oksidit të merkurit (II). Shpjegoni pse është e nevojshme të kryhen operacione në temryava?
3. Ligjet bazë të kimisë.
Zinku Vikoristannya spoluk në mjekësi bazohet në këtë dizajn tart, antiseptik. 0,25% razchin sulfate zink vykorytutsya për përgatitjen e pikave të syrit menjëherë me acid borik 2%.
Zavdannya.
- Përgatitni një zgjidhje 0,25% ndaj sulfatit të zinkut me një vëllim prej 100 ml (ρ = 1,02 g / ml).
- Zd_ysniti rishikim
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- Lidhje kovalente, viznennya, shih, mekanizmi i ndriçimit, fuqia. Valence. Skena oksidohet.
· Farmacist për të kontrolluar cilësinë e barit zaliza me metodën e permanganatometrisë.
Zavdannya.
1. Për të shkruar një përgjigje të barabartë dhe edukim duke përdorur një metodë elektronike.
2. Llogaritni, çfarë vëllimi prej 0,5% - të (ρ = 1,004 g/ml) madhësisë së hidroksidit të natriumit nevojitet për reaksionin me tretësirë 0,1 M të klorurit (III) vëllim prej 20 ml.
3. Ligji periodik që sistemi periodik në dritën e ditës për Budovën e atomit.
· Zalizo, i rinovuar, i cili ngec nga brenda në krahasim me të, por mund të shihet nga shtëpitë me sulfide të medi, vugilla, acid silicik, mis'yaku.
Zavdannya.
1. Propozoni mënyrën për të hequr qafe shtëpinë. Obruntuvati vidpovid.
3. Lloji kryesor i tingullit kimik. Natyra lëshon një tingull gazmor.
· Për organizmin e permanganatit є me kokrra, їkh zeshkozhennya për të kryer 3% zgjidhje uji të H 2 Pro 2 me acid acid.
Zavdannya.
1. Shkruani një reagim të përbashkët. Niveli i përgjigjes me metodën elektronike
- Oxydi, viznachennya, klasifikimi, nomenklatura, fuqia dhe metodat e obsesionit.
· Numri i fjalëve në preparat kryhet me metodën e permanganatometrisë, ne do të përdorim Fe2 + për të oksiduar në Fe3 +. Një përzgjedhje e kripërave të rinovueshme përdoret për të nxjerrë sasinë e permanganatit të natriumit gjatë ngrohjes dhe kur ftohet.
Zavdannya.
1. Të shkruajnë reaksionet standarde, të cilat janë në bazë të përkufizimit bazë.
2. Përgatitni 200 ml KMnO 4 0,1 n (faktori i ekuivalencës në vlerë për preparatin).
3. Acidet, viznachennya, klasifikimi, nomenklatura, fuqia, mënyrat e obsesionit.
· Përgatitja farmakopeale e nitratit të mediumit duhet të shpërndahet me rang sulmues: tretja e aliazhit mineral-mesatar nga hollimi i acidit nitrik, për të pastruar largimin e nitrateve nga shtëpitë, precipitohet me acid klorhidrik. Rrethimi, si rrjedhim, futet me zink në mjedisin acid, dhe në mes, jo nga shtëpitë, përsëri në acid nitrik.
Zavdannya.
- Shkruani një rresht reagimesh të zakonshme.
- Identifikimi i reaksioneve pozitive ndaj anionit Cl-, Br-, J me bazë të nitratit të mesëm, i cili është bazë për vërtetimin e vlefshmërisë së preparateve në kloride, jodide, bromide në kalori.
- Prezantimi, viznachennya, klasifikimi, nomenklatura, fuqia, mënyrat e obsesionit.
9. Nitrati i mediumit stagnon ne rast erozionesh, kthesash, gjendje konjuktiviti ne viglyadas 2.5 dhe 10% tretësirat ujore.
Zavdannya.
- Përgatitni madhësi 2% AgNO 3 sipas vëllimit 50 ml (ρ = 1,015 g / ml). Sa mendje i është kushtuar ndryshimit?
- Zd_ysniti rishikim
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli, viznachennya, klasifikimi, nomenklatura, fuqia, mënyrat e obsesionit.
· Farmacisti duhet të kryejë identifikimin e preparatit farmakopeial me bar sulfate.
Zavdannya.
1. Si mund ta përdor sulfat vicorist në mjekësi? Pse sulfati barii duhet të lidhet me karbonat natriumi përpara kryerjes së reaksioneve të identifikimit? Dëshmi për konfirmimin e reagimeve të ngjashme.
2. Vikonimi i reaksioneve të identifikimit të kripërave BaSO4, CaSO4, Na2SO4.
3. Spoluks komplekse, viznachennya, budova për A. Werner, natyra e tingullit kimik, klasifikimi, nomenklatura, disociimi. Stagnimi i zgjidhjeve komplekse në analizat mjekësore dhe kimike.
· Një farmacist me një zgjidhje të koncentruar të një amiaku, duke lejuar një shkatërrim të madh të teknologjisë së sigurisë - duke i drejtuar robotët në kokën e kalorësit pa tërheqje të shtuar.
Zavdannya.
- Çfarë trashëgimie mund të bëni kur punoni me një gamë të përqendruar amiaku pa prekur teknologjinë e sigurisë? Ndihma mjekësore Yak pershu është e nevojshme për të paguar kur amiaku hiqet në çifte.
- Zdіsniti kështu rizhvillimi.
(NH 4) 3 PO 4 → NH 3 → NH 4 JO 2 → N 2 → JO → JO 2 → HNO 3 → Hg (NO 3) 2 → JO 2
Për të shkruar reaksionet e sakta për pamjen molekulare dhe jonike, dhe për OVR - nivelin e metodës së bilancit elektronik.
- Kinetika e kimisë. Shpejtësia e reaksioneve kimike. Infuzion i faktorëve fleksibël në shpejtësinë e reaksioneve kimike.
· Azoti në ilaç është i ndenjur në sasinë e amoniakut në ujë, kripërat e amonit, oksidit nitrik dhe nitritit të natriumit.
Zavdannya.
- Çfarë do të bëj me haraçin ndaj azotit? Shkruani formulat e fjalimeve të dhëna dhe reagimet e barabarta, që karakterizojnë fuqinë kryesore.
- Shkruani një reagim rіvnyannya midis nitratit të natriumit dhe permanganatit të kalciumit në mes të thartë. Të njohë reaksionin me metodën e reaksionit
- I panegociueshëm dhe ujqër reaksionet kimike... Khimichna Rivnovaga. Ligji Mac për sisteme po aq të rëndësishme. Rivnovagi konstante. Parimi i Le Chatel.
· Farmacisti duhet të kryejë identifikimin e kripërave me sulfat natriumi, klorur natriumi, hidrokarbonat natriumi.
Zavdannya.
- Reaksionet Viconatie ndaj jonit SO 4 2-, Cl-, HCO 3-.
- Rosrahuvati, sasia e gramëve në kristalhidratin Na 2 SO 4 · 10H 2 O është e nevojshme që farmacisti të heqë sasinë e ujit në sasinë 500 g, të heqë 5% të sasisë së Na 2 SO 4?
- Reaksionet që çojnë në oksidim. Dispozitat kryesore të teorisë elektronike të reaksioneve oksidativo-vitale. Nayvazhivіshі oksiduese dhe figura kryesore. Reaksionet Zrivnyannya oksid-vidnovnykh me metodën e bilancit elektronik dhe me metodën jon-elektronike.
Acidi Kaliєva sіl sіrchanoіy dhe veshja e shumë preparateve të huaja për trupin (ksenobiotikë) - droga lіkuvalny Ky metabolizëm bazohet në thëniet e disa të folurit jo të zgjuar - konjugatave, pasi është e lehtë të transferohet në trup.
Zavdannya.
- Otrimatyvu sіl sіl acid sіlchanoic në një mënyrë normale, vikoryuchi në tryezën e reagentit. Shkruani një rresht reagimesh të zakonshme.
- Gama e reaksioneve molekulare, të cilat rrotullohen me shpejtësi kaq të shpejtë:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Sistemet e shpërndarjes, emërtimi, klasifikimi. Pezullime, aerosole, emulsione. Vikoristannya sisteme të shpërndara trashë në mjekësi dhe farmaci.
Një farmacist duhet të heqë një zgjidhje 5% të acidit sirkanoik.
Zavdannya.
- Cila është shëndeti oksidativ i anionit SO 4 2 në përqendrimin e acidit? Shkruani reaksionet e sakta për të karakterizuar fuqinë e acidit të holluar dhe të koncentruar.
- Përgatitni 5% të forcave të acidit sirkanoik, mayuchi 50 ml acid sirkanoik dhe një fraksion masiv të H 2 SO 4 30%.
- Dallimet kolosale, klasifikimi, emërtimi, molekularo-kinetike atë fuqi optike, refuzim. Stabiliteti i dallimeve kolosale. Koagulimi. Peptizimi. Budova micel. Dializ.
· Sірка, scho për të hyrë në magazinë e aminoacideve, për të oksiduar në organizëm. Me një acid të tërë endogjen sirchan kujdeset për fatin e spoluchit të huaj të krundeve - fenol, kresol, indol.
Zavdannya.
- Përshkruani fuqinë e acidit acid dhe anuloni rregullat e robotikës me acide.
- Rosrahuvati, i cili është një vëllim i acidit sirkanoik me një fraksion masiv H 2 SO 4 25% dhe i trashë 1,18 g / ml, është e nevojshme të merret për neutralizimin e hidroksidit të kalciumit, vëllimi 50 ml, me një fraksion masiv KOH 12%. dhe i trashë 1.1 g/ml.
- E vërteta e vendimit, vlera, kuptimi kryesor, dita e procesit të vendimit. Difuzioni. Osmoza. Vizë osmotike.
· Në rrethet industriale, ku ka shumë ujë, nuk është e lehtë të merren pllaka acidi.
Zavdannya.
- Shho është pranë magazinë e kimisë dërrasat e acidit në zonat qikh? Yak vin për të pretenduar? Shkruani një reagim të thjeshtë.
- Nivelet molekulare dhe të shpejta të hidrolizës së kripërave të hershme:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Sirvododen për të hyrë në natyrë numër i madh i gjërave për zhvillimin e proceseve biologjike dhe zhvillohen në ujërat prominerale.
Zavdannya.
- Fuqia e pushtetit.
- Rishikimi i Zd_ysniti:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Shkruani një reagim të thjeshtë ndaj shikuesit molekular dhe jonik.
- Shpërbërja e acideve, bazave, kripërave, ujit. Rivnovaga acid-bazë në razchiny. Ionny dobutok vodi, pH-zgjidhje.
· Një ilaç zyrtar i sirki є sirka, i veshur me (Sulfur praecipitafum).
Zavdannya.
- Përshkruani fuqinë e verës dhe modifikimet alotropike të vajit.
- Rishikimi i Zd_ysniti:
Reagimet Zr_vnyati me metodën e bilancit elektronik.
- Hydroliz. Ndjeshmëria ndaj procesit të hidrolizës. Hidroliza e llojeve të ndryshme të kripërave. Hapi drejt hidrolizës. Infuzion i faktorëve të rinj në fazat e hidrolizës.
Një farmacist do të kryejë një reaksion identifikimi të tretësirës 3% të peroksidit të peroksidit: deri në 1 ml acid klorhidrik të holluar, 1 ml acid klorhidrik të holluar, 1 ml eter dhe 0,5 ml tretësirë të dikromatit të kalciumit, si rezultat i Përqendrimi i acidit klorhidrik 6
Zavdannya.
- Reagimi Viconati i identifikimit të peroksidit të ujit.
- Për të shkruar një standard për identifikimin e ndryshimit midis peroksidit të ujit dhe shëndetit duke përdorur metodën e bilancit elektronik.
- Karakteristikat e përgjithshme të elementeve të pidgrupit kokë të grupit VII dhe të spoluk. mjeko- kuptimplotë biologjikisht halogjen
· Kisen є një produkt farmaceutik që përshkruhet nga GF. Yogo zasosovyut për thithje për lloje të ndryshme të urisë së thartë.
20. Zavdannya.
- Shkruani reaksionet e sakta për zbulimin e CO, 2, NO, NO2.
- Për të shkruar reaksionet r_vnyannya, të cilat janë në bazë të metodës laboratorike të refuzimit të thartirës. Nivelet e induksionit të reaksioneve me metodën e bilancit elektronik
- Klor, ujë me klor, acid klorhidrik, klorur. Fuqia fizike dhe kimike e klorit dhe gjysma tjetër. Rëndësia mjekësore dhe biologjike e halogjeneve.
· Rishikimi i barnave nga farmacisti i bazuar në klorur natriumi, brom natriumi dhe jodur natriumi.
Zavdannya.
- Për çdo qëllim, është e mundur të përdoret kripë në farmaci dhe mjekësi.
- Reagimet Vykonati yakіsnі mbi anioni Cl-, Br-, J-.
- Fuqia fizike dhe kimike e klorit acid. Otrimannya. Zasosuvannya.
· Një nga metodat industriale të heqjes së jodit për farmaceutikë është procesi i shikimit të jodit nga ujërat e shpimit. Yodidi, pranë ujërave të shpimit, oksidohet sipas skemës:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Zavdannya.
- Preparatet e jodit jak dhe si të ngeceni në mjekësi.
- Për të mësuar reagimin, për të hedhur bazat për obsesionin me jodin me metodën e napivreaktsii.
- Karakteristikë Zagalny e kalkogjeneve. Fuqia është e thartë se yogo spoluk. Kuptimi mjekësor dhe biologjik
· Farmacist viznacha droga referencë në klorur natriumi, kalcium dhe kalcium.
Zavdannya.
- Për çdo qëllim, preparate vikorist dhe farmaceutike.
- Vikonati i reaksioneve të identifikimit të kripërave të dhëna.
- I thar spolukin me uje. Autoritetet fizike dhe kimike të ujit. Uji peroksid, fuqia, ruajtja në mjekësi. Kuptimi i ujit në jetën e organizmave.
· Halogjenet Zi spoluk me hipoklorit të likenit të thartë bëhen interes për mjekësinë pasi dezinfektohen.
Zavdannya.
- A bazohet në fuqinë e hipokloriteve? Shkruani një rresht reagimesh të zakonshme.
- Rosrahuvati, duhet të merren disa gramë klor vapna për të hequr 2 litra klor aktiv.
- Sirka dhe її spoluki. Alotropia e një sirka vilnoy. Fuqia fizike dhe kimike e ujit, ujit, ujit, acidit dhe kripërave.
· Në rast të mungesës së aciditetit të lëngut të lëngut, është e nevojshme të përdoret acid klorhidrik i holluar brenda.
Zavdannya.
- Rilexoni rregullat themelore të robotit me acide.
- Rosrahuvati, në një shishe me tretësirë 36,5% (ρ = 1,19 g / ml) të acidit klorhidrik, dhe është e nevojshme të merren 100 ml për ta përgatitur atë. 8,2% (ρ = 1,040 g / ml) acid.
- Fuqitë fizike dhe kimike të oksideve të ujit, acidit të virgjër dhe acidit organik. Sulfitet. Sulfati. Pushteti, posedimi, posedimi.
· Farmacia ka një nga solucionet standarde є solucione, ku mund të hiqet 33% acetat kalciumi, i cili mund të shpërndahet me një tretësirë prej 30% karbonat kalciumi - me bazë acidin organik.
Zavdannya.
1. Shkruani një reagim të barabartë me shikuesin molekular dhe atë jonik.
- Karakteristikat kryesore të elementeve të grupit të kokës së grupit V. Fuqia e azotit. Vlera e azotit në jetën e organizmave.
· Përshkrimi i dallimeve të të folurit, i cili është një bazë e fortë dhe acid i dobët. Për porosinë e stabilizatorit jak GFH, 0.1 n tretësirë e klorurit të natriumit furnizohet me një madhësi prej 4 ml për 1 litër tretësirë.
Zavdannya.
- Shkruani një shembull të reaksionit ndaj hidrolizës së kripës CH3COONa.
- Rosrahuvati, disa gram NaOH duhet të respektohen, të shkurtohen me 500 ml të madhësisë 0.1n. Përgatitni një gamë të gjerë zgjidhjesh për teknologjinë e sigurisë.
- Amiak. Amoniak i kripës. Fuqia. Stagnacion në mjekësi dhe farmaci.
· Një farmacist përgatiti një recetë për një pomadë: 1 g karbonat kalciumi dhe 0,5 g tetraborat natriumi në 70 ml ujë të distiluar, 10 g fusion stearin me 15 g vazelinë olia dhe një rrjedhë e hollë duke e trazuar trëndafilin në karbonat të ngrohtë. me ujë. ...
Zavdannya.
- Sa fjalë keni adoptuar në të kaluarën? Jake njeriun e mesëm të pretendojë për çfarë? Dëshmi për konfirmimin e reagimeve të ngjashme.
- Përgatitni vagi tekniko-kimike për robotët. Respektoni 1 g kalori karbonat në teresat tekno-kimike.
- Oksidi në azot. Acidi azoti dhe kripërat. Autoritetet fizike dhe kimike. Vlera mjekësore dhe biologjike me azotin
Një farmacist duhet të përgatisë permanganat 0.05% në vëllim 200 ml për shpëlarjen e gojës dhe fytit bosh.
Zavdannya.
- Në çfarë fuqie për të permanganat cali runtuet yogo veprim politik? Mangani Yaki spoluksyu stagnon brenda për qëllime të pijes?
- Sasia e KMnO 4 gram duhet të përdoret për të hequr 200 ml 0,05% KMnO 4 (ρ = 0,9994 g / ml.). Demonstroni teknikën e marrjes së diapazonit të dhënë.
- Molekulat e acidit nitrik Budova. Fuqia fizike dhe kimike e acidit nitrik dhe kripërave. Mediko - vlera biologjike e azotit dhe spoluk.
Farmaceutikë ka oksid merkuri (II), i cili është i egër si një antiseptik, dhe shpërndan hidroksid natriumi në formën e kripërave të holluara të merkurit (II).
Zavdannya.
1. Shkruani një reagim specifik ndaj oksidit të merkurit (II). Cilat reagime duhet të kryhen në temryava?
3. Ligjet bazë të kimisë.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Acidi nadkromik, i cili mund të gjendet në të njëjtën kohë, H 2 CrO 6 është një nga ngjyrat blu. Sinergjia e rimbushjes së acidit dhe mbështetja për përgatitjen Н2О2.
Zavdannya.
- Reagimi Zrіvnyati tsyu me metodë elektronike.
- Çfarë lloj kromi mund të shkaktojë fuqi oksiduese dhe çfarë ndodh me të?
- Fuqia e fosforit, oksideve të fosforit dhe acideve fosforike dhe zotërimi i tyre. Vlera mjekësore dhe biologjike e fosforit
· Përmbledhja e oksidit të magnezit (85%) dhe peroksidit të magnezit (15%) - një ilaç i quajtur "peroksid magnezi", i cili përdoret për të ngecur në rast të zhvendosjes së zorrëve.
Zavdannya.
- Shpjegoni ilaçin antiacid dhe baktericid. Dëshmi për konfirmimin e reagimeve të ngjashme.
- Rosrahuvati, disa gramë MgO dhe MgO 2 duhet të merrni për të përgatitur 100 g të këtij preparati. Respektoni 10 g oksid magnezi në terezat tekno-kimike.
- Karakteristikat e përgjithshme të elementeve të grupit IV të grupit të kokës. Budova, Fuqia fizike alotrop në karbon. Fuqia gazmore e një personi të fortë në qymyr.
· Shpëlajeni hidrokarbonatin e natriumit (sodën pitnoy) për të qëndruar në shpëlarje viglyadi, lani me sy të zjarrtë, guaska mukoze të fisnikëve të sipërm dichny.
Zavdannya.
- A është antiseptik për fuqinë e hidrokarbonatit të natriumit? Dëshmi për konfirmimin e reagimeve të ngjashme. Çfarë mund të përdoret si një antiseptik me tetraborat natriumi Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Përgatitni tretësirë 5% të NaHCO 3 në vëllim 50 ml (= 1,036 g / ml).
- Budova e molekulave, fuqia fizike dhe kimike e spoluk acid në qymyr. Mediko - kuptim biologjik në qymyrin që spoluk.
Në preparatet antacid, të cilat hakmerren ndaj hidrokarbonatit të natriumit, vicoristov në rast të sëmundjes së hershme, e cila mbikëqyret nga aciditeti, tobto. acidoza.
Zavdannya.
- Në çfarë fuqie të çmimit të kripës duhet të përdorim barna antacid? Dëshmi për konfirmimin e reagimeve të ngjashme. Çfarë lloj fjalimi mund të blini për qëllimet tuaja?
- Rishikimi i Zd_ysniti:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Shkruani një reagim të thjeshtë ndaj shikuesit molekular dhe jonik.
Reaksioni i Vikonatit Na 2 CO 3 → NaCl → NaNO 3.
- Silic që yogo spoluky, i njohur me natyrën, refuzimin, fuqinë fizike dhe kimike. Mediko - me kuptim biologjik silikon.
· Tretësirë 2,5% NaCl përdoret brenda për larjen e slurit kur hiqet AgNO 3.
Zavdannya.
1. Pse duhet të përdor solucionin NaCl? Dëshmi për konfirmimin e reagimeve të ngjashme.
3. Karakteristikat e përgjithshme të elementeve të grupit kryesues të grupit të tretë. Fuqia është e mërzitshme se yogo spoluk. Rëndësia mjekësore dhe biologjike në mjekësi.
· Për mbarështimin e formave të rralla lykarsky, shenja për ін'єкцій, ін'кцій, vikoristovyut іzotonіchny rozchin.
Zavdannya.
1. Cili është edhe ndryshimi izotonik? Pse quhet izotonik?
3. Aluminіnіy se yogo spoluky, pushtet, refuzim. Rëndësia mjekësore dhe biologjike e aluminit.
· 3% zgjidhje uji ndaj ujit peroksid zasosovyat jak zovn_shn_y zasib baktericid.
Zavdannya.
1. Mbi çfarë baze bazohet baktericid dhe gjak-spinal për peroksidin e ujit. Për çfarë lloj vizitash të huaja duhet të kujdeseni kur jeni duke udhëtuar?
2. Rosrahuvati, jr. Pergidrol (tretësirë ujore 30% e Н 2 Pro 2, ρ = 1,1 g / ml) duhet të merret për të hequr 500 ml tretësirë 3% (ρ = 1,005 g / ml). Përgatitni një gamë të gjerë zgjidhjesh për të përmbushur teknologjinë e sigurisë.
3. Metalet e grupit të kokës së grupit ІІ. Karakteristika Zagalny, refuzimi, fuqia fizike dhe kimike. Kripë kalcium dhe magnez. Fortësia e ujit. Usunennya zhorstkosti vodi. Rëndësia mjekësore dhe biologjike e elementeve të grupit të kokës II.
· Industria farmaceutike aktuale e prodhimit të barnave nga mulliri i agregatit, lloji i sistemeve të shpërndara, mënyra e futjes në organizëm.
Zavdannya.
1. Cilat sisteme quhen të shpërndara?
Si të klasifikohen sistemet e shpërndara?
A përmbajnë drogë sistemet e shpërndara viglyadi? Sillni vithe specifike.
- Hidrosol i qenit Otrimati duke përdorur metodën e zëvendësimit të razchinnik.
- Karakteristikat e rëndësishme të metaleve të huaja, posedimi, fuqia fizike dhe kimike. Naivazhlivіshі poluchny metalіv. Vlera mjekësore dhe biologjike e metalit
Në fjalimet e ujit viglyadі razchinіv іznіh, fillojnë të bëhen të ndenjur rіdki lykarski formi, scho unë mund të ndryshoj përsëri ndryshimin.
Zavdannya.
- Spravzhn_ razchini, razchinn_st, nxitje, mosshkatërrim, mbipopullim i razchini. Çfarë burokratësh kanë?
- Përgatitni 5% razine CuSO 4 sipas vëllimit 100 ml (ρ = 1,051 g / ml) me vitriol agrume CuSO 4 ∙ 5H 2 O
- Karakteristika fillestare është d - elementet. Pidgroup metalik І grup dhe їkh spoluk. Rëndësia mjekësore dhe biologjike.
· Rusia ka një përpunim elektrik të lëngjeve dhe siruvinës së freskët të gjelbër dhe me pak lëng: manaferrat, frutat, kulturat rrënjësore të perimeve, organizmat e vegjël të perimeve, me ndihmën e shfaqjes së lëngjeve (të brendshme natyrale). Vmist i brendshëm është një ndryshim kolosal i tullave, acidet nukleike, në karbohidrate, tanine
Zavdannya.
1. Ju quhen “kolosale”? Yak erë e keqe klasifikoj? Rilexoni fuqinë e dallimeve kolosale. Cili proces qëndron në bazën e vizionit të lëngjeve nga siruvina në rritje?
2. Otrimo hidrosolin me hidroksidin e kripës (III) me metodën e hidrolizës së FeCl 3. Shkruaj një diagram të sythave.
- Metalet janë pjesërisht nga grupi i dytë, karakterizimi, fuqia fizike, fizike dhe kimike. Rëndësia mjekësore dhe biologjike.
Kur përgatitni tableta në bazë të ekstraktit të rrënjës së sanëzit, nuk rekomandohet përdorimi i karbonatit të magnezit si bazë napovnuvach, sepse është e mundur të shkaktohet neutralizimi i acidit izovalerik dhe ekstrakti valtrate deri në aciditet.
Zavdannya.
1. Shpjegoni manifestimin e fuqisë së karbonatit të magnezit. Shkruani një reagim të thjeshtë ndaj shikuesit molekular dhe jonik. Si mund të jem fitimtar për përgatitjen e tabletave me ekstrakt valeriane?
2. Rishikimi i Zd_ysniti:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
Shkruani një reagim të thjeshtë ndaj shikuesit molekular dhe jonik.
3. Karakteristikat e përgjithshme të elementeve të grupeve VI, VII të pidgrupeve dytësore. Fuqia oksiduese e kromit, manganit dhe spoluk. Rëndësia mjekësore dhe biologjike.
· Zrіdzheny në gazin e acidit karbonik vikoristovyuyut në virobniztvі farmaceutike për viluchennya fjalimin biologjikisht aktiv nga lіkarskoy roslinnoy sirovini.
Zavdannya.
- Me çfarë lloj fuqie në dioksidin e karbonit bëhet gazi për qëllime tsikh?
- Rishikimi i Zd_ysniti:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
Reagimet ndaj shkëmbimit të informacionit me shikuesin molekular dhe jonik.
- Karakteristikat e përgjithshme të elementeve të grupit VIII janë të grupit pidwise. Fuqia e shpirtit është ajo yogo spoluk. Rëndësia mjekësore dhe biologjike.
Lista e ekzaminimeve për të ushqyerit nga disiplina
Kuptimi kryesor i ligjeve të kimisë. Gëzuar ditëlindjen atom.
Ligji periodik dhe sistemi periodik D.I. Mendelejevi në dritën e atomit.
Viznachennya, shikoni, mendoni për natyrën e tingullit kimik.
Vlera, mekanizmi i ndriçimit, fuqia e lidhjes kovalente. Valence. Skena oksidohet.
Oxydis: emërtimi, klasifikimi, nomenklatura, fuqia dhe metodat e obsesionit.
Acidet: viznachennya, klasifikimi, nomenklatura, fuqia dhe metodat e posedimit.
Parashtresat: vizat, klasifikimi, nomenklatura, fuqia dhe metodat e obsesionit.
Soli: emërtimi, klasifikimi, nomenklatura, fuqia dhe metodat e obsesionit.
Spoluks komplekse: viznachennya, budova për Werner, tipi, nomenklaturë.
Shpejtësia e reaksioneve kimike. Zyrtarë, karrierës injektojnë një ndjenjë të reagimit të kimisë.
Reaksionet kimike të pakthyeshme dhe të kthyeshme. Khimichna Rivnovaga. Parimi i M. Chatel-it. Rivnovagi konstante.
Reaksionet oksidative-indikative: vlera, kuptimi bazë, oksidimi dhe rinovimi i përditshëm, oksidimi i ri dhe reaksionet e plumbit.
Sistemet e shpërndarjes: përcaktimi, klasifikimi. Sisteme të shpërndara në mënyrë të trashë: suspensione, aerosole, emulsione.
Dallimet kolosale: vlera, fuqia, obsesioni, budova micel.
Vendimet e vërteta: vlera, kuptimi bazë, i përditshëm në procesin e zgjidhjes. Difuzioni. Osmoza. Vizë osmotike.
Dispozitat kryesore të teorisë së shpërbërjes elektrike. Mekanizmi i disociimit elektrik. Hapi është konstanta e disociimit.
Shpërbërja e acideve, bazave, kripërave. Shpërbërja e ujit dhe pH-tretësirave.
Mungesa e hidrolizës. Hidroliza e llojeve të ndryshme të kripërave. Hapi drejt hidrolizës.
Karakteristikat kryesore të elementeve të grupit kryesor të grupit VII. Rëndësia mjekësore dhe biologjike e halogjeneve
Klor, ujë me klor dhe acid klorhidrik. Refuzim, fuqi. Kloridi.
Kisnevi spoluki klorin.
Karakteristikë Zagalny e kalkogjeneve. Kisen se yogo spoluki. Kuptimi mjekësor dhe biologjik
Vlastivosti spoluk ujë i thartë (ujë, peroksid uji). Zastosuvannya N 2 Pro 2 nga medi. Vlera e makinës.
Syrka. Alotropia e vilnoy sirka. Autoritetet e gëzuara të botës. Sirvoden. Acidi hidrohidrik dhe kripërat.
Fuqia fizike dhe kimike e oksideve të ujit, acideve të pastra dhe të pastra, kripërave të acideve të pastra dhe të pastra dhe të tjera.
Karakteristikat kryesore të elementeve të grupit të kokës së grupit V. Azot i së njëjtës fuqi.
Fuqia e amoniakut dhe kripërave të amoniakut. Stagnacion në mjekësi dhe farmaci.
Oksidi në azot. Acidi azoti dhe kripërat. Fuqia fizike dhe kimike, ruajtja.
Fuqia fizike dhe kimike e acidit nitrik. nitrati. Mediko - vlera biologjike e azotit dhe spoluk.
Karakteristikat e elementit 15 R. Vilny fosfor: alotropia, fuqia fizike dhe kimike, posedimi.
Fosfin. Oksidi i fosforit dhe acidi fosforik: fuqia, posedimi. Vlera mjekësore dhe biologjike e fosforit
Karakteristikat e përgjithshme të elementeve të grupit IV të grupit të kokës. Në qymyr: fuqia fizike e alotropeve në qymyr, fuqia kimike.
Kisnevy spoluky në qymyr: molekulat budova, fuqitë fizike dhe kimike. Kuptimi mediko-biologjik në qymyrin që spoluk.
Silic që spoluky: njohja e natyrës, refuzimi, fuqia fizike dhe kimike. Mediko - me kuptim biologjik silikon.
Grupi kryesor i grupit të tretë: karakteristikat kryesore të elementeve. Kufiri i këtij yogo spoluky: refuzimi, fuqia fizike dhe kimike, ruajtja në mjekësi.
Alumini dhe yogo spoluky: obsesioni, fuqia fizike dhe kimike. Rëndësia mjekësore dhe biologjike e aluminit.
Metalet e grupit të kokës së grupit II: karakterizimi, obsesioni, fuqia fizike dhe kimike. Kripë kalcium dhe magnez. Fortësia e ujit. Usunennya zhorstkosti vodi. Rëndësia mjekësore dhe biologjike e elementeve të grupit të kokës II.
U hodhën pellgje: karakterizimi, posedimi, pushteti, navazhliv spoluks. Rëndësia mjekësore dhe biologjike.
Karakterizimi i elementeve d është fillestar. Grupi i grupit I të pidwise me bit metalik. Podnannya mіdі, sіbla. Rëndësia mjekësore dhe biologjike.
Metalet e grupit të dytë: karakterizimi i Budovisë, fuqia fizike dhe kimike. Rëndësia mjekësore dhe biologjike.
Grupet dytësore të grupeve VI, VII: karakteristikat karakteristike të elementeve të grupit, fuqia e kromit, manganit dhe spolukut të tyre. Rëndësia mjekësore dhe biologjike.
Duke treguar grupin VIII: karakteristikat e përgjithshme të elementeve të grupit, fuqia e këtij grupi. Rëndësia mjekësore dhe biologjike.
Ustatkuvannya. Në tryezën e lëkurës përpara shkencëtarëve, ekziston një plan mësimi, një diagram i ndërveprimit të acidit nitrik me metalet, një grup reagentësh, një provë e materialit të mbyllur.
Oksidi në azot
Vchitel.Mendoni të shkruani formulën për oksidet e azotit. A quhen oksidet kripëformuese apo jo të kripura? Per cfare?
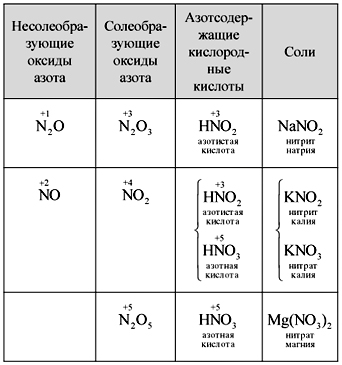
Shkencëtarët shkruajnë në mënyrë të pavarur formulat e pesë oksideve të azotit, emërtojnë ato, hamendësojnë acidet e tharta të përziera me azot dhe formulojnë formën midis oksideve dhe acideve. Një nga dijetarët do të shkruajë në dozën (tabela).
Tabela
Zëvendësimi i oksideve, acideve dhe kripërave të azotit
Demonstrimi i informacionit:
ndërveprimi i oksidit të azotit (IV) me ujin
Vchitel. Keni një anije s JO 2 Ka një valë uji dhe një valë uji, në vend të një testi vip të lakmusit.
Kush sposterіgaєmo? Rosechin chervonin përmes dy acideve, është në rregull.
2NO 2 + H 2 O = HNO 2 + HNO 3.
Hapi i oksidimit të azotit JO 2 dera +4, tobto. fitoi mіzh industrial +3 і +5, pasi në nivelin e ngurtësisë, oksidi i azotit (IV) sillet në formën e dy acideve - azotit dhe azotit.
Magazina ta budova molecules
Vchitel.Për të shkruar formulën molekulare të acidit nitrik, llogarisni peshën molekulare dhe nënkuptoni fazën e elementeve të oksiduar. Ruani formulat strukturore dhe elektronike.
Shkencëtarët të formulojnë formula të tilla (Fig. 1).
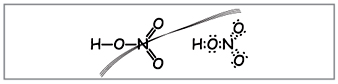
Vchitel.Sipas numrit të formulave, dhjetë elektrone mund të mbështillen rreth azotit, i cili nuk mund të jetë i kuq, sepse Azoti gjendet në periudhën tjetër dhe sa më shumë që të jetë e mundur në topin e fundit në atë më të re mund të mos ketë më shumë elektronikë. Super-frekuenca është asimiluar, sikur të lëshohet, por midis atomit të azotit dhe një prej atomeve në acid, krijohet një lidhje kovalente pas mekanizmit dhurues-pranues.(Fig. 2).
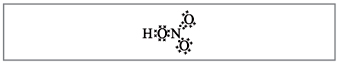
I vogël. 2. Formula elektronike e acidit nitrik.
Atomi i elektronit dhe i azotit shënohet me pika të zeza
Formula strukturore e acidit nitrik mund të nxirret si më poshtë(Fig. 3) :
I vogël. 3. Formula strukturore e acidit nitrik
(banda e indikacioneve donator-pranues me një sulmues)
Megjithatë, është sjellë nga rruga e mëparshme që nën-lidhja është e ndarë në mënyrë të barabartë midis dy atomeve të kisny. Faza e azotit të oksiduar në acidin nitrik është e shtrenjtë +5, dhe valenca (respekti i kafshëve) është e shtrenjtë, më shumë se një zgjedhje e basteve elektronike.
Fuqia fizike e acidit nitrik
Vchitel.Këtu është një shishe me acid nitrik të holluar me atë të koncentruar. Përshkruani fuqitë fizike që janë.
Shkencëtarët e përshkruajnë acidin nitrik jak ridina është i rëndësishëm për ujin, ngjyrë të përtypur, me një erë të athët. Acidi nitrik Razchin pa ngjyrë dhe pa erë.
Vchitel. Dodam, temperatura e vlimit të acidit nitrik +83 ° C, temperatura e ngrirjes –41 ° W, tobto. për mendjet e mprehta të tse ridinit. Një erë e mprehtë dhe ato që kur e heqin të shpjegojnë se acidi përqendrohet pak para se të dalë drita, ose kur nxehet shpesh shembet.
Kimia e fuqisë së acidit
Vchitel. Mendoni se çfarë lloj frazash shkëmbejnë acidet?(Emer shkencor.)
Përpara se të merrni reagjentë, profetizoni listën e reagimeve dhe shkruani paralajmërimet tuaja (reagimet e shënimit të kërkesës në dritën TED).
Dhe tani ne po ushqehemi me fuqitë specifike të acidit nitrik.
Ne jemi lëmuar, por acidi në rastin e zbergannі zhovtіє, tani kryejmë një reaksion kimik:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(Shkencërisht për të regjistruar në mënyrë të pavarur bilancin elektronik të reagimit.)
"Buri gaz"(JO 2) acid farbu.
Veçanërisht acidi reduktohet në metale. Ju e dini që ata hodhën ujin nga acidet, përndryshe ai nuk humbet gjatë ndërveprimit me acidin nitrik.
Mrekullohuni me diagramin që keni në festë, tregohet se si shihen gazrat gjatë reaksionit të acidit dhe përqendrimit me metalet.(Robot me një diagram.)
Demonstrimi i informacionit:
ndërveprimi i acidit nitrik të përqendruar me mesdi
Akoma më efektiv është demonstrimi i reaksionit të acidit nitrik (konc.) me pluhurin e mediumit, ose në mënyrë alternative, me shtimin e shigjetës me copa të vogla mjalti:
Për të regjistruar në mënyrë të pavarur bilancin elektronik të reaksionit:
Obsesioni me acidin
Vchitel. Mësimi do të jetë i pakuptueshëm, pasi ushqimi i acidit nitrik nuk është i dukshëm.
Metoda laboratorike: dija e acidit klorhidrik të koncentruar në nitrat (Fig. 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Në promislovostі acid në posedim bazë në mënyrë amike.
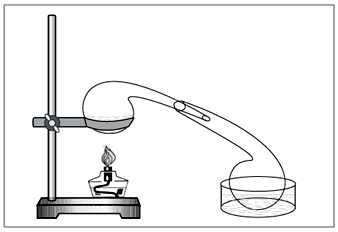
I vogël. 5. Për heqjen e acidit nitrik në laborator
enët kimike të modës së vjetër vikoristovuvati të zgjedhura me dorë - përgjigje
Metoda e mbajtjes së acidit me azot dhe acid në temperatura deri në 2000 ° C (hark elektrik) nuk është zgjeruar veçanërisht.
Në Rusi, historia e heqjes së acidit nitrik ishte e lidhur me emrat e kimisti-teknologut Ivan Ivanovich Andreev (1880-1919).
Vin në 1915 p. Pasi hapi instalimin e parë për acidifikimin me amoniak dhe realizoi metodat e shpërbërjes në shkallën e fabrikës në vitin 1917 p. Fabrika e parë e ndërtimit pranë Donetsk.
E gjithë metoda përfshin disa hapa.
1) Përgatitja e ngjarjeve edukative dhe sociale.
2) Oksidimi i amiaku kisnem povitrya në platin cittsi:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) Oksidohet më tej në oksid azoti (II) në oksid azoti (IV):
2NO + O2 = 2NO2.
4) Përcaktimi i oksidit të azotit (IV) nga uji dhe përmbajtja e acidit:
3NO2 + H2O = 2HNO3 + NO.
Është e lehtë të kryhet procesi në prani të acidit, i gjithë oksidi i azotit (IV) shndërrohet në acid nitrik.
5) Përfundimet e fazës së largimit të acidit nitrik - pastrimi i gazeve, si atmosfera, nga oksidi në azot. Magazina e gazrave cich: deri në 98% azot, 2-5% acid dhe 0,02-0,15% okside të azotit. (Azoti merret nga burimi i amoniakut, merret për oksidimin e amoniakut.) Nëse oksidet e azotit në këto gaze janë më shumë se 0.02%, atëherë kryhet posaçërisht për t'i rinovuar në mënyrë katalitike në azot, për këtë ka pak probleme të mëdha. .
Shkruar nga të gjithë agjërimet e përmendura të ushqyerjes: dhe për çfarë na duhet acidi?
Acidi thithës
Vchitel.Acidi nitrik zëvendësues për virobrytvu: azoti i mirë, dhe në radhë të parë kripa e acidit amic (si її fiksohet?); fjalimet vibukhovy (pse?); barvnikiv; nіtratіv, se si të jesh në nivel sulmues.
Materiali mbyllës
Përvoja frontale për klasën
- Pse niveli i azotit të oksiduar në acidin nitrik është +5, dhe valenca e chotirit?
- A nuk hyn acidi nitrik në reaksion me metale të shndritshme?
- Duhet të merrni pak acid klorhidrik dhe acid nitrik, ka tre metale në tryezë - mjaltë, alumin dhe zink. Çfarë do të thuash?
Test
opsioni 1
1. Cili është numri i numrave që lidhen me shpërndarjen e elektroneve për nivelet e energjisë në atomin e azotit?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Përfundoni prakticitetin e reagimeve praktike:
1) HNO 3 (rozë) + Cu ...;
2) Zn + HNO 3 (konc.) ...;
3) HNO 3 + MgCO 3 ...;
4) CuO + KNO 3….
3. Prezantoni, si rregull, një nga fazat e procesit premtimet acid nitrik.
1) 4NH 3 + 5O 2 = 4NO + 6H 2 O;
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Hapat negativë të oksidimit manifestohen nga azoti në fund:
1) N 2 O; 2) JO; 3) JO 2; 4) Na 3 N.
5. Ndërveprimi i ashklave të mjaltit me acid nitrik të koncentruar për të prodhuar derisa të miratohet:
1) JO 2; 2) JO; 3) N 2; 4) NH 3.
Opsioni 2
1. Vlera e valencës së azotit është një:
1) 1; 2) 2; 3) 5; 4) 4.
2. Shkruani ndërveprimin e mundshëm të acidit nitrik të përqendruar me metalet avancuese: natrium, alumin, zink, zalizo, krom.
3. Vibroni fjalimin, si є syruvinoy për acidin nitrik:
1) azoti dhe uji;
2) amіak, ndonjëherë ai ujë;
3) nitrat.
4. Acidi nitrik i koncentruar nuk reagon me:
1) gaz dioksid karboni;
2) acid klorhidrik;
3) në qymyr;
4) bar hidroksid.
5. Me ndërveprimin edhe të acidit të holluar dhe magnezit, duhet pretenduar:
1) JO 2; 2) JO; 3) N 2 O; 4) NH 4 JO 3.
Dëshmitë Opsioni 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Opsioni 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Trivneviy zalik spinner 11 klasë
Tema: " METALE "
Formulari i mësimit: zalik
Tsil: të rishqyrtohen njohuritë e bursave për temën: “Jonmetalet”; informacion publik për fuqitë dërrmuese jometale dhe spoluk; për të nxitur formulimin e njohurive për situatat jo standarde dhe të jetesës, nga sipërmarrjet zëvendësuese dhe të diferencuara.
Zavdannya:
1. Të rishikojë domenin publik dhe të mbyllë njohuritë e studimeve rreth jometaleve dhe їkh spoluks; merre zhvillimin nga pikëpamja e logjikës mashtruese dhe kimisë volodya; kalimi nga një pranim formal - logjik i materialit nga ata në një mesazh figurativ logjik me ndihmën e ndërtesave të avancuara, të realizueshme dhe jo standarde.
2. Razvinuvichki kursyer, zbulimin e faljeve, ringjalljen e fabrikës, vvdinya duke parë njollë, kapjen e fakteve, mjerim, është logjike për mendimet dhe robotët e këqij; vchiti rozmіrkovuvati, robiti pripuschennya, parashikimi.
3. Pranoni formulimin e ideve kryesore vizuale nëpërmjet veprimtarisë njohëse dhe pavarësisë krijuese të shkencëtarëve.
4. Vihovuvati vmіnnya pratsyuvati vetëkontroll nga vetëkontrolli. Trego lidhjet me ata që jetojnë në jetë. Vihovuvati svitoglyad shkencore në bazë të ndërlidhjes së fuqive që budovi.
Trajtimi i atyre reagentëve: epruveta, llamba alkooli, epruveta, syrnik dhe raschini: ; ;
; ;
;
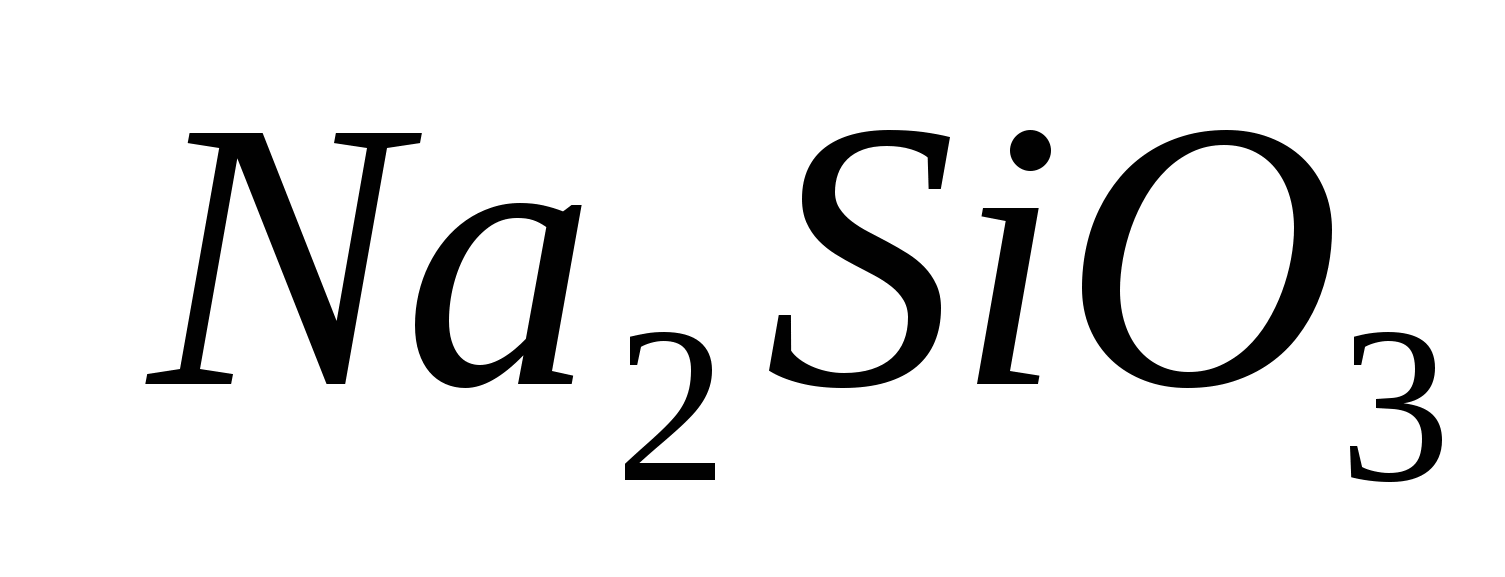 .
.
Përgatitja para hyrjes.
Mësuesi përgatiti tre nivele të palosshmërisë së llojeve të fillimit: test, të ushqyerit teorik, të kuptuarit dhe zhvillimin e fjalëve.
Mësuesi është gati t'ju edukojë, sepse ju do të rishikoni ekipin.
Për 1 - 2 ditë, një fletë informacioni dërgohet në zyrë.
Fleta e rrugës është e dukshme për lëkurën. Diagrami i robotëve në hapat tregohet në fletët e rrugës.
FLETA E RRUGËS.
F.І. studiues
Emërtoni hapin
Orari i fazave
Numrin e regjistrimit
Nënshkrimi i kthimit
Problemi i Rozrakhunkov
Rosp_znavannya
Ri-mishërimi
Shkoni në mësim.
Shkencëtarët hyjnë në klasë me fletët e rrugës, 5 fletë bosh, me stilolaps dhe shkojnë në hap, vlerat për numrin 1. Shkencëtarët marrin njohuritë për palosshmërinë dhe kthehen në shkronjën e re, nëse fle, në skenë të "përcaktimit të fjalëve".
Në robot, në fazën e lëkurës futen 7 - 8 kunja, duke e kthyer vistavlya në fletën e rrugës rivn, nr.
Vlerësimi shfaqet si mesatarja aritmetike e të gjitha fazave.
SHTESËS
"Njohja e fjalimeve"
1 rіven
1. Sigurohuni që ta dini 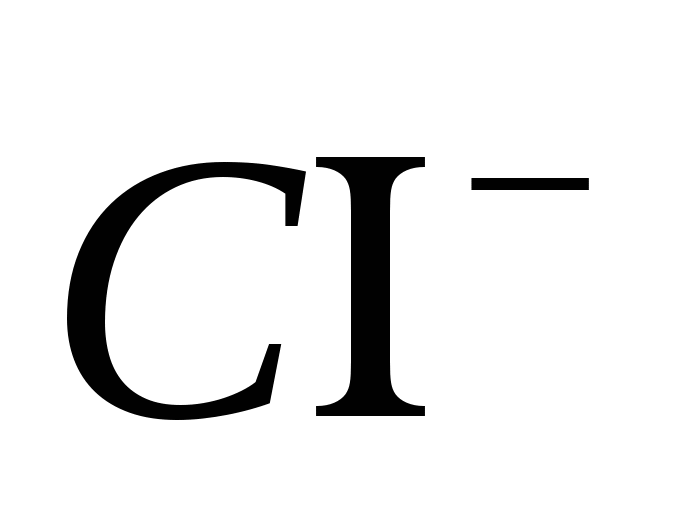
2. Sigurohuni që Joni të jetë i qartë 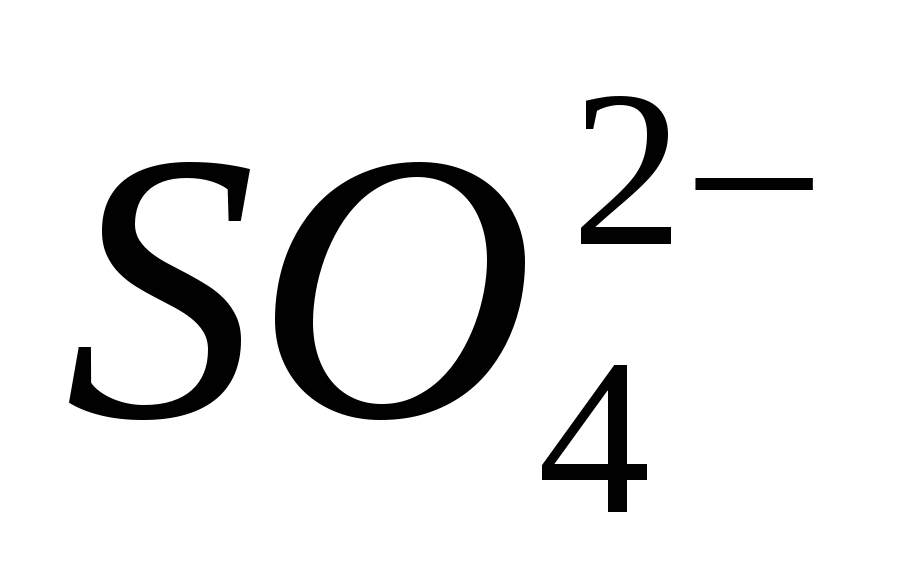
3. Sigurohuni që Joni të jetë i pastër 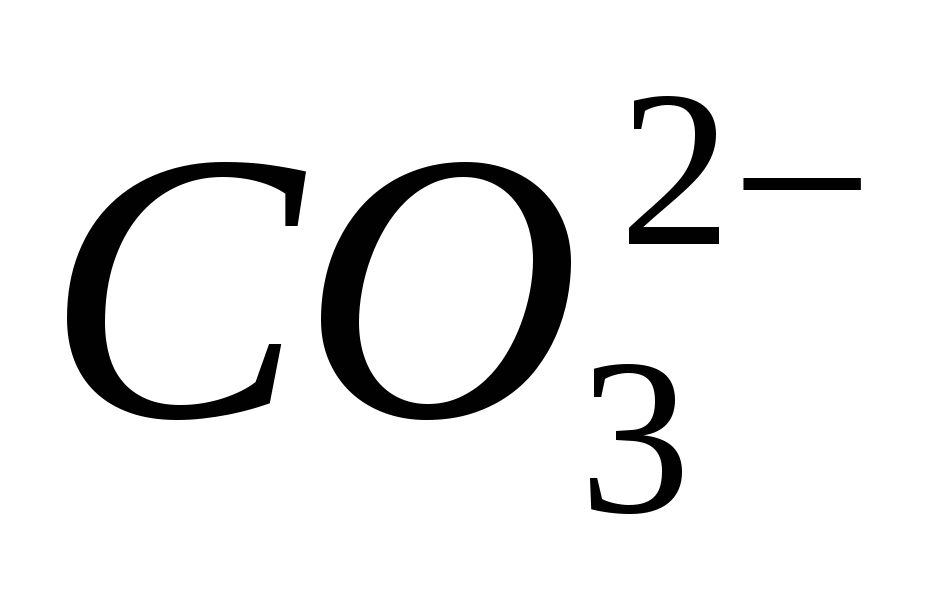
4. Bëjeni të qartë 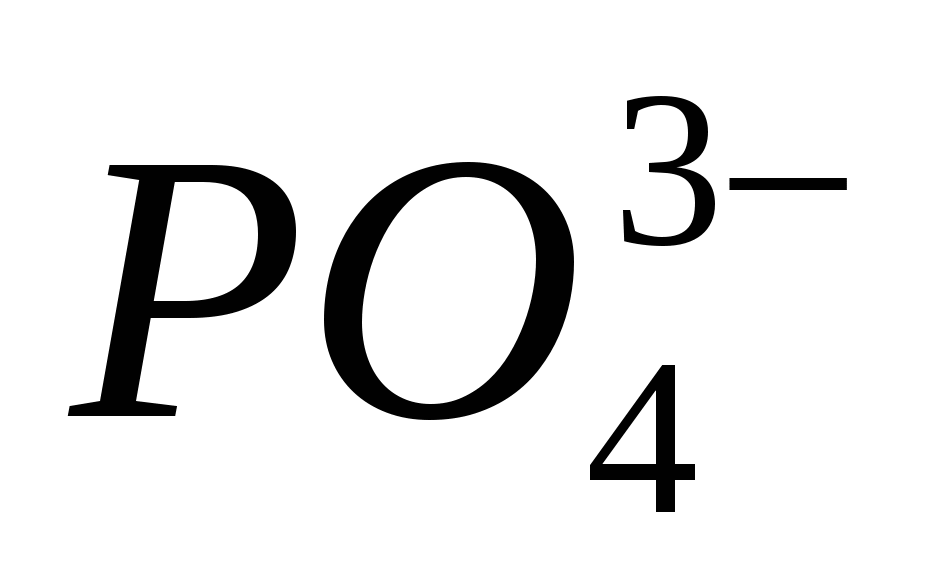
5. Sigurohuni që Joni të jetë i pastër 
2 rіven
1. Përcaktoni ndryshimet pas një reagenti:
2. Përcaktoni ndryshimet pas një reagenti:
3. Përcaktoni dallimet pas një reagenti:
4. Përcaktoni ndryshimet pas një reagenti: 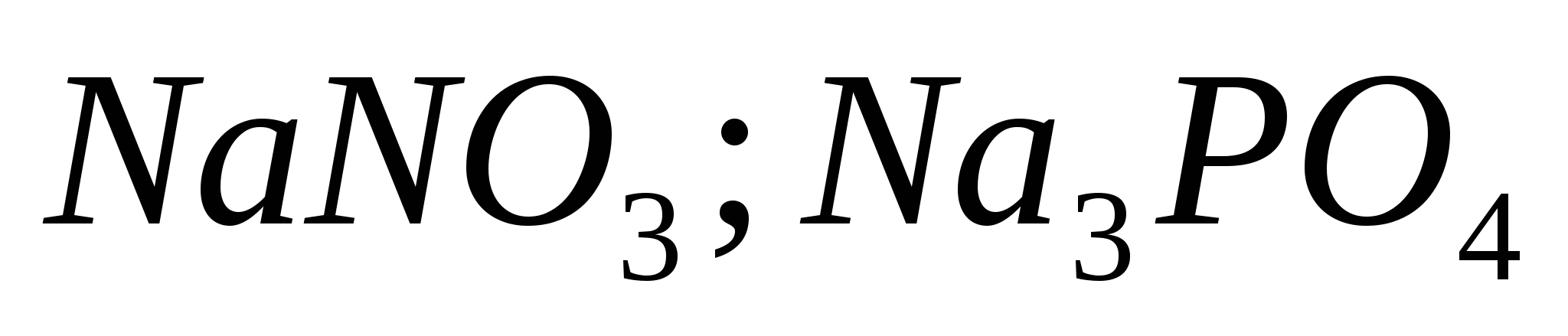 ;
;
5. Përcaktoni ndryshimet pas një reagenti:
3 rіven
1. Projektimi pa reagentë shtesë për miratim:
2. Projektimi pa reagentë shtesë për miratim:
3. Projektimi pa reagentë shtesë për miratim:
4. Projektimi pa reagentë shtesë për miratim:
5. Projektimi pa reagentë shtesë për miratim:
Etap "Rishikimi i të folurit"
1 rіven
1. Përfundoni reaksionet standarde
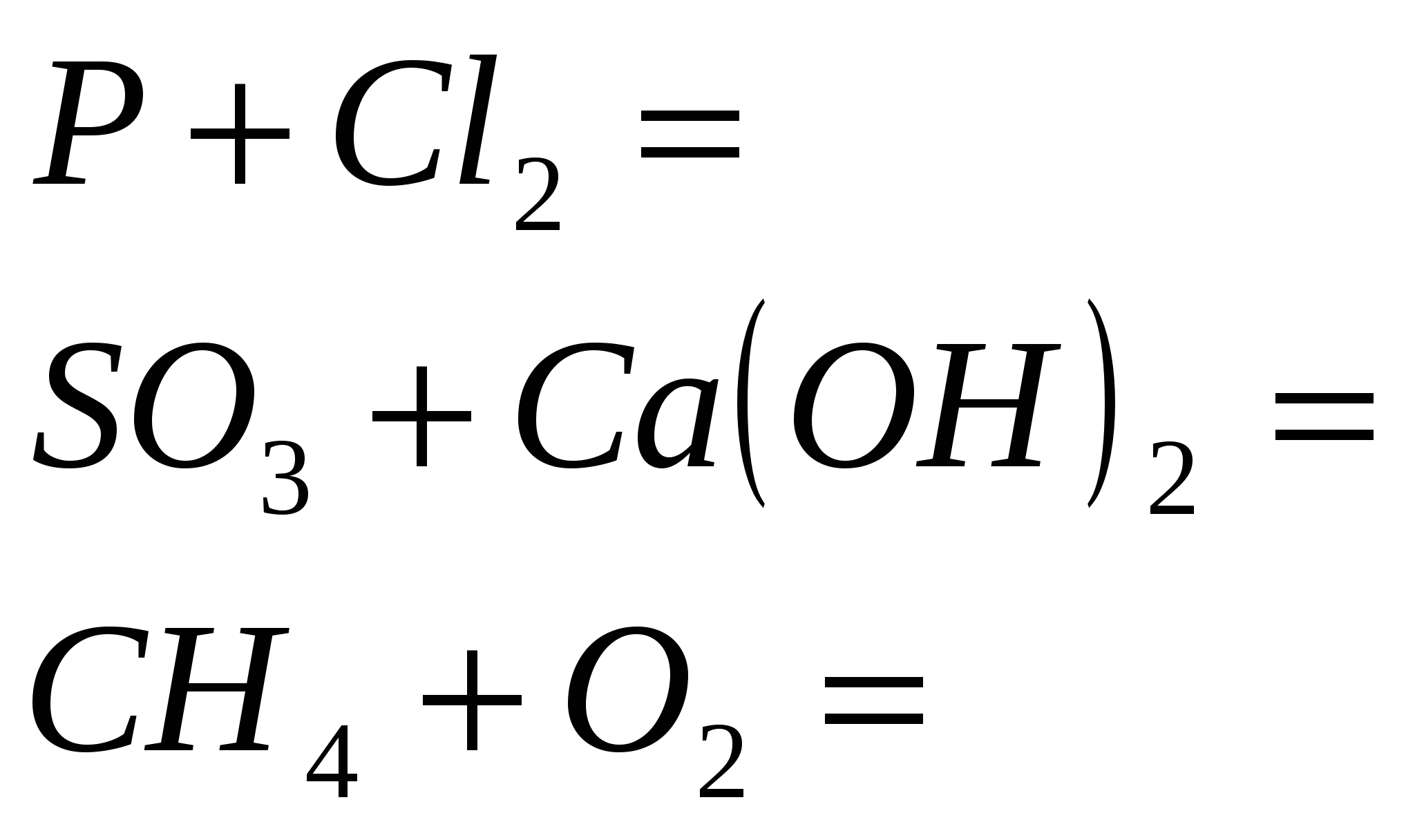
2.Për të përfunduar reagimet rutinë
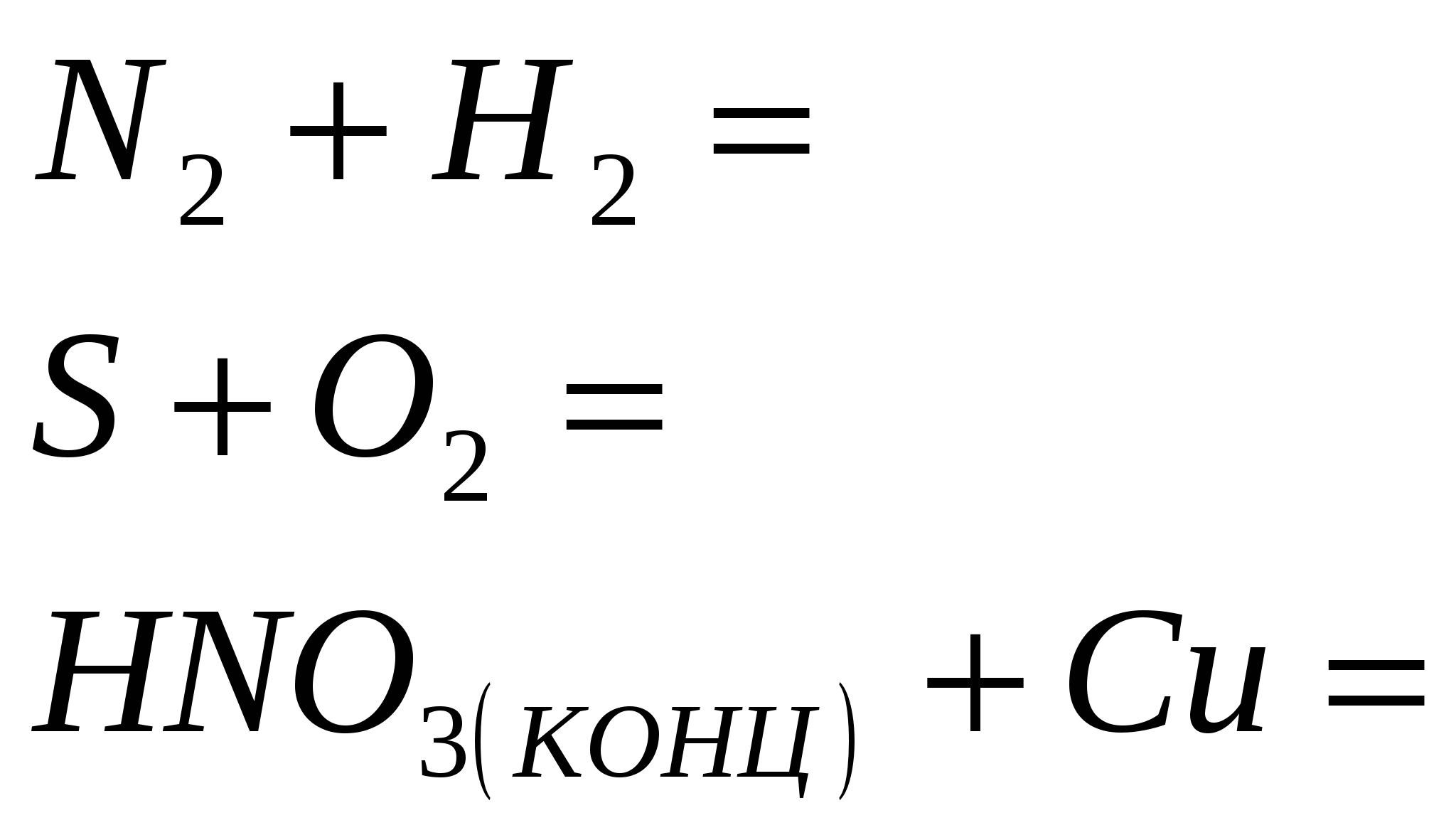
3. Përfundoni reaksionet standarde
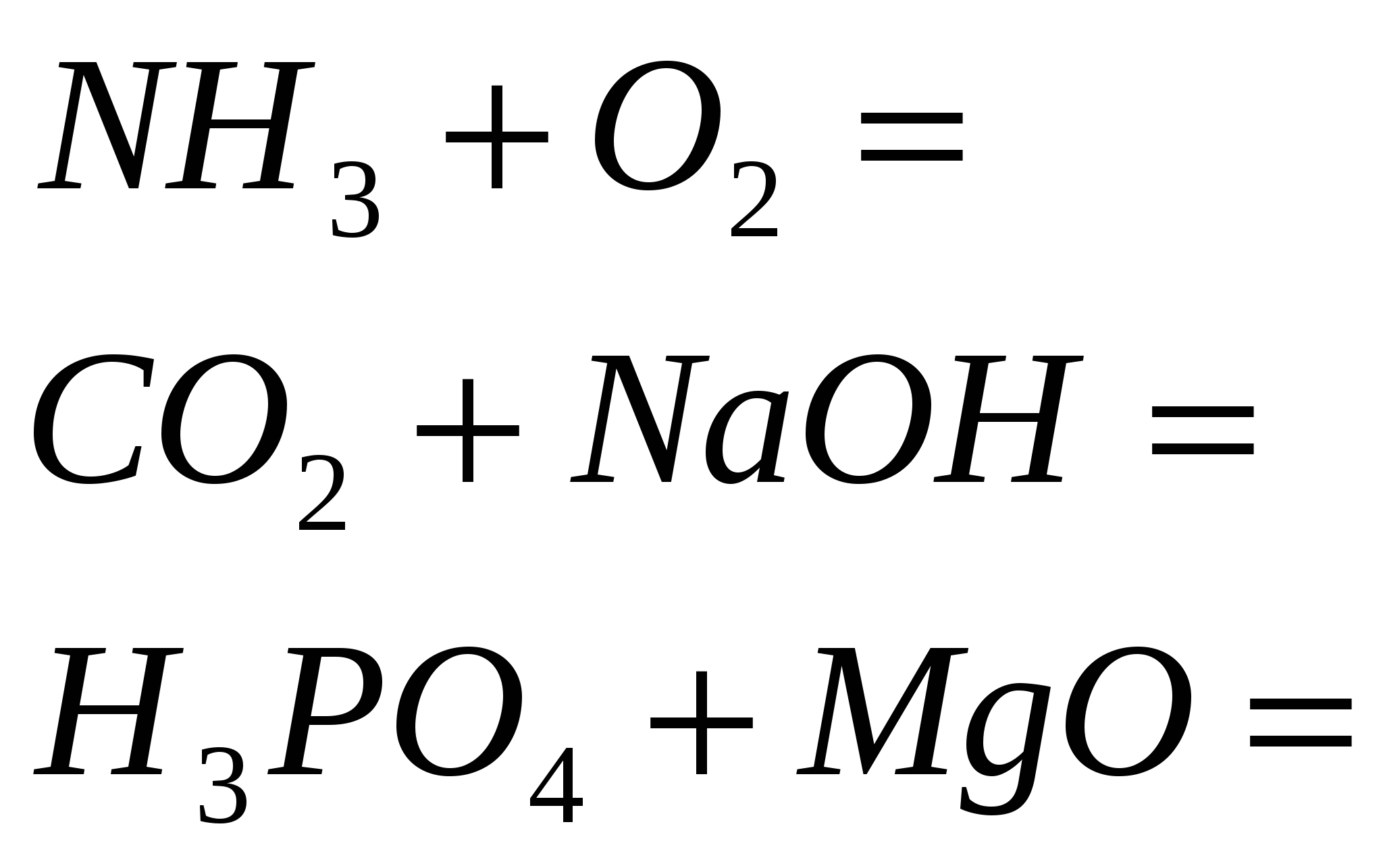
4. Përfundoni reaksionet standarde
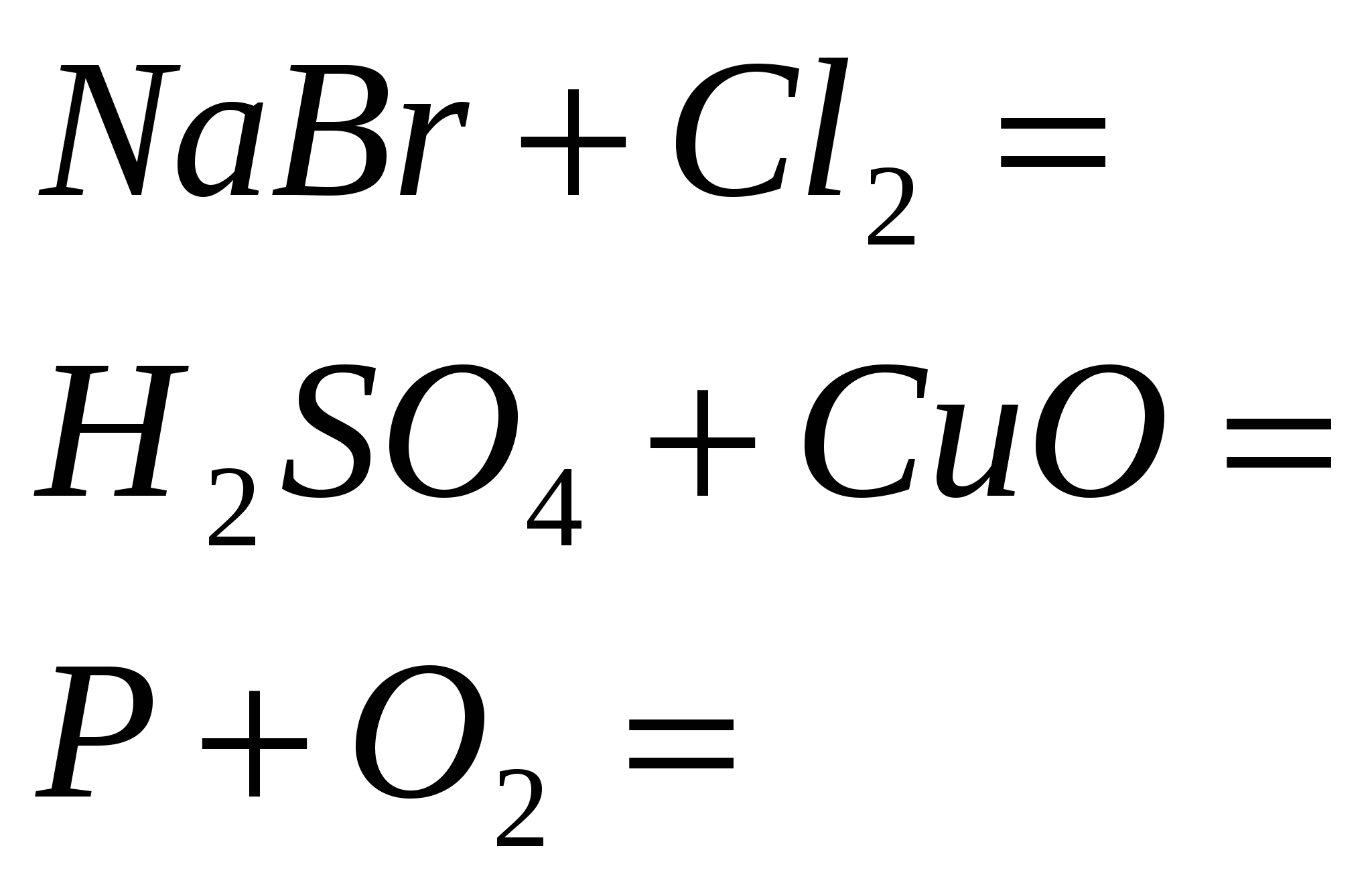
5. Përfundoni reaksionet standarde
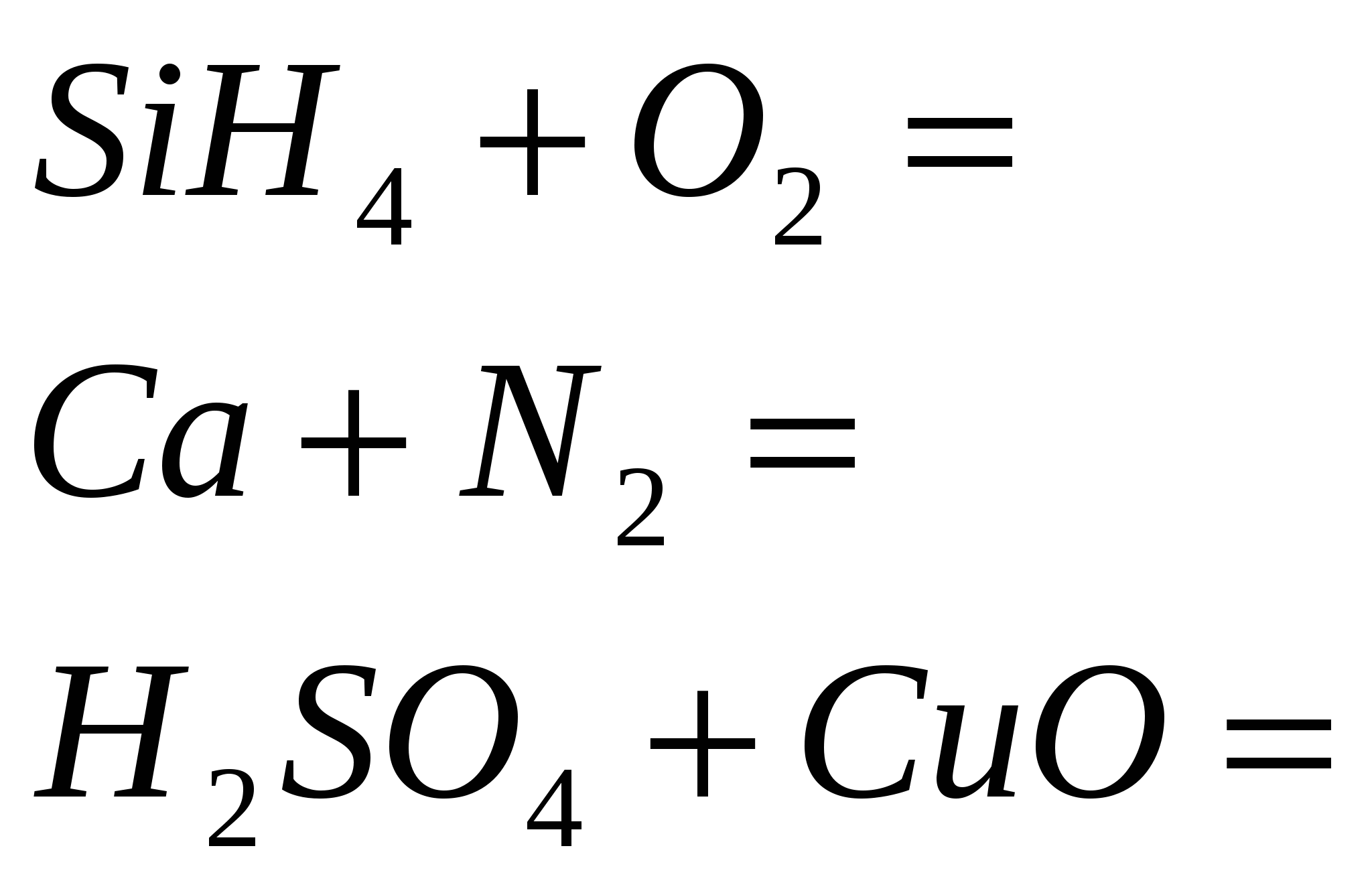
2 rіven
Rishikimi Zdіysnіt:
3rіven
Rishikimi Zdіysnіt:
3.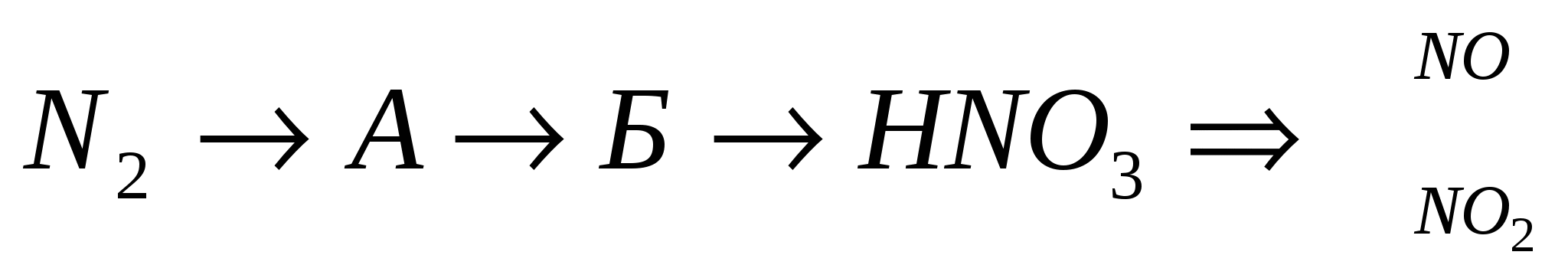
Hapi "Test"
opsioni 1
a) O, b) S, c) Cl, d) C, e) Si.
a) 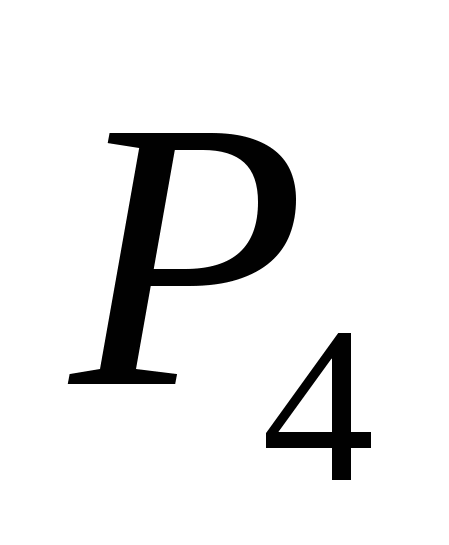 , b) C, c)
, b) C, c) 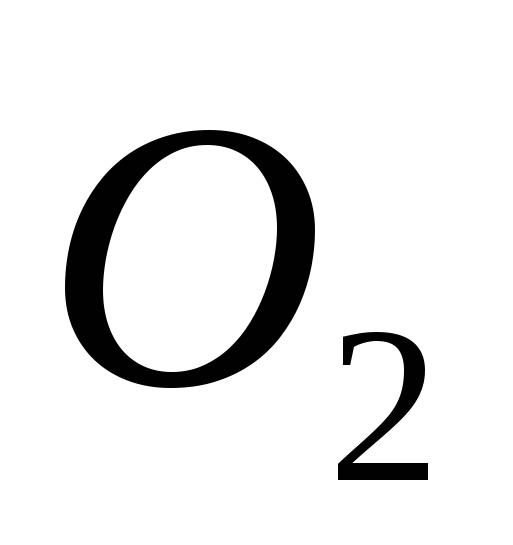 , G)
, G) 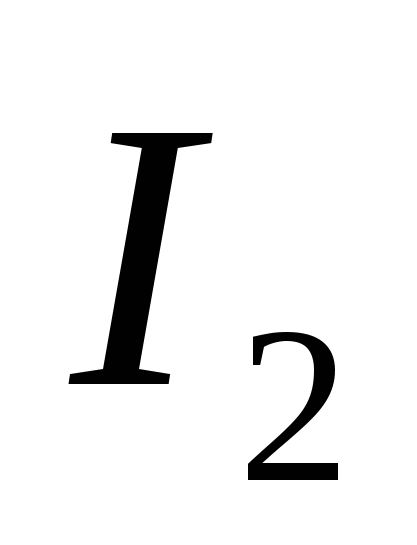 e)
e) 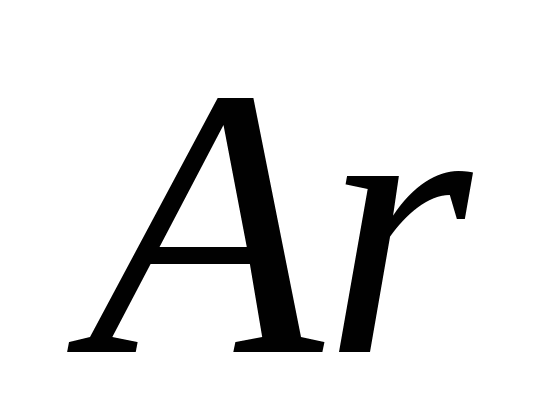 .
.
a)  , b)
, b) 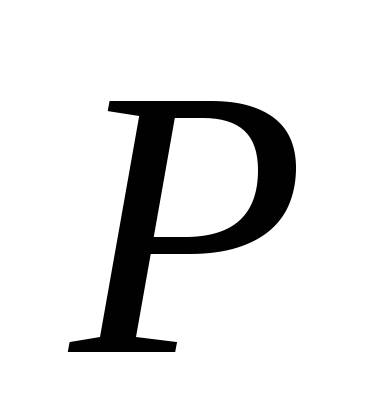 , v)
, v)  , G)
, G)  e)
e)  .
.
4. Formula elektronike e elementit. Yogo duke fluturuar vodneva spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Forca e rritjes së acideve hidrohalike në serinë:
a) ![]()
b) 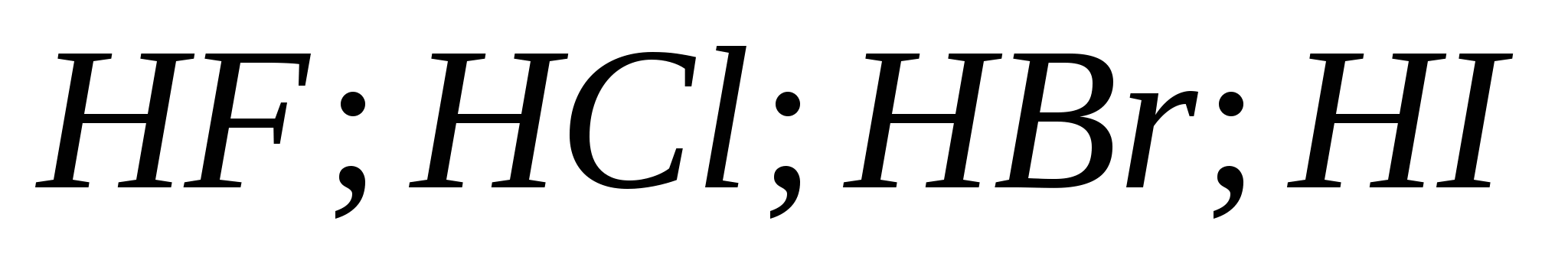
v) 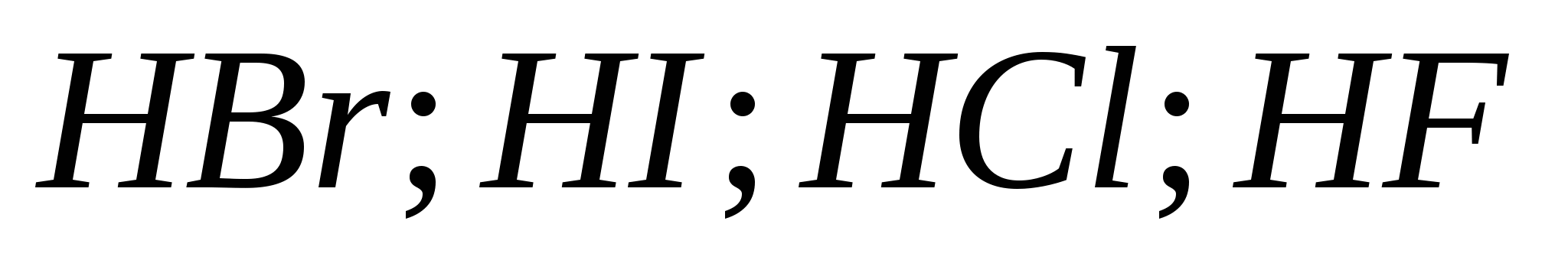
G) 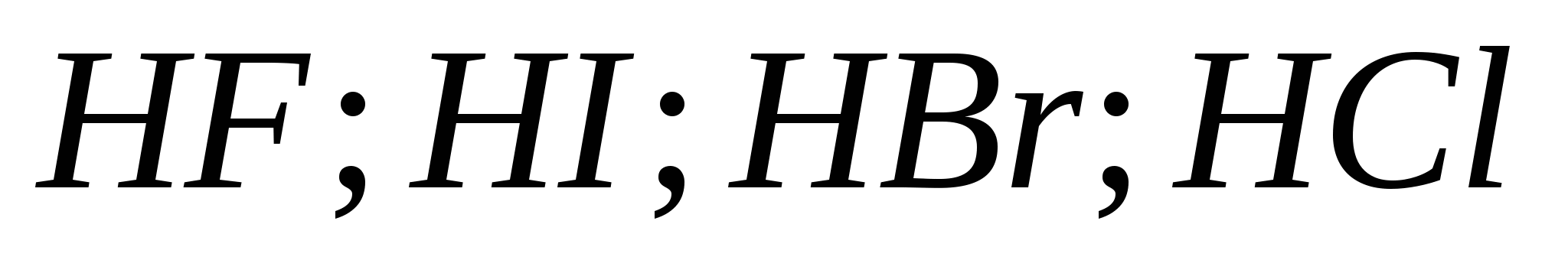
6. Nga halogjenet para boyovyh diakh ngec fjala:
a) fluor; b) klorin; c) jod; d) bromin.
7. Acidi i holluar sirkan për fuqinë oksiduese për zhvillimin e atomeve:
a)  , b)
, b)  , v)
, v)  .
.
8. Oksidi i azotit V mund të kombinohet:
a)  , b)
, b) 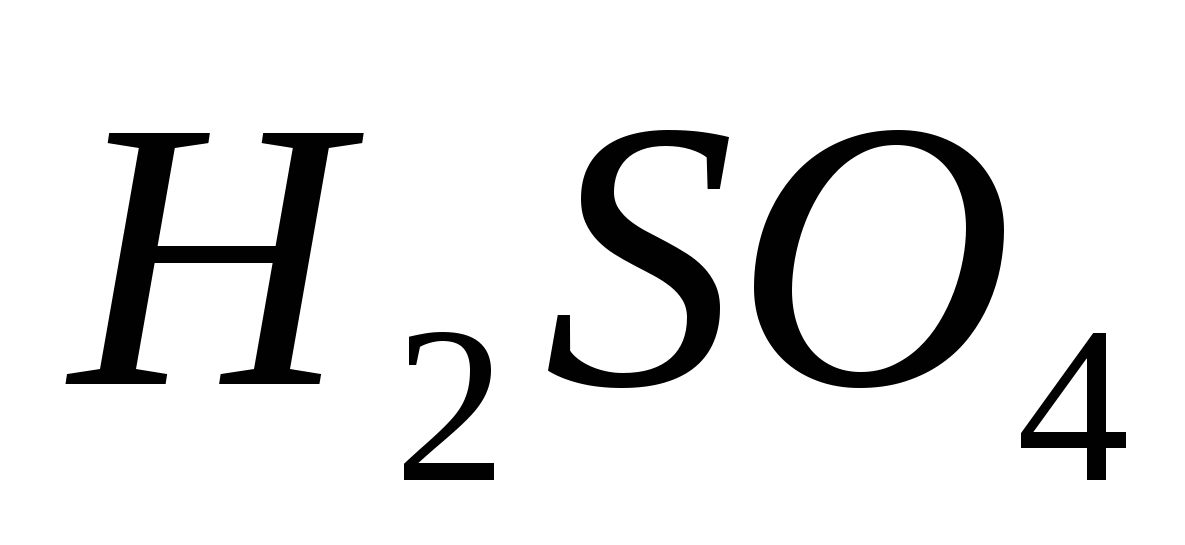 , v)
, v)  , G)
, G) 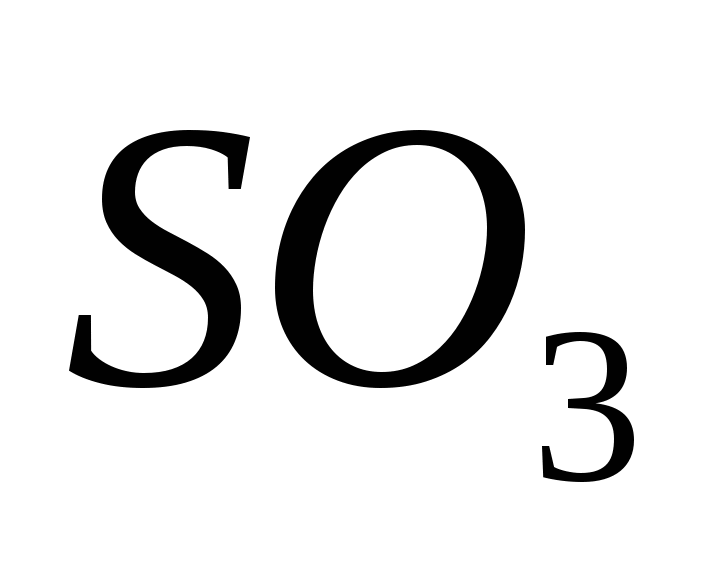 e)
e)  .
.
9. Reagimi: për të sjellë autoritete të tilla në Amerikë:
a) oksidativ, b) i vetëm, c) acid, d) bazik.
10. Forca e acideve në një rresht
a) të ndryshosh, b) të rritesh, c) të ndryshosh shumë, pastaj të ndryshosh; d) një spërkatje e rënies, rritjes, e) mosndryshimit.
Opsioni 2
Hiret kristal atomike mund të jenë fjalime të thjeshta, të miratuara:
a)  , b)
, b)  , v)
, v) 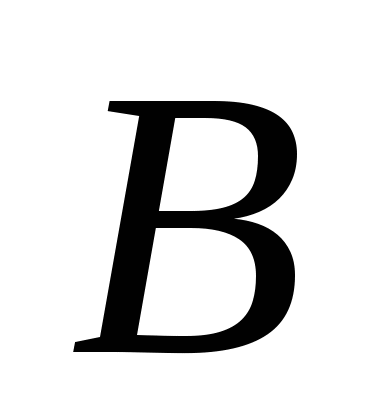 , G)
, G) 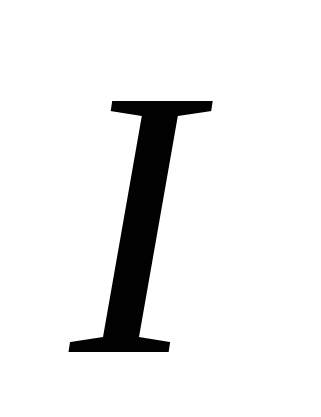 e)
e)  .
.
2. Gaz për mendjet normale є:
a)  , b)
, b) 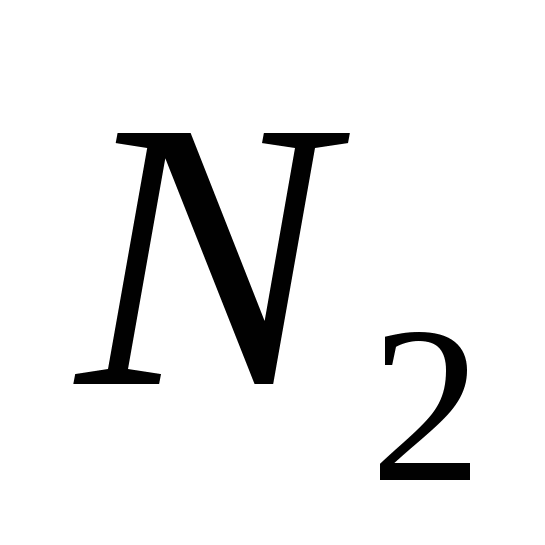 , v)
, v) 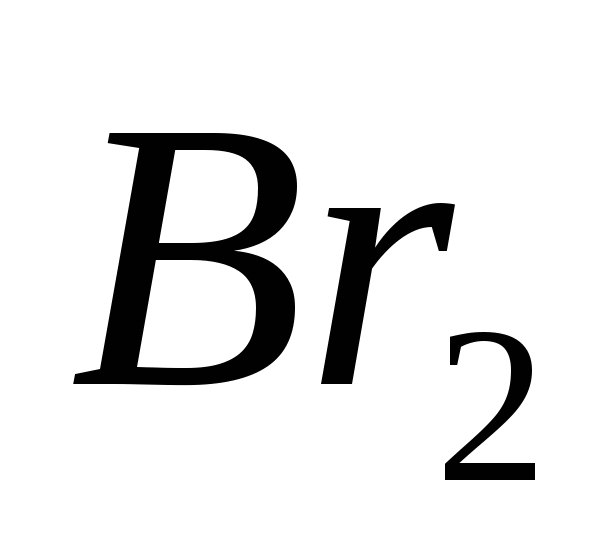 , G)
, G)  e)
e) 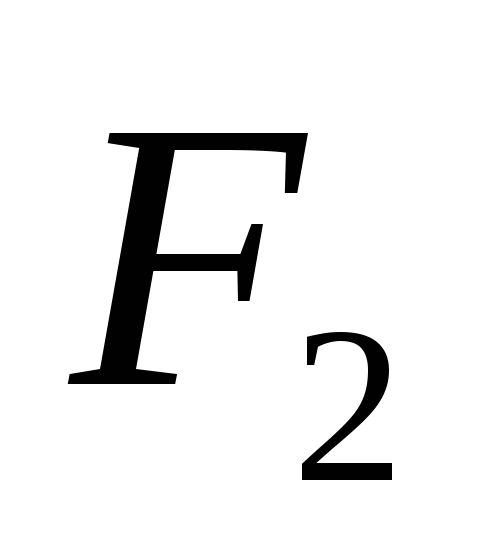 .
.
3. Modifikimet alotropike vendosin elementët e mëposhtëm:
a) 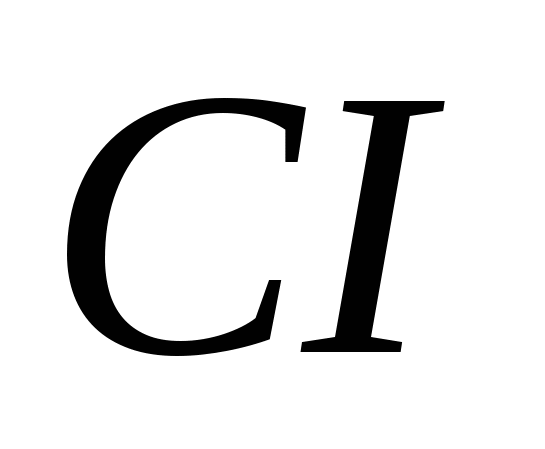 , b)
, b) 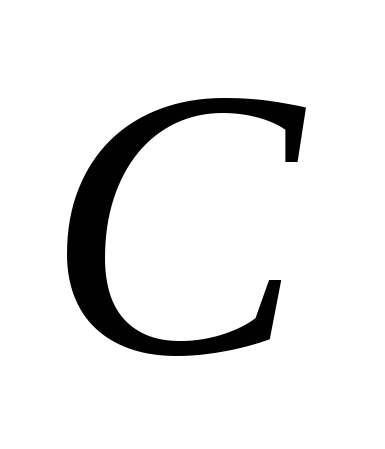 , v)
, v)  , G)
, G) 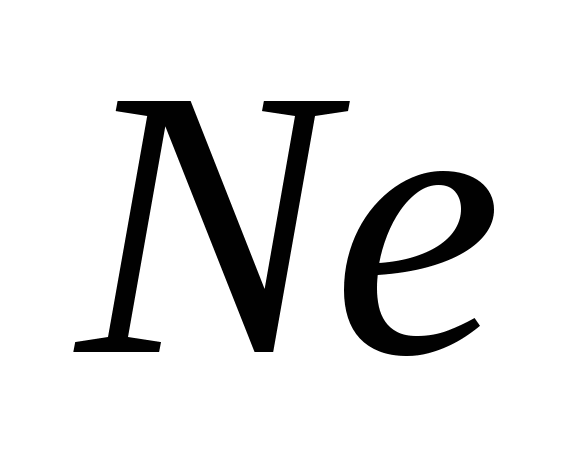 e)
e)  ,
,
4. Formula elektronike e elementit. Yogo duke fluturuar vodneva spoluk:
a) 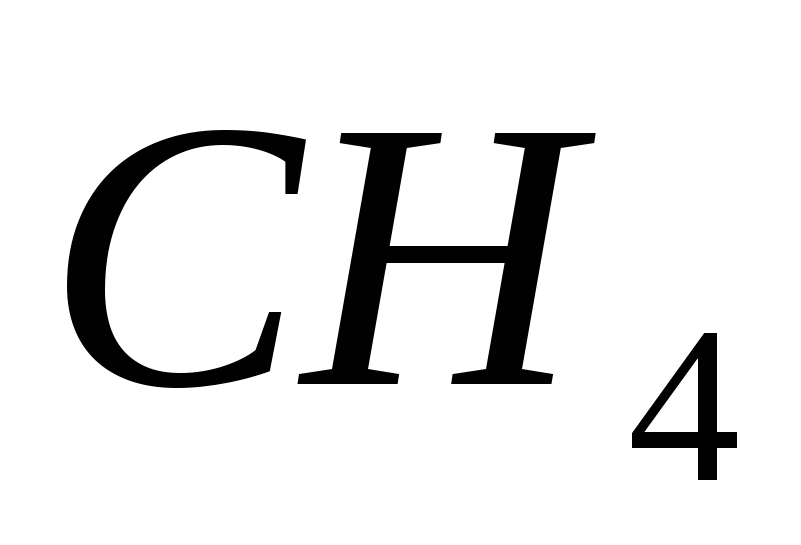 , b)
, b) 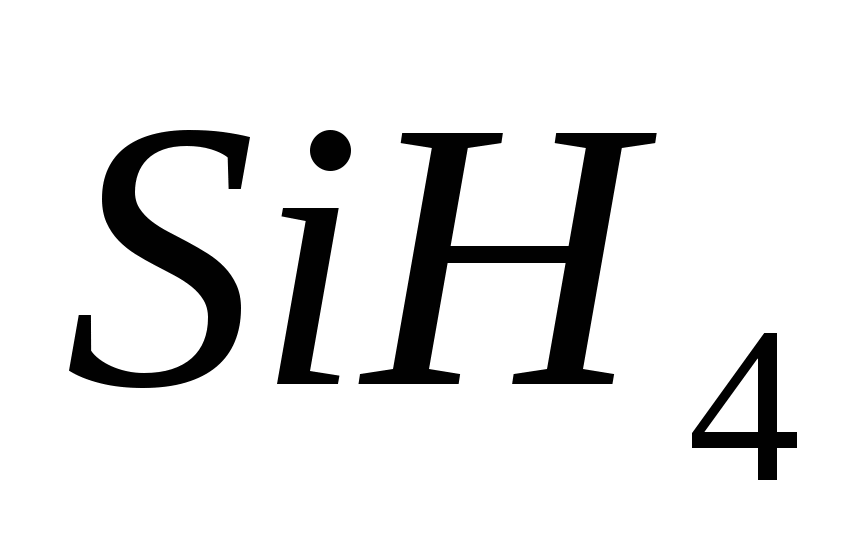 , v)
, v)  , G)
, G) 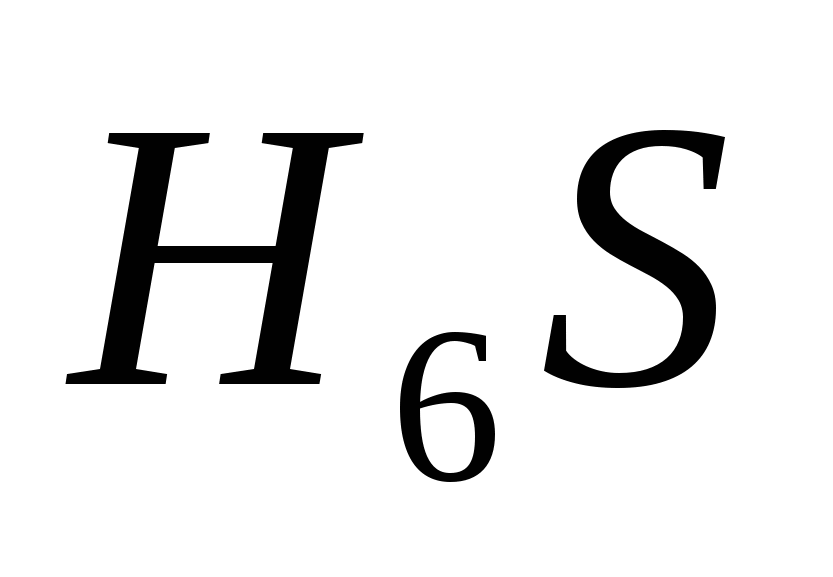 e)
e)  .
.
5. Fuqia kryesore e rrugëve ujore verore ndryshon në rendin e mëposhtëm:
a) 
b) 
v) 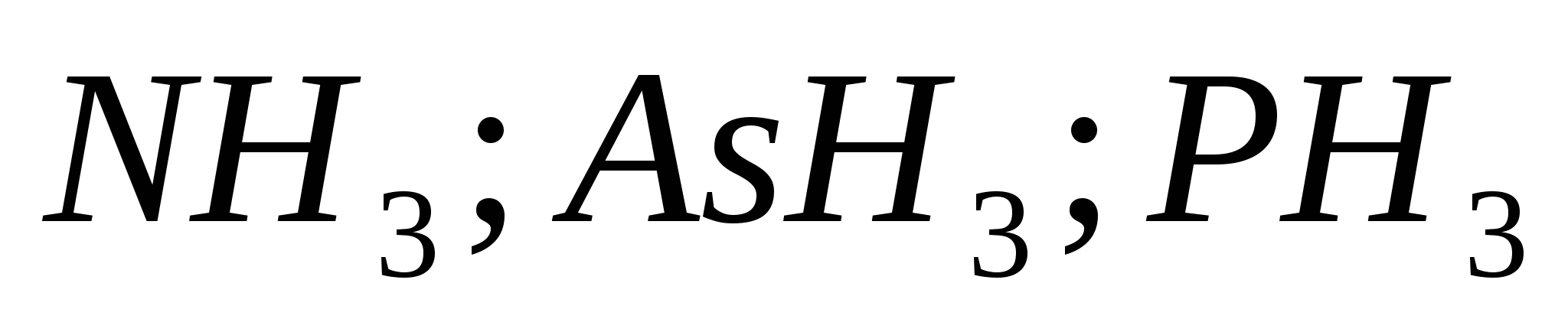
G) 
6. Për t'u ngjitur pas klorit, mund të përdorni solucione të koncentruara:
a)  , b)
, b) 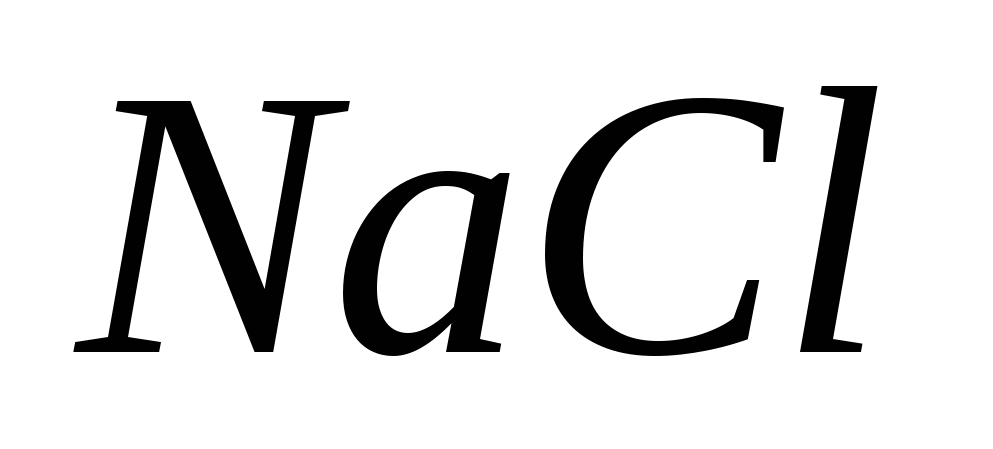 , v)
, v)  , G)
, G)  .
.
7. Acidi i përqendruar sirchan është fuqi oksiduese për rakhunok e atomeve:
a)  , b)
, b)  , v)
, v)  .
.
SHËNIM: 9-10 pamje të sakta - "5"; 7-8- "4"; 5-6- "3"; më pak se 5-2
ETAP "Teoria"
I ryven (në "3")
Shkruani reaksionet tipike për të karakterizuar fuqinë e acidit klorhidrik të holluar.
Shkruani reaksione specifike për të karakterizuar fuqinë e oksidit serky (VI).
Shkruani reaksionet tipike për të karakterizuar fuqinë e acidit të natriumit.
Shkruani reaksionet përkatëse për të karakterizuar fuqinë e oksidit të fosforit (V).
Shkruani përgjigjet reaksionare që karakterizojnë fuqinë e Amerikës.
II ryven (në "4")
Shkruani formulat e burimeve jometalike të ujit veror në periudhën e dytë. Shpjegoni se si dhe pse ka një ndryshim në fuqinë e acidit.
Shkruani formulat për oksidet e tjera jometale në periudhën e tretë. Shpjegoni se si dhe pse ka një ndryshim në fuqinë e acidit.
Shkruani formulat e elementeve më acide në periudhën III. Shpjegoni se si dhe pse ka një ndryshim në fuqinë e acidit.
Shkruani formulat e grupit VI të jometaleve të avullueshëm me bazë uji. Shpjegoni se si dhe pse ka një ndryshim në fuqinë e acidit.
Shkruani formulat e acideve më acide të elementeve të grupit VA. Shpjegoni se si dhe pse ka një ndryshim në fuqinë e acidit.
Niveli III (në "5")
Përcaktoni vetitë acidike dhe acidike të acideve klorhidrik dhe nitrik. Ju lutemi konfirmoni reagimet e thjeshta.
Përcaktoni fuqinë oksiduese dhe acidike të oksidit gri (IV) dhe oksidit në karbon (IV). Ju lutemi konfirmoni reagimet e thjeshta.
Ndryshoni fuqinë oksiduese dhe acidike të ujit dhe ujit me fluor. Ju lutemi konfirmoni reagimet e thjeshta.
Përcaktoni aciditetin e acidit nitrik të koncentruar dhe të holluar. Ju lutemi konfirmoni reagimet e thjeshta.
Përcaktoni aciditetin e oksidit në karbon (II) dhe oksidit në karbon (IV). Ju lutemi konfirmoni reagimet e thjeshta.
ETAP "Problemi Rozrakhunkova"
I ryven (në "3")
II ryven (në "4")
Me ndërveprimin e 37 g hidroksid kalciumi me sulfat amoniumi hiqen 15 g amoniak. Llogaritni pjesën e masës së hyrjes amiak%.
Kur spalyuvanny në kosi 62 g fosfor, hiqet 130 g oksid fosfori (V). Llogaritni pjesën masive të hyrjes në oksidin e fosforit (V)%.
Sa gram 10% keni nevojë për hidroksid natriumi për të neutralizuar 8,96 litra ujë me klor?
Filtrat e litrave në dioksid karboni mund të shkurtohen në pako 10 kg vapnyak dhe 20% e shtëpive mund të hiqen.
Sa gram rrethim duhet vendosur për të kaluar 11,2 litra dioksid karboni përmes 900 g bar hidroksid 10%?
Niveli III (në "5")
Çfarë vëllimi i acidit nitrik 80% (pl. 1,46 g / ml) është i nevojshëm për mjaltin "razchinennya" 32 g?
Yaka masa do të kërkohet për reaksionin me acid nitrik shumë të koncentruar për të hequr 4 l (n.u.) oksid azoti (IV);
Kur "thyehet" në përqendrimin e acidit klorhidrik, 20 g aliazh ari me 4,2 l (n.u.) oksid gri (IV). Visni fraksionin masiv në% të aliazhit.
Një shumë gazi në klor dhe një vëllim prej 1 l kaloi përmes një tretësire të jodidit të kalciumit. Pashë 5,08 r jod në tsomu. Kërkoni për një pjesë (%) të gazit të klorit në shumën e keqe.
Sasia e silikonit dhe vugilla me një masë prej 10 g u derdh mbi një gamë shumë të koncentruar të hidroksidit të natriumit. Si rezultat i reaksionit janë parë 5.6 litra ujë (n.o.). Visni fraksionin masiv të silikonit (%) në tsіy sumіshі.
