Vetitë fizike të sio2. Komponimet e oksigjenit. Silic (II) SiO
Oksidi i silikonit (II) SiO. Në natyrë, nuk ndodh, por mund të merret nga reagimi:
SiO 2 + Si → 2 SiO.
Nën presionin normal, lartësimi i monoksidit të silikonit fillon në rreth 1200 ° C (kur vetë materialet fillestare praktikisht nuk avullojnë ende). Në çifte, SiO është një përbërje individuale. Energjia e shkëputjes së elementeve është 789 kJ / mol. Konvertimi në një gjendje solide mund të realizohet vetëm me ftohje të shpejtë ("shuarje") të fazës së gazit. Përndryshe, shpërhapja nga ekuacioni ka kohë për të kaluar:
2 SiO = SiO 2 + Si.
Monoksidi i silikonit oksidohet ngadalë nga oksigjeni atmosferik dhe shpërndahet lehtësisht në alkaline për të formuar kripërat e acidit silik dhe lirimin e hidrogjenit. Është lehtë elektrizuar nga fërkimi, duke fituar një pagesë të fortë negative.
Oksidi silic (IV) SiO 2.Oksidi i silikonit (IV) quhet gjithashtu silicë. Kjo është një substancë e fortë refraktare. (pika e shkrirjes 1700 ° C)i përhapur në natyrë në dy forma: 1) silicë kristaline - në formën e një minerali të kuarcit dhe varieteteve të tij (kristal shkëmb, kalcedoni, agat, jasper, gëlqere); kuarci formon bazën e rërës së kuarcit të përdorur gjerësisht në ndërtim dhe në industrinë e silikatit; 2) silicë amorf - në formën e përbërjes minerale opal SiO 2 nH2O; format tokësore të silicës amorf janë diatomite, tripoli (infusorial earth); Një shembull i silicë artificiale amorf anhydrous është xhel silicë, e cila është marrë nga metasilicate natriumi:
Xhel silicë ka një sipërfaqe të zhvilluar dhe për këtë arsye absorbon mirë lagështinë.
Në 1710 ° kuarci shkrihet. Me ftohje të shpejtë të masës së shkrirë, formohet xhami kuarci. Ajo ka një koeficient shumë të ulët të zgjerimit, kështu që xhami i nxehtë kuarci nuk plas kur uji ftohet me shpejtësi. Qelqat laboratorike dhe instrumentet për kërkime shkencore janë bërë nga qelqi kuarci.
Struktura e SiO 2 në një imazh planar mund të përfaqësohet si më poshtë:
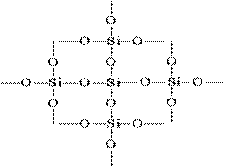
Çdo atom siloni është i mbyllur në një tetrahedron prej 4 atomesh oksigjeni. Në këtë rast, atomi i silikonit ndodhet në qendër dhe atomet e oksigjenit ndodhen në majat e tetraedrit. I gjithë pjesa silicë mund të konsiderohet si një kristal formulë e të cilit është (SiO 2) n. Një strukturë e tillë e oksidit të silikonit (IV) përcakton fortësinë e lartë dhe refractoriness.
Vetitë kimike të oksidit të silikonit (IV) SiO 2 i referohen oksideve të acidit. Kur shkrin atë me alkaline të ngurta, oksidet bazë dhe karbonatet, kripërat e acidit silikik formohen:
Vetëm acid hydrofluoric ndërvepron me oksid silikoni (IV) (gravurë qelqi):
SiO 2 + HF → SiF 4 + H 2 O
Oksidi i silikonit (IV) nuk shpërndahet në ujë dhe nuk ndërvepron kimikisht me të. Prandaj, acid silikik është marrë indirekt, për shembull, nga hidroliza:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 ortosilikon acid.
H 4 SiO 4 është i tretshëm, kur nxehet ose qëndron, procesi i polimerizimit është duke u zhvilluar:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 acid diorthokremnievy.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 acid tetraorotremilikik.
Ajo mbyllet unazën:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 acid tetrametakilikik.
Në këtë rast, acidi silikik (në varësi të përqendrimit të solucioneve fillestare të kripës dhe acidit) mund të merret si në formën e një mase xhelatinoze që përmban ujë, dhe në formën e një solucioni kolloid (sol). Përbërja e acidit silikik të fituar varet nga materialet fillestare dhe kushtet e përgatitjes. Të gjithë acidet silicike janë shumë të dobëta (më të dobëta se qymyri).
Nëse acidi karbonik në një solucion lëshon acid silicik nga kripërat e tij, atëherë reaksioni i kundërt ndodh gjatë kalcinimit. E para është për shkak të forcës më të ulët (shkalla e disociimit) të acidit silikik, i dyti - luhatshmëria e tij më e ulët kur nxehet.
Kur acidet polikilikike të nxehta dhe dehidratimi gradual i tyre mund të merren nga gjobë SiO 2, e cila quhet xhel silicë . Thith ujin mirë, e vendos atë në pajisje për të parandaluar oksidimin e elementeve të shtrenjta.
Nëngrup i Gjermanisë
Ge (+4) Sn (+2, +4) Pb(+2) - gjendje oksidimi rezistente
Germaniumi u parashikua nga DI Mendeleev në 1871 dhe zbuloi në 1886. Tin dhe plumbi u përkasin elementëve që ishin më të njohura për njerëzimin për një kohë të gjatë: egjiptianët ishin në gjendje t'i ndienin ato nga orët më shumë se 3000 vjet para Krishtit. e. Në Indi, plumbi u bë i njohur rreth 2500 vjet, dhe kallaj 1500 vjet para Krishtit. e. Shkrirja e kallajit të prodhuar në Kinën e lashtë.
Getting.Përbërjet natyrore të germaniumit konvertohen në GeO 2 dhe reduktohen me hidrogjen:
GeO 2 + H 2 t → Ge + H 2 O në temperatura prej rreth 1000 ° C.
Tin është marrë nga minerale natyrore cassiterite(SnO 2):
SnO 2 + C → Sn + CO.
Skema më e thjeshtë për reduktimin e plumbit industrial bazohet në dy reagime të njëpasnjëshme:
PbS + O 2 → SO 2 + PbO galenë(PbS) është djegur dhe pastaj është reduktuar me thëngjill:
PbO + С → СO + Pb.
Aplikimi.Të tre elementët janë shumë të rëndësishëm për teknologjinë moderne. Disa përbërës të kallajit dhe plumbit janë gjithashtu të përdorimit të konsiderueshëm. Derivatet e plumbit janë shumë toksike.
Germaniumi është një gjysmëpërçues tipik (n-lloj me një gjerësi bandgap prej 0.75 eV) dhe gjen përdorime të ndryshme në inxhinieri elektrike. Ai përdoret më gjerësisht për prodhimin e ndreqësve AC.. Ky aplikim bazohet në një përçueshmëri unipolare që del nga lidhja ndërmjet germaniumit të pastër dhe aliazhit germanium me indium. Rrjedha e tanishme (rrjedha elektronike) kalon në një instalim të tillë praktikisht vetëm nga germani në aliazh, por jo anasjelltas. Ndreqësit Germanium karakterizohen nga efikasiteti jashtëzakonisht i lartë (rreth 98%) dhe një jetë shumë e madhe (me funksionimin e duhur) të shërbimit. Disavantazhi kryesor i ndreqësve të tillë është ndjeshmëria e tyre ndaj ngrohjes - mbi 70 ° C, shpejtësia e tyre bie shpejt.
Zona e përdorimit të rëndësishme gjermania është një optikë infra të kuqe, pasi rrezet me një gjatësi vale më shumë se 2 mikronë, ai praktikisht nuk vonon. Përkundrazi, në dritën dhe afër saj (0.2? 2 mikronë), germani absorbon intensivisht energjinë. Nëse një sipërfaqe metalike me shkëlqim (e cila ruan mirë ngrohtësinë, por nuk ngroh mirë) është e mbuluar me film germanium, atëherë sipërfaqja ngroh shumë më tepër se pa një film. Është raportuar se në një fuçi të përgatitur në këtë mënyrë nën veprimin e dritës së diellit, mund të merret uji i valë.
Tin është përdorur kryesisht për hekur tinning në mënyrë që të mbrojtur atë nga ndryshk. (tinplate për industrinë e konservimit). Trashësia e veshjeve të tilla të kallajit është shumë e vogël - sipas rendit të mikronave. Në formën e fletëve të hollë (të ashtuquajturat Stannioles) konsumohet kallaji për prodhimin e kondensatorëve në industrinë elektrike . Plumbi përdoret për prodhimin e pllakave të baterisë, pllakave të kabllove elektrike, plumbave dhe të shtënave, për të mbrojtur nga rrezet X dhe g-rrezet, si dhe në industrinë kimike (tubacionet etj.). Sasi shumë të mëdha të kallajit dhe plumbit janë shpenzuar për prodhimin e një numri të lidhjeve teknikisht të rëndësishme.
Më e rëndësishmja prej tyre janë bronz të ndryshëm (lidhjet Cu dhe Sn), lidhjet për kushineta (babbits, zakonisht të bëra në bazë të Pb ose Sn dhe gjithashtu përmbajnë Sb dhe Cu), lidhjet tipografike (5-30% Sn, 10-20% Sb, pjesa tjetër është Pb) dhe lidhësi i zakonshëm "i butë" (30-70% Sn, 70-30% Pb). Shpesh mund të zëvendësohet me një aliazh më të lirë prej 90% Pb, 6% Sn, 4% Sb. Me rëndësi të madhe janë lidhjet për kushineta me një përbërje të përafërt prej 98% Pb, 1% Ca, 1% Na.
Silicë (silicë, silicë) është një substancë e përbërë nga kristale të pangjyrë me forcë të lartë, ngurtësi dhe refractoriness. Dioksidi i silikonit është rezistent ndaj acideve dhe nuk ndërvepron me ujin. Me një rritje në temperaturën e reagimit, substanca ndërvepron me alkaline, shkrihet në acidin fluoridik, është një dielektrikë e shkëlqyer.
Në natyrë, dioksidi i silikonit shpërndahet gjerësisht: oksidi i silikonit kristalor përfaqësohet nga minerale të tilla si diaspri, agat (dioksidet kristalore të dioksidit të silikonit), kristali i shkëmbit (kristalet e mëdha të materies), kuarci (dioksid silici i lirë), kalcedoni, ametist, silikat).
Nën kushte normale (në temperaturë dhe presion të ambientit natyror), ka tre modifikime kristaline të dioksidit të silikonit - tridimite, kuarci dhe kristobalite. Kur rritet temperatura, dioksidi i silikonit kthehet së pari në koesite, dhe pastaj në stishovite (një mineral i gjetur në 1962 në një krater meteoriti). Sipas studimeve, është stishovit, një derivat i dioksidit të silikonit, që ka një pjesë të madhe të mantelit të Tokës.
Formula kimike e substancës - SiO 2
Përgatitja e silicë
Dioksidi i silikonit prodhohet industrialisht në bimë të kuarcit që prodhojnë koncentrat të kuarcit të pastër, i cili përdoret më pas në industrinë kimike dhe elektronike, në prodhimin e optikave, gome dhe mbushëse për lyerje të bojës dhe llak, etj. Dioksid natyral i silikonit, ndryshe i quajtur silicë, përdoret gjerësisht në ndërtim (beton, rërë, zë dhe materiale izoluese të ngrohjes).
Sinteza e dioksidit të silikonit me një metodë sintetike kryhet nga veprimi i acideve në silikat natriumi, në disa raste në silikate të tjera të tretshme ose me metodën e koagulimit të silicës kolloidale nën ndikimin e joneve. Përveç kësaj, dioksidi i silikonit prodhohet nga oksidimi i silikonit me oksigjen në një temperaturë prej rreth 500 gradë Celsius.
Zbatimi i dioksidit të silikonit
Materialet që përmbajnë silic janë përdorur gjerësisht si në fushën e teknologjive të larta dhe në jetën e përditshme. Dioksidi i silikonit përdoret në prodhimin e qelqit, qeramikës, produkteve të betonit, materialeve gërryese, si dhe në inxhinieri radio, instalime ultrasonike, çakmakë etj. Në kombinim me një numër përbërësish, silicë përdoret në prodhimin e kabllove me fibra optike.
Dioksidi i silikonit amorf jo-poroz përdoret gjithashtu në industrinë ushqimore si një shtesë, e regjistruar nën numrin E551, duke parandaluar grumbullimin dhe ngjitjen e produktit kryesor. dyoksid  ushqimi i silikonit përdoret në industrinë farmaceutike si një enterosorbent i drogës, në prodhimin e pastave. Substanca gjendet në patate të skuqura, në biskota, shkopinj misri, kafe të çastit, etj.
ushqimi i silikonit përdoret në industrinë farmaceutike si një enterosorbent i drogës, në prodhimin e pastave. Substanca gjendet në patate të skuqura, në biskota, shkopinj misri, kafe të çastit, etj.
Dëmtimi i silicës
Zyrtarisht konfirmoi se substanca e dioksidit të silikonit kalon nëpër traktin gastrointestinal të pandryshuar, pas së cilës është hequr krejtësisht nga trupi. Sipas një studimi 15-vjeçar nga ekspertët francezë, pirja e ujit të pijshëm me alumin të lartë zvogëlon rrezikun e zhvillimit të sëmundjes së Alzheimerit me 10%.
Kështu, informacioni rreth rreziqeve të dioksidit të silikonit, i cili është një substancë kimikisht inerte, është e gabuar: shtesa dietike E551, e marrë me gojë, është plotësisht e sigurt për shëndetin.
Oksidi i silikonit SiO 2 është një substancë e ngurtë, shumë e fortë (pika e shkrirjes më shumë se 1700 ° C), e shpërndarë gjerësisht në natyrë, ku gjendet kryesisht në formën e mineralit kuarc, si dhe kristobaliti dhe tridimiti.
Në temperaturat e zakonshme, kuarci është një modifikim i qëndrueshëm, me rritje të transformimeve polimorfike të temperaturës:
Silicë e të gjitha modifikimeve në formën e një monomeri nuk ekziston; ajo është gjithmonë polimer dhe "e ndërtuar" e tetraedrës duke formuar një grilë shumë të fortë atomike
Çdo atom silikoni në (SiO 2) n kristale është i rrethuar tetraedrisht nga katër atome oksigjen, secila prej të cilave është e tejkaluar. Nëpërmjet një atom të zakonshëm të oksigjenit, tetrahedra në kënde të ndryshme lidhen me njëri-tjetrin, duke formuar një grilë të vazhdueshme tre-dimensionale; rregullimi i ndërsjellë i tetraedrës në hapësirë përcakton një ose një tjetër modifikim të silicë.
Në modifikime të ndryshme të forcës lidhjes silicë ndryshon. Kjo ndikon në madhësinë e këndeve Si-O-Si dhe distancat Si-O, për shembull, këndi i lidhjes Si-O-Si në modifikime të ndryshme të silikagjës ndryshon nga 120 në 180 °. Kalimet kuarc-tridimite-cristobalite shoqërohen nga thyerja dhe transformimi i lidhjeve, të cilat mund të ndodhin vetëm në temperatura të larta.
Kuarc. Shpesh gjenden në natyrë në formën e kristaleve shumë të mirëformuara, ndonjëherë me përmasa të konsiderueshme. Kristalet formohen nga tetrahedra të rregulluar në një formë spirale rreth boshtit qendror, në formën e një spirale. Në të njëjtën kristal, drejtimi i spirales mund të jetë i kundërt. Kristale të tilla janë izomere optike. Ata rrotullohen në planin e polarizimit të dritës, dhe mund të jenë të dyja të djathtat dhe të majtën. Ata dhe kristalet e tjera ndryshojnë si subjekt nga imazhi i tyre i pasqyruar.
Kuarci përdoret në fusha të ndryshme të shkencës dhe teknologjisë, dhe kristalet e saj shpesh rriten artificialisht. Disa lloje kuarci kanë emra të veçantë. Kristalët e pandryshueshëm të pandryshueshëm quhen kristal rok. Ekzistojnë gjithashtu varietete me ngjyrë të kuarcit: kuarci në rritje, violet (ametist), ngjyrë kafe e errët (topaz i tymosur), jeshile (chrysoprase) etj. Modifikimi kristalor i kuarcit me shtesa të substancave të tjera quhet kalcedoni. Varietetet e kalcedonit janë agat, diaspri dhe të tjerë. Kristal shkëmbore dhe varietetet me ngjyrë të kuarcit përdoren si gurë të çmuar dhe gjysëm të çmuar.
Tridimiti ndodh në shkëmbinj vullkanikë, por në sasi shumë të vogla. Tridimi i njohur dhe origjina e meteoritit.
Kristobaliti në natyrë nganjëherë gjendet në formën e kristaleve të vogla të ngulitura në lava, si tridimiti. Tridimite dhe cristobalite kanë një strukturë më të "lirshme" se sa kuarci. Kështu, dendësia e kristobalit, tridymite dhe kuarc është 2.32; 2.26 dhe 2.65 g / cm 3, respektivisht.
Silicë shkrihet me ftohje të ngadaltë lehtë formon qelqi amorf kuarc. Silicë në formën e qelqit gjendet gjithashtu në natyrë. Dendësia e qelqit amorf është 2.20 g / cm 3 - më e ulët se ajo e të gjitha modifikimeve kristaline. Xhami kuarci ka një koeficient të lehtë të zgjerimit të temperaturës, prandaj përdoret për të përgatitur qelqe laboratorike rezistente ndaj ndryshimeve të papritura të temperaturës.
Të gjitha modifikimet e silicës në ujë janë praktikisht të pazgjidhshëm (në një temperaturë prej 25 ° C, tretshmëria e kuarcit është 7, cristobalite - 12, tridymite - 16, qelqi kuarc - 83 mg / l). Prandaj, në kushte normale, vetëm solucionet alkaline dhe acidet hidrofluorik veprojnë mbi to:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O. (2)
Reagimi i fundit përdoret në "gravurë" të qelqit.
Silicë e shtuar reagon me okside bazë, alkaline (reagim (1)) dhe karbonate për të formuar silikate:
SiO2 + CaO = SaaSiO3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2. (4)
Reaksionet (3) dhe (4) janë në bazë të prodhimit industrial të syzeve të ndryshme, si dhe të çimentos. Kështu, përbërja e xhamit të zakonshëm (për shembull, dritare, për prodhimin e enëve) shprehet me formulën Na2O. CaO. 6SiO 2. Gota e tillë prodhohet duke shkrirë një përzierje të sodës, rërës dhe gurit gëlqeror. Procesi kryhet në një temperaturë prej ~ 1400 ° C deri në heqjen e plotë të gazrave:
Na2CO3 + CaCO3 + 6SiO2 = Na2O. CaO. 6SiO2 + 2CO2.
Për nota të veçanta të qelqit - i panënshtruar, "i pathyeshëm" - kur të gatuani, shtoni oksidet e bariumit, plumbit, borit. Për të marrë syze me ngjyrë, futen edhe aditivë të ndryshëm, për shembull, shtimi i oksidit të kobaltit Co 2 O 3 jep një ngjyrë blu, oksid kromi Cr 2 O 3 - jeshil, dioksid mangani MnO 2 - rozë.
SiO 2 oksid është një anhidrid i një numri të acideve silicike, përbërja e të cilave mund të shprehet me formulën e përgjithshme xSiO 2 ∙ yH 2 O, ku x dhe y janë numra të plotë: 1) x = 1, y = 1: SiO 2. H 2 Oh, dmth. H 2 SiO 3 - meta-silikon acid; 1) x = 1, y = 2: SiO 2. 2H 2 O, dmth. acid ortosilikik; 1) x = 2, y = 1: 2SiO 2. H 2 Oh, dmth. H 2 Si 2 O 5 - bimeta silicic acid.
Acidet molekulat e të cilave përmbajnë më shumë se një molekulë SiO 2 i përkasin polisiliconit.
Acidet më të thjeshta silicike janë H2Si03, e cila shpesh quhet thjesht silic dhe kripërat e saj janë silikate. Nga silikatet, vetëm silikatat e natriumit dhe kaliumit janë të tretshëm në ujë, mbetjet e mbetura janë substanca refraktare, të pazgjidhura në ujë.
Zgjidhjet e silikateve rriten te turbullt kur gjenden ne ajri, pasi qe CO 2 qe permban ate zhvendos acidin silikik nga kriperat e tij (H2 SiO3 eshte me i dobet se acid karbonik, konstanta e disocializimit te H2SiO3 ne fazen e pare eshte e barabarte me K 1 = 2.2 10-10 ).
H 2 SiO 3 është praktikisht i pazgjidhshëm në ujë - kjo pronë është përdorur si një reagim cilësor për zbulimin e joneve silikate:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
Silikatet merren duke fiksuar SiO 2 me alkaline ose karbonate.
Solucionet e koncentruara të silikateve të natriumit dhe kaliumit quhen qelq i lëngshëm, ata kanë një reagim fuqishëm alkalik për faktin se ato janë shumë të hidrolizuara:
K 2 SiO 3 + H 2 O 2 KON + H 2 SiO 3 ↓.
Xhami i lëngët përdoret, për shembull, për prodhimin e ngjitësve, pëlhurave të papërshkueshme nga uji.
Çimentoja është shumë e përdorur gjerësisht në ndërtim si një lidhës, i cili kur përzihet me ujin fortësohet. Zakonisht, çimento prodhohet në furra të mëdha rrotulluese ku silikat të ndryshme janë të pjekura dhe të prera (në një temperaturë -1000 ° C).
Ekzistojnë disa lloje të çimentos, megjithatë, është e mundur të dallohen dy lloje të çimentos sipas parimit të "koagulimit" të tyre - çimentos së zakonshme dhe çimentos së Portlandit. Procesi i "caktimit" të çimentos konvencionale të përbërë nga silikat kalciumi, ndodh për shkak të formimit të karbonatit të kalciumit për shkak të dioksidit të karbonit në ajër:
CaO. Si02 + CO2 + H2O = CaCO3 ↓ + H2 SiO3 ↓.
Kur përcaktimi i çimentos Portland dioksidit të karbonit nuk është i përfshirë në proces, dhe hidroliza e silikateve ndodh me formimin e mëvonshëm të hidrateve të pazgjidhshme kristaline:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Karbide dhe silicide
· Komponimet e karbonit dhe silikonit me metale - karbidet dhe silicidet, përveç reaksioneve të konsideruara, merren gjithashtu nga bashkëveprimi i silikonit me hidridet metalike, për shembull:
· 2CaH 2 + Si = Ca 2 Si + 2H 2.
· Të gjitha këto reagime ndodhin në temperatura të larta. Në mesin e karbideve lëshojnë të ashtuquajturat "metanide" dhe "acetilene". E para konsiderohen si derivate të metanit që përmbajnë karbon në gjendje oksidimi -4 (Be 2 C, Al 4 C 3), e dyta - si derivatet e acetilenit me një shkallë të oksidimit të karbonit -1 (Li2C2, Ag2C2, Cu2C2 , CAC 2). Acetilidet e argjendit dhe bakrit (I) mund të merren lehtësisht duke kaluar acetilen përmes një zgjidhje amoniake të oksidit të argjendit ose bakrit (I) klorid. Shumica e methanideve dhe acetilideve reagojnë në mënyrë aktive me ujë (sidomos me acide), duke lëshuar hidrokarburet korresponduese:
· Саі 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag2C2 + 2HCl = 2AgCl ↓ + C2H2.
· Ndryshe nga karbidet, vetëm silicidet e metaleve alkaline ose alkaline-tokë ndërveprojnë me ujë dhe acide, duke prodhuar përbërësin më të thjeshtë të hidrogjenit silos monosilan, i cili shpesh quhet thjesht silan SiN 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4.
· Silani është një gaz i pangjyrë që ka erën e mykut, në mënyrë spontane të ndezshme në ajër, që digjet në SiO 2 dhe në ujë:
· SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· Alkalis shumë lehtë zbërthen silan nga ekuacioni:
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2,
· Uji gjithashtu hidrolizon silanin, por shumë më ngadalë:
· SiH 4 + 2H 2 O = SiO 2 + 4H 2.
· Kur ndizet mbi 400 ° C pa akses ajror, silani dekompozohet në silikon dhe hidrogjen (një nga metodat për prodhimin e silikonit):
· SiH 4 = Si + 2H 2.
· Përveç monosilanëve, janë gjithashtu të njohur edhe disilani Si 2 H 6, trisilani Si 3 H 8, tetrasilan Si 4 H 10, etj. Në shtetin individual, komponimet u izoluan vetëm deri në Si 6 H 14 përfshirëse. Të gjitha këto komponime i përkasin serisë homologe të silaneve, të cilave korrespondon formula e përgjithshme Si n H 2 n + 2. Si alkanët, silanët janë të pangjyrë, anëtarët e parë të serive homologe janë të gazta në kushte normale, në vijim janë lëngjet. Aktiviteti kimik i silaneve dhe hidrokarbureve është i ndryshëm: në kontrast me alkane mjaftueshëm inerte, silani të gjitha reaktive. Kjo është për shkak të afinitetit më të ulët silikoni për hidrogjenin në krahasim me karbonin dhe afinitetin shumë të lartë të silikonit për oksigjen. Për më tepër, lidhjet Si-Si janë më pak të qëndrueshme se sa obligacionet С-С. Në dallim nga lidhja C-H, lidhja Si-H ka një karakter më shumë jonik.
· Energjia e lidhjeve Si-E dhe CE.
· Forca e ulët e lidhjes Si-Si është për shkak të kufizimit të serive homologe të silaneve.
· Në mesin e karbideve dhe silicideve, një vend i veçantë zë karborundi SiC, i cili mund të quhet karabit silikoni dhe silicid karboni. Carborundum ka një pikë të lartë të shkrirjes për shkak të strukturës së tij si diamanti; ngurtësinë e saj është afër me atë të diamantit. Kimikisht, QS është shumë e qëndrueshme.
· Koncepti i zgjidhjeve kolloidale
Në natyrë dhe teknologji shpesh gjenden sisteme të shpërndara në të cilat një substancë shpërndahet në mënyrë të barabartë si grimca brenda një substance tjetër.
Në sistemet e shpërndara, ekziston një fazë e shpërndarë - një substancë e ndarë e imët dhe një medium shpërndarës - një substancë homogjene në të cilën shpërndahet faza e shpërndarë. Sistemet shpërndarëse përfshijnë zgjidhje të zakonshme (të vërteta), zgjidhje koloidale, si dhe pezullime dhe emulsione. Ato ndryshojnë nga njëri-tjetri kryesisht në madhësi të grimcave, dmth. Shkalla e shpërndarjes (fragmentimit).
Sistemet me madhësi të grimcave më të vogël se 1 nm janë zgjidhjet e vërteta që përbëhen nga molekulat solucion ose jonet. Ato duhet të konsiderohen si një sistem me një fazë. Sistemet me madhësi të grimcave më të mëdha se 100 nm janë sisteme me trashësi të shpërndara - pezullime dhe emulsira.
Pezullimet janë sisteme të shpërndara në të cilat faza e shpërndarë është e ngurtë dhe mesatarja e shpërndarjes është një lëng, dhe ngurta është praktikisht i pazgjidhshëm në lëng.
Emulsione janë sisteme të shpërndara në të cilat si faza e shpërndarë ashtu edhe mesatarja e shpërndarjes janë lëngje që nuk janë reciprokisht të përzier. Një shembull i një emulsioni është qumështi, në të cilin topa të vogla të yndyrës lundrojnë në një lëng.
Pezullimet dhe emulatimet janë sisteme dyfazësh.
Zgjidhjet kolloidale janë sisteme me dy faza shumë të shpërndara, të përbërë nga një medium dispersion dhe një fazë e shpërndarë, dhe dimensionet lineare të grimcave të fundit qëndrojnë në intervalin 1 deri në 100 nm. Siç mund të shihet, zgjidhjet kolloidale sipas madhësisë së grimcave janë ndërmjetëse midis zgjidhjeve të vërteta dhe pezullimeve dhe emulsioneve. Grimcat kolloidale zakonisht përbëhen nga një numër i madh i molekulave ose i joneve.
Zgjidhjet kolloidale quhen gjithashtu sols. Ato përftohen nga metodat e shpërndarjes dhe kondensimit. Shpërbërja kryhet më shpesh duke përdorur "mullinj colloid" të veçantë. Në metodën e kondensimit, grimcat kolloidale formohen duke kombinuar atomet ose molekula në agregate. Gjatë rrjedhës së shumë reaksioneve kimike, ndodh kondensimi dhe formohen sisteme shumë të shpërndara (reshjet, hidroliza, reagimet e reduktimit të oksidimit, etj.).
1 nm - nanometer (1 nm = 10 -9 m).
Në kontrast me zgjidhjet e vërteta, sinds karakterizohen nga efekti Tyndall, dmth. Shpërndarja e dritës nga grimcat kolloidale. Kur një kon të lehta del përmes një rreze të dritës, ajo shfaqet në një dhomë të errët. 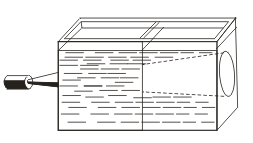 . Kështu që ju mund të njihni nëse kjo zgjidhje është koloidale apo e vërtetë.
. Kështu që ju mund të njihni nëse kjo zgjidhje është koloidale apo e vërtetë.
Një nga vetitë e rëndësishme të sols është se grimcat e tyre kanë akuza elektrike të së njëjtës shenjë. Për shkak të kësaj, ato nuk bashkohen në grimca më të mëdha dhe nuk precipitojnë. Në të njëjtën kohë, grimcat e disa soleve, për shembull, metalet, sulfidet, silikat dhe acidet e kallajit, kanë një ngarkesë negative, ndërsa të tjerët, për shembull hidroksidet, oksidet metalike, kanë një pagesë pozitive. Shfaqja e një ngarkese shpjegohet nga adsorpimi i joneve nga zgjidhja me grimca kolloidale.
Për të precipituar një sol, është e nevojshme që grimcat e tij të bashkohen në agregate më të mëdha. Kombinimi i grimcave në agregate më të mëdha quhet koagulim, dhe sedimentimi i tyre nën ndikimin e gravitetit quhet sedimentimi.
Zakonisht koagulimi ndodh kur shtimi i soleve: 1) elektrolit, 2) një tjetër sol, grimcat e të cilit kanë një ngarkesë të kundërt dhe 3) kur nxehet.
