Squfur. Sulfid hidrogjeni dhe sulfide
4.doc
240Squfur. Sulfide hidrogjeni, sulfide, hidrosulfide. Oksidet e squfurit (IV) dhe (VI). Acid sulfurik dhe acid sulfurik dhe kripërat e tyre. Esteret e acidit sulfurik. Thiosulfate natriumi
4.1. squfuri
Squfuri është një nga elementet e pakta kimike që njerëzit kanë përdorur për disa mijëvjeçarë. Ajo është e shpërndarë gjerësisht në natyrë dhe gjendet si në shtetin e lirë (squfurit vendas) dhe në komponimet. Mineralet që përmbajnë squfur mund të ndahen në dy grupe - sulfide (pirit, glitter, dummy) dhe sulfate. Squfuri amtare gjendet në sasi të mëdha në Itali (Sicili Island) dhe SHBA. Në CIS, depozitat natyrore të squfurit gjenden në rajonin e Vollgës, në shtetet e Azisë Qendrore, në Krime dhe zona të tjera.
Mineralet e grupit të parë përfshijnë shndritjen e plumbit PbS, shndrit bakri Cu 2 S, shkëlqim argjendi - Ag 2 S, pengesë zinku - ZnS, pengesë kadmiumi - CdS, pirite ose hekuri pirit - FeS 2, kalkopyrite - CuFeS 2, cinabar - HgS.
Mineralet e grupit të dytë përfshijnë gipsi CaSO 4 2H 2 O, mirabilite (kripë Glauber) - Na 2 SO 4 10H 2 O, dhe kizerite - MgSO 4 H 2 O.
Sulmi gjendet në kafshë dhe bimë, si pjesë e molekulave të proteinave. Komponimet organike të squfurit gjenden në naftë.
pritje
1. Kur squfuri nxirret nga komponimet natyrale, për shembull, nga squfuri pyrit, nxehet në temperatura të larta. Sulfuri pirit dekompozohet për të formuar hekur (II) sulfide dhe squfur:
2. Squfuri mund të merret me oksidimin e sulfidit të hidrogjenit nga mungesa e oksigjenit nga reaksioni:
2H 2 S O 2 = 2S 2H 2 O
3. Sot, rikuperimi i squfurit nga reduktimi i dioksidit të karbonit të dioksidit të squfurit SO 2 është një nënprodukt i zakonshëm në shkrirjen e metaleve nga mineralet e squfurit:
SO 2 C = CO 2 S
4. Gazrat e mbeturinave të furrave metalurgjike dhe të koksit përmbajnë një përzierje të dyoksidit të squfurit dhe sulfidit të hidrogjenit. Kjo përzierje kalon në një temperaturë të lartë mbi katalizatorin:
H2S SO2 = 2H2O3S
^ Vetitë fizike
Squfuri është një ngjyrë e verdhë e fortë dhe e brishtë e limonit. Është praktikisht i pazgjidhshëm në ujë, por mirë i tretshëm në anilin CS 2 në disulfid karboni dhe disa tretës të tjerë.
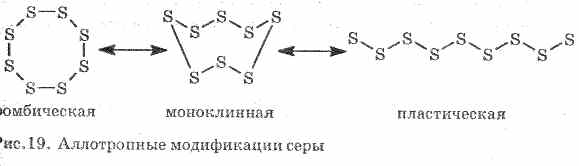
I varfër kryen ngrohje dhe rrymë elektrike. Squfur formon disa modifikime allotropic:
1 . ^ Sulfuri Rhombic (më të qëndrueshme), kristalet kanë formën e oktaedrës.
Kur squfuri nxehet, ngjyra dhe viskoziteti ndryshojnë: së pari, formohet drita e verdhë dhe më pas, kur temperatura rritet, errësohet dhe bëhet aq e trashë sa që nuk rrjedh nga tubi, me ngrohje të mëtejshme, viskoziteti bie përsëri dhe në 444, 6 ° S squfuri vlon .
2. ^ Squfuri monoklinik - modifikimi në formë të gjilpëve të verdhë të errët, të fituara nga ngadalësimi i ngopjes së squfurit të shkrirë.
3. Squfur plastikformohet nëse squfuri i nxehtë në valë derdhet në ujë të ftohtë. Shtrirë lehtësisht si gome (shih figurën 19).
Squfuri natyror përbëhet nga një përzierje e katër izotopeve të qëndrueshme: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Vetitë kimike
Një atom sulfur, që ka një nivel të jashtëm të energjisë të papërfunduar, mund të bashkojë dy elektronet dhe të shfaqë një diplomë
Oksidimi -2. Sulmi shfaq një gjendje oksidimi të tillë në komponimet me metale dhe hidrogjen (Na 2 S, H 2 S). Kur rrebeshi ose sosje e elektroneve tek atomi i elementit më elektronegativ, shkalla e oksidimit të squfurit mund të jetë 2, 4, 6.
Squfuri është relativisht inerte në të ftohtë, por me rritje të temperaturës, reaktiviteti i saj rritet. 1. Me metale, squfuri shfaq vetitë e oksidimit. Kur këto reagime formojnë sulfide (me ari, platini dhe iridiumi nuk reagojnë): Fe S = FeS
2. Në kushte normale, squfuri nuk reagon me hidrogjen, dhe në 150-200 ° C ndodh një reaksion i kthyeshëm:
3. Në reagimet me metale dhe me hidrogjen, squfuri sillet si një agjent tipik oksidues dhe në prani të agjentëve të fortë oksidues shfaq uljen e vetive.
S 3F 2 = SF 6 (nuk reagon me jod)
4. Djegija e squfurit në oksigjen vazhdon në 280 ° C, dhe në ajër në 360 ° C. Kjo formon një përzierje të SO 2 dhe SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Kur nxehet pa ajër, squfuri direkt kombinon me fosfor, karbon, duke treguar vetitë oksiduese:
2P 3S = P 2 S 3 2S C = CS 2
6. Kur ndërveprojnë me substanca komplekse, squfuri sillet kryesisht si agjent reduktues:
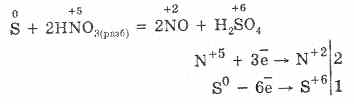
7. Squfuri është i aftë për reagime në disproporcionim. Pra, kur vlon pluhur squfuri me alkal, sulfites dhe sulfides janë formuar:
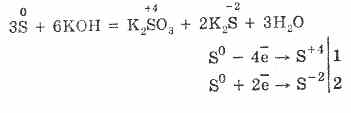
kërkesë
Sulmi përdoret gjerësisht në industri dhe bujqësi. Rreth gjysma e prodhimit të saj konsumohet për të prodhuar acid sulfurik. Sulmi përdoret për vulcanizimin e gomës: në këtë rast, goma konvertohet në gome.
Në formën e squfurit (gjobë pluhur) squfuri përdoret për të luftuar sëmundjet e vreshtit dhe pambukut. Përdoret për të marrë barut, ndeshje, kompozime të shkëlqyera. Në mjekësi, përgatitur vaj squfur për trajtimin e sëmundjeve të lëkurës.
4.2. Sulfide hidrogjeni, sulfide, hidrosulfide
Sulfuri i hidrogjenit është një analog i ujit. Formula e saj elektronike
Ajo tregon se dy p-elektronet e nivelit të jashtëm të atomit të squfurit janë përfshirë në formimin e lidhjeve H-S-H. H 2 S molekula ka një formë këndore, kështu që është polare.
^ Të jesh në natyrë
Sulfidi i hidrogjenit gjendet në natyrë në gazra vullkanike dhe në ujërat e disa burimeve minerale, si Pyatigorsk, Matsesta. Ajo formohet nga prishja e substancave organike që përmbajnë squfur nga mbetjet e kafshëve dhe bimëve të ndryshme. Kjo shpjegon aromën karakteristike të pakëndshme të ujërave të zeza, gropave dhe deponive.
pritje
1. Sulfuri i hidrogjenit mund të merret nga lidhja e drejtpërdrejtë e squfurit me hidrogjenin me ngrohje:
2. Por zakonisht arrihet nëpërmjet veprimit të acidit të holluar hidroklorik ose sulfurik në hekur (III) sulfide:
2HCl FeS = FeCl2H2S2 2H FeS = Fe2H2S Ky reaksion shpesh kryhet në aparatin Kipp.
^ Vetitë fizike
Nën kushte normale, sulfidi i hidrogjenit është një gaz i pangjyrë me një erë të fortë karakteristike të vezëve të kalbura. Shumë helmues, inhalimi lidhet me hemoglobinën, duke shkaktuar paralizë, e cila është e sëmurë.
Ko çon në vdekje. Në përqëndrime të ulëta, më pak të rrezikshme. Është e nevojshme të punohet me të në kabinete shkarkimi ose me pajisje të mbyllura hermetikisht. Përmbajtja e lejuar e H 2 S në ambientet e prodhimit është 0.01 mg për 1 litër ajri.
Sulfuri i hidrogjenit është relativisht mirë i tretshëm në ujë (në 20 ° С 2.5 vëllime të sulfidit të hidrogjenit të shpërndarë në 1 vëllim uji).
Një zgjidhje e sulfidit të hidrogjenit në ujë quhet ujë sulfid hidrogjeni ose acid sulfid hidrogjeni (ai zbulon vetitë e një acidi të dobët).
^ Vetitë kimike
1, Kur nxehet fuqishëm, sulfidi hidrogjen pothuajse plotësisht dekompozohet për të formuar squfur dhe hidrogjen.
2. Sulfuri i gaztë hidrogjen djeg në ajër me një flakë blu me formimin e oksidit të squfurit (IV) dhe ujit:
2H 2 S 3O 2 = 2SO 2 2H 2 O
Me mungesën e oksigjenit formohen squfuri dhe uji: 2H 2 S O 2 = 2S 2H 2 O
3. Sulfidi i hidrogjenit është një agjent reduktues mjaft i fortë. Kjo pronë kimike e rëndësishme mund të shpjegohet si më poshtë. Në një zgjidhje të H 2 S, është relativisht e lehtë për të dhuruar elektronet në molekulat e ajrit të oksigjenit:
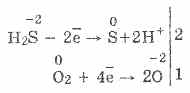
Në të njëjtën kohë, oksigjeni në ajër oxidizes sulfide hidrogjenit në squfur, e cila e bën ujin sulfid hidrogjen turbullt:
2H 2 S O 2 = 2 S 2 H 2 O
Kjo shpjegon faktin se sulfidi i hidrogjenit nuk grumbullohet në sasi shumë të mëdha në natyrë, kur materia organike decays - oksigjen nga ajri oksidohet atë në squfur të lirë.
4, sulfuri hidrogjeni reagon fuqishëm me solucione halogjene, për shembull:
H 2 S I 2 = 2HI S Sulfuri çlirohet dhe zgjidhja e jodit bëhet e zbardhur.
5. oksiduesit e ndryshëm reagojnë fuqishëm me sulfid hidrogjeni: nën veprimin e acidit nitrik, formohet squfuri i lirë.
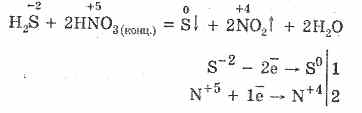
6. Një zgjidhje e sulfidit të hidrogjenit është acid për shkak të shkëputjes:
H 2 SÞH HS - HS - ↔H S -2
Faza e parë zakonisht mbizotëron. Është një acid shumë i dobët: më i dobët se acid i qymyrit, i cili zakonisht zhvendos H2S nga sulfatet.
Sulfide dhe hidrosulfide
Acidi hydrofluoric, si një dibasic, formon dy rreshta të kripërave:
Mesme - sulfide (Na2S);
Kosi - hidrosulfide (NaHS).
Këto kripëra mund të merren: nga bashkëveprimi i hidroksideve me sulfid hidrogjeni: 2NaOHH 2 S = Na2S2H2O
Ndërveprimi i drejtpërdrejtë i squfurit me metalet:
Reagimi i shkëmbimit të kripërave me H2S ose ndërmjet kripërave:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuSH H 2 SO 4 Cu 2 H 2 S = CuS 2H
Hidrosulfidet janë pothuajse të gjitha të tretshëm në ujë.
Sulfidet e metaleve alkali dhe toka alkaline janë lehtësisht të tretshëm në ujë, pa ngjyrë.
Sulfidet e metaleve të rënda janë praktikisht të pazgjidhshëm ose pak të tretshëm në ujë (FeS, MnS, ZnS); Disa prej tyre nuk shpërndahen në acide të holluara (CuS, PbS, HgS).
Si kripëra të një acidi të dobët, sulfidet në tretësirat ujore janë shumë të hidrolizuara. Për shembull, sulfidet e metalit alkali, kur shpërndahen në ujë, kanë një reaksion alkalik:
Na 2 S NaOH NaN NaOH
Të gjitha sulfatet, si sulfidi i hidrogjenit vetë, janë agjentë reduktues të fuqishëm:
3PbS -2 8HN 5 O 3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
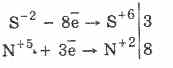
Disa sulfide kanë një ngjyrë karakteristike: CuS dhe PbS - e zezë, CdS - e verdhë, ZnS - e bardhë, MnS - e kuqe, SnS - kafe, Al 2 S 3 - portokalli. Analiza cilësore e kationeve bazohet në tretshmërinë e ndryshme të sulfideve dhe ngjyrave të ndryshme të shumë prej tyre.
^ 4.3. Oksid squfuri (IV) dhe acid sulfurik
Oksidi i squfurit (IV), ose dioksidi i squfurit, në kushte normale, është një gaz i pangjyrë me një erë të mprehta mbytëse. Kur ftohet në -10 ° C, liquefies në një lëng të pangjyrë.
pritje
1. Në kushte laboratorike, oksidi i squfurit (IV) merret nga kripërat e acidit sulfuroz të veprimit të acideve të forta në to:
Na2S03H2SO4 = Na2SO4S02H2O2NaHSO3H2SO4 = Na2SO4SO2H2O2HSO3HH2SO2H2O2H2SO2H2O2SO2H2SO2H2O2SO4H2O2H2O2SO2H2O2H2O2SO2H2O2H2O2SO2H2O2
2. Gjithashtu dioksidi i squfurit formohet nga bashkëveprimi i acidit sulfurik të koncentruar kur nxehet me metale të ulëta aktive:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. Oksidi i squfurit (IV) formohet gjithashtu kur squfuri digjet në ajër ose në oksigjen:
4. Në kushte industriale, SO 2 është marrë nga piritimi i pirit me FeS 2 ose xeherorët e squfurit të metaleve me ngjyra (zinku i ZnS, plumbit PbS, etj.):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Formula strukturore e molekulës SO 2:
Katër atome squfuri dhe katër elektrone nga dy atome oksigjeni marrin pjesë në formimin e lidhjeve në molekulën SO 2. Ndërhyrja reciproke e çifteve elektronike të lidhjes dhe çifti i vetmuar elektron i squfurit i jep molekulës një formë këndore.
Vetitë kimike
1. Oksidi i squfurit (IV) shfaq të gjitha vetitë e oksideve të acidit:
Ndërveprimi i ujit
Ndërveprimi me alkalet
Ndërveprimi me oksidet bazë.
2. Oksidi i squfurit (IV) karakterizohet nga reduktimi i vetive:
S 4 O 2 O 0 2 2S 6 O -2 3 (në prani të një katalizatori, kur nxehet)
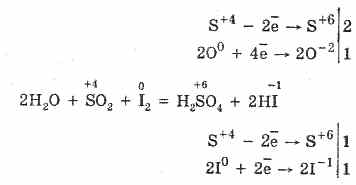
Por në prani të agjentëve reduktues të fortë, SO 2 sillet si një agjent oksidues:
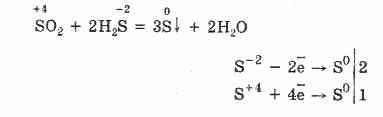
Dyfisni i redoksit të oksidit të squfurit (IV) shpjegohet me faktin se squfuri ka një gjendje oksidimi prej 4 në atë dhe për këtë arsye mund të heqë dorë nga 2 elektronet, të oksidohet në S 6 dhe duke marrë 4 elektron, ai mund të reduktohet në S °. Shfaqja e këtyre ose e pronave të tjera varet nga natyra e komponentit reaktiv.
Sulfuri oksid (IV) është shumë i tretshëm në ujë (40 vëllime të SO 2 të shpërndarë në 1 vëllim në 20 ° С). Në këtë rast, formohet acid acid sulfuroz ekzistues vetëm në solucion ujor:
SO 2 H 2 O, OH 2 SO 3
Reagimi është i kthyeshëm. Në zgjidhjen ujore, oksidi i squfurit (IV) dhe acid sulfurosor janë në ekuilibër kimik, të cilat mund të zhvendosen. Me lidhjen e H2SO3 (neutralizimi i acidit
Ju) reagimi vazhdon në drejtim të formimit të acidit sulfuroz; kur hiqet SO 2 (defekt me një zgjidhje të azotit ose ngrohjes), reagimi vazhdon drejt materialeve fillestare. Zgjidhja e acidit sulfurik përmban gjithmonë oksid squfuri (IV), i cili i jep një erë të mprehtë.
Acidi sulfurik ka të gjitha vetitë e acideve. Në zgjidhje ajo dissociates në hapa:
H 2 SO 3 ↔ HSO - 3 HSO - 3 ↔H SO 2- 3
Termikisht e paqëndrueshme, e paqëndrueshme. Acidi sulfurik, si dibazi, formon dy lloje të kripërave:
Sulmet e mesme (Na2S03);
Kosi - hidrosulfit (NaHS03).
Sulfite formohen kur alkali neutralizohet plotësisht nga acidi:
H2SO3 2NaOH = Na2S03H2O
Hydrosulphites janë marrë me një mungesë të alkali:
H2SO3 NaOH = NaHSO3H2O
Acidi sulfurik dhe kripërat e tij posedojnë si vetitë oksiduese ashtu edhe reduktuese, të cilat përcaktohen nga natyra e partnerit të reagimit.
1. Pra, nën veprimin e sulfites oksigjenit janë oksiduar në sulfate:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
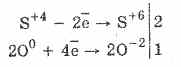
Sulfuroks acid oxidation nga bromine dhe permanganat kalium vazhdon edhe më lehtë:
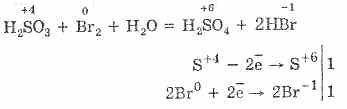
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
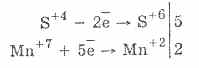
2. Në praninë e agjentëve reduktues më të fuqishëm, sulmet shfaqin vetitë oksiduese:
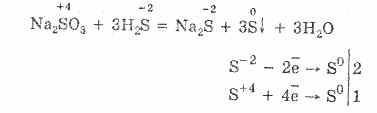
Pothuajse të gjitha hydrosulphites dhe sulphites alkali metalike shpërndarë nga kripërat e acidit sulfurous.
3. Meqë H2SO3 është një acid i dobët, veprimi i acideve në sulfite dhe hydrosulfites rezulton në lirimin e SO 2. Kjo metodë përdoret zakonisht kur merret SO 2 në kushte laboratorike:
NaHSO3H2SO4 = Na2SO4SO2H2O
4. Sulfitet e tretshme në ujë janë lehtësisht nën hidrolizë, si rezultat i të cilave rritet përqendrimi i joneve OH në zgjidhje:
Na 2 SO 3 NONgjithaNSO 3 NaOH
kërkesë
Sulfur oksid (IV) dhe acid sulfurous njollos shumë ngjyra, duke formuar me ta përbërje të pangjyrë. Kjo e fundit mund të shpërbëhet përsëri kur të nxehet ose në dritë, si rezultat i së cilës ngjyri është restauruar. Prandaj, efekti zbardhues i SO 2 dhe H 2 SO 3 është i ndryshëm nga efektet zbardhuese të klorit. Zakonisht, squfuri (IV) rxid zbardh leshin, mëndafshin dhe kashtën.
Oksidi i squfurit (IV) vret shumë mikroorganizma. Prandaj, për të shkatërruar kërpudhat myk, ata fumigate bodrumet e papërpunuara, bodrume, fuçi verë, etj Ajo është përdorur edhe në transportin dhe ruajtjen e frutave dhe manave. Në sasi të mëdha, oksidi i squfurit IV) përdoret për të prodhuar acid sulfurik.
Një aplikim i rëndësishëm është zgjidhja e kalciumit hydrosulfite CaHSO 3 (solfit sulfur), i cili përdoret për të trajtuar drurin dhe pulpë letre.
^ 4.4. Oksid squfuri (VI). Acidi sulfurik
Oksidi i squfurit (VI) (shih tabelën 20) është një lëng i pangjyrë që solidifikohet në një temperaturë prej 16.8 ° С në një masë të ngurtë kristaline. Thith lagështi shumë fuqishëm, duke formuar acid sulfurik: SO 3 H 2 O = H 2 SO 4
Tabela 20. Prona të oksideve të squfurit
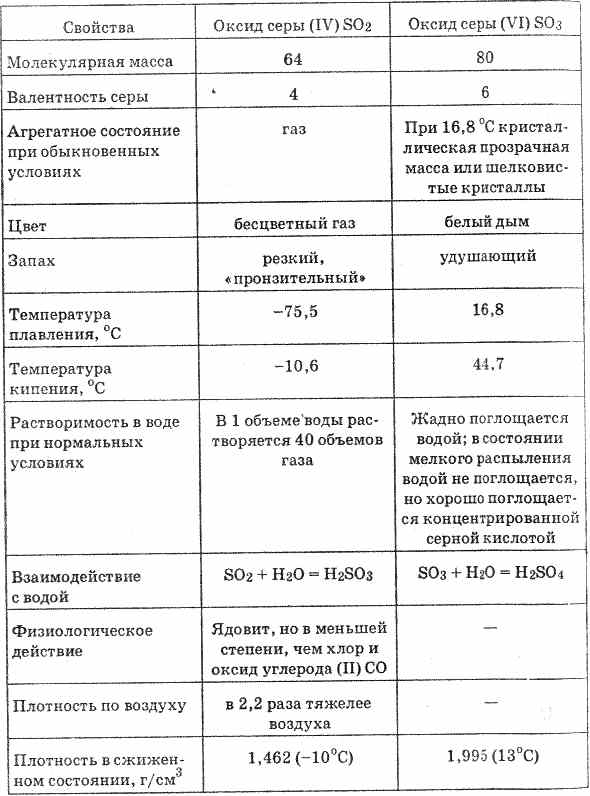
Shpërndarja e oksideve të squfurit (VI) në ujë shoqërohet me lëshimin e një sasi të konsiderueshme të nxehtësisë.
Sulfuri oksid (VI) është shumë i tretshëm në acid sulfurik të koncentruar. Një zgjidhje e SO 3 në një acid anhydrous quhet oleum. Oleum mund të përmbajë deri në 70% SO 3.
pritje
1. Oksidi i squfurit (VI) përftohet nga oksidimi i dioksidit të squfurit me oksigjen në praninë e katalizatorëve në një temperaturë prej 450 ° C (shih Prodhimi i acidit sulfurik):
2SO2O2 = 2SO3
2. Një tjetër mënyrë për të oksiduar SO 2 në SO 3 është përdorimi i oksidit nitrik (IV) si një agjent oksidues:
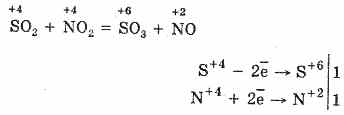
Oksidi nitrik i rezultuar (II) kur ndërvepron me oksigjen atmosferik lehtë dhe shpejt kthehet në oksid nitrik (IV): 2NO O 2 = 2NO 2
E cila përsëri mund të përdoret në oksidimin e SO 2. Prandaj, NO 2 vepron si një transportues oksigjeni. Kjo metodë e oksidimit të SO 2 në SO 3 quhet azotuar. Molekula e SO 3 ka formën e një trekëndëshi, në qendër të të cilit
Atomi i squfurit ndodhet:
Një strukturë e tillë është për shkak të ndërhyrjes së ndërsjellë të çifteve elektron të lidhjes. Një atom sulfur ka dhënë gjashtë elektrone të jashtëm për formimin e tyre.
Vetitë kimike
1. SO 3 - oksid tipik acid.
2. Oksidi i squfurit (VI) ka vetitë e një agjenti të fortë oksidues.
kërkesë
Oksidi i squfurit (VI) përdoret për të prodhuar acid sulfurik. Më e rëndësishmja është mënyra e kontaktit e marrjes
Acidi sulfurik. Me këtë metodë, ju mund të merrni H2SO4 të çdo përqendrimi, si dhe oleum. Procesi përbëhet nga tri faza: marrja e SO 2; oksidimi i SO2 në SO3; marrja e H2SO4.
SO 2 është marrë nga djegia e piritit FeS 2 në furra të veçanta: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Për të përshpejtuar pjekjen, pirit është para-tokë, dhe për djegie më të plotë nga squfuri, në mënyrë të konsiderueshme më shumë ajër (oksigjen) është injektuar sesa kërkohet nga reagimi. Gazi që largohet nga furra përbëhet nga oksidi i squfurit (IV), oksigjeni, azoti, komponimet e arsenikut (nga papastërtitë në pirate) dhe avujt e ujit. Ajo quhet gaz i pjekjes.
Gaz i pjekur i nënshtrohet pastrimit të plotë, pasi edhe një përmbajtje e vogël e komponimeve arsenike, si dhe pluhuri dhe lagështia, helmojnë katalizatorin. Gazi pastrohet nga komponimet e arsenikut dhe pluhuri, duke kaluar përmes precipituesve të veçantë elektrostatik dhe një kullë larjeje; lagështia absorbohet nga acidi sulfurik i koncentruar në një kullë tharje. Gazi i pastruar që përmban oksigjen është ndezur në një shkëmbyes nxehtësie deri në 450 ° C dhe hyn në aparatin e kontaktit. Brenda aparatit të kontaktit janë raftet e grilave të mbushura me katalizator.
Më parë, platin metalik i grimcuar imët u përdor si katalizator. Më pas, ajo u zëvendësua nga komponimet e vanadit - oksidi i vanadit (V) V2 O5 ose vanadil sulfat VOSO 4, i cili është më i lirë se platini dhe më ngadalë helmohet.
Reaksioni i oksidimit të SO 2 në SO 3 është i kthyeshëm:
2SO2O2SO2
Një rritje në përmbajtjen e oksigjenit në gazin e kalçinimit rrit prodhimin e oksidit të squfurit (VI): në një temperaturë prej 450 ° C, zakonisht arrin 95% ose më shumë.
Oksidi sulfurik i formuar (VI) është ushqyer me anë të një metode kundra rrymës në një kullë absorbimi, ku absorbohet nga acidi sulfurik i koncentruar. Siç ngopet, formon forma e parë e acidit sulfurik anhidrid, dhe pastaj është oleum. Në të ardhmen, oleumi është i holluar në 98% acid sulfurik dhe u shpërndahet konsumatorëve.
Formula strukturore e acidit sulfurik:
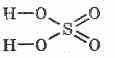
^ Vetitë fizike
Acidi sulfurik është një lëng i rëndë, pa ngjyrë, me vaj që kristalizohet në 10.4 ° C, gati dyfish ( = 1.83 g / cm 3) është më e rëndë se uji, pa erë, pa gjak. Jashtëzakonisht higroskopike. Lagështia thith me lëshimin e sasive të mëdha të nxehtësisë, kështu që ju nuk mund të derdhni ujë në acid sulfurik të koncentruar - do të ketë një spërkatje të acidit. Për
Acidi sulfurik duhet të shtohet në ujë në pjesë të vogla.
Acidi sulfurik anhidor shkrin deri në 70% të oksidit të squfurit (VI). Kur nxehet, ajo heq SO 3 derisa të formohet një zgjidhje me një fraksion masiv të H2SO4 prej 98.3%. Anhydrous H 2 SO 4 pothuajse nuk kryen rrymë elektrike.
^ Vetitë kimike
1. Përzihet me ujë në çdo përmasë dhe formon hidratet me përbërje të ndryshme:
H2SO4H2O, H2SO4H2O, H2SO4H2O, H2S04 4H2O, H2SO4, 6,5 H 2 O
2. Acidi sulfurik i koncentruar karbonizon materien organike - sheqer, letër, dru, fibër, largimin e elementeve të ujit:
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
Qymyr i formuar pjesërisht ndërvepron me acid:
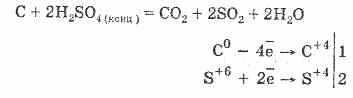
Dehidrimi i gazit bazohet në thithjen e ujit nga acidi sulfurik.
Si një acid i fortë jo i paqëndrueshëm, H2SO4 zhvendos acide të tjera nga kripërat e thata:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Megjithatë, nëse H2SO4 shtohet në solucionet e kripës, nuk ndodh zhvendosja e acidit.
H 2 SO 4 - acid i fortë dibazik: H 2 SO 4 ↔ HSO - 4 HSO - 4 ↔H SO 2- 4
Ka të gjitha vetitë e acideve të fortë të paqëndrueshme.
Acidi sulfurik i holluar karakterizohet nga të gjitha vetitë e acideve jo oksidues. Gjegjësisht: ndërvepron me metale që janë në serinë elektrokimiale të tensionit të metaleve deri në hidrogjen:
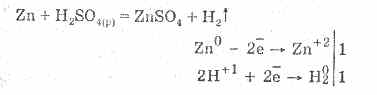
Ndërveprimi me metalet është për shkak të reduktimit të joneve të hidrogjenit.
6. Acidi sulfurik i koncentruar është një agjent oksidimi energjik. Kur nxehet, oxidizes shumica e metaleve, duke përfshirë ato në seri elektrokimike e streseve pas hidrogjenit, nuk reagon vetëm me platin dhe ari. Varësisht nga aktiviteti i metalit, produktet e reduktimit mund të jenë S -2, S ° dhe S 4.
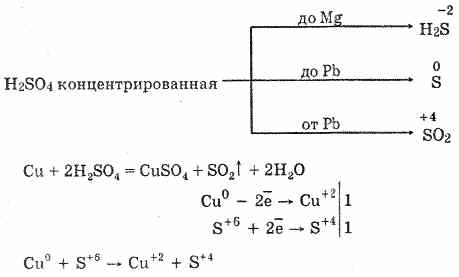
Në të ftohtë, acid sulfurik i koncentruar nuk ndërvepron me metale të forta si alumini, hekuri dhe kromi. Kjo është për shkak të pasivimit të metaleve. Kjo veçori përdoret gjerësisht kur transportohet në një enë hekuri.
Megjithatë, kur nxehet:
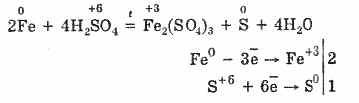
Kështu, acid sulfurik i koncentruar ndërvepron me metale për shkak të reduktimit të atomeve formues të acidit.
Reaksioni cilësor ndaj jonit të sulfatit SO 2-4 është formimi i një precipitati të bardhë kristalor të BaSO4, i pazgjidhshëm në ujë dhe në acide:
SO 2- 4 Ba 2 BaSO 4
kërkesë
Acidi sulfurik është produkti më i rëndësishëm i industrisë kimike kryesore të angazhuar në prodhimin e produkteve jo-
Acidet organike, alkalet, kripërat, plehrat minerale dhe klori.
Për një sërë aplikacionesh acid sulfurik renditet i pari në mesin e acideve. Shuma më e madhe e tij konsumohet për të marrë plehra fosfat dhe azot. Duke qenë jo i paqëndrueshëm, acidi sulfurik përdoret për prodhimin e acideve të tjera - hidroklorik, hidrofluorik, fosforik dhe acetik.
Shumë prej tyre shkon për pastrimin e produkteve të naftës - benzinë, vajguri, vajra lubrifikuese - nga papastërtitë e dëmshme. Në inxhinieri mekanike, acidi sulfurik pastron sipërfaqen metalike nga oksidet para shtresës (nikel plating, krom plating, etj). Acidi sulfurik përdoret në prodhimin e eksplozivëve, fibrave artificiale, ngjyrave, plastikës dhe shumë të tjerave. Përdoret për të mbushur bateritë.
Kripërat e acidit sulfurik janë të rëndësishme.
^ Sulfat natriumiNa 2 SO 4 kristalizohet nga solucionet ujore në formën e një hidrati të Na 2 SO 4 10H 2 O, i cili quhet kripë Glauber. Përdoret në mjekësi si laksativ. Sulfat natriumi anhidri përdoret në prodhimin e sodës dhe qelqit.
^ Sulfat amoni(NH 4) 2 SO 4 - pleh nitrogjeni.
Sulfat i kaliumitK 2 SO 4 - pleh potasiumi.
Sulfat kalciumi CaSO 4 gjendet në natyrë në formën e mineralit të gipsit CaSO 4 2H 2 O. Kur nxehet në 150 ° C, humbet pak nga uji dhe shkon në një hidrat 2CaSO 4 H 2 O, të quajtur gips djegur ose alabastër. Kur të përzihet me ujë në një masë të pastë, alabastri përkeqësohet pas njëfarë kohe, duke u kthyer në CaSO 4 2H 2 O. Gipsi përdoret gjerësisht në ndërtim (suva).
Sulfat magnezMgSO 4 gjendet në ujin e detit, duke shkaktuar shijen e saj të hidhur. Hidrat kristalor, i quajtur kripë e hidhur, përdoret si laksativ.
sarkazëm- emri teknik i hidrateve kristalike të sulfateve metalike Fe, Cu, Zn, Ni, Co (kripërat e dehidratuara nuk janë vitriale). Sulfat bakriCuSO 4 5H 2 O është një substancë toksike blu. Bimët janë mbuluar me një zgjidhje të holluar dhe fara mbillen para mbjelljes. Hekuri i qelqtëFeSO 4 7H 2 O është një substancë e lehtë e gjelbër. Përdoret për të kontrolluar dëmtuesit e bimëve, ngjyrave, ngjyrave minerale etj. Sulfat i zinkutZnSO 4 7H 2 O përdoret në prodhimin e bojërave minerale, në sittoprechatanii, mjekësi.
^ 4.5. Esteret e acidit sulfurik. Thiosulfate natriumi
Ekstrat e acidit sulfurik përfshijnë dialkil sulfatet (RO 2) SO 2. Këto janë lëngje të valë të lartë; më i ulët i tretshëm në ujë; në prani të alkalit, alkoolit dhe kripërat e acidit sulfurik formohen. Sulfatet dialkil të ulëta janë agjentët alkilues.
Dietil sulfat(C2H5) 2SO4. Pika e shkrirjes -26 ° С, pika vlimi 210 ° С, i tretshëm në alkool, i pazgjidhshëm në ujë. E fituar nga reagimi i acidit sulfurik me etanol. A është agjent etilizimi në sintezën organike. Penetron lëkurën.
Sulfat dimetil(CH3) 2SO4. Pika e shkrirjes -26.8 ° С, pika vlimi 188.5 ° С. I tretshëm në alkool, i keq - në ujë. Reagimet me amoniak në mungesë të tretësit (me një shpërthim); Squfur disa komponime aromatike, të tilla si esteret fenol. Ajo është marrë nga ndërveprimi i 60% oleum me metanol në 150 ° С. Është një agjent methylating në sintezën organike. Kancerogjene, ndikon në sytë, lëkurën, organet e frymëmarrjes.
^ Thiosulfate natriumi Na 2 S 2 O 3
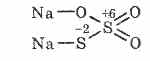
Kripë e acidit thiosulfurik në të cilin dy atome squfuri kanë gjendje të ndryshme oksidimi: 6 dhe -2. Substanca kristaline, e tretur mirë në ujë. E disponueshme në formën e kristaltë Na 2 S 2 O 3 5H 2 O, zakonisht të referuara si hyposulphite. I marrë nga ndërveprimi i sulfit të natriumit me squfur gjatë valë:
Na 2 SO 3 S = Na 2 S 2 O 3
Ashtu si acidi thiosulfurik, është një agjent reduktues i fortë, i cili lehtësisht oksidohet nga klori në acid sulfurik:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
Përdorimi i thiosulfatit të natriumit për thithjen e klorit (në maska të para të gazit) është bazuar në këtë reagim.
Një oksidim pak i ndryshëm ndodh agjentët e dobët oxidizing thiosulfate natriumi. Kjo formon kripërat e acidit tetrathionic, për shembull:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Thiosulfate natriumi është një nënprodukt në prodhimin e NaHS03, ngjyra sulfur, në pastrimin e gazeve industriale nga squfuri. Përdoret për të hequr gjurmët e klorit pas zbardhjes së pëlhurave, për nxjerrjen e argjendit nga xehe; është një fiksues në fotografim, një reagent në jodometria, një antidot për helmim me komponimet e arsenit, merkuri, një agjent anti-inflamator.
Sulfuri i elementit kimik është i vendosur në grupin VIA, periudha 3 PSCE. Në shtresën e jashtme të elektronit të atomit të sulfurit ka 6 elektrone. Duke treguar vetitë e agjentit oksidues në formimin e substancave me metale dhe hidrogjen, squfuri fiton gjendjen e oksidimit -2 (merr 2 elektron).
Në përbërjen e komponimeve që përmbajnë oksigjen, squfuri shfaq shtete oksidimi +4 dhe +6. Kështu, squfuri karakterizohet nga shtetet e oksidimit -2; 0; 4; 6.
Në natyrë, squfuri gjendet në shtetin e saj të lindjes dhe në përbërjen e mineraleve. Për shembull, squfuri përmban shkëlqim plumbi (përbërësi kryesor është sulfuri i plumbit PbS) dhe shkëlqim bakri (përbërësi kryesor është sulfuri bakri Cu 2 S).
Squfuri formon disa substanca të thjeshta - modifikime allotropic. Squfuri është më i qëndrueshëm në temperaturën e dhomës (Fig. 1). Kjo substancë përbëhet nga molekulat S8. Squfuri i squfurit është i verdhë dhe shkrihet në një temperaturë prej + 112.8 ° C.
Fig. 1. Modifikimi Rhombic i squfurit
Kur nxehet, squfuri i squfurit gradualisht shndërrohet në një masë ngjyrë kafe të trashë ngjitëse. Kjo është një tjetër modifikim alotropik i squfurit - squfurit plastik. Sulfuri i plastikës përbëhet nga molekulat e squfurit linear S n.
Sulmi në reagimet kimike me metale dhe hidrogjen luan rolin e një agjenti oksidues. Shkalla e saj e oksidimit zvogëlohet nga 0 në -2. Në reagimin me oksigjenin, squfuri vepron si një agjent reduktues, duke rritur shkallën e oksidimit nga 0 në +4.
Konsideroni shembuj të ndërveprimeve që përfshijnë squfur.
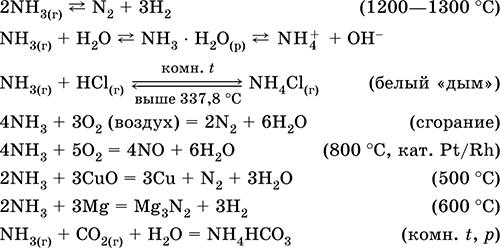
Kur squfuri ndërvepron me hidrogjen, formohet sulfidi i hidrogjenit:
Kur zinku ndërvepron me squfur, formohet sulfidi i zinkut:
Sulfuri digjet në oksigjen me formimin e oksidit të squfurit (IV) (Fig.2):

Fig. 2. Djegia e squfurit në oksigjen
Konsideroni vetitë e përbërjeve të squfurit me gjendje oksidimi "-2". Përbërje të tilla përfshijnë sulfid hidrogjeni dhe sulfide - kripërat e acidit sulfid hidrogjeni.
Sulfuri i hidrogjenit është një gaz me erë të vezëve të kalbura. Ajo digjet në ajër. Për më tepër, me një mungesë dhe një oksigjen të tepërt, djegia vazhdon ndryshe.
Në një tepricë të oksigjenit, sulfidi hidrogjen djeg për të formuar oksid squfuri (IV) dhe ujë:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Me mungesën e oksigjenit, djegja e paplotë e sulfidit të hidrogjenit ndodh me lirimin e squfurit: 2H 2 S + O 2 = 2S + 2H 2 O.
Sulfuri i hidrogjenit është shumë i tretshëm në ujë. Zgjidhja që rezulton është një acid i dobët i sulfidit të hidrogjenit. Kripërat e sulfidit të hidrogjenit quhen sulfide. Acid hidrofluorik dhe sulfide të tretshme në ujë hyjnë në reagime shkëmbimi.
Ndërveprimi i acidit sulfid hidrogjen dhe bakri (II) klorid formon bakër pazgjidhshëm (II) sulfide dhe acid klorhidrik: H2S + CuCl2 = CuS + 2HCl.
Kur sulfidi i kaliumit ndërvepron me nitratin e zinkut, precipiton sulfidi i zinkut dhe formohet nitrat i kaliumit: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
referencat
- Orzhekovsky P.A. Mbledhja e detyrave dhe ushtrimeve në kimi: klasa e 9-të: në tekstin mësimor P.A. Orzhekovski dhe të tjerët. "Kimi. Klasa 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M .: AST: Astrel, 2007. (faqe 91-97)
- Orzhekovsky P.A. Kimi: klasa e 9-të: studime. për imazhin e përgjithshëm. themeluar. / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. - M .: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Kimi: klasa e 9-të: studime për të përgjithshme. themeluar. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M .: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Kimi: neorgan. kimi. Autoriteti. Kimi: studime. për 9 cl. / G.E. Rudzitis, F.G. Feldman. - M .: Arsimi, Tekstet e Moskës OJSC, 2009.
- Khomchenko I.D. Mbledhja e detyrave dhe ushtrimeve në kimi për shkollën e mesme. - M .: RIA "Vala e Re": Botues Umerenkov, 2008.
- Enciklopedi për fëmijët. Vëllimi 17. Kimi / Kapitulli. Ed. VA Volodin, Ved. shkencore. Ed. I. Leenson. - M .: Avanta +, 2003.
- Një koleksion i vetëm i burimeve dixhitale arsimore (përvojat video në temë) ().
- Versioni elektronik i revistës "Kimi dhe Jeta" ().
detyrat e shtëpisë
- a. 136 Nr. 3; p.140 № 2-4 nga libri shkollor P.A. Orzhekovsky "Kimi: klasa e 9-të" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M .: Astrel, 2013.
sulfides (nga squfuri i gjërë, squfuri - squfuri)
komponimet e squfurit me më shumë elemente elektropositive; mund të konsiderohen si kripëra të acidit sulfid hidrogjen (Shih Acidi sulfid hidrogjen) H 2 S. Ka dy seri C: mesatarja (normale) e formulës së përgjithshme M 2 S dhe acid (hydrosulfides) i formulës së përgjithshme MHS, ku M është një metal monovalent. C. metalet alkali janë të pangjella, të tretshëm në ujë. Zgjidhjet e tyre ujore janë shumë të hidrolizuara dhe alkaline. Nën veprimin e acideve të hollë lëshojnë H 2 S. C. Metalet e tokës alkaline janë të pangjyrë, pak i tretshëm në ujë. H 2 S është emetuar në ajër të lagësht. Veti të tjera janë të ngjashme me metalet alkali S.. Të dy ata dhe të tjerët S. janë lehtësisht të oksiduar në sulfate. C. Metalet e rënda janë praktikisht të pazgjidhshme në ujë. Pothuajse të gjithë janë të zeza ose të zeza-kafe (me përjashtim të ZnS të bardhë, MnS rozë, CdS verdhë, Sb 2 S 3 portokalli, SnS 2 e verdhë). Raporti i pabarabarte i C. ndaj acideve dhe C. amonium përdoret në analizat kimike. I.K. Malina.
Enciklopedia e Madhe Sovjetike. - M .: Enciklopedia Sovjetike. 1969-1978 .
Shihni se çfarë "Sulphides" janë në fjalorë të tjerë:
Komponimet e squfurit me metale dhe disa jo-metale. Sulfidet metalike janë kripërat e acidit sulfid hidrogjen H2S: të mesme (për shembull, Na2S) dhe acid, ose hidrosulfides (NaHS). Me djegien e sulfideve natyrale merren metalet me ngjyra dhe SO2. Sulfide fosforike dhe ... ... Fjalor i madh enciklopedik
Enciklopedia Moderne
sulfides - Sulfide, sulfide inorganike të përbërjeve të squfurit me metale dhe disa jo-metale. Të përfshira në xeherorët e sulfurit; përdoret si fosfor (për shembull, CdS, ZnS). Sulfide molibden, lubrifikantë të ngurtë titani. Sulfat e fosforit ... ... Fjalor i ilustruar enciklopedik
- (lat. i ri, nga latinisht squfuri i squfurit). Komponimet e një trupi me squfur, që korrespondon me okside ose acide. Fjalori i fjalëve të huaja të përfshira në gjuhën ruse. Chudinov, AN, 1910. SULFIDES Novolatinsk., Nga Lat. squfur, squfur. Lidhja ... ... Fjalori i fjalëve të huaja të gjuhës ruse
1. Komponimet natyrale të squfurit të metaleve dhe disa jo-metale. Në kimik lidhje konsiderohen si kripëra të acidit H2S të sulfidit të hidrogjenit. Një numër i elementeve formojnë polysulfides me squfur, të cilat janë kripërat e acidit poli sulfur H2Sx. Kryesore ... ... Enciklopedia gjeologjike
sulfides - - komponimet e squfurit me metale dhe disa jo-metale; kripërat sulfide metalike të acidit H2S sulfid hidrogjeni. [Fjalor terminologjik për beton dhe beton të përforcuar. FSUE "SIC" Ndërtim "NIIZHB dhe A. A. Gvozdeva stacioni i metrosë, Moskë, 2007. 110 p.] ... ... Enciklopedia e termave, përkufizimeve dhe shpjegimeve të materialeve të ndërtimit
SULFHES, s, u sulfide, një burri (Spec.). Komponimet kimike të squfurit me metale dhe jo-metale të caktuara. Organike me Dashuri s. | adj. sulfur, oh, oh. Fjalor Ozhegova. SI Ozhegov, N.Yu. Shvedova. 1949 1992 ... Fjalor Ozhegova
Sulfides, R2S (R radikale aromatike), janë fituar më lehtë duke shtuar dropwise një zgjidhje të kripërat diazo në 60 70 ... Enciklopedia e Brockhaus dhe Efron
sulfides - (1) në kiminë inorganike, përbërës të tillë të elementeve me squfur, në të cilat atomet squfur kanë një gjendje oksidimi prej 2. Në kimik. janë konsideruar si kripëra të acidit të dobët të sulfidit të hidrogjenit (zgjidhje ujore e H2S). Shumë S. janë të natyrshme ... ... Enciklopedia e Lartë Politeknike
s; pl. (njësi sulfide, dhe; m.). [nga lat. sulfur squfur] Chem. Komponimet e squfurit me metale dhe disa jo-metale. C. titan. Organike me Dashuri s. (klasa e mineraleve). ◁ Sulfide, th, oh. Me përzierje të përziera. Nga ore ore. * * * sulfide të përbërjeve të squfurit ... Fjalor enciklopedik
- (nga squfuri latin squfuri) një klasë e përbërjeve kimike që janë komponimet metalike (si dhe një numër jo-metali B, Si, P, As) me squfur (S), ku ka një gjendje oksidimi prej -2. Mund të konsiderohet si kripë e sulfidit të hidrogjenit ... ... Wikipedia
libra
- Depozitat e uraniumit të llojit të mosmarrëveshjeve në Phanerozoic, Andrei Borisovich Khalezov. Karakteristikat e depozitave të uraniumit në strukturat e paleo-luginës së lumit në sipërfaqet e mosmarrëveshjeve strukturore dhe stratigrafike janë konsideruar në shembullin e tre rajoneve të rajonit Ural me të ndryshme ...
squfuri - Elementi i periudhës së tretë dhe grupi VIA i Sistemit Periodik, numri serik 16, i referohet chalcogens. Formula elektronike e atomit [10 Ne] 3s 2 3p 4, gjendja e oksidimit karakteristik 0, -II, + IV dhe + VI, shteti S VI konsiderohet i qëndrueshëm.
Shkalla e oksidimit të squfurit:
Elektronegativiteti i squfurit është 2.60, karakterizohet nga vetitë jo-metalike. Në komponimet e hidrogjenit dhe oksigjenit ajo gjendet në anione të ndryshme, formon acidet që përmbajnë oksigjen dhe kripërat e tyre, komponimet binare.
Në natyrë - pesëmbëdhjetë prevalenca kimike element (i shtati në mesin e jo-metale). Ajo gjendet në formën e lirë (amtare) dhe të ngjashme. Një element vital për organizmat më të lartë.
Sulfur S. Substanca e thjeshtë. Verdha kristalore (α-rombi dhe β-monoklini,
në 95.5 ° C) ose amorf (plastik). Në faqet e grilave ekzistojnë molekulat S 8 (ciklet e tipit "korona" jo-planorë), squfuri amorfol përbëhet nga zinxhirët S n. Substanca e shkrirjes së ulët, viskoziteti i lëngut kalon përmes një maksimumi në 200 ° C (hendeku i molekulave S8, ndërthurja e zinxhirëve Sn). Në një molekulë palë S8, S6, S4, S2. Në 1500 ° C, squfuri monoatomik shfaqet (në ekuacionet kimike për thjeshtësi, çdo squfur përfaqësohet si S).
Squfuri nuk shpërndahet në ujë dhe në kushte normale nuk reagon me të, është mirë i tretshëm në disulfidin e karbonit CS 2.
Sulmi, posaçërisht pluhur, ka një aktivitet të lartë kur nxehet. Reagimet si një agjent oksidues me metale dhe jo-metale:
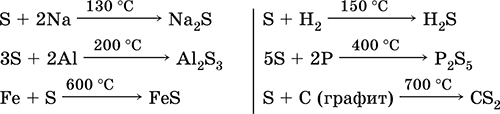
çfarë lidhje reduktimin e agjentit - me fluorin, oksigjenin dhe acidet (kur valë):
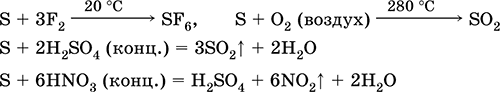
Sulfuri i nënshtrohet shpërbërjes në solucione alkali:
3S 0 + 6KOH (conc.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
Në temperatura të larta (400 ° C) squfuri zhvendos jodin nga hidrogjeni jodur:
S + 2NI (g) = I2 + H2S,
por në zgjidhje reagimi shkon në mënyrë të kundërt:
I 2 + H 2 S (p) = 2 HI + S ↓
pritje: në industri shkrirë nga depozitat natyrore të squfurit amtare (duke përdorur avujt e ujit), të lëshuara gjatë desulfurizimit të produkteve të gazifikimit të qymyrit.
Sulmi përdoret për sintetizimin e disulfidit të karbonit, acidit sulfurik, ngjyrave të sulfit (vat), në vulcanization e gome, si një mjet për të mbrojtur bimët nga myk pluhur, dhe për trajtimin e sëmundjeve të lëkurës.
Sulfuri i hidrogjenit H 2 S. Acid pa oksigjen. Gazi i pangjyrë me erë mbytëse, më të rëndë se ajri. Molekula ka strukturën e një tetraedri të dyfishtë të pakompletuar [:: S (H) 2]
(sp 3 - hibridizimi, këndi H - S - H është larg nga tetrahedral). I paqëndrueshëm kur nxehet mbi 400 ° C. Ajo është pak i tretshëm në ujë (2.6 l / 1 l H2O në 20 ° C), një zgjidhje e ngopur është decimolar (0.1 M, "ujë sulfid hidrogjeni"). Një acid shumë i dobët në solucion, praktikisht nuk disocion në fazën e dytë tek Sionet 2- (përqendrimi maksimal i S2-1 është i barabartë me 1 10 -13 mol / l). Kur qëndron në ajër, zgjidhja bëhet e vrenjtur (frenues - sukrozë). Ajo neutralizohet nga alkaline, jo plotësisht - nga hidrati i amoniakut. Agjent i fortë reduktues. Ajo hyn në reaksione të këmbimit jon. Agjent sulfidues, precipiton nga një zgjidhje e sulfideve me ngjyrë të ndryshme me tretshmërinë shumë të ulët.
Reaksione cilësore - Sedimentimi i sulfideve, si dhe djegia e paplotë e H 2 S me formimin e një depoziti të squfurit të verdhë në një objekt të ftohtë të futur në flakë (spatula prej porcelani). Një nënprodukt i rafinimit të naftës, gazit natyror dhe gazit të koksit.
Përdoret në prodhimin e përbërjeve squfuri, inorganike dhe organike që përmbajnë squfur si një reagent analitik. Jashtëzakonisht helmuese. Ekuacionet e reagimeve më të rëndësishme:
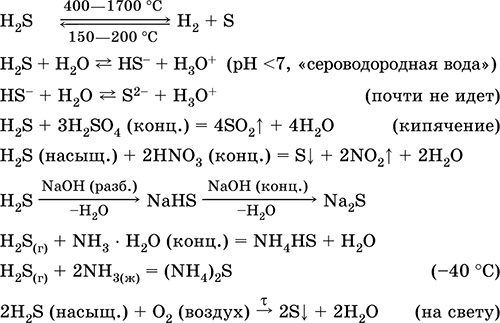

pritje: në industri - Sinteza direkte:
H 2 + S = H 2 S(150-200 ° C)
ose duke ngrohur squfur me parafine;
në laborator - Zhvendosja e sulfideve nga acide te forta
FeS + 2NCl (conc.) = FeCl2 + H 2 S
ose hidrolizë e plotë e përbërësve binar:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Sulfidi natriumi Na 2 S. Kripë pa oksigjen. Bardhë, shumë higroskopike. Shkrihet pa dekompozim, termikisht e qëndrueshme. Ajo është mirë e tretshme në ujë, hidrolizohet nga anioni, krijon një medium shumë alkaline në zgjidhje. Kur qëndron në ajër, zgjidhja bëhet e vrenjtur (squfuri koloidal) dhe kthehet në të verdhë (bojë polysulfide). Agjent reduktues tipik. Bashkangjit squfur. Ajo hyn në reaksione të këmbimit jon.
Reaksione cilësore në jon S2-- depozitimi i sulfideve metalike të ngjyrosura në mënyrë të ndryshme, nga të cilat MnS, FeS, ZnS janë dekompozuar në HCl (et).
Përdoret në prodhimin e ngjyrave të squfurit dhe celulozës, për të hequr flokët e lëkurës gjatë rrezitje të lëkurës, si një reagent në kimikën analitike.
Ekuacionet e reagimeve më të rëndësishme:
Na2S + 2NCl (dec.) = 2NaCl + H2S
Na 2 S + 3H 2 SO 4 (conc.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (deri në 50 ° C)
Na 2 S + 4HNO 3 (conc.) = 2NO + S + + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (ul.) = 2NaHS
Na 2 S (t) + 2O2 = Na2SO4 (mbi 400 ° C)
Na2S + 4H2O2 (conc.) = Na2S04 + 4H2O
S 2- + M 2+ = MnS (trupor) ↓; FeS (e zezë) ↓; ZnS (e bardhë) ↓
S 2- + 2Ag + = Ag 2 S (i zi) ↓
S 2- + M 2+ = CdS (verdhë) ↓; PbS, CuS, HgS (e zezë) ↓
3S 2- + 2Bi 3+ = Bi 2 S 3 (korriku - i zi) ↓
3S 2- + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
pritje në industri - kalcinimi i mineralit mirabilite Na 2 SO 4 10H 2 O në prani të agjentëve reduktues:
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 ° C, cat Fe 2 O 3)
Na2SO4 + 4C (koks) = Na2S + 4CO (800-1000 ° C)
Na2SO4 + 4CO = Na2S + 4SO2 (600-700 ° C)
Sulfidi i aluminit Al 2 S 3. Kripë pa oksigjen. E bardhë, lidhja Al-S është kryesisht kovalent. Shkrihet pa dekompozim nën presionin e tepruar të N 2, ajo lehtë sublimohet. Ajo oksidohet në ajër kur kalcinuar. Plotësisht hidrolizuar me ujë, nuk precipituar nga zgjidhja. Shkatërruar nga acide të forta. Përdoret si një burim solid i sulfidit të pastër të hidrogjenit. Ekuacionet e reagimeve më të rëndësishme:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (i pastër)
Al 2 S 3 + 6NCl (dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (conc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (ajri) = 2Al 2 O 3 + 6SO 2 (700-800 ° C)
pritje: ndërveprimi i aluminit me squfur të shkrirë në mungesë të oksigjenit dhe lagështisë:
2Al + 3S = AL 2 S 3(150-200 ° C)
Hekur (II) sulfide FeS. Kripë pa oksigjen. E zezë dhe gri me një ngjyrë të gjelbër, të fortë, dekompozohet kur nxehet në vakum. Në gjendjen e lagësht është e ndjeshme ndaj oksigjenit në ajër. I pazgjidhshëm në ujë. A nuk precipitojnë në ngopjen e solucioneve të kripërave të hekurit (II) me sulfid hidrogjeni. Shkatërruar nga acidet. Përdoret si lëndë e parë në prodhimin e hekurit, një burim solid i sulfidit të hidrogjenit.
Komponimi i përbërjes hekuri (III) të Fe 2 S 3 nuk dihet (nuk është marrë).
Ekuacionet e reagimeve më të rëndësishme:
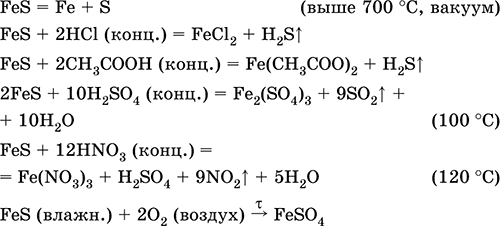
marrja e:
Fe + S = Fes (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 Fes + 3H2O (700-1000 ° C)
FeCl2 + 2NH 4 HS (g) = Fes ↓ + 2NH 4 Cl + H 2 S
Disulfid hekuri FeS 2. Lidhja binare. Ajo ka strukturën jonike Fe 2+ (-S - S-) 2-. E verdhë e errët, e qëndrueshme termikisht, shpërbëhet gjatë ndezjes. I pazgjidhshëm në ujë, nuk reagon me acide të holluara, alkaline. Ajo dekompozohet nga agjentët acid-oksidues, të pjekur në ajër. Përdoret si lëndë e parë në prodhimin e hekurit, sulfurit dhe acidit sulfurik, një katalizator në sintezën organike. Në natyrë - minerale minerale pirit dhe marcasite.
Ekuacionet e reagimeve më të rëndësishme:
FeS 2 = FeS + S (mbi 1170 ° C, vakum)
2FeS 2 + 14H 2 SO 4 (conc., Malet) = Fe 2 (SO 4) 3 + 15SO 2 + 14N 2 O
FeS 2 + 18HNO 3 (conc.) = Fe (NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
4FeS 2 + 11O 2 (ajri) = 8SO 2 + 2Fe 2 O 3 (800 ° C, pjekje)
Hidrosulfid i amonit NH 4 HS. Kripë e acidit pa oksigjen. Bardhë, shkrirë nën presion. Jashtëzakonisht e paqëndrueshme, termikisht e paqëndrueshme. Ajo oksidizon në ajër. Është mirë i tretshëm në ujë, hidrolizohet nga kationi dhe anioni (mbizotëron), krijon një mjedis alkaline. Zgjidhja kthehet e verdhë në ajër. Ajo dekompozohet nga acidet, në një solucion të ngopur shton squfur. Alkalet nuk janë neutralizuar, kripë e mesme (NH 4) 2 S nuk ekziston në zgjidhje (për kushtet e marrjes së kripës së mesme, shih titullin "H 2 S"). Përdoret si një komponent i zhvilluesve të fotove, si një reagent analitik (precipituesi i sulfurit).
Ekuacionet e reagimeve më të rëndësishme:
NH 4 HS = NH3 + H2S (mbi 20 ° C)
NH 4 HS + HCl (dec.) = NH4C1 + H2S
NH 4 HS + 3HNO 3 (conc.) = S ↓ + 2NO2 + NH4N03 + 2H2O
2NH 4 HS (sat H2S) + 2CuSO4 = (NH4) 2SO4 + H2SO4 + 2CuS ↓
pritje: ngopja e koncentruar e NH3 me sulfide hidrogjeni:
NH 3 H 2 O (conc.) + H 2 S (g) = NH 4 HS + H2O
Në kimi analitike, një zgjidhje që përmban sasi të barabarta të NH 4 HS dhe NH 3 H 2 O konsiderohet konvencionalisht si një zgjidhje e (NH4) 2S dhe formula e kripës mesatare përdoret në shkrimin e ekuacioneve të reagimit, edhe pse sulfidi i amonit tërësisht hidrolizohet në ujë tek NH4 HS dhe NH 3 H 2 O.
Dioksid sulfuri. Sulfites
Dioksidi i squfurit SO 2. Oksid acid. Gazi pa ngjyrë me erë të athët. Molekula ka strukturën e një trekëndëshi jo të plotë [: S (O) 2] (sp 2 - hibridizimi), përmban σ, π - lidhjet S = O. Lëngëzuar lehtë, termikisht e qëndrueshme. Është i tretshëm në ujë (~ 40 l / 1 l H20 në 20 ° C). Formon një polihidrat me vetitë e një acidi të dobët, produktet e dissociimit - joneve HSO 3 - dhe SO 3 2-. Ion HSO 3 - ka dy forma tautomerike - simetrik (jo acid) me strukturën e tetraedarit (sp 3 - hibridizimi), i cili mbizotëron në përzierje dhe asimetrike (acid) me strukturën e tetraedarit jo të plotë [: S (O) 2 (OH)] (sp 3 - hibridizimi). Jon SO3 2- është gjithashtu tetrahedral [: S (O) 3].
Reagimet me alkaline, amoniak hidrat. Reduktues tipik, agjent oksidues i dobët.
Reaksioni cilësor - njollë e "jodit të verdhë" kafe. Intermediate në prodhimin e sulfites dhe acidit sulfurik.
Përdoret për zbardhjen e leshit, mëndafshit dhe kashtës, ruajtjen dhe ruajtjen e frutave, si një dezinfektues, antioksidues, ftohës. Toksike.
Komponimi i H2SO3 (acid sulfuroz) nuk dihet (nuk ekziston).
Ekuacionet e reagimeve më të rëndësishme:
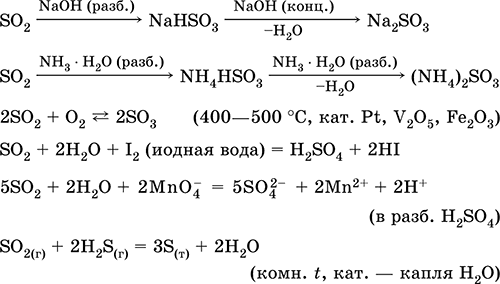
Shpërndarja në ujë dhe në pronat e acidit:
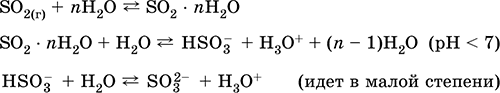
pritje: në industrinë - djegia e squfurit në ajër të pasuruar me oksigjen dhe, në një masë më të vogël, pjekja e mineraleve të sulfurit (SO 2 - gaz shoqërues gjatë pjekjes së piritit):
S + O 2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, pjekje)
në laborator - zhvendosja e sulfiteve me acid sulfurik:
BaSO 3 (t) + H2SO4 (conc.) = BaSO 4 ↓ + SO 2 + H 2 O
Sulfiti natriumi Na2SO3. Oksosol. Të bardhë. Kur nxehet në ajër shpërbëhet pa shkrirë, shkrihet nën presion të argonit. Në gjendjen e lagësht dhe në zgjidhje të ndjeshme ndaj oksigjenit në ajër. Është i tretshëm në ujë, hidrolizuar nga anioni. Shkatërruar nga acidet. Agjent reduktues tipik.
Reaksioni cilësor në jon SO3 2- - formimi i një precipitati të bardhë të sulfit barium, i cili transferohet në zgjidhje me acide të forta (HCl, HNO3).
Përdoret si reagent në kimikën analitike, një komponent i zgjidhjeve fotografike, neutralizues i klorit në zbardhimin e pëlhurave.
Ekuacionet e reagimeve më të rëndësishme:
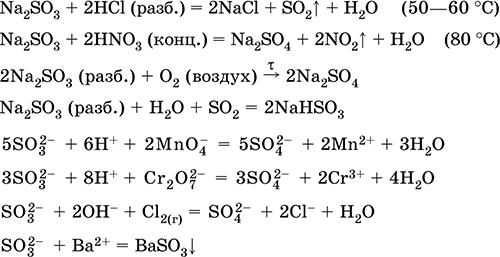
marrja e:
Na 2 CO 3 (conc.) + SO 2 = Na2SO3 + CO 2
Acidi sulfurik. sulfateve
Acidi sulfurik H2SO4. Acid oxoic. Lëng i pangjyrë, shumë i trashë (me vaj), shumë higroskopik. Molekula ka një strukturë tetë tetrahedral (sp 3 γ γ hybridization), përmban σ - lidhjet kovalente S - OH dhe σπ - lidhjet S = O. Jon SO 4 2- ka një strukturë të saktë - tetrahedral. Ajo ka një gamë të gjerë temperaturë të gjendjes së lëngët (~ 300 gradë). Kur nxehet mbi 296 ° C ajo shpërbëhet pjesërisht. Është distiluar si një përzierje azeotropike me ujë (pjesa masive e acidit është 98.3%, pika e vlimit është 296-340 ° C), shpërbëhet plotësisht me ngrohje më të fortë. Përzihet pakufizuar me ujë (me të fortë exo-effect). Acid i fortë në tretësirë, neutralizohet nga alkali dhe hidrati i amoniakut. Konverton metale në sulfate (me një tepricë të acidit të koncentruar në kushte normale, formohen hidrosulfate të tretshme), por meta Be, Bi, Co, Fe, Mg dhe Nb janë të pasivuara në acid të koncentruar dhe nuk reagojnë me të. Reagimet me okside dhe hidrokside bazë, dekompozon kripërat e acideve të dobëta. Oxidizer i dobët në një zgjidhje të holluar (për shkak të H I), të fortë - në një zgjidhje të koncentruar (për shkak të S VI). Well shpërndan SO 3 dhe reagon me të (një lëng i rëndë vaji është formuar - oleum, përmban H2S2O7).
Reaksioni cilësor në SO 4 2- jon - reshjet e barium sulfat bardhë BaSO 4 (precipitati nuk është konvertuar në një zgjidhje të acideve hidroklorik dhe nitrik, në dallim nga bardha e precipituar BaSO 3).
Përdoret në prodhimin e sulfateve dhe përbërësve të tjerë të squfurit, plehrave minerale, eksplozivëve, ngjyrave dhe ilaçeve, në sintezën organike, për "hapjen" (fazën e parë të përpunimit) të mineraleve dhe mineraleve të rëndësishme industriale, për rafinimin e produkteve të naftës, elektrolizës së ujit, si elektrolit të baterive të plumbit . Vdekur, shkakton djegie të lëkurës. Ekuacionet e reagimeve më të rëndësishme:
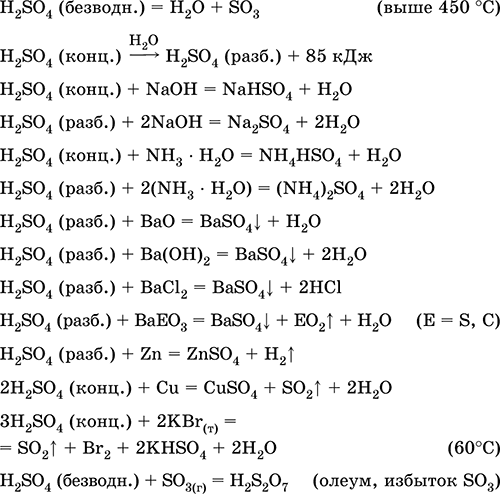
pritje në industri:
a) sintezën e SO 2 nga squfuri, xeherorët e sulfideve, sulfurit e hidrogjenit dhe xeherorët e sulfatit:
S + O 2 (ajri) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (ajër) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, pjekje)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250-300 ° C)
CaSO4 + (koks) = CaO + SO 2 + CO (1300-1500 ° C)
b) konvertimi i SO 2 në SO 3 në aparatin e kontaktit:
c) sintezën e acidit sulfurik të koncentruar dhe anhidrik:
H 2 O (Kol. H2SO4) + SO3 = H2SO4(konc., anhyd.)
(thithja e SO 3 me ujë të pastër me prodhimin e H2SO4 nuk kryhet për shkak të ngrohjes së fortë të përzierjes dhe dekompozimit të kundërt të H2SO4, shih më lart);
d) sintezën oleum - një përzierje e H 2SO 4 anhidrid, acidit disarik H2S2O7 dhe SO3 tepërt. SO 3 i tretur siguron mungesën e ujit (H 2 SO 4 formohet menjëherë kur futet uji), gjë që lejon transportimin e sigurt në tanke çeliku.
Sulfat natriumi Na2SO4. Oksosol. E bardhë, higroskopike. Shkrirë dhe vlon pa dekompozim. Forma hidrat kristaline (minerale mirabilite) humbet lehtë ujin; emri teknik Kripë Glauber's. Është i tretshëm në ujë, jo i hidrolizuar. Reagimet me H2SO4 (conc.), SO 3. Rivendosur nga hidrogjeni, koks kur nxehet. Ajo hyn në reaksione të këmbimit jon.
Përdoret në prodhimin e qelqit, celulozës dhe ngjyrave minerale, si një ilaç. Përgatitur në shëllirë të liqeneve të kripura, në veçanti në Gjirin e Kara-Bogaz-Gol të Detit Kaspik.
Ekuacionet e reagimeve më të rëndësishme:
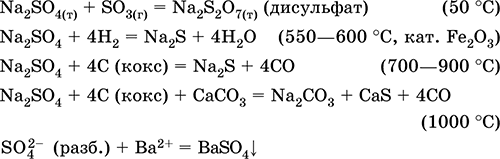
Kaliumi hidrosulfate KHSO 4. Kripë acid oksol. Bardhë, higroskopike, por nuk formon hidratet kristalore. Kur nxehet shkrihet dhe dekompozohet. Është mirë i tretshëm në ujë, anioni pëson disociim në solucion, mjeti i tretësit është fort acid. Ajo neutralizohet nga alkaline.
Përdoret si një komponent i flukseve në metalurgji, një pjesë integrale e plehrave minerale.
Ekuacionet e reagimeve më të rëndësishme:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (deri në 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320-340 ° C)
KHSO 4 (dil.) + KOH (conc.) = K2SO4 + H2O KHSO 4 + KCl = K2SO4 + HCl (450-700 ° C)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° C, M = Al, Cr)
pritje: trajtimi i sulfatit të kaliumit në të ftohtë (me më shumë se 6%) acid sulfurik
K 2 SO 4 + H 2 SO 4 (conc.) = 2 KHSO 4
Sulfat kalciumi CaSO 4. Oksosol. Bardhë, shumë higroskopik, i fortë, dekompozohet kur kalcinuar. Natyrore CaSO 4 gjendet në formën e një minerali shumë të zakonshëm gips CaSO 4 2H 2 O. Në 130 ° C, gips humbet disa nga uji dhe shkon në llaç i djegur2CaSO 4 H 2 O (emri teknik Alabaster). Gips i dehidruar plotësisht (200 ° C) i përgjigjet mineralit anhidritCaSO 4. Është pak i tretshëm në ujë (0.206 g / 100 g H2O në 20 ° C), tretshmëria zvogëlohet kur nxehet. Reagimet me H2SO4 (conc.). Shënohet nga koks gjatë shkrirjes. Përcakton shumicën e fortësisë "konstante" të ujit të freskët (për më shumë hollësi, shih 9.2).
Ekuacionet e reaksioneve më të rëndësishme: 100-128 ° C
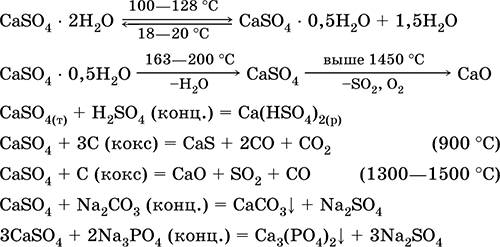
Përdoret si lëndë e parë në prodhimin e SO 2, H 2 SO 4 dhe (NH 4) 2 SO 4, si një fluks në metalurgji, mbushëse letre. Morfa lidhëse e përgatitur nga gipsi i djegur "vendos" më shpejt se përzierja bazuar në Ca (OH) 2. Përforcimi sigurohet nga lidhja e ujit, formimi i gipsit në formën e masës së gurit. Gips i djegur përdoret për të bërë hedhje suva, forma dhe produkte arkitekturore dhe dekorative, mure ndarëse dhe panele, dhe dysheme guri.
Sulfat kaliumi alumini KAl (SO 4) 2. Kripë e dyfishtë oksol. E bardhë, higroskopike. Me nxehtësi të fortë decomposes. Forma hidrat kristaline - aluminit kalium alum. Mesatarisht i tretshëm në ujë, hidrolizohet nga kation alumini. Reagimet me alkaline, amoniak hidrat.
Përdoret si një mordant në pëlhura ngjyrosëse, lëkurë për rrezitje, mpiksje në pastrimin e ujit të freskët, një përbërës i kompozimeve të letrës dhe një agjent hemostatik i jashtëm në mjekësi dhe kozmetikë. Formohet nga bashkëkristalizimi i sulfateve të aluminit dhe kaliumit.
Ekuacionet e reagimeve më të rëndësishme:
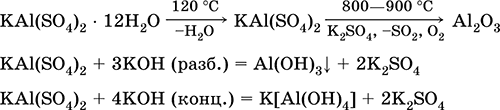
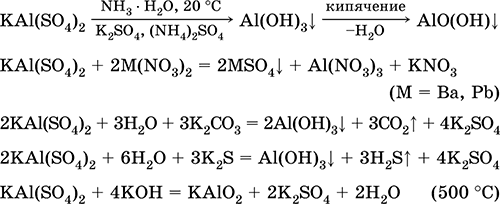
Kromi (III) sulfat - kaliumi KCr (SO 4) 2. Kripë e dyfishtë oksol. Kuq (hidrat i errët purpurt, emri teknik kalium alum). Kur nxehet dekompozohet pa shkrirjen. Ai është lehtësisht i tretshëm në ujë (ngjyra gri-blu e zgjidhjes korrespondon me aquacomplex 3+), hidrolizohet nga kationi i kromit (III). Reagimet me alkaline, amoniak hidrat. Oksidues i dobët dhe agjent reduktues. Ajo hyn në reaksione të këmbimit jon.
Reaksione cilësore për reduktimin e joneve Cr 3+ në Cr 2+ ose oksidimi në të verdhë CrO 4 2-.
Përdoret si një agjent për rrezitje për lëkurë, një pëlhurë ngjyrosëse, një reagent në një fotografi. Formohet nga bashkëkristalizimi i kromit (III) dhe sulfateve të kaliumit. Ekuacionet e reagimeve më të rëndësishme:
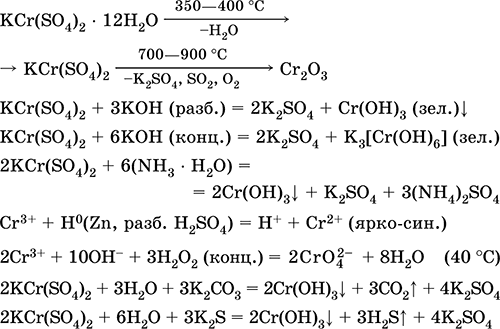
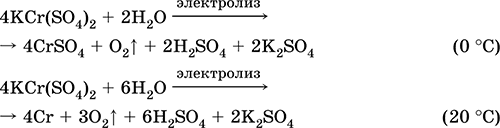
Mangani (II) sulfat MnSO4. Oksosol. Bardha, kur kalcinuar, shkrihet dhe dekompozohet. Hidrat kristalor MnSO 4 5H 2 O - e kuqe - trëndafili, emri teknik mangani vitriol. Ajo është e tretshme në ujë, ngjyrë trëndafili (pothuajse i pangjyrë) i zgjidhjes korrespondon me aquacomplex 2+; hidrolizohet nga kationi. Reagimet me alkaline, amoniak hidrat. Agjenti i reduktimit të dobët reagon me agjentë tipikë (të fortë) oksidues.
Reaksione cilësore në Mn 2+ jon - një përçim me jon MnO 4 dhe zhdukjen e ngjyrës vjollcë të këtij të fundit, oksidimi i Mn 2+ në MnO 4, dhe paraqitja e një ngjyre vjollce.
Përdoret për të marrë Mn, MnO2 dhe komponimet e tjera të manganit, si reagent mikronutrient dhe analitik.
Ekuacionet e reagimeve më të rëndësishme:
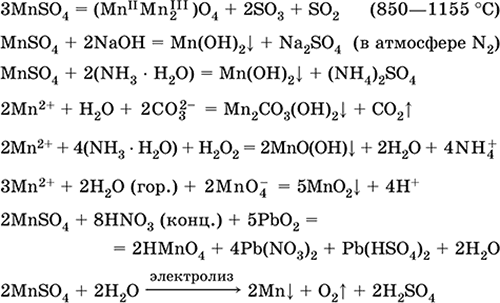
marrja e:
2MnO 2 + 2H 2 SO 4 (conc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Hekuri (II) sulfat FeSO 4. Oksosol. Bardhë (hidrat dritë e gjelbër, emri teknik hekuri vitriol),lagështithithës. Ajo shpërbëhet kur nxehet. Është i tretshëm në ujë, në një masë të vogël të hidrolizuar nga kationi. Është oksiduar shpejt në zgjidhje nga oksigjeni në ajër (zgjidhja kthehet e verdhë dhe bëhet e vrenjtur). Reagimet me agjentë acid-oksidues, alkaline, amoniak hidrat. Agjent reduktues tipik.
Përdoret si një përbërës i bojrave të mineraleve, elektroliteve në electroplating, ruajtjes së drurit, fungicidit, drogës kundër anemisë. Në laborator, më shpesh ajo merret si kripë e dyfishtë Fe (NH 4) 2 (SO 4) 2 6N 2 O ( kripë mora) më rezistente ndaj ajrit.
Ekuacionet e reagimeve më të rëndësishme:
![]()
marrja e:
Fe + H2SO4 (dec.) = FeSO 4+ H 2
FeCO3 + H2SO4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. VA-grup jo-metale
Azotit. amoniak
azot - një element i periudhës së dytë dhe grupi VA i sistemit periodik, numri serial 7. Formula e elektronit atomik [2 Ai] 2s 2 2p 3, shtetet karakteristike të oksidimit 0, -III, + III dhe + V, më pak shpesh + II, + IV dhe etj.; N v shteti konsiderohet relativisht i qëndrueshëm.
Shkalla e oksidimit të azotit:
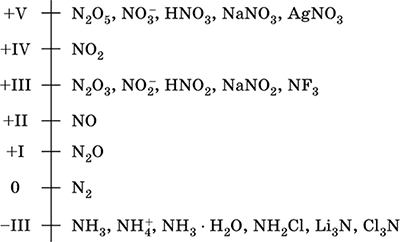
Azoti ka një elektronegativitet të lartë (3.07), i treti pas F dhe O. Shfaq vetitë tipike jo-metalike (acidike). Formon acide, kripëra dhe komponime binare të ndryshme oksigjeni, si dhe kationin NH4 + dhe kripërat e tij.
Në natyrë - shtatëmbëdhjetë elementi i prevalencës kimike (i nënti ndër jo-metale). Një element vital për të gjitha organizmat.
Azotit N 2. Substanca e thjeshtë. Ai përbëhet nga molekula jo polare me një lidhje të qëndrueshme σππ - N ≡ N, kjo shpjegon inertitetin kimik të azotit në kushte normale. Një gaz i pangjyrë, pa erë që kondensohet në një lëng të pangjyrë (ndryshe nga O 2).
Komponenti kryesor i ajrit: 78,09% në volum, 75,52% në peshë. Nga ajri i lëngshëm, azoti azotizon oksigjenin O 2. Ajo është pak i tretshëm në ujë (15.4 ml / 1 l H2O në 20 ° C), tretshmëria e azotit është më e vogël se ajo e oksigjenit.
Në temperaturën e dhomës, N 2 reagon vetëm me litium (në një atmosferë të lagësht), duke formuar nitride litium Li 3 N, nitratet e elementeve të tjerë sintetizohen me ngrohje të fortë:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
Në një shkarkesë elektrike, N 2 reagon me fluorin dhe në një masë shumë të vogël me oksigjen:
Një reagim i kthyeshëm për të prodhuar amoniakun ndodh në 500 ° C, nën presion deri në 350 atm dhe domosdoshmërisht në prani të një katalizatori (Fe / F 2 O 3 / FeO, në laboratorin e Pt):
Në përputhje me parimin Le Chatelier, një rritje në prodhimin e amoniakut duhet të ndodhë me një rritje të presionit dhe një rënie të temperaturës. Megjithatë, shkalla e reagimit në temperatura të ulëta është shumë e ulët, kështu që procesi kryhet në 450-500 ° C, duke arritur një yield të amoniakut prej 15%. N2 dhe H2, të paaktivizuara, kthehen në reaktor dhe kështu rrisin shkallën e reagimit.
Azoti është kimikisht pasiv sa i përket acideve dhe alkaleve, nuk mbështet djegien.
pritje në industri - distilimi i pjesshëm i ajrit të lëngshëm ose heqja e oksigjenit nga ajri me anë të mjeteve kimike, për shembull, me reaksionin 2C (koks) + O 2 = 2CO me ngrohje. Në këto raste prodhohet azoti, i cili gjithashtu përmban papastërtitë e gazeve fisnike (kryesisht argon).
laborator sasi të vogla të azotit kimikisht të pastër mund të merren nga një reaksion kombinim me ngrohje të moderuar:
N-III H 4 N III O 2 (t) = N2O + 2H2O (60-70 ° C)
NH4Cl (p) + KNO2 (p) = N2O + KCl + 2H2O (100 ° C)
Përdoret për sintezën e amoniakut, acidit nitrik dhe produkteve të tjera që përmbajnë azot, si një mjedis inerte për proceset kimike dhe metalurgjike dhe ruajtjen e substancave të ndezshme.
Amoniaku NH 3. Komponimi binar, shkalla e oksidimit të azotit është - III. Gazi pa ngjyrë me erë të mprehtë karakteristike. Molekula ka strukturën e një tetrahedroni jo të plotë [: N (H) 3)] (sp 3 γиб-hibridizimi). Prania e azotit në molekulën NH 3 të një çifti të donatorëve elektron në një sp 3 - orbital hibride shkakton një reaksion karakteristik shtesë të kationit të hidrogjenit, me formimin e një kationi ammonium NH 4 +. Lëngëzuar nën presion në temperaturën e dhomës. Në gjendjen e lëngshme është e lidhur për shkak të lidhjeve me hidrogjen. Termikisht e paqëndrueshme. Është i tretshëm në ujë (më shumë se 700 l / 1 l H20 në 20 ° C); proporcioni në solucion i ngopur është = 34% në masë dhe = 99% në volum, pH = 11.8.
Shumë reaktive, të prirur ndaj reaksioneve shtesë. Ngrihet në oksigjen, reagon me acide. Ajo ekspozon reduktimin (për shkak të N-III) dhe oksidimin (për shkak të H I) pronave. Thate vetëm me oksid kalciumi.
Reaksione cilësore - formimi i "tymit" të bardhë në kontakt me HCl të gaztë, zveri i letrës i lagur me një zgjidhje të Hg 2 (NO 3) 2.
Produkt i ndërmjetëm në sintezën e HNO 3 dhe kripërat e amonit. Përdoret në prodhimin e sodës, plehrave azotike, ngjyrave, eksplozivëve; amoniaku i lëngët është një ftohës. Toksike.
Ekuacionet e reagimeve më të rëndësishme:
pritje: në laborator - zhvendosja e amoniakut nga kripërat e amonit kur nxehet me gëlqere (NaOH + CaO):
ose valë një tretësirë ujore të amoniakut, e ndjekur nga tharja e gazit.
industri amoniaku sintetizohet nga azoti (shih) me hidrogjen. Prodhuar nga industria ose në një formë të lëngët ose në formën e një zgjidhjeje të koncentruar ujore nën emrin teknik ujë amoniak.
Hidrat amoniak NH 3 H 2 O. Përbërja intermolekulare. Bardhë, në grilën kristalore janë molekulat NH 3 dhe H 2 O, të lidhur nga një lidhje e dobët me hidrogjen H 3 N ... HON. I pranishëm në një solucion ujor të amoniakut, një bazë e dobët (produktet e dissociimit - kationi NH 4 - dhe anioni OH -). Kation amoniumi ka një strukturë të rregullt π-tetrahedral (sp 3 - hibridizimi). Termikisht i paqëndrueshëm, i dekompozuar plotësisht nga vlimi i zgjidhjes. Neutralizuar nga acide të forta. Tregon reduktimin e pronave (për shkak të N III) në një zgjidhje të koncentruar. Ai hyn në reagimin e shkëmbimit të joneve dhe kompleksimit.
Reaksioni cilësor - Formimi i "tymit" të bardhë në kontakt me HCl të gaztë.
Është përdorur për të krijuar një medium të dobët alkaline në zgjidhje, gjatë reshjeve të hidroksideve amfoterike.
Zgjidhja e amoniakut 1M përmban kryesisht hidrat NH 3 H 2 O dhe vetëm 0.4% të NH4 + dhe OH - joneve (për shkak të disociimit të hidratit); kështu, jonik "hidroksid amoniak NH 4 OH" praktikisht nuk gjendet në zgjidhje, nuk ka përbërje të tillë në hidrat të fortë. Ekuacionet e reagimeve më të rëndësishme:
NH 3 H 2 O (conc.) = NH 3 + H 2 O (valë me NaOH)
NH 3 H 2 O + HCl (dec.) = NH 4 Cl + H 2 O
3 (NH3H2O) (conc.) + CrCl3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 H 2 O) (conc.) + ЗBr 2 (p) = N2 + 6NH4Br + 8H2O (40-50 ° C)
2 (NH 3 H 2 O) (conc.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH3H2O) (conc.) + Ag 2 O = 2OH + 3H2O
4 (NH3H2O) (conc.) + Cu (OH) 2 + (OH) 2 + 4H2O
6 (NH3H2O) (conc.) + NiCl2 = Cl2 + 6H2O
Shpesh quhet zgjidhje e amoniakut të tretur (3-10% - -) amoniak të lëngët (emri u shpik nga alkimistët) dhe zgjidhja e koncentruar (18.5-25%) ujë amoniak (prodhuar nga industria).
