Formula kimike e acidit sulfurik. Acidi sulfurik: vetitë kimike, përgatitja
H2SO3, acid dibazik i dobët. Në një formë të lirë ajo nuk është e ndarë, ekziston në zgjidhjet e ujit. Sulfit acid sulfurik ... Fjalor i madh enciklopedik
Acidi sulfurik - (H2SO3) acid i dobët dibazik. Ekziston vetëm në zgjidhje ujore. Kripërat S. deri në Sulfites. Aplikuar në letër pulpë dhe industrinë ushqimore. Shihni gjithashtu Acidet dhe anhidridet ... Enciklopedia ruse për mbrojtjen e punës
acid sulfurik - - [A.S. Goldberg. Anglisht rusisht Fjalor të energjisë. 2006] Temat e energjisë në përgjithësi EN sulfurous acid ... Udhëzuesi i përkthyesit teknik
H2SO3, acid dibazik i dobët. Në një formë të lirë ajo nuk është e ndarë, ekziston në zgjidhjet e ujit. Sulfit acid sulfurik. * * * Acid sulfurik, acid sulfurik, H2SO3, acid dibazik i dobët. Pa pagesë nuk është zgjedhur, ... ... Fjalor enciklopedik
acid sulfurik - sulfito rūgštis statusas T ë sritis chemija formulë H2SO3 atitikmenys: angl. acid rus sulfurous. acid sulfurik ryšiai: sinonimas - vandenilio trioksosulfatas (2-) ... Chemijos terminų aiškinamasis žodynas
H2SO3, acid dibazik i dobët, që korrespondon me shkallën e oksidimit të squfurit +4. Njohur vetëm në zgjidhje ujore holluar. Konstantet e shkëputjes: K1 = 1.6 · 10 2, K2 = 1.0 · 10 7 (18 ° C). Ai jep dy rreshta kripë: Sulfite normale dhe të thartë ... ... Enciklopedia e Madhe Sovjetike
H2SO3, acid dibazik i dobët. Në formën e lirë nuk është e theksuar, ajo ekziston në ujërat. p rah. Kripërat S. k. Sulfites ... Shkenca natyrore. Fjalor enciklopedik
Shihni Squfur ... Fjalori enciklopedik i FA Brockhaus dhe I.A. Efron
Dioksidi i squfurit (dioksidi) formohet nga squfuri i djegur në ajër ose në oksigjen. Gjithashtu, merret nga calcining në ajër ("djegia") e sulfideve të metaleve, për shembull, pirite hekuri:
Sipas këtij reagimi, dioksidi i squfurit zakonisht merret në industri (për metoda të tjera industriale të marrjes së cm, 9 § 131).
Dioksidi i squfurit është një gaz i pangjyrë ("dioksidi i squfurit") me një eapach të mprehtë të squfurit të nxehtë. Ai kondensohet lehtësisht në një lëng të pangjyrë që valë. Kur lëngu zhduket, ka një rënie të fortë të temperaturës (para).
Dioksidi i squfurit është shumë i tretshëm në ujë (rreth 40 vëllime në 1 vëllim uji në); në të njëjtën kohë, bëhet reagimi me ujë pjesërisht dhe formohet acid sulfurosor:
Kështu, dioksidi i squfurit është anhidridi i acidit sulfurik. Kur nxehet, tretshmëria zvogëlohet dhe ekuilibri ndryshon në të majtë; gradualisht dioksidi i squfurit lëshohet përsëri nga zgjidhja.
Molekula është ndërtuar në mënyrë të ngjashme me molekulën e ozonit. Bërthamat e atomeve të saj përbërës formojnë një trekëndësh të pandryshkshëm:
Këtu, atomi i squfurit, si atomi i oksigjenit qendror në molekulën e ozonit, është në gjendje α-hibridizimi dhe këndi është afër. Orientuar perpendicularisht në planin e molekulës, orbitali i atomit të squfurit nuk merr pjesë në hibridizim. Për shkak të këtyre orbitaleve dhe orbitave të ngjashme të orientuara nga atomet e oksigjenit, formohet një lidhje tre-qendrore; palë elektron që mban atë i takon të tre atomeve të molekulës.
Dioksidi i squfurit përdoret për të prodhuar acid sulfurik dhe gjithashtu (në sasi shumë më të vogla) për zbardhjen e kashtës, leshit, mëndafshit dhe si një dezinfektues (për shkatërrimin e kërpudhave të mykut në bodrume, bodrume, fuçi vere, tanke fermentimi).
Acidi sulfurik është një përbërës shumë i brishtë. Dihet vetëm në tretësirat ujore. Kur përpiqen të izolojnë acid sulfurik, ajo shpërbëhet në ujë. Për shembull, kur acidi sulfurik i koncentruar vepron në sulfitet natriumi, dioksidi i squfurit lëshohet në vend të acidit sulfuroz:
Zgjidhja e acidit sulfurik duhet të jetë i mbrojtur nga ajri, përndryshe, absorbimi i oksigjenit nga ajri, oksidohet ngadalë në acid sulfurik:
Acidi sulfurik është një agjent reduktues i mirë. Për shembull, halogjenët e lirë janë restauruar nga halidrat e hidrogjenit:
![]()
Megjithatë, kur ndërveprojnë me agjentë të reduktuar, acid sulfurik mund të luajë rolin e një agjenti oksidues. Pra, reagimi i tij me sulfid hidrogjeni kryesisht vazhdon sipas ekuacionit:
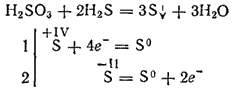
Duke qenë dybashëse, acid sulfurous formon dy rreshta kripëra. Kripërat e saj të mesme quhen sulfite, kripëra acid - hydrosulfites.
Ashtu si acid, sulfites dhe hydrosulfites janë agjentë reduktues. Kur ato oksidohen, fitohen kripërat e acidit sulfurik.
Sulfitet e metaleve më aktivë gjatë kalcinimit treten me formimin e sulfideve dhe sulfateve (reaksioni i vetëoksidimit - vetë-reduktimi):
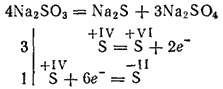
Kaliumi dhe sulfiti i natriumit përdoren për zbardhjen e disa materialeve në industrinë e tekstilit për ngjyrosjen e pëlhurave, në fotografinë. Zgjidhja (kjo kripë ekziston vetëm në solucion) përdoret për përpunimin e drurit në të ashtuquajturën pulpë sulfite, nga e cila merret letër.
Acidi sulfurik është në gjendje të reagojë me oksigjen. Kjo formon acid sulfurik. Ky reagim merr një kohë shumë të gjatë dhe është e mundur vetëm nëse shkelen rregullat e magazinimit. Acidi sulfurik ka si vetitë e oksidimit ashtu edhe të reduktimit. Me ndihmën e saj ju mund të merrni acide halogjene. Një tretësirë ujore kur reagon me klor formon klorur dhe acid sulfurik.
Kur reagon me agjentë të fortë reduktues, acidi sulfurosor luan rolin e një agjenti oksidues. Një nga këto substanca është sulfid hidrogjeni, një gaz me erë shumë të pakëndshme. Ndërveprimi me një solucion ujor të acidit sulfurik, formon squfur dhe ujë. Kripërat e acidit sulfurik gjithashtu kanë vlera reduktuese. Ata janë të ndarë në sulfite dhe hydrosulfites. Reaksionet e oksidimit të këtyre kripërave prodhojnë acid sulfurik.
Prodhimi i acidit sulfurik
Acidi sulfurik formohet vetëm nga bashkëveprimi i dioksidit të squfurit dhe ujit. Nevoja për të marrë gaz të thartë. Kjo mund të bëhet me bakër dhe acid sulfurik. Derdhni butësisht acidin sulfurik të koncentruar në tub dhe hidhni një copë bakri në të. Ngroheni tubin me një llambë shpirtërore.
Si rezultat i ngrohjes, formohet sulfati i bakrit (sulfati i bakrit), uji dhe dioksidi i squfurit, i cili me ndihmën e një tubi të veçantë duhet të sillet në kon me ujë të pastër. Në këtë mënyrë, mund të merret acid sulfurik.
Mos harroni se dioksidi i squfurit është i dëmshëm për njerëzit. Kjo shkakton dëmtimin e rrugëve të frymëmarrjes, humbjen e oreksit dhe dhimbjen e kokës. Zbutja e zgjatur mund të shkaktojë zbehje. Kur punoni me të, duhet të keni kujdes.
Përdorimi i acidit sulfurik
Acidi sulfurik ka veti antiseptik. Përdoret në dezinfektimin e sipërfaqeve, fermentimin e grurit. Mund të përdoret për të zbardhur disa substanca që treten kur reagojnë me oksidantë të fortë (për shembull, klori). Substancat e tilla përfshijnë leshin, mëndafshin, letrën dhe disa të tjerë. Vetitë e tij antibakteriale përdoren për të parandaluar fermentimin e verës në fuçi. Kështu, një pije fisnike mund të ruhet për një kohë shumë të gjatë, duke fituar një shije fisnike dhe aromë unike.
Acidi sulfurik përdoret në prodhimin e letrës. Shtimi i këtij acidi është përfshirë në teknologjinë e prodhimit të pulpës së sulfurit. Pastaj ajo trajtohet me një solucion të hidrosulfit të kalciumit për të lidhur së bashku fibrat.
