Kur lidh 28 g silic me oksigjen. Komponimet e oksigjenit të silikonit
Kremniy.Obschaya harakteristika.Osnovnoe ndryshim karbonit: mungese n komunikim soedineniyah.Silitsidy.Soedineniya me hidrogjen (Silanes) oksidimit dhe gidroliz.Tetraftorid dhe tetrachloride silikonit, silikon gidroliz.Geksaftorosilikaty.Kislorodnye soedineniya.Oksid (IV) .Silikagel.Kremnevaya kislota.Silikaty.Rastvorimost dhe gidroliz.Prirodnye silikate dhe aluminosilikatet tseolity.Kremniyorganicheskie soedineniya.Silikony siloksany.Ispolzovanie dhe komponimet e silikonit ne mjekesi.
silic (lat. Silicium), Si, element kimik i Grupit IV të Sistemit Periodik; numri atomik 14, masa atomike 28.086. Silic gjithashtu ekspozon hibridizimin sp3 të elektronikës
orbitalet. Në shtresën e jashtme elektronike të atomit të silikonit ka valencë 3d-
orbitale (Si: 3s23p23d0),
Silic pas oksigjenit është elementi më i zakonshëm në kore. Ndryshe nga karboni në një shtet të lirë, silic nuk gjendet në natyrë. Komponimet më të zakonshme të saj janë silikat (IV) SiO2 dhe kripërat e acideve silicik - silikate. Ata formojnë guaskën e kores së tokës. Komponimet e silikonit gjenden në bimë dhe kafshë. Nga vetitë kimike të silikonit, si karboni, kjo është një Jometalet, por nemetallichnost është më pak e theksuar, pasi ajo ka një rreze më të madhe atomike
Silic. formon komponimet me pothuajse të gjitha metalet - me ilitsidy (komponimet nuk u gjetën vetëm me Bi, Tl, Pb, Hg). Marrë 250 silicides, përbërja e të cilave (Mesi, MeSi2, Me5Si3, Me3Si, Me2Si et al.) Në përgjithësi nuk i plotësojnë valencat klasike. Silicides ndryshojnë në refractoriness dhe ngurtësinë; Rëndësia e madhe praktike janë ferrosilicon (reductant në shkrirjes lidhjeve të veçanta cm. ferroalloys) dhe MoSi2 molibden silicide (ngrohje elektrike, blades turbinë me gaz dhe të ngjashme. d.).
Silane. Në veprim në silicides e acidit hidroklorik e përgatitur nga lidhjes thjeshtë hidrogjeni e silikonit silanit SiH4:
Silani është një gaz helmues me një aromë të pakëndshme që ndez spontanisht. ajrit
Ata janë reaktive dhe janë agjentë të reduktuar.
reagoni me ujë në temperaturën e dhomës:
SiH4 + 2H2O → SiO2 + 4H2,:
tetrafluoride silikat përgatitur nga fluorinim me fluorine thelbësor të dioksid silikoni.
Procesi fluorinimi kryhet në dy faza në reaktorin flaka, duke drejtuar një tepricë e fluorit thelbësor nga hapi 1 deri në 2.
Rezultati teknik është prodhimi i silikonit në mënyrë të vazhdueshme me rendiment të lartë dhe cilësinë e produktit.
Silic tetrafluoride SiF4 formohet nga veprimi i acidit hydrofluoric (hydrofluoric) në xhami:
Na2SiO3 + 6HF® 2NaF + SiF4 + 3H2O
Komponimet e oksigjenit të silikonit
Komponenti më i rëndësishëm i oksigjenit i silikonit është dioksidi silikonik SiO2 (silicë), i cili ka disa modifikime kristaline.
Modifikimi i temperaturës së ulët (deri në 1143 K) quhet kuarci. Kuarci ka vetitë piezoelektrike. Varieteteve natyrore të kuarcit: kristal rock, topaz, ametist. Varietetet e silicë janë chalcedony, opal, agat,. jasper, rërë.
Silicë është rezistente kimikisht; ndikohet vetëm nga fluori, acidet hidrofluorike dhe solucionet alkali. Lehtë shkon në një gjendje qelqi (qelqi kuarci). Xhami kuarci është i brishtë, shumë kimikisht dhe termikisht i qëndrueshëm. Acidi silikik përkatës SiO2 nuk ka një përbërje specifike. Në mënyrë tipike, acid silikik regjistrohet si xH2O-ySiO2. Acidet silicike u përzgjodhën: H2SiO3 (H2O-SiO2) - meta-silikon (tre-okso-silikon), H4Si04 (2H20-Si02) - orto-silikon (tetra-okso-silikon), H2Si2O5 (H2O * SiO2) - silic dimetik.
Acidet silikike janë substanca të dobëta të tretshme. Në përputhje me natyrën më pak metaloid të silikonit në krahasim me karbonin, H2SiO3 si një elektrolit është më i dobët se H2CO3.
Përkatëse ndaj acideve silicike kripërat-silikatat në ujë janë të pazgjidhshme (përveç silikateve të metalit alkali). Silikatat e tretshme hidrolizohen nga ekuacioni
2SiO3 - + H20 = Si2O52- + 20H-.
Solucione të koncentruara të silikateve të tretshme quhen xham të lëngët. Silikati i zakonshëm i xhamit të qelqit të natriumit dhe kalciumit ka një përbërje të Na20-CaO-6Si02. Ajo është marrë nga reagimi
Njihet një shumëllojshmëri e gjerë e silikates (më saktë, oksosilikate). Një rregullsi e caktuar vërehet në strukturën e oksosilikates: të gjitha përbëhen nga tetrahedra Si04, të cilat janë të lidhura me njëri-tjetrin përmes një atom oksigjeni. Kombinimet më të zakonshme të tetraedrës janë (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), të cilat, si njësi strukturore, mund të kombinohen në zinxhirë, shirita, rrjeta dhe skelete (Figura 4).
Silikatat më të rëndësishme natyrore janë, për shembull, talk (3MgO * H20-4Si02) dhe asbest (SmgO * H2O * SiO2). Ashtu si me SiO2, gjendja e qelqtë (amorf) është karakteristikë e silikates. Me kristalizimin e kontrolluar të qelqit, është e mundur të fitojmë një gjendje të shkëlqyeshme kristaline (sitalls). Sitalet karakterizohen nga forca e rritur.
Përveç silikateve, aluminosilikatet janë të përhapura në natyrë. Aluminosilikate - kornizat oksosilikate, në të cilat një pjesë e atomeve të silikonit zëvendësohet me trivalent Al; p.sh. Na12 [(Si, Al) 04] 12.
Për acidin silikik, një gjendje koloidale është karakteristike kur kripërat e acidit H2SiO3 nuk preken menjëherë. Zgjidhjet kolloidale të acidit silicik (sols) në kushte të caktuara (për shembull, kur nxehet) mund të konvertohen në një xhel me xhel të përhapur homogjen të acidit silikik. Gels janë komponime të molekulës së lartë me një strukturë hapësinore, shumë të lirshme të formuar nga molekulat SiO2, të cilëve boshllëqet janë të mbushura me molekula H2O. Kur dehidraton xhel me silicë, merret xhel silicë - një produkt poroz me kapacitet të lartë adsorpimi.
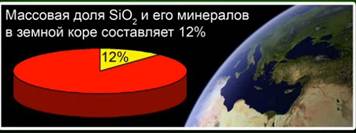
Oksid silikoni (IV) (silicë) - përbërja më e zakonshme në koren e tokës, duke përbërë 12% të masës së saj në formën e mineraleve të ndryshme. Dalloni në mes silicë kristaline dhe amorf. Formula më e thjeshtë për oksidin e silikonit (IV) është SiO2. Ajo kristalizon në grilën atomike.
1) silicë kristaline - në formën e një minerali të kuarcit dhe varieteteve të tij (kristali i kuq, kalcedoni, agat, diaspri, gripi); kuarci formon bazën e rërës së kuarcit të përdorur gjerësisht në ndërtim dhe në industrinë e silikatit.
2) silicë amorf - në formën e përbërjes minerale opal SiO2 nH2O; format tokësore të silicë amorf janë diatomite, Tripoli (toka infuzore); Një shembull i silicë artificiale amorf anhydrous është xhel silicë, e cila është marrë nga metasilicate natriumi:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Xhel silicë ka një sipërfaqe të zhvilluar dhe për këtë arsye absorbon mirë lagështinë.
Xhel silicë është një xhel i tharë i formuar nga supersaturated solutions of acid silicic (nSiO2 · mH2O) në pH\u003e 5-6. Sorbent hydrophilic të ngurta.
pritje
Është marrë nga acidifikimi i solucioneve të silikatit metalik alkali, e ndjekur nga larja dhe tharja e xhelit të formuar:
Acidi silikik. SiO2 është anhidrid i një numri të acideve silicike
Acidi silikik është i ndërtuar nga njësitë strukturore tetrahedral (në çdo njësi të tillë, atomi i silikonit është në qendër të tetraedrit dhe atomet e oksigjenit ndodhen në majë). Lidhjet strukturore, që bashkohen në zinxhirë, formojnë acide më të qëndrueshme të polisilicës:
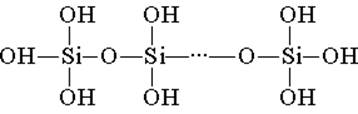
Përbërja e një komponimi të tillë mund të shprehet me formulën (H2SiO3) n. Megjithatë, acid silikik zakonisht përfaqësohet nga formula H2SiO3. H2SiO3 - acid është shumë i dobët, pak i tretshëm në ujë. Kur nxehet, ajo lehtësisht shpërbëhet në të njëjtën mënyrë si acidi karbonik:
Të gjithë acidet silicike janë shumë të dobëta (më të dobëta se qymyri).
silikate. Sallat e të gjitha acideve silicike quhen silikate, megjithëse, si rregull, në literaturën arsimore, silikat nënkuptojnë kripërat e acidit metacilikik. Përbërja e tyre përfaqësohet zakonisht nga formula në formën e përbërjeve të oksideve të elementeve. Për shembull, kalçi silikat CaSiO3 mund të shprehet si: CaO × SiO2.
Silikatat e përbërjes R2O × nSiO2, ku R2O janë oksidet e natriumit ose kaliumit, quhen qelqi i tretshëm dhe zgjidhjet e tyre ujore të përqendruara quhen xham të lëngshëm. Më e rëndësishmja është qelqi i tretshëm në natrium.
Kur qëndron në ajër, zgjidhjet e silikateve rriten të turbullta, pasi që dioksidi i karbonit (IV) në ajër zhvendos acidin silikik nga kripërat e tij:
Acidi silikik është praktikisht i pazgjidhshëm në ujë - kjo pronë përdoret si një reagim cilësor ndaj jonit SiO32-.
Silikatet merren me shkrirjen e silicave me alkaline ose karbonate:
Solubility silicic acid dhe shkalla e shpërbërjes së saj varet nga disa faktorë, nga të cilët më të rëndësishmet janë modifikimi i dioksidit të silikonit, shkalla e shpërndarjes së tij dhe temperatura. Kur lëkura xhel me silicë me ujë, ekuilibri i solubilitetit vendoset për disa orë, në rastin e kuarcit nevojiten shumë muaj dhe madje edhe vite.
SILICATAT NATYRORE (Nga latinishtja SILEX, vdekjet gjini silicis - strall * një silikate natyrore; ... N naturliche Silikate; f silikate NATURELS; ... dhe silicatos Naturales) - klasë të mineraleve, kripëra silicik, ISO dhe acidet geteropolikremnievyh. Pjesa e silikateve natyrore përbën deri në 75% të masës së kores së tokës dhe rreth 25% të specieve minerale. Në natyrë, ka më shumë se 700 silikate natyrore, duke përfshirë mineralet më të mëdha të rock-formimin (feldspars, pyroxenes, amphiboles, mikë, etj).
aluminosilikatet - një grup silikatash natyrale dhe sintetike, anionet komplekse të të cilave përmbajnë silikon dhe alumin. Shembuj të anioneve komplekse: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, dhe nganjëherë Ba2 + dhe Li + veprojnë si katione.
Aluminosilikate natyrale janë mineralet më të zakonshme, ato përbëjnë deri në 50% të masës së kores së tokës. Këto përfshijnë feldspars (albite, orthoclase, anortite), mineraleve argjilore dhe mikë.
zeolites - Këto janë aluminosilikate ujore të kalciumit, natriumit, kaliumit, bariumit dhe disa elementëve të tjerë. Grupi zeolites përfshin më shumë se dyzet minerale, të cilat ndryshojnë në përbërjen (sidomos në numrin e molekulave të ujit në sherbet kristaltë), dhe natyrisht mbi vetitë fizike dhe kimike. Por, pothuajse të gjithë këtë grup të mineraleve është një pronë e përbashkët - ato janë sorbents mira posedojnë veti jon-këmbimit, të aftë për të ndryshuar lëvizjen e joneve individuale dhe molekulare Sieves punë. Dhe relativisht kohët e fundit, këto minerale kanë gjetur një përdorim krejtësisht të papritur - ata filluan të përdoren në bujqësi.
Përbërësit Organosilicon - komponimet në molekulat e të cilave ka një lidhje midis silikonit dhe atomeve të karbonit. Komponimet Organosilicon nganjëherë quhen silikone, nga emri i silikonit latin "silic". Përbërësit Organosilicon përdoren për të prodhuar lubrifikantë, polimere, gome, gome, lëngje silikoni dhe emulsione. Komponimet Organosilicon përdoren në kozmetikë, kimikate shtëpiake, ngjyra dhe llaqe, detergjentë. Një tipar dallues i produkteve të bazuar në komponimet organosilicon nga produkti në bazë të komponimeve organike të zakonshme janë në performancën në përgjithësi të lartë dhe karakteristika, si dhe aplikimet e sigurisë njerëzore. Polimere silikoni mund të përdoren për të bërë moulds në gatim. Polimerizimi i përbërjeve organosilikon dhe ngjitëseve është i sigurt për njerëzit dhe nuk kërkon nxjerrjen.
siloxane - komponimet që përmbajnë silici të alternuara dhe atome oksigjen në një molekulë. Më të lartë kanë siloxane të lartë molekulare - polyorganosiloxanes; shih Polimere silikoni.
silicones (polyorganosiloxanes) - komponimet organosilikon me peshë molekulare me oksigjen të lartë me formulën kimike n, ku R = grupi organik (metil, etil ose fenil). Tani kjo përmbahet përkufizim tashmë shumë e rrallë, dhe në "Silicones" janë të kombinuara si polyorganosiloxanes (vajra p.sh. silikoni si ICP, uji-i neveritshëm llojin e NGL ose peshë të ulët molekulare prej kauçuku SKTN) dhe madje edhe monomers organosilicon (Silanes të ndryshme), mjegulluar dallimin midis termave "silikon" dhe " silikoni ".
Silic metalik  Kristal silic
Kristal silic
silic (SI). Ky element kimik është 1/4 e përbërjes së kores së tokës. Kuarc, kristal shkëmb, rërë, argjilë, granit, mikë, asbest - e gjithë kjo komponimet kimike të silikonit
Siliconi është një element i ndërmjetëm (amfoterik) dhe mund të shfaqë vetitë metalike dhe jo-metalike. Ajo mund të formojë komponimet kimike, të dyja me metale dhe jo-metale.
Silic pastër - një substancë kimikisht e thjeshtë e ngjyrës gri, e fortë, e fortë dhe e brishtë. Kristal silic Ajo ka një famë metalike dhe përdoret gjerësisht në industrinë e gjysmëpërçuesve (është një gjysmëpërçues).
Silic mund të shtrihet si në një gjendje kristaline ( silikon kristalor), dhe në gjendjen amorf ( silic amorf). Silic kristali formohet duke ftohur një zgjidhje të silikonit amorf në një metal të shkrirë. Nga ana tjetër, silic kristali është një material shumë i brishtë dhe lehtë shtypet në një pluhur amorfe. Kështu, silic amorf është një fragment i kristaleve të silikonit kristalor.
Në shtetin e lirë, silic është mjaft i vështirë për t'u marrë. Prodhimi i tij industrial është i lidhur me rikuperimin e kuarcit, formula kimike e të cilit është SiO 2, reduktimi i reduktimit prodhohet nga koks i nxehtë (karbon).
SiO 2 + C → CO 2 + Si
Në laborator, silic pastër është reduktuar nga rërë silicë me magnez metalike duke përdorur reagimin e mëposhtëm:
SiO 2 + 2Mg → Si + 2MgO.
Gjatë kësaj reaksioni, formohet një pluhur kafe prej silici amorf. Kur nxehet, pluhuri mund të reagojë ngadalë me solucione të koncentruar të alkaleve (për shembull, hidroksid natriumi NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - substanca komplekse që rezulton - e quajtur edhe xhami e lëngshme.
Është interesante se aktiviteti kimik i silikonit varet nga madhësia e kristaleve të saj. Silic kristali është më pak kimikisht aktiv se amorf. Ky i fundit reagon lehtësisht me fluorin edhe në temperaturë të zakonshme dhe në një temperaturë prej 400-600 0 C reagon me oksigjenin, klorin, bromin, squfurin për të formuar komponimet përkatëse kimike. Në temperatura shumë të larta, silikon reagon me azot dhe karbon për të formuar, respektivisht, nitride dhe karabit silikoni.
Nëse përpiqeni të shpërndani silikon në një përzierje të HF (hydrofluoric) dhe HNO 3 acid nitrogjen, atëherë reagimi nuk do të vazhdojë. Por nëse kryeni një reagim kimik me një alkali, për shembull me hidroksid kaliumi, atëherë reagimi do të bëhet me formimin e një kripë të acidit silikik
Si + KOH → K 2 SiO 3 + H 2
Nëse kalcinuar në silicë furre (rërë) me koks, ajo rezulton një substancë shumë të ngurtë kristalor. karborund SIC
SiO 2 + 3C → SiC + 2CO
karborund - substancë shumë e fortë dhe refraktare. Në industri, ajo prodhohet në sasi të mëdha për shkak të këtyre pronave. Është interesante se grilata kristalore e karborundit është e ngjashme me grilën e substancës më të vështirë - diamant, por në të, atomet individual të karbonit zëvendësohen në mënyrë uniforme nga atomet e silikonit.
Në temperatura të larta, si dhe gjatë reaksioneve kimike nën veprimin e acideve në komponimet metalike me silikon, silane SiH 4.
Cilan - kjo është një gaz i pandjeshëm vetë-ndezës. Mund të ndizet në ajër për të formuar silicë dhe ujë.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Nëse oksidi i silikonit SiO 2 ndizet në prani të karbonit në një rrymë klori, ndodh një reaksion kimik me formimin e klorurit të silikonit
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Klorur silikoni - është një lëng, temperatura e vlimit prej të cilave është vetëm 54 0 C. Klorid silikoni shpërndahet lehtësisht në ujë me formimin e një solucioni të dy acideve: silicic dhe hydrochloric
SiCl4 + H2O → H2Si03 + HCl
Nëse ky reagim kimik vazhdon në një atmosferë të ajrit të lagësht, do të shfaqet tymi i trashë gjatë formimit të dy acideve.
Fluor i silikonit SiF 4 - formuar si rezultat i një reaksioni kimik të acidit hidrofluorik dhe oksidit të silikonit
SiO 2 + 4HF → SiF 4 + 2H 2 O
Fluori i silikonit është një gaz i pangjyrë me erë "të fortë". Si dhe klorur silikoni, në ujë kjo gaz formon dy acide: silic dhe hydrofluoric. Por interesant, fluori i silikonit mund të ndërveprojë me acidin hidrofluorik për t'u formuar acid hexafluorosilicic formula kimike e të cilit është H 2 SiF 6. Kripërat e saj dhe acidi vetë janë helmues.
silic
Metale bazë dhe jo-metale
Në këtë mësim do të studioni temën e "silicit". Konsideroni informacion në lidhje me silikonin: struktura e tij elektronike, ku silic është në natyrë, studioj allotropia e silikonit, shpjegon vetitë e tij fizike dhe kimike. Mësoni se ku silikon përdoret në industri dhe fusha të tjera, si prodhohet. Ju do të njiheni me silicë, acid silicik dhe kripërat e saj - silikat.
Tema: Metalet bazë dhe jo metalet
Mësimi: Silic. Gazra fisnike
Siliconi është një nga elementët më të zakonshëm kimikë në koren e tokës. Përmbajtja e saj është gati 30%. Në natyrë, ajo gjendet kryesisht në formën e formave të ndryshme të dioksidit të silikonit, silikateve dhe aluminosilikates.
Silic është tetravalent në pothuajse të gjitha përbërjet e tij. Në këtë rast, atomet e silikonit janë në gjendje të ngazëllyer. Fig. 1.
Për të shkuar në këtë gjendje, një nga elektronet 3s zë një vend të zbrazët në orbitalët 3p. Në këtë rast, në vend të 2 elektroneve të palëkundur në gjendjen tokësore, siliconi në gjendje të ngazëllyer do të ketë 4 elektronet e palëvizur. Ai do të jetë në gjendje të krijojë 4 obligacione kovalente nga mekanizmi i këmbimit.


Atomet e silikonit nuk janë të prirur për formimin e lidhjeve të shumëfishta, por përbëjnë komponimet me lidhje të vetme-Si-O-. Silic, ndryshe nga karboni, nuk është tipik i allotropisë.
Një nga modifikimi allotropic është silic kristalornë të cilën çdo atom siloni është në sp 3 hibridizimi. Fig. 2, 3. Siliconi kristalor është një substancë e ngurtë, e fortë dhe e qëndrueshme kristaline e gri të errët me një shkëlqim metalik. Nën kushte normale - një gjysmëpërçues. Ndonjëherë, silic amorf gjithashtu emetohet si një modifikim alotropik i silikonit. Kjo është një pluhur ngjyrë kafe e errët, më kimikisht aktive se sa silic kristaline. Nëse kjo është një modifikim allotropic është një pikë e diskutueshme.
Vetitë kimike të silikonit
1. Ndërveprimi me halogjene
Si + 2F 2 → SiF 4
2. Kur nxehet, djegia e silicit në oksigjen, formohet silicë (IV).
Si + O 2 → SiO 2
3. Në temperatura të larta, silici ndërvepron me azot ose karbon.
3Si + 2N 2 → Si 3 N 4
4. Siliconi nuk reagon me solucione ujore të acideve. Por ajo shkrihet në alkaline.
Si + 2NaOH + H2O → Na2Si03 + 2H2
5. Kur silikon shkrihet me metale, formohen silicide.
Si + 2Mg → Mg 2 Si
6. Silicioni nuk ndërvepron direkt me hidrogjen, por komponimet e hidrogjenit të silikonit mund të merren nga ndërveprimi i silicideve me ujë.
Mg2 Si + 4H2O → 2Mg (OH) 2 + SiH 4 (silane)
Silanët janë të ngjashëm në strukturë me alkanët, por janë mjaft reaktiv. Monosilani më i qëndrueshëm është i ndezshëm në ajër.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Marrja e silikonit
Siliciti merret me reduktim nga oksidi i silikonit (IV)
SiO 2 + 2Mg → Si + 2MgO
Një nga detyrat është për të marrë silic të lartë të pastërtisë. Për këtë qëllim, silic teknik është transferuar në tetraklorid silikoni. Tetrakloridi që rezulton reduktohet në silan, dhe silani dekompozohet në silikon dhe hidrogjen kur nxehet.
Silic është në gjendje të formojë dy okside: SiO 2 - oksid silikoni (IV) dhe SiO - oksid silikoni (II).
siO - oksid silikoni (II) - kjo është një substancë ngjyrë kafe e errët amorf, e cila formohet nga bashkëveprimi i silikonit me oksid silikoni (IV)
si + Sio 2 → 2 Sio.
Megjithë stabilitetin e saj, kjo substancë thuajse nuk përdoret kurrë.
siO 2 - oksid silikoni (IV)


Kjo substancë përbën 12% të kores së tokës. Fig. 4. Përfaqësohet nga minerale të tilla si kristali shkëmb, kuarci, ametist, limoni, jasper, kalcedoni. Fig. 5.
SiO 2 - oksidi i silikonit (IV) - një substancë e strukturës jo molekulare.
Grilat e saj kristalë janë atomike. Fig. 6. Kristalët SiO 2 kanë formën e një tetraedri, të cilat janë të ndërlidhura nga atomet e oksigjenit. Formula e molekulës (SiO 2) n do të ishte më e saktë. Meqë SiO 2 formon një substancë të strukturës atomike, dhe CO 2 - të një strukture molekulare, dallimi në vetitë e tyre është e qartë. CO 2 është një gaz, dhe SiO 2 është një substancë kristaline e ngurtë transparente, e pazgjidhshme në ujë dhe e fortë.
Vetitë kimikesiRreth 2
1. Oksidi i silikonit (IV) SiO 2 është një oksid acid. Ajo nuk reagon me ujë. Acidi silikik nuk mund të merret nga hidratimi i SiO 2. Kripërat e saj, silikatet, mund të merren duke reaguar SiO2 me solucione të nxehta alkali.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Reagimet me karbonatet e metaleve alkaline dhe alkaline.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Ndërvepron me metale.
SiO 2 + 2Mg → Si + 2MgO
4. Reagimi me acid fluoreshent.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Vetitë kimike të acidit silikik dhe silikateve
Marrja e acidit silicik
Acidi silikik precipiton si një përbërës polimerik. Formulat e acidit silikik -
H 2 SiO 3 (forma meta) dhe H 4 SiO 4 (forma orto) - pasqyrojnë raportin e elementeve, por jo përbërjen e vërtetë. Konvencionalisht, në aeroplan, përbërja e acidit silikik përshkruhet si Fig. 7.
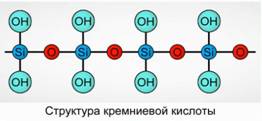
Për acidin silicik përdoret gjithmonë formula H2 SiO3.
1. H 2 Sio 3 dekompozohet kur nxehet
H 2 SiO 3 H 2 O + SiO 2 (xhel silicë)
2. Ndërvepron me zgjidhje alkali
H 2 SiO 3 + 2 NaOH Na 2 SiO 3 + 2H 2 O
Kripërat e acidit silikik - silikate - i referohen komponimeve jonike. Këto janë substanca solide pa ngjyrë. Vetëm silikat të metaleve alkaline, përveç litiumit, janë të tretshëm në ujë.
1. Silikatat e tretshme hidrolizohen nga anioni
Na 2 SiO 3 + H 2 O 3 NaHSio 3 + NaOH
2. Silikatat e tretshme bashkëveprojnë me acide të forta.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
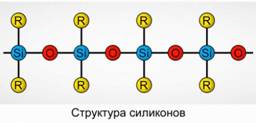
Polyorganosiloxanes (silikonet)
Polyorganosiloxanes (silikonet) janë oksigjenuar, komponimet organosilikon me peshë molekulare të lartë.
R 2 [ Sio] n
R është një grup organik (metil, etil ose fenil). Baza e strukturës së siloksaneve është një zinxhir i atomeve dhe oksigjenit të alternuar të silikonit. Figura 8. Duke ndryshuar gjatësinë e zinxhirit dhe grupet organike, mund të merren silikone me vetitë e ndryshme. Duke ndryshuar kushtet e polimerizimit, ju mund të merrni molekula me gjatësi të ndryshme.


Polimeret e zinxhirit të shkurtër janë lëngje, më të gjata janë lubrifikantë të vlefshëm. Fig. 9, të cilat mbajnë pronat e tyre në një gamë të madhe temperature nga
100 0 С deri + 300 0 С. Më shumë molekula formojnë gome që nuk humbasin elasticitetin e tyre në temperatura të ulëta. Kanë rezistencë të lartë ndaj tretjes, janë kimikisht inerte. Fig. 10. Kjo shkakton variante të ndryshme të aplikimit të tyre. Ato mund të përdoren për të krijuar makina artificiale ose makina të veshkave, dhe mund të përdoren si këpucë për këpucë. Polimere Siloxane përdoren në mjekësi për të krijuar implante të ndryshme të indeve të buta, meqë polimeret e tilla janë kimikisht inerte dhe nuk refuzohen nga trupi. Ato nuk janë të lagura me ujë. Përdoret në krem. Kur aplikoni këtë krem në duart e tij, ai do të zëvendësojë dorashka gome.
Kopshti Inorganik
Në një gotë transparente të mbushur me silikat natriumi, ngjyejini kristalet e kripërave të ngjyrosur, për shembull, sulfat bakri. Pas njëfarë kohe, mund të shihet që tubat e hollë të formuar nga kristalet, të cilat përbëhen nga silikat të pazgjidhshëm. Fig. 11.

Marrja e stuko "budalla"
Vëllime të barabarta të silikatit të natriumit dhe alkoolit mjekësor janë të përziera. Precipitati filtrohet dhe shtrydh në mënyrë që të mos pihet alkooli. Kjo është stuko. Fig. 12. Është quajtur kështu sepse ishte planifikuar ta përdorte atë si një stuko për dritare. Por doli se ajo ka prona të tilla që nuk mund të përdoret për qëllimin e synuar. Nëse e rrotulloni topin dhe e hedheni në dysheme, ajo do të kërcejë si një top gome. Nëse vendoset në tavolinë, ajo do të përhapet si një lëng. Nëse goditni një objekt të fortë, ai do të shkatërrohet si një trup i ngurtë. Pas një kohe, kur alkooli të thahet, kjo stuko do të shkërmoqet.
![]()
Përmbledhur mësimin
Në këtë mësim, ju keni studiuar temën "Silic". Ne shqyrtuam informacione për silikonin: struktura elektronike e tij, ku silic është vendosur në natyrë, ka studiuar allotropinë e silikonit, shpjegoi vetitë fizike dhe kimike të saj. Ata mësuan se ku përdoret silic në industri dhe zona të tjera, si prodhohet. Ju u takuat me silicë, acid silicik dhe kripërat e tij - silikat.
referencat
1. Rudzitis G.E. Kimi. Bazat e kimisë së përgjithshme. Klasa 11: libër mësimor për institucionet arsimore: niveli bazë / G.E. Rudzitis, F.G. Feldman. - botimi i 14-të. - M .: Iluminizmi, 2012.
2. Popel P.P. Kimi: 8 kl .: Tekste për shkollat e mesme / PP. Popel, L.S. - К.: ИЦ "Academy", 2008. - 240 fq.: Ill.
3. Gabrielyan O.S. Kimi. Klasa e 11-të. Niveli bazë. 2 ed., Sr. - M .: Drofa, 2007. - 220 f.
detyrat e shtëpisë
1. № 2-4 (faqe 138) Rudzitis G.E. Kimi. Bazat e kimisë së përgjithshme. Klasa 11: libër mësimor për institucionet arsimore: niveli bazë / G.E. Rudzitis, F.G. Feldman. - botimi i 14-të. - M .: Iluminizmi, 2012.
2. Cilat janë aplikimet e polyorganosiloxanes.
3. Krahasoni vetitë e modifikimeve allotropic të silikonit.
