Përzierjet e kalciumit dhe magnezit
Pra, duke përcaktuar dje se sa kalcium përmban në vezën e grirë, pyetja u ngrit "për të pirë apo jo për të pirë?". Ashtu si shumica e njerëzve, dalin me çdo gjë nga pikëpamja shkencore dhe derisa ta shoh vetë, të zbuloj, kontrolloj, të ndiej një fjalë për një grua. Prandaj, unë do t'i ndaj mendimet e mia në bazë të informacionit të zbuluar rreth vezës së vezëve dhe kalciumit.
Mbledhja në internet e informacionit rreth përdorimit të guaskës së vezëve si një shtesë ushqimore më shumë se një herë erdhi në të gjitha vërejtjet kritike të mjekëve se karbonati i kalciumit i përfshirë në shellin e vezës është i pazgjidhshëm në ujë dhe për këtë arsye nuk mund të absorbohet nga trupi.
Për më tepër, historia e bashkëshortit të mikut tim u kujtua se gjatë shtatzënisë ajo i tha mjeku i saj, i cili kishte vërejtur se po merrte predha të grimcuar vezë - mjeku e hoqi atë dhe përshkroi një lloj kompleksi që përmbante kalcium.
Ku është e vërteta?
Në të vërtetë, karbonati i kalciumit CaCO3 (pikërisht në këtë lloj, kalciumi është në vezën e vezës) është i pazgjidhshëm në ujë dhe alkool.
Një parakusht i vërtetë i domosdoshëm për thithjen e kalciumit është solubility e saj në ujë.
Por mbani mend se baza e tretjes sonë është acidi klorhidrik që kalon në stomak.
Dhe kjo është ajo që ndodh në stomakun tonë:
СaCO3 + 2HCl (acid klorhidrik) = СаCl2 (klorur kalciumi) + Co2 + H20
Por kloruri i kalciumit është krejtësisht i tretshëm në ujë !!! Është në këtë formë që kalciumi absorbohet!
Nuk i di mjekët? Ose ata thjesht janë dinak dhe na shesin ilaçe!
Plus, gjatë kësaj reaksioni, ndodh një rënie në aciditetin e stomakut. Ajo që është e rëndësishme për njerëzit që vuajnë nga aciditeti i lartë.
Një shembull është gruaja ime, ajo ka aciditet të lartë, dhe ajo merr një vezë të vogël të grirë çdo ditë dhe kjo zgjidh dy probleme në të njëjtën kohë dhe kompenson mungesën e kalciumit dhe ul aciditetin e saj. Por pluhuri shell veze shuhet lëng limoni nuk mund të pij - nuk ka përzierje! Dhe tani e kuptoj pse.
Siç kemi parë më lart, për thithjen e kalciumit nga karbonati i kalciumit kërkon lëng gastrik me aciditet të lartë.
Në jetën reale, shumë shpesh ndodh një situatë kur aciditeti i stomakut është i ulët ose zero. Kjo situatë është veçanërisht karakteristike për njerëzit e moshuar, kur nevoja për kalcium është veçanërisht e lartë për të parandaluar osteoporozën. Për shembull, pas 50 vjetësh, aciditeti i ulët ndodh në rreth 40% të njerëzve. Në këto kushte, thithjen e karbonatit te kalciumit per shpërbërjen në stomak është e nevojshme, acid klorhidrik, bie në 2%.
Ndoshta përgjigja është arsyeja pse njerëzit e moshuar shpesh vuajnë nga sëmundje që lidhen me mungesën e kalciumit - ata thjesht nuk mund të ketë atë në mënyrë të zakonshme për të mësuar.
Tani e konsiderojnë pse shumë receta për marrjen e vezëve grimcuar janë këshilluar për të shlyer atë me lëng limoni.
Kur shtojmë lëng limon, acid citrik pluhur karbonat kalciumi (CaCO3) është në reaksion me një acid citrik (C6H8O7) dhe të marrë citrat kalciumi (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = CA3 (C6H5O7) 2 + 3CO2 + 3H2O
Këtu është. Dhe absorbimi i citratit të kalciumit, i cili nuk kërkon acid klorhidrik në stomak, është 44%. Si rezultat, në kushtet e aciditetit të ulët të sildenafil kalciumit në trup merr 11 herë më shumë kalcium se karbonat!
Dhe citrat kalciumi tashmë është një ilaç i njohur që na është shitur për para! Dhe ata e bëjnë këtë, vetëm ata nuk përdorin lëng limoni, por acid limoni!
Nga rruga, karbonat kalciumi (vezë e vezëve të copëtuar) është një ushqim i regjistruar ushqyes. E170Dhe citrate kalciumi (eggshells tona grimcuar derdhur lëng limoni) është një shtesë ushqyese e regjistruar E333! Dhe ata janë shtuar në shumë produkte ushqimore, veçanërisht produktet e qumështit, përfshirë qumështin, për të rritur përqindjen e kalciumit !.
Pra, pse të paguani më shumë!
Përfundim, nëse keni aciditet të lartë - ndoshta më mirë të përdorni një eggshells grimcuar, në qoftë se aciditeti reduktohet ndoshta më mirë për të shuar pluhur shell vezë me lëng limoni.
Dhe më shumë,
Në natën, ka një sekretim të përshpejtuar të kripërave minerale nga trupi (circadian proceset përshpejtimi rithithes në eshtra). Prandaj, përgatitjet e kalciumit duhet të merren pas drekës dhe në mbrëmje.Kjo do të parandalojë humbjen e përshpejtuar e kalciumit gjatë gjysmës së dytë të natës, sidomos në nivelin e saj të reduktuar (ose mungesa) në zorrë. Gjithashtu, vërehet efekt negativ negativ i dozës së veprimtarisë farmakoterapeutike të kalciumit: në doza të ulëta ky biometall absorbohet më mirë se në të lartë.
Lidhur me këtë më racionale për të marrë drogën disa herë në ditë.
Ne lexojmë, diskutojmë. Më poshtë janë disa artikuj mbi këtë temë.
__________________________________________________________________________________________________________
Citrate kalciumi kundrejt karbonatit të kalciumit
Burimi i< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Citrate kalciumi.
Kalciumi citrate është një burim i shkëlqyer i kalciumit të absorbuar, i cili luan një rol shumë të rëndësishëm në trup, sepse ndikon në shumë procese enzimatike dhe koagulimin e gjakut. Mungesa e kalciumit çon në brishtësinë e eshtrave dhe osteoporozën. Për fëmijët e vegjël, është e mirë për shëndetin e dhëmbëve, të rriturit kanë nevojë për konsum të rregullt të kalciumit për të stabilizuar presionin e gjakut.
Sipas Institutit Kombëtar të Kancerit (SHBA), shtojca E-333 potencialisht mund të parandalojë kancerin e zorrës së trashë dhe kanceret e tjera. Përveç kësaj, citrate të kalciumit përdoren në mjekësi për të hequr metalet e rënda nga trupi.
Meqë citrati i kalciumit është një nga format më të rëndësishme të transportit të kalciumit në trupin e njeriut, përdoret në mjekësi së bashku me karbonat kalciumi më pak efektiv (shtues E-170) për të rimbushur rezervat e kalciumit në trup. Për të njëjtën arsye, citrat kalciumi përdoret në formën e shtesave dietike (shtesa dietike).
Në industrinë ushqimore, E-333 shtues përdoret si stabilizues, ruajtës, rregullator i aciditetit, fiksues me ngjyra.
Si stabilizues, shtesa ushqimore E-333 përdoret në prodhimin e qumështit të kondensuar, kremës, krem djathit. Në bllokime, pelte dhe fruta të konservuar, E-333 shtues përdoret si rregullator i aciditetit. Citratet e kalciumit gjithashtu përdoren gjerësisht për të pasuruar kalciumin në qumësht dhe produkte qumështi, produkte buke dhe mielli, dhe pije joalkoolike.
Në pamje, citrat kalciumi është një pluhur i bardhë me një shije të theksuar të thartë. I tretshëm në ujë. Formula molekulare e citratit të kalciumit: Ca3 (C6H5O7) 2. Merrni E-333 nga bashkëveprimi i acidit citrik me hidroksid kalciumi.
Prona dhe funksionet teknologjike:
Emrat e mundshëm të shtesave ushqimore:
- E-333
- E-333
- Citrate kalciumi
- Kalciumi citraton
- Citrate monokalciumi
- Citrate dikalci
- Citrate trikalciumi
_____________________________________________________________________________________________
Kalciumi Citrate
Në mes të shekullit të njëzetë. filloi një lloj "bumi": biokimistët, fiziologët, biofizikantët, farmakologët dhe mjekët filluan të tregonin një interes në rritje për të studiuar rolin e kalciumit në rregullimin e aktivitetit të organeve dhe sistemeve të trupit. Janë zbuluar që jonet e kalciumit janë përfshirë në ngacmimin dhe tkurrjen e qelizave të muskujve, rregullimin e permeabilitetit të membranës së qelizave, ndërveprimet ndërcellulare, koagulimin e gjakut, sekretimin e hormoneve, ndërmjetësuesit, enzimat; kryejnë funksionin e një sinjal transducer që hyn në qelizë, të marrë pjesë në proceset e rregullimit të metabolizmit intracellular, duke përfshirë energjinë. Në sipërfaqen e membranës së kardiomiokiteve dhe enëve të joneve të kalciumit të lirë është 1000 herë më shumë se në citosolin e qelizave. Nga hapësira ekstracelulare ata depërtojnë në citoplazmë përmes kanaleve të veçanta të kalciumit, duke ndikuar në procese të ndryshme fiziologjike dhe funksione të qelizave të të gjitha organeve, tonin vaskular, intensitetin e systoleve, diastolin.
Kalciumi luan një rol të rëndësishëm në formimin e indeve të eshtrave dhe ruajtjen e strukturës dhe funksionit normal të saj. Së bashku me proteina të veçanta, jonet e kalciumit sigurojnë ngurtësinë dhe elasticitetin e kockave.
E gjithë kjo shërbeu si një themel teorik për zhvillimin dhe futjen e përgatitjeve të kalciumit bazuar në kripërat e saj në praktikë mjekësore. Aktualisht, në praktikën mjekësore, përdoren kripërat e tilla të kalciumit si glicerofosfat, glukonat, karbonat, laktat, citratet, kloridet, fosfatet dhe shumë të tjerë.
Farmakokinetika e drogës CALCIUM CITRATE ka karakteristikat e veta. Kalciumi absorbohet nga zorra në një formë të tretshme dhe jonizuese. Shpërndarja e drogës ndodh më mirë në mjedisin acid të stomakut. Kalciumi i tretur i jonizuar depërton mirë në të gjitha indet, depërton në barrierën placentale, kalon në qumështin e nënës. Zgjidhet kryesisht në feces, rreth 20% - me urinë. Një tipar i rëndësishëm i Citratit të Kalciumit është aftësia e ulët për të formuar gurë në veshka, gjë që është e rëndësishme me përdorimin afatgjatë të kësaj kripë. Kjo është për shkak të faktit që kripta e citratit zvogëlon sasinë e oksalatit në urinë.
Përshtatshmëria biologjike përcaktohet nga shpejtësia dhe masa në të cilën përbërës aktiv absorbuar nga forma e dozimit, ajo bëhet e disponueshme në vendin e veprimit terapeutik të synuar.
Natën, ka një çlirim të përshpejtuar të kripërave minerale nga trupi (përshpejtimi qarkullues i proceseve resorptive në kockë). Prandaj, përgatitjet e kalciumit duhet të merren pas drekës dhe në mbrëmje, gjë që do të parandalojë humbjen e përshpejtuar të kalciumit në gjysmën e dytë të natës, sidomos me nivelin e zvogëluar (ose mungesën) në zorrë. Efekti negativ i dozës së varur të aktivitetit farmakoterapeutik të kalciumit është vërejtur: ky biometal absorbohet më mirë në doza të ulëta sesa në doza të larta. Në këtë drejtim, është më racionale që të marrë drogën disa herë në ditë. Për grupmoshat e ndryshme ekzistojnë norma të ndryshme fiziologjike të marrjes së kalciumit (tabela).
tabelë
Shkalla e rekomanduar e marrjes së kalciumit në njerëz të moshave të ndryshme
(sipas Shoqatës Kanadeze për Osteoporozën)
Vitamina D, acidi klorhidrik, laktoza, acidi citrik, prania e proteinave në ushqim, fosfor, magnez, si dhe disa ushqime si gjalpë, vezë, qumësht, peshk, yndyrë cod, lakër etj, kontribuojnë në thithjen e joneve të kalciumit.
Përthithja e kalciumit po përkeqësohet: mungesa e proteinave në ushqim, respektimi i rreptë i një diete vegjetariane, mungesa e magnezit, fosforit, ushqimet e pasura me acid oksalik (borzilok, raven, spinaq).
Përthithja e kalciumit ngadalësohet në sëmundjet e organeve të tretjes (gastrit, enterit, kolit, ulçerë peptike), pankreasit (diabeti, pankreatiti), patologjitë e organeve të tjera endokrine.
Duhet të theksohet se disa ilaçe, sidomos glukokortikoidet, barnat kontraceptive hormonale për përdorim sistemik, levotiroksina gjithashtu përkeqësojnë thithjen e joneve të kalciumit.
Sipas rezultateve të hulumtimit shkencor (të dhëna nga Shoqata Kanadeze për Osteoporozën), nuk ka dëshmi bindëse mbi bazën e të cilave mund të rekomandohet konsumi shtesë i mineraleve të tjera (magnez, zink, bakër etj.) Për parandalimin ose trajtimin e osteoporozës.
Rezultatet e studimeve klinike të kryera në Ukrainë dhe në vende të tjera kanë konfirmuar efektivitetin e lartë të kësaj droge në trajtimin e shumë sëmundjeve. Citrat kalciumi përdoret gjithashtu për qëllime profilaktike në sëmundje të ndryshme.
Me osteoporozën tek njerëzit e moshuar, ostiomalacia CALCUM CITRATE është e përshkruar 2-6 tableta në ditë, duke e ndarë dozën ditore në 3-4 doza. Drogës është marrë para ngrënies ose 1-1,5 orë pas një vakt, për 3 muaj. Pacientë të tillë gjithashtu duhet të përshkruhen vitamina D3 prej 400-800 IU në ditë, dhe gjithashtu përfshijnë vajin, qumështin, peshkun dhe vezët në dietë.
Kalciumi citrate - formulimi optimale për kalcium, jo vetëm të rriturit, por edhe fëmijët dhe adoleshentët, si ajo kontribuon për të densitetit të kockave mineral, duke rritur në masë e kockave dhe për të forcuar dhëmb smalt dhe dentin. Fëmijët nën 6 muaj emërojë 1/2 tabletë (250 mg) (grimcuar, tretur në një sasi të vogël të qumështit), të moshës 6-12 muaj - edhe në 1/2 tabletë 2 herë në ditë, të moshës 1 vit për 10 vjet - 1-2 tableta, 10-18 vjeç - 2-3 tableta në ditë.
Indikacionet për emërimin e Citratit të Kalciumit janë:
hypocalcemia për shkak të gjakderdhjes së origjinave të ndryshme, si dhe gjatë shtatzënisë dhe laktacionit, me lëndime - për të plotësoj rritje nevojën e trupit për jonet e kalciumit;
shkeljes së përthithjes kalciumi në sëmundjeve të traktit të tretjes, dhe një të rritur nivelin e sekretimit te kalciumit nëpërmjet veshkave dhe të zorrëve;
hypoparathyroidism, dehidratim i gjenezës të ndryshme, të sëmundjeve alergjike dhe komplikimet alergjike kur marrë medikamente, rritje depërtueshmëri të enëve të gjakut, të reduktuar koagulimit të gjakut.
citrate kalciumi duhet të administrohet kur të marrë glukokortikoideve, kontraceptivët oralë, Levothyroxine. Në tre rastet e fundit, ilaçi merret me 1 tabletë 6 herë në ditë pas ngrënies.
Kalcium Citrate tolerohet zakonisht mirë, nganjëherë mund të lindin mostretje (kapsllëk ose diarre, nauze, të vjella, humbje e oreksit, dhimbje barku), poliuria.
Nuk rekomandohet marrje të njëkohshme të sildenafil kalcium me antacids që përmbajnë alumin, për shkak të ulur efektivitetin e tyre. Ajo është e padëshirueshme për të përshkruajnë atë në lidhje me përgatitjet e tjera kalcium.
Në përfundim, mund të vërehet vetitë farmakologjike pozitive të kalcium citrilat:
kripa e kalciumit citrate është shpërbërë dhe dhe absorbohet në traktin e tretjes, që rezulton në absorbability mirë të kalciumit në trup dhe rrjedhimisht efikasitetin e saj në profilaktik ose aplikim terapeutikqë është konfirmuar nga rezultatet e shumë studimeve klinike.
Rreziku i ulët i formimit të gurit në veshka, ndërsa duke marrë drogë rrit vlerën e sildenafil kalcium me përdorim të zgjatur.
IS Chekmaev, Shef i Departamentit të Farmakologji me normë Klinike Farmakologjisë të Universitetit Mjekësore Kombëtare, anëtar përkatës i Akademisë Kombëtare të Shkencave dhe Akademisë së Shkencave Mjekësore të Ukrainës, nderuar Punëtor i Shkencës dhe Teknologjisë, Profesor
Faqe 1
Reagimi i karbonateve me acidet mund të përdoret si një mostër për karbonatet. Acidi karbonik është një acid shumë i dobët dhe i paqëndrueshëm. Ajo mund të jetë e shtrydhur nga kripërat e saj nga veprimi i acideve më pak të paqëndrueshëm dhe më të fortë.
Në mënyrë të ngjashme, reagimet e karbonatit të kalciumit me acidet vazhdojnë.
Si rezultat i reagimit të karbonatit me acid klorhidrik, merren klorur kalciumi dhe magnez, të cilat shpërndahen mirë në ujë dhe mbeten në formën e një solucioni të përqendrimeve të ndryshme. Shkalla e reagimit në mbledhësit e këtij lloji varet kryesisht nga presioni dhe temperatura.
Si rezultat i reagimit të karbonatit me acid klorhidrik klorur kalciumi dhe magnez, i tretshëm mirë në ujë dhe mbetur në formën e një zgjidhjeje të përqendrimeve të ndryshme.
Futja e karbonatit të natriumit jo të tharë në reaksion kërkon një presion më të lartë dhe një rritje në sasinë e katalizatorit.
Shpjegimi i fenomeneve të shënuara ose të vëzhguara: pse reagimi i karbonatit të kalciumit me acid sulfurik fillon në fillim me dhunë dhe pastaj ndalet. Pse kur nxehet substanca e thatë e karbonit të amonit zhduket nga tubi.
Efekti i dobishëm i karbonatit të kalciumit në stabilitetin e çimentos Portland mund të shpjegohet me reagimin e karbonatit me minerale klinker që përmbajnë alumini. Kështu, përbërësi aluminat i gurit të çimentos lidhet kimikisht para se të futet në kontakt me sulfatet e mjedisit.
Disa aplikime të karbonatit barium bazohen në pazotshmërinë praktike të sulfatit barium, i cili formohet nga reaksioni i karbonatit barium me substanca që përmbajnë jonet sulfate. Pra, kur thahen një tullë para se të digjet, në sipërfaqen e saj shfaqet lulëzim i bardhë, i shkaktuar nga kristalizimi i sulfatit të gipsit ose magnezit që përmbahen në argjilë. Për të parandaluar që kjo të ndodhë, barium karbonat shtohet në balta, e cila shkakton reshjet e jonit të sulfatit.
Në hyrjen e tij në kiminë e solids, Hedwal, si një shembull i një reagimi teorikisht të mundshëm, rezulton në reagimin e karbonatit të kalciumit me SiO2, gjë që rezulton në formimin e silikatit të kalciumit. Ai e shoqëron këtë shembull duke vënë në dukje se me të ashtuquajturat metamorfozë gjeotermale, temperatura e zakonshme nuk mjafton, pasi reagimi ndërmjet karbonatit të kalciumit dhe acidit silikoz mund të vërehet në kushte laboratorike vetëm në temperatura prej 500 ° C.
Për të zvogëluar koston e formimit të flegmës në këtë proces, Klima dhe Ward sugjeruan përdorimin e zgjidhjes karbonatike të amonit (në vend të nitratit të amonit) dhe krijimin e gëlbazës për shkak të reagimit të karbonatit të pasuruar të amonit me gëlqere.
Ndërsa rritet temperatura, reagimi ndryshon drejt formimit të një silikat më alkaline. Gibson dhe Ward11 në reagimin e karbonatit të natriumit me kuarc në një temperaturë prej 726 deri në 805 C në një rrymë të azotit treguan se orto-silikat formohet në praninë e një sasie të mjaftueshme të karbonatit të natriumit. Shkalla e reagimit varet nga koha, madhësia e mostrës, shkalla e rrjedhjes së gazit dhe përbërja e përzierjes së reagimit. Gibson dhe Ward argumentojnë se ka silikate natriumi të klasës së ndërmjetme.
Karbonat i tepërt i natriumit titrohet me acid klorhidrik. Sasia e squfurit në produktin e analizuar llogaritet nga sasia e karbonatit të natriumit që ka reaguar.
Dhe karbonat kalciumi dhe si ndërveprojnë këto komponime kimike.
Karbonat kalciumi
Grilë karbonat kalciumi CaCO₃CaCO3 është një përbërje shumë e zakonshme në botë rreth, ajo përbëhet nga: shkumës, gur gëlqeror, mermer etj. Prandaj, vlen të përmendet se roli i kësaj substance për njerëzit është shumë i rëndësishëm, sepse karbonati i kalciumit përdoret gjerësisht në industrinë ushqimore, si një ngjyrë e bardhë natyrale. CaC03 përdoret gjithashtu në prodhimin e letrës, plastikës, ndërtimit dhe në shumë fusha të tjera.
Karbonat kalciumi është një substancë e bardhë (kristale të ngurta) në formë pluhuri ose të ngurtë. Ai është në gjendje të reagojë me ujë, por jo të tretur plotësisht në të. Prandaj, uji bëhet i turbullt, dhe në të ka një precipitim të bardhë. Por nëse reagimi me ujë do të ndodhë në praninë, atëherë do të marrim një kripë acid të tretshme, bikarbonat kalciumi:
CaCO3 + CO₂ + H20 → Ca (HCO3)
Konsideroni se si është bërë karbonat kalciumi.
Shumica e karbonatit të kalciumit merret nga burimet natyrore. Pra, për të marrë karbonat kalciumi, si rregull, përdorni një burim të pastër, shpesh mermer.
 Statuja e mermerit të Davidit nga Michelangelo Buonarroti
Statuja e mermerit të Davidit nga Michelangelo Buonarroti
Por në kushte laboratorike, karbonati i kalciumit mund të merret me kalcinimin e oksidit të kalciumit. Kalcinimi i referohet nocionit të përgjithshëm të djegies, si rezultat i të cilave kimikatet fitojnë prona të reja. Qitjes kryhet në një temperaturë mjaft të lartë, duke mos arritur shkrirjen.
Uji është i përzier me oksid kalciumi që rezulton, reagimi prodhon hidroksid. Pastaj teknikët marrin dioksid karboni, i cili kalon përmes zgjidhjes së marrë më parë. Precipitati i formuar është karbonat kalciumi:
CaO + H20 = Ca (OH);
Ca (OH) + CO₂ = CaCO3 + H20
Nëse ne ngrohim kripën e acidit karbonik dhe kalciumit në një temperaturë të lartë (900-1000 ° C), si rezultat i procesit kimik do të marrim dioksid karboni (dioksid karboni), si dhe oksid kalciumi CaO - gëlqere e përdorur në ndërtim:
CaCO3 = CaO + CO2
Nëse temperatura është edhe më e lartë (1500 ° C), atëherë produktet e reaksionit do të jenë karbidi i kalciumit dhe monoksidi i karbonit.
Acidi klorhidrik
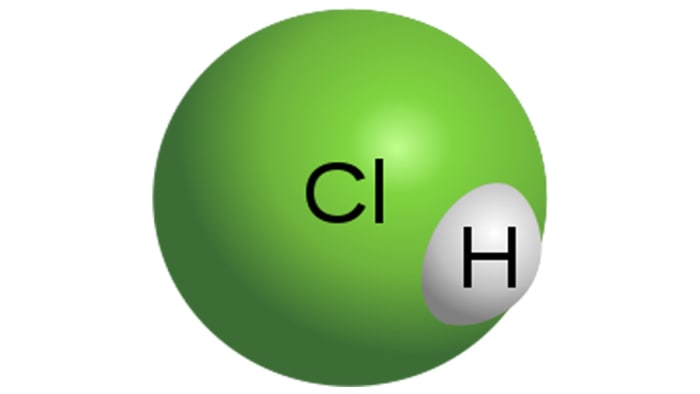 Molekula e acidit klorhidrik
Molekula e acidit klorhidrik
HCl është një acid i fortë monobasik, i cili është marrë duke shpërndarë klorur hidrogjeni në ujë. Kjo është një lëng i pangjyrë, edhe pse acidi teknik mund të ketë një ngjyrë të verdhë, për shembull, për shkak të papastërtisë së hekurit. Vetitë e HCl do të varen drejtpërsëdrejti nga përqendrimi i klorur hidrogjeni në zgjidhje.
Kripërat e acidit klorhidrik quhen kloride. Kjo substancë është shumë kaustike, prandaj kërkon trajtim të kujdesshëm: edhe nëse një rënie e vogël bie në lëkurë, atëherë një djegje e fortë kimike nuk mund të shmanget. Prandaj, kur punoni me acide të fortë, është e këshillueshme që gjithmonë të sillni neutralizues me ju: zgjidhje të dobëta alkaline, (sode buke) etj. Vlen të kujtohet se kur hapet një enë me avujt e koncentruar të acideve HCl formohen, të cilat ndikojnë negativisht në sytë dhe sistemin e frymëmarrjes. Prandaj, në eksperimentet kimike, do të ishte më mirë të përdorni një aparat respirator dhe syze.
Marrja e acidit hidroklorik
Gazi i klorurit të hidrogjenit tretësohet në ujë. Vet klorusi i hidrogjenit merret si më poshtë: hidrogjeni është djegur në klorin, duke marrë kështu një acid sintetik. Nga ana tjetër, acidi klorhidrik mund të merret duke përdorur gazra anësore, të cilat janë marrë në një numër eksperimentesh kimike, për shembull, kur hidrokarburet e klorit janë të klorinuara. Acidi i marrë në këtë mënyrë quhet abgasik.
Aplikoni acid klorhidrik në mjekësi, industri, dhe gjithashtu për reaksione kimike.
Acidi i pangjyrë me një erë të mprehtë të klorur hidrogjeni reagon mirë me metale. Reagimi i redoksit ndodh. Agjentët reduktues në procesin e reaksionit janë atomet metalike dhe agjentët oksidues janë kationë hidrogjeni.
Kryesisht reaksionet kimike me metale shoqërohen nga lëshimi i hidrogjenit. Intensiteti i ndërveprimit varet nga aktiviteti i metalit, për shembull, litiumi i metalit alkali reagon me dhunë, ndërsa reagimi me alumini është i dobët për shkak të filmit të fortë të oksidit të këtij elementi.
Acidi klorhidrik dhe zinku:
2HCl + Zn = ZnCl2 + H2
Acidi klorhidrik dhe hekuri:
2HCl + Fe = FeCl2 + H2
Acidi klorhidrik dhe magnezit:
2HCl + Mg = MgCl2 + H2
 Klorid magnez, që përdoret për pastrimin e rrugëve nga akulli
Klorid magnez, që përdoret për pastrimin e rrugëve nga akulli
Me oksidet metalike, acid formon kripë dhe ujë:
CuO + 2HCl = CuCl2 + H20
Reagimi i acidit hidroklorik dhe karbonat kalciumi
Për eksperimentin do të duhet:
provë tub;
pipetta kimike;
karbonat i ngurtë kalciumi (mermer);
acid klorhidrik;
doreza;
respirator.
Warning! Mos provoni këtë përvojë veten!
Kryeni eksperimentin në një zonë të ventiluar mirë, përdorni kujdes kur punoni me acid klorhidrik.
Shtoni disa pjesë të mermerit në anije dhe pipetoni disa acid klorhidrik. Si rezultat, do të ketë një reagim të menjëhershëm me formimin e flluskave - dioksidi i karbonit lëshohet. Ky është një reagim shkëmbimi, produktet e të cilit janë: një kompleks i dobët dhe i paqëndrueshëm, acid karbonik, i cili shpërbëhet në dioksid karboni dhe ujë. Ekuacioni i reagimit të shpërbërjes së karbonatit të kalciumit në acid klorhidrik:
CaCO3 + 2HCl (dil.) → CaCl2 + CO2 + H20
- karakteristika e elementit të magnezit: struktura elektronike, shtetet e mundshme të oksidimit, komponimet bazë: oksid, hidroksid, kripëra. Çfarë është karbonizimi dhe cili është roli i saj në ndërtim.
MgCO3 = MgO + CO2
Aplikimi.
Në industri përdoret për prodhimin e refraktarëve, çimentos dhe pastrimit të produkteve të naftës, si një mbushës në prodhimin e gomës. Oksidi i magnezit ultra-i lehtë përdoret si një gërryerje shumë e mirë për pastrimin e sipërfaqeve, në veçanti, në industrinë elektronike.
Në mjekësi përdoret në rast të rritjes së aciditetit të lëngut stomak, pasi ajo shkaktohet nga përmbajtja e tepruar e acidit klorhidrik. Magnezia e djegur merret edhe kur acidi lëshohet aksidentalisht në stomak.
Në industrinë ushqimore është regjistruar si një shtesë ushqimore E530.
Është një reflektor absolut - një substancë me koeficient reflektimi të barabartë me një në një spektër të gjerë spektri. Mund të përdoret si një standard i bardhë në dispozicion.
Hidroksid magneziumi - Hidroksid metali kryesor është magnez. Baza e dobët e pazgjidhshme.
Nën kushte standarde, hidroksid magnezi është një grilë pa ngjyrë gjashtëkëndore. Në temperatura mbi 350 ° C dekompozohet në oksid magnezi dhe ujë. Përthith dioksid karboni dhe ujë nga ajri për të formuar karbonatin kryesor të magnezit. Hidroksid magnezi është praktikisht i pazgjidhshëm në ujë, por i tretshëm në kripërat e amonit. Është një bazë e dobët. Kjo ndodh në natyrë në formën e brucit mineral.
Getting.
Ndërveprimi i kripës së magnezit të tretshëm me alkalet:
Në përgjithësi:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
shembuj:
MgCl2 + 2NaOH = Mg (OH) 2 ¯ + 2NaCl
Mg (NO3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
Ndërveprimi i zgjidhjes së klorurit të magnezit me dolomitin e djegur:
MgCl2 + CaO × MgO + 2H2O = 2 Mg (OH) 2 + CaCl2
Ndërveprimi i magnezit metalik me avull uji:
Mg + 2H2O = Mg (OH) 2 + H2 -
Vetitë kimike
Ashtu si të gjitha bazat e dobëta, hidroksid magnezi është termikisht i paqëndrueshëm. Shkrihet kur nxehet në 350 ° C:
Ndërvepron me acide për të formuar kripë dhe ujë (reagim neutralizimi):
Mg (OH) 2 + 2HCl = MgCl2 + 2H20
Mg (OH) 2 + H2SO4 = MgSO4 + 2H2O
Ndërveprimi me oksidet acidike për të formuar kripë dhe ujë:
Mg (OH) 2 + SO3 = MgSO4 + H2O
Ndërveprimi me solucione të nxehtë të koncentruar të alkaleve me formimin e hidroksigagnesistëve:
Mg (OH) 2 + 2NaOH = Na2
Mg (OH) 2 + Sr (OH) 2 = Sr
Aplikimi.
Hidroksid magnezi përdoret për të lidhur dioksidin e squfurit, si një flocculant për trajtimin e ujërave të ndotura, si një retardant flaka në polimeret termoplastike (poliolefina, PVC), si një shtesë në detergjentë, për të prodhuar oksid magnez, rafinimin e sheqerit, si një komponent i pastave.
Në mjekësi, përdoret si një ilaç për të neutralizuar acidin në stomak, si dhe një laksativ shumë të fortë.
Në Bashkimin Europian, hidroksid magnezi është regjistruar si një shtesë ushqimore E528.
Kripërat e magnezit.
Shumica e kripërave të magnezit janë shumë të tretshëm në ujë. Ion Mg 2+ i jep zgjidhje një shije të hidhur. Halidet e magnezit, me përjashtim të MgF2, janë shumë të higroskopike - ato rrjedhin në ajër.
Klori magneziumi MgCl2 (klorur magnez) shkrihet anhidrid në 718 °. Në prani të gjurmëve të ujit ajo "pi" në ajër - ajo shpërbëhet në HCl dhe MgO. Hidrat kristalor pa ngjyrë me 1, 2, 4, 6, 8 dhe 12 molekula uji lëshohen nga zgjidhja ujore. Në rangun e temperaturës prej -3,4 deri në 116,7 °, hidrati kristalgjik i MgCl2 × 6H2 0 është i qëndrueshëm, i cili ndodh natyrshëm si mineral biskofit, dhe në sasi të mëdha merret me avullimin e shëllirëve të detit. Klori i magnezit krijon kripëra të dyfishta, prej të cilave karnalliti mineral KCl × MgCl2 × 6H2O - burimi i magnezit dhe kaliumit - është jashtëzakonisht i rëndësishëm.
Aplikimi.
1. Klorid magnezi përdoret kryesisht në prodhimin e magnezit metalik, MgCl2 × 6H 2 0 përdoret për të siguruar çimento magnezi.
2. Përdoret për përpunimin e akullit dhe borës si një shtesë. Si rezultat i reagimit me borë, ajo shkakton shkrirjen. Ajo ka një klasë të tretë të rrezikut (substanca të moderuara të rrezikshme) dhe vetitë agresive gërryese.
Bikarbonat e magnezit - kripëra acidike e magnezit dhe acidit karbonik me formulën Mg (HCO3) 2, ekziston vetëm në solucione ujore.
Getting.
Transmetimi i dioksidit të karbonit nëpërmjet një pezullimi të karbonatit të magnezit:
MgCO3 + CO2 + H2O = Mg (HCO3) 2
Vetitë fizike.
Bikarbonati i magnezit ekziston vetëm në solucione ujore.
Prania e bikarbonatit të magnezit në ujë shkakton ngurtësi të përkohshme.
Vetitë kimike
Kur përqendrohet në zgjidhje, bikarbonati i magnezit dekompozon:
Mg (HCO3) 2 = MgCO3 + CO2 - + H2O
Hidrofosfati i magnezit (fosfati magnez i zevendesuar) - nje kripë acidike e magnezit dhe acidit fosforik me formulën MgHPO4, pak i tretshëm në ujë, formon hidratet kristalore.
Getting.
Efekti i acidit ortofosforik në oksid magnezi ose karbonat magnezik:
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO3 + H3 PO4 = MgHPO4 + CO2 - + H2O
Veprimi i ortofosfat i natriumit të disubstituar në klorur magnezi:
MgCl2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
Dekompozimi i magnezit të dihidrogjen fosfatit:
Mg (H2PO4) 2 = MgHPO4 + H3PO4
Vetitë fizike.
Fosfati i hidrogjenit të magnezit formon kristale të bardha, të cilat janë hidrate kristaline: në temperatura deri në 225 ° C, MgHPO4 monohidrat formohet. H 2 O, dendësia e 2.32 g / cm³, në temperaturë prej 36 ° С, formohet trihidrat MgHPO4. 3H 2 O, dendësia 2.10 g / cm³, me temperaturën e dhomës MgHPO4 heptahidrat është formuar. 7H 2 O.
Vetitë kimike.
Kur nxehet shkon në pirofosfat:
Aplikimi.
Përdoret në shtojcën e ushqimit E343.
Fosfat dihidrogjen magnez - kripë acide e metalit të magnezit dhe acidit ortofosforik me formulën Mg (H2P04) 2, kristale të pangjella, higroskopike, të tretshëm në ujë, formojnë hidratet kristalore.
Getting.
Shpërndarja e oksidit të hidroksidit ose magnezit në acidin ortofosforik:
Vetitë fizike.
Fosfati i dihidrogjenit të magnezit formon kristale të pangjyrë.
Përbërja kristalore e hidratit të Mg (H2P04) 2. nH 2 O, ku n = 2, 4, 6.
Karbid magneziumi - komponimi binar inorganik i magnezit dhe karbonit me formulën MgU2. Gjithashtu i njohur karabit magnez me formulën Mg 2 C.
Getting.
Sintering fluoride magnezi dhe karabit kalciumi:
Acetileni që rrjedh mbi pluhurin e magnezit:
Duke rivendosur pentanë me pluhur magnez në 650 ° C, mund të merret karabit më kompleks Mg 2 C 3.
Vetitë kimike.
Kur nxehet dekompozohet me formimin e karbidit të ndërmjetëm Mg2C3:
Ndërvepron me ujë:
Karbonat magnez, karbonat magneziumi, MgCO 3 - kripë magnez të acidit karbonik.
Prona.
Kristal të bardhë, dendësia 3,037 g / cm ³. Në 500 ° C është e dukshme, dhe në 650 ° C ajo është dekompozuar plotësisht në MgO dhe CO2. Shkalla e tretshmërisë së karbonatit të magnezit në ujë është e parëndësishme (22 mg / l në 25 ° C) dhe zvogëlohet me rritjen e temperaturës. Kur CO 2 është i ngopur me një suspendim ujor të MgCO3, ky i fundit shpërbëhet për shkak të formimit të bikarbonatit Mg (HCO3) 2. Nga solucionet ujore në mungesë të një tepërt të CO 2, karbonat bazë të magnezit emetohen. Me karbonate të një numri metalesh, karbonati i magnezit krijon kripëra të dyfishta, të cilat përfshijnë dolomitin natyral mineral MgCO3 · CaCO3.
Prevalenca në natyrë.
Karbonat magnezi është shpërndarë gjerësisht në natyrë në formën e magnezit mineral.
Aplikimi.
Karbonat magnez bazë 3MgCO 3 · Mg (OH) 2 · 3H 2 O (i ashtuquajturi magnezi i bardhë) përdoret si një mbushës në komponimet e gomës për prodhimin e materialeve izoluese termike.
Karbonati i magnezit është i nevojshëm në prodhimin e qelqit, çimentos, tullave.
Nitrat magnez Mg (NO 3) 2 - Kristale të pangjella higroskopike me një grilë kub; pika e shkrirjes 426 ° C (me dekompozim). Lëndësia në ujë (g për 100 g): 73.3 (20 ° C), 81.2 (40 ° C), 91.9 (60 ° C). Gjithashtu i tretshëm në etanol, metanol, NH3 të lëngshme. Varësisht nga përqendrimi, nona-, heksa- dhe dihidratet kristalizohen nga solucionet ujore.
Komponenti i plehrave komplekse, meqenëse Magnezi është pjesë e klorofilit, e cila është e nevojshme për fotosintezën, rrit aktivitetin e shumë enzimeve dhe vepron si një transportues fosforesh. Shkalla e tretshmërisë së lartë dhe përçueshmëria e ulët elektrike e bëjnë produktin jashtëzakonisht të përshtatshëm për ushqimin dhe fertilitjen e gjetheve, sidomos kur përdoren ujërat e ujitjes me përqendrim të lartë të kripës. Plehrat përdoren për ushqimin e rrënjëve dhe gjetheve të perimeve, manave, kulturave të frutave, rrushit; oksidues në kompozime piroteknike.
karbonizim- ngopja e çdo zgjidhje me dioksid karboni. Përdoret në ndërtim.
Karbonizimi mineral - acidi silikik në silikat është zëvendësuar me acid karbonik për të formuar karbonate. Nga karbonatet, minerali që formon shkëmbinjtë në shkëmbinj sedimentarë është kalciumi (lime spar) CaCO3. Magneziti - MgCO3 dhe dolomiti - CaMg (CO3) 2 janë më pak të zakonshme. ujë të pastër, që nuk përmbajnë acid karbonik, kalciumi shpërndahet në një sasi të vogël (0.03 g për litër ujë); magnezit është praktikisht i pazgjidhshëm. Nëse uji përmban dioksid karboni, kalciumi shpërndahet lehtësisht me formimin e karbonatit acidik të kalciumit, i tretshëm në ujë - Ca (HCO3) 2.
Karbonizimi është një ndryshim që ndodh në beton në çimento Portland kur ekspozohet ndaj ajrit C0. Hidroksid kalciumi Ca (OH) 2 në prani të lagështisë është prekur veçanërisht. Hidroksid kalciumi konvertohet në karbonat kalciumi kur absorbon dioksidin e karbonit. Karbonat kalciumi është i dobët i dobët në ujë dhe, si rezultat, tenton të mbyllë hermetikisht poret në sipërfaqen e betonit (që do të thotë beton i dendur dhe i papërshkueshëm nga uji).
Në mënyrë tipike, pH e ujit pore në beton shkon nga 10.5 në 11.5. Nëse për shkak të karbonizimit zvogëlohet në 9 dhe më poshtë, atëherë korrozioni i përforcimit është i mundur. Prandaj, trashësia e shtresës së karbonizuar është një faktor i rëndësishëm në mbrojtjen e përforcimit: sa më i thellë karbonizimi, aq më i madh është rreziku i korrozionit të çelikut. Thellësia e carbonation mund të përcaktohet duke trajtuar konkrete me phenolphthalein. Prania e pronave alkaline nën veprim të phenolphthalein tregohet nga pamja e një ngjyre trëndafili, ndërsa betoni i gazuar ruan ngjyrën e tij origjinale.
Betoni i dendur me cilësi të lartë i nënshtrohet karbonizimit shumë ngadalë. Nuk ka gjasa që carbonization do të vërehet në një thellësi prej më shumë se 5-10 mm edhe pas operacionit për 50 vjet. Nga ana tjetër, thellësia e karbonizimit të betonit të përshkrimit të ulët të fuqisë mund të arrijë 25 mm në më pak se 10 vjet. Përvoja tregon se produktet konkrete me cilësi të ulët janë veçanërisht të ndjeshme ndaj karbonizimit.
- karakteristikë e elementit të kalciumit: struktura elektronike, shtetet e mundshme të oksidimit, komponimet kryesore: oksid, hidroksid, kripëra.
kalcium - një element i nëngrupit kryesor të grupit të dytë, periudha e katërt e tabelës periodike të elementeve kimike DI Mendeleev, me numër atomik 20. Ajo është e shënjuar me simbolin Ca (lat. Kalcium). Struktura elektronike 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, gjendja e oksidimit +2, 0. Përmban metale alkaline tokësore.
Substanca e thjeshtë e kalciumit është një metal i butë, kimikisht i aktivizuar tokësor alkaline me ngjyrë të bardhë argjendi. Prodhimi industrial: elektroliza e kloridit të kalciumit të shkrirë.
Oksid Kalciumi CaO - oksid bazë, gëlqere e lëngët. E bardhë, higroskopike. I panënshtruar, termikisht e paqëndrueshme, e paqëndrueshme gjatë ndezjes. Ai reagon fuqishëm me ujë (me një ekzo-efekt të lartë), formon një solucion fuqishëm alkaline, procesi quhet zvarritja e limonit. Reagimet me acidet, oksidet metal, jo-metale. Është përdorur për të sintetizuar komponimet e tjera të kalciumit, një përbërës i materialeve lidhëse në ndërtim.
Prodhimi në industri - shkarkimi gëlqeror (900 - 1200 o C)
Hidroksid kalciumi Ca (OH) 2 - gëlqere hidratuar, hidroksid bazë. I dekompozuar me ngrohje të moderuar. E bardhë, higroskopike. Përthith lagështi dhe dioksid karboni nga ajri. Pak i tretshëm në të ftohtë. ujë, edhe më pak - në ujë të valë. Një zgjidhje e qartë (ujë i kripur) shpejt bëhet i vrenjtur për shkak të reshjeve të hidroksidit (pezullimi quhet qumësht i gëlqeres). Reaksioni cilësor është transmetimi i dioksidit të karbonit përmes ujit të kripur me paraqitjen e sedimentit CaCO3 dhe kalimin e tij në zgjidhje. Reagimet me acide dhe okside acid, hyn në reagime të këmbimit jon.
Përdoret në ndërtim për përgatitjen e llaçit të gëlqeres (rërë + gëlqere e shkrirë + ujë), të cilat shërbejnë si një material lidhës për gurin dhe tulla, mbarimin (suvatimin) e mureve dhe qëllime të tjera të ndërtimit. Solidifikimi i zgjidhjeve të tilla është për shkak të absorbimit të CO2 nga ajri.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H2SO4 → CaSO4 + 2H2O,
Reagon me kripërat nëse formon një precipit:
Ca (OH) 2 + Na2SO3 → CaSO3 ↓ + 2NaOH
Kripërat e kalciumit.
Sulfat kalciumi (CaSO4) - kompleksi inorganik, kripë kalciumi e acidit sulfurik.
A gjendet në natyrë si një dihidrat CaSO 4? 2H 2 O (gips, selenit) dhe në anhydrite shtetërore anhydrous.
Klorid kalciumi, CaCl2 - kripë kalciumi i acidit klorhidrik.
Posedon vetitë e larta higroskopike. Tretshmëria (g për 100 g H2O): 74 (20 ° C) dhe 159 (100 ° C). Solucionet ujore të klorurit të kalciumit ngrijnë në temperatura të ulëta (20% në -18.57 ° C, 30% në -48 ° C).
Formon një hidrat CaCl2 · 6H2O, të qëndrueshme deri në 29.8 ° C; në temperatura të larta, hidratet kristalore me 4, 2 dhe 1 molekulat H2O bien nga zgjidhja e ngopur. Kur CaCl2 * 6H2O (58.8%) është përzier me borë ose akull (41.2%), temperatura bie në -55 ° C (pikë kriohidrate).
Kloridi i kalciumit merret si një nënprodukt në prodhimin e sode.
Në laboratorin kimik, kloruri i kalciumit përdoret si një mbushës për tharjen e tubave, i quajtur edhe klorid kalciumi, që ka për qëllim të izolojë substanca në enë nga avujt e ujit atmosferik dhe për tharjen e gazrave.
Kloridi i kalciumit përdoret gjithashtu si një përshpejtues për vendosjen e çimentos;
Karbonat kalciumi (karbonat kalciumi) - përbërësi kimik inorganik, kripë e acidit karbonik dhe kalciumit. Formula kimike -CaCO3. Në natyrë, ajo gjendet në formën e mineraleve - kalcit, aragonite dhe vaterite, është përbërësi kryesor i gurit gëlqeror, mermer, shkumës, është pjesë e guaskës së vezëve. I pazgjidhshëm në ujë dhe etanol.
Stuko, ngjitëse të ndryshme - të gjitha ato përmbajnë karbonat kalciumi në sasi të konsiderueshme. Gjithashtu, karbonati i kalciumit është një komponent thelbësor në prodhimin e kimikateve shtëpiake.
Karbonat kalciumi gjithashtu përdoret gjerësisht në sistemet e pastrimit, si një mjet për të luftuar ndotjen e mjedisit, me ndihmën e karbonatit të kalciumit për të rivendosur ekuilibrin acid-bazë të tokës.
- Shembuj që ilustrojnë përdorimin e oksideve dhe hidroksideve të kalciumit dhe magnezit në ndërtim.
Oksid kalciumi dhe hidroksid:
Kur zbukuro dhomat.
Kur zbardh gardhe druri dhe trungjet e lëkundur - për të mbrojtur nga kalbja dhe zjarri.
Për përgatitjen e llaçit të gëlqeres. Lime është përdorur për ndërtimin e masonerisë që nga kohërat e lashta. Përzierja zakonisht përgatitet në këtë proporcion: tre ose katër pjesë të rërës (sipas peshës) shtohen në një pjesë të një përzierjeje të hidroksidit të kalciumit (gëlqeres së hidratuar) dhe ujit. Kur kjo ndodh, përzierja vështrohet nga reaksioni: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Ky është një reagim ekzotermik, lirimi i energjisë është 27 kcal (113 kJ).
Siç mund të shihet nga reagimi, uji lëshohet gjatë tij. Ky është një faktor negativ, sepse në dhomat e ndërtuara me llaç gëlqeror, lagështia e lartë vazhdon për një kohë të gjatë. Në këtë drejtim, si dhe për shkak të një numri të avantazheve të tjera mbi hidroksid kalciumi, çimento ka zëvendësuar praktikisht atë si një lidhje për ndërtimin e zgjidhjeve. Për më tepër, është gjithashtu e papranueshme për përdorim kur hedhjen e soba, sepse nën ndikimin e temperaturave të larta, mbytës dioksidit të karbonit është lëshuar.
Për përgatitjen e betonit silikatik. Përbërja e betonit silikator është identik me përbërjen e llaçit të gëlqeres, megjithatë, ajo përgatitet me një metodë tjetër - një përzierje e oksidit të kalciumit dhe rërës kuarci nuk trajtohet me ujë, por me avull uji të nxehur (174.5-197.4 ° C) në një autoklavë me presion prej 9-15 atmosferash.
Në prodhimin e tullave silikate.
Oksid dhe magnez magnez:
për prodhimin e sistemeve të kombinuara të materialeve zjarrduruese (bordet e ndërtimit të magnezit), për prodhimin e çimentos. Magnezi i oksidit të magnezit (magnezit kaustik) përdoret si një lidhës, i cili, i përzier me zgjidhjen MgCl2, është në gjendje të përforcohet shpejt dhe të fitojë forcë në ajër.
- fortësia e ujërave natyrore: përkufizimi, llojet e fortësisë, metodat për heqjen e ngurtësisë së ujit: fizik, kimik (ekuacionet e reagimit), fiziko-kimike.
Uji natyral që përmban një sasi të madhe të kripërave të kalciumit ose magnezit në një zgjidhje quhet ujë i fortë në krahasim me ujin e butë që përmban pak ose aspak kalcium dhe kripëra magnez.
E para nga këto është për shkak të pranisë së bikarbonateve të kalciumit dhe magnezit, e dyta për praninë e kripërave të acideve të fortë, sulfateve ose klorideve të kalciumit dhe magnezit. Me valë të zgjatur të ujit me fortësi karbonate, në të shfaqet një precipit, i përbërë kryesisht nga CaCO3, dhe në të njëjtën kohë lëshohet CO2.
Të dyja këto substanca shfaqen si rezultat i dekompozimit të karbonatit të kalciumit:
Prandaj, ngurtësia e karbonatit quhet gjithashtu ngurtësi e përkohshme. Në mënyrë sasiore, ngurtësia e përkohshme karakterizohet nga përmbajtja e bikarbonateve të larguara nga uji kur është zier për një orë. Ngurtësia e mbetur pas valës së tillë quhet ngurtësi e vazhdueshme.
Fortësia e ujit është shprehur nga shuma e miliequivalents e joneve të kalciumit dhe magnezit të përmbajtura në ujë. Një milliequivalent i ngurtësisë korrespondon me një përmbajtje prej 20.04 mg / l ose 12.16 mg / l.
Ngurtësinë e ujërave natyrore ndryshon shumë. Është e ndryshme në rezervuarë të ndryshëm, dhe në të njëjtin lumi ndryshon gjatë gjithë vitit (minimumi gjatë përmbytjes). Ngurtësia e ujërave të detit është shumë më e lartë se lumenjtë dhe liqenet. Kështu, uji i Detit të Zi ka një ngurtësi totale prej 65.5 meq / l. Vlera mesatare e ngurtësisë së ujit të oqeanit botëror është 130.5 meq / l (duke përfshirë 22.5 meq / l për meq / l).
Prania në ujë e një sasi të konsiderueshme të kripërave të kalciumit ose magnezit e bën ujin të papërshtatshme për shumë qëllime teknike. Kështu, me ushqim të zgjatur të kaldajave të avullit me ujë të fortë, muret e tyre bëhen gradualisht të mbuluara me një kore të dendur të nakiii. Një kore e tillë tashmë në një shtresë trashësie në masë të madhe zvogëlon transferimin e nxehtësisë nga muret e kazan dhe, rrjedhimisht, të çon në një rritje të konsumit të karburantit. Përveç kësaj, kjo mund të shkaktojë kërcitje dhe plasaritje si në gypat e ngrohjes ashtu dhe në muret e vetë bojlerit.
Uji i fortë nuk jep shkumë me sapun, pasi kripërat e tretshme të acideve yndyrore - palmitike dhe stearike - të përfshira në sapun janë transformuar në kripëra të pazgjidhshme të kalciumit të të njëjtëve acide:
Uji i fortë nuk mund të përdoret kur kryen disa procese teknologjike, për shembull, kur ngjyroset.
Ngurtësia konstante e ujit është për shkak të pranisë në të kryesisht të sulfateve dhe klorideve të kalciumit dhe magnezit dhe nuk eliminohet nga vlimi. Shuma e ngurtësisë së përkohshme (të lëvizshme) dhe konstante është ngurtësia totale e ujit.
Ka mënyra të ndryshme për të përcaktuar ngurtësinë.
Shqyrto dy prej tyre:
1) përcaktimin e ngurtësisë së përkohshme duke përdorur një zgjidhje të titruar të acidit klorhidrik
2) metodë komplekse për përcaktimin e ngurtësisë totale.
Gjatë titrimit të mostrës së ujit me acid klorhidrik në praninë e portokallit metil, ndodh dekompozimi i bikarbonateve, duke shkaktuar ngurtësi të përkohshme:
Metoda e përcaktimit. 100 ml ujë të testuar merren në një shishe konike me një pipetë ose një cilindër matës, shtohen 2-3 pika të portokallit metil dhe titrohen me 0,1 dhe. HCl derisa të shfaqet ngjyra portokalli.
Analiza e rezultatit të llogaritjes. 1 ml 0,1 n. Zgjidhja HCl korrespondon me 0.1 / 1000 g-eq ose 0.1 mg-eq Ca 2+. V (HCl) korrespondon me 0.1 V (HCl) / 1000 g-eq ose 0.1 V (HCl) mg-eq Ca 2+. 0.1 V (HCl) mEq është në volumin e V A. Për të shprehur ngurtësinë në miligram-ekuivalentë për 1 l ujë, ju duhet të ndani vlerën e gjetur nga V A dhe shumoheni atë me 1000, dmth. Ngurtësia e ujit nën studim është
![]()
Metodat e eliminimit.
Zbutje termike. Bazuar në vlimin e ujit, si rezultat i kalciumit termikisht të paqëndrueshëm dhe bikarbonatet e magnezit dekompozohen me formimin e shkallës:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
Vërshimi heq vetëm ngurtësinë e përkohshme (karbonat). Gjeni aplikimin në jetë.
Zbutja e reagentit. Metoda bazohet në shtimin e hirit sode Na2CO3 ose gëlqere të hidratuar Ca (OH) 2 në ujë. Në të njëjtën kohë, kripërat e kalciumit dhe magnezit kalojnë në komponime të pazgjidhura dhe si rezultat precipitojnë.
Për shembull, shtimi i gëlqeres hidratues çon në konvertimin e kripës së kalciumit në karbonat të pazgjidhshëm:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Reagimi më i mirë për eliminimin e fortësisë së përgjithshme të ujit është ortofosfat natriumi Na3PO4, i cili është pjesë e shumicës së familjeve dhe produkteve industriale:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
Ortofosfatet e kalciumit dhe magnezit janë shumë të dobëta në ujë, dhe për këtë arsye mund të ndahen lehtë me filtrim mekanik. Kjo metodë justifikohet me një konsum relativisht të lartë të ujit, pasi përfshin zgjidhjen e disa problemeve specifike: filtrimi i sedimenteve, dozimi i saktë i reagensit.
këmbimit dosja. Metoda bazohet në përdorimin e ngarkimit të grimcave të shkëmbimit të joneve (shpesh rezinat e këmbimit të joneve). Një ngarkesë e tillë në kontakt me ujin thith kationet e kripës së fortësisë (kalcium dhe magnez, hekur dhe mangan). Në vend të kësaj, varësisht nga forma jonik, ajo i jep jonet e natriumit ose hidrogjenit. Këto metoda janë përkatësisht quajtur Na-cationization dhe H-cationization. Me ngarkimin e përzgjedhur siç duhet të shkëmbimit të joneve, ngurtësia e ujit zvogëlohet me kationizim natriumi me një fazë në 0.05-0.1 ° W, me ngarkim me dy faza - në 0.01 ° W. Në industrinë, filtrat e këmbimit të joneve zëvendësojnë jonet e kalciumit dhe magnezit me jonet e natriumit dhe kaliumit, duke prodhuar ujë të butë.
Osmozë e kundërt. Metoda bazohet në kalimin e ujit përmes një membrane gjysmëpërçues (zakonisht poliamide). Së bashku me kripërat e ngurtësisë, shumica e kripërave të tjera hiqen. Efikasiteti i pastrimit mund të arrijë 99.9%.
Ekzistojnë nanofiltrime (diametri nominal i vrimave të membranës është i barabartë me njësitë e nanometrave) dhe picofiltrimi (diametri nominal i vrimave të membranës është i barabartë me njësitë e pikometrave).
Si disavantazhet e kësaj metode duhet të theksohet:
Nevoja për para-trajtimin e ujit të furnizuar në membranën e osmozës së kundërt;
Kostoja relativisht e lartë e 1 litër ujë të prodhuar (pajisje të shtrenjta, membrana të shtrenjta);
Mineralizimi i ulët i ujit të prodhuar (sidomos kur picofiltration). Uji bëhet pothuajse i distiluar.
Electrodialysis. Ajo bazohet në heqjen e kripërave nga uji nën veprimin e një fushe elektrike. Heqja e joneve të substancave të tretura ndodh për shkak të membranave speciale. Ashtu si me përdorimin e teknologjisë së kundërt osmozë, heqja e kripërave të tjera, përveç joneve të fortësisë, ndodh.
Uji plotësisht i pastër nga kripërat e fortësisë mund të distilohet.
