Visoka koncentracija silicija. Veš kako
procesor? Pisok? In kaj imate pri besedi asociacije? Ali morda Silicijeva dolina?
Kot da ga ne bi bilo, s silicijem se držimo danes, in če želite vedeti, kaj je Si in zakaj jeste, prosim za mačko.
Vstop
Kot študent ene od moskovskih univerz na specialnosti "Nanomateriali" vas želim, dragi bralec, spoznati z najpomembnejšimi kemičnimi elementi našega planeta. Dolgo časa sem nekaj izbiral, oglje ali silicij, pa sem se vseeno odločil za Si, da je srce vsakega sodobnega pripomočka na njem samem, tako da lahko rečeš tako krasno. Svoje misli bom poskušal narediti zelo preproste in dostopne, ko sem napisal to gradivo, sem ga shranil, predvsem pri novincih, vendar ga lahko vse več ljudi dobi iz cicave, zato bi rad povedal, da je bil članek napisan izključno za širitev interesov, kar se je zataknilo. In tako začnimo.
Silicij
Silicij (lat. Silicium), Si, kemični element IV skupine Mendeljevega periodnega sistema; atomsko število 14, atomska teža 28,086.
V naravi je element predstavljen s tremi stabilnimi izotopi: 28Si (92,27%), 29Si (4,68%) in 30Si (3,05%).
Debelina (n.s.) 2,33 g/cm?
Tališče 1688 K

Prah Si
Zgodovinski dokaz
Griči silicija, širne dežele, bulvarji ljudi iz kamene dobe. Bilo je na tisoče papalin kamna in zalivanje kamna. Zastosuvannya spoluk Silicij, povezan z njihovo predelavo, - pripravo skladišča - se je začel okoli 3000 pr. e. (Stari Egipt). Prej v hiši je bil uporabljen silicij - oksid SiO2 (silicijev dioksid). V 18. stoletju so silicijev dioksid vbrizgali s preprostim telesom in ga odnesli v »dežele« (kar se uporablja v njegovem imenu). Skladnіst v skladišče silicijevega dioksida z nameščenim І. I. Berzelius. V istem letu je leta 1825 odstranil elementarni silicij iz silicijevega fluorida SiF4 in nadomestil preostali kovinski kalij. Nov element so poimenovali "silicij" (lat. silex - kremen). Rusko ime vvív G. I. Hess pri 1834 roci.

Silikonski lok podaljškov v naravi v skladišču zvočnega zvoka
Širjenje silicija v naravi
Po širini v zemeljski skorji je silicij še en (za kislim) element, njegovo povprečje v litosferi je 29,5 % (za maso). Zemeljsko lubje, silicijevo sivo, ima enako primarno vlogo, kot oglje zemeljske svetlobe bitja. Za geokemijo silicija je pomembno predvsem to, da je pomembna povezava med jogom in kislim. Skoraj 12 % litosfere postane kremen SiO2 v obliki minerala kremena in različnih vrst. 75% litosfere sestavljajo različni silikati in aluminosilikati (polova, sljuda, amfibol toshcho). Skupno število mineralov, ki jih lahko nadomesti kremen, presega 400.
Fizična moč silicija
Mislim, da še posebej ni varto, to je vse Fizična moč Imam prost dostop, vendar bom naštel najpogostejše.
Vrelišče 2600 °С
Silicijev prozorium za dovgokhvilovyh ІCh-promenіv
Dielektrična penetracija 11.7
Mohsova trdota silicija 7,0
Rad bi povedal, da se pri silikonskem tenditnem materialu spominska plastična deformacija začne pri temperaturah nad 800°C.
Silicij je prevodnik, isto vino poznamo veliko zastosuvannya. Električna moč silicija lahko leži v hiši.
Kemična moč.
Tukaj je bogato, neverjetno je, bi lahko rekli, a naletim na najbolj znanega. Na policah Si (podobno kot ogljik) 4-valentni.
Na površini silicijevega zavdyaka je taljenje oksida stabilno pri vetru pri povišanih temperaturah. V kislini oksidira pri 400 °C, pri čemer se raztopi silicijev oksid (IV) SiO2.
Silicij je odporen na kisline in je manj verjetno, da se meša z dušikovo in fluorovodikovo kislino, na vročih travnikih ga zlahka ločimo od vode.
Silicij tvori 2 skupini kislih silanov - siloksan in siloksenij. Silicij reagira z dušikom pri temperaturah nad 1000 °C. je dragocen material za kemično industrijo, pa tudi za proizvodnjo gasilnih aparatov. Visoko trdoto ter toplotno in kemično odpornost imajo tlaki iz silicijevega karbida (silicijev karbid SiC) in bora (SiB3, SiB6, SiB12).
Otrimanya Silicij
Mislim, da tse naytsíkavísha del, tukaj je poročilo.
Priznavanje v prahu je razdeljeno na:
1.
Silicijeva elektronska moč(t.z. elektronski silicij"") - najbolj silicij silicij iz silicijeve meglice nad 99,999% za steno, električna podpora silicijeve elektronske kakovosti se lahko spremeni v intervalu od približno 0,001 do 150 ohm cm, vendar s katero vrednost podpore je kriv, vendar je zagotovljena hiša all inclusive, tako da lahko vstopite v kristalno hišo drugih, ki želijo skrbeti za naloge vrtca električnega opira, zvonijo, nesprejemljivo.
2.
Silicij sony kakovosti(t.z. "sonyachny silicon") - silicij iz mešanega silicija nad 99,99% na vlakno, ki se uporablja za proizvodnjo fotoelektričnih pretvornih naprav (zvočnih baterij).

3.
Tehnični silicij- bloki silicijeve polikristalne strukture, vzeti z metodo karbotermne obnove iz čistega kremenčevo piskanje; pokrov z 98% silicija, glavni del je premog, prezračen z veliko količino lahkih elementov - bor, fosfor, aluminij; v glavnem pomožno uporablja za posedovanje polikristalnega silicija.
Silicij tehnične čistosti (95-98%) ima med grafitnimi elektrodami električne udarce navdahnjenega silicijevega dioksida SiO2. V povezavi z razvojem nap_v_dnikovoї tehníko razrobleno metode pridobivanja čistega in posebej čistega silicija. Zaradi napredne sinteze čistega vih_dnih spoluk silicija, z yakikh vityagyat silíkí vídnovlennya vídnovlennya аbo termíchnogo razkladannya.
Polikristalni silicij ("polisilicij") - najčistejša oblika silicija, ki je komercialno uspešna, - izdelek, ki se uporablja za čiščenje tehničnega silicija s kloridnimi in fluoridnimi metodami in je zmagovalec za proizvodnjo mono- in multikristalnih silicij.
Tradicionalno se polikristalni silicij odstrani iz tehničnega silicija s potjo prenosa joge v pipe silana (monosilana, klorosilana, fluorosilana) z ofenzivnim dnom silanov, ki se usedejo, rektificiranega čiščenja pretvorjenega silana in obnove silana v kovinski silicij. .
Prevodniki iz čistega silicija se dobijo v dveh vrstah: polikristalni(ojačitev SiCl4 ali SiHCl3 s cinkom ali vodo, toplotna ekspanzija SiI4 in SiH4) in monokristalni(Taljenje cone brez lončka in "navijanje" monokristala iz staljenega silicija - metoda Czochralsky).

Tukaj lahko uporabite metodo Czochralskega za vibriranje silicija.
Metoda Czochralskega- metoda vibriranja kristalov s potjo vijuganja po hribu v zraku na površini velike obveznosti taljenja z začetkom storža kristalizacije s potjo prinašanja semenskega kristala (ali velikega števila kristalov). ) dane strukture in kristalografske orientacije atsíí v stiku s talino proste površine.
Zastosuvannya silicij
Posebej legiran silicij se pogosto uporablja kot material za pripravo električnih prevodnikov (tranzistorji, termistorji, močnostni vibratorji, tiristorji; fotocelice sony, ki se uporabljajo v vesoljskih plovilih, pa tudi veliko najrazličnejših stvari).
Drobci silikonske prosorije za menjavo iz dolgih dlačic v velikosti od 1 do 9 mikronov, lahko se postavi v infrardečo optiko.
Silicij je lahko drugačen in vsa področja zastosuvannya, ki se širijo. V metalurgiji Si
uporablja se za odstranjevanje kislosti (deoksidacije) iz staljenih kovin.
Silicij skladišče veliko število zlitin dvoranskih in barvnih kovin.
Trdne silicijeve zlitine za povečanje odpornosti proti koroziji, izboljšanje njihove livarne moči in povečanje mehanske trdnosti; prote z večjo zmistí Silicij lahko viklikati kryhkíst.
Najpomembnejše so zlitine, bakrove in aluminijeve zlitine, ki se lahko uporabljajo za maščevanje pasov.
Kremen se obdeluje s steklenimi, cementnimi, keramičnimi, električnimi in drugimi industrijskimi galužami.
Čiščenje silicija je pomembno za izdelavo posameznih elektronskih naprav (na primer procesorja vašega računalnika) in mikrovezij z enim čipom.
Čisti silicij, ki se uporablja za čisti silicij, čiščenje metalurškega silicija, saj je kristalni silicij glavna surovina za energijo Sony.
Monokristalni silicij - smetana elektronike in sony power engineering se uporablja za izdelavo zrcal plinskih laserjev.

Čistilni silicij in produkt joge
Silicij v telesu
Silicij v telesu se nahaja v očeh različnih spolov, ki igrajo vodilno vlogo pri osvetljevanju trdih skeletnih delov in tkiv. Posebej bogati s silicijem lahko kopičijo ostanke morskih alg (na primer diatomejske alge) in bitja (na primer spužve s silicijevim rogom, radiolarije), ki so v času oceana na dnu oceana utrjene z usedlinami silicijevega oksida. (IV). V mrzlih morjih in jezerih so bolj pomembni biogeni muli, bogati s silicijem, v tropskih morjih pa vaping muli z nizko vsebnostjo silicija. Trave, šaši, palme in njivske preslice naberejo sredi kopenskih rastlin veliko silicija. V hrbteničnih bitjih, namesto silicijevega (IV) oksida, v rekah pepela 0,1-0,5%. V največjem številu pojavov silicija v alkalnem srečna tkanina, nirkah, pidshlunkovy trezor. V dopolnilni prehrani imajo ljudje do 1 g silicija. Ob visokem vnosu silicijevega (IV) oksida v zrak se le-ta porabi v človeški legeni, kar povzroči bolezen – silikozo.
Visnovok
No, glede na vse, če si prebral do konca in malo prodrl, potem si malo bližje uspehu. Jaz spodívayus, pisanje nisem za nič in píst vouchsafed hoch komu. Za spoštovanje.
SILIKON. (Silicij), Si - kem. element IV skupine periodnega sistema elementov; pri. n. 14, pri. m. 28.086. Kristalni silicij-temno siv govor s smolnatim leskom. V večini primerov se razkrije stopnja oksidacije - 4, +2 in +4. Naravni silicij je sestavljen iz stabilnih izotopov 28Si (92,28 %), 29Si (4,67 %) in 30Si (3,05 %). Umik radioaktivnih izotopov 27Si, 31Si in 32Si z obdobji povratnega razpada 4,5 sekunde, 2,62 leta in 700 let. prvič viden leta 1811 v francoščini. kemik in fizik J. L. Gay-Lussac in francoski. kemik L. J. Tenar, manj pa je identifikacij leta 1823 Šved, kemik in mineralog J. Ya. Berzelius.
Za širino v zemeljski skorji (27,6%), silicij-drugi (po kislem) element. Vedeti je pomembno. v obliki kremena Si02 in drugih kislih govorov (silikati, alumosilikati itd.). Za najboljše ume je vzpostavljena stabilna modifikacija prtičkov, ki ima kubično strukturo, osredotočeno na obraz, kot je diamant, s periodo a = 5,4307 A. Intermitentna penetracija je 2,35 A. Širina je 2,328 gcm. Z visokim tlakom (120-150 kbar) pojdite na večje žice in kovinske modifikacije. Kovinska modifikacija-superprevodnik s temperaturo prehoda 6,7 K. Z naraščajočim tlakom se tališče zniža s 1415 ± 3 ° C pri tlaku 1 bar na 810 ° C pri tlaku 15,104 bar redko). ). Pri taljenju pride do povečanja koordinacijskega števila in metalizacije medatomskih vezi. Amorfni silicijev značaj bližnjega reda, ki kaže močno ustvarjeno prostorninsko osredotočeno kubično strukturo, skoraj redko. Debievskaya t-ra je blizu 645 K. Coef. temperatura linearna ekspanzija se spreminja s spreminjanjem t-ri po ekstremnem zakonu, nižja od t-ri 100 To vina postane negativna, doseže najmanj (-0,77 10 -6) deg -1 pri t-ri 80 K; pri t-rí 310 K vino je 2,33 10-6 deg-1, pri t-rí 1273 K-4,8 10 deg-1. Talilna toplota 11,9 kcal/g-atom; tkіp.3520 K.
Toplota sublimacije in izhlapevanja pri temperaturi taljenja je 110 in 98,1 kcal/g-atom. Toplotna prevodnost in električna prevodnost silicija sta v čistosti in temeljitosti kristalov. Zí rostannyam t-ri coef. toplotna prevodnost čistega K. postopoma narašča (do 8,4 cal / cm X X sec deg pri t-ri 35 K), nato pa se spremeni in doseže 0,36 in 0,06 cal / cm sec deg pri t-ri vídpovidno 300 in 1200 K. Entalpija, entropija in toplotna kapaciteta K. v standardnih glavah je enaka 770 cal/g-atom, 4,51 in 4,83 cal/g-atom - deg. Silicij diamagneten, magnetna občutljivost trdnih (-1,1 10 -7 mu/g) in redkih (-0,8 10 -7 mu/g). Silicij je slabo naložen v t-ri. Površinska energija, debelina in kinematična viskoznost redkega K. pri temperaturi taljenja postanejo 737 erg/cm2, 2,55 g/cm3 in 3 10 m2/sek. Tipičen prevodnik iz kristalnega silicija s širino ograjenega območja 1,15 ev pri t-p 0 do 1,08 u - pri t-p 300 K. Pri sobni temperaturi je koncentracija mokrih nosilnih nabojev blizu 1,4 10 10 cm - 3;
Moč silicija pada zaradi narave in koncentracije hiš, pa tudi zaradi popolnosti kristala. Prstan za otrimannya napіvprovіdnikovogo Do. z vodenjem r- in n-tipa joge se kombinirajo z elementi IIIb (bor, aluminij, galij) in Vb (fosfor, mish'yak, antimon, bizmut) podskupino, ki ustvarjajo sukupnіst vídpovіdno do akceptorja in darovalca rívní v , roztashovannyh v bližini kordonov con. Za legiranje vicorista so ti drugi elementi (na primer) oblikovani tako. glybokí rivní, yakí obumovlyuyut zakopavanje in rekombinacija nosesív stroškov. Tse vam omogoča, da vzamete materiale z visoko elektro. podpora (1010 ohm cm pri t-rí 80 K), da majhna trivalnost baze manjših obrabnih stroškov, kar je pomembno za povečanje števila različnih gospodarskih poslopij. Koeficient termoelektrična energija s silicijem je treba le odložiti v t-ri in na mestu hiše, zbіlshyuyuchi zí zrostannym elektroopor (pri p = 0,6 ohm - cm, a = 103 mikrovoltov / toča). Dielektrična penetracija silicija (od 11 do 15) je šibko odložena v skladišču in temeljitost monokristalov. Zakoni optičnega glinenja silicija se močno spremenijo zaradi spremembe v čistosti, koncentraciji in naravi napak v življenju ter dolgoživosti.
Kordon posrednega glinenja elektromagnetnega kolivana je blizu 1,09 evra, neposrednega glinenja - do 3,3 evra. V vidnem območju spektra parametrov kompleksnega indikatorja loma (n - ik) je že mogoče ležati na površini hiše. Za posebej čisti Do. (priλ \u003d 5461 A in t-re 293 K) n \u003d 4,056 in k \u003d 0,028. Robotska proizvodnja elektronike je blizu 48 evrov. Silikonski trend. Yogo trdota (t-ra 300 K) za Moos - 7; HB = 240; HV y \u003d 103; I = 1250 kgf / mm2; modul norm, elastičnost (polikristal) 10890 kgf / mm2. Med mineralnostjo, da leži v globini kristala: na viginu je globina 7 do 14; coef. Togost 0,325 1066 cm2/kg.
Pri sobni temperaturi silicij praktično ne deluje s plinom podobnimi (vključno) in trdnimi reagenti, krím lіv. Pri premikanju t-ri je aktivna interakcija s kovinami in nekovinami. Zocrema, ki raztaplja karbid SiC (pri temp. 1600 K), nitrid Si3N4 (pri temp. 1300 K), fosfid SiP (pri temp. 1200 K) in arzenid Si As, SiAS2 (pri temp. 1000 K). S kislo reakcijo pri temperaturi 700 K, gašenje Si02 dioksida, s halogeni - SiF4 fluorid (pri temperaturi več kot 300 K), SiCl4 klorid (pri temperaturi več kot 500 K), SiBr4 bromid (pri temperaturi 700 K) v nodidu SiI4 (pri tal. 1000). Intenzivno reagira z mnogimi drugimi. kovin, ugotavljanje trdnih razlik v njihovi zamenjavi za hi-kem. na polovici - silicidi. Območja koncentracije homogenosti trdnih vrtnic se pojavijo glede na naravo rozete (na primer Nimechchin v 0 do 100%, v jeseni do 15%, v alfa cirkoniju manj kot 0,1%).
Razlika med kovinami in nekovinami v trdnem siliciju je bistveno manjša in zveni retrogradno. S kakšnimi mejami, namesto hiše, kaj se dela pri Do. ne zelo globoko, doseže maksimum ( 2 10 18 , 10 19 , 2 10 19 , 1021, 2 10 21 cm) območje t-r víd 1400 do 1600 K. Hiše z globoko rívenny vídznyayutsya nekoliko manjši rozchinnístyu (víd 1015 za selen in 5 10 16 za zalíza do 7 10 17 za nikelj in 10 18 cm-3 za midi). Pri redkem jeklu silicij ni obdan z navadnimi kovinami, pogosto z odličnimi vizijami toplote. Čisti silicij pripravimo iz tehničnega izdelka 99% Si і - 0,03% Fe, Al і Co), kaljenega s kremenom in premogom v električnih pečeh. Začnite z novim vdihom do tam (sum_shy klorovodikova in sirchanoy, nato pa fluorid-voda in sirchanoy) hiš, po katerem se izdelek (99,98%) odvzame, obdela s klorom. Sinteze se čistijo z destilacijo.
Silicijev prevodnik se uporablja v kombinaciji s SiCl4 kloridom (ali SiHCl3) v vodi ali toplotnim raztezanjem SiH4 hidrida. Preostalo čiščenje in mletje monokristalov se izvede z gladko metodo cone brez lončka ali po metodi Czochralskyja, pri čemer se upošteva posebno čista omaka (v hiši do 1010-1013 cm-3) cf\u003e 10 3 ohm cm iv pri ki vnesti doziranje števila potrebnih hiš. Tako pripravite valjaste kreme premera 2-4 in dolžine 3-10 cm Za posebne. namen je proizvesti še več monokristalov. Tehnični silicij in predvsem jogove zlitine iz vikorične soli, kot so kisla jekla in zlitine, ter lahki dodatki. Posebno čist zrazki monokristal K., dopiran z različnimi elementi, je znano, da se uporablja kot osnova za različne nizkotokovne (zocrema, termoelektrične, radijske, svetlobne in fototehnične) in visokotokovne (vibracijske, pretvorne) priključke.
Silicij in silicij
Silicij pripeljemo do nekovin in 4 elektroni so lahko na istem energijskem nivoju. Vín lahko víddavati njihove, prikazuje stopnjo oksidacije + 4 in dodaja elektrone, prikazuje stopnjo oksidacije - 4. Vendar pa je sposobnost dodajanja elektronov siliciju bistveno manjša, nižja pri ogljiku. Atomi silicija imajo lahko večji radij, manjši atomi ogljika.
Narava pozna silicij .
Silikonski lok podaljškov v naravi. na njen del pade več kot 26% mase zemeljske ošpice. Za širino vin sedite na drugem mestu (po kislem). Na vídmínu víd víd uglec C vílny stíní vіrіdí ne zustrichaetsya. Він vstopi v skladišče različnih kemičnih sestav, predvsem različnih modifikacij silicijevega oksida (IV) in soli silicijeve kisline (silikati).
Obsedenost s silicijem .
Pri industrijskem siliciju tehnične čistosti (95 - 98 %) prevladuje SiO 2 koks v električnih pečeh med praženjem:
SiO 2 + 2C \u003d Si + 2CO
SiO 2 + 2Mg \u003d Si + 2MgO
Na ta način se iz hiš odvzame amorfni prah silicija rjave barve. Prekristalizacijo iz talilnih kovin (Zn, Al) lahko prenesemo v kristalni mlin.
Silicijev tetraklorid, tudi visoke čistosti, se uporablja pri 1000 °C za silicijev tetraklorid SiCl 4 pari cinka:
SiCl 4 + 2Zn \u003d Si + 2ZnCl 2
da čistilni jogo po posebnih metodah.
Fizično Kemična moč silicij.
Čisti kristalni silicij - tenditni in trdi, mlahavi naklon. Tako kot diamant ima kubično kristalno mrežo s kovalentno vrsto vezi. Yogo tališče 1423 °C. Za največje ume je silicij neaktiven element, ki reagira le s fluorom, pri segrevanju pa vstopi v različne kemične reakcije.
Yogo vikoristovuyut kot dragocen material za napіvprovіdnikovіy tehnіtsі. V kombinaciji z drugimi prevodniki vina se odlikuje po visoki odpornosti proti razredčenim kislinam in veliki električni upornosti do 300 °C. Tehnični silicij in ferosilicij se uporabljata tudi v metalurgiji za toplotno obstojna, kislinsko obstojna in orodna jekla, čavune in bogate druge zlitine.
S silicijevimi kovinami kemije, imenovani silicidi, pri segrevanju z magnezijem se magnezijev silicid raztopi:
Si + 2Mg = Mg 2 Si
Silicidi kovin za strukturo te prevlade napovedujejo karbide, zato se kovinski silicidi, tako kot kovinski karbidi, odlikujejo po veliki trdoti, visokem tališču, vroči električni prevodnosti.
Pri cvrtju sumish pisku s koksom v električnih pečeh se silicijev karbid in ogljik mešata s silicijevim karbidom ali karborundom:
SiO2 + 3C = SiC + 2CO
Karborund je ognjevzdržen, trd govor brez palic, dragocen abrazivni in toplotni material. Karborund, jak i, maê atomski kristalni grati. Na čisti postaji je izolator, v prisotnosti hiše pa postane prevodnik.
Silicijeva jaka i , raztopi dva oksida: silicijev oksid (II) SiO in silicijev oksid (IV) SiO 2 . Silicijev oksid (IV) je trda ognjevzdržna snov, ki je v naravi zelo razširjena v svobodni državi. To je kemično stabilen govor, ki deluje samo s fluorom in plinom podobnim fluorom v vodi ali fluorovodikovi kislini:
SiO 2 + 2F 2 \u003d SiF 4 + O 2
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Kazanje neposredno na reakcije je razloženo z dejstvom, da ima lahko silicij veliko sporidnost do fluora. Poleg tega je silicijev tetrafluorid leteči govor.
At tekhnіtsі prozoriya SiO 2 vykorovuyut za pripravo stabilne ognjevzdržne kremenčeve plošče, saj prijazno zgreši ultravijolično spremembo, ima lahko velik koeficient raztezanja, kar kaže na znatne spremembe temperature. Amorfna modifikacija silicijevega oksida (II) tripoli ima veliko poroznost. Yogo vikoristovuyut kot toplotni in zvočni izolator za vibrirajoči dinamit (nos vibukhovo govor) in tako naprej. Silicijev (IV) oksid v vibrirajočem zvoku je eden glavnih vsakdanji materiali. Učinkovit je pri proizvodnji ognjevarnih in kislinsko odpornih materialov, jekla, kot talilo v metalurgiji ipd.
Glede na molekulske formule je kemijsko in fizikalno moč ogljikovega oksida (IV) in silicijevega oksida (IV) enostavno ujemati, moč pa je podobna v kemično skladišče z'ednan raznі. Zakaj je pojasnjeno, da silicijev oksid (IV) ne nastaja le iz molekul SiO 2 , kot so njihovi sodelavci, so v nekaterih izmed njih atomi silicija povezani z atomi kislega. Silicijev (IV) oksid (SiO 2 )n. Njena slika na kvadratu:
Še en predstavnik elementov glavne podskupine skupine IV (IVA skupina) periodnega sistema D. I. Mendelijev - silicij Si.
V naravi je silicij še en kemični element za širino kisline. Zemeljska skorja je od yogo spoluka vedno bolj četrtino nagubana. Najbolj razširjen silicij je silicijev oksid (IV) SiO 2, drugo ime je silicijev dioksid. V naravi se vina izdelujejo z mineralom kremenom (mali 158), bogato paleto takšnih - girski kristal, pa tudi znamenito lila obliko - ametist, pa tudi ahat, opal, jaspis, kalcedon, karneol, v obliki virobní in opojni kamni. Silicijev (IV) oksid je sestavljen tudi iz izjemnega in kremenčevega peska.

Mal. 158.
V dolomit vmešani kristali kremena
Trije različni minerali na osnovi silicijevega oksida (IV) (kremen, kalcedon in drugi) prvi ljudje pripravljen znaraddya pracі. Isti kremen, ki je neopazen in ni ožji od kamna, polaganje storža kamna vítsі - vítsі kremіnyh znaryad pratsі (slika 159). Razloga za to sta dva: širina in dostopnost kremena ter gradnja stavb s tem, kako ostri so robovi.

Mal. 159.
Znaryaddya kamen víku
Druga vrsta naravnih materialov za silicij je silikat. Med njimi so največje širine aluminosilikatov (razumelo se je, da lahko ti silikati nadomestijo kemični element aluminij). Aluminosilikatom se doda granit, videti drugače glina, sljuda. Silikat, ki ne maščuje aluminija, na primer azbest, ki se uporablja za izdelavo ognjemetov.
Silicijev oksid (IV) SiO 2 je nujen za življenje pridelovalcev in bitij. Vina dajejo stebla roslina in zahisnymi tančice bitij (slika 160). Zavdyaki yomu čakalne vrste, čakalne vrste in preslice stojijo mitzno, kot vrečke, gostre listnati šaši, rezani, kot noži, strnišče na poševnem polju, kot glava, in stebla žit na tleh mitzne, ki ne dovoljujejo koruznih polj na poljih ležati v deski in vetru . Luska rebro, lupine kome, kril meteliks, pir'ya ptahiv і volna bitij mítsnі, oskílki smite silicijev dioksid.

Mal. 160.
Silicijev (IV) oksid daje mineralnost steblom roslina in zadušljivim oblinam bitij
Z'ednannya silicij daje gladkost in mehkobo las in nohtov osebe.
Silicij za vstop in v skladišče nižjih živih organizmov - diatomej in radiolarij, najnižjih prsi žive snovi, kot da ustvarjajo svoje nepopolnosti za lepoto okostja s kremenom (slika 161).
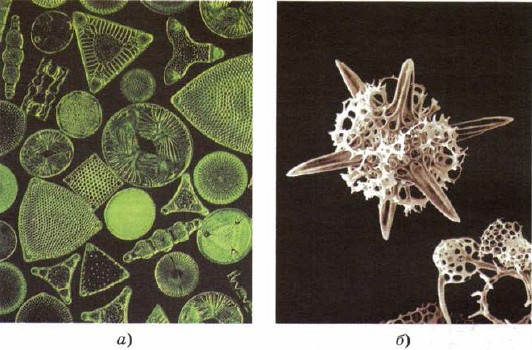
Mal. 161.
Okostja diatomej (a) in radiolarij (b) so sestavljena iz kremena
Prevlada silicija. Uporabljate mikrokalkulator z baterijo sony, zato obstaja obvestilo o kristalnem siliciju. Tse napіvprovіdnik. Na vídmínu víd metalіv, іz pіdvishennyam temperatura yogo elektroprovіdnіst zbíshuєtsya. Na satelitih, vesoljskih ladjah, postajah in dahah budinkiv (majhnih 162) nameščajo sony baterije, ki pretvarjajo sony energijo v elektriko. Smrad deluje kristale napіvprovіdnikіv, in na prvem črnem kremenu. Silicijeve fotocelice je mogoče pretvoriti v elektriko do 10 % energije sony.

Mal. 162.
Sleepy baterija za kabino dahu
Silicij za izgorevanje pri kislosti, ki vas zadovolji s silicijevim oksidom (IV):
![]()
Ker je nekovin, se silicij pri segrevanju spoji s kovinami z raztopinami silicidov, na primer:
![]()
Silicidi se zlahka razmažejo z vodo ali kislinami, ko vidite plinu podoben vodi podoben silicij – silan:
Na površini ogljikovih hidratov se silan na površini samospreje in zgori z raztopljenim silicijevim oksidom (IV) in vodo:
Povečano reakcijo med silanom in metanom CH 4 je razloženo z dejstvom, da je širitev atoma silicija večja, nižja pri ogljiku, zato so kemične vezi Si-H manjše, vezi C-H nižje.
Medsebojno delovanje silicija s koncentriranimi vodnimi spremembami travnikov, zaradi česar nastane silikat in voda:
Silicij vsebuje podobno kot silicijev oksid (IV) magnezij ali ogljik:
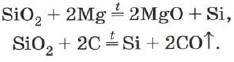
Silicijev oksid (IV) ali silicijev dioksid ali silicijev dioksid SiO 2 jak in CO 2 je kisli oksid. Vendar pa je na površini CO2 molekularna, a atomska kristalna mreža. Temu je SiO 2 trd in ognjevzdržen govor. Vina se ne razlikujejo po vodnih kislinah, fluorovodikovi smetani in aloji pri visokih temperaturah s travniki z raztopljenimi solmi kremenčeve kisline - silikati:
Kremen se lahko uporablja tudi za legiranje silicijevega oksida (IV) s kovinskimi oksidi ali karbonati:
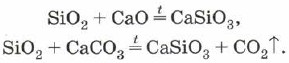
Natrijevi silikati in kalijevi se imenujejo maloprodajne plošče. іх oskrba z vodo- Dobro je uporabiti silikatno lepilo.
Kremenčeva kislina H 2 SiO 3 (slika 163):
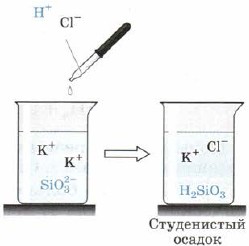
Mal. 163. Kisla reakcija na silikatni ion
Poleg tega je H2SiO3 tudi šibka kislina. V vodi je nedosleden in iz reakcionarnega nemira izpade ob pogledu na ostanke obleganja, ki včasih stisnejo ves volumen razlike, ga spremenijo v trdno maso, grem na žele, žele. Pri obešanju masi se vzpostavi zelo porozen govor - silikagel, ki se pogosto uporablja kot adsorbent - glina drugih govorov.
Laboratorijsko spričevalo št. 40
Posedovanje silicijeve kisline in to dokazovanje moči
Vbrizgavanje silicija. Že veste, da se silicij uporablja za proizvodnjo prevodnih materialov, pa tudi kislinsko odpornih zlitin. Ko se kremenčev pesek zlije z volno pri visokih temperaturah, se raztopi silicijev karbid SiC, ki je na voljo samo diamantu. Zato je treba vicorate za ostrenje ríztsіv metalorіzalnyh verstatіv in poliranje dragega kamna.
Iz staljenega kremena pripravljajo različne kemične kremenčeve posode, ki prenesejo visoke temperature in na mrazu ne pokajo.
Z'ednannya silicij je osnova za upogibanje skladišča v cement.
Zvichayne napaka lahko skladišče, ki se lahko izrazi s formulo Na 2 O CaO 6SiO 2. Yogo se zmaga v posebnih pečeh s topljeno sumish soda, vapnyak in piska.
Vídmіnna riž skla - zdatnіst rozm'yakshuvatisya і v staljenem jeklu nabrekne, ali je oblika, saj se shrani, ko je skladišče ulovljeno. Na podlagi katerega se izdeluje posoda in drugi izdelki.
Dodatkoví yakosti sklu dajejo različne dodatke. Tako se vnos svinčevega oksida zmanjša na kristalno čisto barvo, kromov oksid postane zelen, kobaltov oksid modri itd. (slika 164).

Mal. 164.
Izdelki iz barvnega skladišča
Sklo je eden najstarejših ljudskih vinarjev. Že 3-4 tise. Zaradi tega je izbruhnila vojna v Egiptu, Siriji, Finikiju in Črnem morju.
Sklo - isti material ni manj kot remísnikív, ampak tudi umetniki. Mojster je dosegel najvišjo stopnjo popolnosti Stari Rim, kot bi jim mozaikom lahko odvzeli barvni naklon in delo.

Mal. 165.
Barvno steklo na vitražih katedrale Notre Dame v Chartresu
Ustvarite umetniška dela iz skladišča z obov'yazkovymi atributi velikega muzeja in barvitimi vitraži cerkve, mozaičnimi ploščami - svetlimi zadnjicami tega (slika 165). V enem od prostorov peterburške podružnice Ruske akademije znanosti je mozaični portret Petra I, zmagovitega M. V. Lomonosova (slika 166).

Mal. 166.
Mozaični portret Petra I
Območja zastojev so precej velika. Tse vikonne, plyashkove, lampov, dzerkalne sklo; optični naklon - od okularjev do očal fotoaparata; leče neločljivih optičnih naprav - od mikroskopov do teleskopov.
Drugi najpomembnejši material, premazi na osnovi silicija, je cement. Yogo se uporablja za peko gline in vape v posebnih pečeh, ki so zavite.
Če se prah cementa zmeša z vodo, potem cement ni trdno utrjen, drugače, kot se imenuje budilke, cement rozchin, ki je korak za korakom trši. Pri dodajanju betona cementu ali drobljenemu kamnu je treba beton odstraniti kot pokrivni premaz. Materialnost betona narašča, tako da se v novo vnese nov okvir - izstopi liti beton, iz katerega so izdelane stene panela, bloki prekrivk, fermi mostovi itd.
Skladišče se ukvarja s proizvodnjo cementa silikatno industrijo. Vaughn izdeluje tudi silikatno keramiko - ceglu, porcelan (mali 167), fajanso in izdelke iz njih.

Mal. 167.
Sorte porcelana
Vídkrittya silicij. Čeprav so bili ljudje v starih časih zelo uspešni pri uporabi silicija, je sam silicij leta 1824 prvi opustil švedski kemik J. Ya. Berzelius. Vendar pa sta bila 12 let pred novim kremenom odvzeta J. Gay-Lussac in L. Tenard, ale vin duzhe zabrudneniy hiše.
Latinsko ime silicum izvira iz latinske besede silex-kremen. Rusko ime "silicij" spominja na orehov kremnos - "skel, skel".
Nove besede, ki razumejo
- Naravni viri silicija: silicijev dioksid, kremen in druge sorte, silicijev dioksid, aluminosilikat, azbest.
- Biološki pomen silicija.
- Prevlada silicija: napіvprovіdnikovі, medsebojno delovanje s kislo, kovinami, travniki.
- Silan.
- Silicijev (IV) oksid. Joga Budova in moč: interakcija s travniki, bazičnimi oksidi, karbonati in magnezijem.
- Silicijeva kislina in njene soli. Rozchinne slo.
- Zastosuvannya silicij in yogo polovica.
- Sklo.
- Cement.
poimenuj dan
Najpogosteje v naravi najdemo silicij v obliki silicijevega dioksida - baze na osnovi silicijevega dioksida (IV) SiO 2 (približno 12 % zemeljske mase). Glavni minerali in kamnine, ki jih gasi silicijev dioksid, so veriga (bogati in kremen), kremen in kvarcit, kremen, polov_spar. Silicijev dioksid in aluminosilikat sta v naravi zložena v drugo za širino.
Eno za drugim je opaženo dejstvo o pomembnosti čistega silicija v njegovem naravnem videzu.
Otrimannja
Silicij bo izstopil pri cvrtju hrustljavega belega piskuja (silicijev dioksid) z magnezijem:
S i O 2 + 2 M g → 2 M g O + Si (\displaystyle ~(\mathsf (SiO_(2)+2Mg\ \desna puščica \ 2MgO+Si)))Na kaj se strinjate amorfni silicij , kaj lahko izgleda kot rjav prah.
V industriji tehnično čistost silicija dobimo s taljenjem SiO 2 s koksom pri temperaturi okoli 1800 ° C v rudno-termičnih pečeh tipa jaška. Čistost silicija, odstranjenega s takšno stopnjo, lahko doseže 99,9% (glavne hiše so premog, kovina).
Lahko se odmaknete od čiščenja silicija iz hiš.
- Čiščenje v laboratorijskih umivalnicah se lahko izvaja po poti čelnega posedovanja magnezijevega silicida Mg 2 Si. Dodali smo magnezijev silicid za dodatno klorovodikovo ali oktotsko kislino za odstranitev plina podobnega monosilana SiH 4 . Monosilan očistimo z rektifikacijo, sorpcijo in drugimi metodami, nato pa ga položimo na silicij in vodo pri temperaturi okoli 1000 °C.
- Čiščenje silicija v industrijskem obsegu poteka po poti nevmesnega kloriranja silicija. S tem se raztopijo polovice zalog SiCl 4, SiHCl 3 in SiH 2 Cl 2. іх na drugačen način hišo očistimo (praviloma z destilacijo in disproporcionacijo) in na končni stopnji dodamo čisto vodo pri temperaturah od 900 do 1100 °C.
- Razvijajo se cenejše, čistejše in učinkovitejše industrijske tehnologije za čiščenje silicija. Za leto 2010 pred njimi je mogoče uvesti tehnologije za čiščenje silicija z nadomestnim fluorom (nadomešča klor); tehnologije, ki prenašajo destilacijo na silicijev monoksid; tehnologije, ki temeljijo na hišah iz barvnega stekla in se osredotočajo na medkristalne meje.
Vmíst domíshok pri finaliziranem siliciju se lahko zmanjša na 10 -8 -10 -6% na maso. Več poročil o prehrani čistega silicija je pregledanih v članku Polikristalni silicij.
Metoda pridobivanja silicija v čisti obliki z drobljenjem Mikola, Mikolayovich Beketov.
Fizična moč
Silicijeva kristalna mreža je kubična kot diamant, parameter a = 0,54307 nm (pri visok primež odstraniti druge polimorfne modifikacije silicija), vendar z večjo vezjo med Si-Si atomi v vezi z vezjo zv'azku S-S trdota silicija je bistveno manjša od trdote diamanta. Silicij prasketa, šele ko se segreje na 800 ° C, postane plastičen govor. Vín prozory za infrachervonogo viprominyuvannya s dozhini khvili 1,1 mikronov. Mokra koncentracija nosu v polnitvi je 5,81 10 15 m-3 (za temperaturo 300 K).
Elektrofizična moč
Elementarni silicij v enokristalni obliki je prevodnik s posredno režo. Širina ograjenega prostora pri sobna temperatura shranjevanje 1,12 eV in pri T \u003d 0 K - 1,21 eV. Koncentracija mokrih nosilcev naboja v siliciju za normalne možgane postane blizu 1,5·10 10 cm −3.
Na elektrotrofni moči kristalnega silicija velik dotok gradi hiše, ki tavajo v temi. Za pridobivanje kristalov silicija z globoko prevodnostjo v silicij vnesite atome elementov skupine III, kot so bor, aluminij, galij in indij. Za pridobivanje kristalov iz silicija z elektronsko prevodnostjo v silicij vnesite atome elementi V-ї groupi, kot so fosfor, mish'yak, surma.
Pri sestavljanju elektronskih naprav na osnovi silicija je pomembno, da površinsko kroglo pritrdimo na material (do desetine mikronov), tako da lahko površinsko kakovost kristala dodamo elektrostatični moči silicija in očitno na moč končnega orodja. Med sestavljanjem nekaterih naprav se doda vikor, ki se uporablja za modifikacijo površine, na primer, površina je prevlečena s silicijem z različnimi kemičnimi sredstvi in njeno oprominennya.
Kemična moč
Podobno kot za atome ogljika je tudi za atome silicija značilna sp 3 -hibridizacija orbital. V povezavi s hibridizacijo čisti kristalni silicij tvori diamantom podobna zrna, v katerih je silicij hotivaleten. Hkrati se zvok silicija manifestira tudi kot hotivalentni element z oksidacijskim stanjem +4 ali -4. Zustrichayutsya bivalent pol silicij, na primer, silicijev oksid (II) - SiO.
Za normalne misli je silicij kemično neaktiven in aktivno reagira samo s plinom podobnim fluorom, s katerim se raztopi hlapni silicijev tetrafluorid SiF4. Takšna »neaktivnost« silicija je posledica pasivizacije površine nanovelike kroglice silicijevega dioksida, ki se v prisotnosti kisle, vedno znova vode (vodne pare) negativno usede.
kisanje z raztopljenim SiO 2 dioksidom, proces spremlja povečanje volumna kroglice dioksida na površini, stabilnost oksidacijskega procesa je omejena z difuzijo atomske kisline in kriokonzerviranega dioksida.
Pri segrevanju na temperaturo nad 400-500 ° C silicij reagira s klorom, bromom in jodom - s sprejetjem lahko hlapnih tetrahalidov SiHal 4 in po možnosti halogenidov v zloženem skladišču.
Z vodo silicij brez sredine ne reagira, z vodo pa silicij - silani s formulo Si n H 2n + 2 - imajo posreden način. Monosilan SiH 4 (yogo se pogosto imenuje preprosto silan) je viden v interakciji kovinskih silicidov s kislinami, na primer:
C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 (\displaystyle ~(\mathsf (Ca_(2)Si+4HCl\ \desna puščica \ 2CaCl_(2)+SiH_(4)\ ) puščica navzgor)))SiH 4 silan, ki se pri tej reakciji raztopi, maščuje hiše in druge silane, zokrem, Si 2 H 6 disilan in Si 3 H 8 trisilane, v nekaterih lancetah za atome silicija, med seboj povezane z enojnimi vezmi (- Si -Si-Si- ) .
Silicij reagira z dušikom in borom pri temperaturah blizu 1000 °C, pri čemer se raztopi nitrid Si 3 N 4 ter termično in kemično stabilen borid SiB 3 , SiB 6 in SiB 12 .
Pri temperaturah nad 1000 ° C je mogoče uporabiti silicij, ki je najbližji analog periodnega sistema - ogljik - silicijev karbid SiC (karborund), za katerega je značilna visoka trdota in nizka kemična aktivnost. Karborund se pogosto uporablja kot abrazivni material. S tem pa lahko taljenje silicija (1415 °C) tri ure kontaktiramo s premogom glede na velike kose sintranega drobnozrnatega grafita izostatičnega stiskanja, ki se praktično ne spreminja in ne moti ostalega.
Nižji elementi 4. skupine (Ge, Sn, Pb) so neprevlečeni s silicijem, tako kot večina drugih kovin. Pri segrevanju s silicijem in kovinami lahko nastanejo njihove polovične lupine, silicidi. Silicide lahko razdelimo v dve skupini: ionsko-kovalentne (silicidi lužnih, zemeljskih kovin in magnezija tipa Ca 2 Si, Mg 2 Si in in) in kovinske (silicidi prehodnih kovin). Silicidi aktivnih kovin so položeni pod redčenjem kislin; Kovinam podobni silicidi imajo visoko tališče (do 2000 °C). Najpogosteje se uporabljajo kovinsko podobna silicidna skladišča jaz Si, jaz 3Si2, jaz 2 Si 3 , jaz 5 Si 3 i jaz Si 2. Kovinam podobni silicidi so kemično inertni, odporni na kislost pri visokih temperaturah.
Posebej pomembno je poudariti, da silicij tesni evtektično vsoto, ki omogoča šiljenje (taljenje) materialov za tesnjenje ferosilicijeve keramike pri temperaturah, ki so opazno nižje, nižje od temperature tališča tesnila in silicija.
Pri dodajanju SiO 2 siliciju pri temperaturah nad 1200 ° C se silicijev oksid (II) - SiO raztopi. Ta proces je nenehno podprt s proizvodnjo kristalov s silicijevimi metodami
Silicij v ospredju vizij leta 1811. J.Gay-Lussac in L.Tenar pri prehodu hlapov silicijevega fluorida preko kovinskega kalija proteinov ne opisujeta kot element. Švedski kemik J. Berzelius leta 1823 z opisom silicija, ki ga je odstranil med predelavo kalijeve soli K 2 SiF 6 s kovinskim kalijem pri visoki temperaturi. Nov element so poimenovali "silicij" (lat. silex - kremen). Rusko ime "silicij" je leta 1834 uvedel ruski kemik Herman Ivanovič Hess. Pri prevodu dr. gr. krhmnoz- Kut, gora.
Znanje v naravi, otrimannya:
V naravi se silicij nahaja v vibrirajočem dioksidu in silikatih v drugem skladišču. Naravni silicijev dioksid je pomembnejši v obliki kremena, ki želi uporabiti druge minerale - kristobalit, tridimit, kit, cousite. Amorfni silicijev dioksid se kopiči v usedlinah diatomeje na dnu morij in oceanov - te usedline se usedejo s SiO 2 in vstopijo v skladišče diatomeje in drugih ciliatov.
Vilniy silicij se lahko uporablja za praženje z magnezijevim hrustljavim belim pisku, ki ga za kemično skladišče lahko očistite s silicijevim oksidom SiO 2 + 2Mg = 2MgO + Si. V industriji se silicij tehnične čistosti pridobi s taljenjem SiO 2 s koksom pri temperaturi okoli 1800 ° C v obločnih pečeh. Čistost silicija, pridobljena s takim rangom, lahko doseže 99,9% (glavne hiše so premog, kovina).
Fizične moči:
Amorfni silicij je lahko videti kot rjav prah, katerega debelina je večja od 2,0 g / cm 3. Kristalni silicij - temno siv, bleščeč kristalni govor, kristaliziran in trd, kristalizira v diamantih. To je tipičen prevodnik (bolje je prevajati elektriko, nižji gumijasti izolator in višji za prevodnik - srednji). Silicij prasketa, šele ko se segreje na 800 ° C, postane plastičen govor. Cíkavo, scho silikatni prosorium do infrachervony viprominyuvannya, začenši z dolgim vetrom 1,1 mikronov.
Kemična moč:
Kemično malo aktiven silicij. Pri sobni temperaturi reagira le s plinom podobnim fluorom, hlapni silicijev tetrafluorid SiF 4 se pri tej temperaturi raztopi. Pri segrevanju na temperaturo 400-500 ° C silicij reagira s kislino z raztopljenim dioksidom, s klorom, bromom in jodom - z raztopljenimi lahko hlapnimi tetrahalidi SiHal 4 . Pri temperaturah blizu 1000 ° C silicij reagira z dušikom, da raztopi nitrid Si 3 N 4 z borom - termično in kemično stabilnim boridom SiB 3, SiB 6 in SiB 12. Z vodnim silicijem ne reagira brez težav.
Za jedkanje s silicijem se najbolj uporablja vsota fluorovodikove in dušikove kisline.
Postavljen do travnikov.
Za silicij je značilna stopnja oksidacije +4 ali -4.
Najpomembnejša področja:
Silicijev dioksid, SiO 2- (silicijev anhidrid) ...
...
Silicijeve kisline- šibka, nejasna, utvoryuyuyutsya pri dodajanju kisline velikosti silikata izgleda kot gel (želatini podoben govor). Znano je, da se H 4 SiO 4 (orto-silicij) in H 2 SiO 3 (meta-silicij ali silicij) spreminjata in nepreklicno pretvorita v SiO 2 pri segrevanju in sušenju. Trden porozni izdelek za vstop - silikagel se lahko odpre na površini in deluje kot adsorbent plinov, sušilno sredstvo, katalizator in katalizator obrabe.
silikat- soli kremenčevih kislin dobrega (krim silikati natrija in kalija) niso topne v vodi. moč.
Slapovi- analogi ogljikovih hidratov, silani, polovično, v nekaterih atomih silicija z enojno vezjo, moč yakscho atom silicija z'єdnаnі podvіyny zv'yazkom. Lances in kiltsya se uporabljajo podobno kot ogljikovi hidrati. Vse moči so lahko samozaposlene, ustvarijo vibracije sumiša s ponavljanjem in zlahka reagirajo z vodo.
Zastosuvannya:
Največja količina silicija je znana za izbor zlitin za uporabo aluminija, bakra in magnezija ter za izbor ferosilicidov, ki so lahko pomembni za izbor jekel in ogrevalne opreme. Kristali silicija zastosovuyut baterije sony in napіvprovіdnikovih gospodarskih poslopij - tranzistorji in diode. Silicij služi tudi kot sirovina za proizvodnjo organosilicijevih plošč ali siloksanov, barvanje z oljem, oljem, plastiko in sintetičnimi gumami. Anorganski polži silicijev vicorist se uporablja v tehnologiji keramike in jekla, kot izolacijski material in p'ezokristali
Za nekatere organizme je silicij pomemben biogeni element. Vstopite v skladišče podpornih koč pri roslinu in skeletnih - pri bitjih. Morski organizmi – diatomeje, alge, radiolarije, spužve – so skoncentrirani na velikih površinah silicija. Odlične številke koncentrat preslice in žit s silicijem, v prvi črni - bambusovi in riževi podobni pidrodini, med njimi - sadilni riž. M'yazova tkivo osebe za maščevanje (1-2) 10 -2% silicija, kostno tkivo - 17 10 -4%, kri - 3,9 mg / l. Vendar pa človek danes lahko zaužije v telo do 1 g silicija.
Antonov S.M., Tomilin K.G.
HF Tyumen State University, 571 skupina.
