Fizikalne lastnosti sio2. Spojine s kisikom. Silicijev oksid (II) SiO
Silicijev oksid (II) SiO. V naravi se ne pojavlja, vendar se lahko doseže z reakcijo:
SiO2 + Si → 2 SiO.
Pod normalnim tlakom se sublimacija silicijevega monoksida začne pri okoli 1200 ° C (ko sami izhodni materiali praktično še ne izhlapijo). V parih je SiO posamezna spojina. Energija disociacije elementov je 789 kJ / mol. Pretvorbo v trdno stanje lahko dosežemo le s hitrim hlajenjem ("gašenjem") plinske faze. V nasprotnem primeru je čas za prestavljanje z enačbo:
2 SiO = Si02 + Si.
Silicijev monoksid se počasi oksidira z atmosferskim kisikom in se zlahka raztaplja v alkalijah, da se tvorijo silicijeve kisline in sproščanje vodika. Z lahkoto se elektrificira s trenjem in pridobi močan negativen naboj.
Silicijev oksid (IV) Si02.Silicijev oksid (IV) imenujemo tudi silicijev dioksid. Je trdna ognjevzdržna snov. (tališče 1700 ° C)razširjena v naravi v dveh oblikah: 1) kristalni silicijev dioksid - v obliki kremenovega minerala in njegovih sort (kamniti kristali, kalcedona, ahat, jaspis, kremen); kremenjak je osnova kremenovih peskov, ki se pogosto uporabljajo v gradbeništvu in v silikatni industriji; 2) amorfni silicijev dioksid - v obliki mineralne zmesi opal SiO 2 nH20; zemeljske oblike amorfnega silicijevega dioksida so diatomit, tripoli (infuzorijska zemlja); Primer umetnega amorfnega brezvodnega silicijevega dioksida je silikagel, ki ga dobimo iz natrijevega metasilikata:
Silikagel ima razvito površino in zato dobro vpija vlago.
Pri 1710 ° kremena se topi. S hitrim ohlajanjem staljene mase se tvori kremenovo steklo. Ima zelo nizek koeficient ekspanzije, tako da se vroče steklo kvarca ne razpoči, ko se voda hitro ohladi. Laboratorijska steklovina in instrumenti za znanstvene raziskave so izdelani iz kremenovega stekla.
Struktura SiO 2 v ravninski sliki je lahko predstavljena na naslednji način:
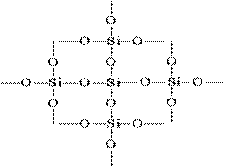
Vsak silicijev atom je zaprt v tetraedru s 4 kisikovimi atomi. V tem primeru je atom silicija v središču, kisikovi atomi pa se nahajajo v tockih tetraedra. Celoten kos silicijevega dioksida se lahko obravnava kot kristal, katerega formula je (SiO2) n. Takšna struktura silicijevega oksida (IV) določa njeno visoko trdoto in ognjeodpornost.
Kemijske lastnosti silicijevega oksida (IV) SiO2 se nanaša na kislinske okside. Pri taljenju trdnih alkalij, bazičnih oksidov in karbonatov se tvorijo soli silicijeve kisline: \\ t
Samo fluorovodikova kislina sodeluje s silicijevim oksidom (IV) (jedkanje stekla): \\ t
Si02 + HF → SiF4 + H20
Silicijev (IV) oksid se ne raztopi v vodi in z njim kemično ne sodeluje. Zato se silikatna kislina dobi posredno, na primer s hidrolizo: \\ t
SiS2 + H20OH2S + H4SiO4 ortosilikonska kislina.
H 4 SiO 4 je topen, kadar se segreva ali stoji, poteka postopek polimerizacije:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 diorthokremnievna kislina.
2H6Si2O7 → H20 + H10SiO13 tetraorotremilična kislina.
Zapre obroč:
H10SiO13 → H20 + (H2Si3) 4-tetrametacilna kislina.
V tem primeru lahko silicijevo kislino (odvisno od koncentracije začetnih raztopin soli in kisline) dobimo tako v obliki želatinaste mase, ki vsebuje vodo, kot v obliki koloidne raztopine (sol). Sestava pridobljene silicijeve kisline je odvisna od izhodnih materialov in pogojev priprave. Vse silicijeve kisline so zelo šibke (šibkejše od premoga).
Če ogljikova kislina v raztopini sprosti silicijevo kislino iz njenih soli, se med kalciniranjem pojavi povratna reakcija. Prvi je posledica nižje moči (stopnja disociacije) silicijeve kisline, druga pa nižja hlapnost pri segrevanju.
Pri segretih polisiličnih kislinah in njihovi postopni dehidraciji lahko dobimo fino SiO 2, ki se imenuje silikagel . Dobro vpija vodo, postavljam jo v pripomočke, ki preprečujejo oksidacijo dragih elementov.
Nemška podskupina
Ge (+4) Sn (+2, +4) Pb(+2) - odporna oksidacijska stanja
Germanium je napovedal DI Mendeleev leta 1871, odkril pa ga je leta 1886. Kositer in svinec spadata med elemente, ki so bili človeštvu že dolgo znani: Egipčani so jih lahko tali iz rud več kot 3000 let pred našim štetjem. e. V Indiji je vodstvo postalo znano okoli 2500 let, in do 1500 let pred našim štetjem. e. Taljenje kositra, proizvedeno v stari Kitajski.
Prejem.Naravne spojine germanija se pretvorijo v GeO 2 in reducirajo z vodikom:
GeO 2 + H 2 t → Ge + H 2 O pri temperaturah okoli 1000 ° C.
Kositer se pridobiva iz naravnih mineralov kasiterit(SnO 2):
SnO2 + C → Sn + CO.
Najenostavnejša shema za industrijsko zmanjšanje svinca temelji na dveh zaporednih reakcijah: \\ t
PbS + O2 → SO2 + PbO Galena(PbS) sežge in nato zmanjša s premogom:
PbO + S → SO + Pb.
Uporaba.Vsi trije elementi so zelo pomembni za sodobno tehnologijo. Nekatere spojine kositra in svinca so prav tako zelo pomembne. Derivati svinca so zelo strupeni.
Germanij je tipičen polprevodnik (n-tipa z širino prepustnega pasu 0,75 eV) in najde različne uporabe v elektrotehniki. Najpogosteje se uporablja za izdelavo AC usmernikov.. Ta aplikacija temelji na enopolni prevodnosti, ki izhaja iz stika med čistim germanijem in leguro germanija z indijem. Tok (pretok elektronov) v takšni instalaciji prehaja praktično samo iz germanija v zlitino, vendar ne obratno. Germaniumove usmernike odlikuje izredno visoka (okoli 98%) učinkovitost in zelo velika (s pravilnim delovanjem) življenjska doba. Glavna pomanjkljivost takšnih usmernikov je njihova občutljivost na ogrevanje - nad 70 ° C, njihova učinkovitost hitro pade.
Pomembno območje uporabe nemčija je infrardeča optika, ker žarki z valovno dolžino več kot 2 mikrona, praktično ne zamujajo. Nasprotno, pri svetlobi in v njenem razponu (0,2 do 2 mikronov), germanij intenzivno absorbira energijo. Če je sijoča kovinska površina (ki dobro skladišči toploto, vendar se ne segreva dobro) prekrita s filmom iz germanija, se površina povrne veliko bolj kot brez filma. Ugotovljeno je bilo, da v tako pripravljenem sodu pod vplivom sončne svetlobe lahko dobimo vrelo vodo.
Kositer se v glavnem uporablja za kositranje železa, da bi ga zaščitili pred rjavenjem. (pločevina za industrijo konzerviranja). Debelina takšnih kositrnih premazov je zelo majhna - reda mikronov. V obliki tankih listov (ti. Stannioles) se kositer porabi za proizvodnjo kondenzatorjev v elektroindustriji . Svinec se uporablja za izdelavo baterijskih plošč, plošč električnih kablov, nabojev in strel, za zaščito pred rentgenskimi žarki in žarki, kot tudi v kemični industriji (cevovodi itd.). Zelo velike količine kositra in svinca se porabijo za izdelavo številnih tehnično pomembnih zlitin.
Med njimi so najpomembnejši različni bron (Cu in Sn zlitine), zlitine za ležaje (babice, običajno narejene na osnovi Pb ali Sn, ki vsebujejo tudi Sb in Cu), tipografske zlitine (5-30% Sn, 10-20% Sb, ostalo je Pb) in običajen "mehki" spajk (30-70% Sn, 70-30% Pb). Pogosto ga lahko zamenja cenejša zlitina 90% Pb, 6% Sn, 4% Sb. Zelo pomembne so zlitine za ležaje s približno sestavo 98% Pb, 1% Ca, 1% Na.
Silicijev dioksid (silicijev dioksid, silicijev dioksid) je snov, ki jo sestavljajo brezbarvni kristali z visoko trdnostjo, trdoto in neodzivnostjo. Silicijev dioksid je odporen na kisline in ne vpliva na vodo. S povečanjem reakcijske temperature snov reagira z alkalijami, raztopi v fluorovodikovi kislini, je odličen dielektrik.
V naravi je silicijev dioksid široko razširjen: kristalni silicijev oksid predstavljajo minerali, kot so jaspis, agat (kristalinične silicijevega dioksida), kamniti kristali (veliki kristali snovi), kremen (prost silicijev dioksid), kalcedon, ametist, morion, topaz (barvni kristali). silicijev dioksid).
V normalnih pogojih (pri naravni temperaturi okolja in tlaku) obstajajo tri kristalne modifikacije silicijevega dioksida - tridimita, kvarca in kristobalita. Ko se temperatura dvigne, se silicijev dioksid najprej spremeni v koesit, nato pa v stišovit (mineral najdemo leta 1962 v meteoritnem kraterju). Po raziskavah je to stishovit, derivat silicijevega dioksida, ki povezuje velik del Zemljinega plašča.
Kemijska formula snovi - SiO 2
Priprava kremena
Silicijev dioksid se industrijsko proizvaja na kvarčnih rastlinah, ki proizvajajo čisti kvarčni koncentrat, ki se nato uporablja v kemični in elektronski industriji, pri izdelavi optike, gumijastih in lakirnih polnil, izdelavi nakita itd. Naravni silicijev dioksid, imenovan tudi silicijev dioksid, se pogosto uporablja v gradbeništvu (beton, pesek, zvočni in toplotnoizolacijski materiali).
Sinteza silicijevega dioksida s sintetično metodo se izvaja z delovanjem kislin na natrijev silikat, v nekaterih primerih na druge topne silikate ali s postopkom koagulacije koloidnega silicijevega dioksida pod vplivom ionov. Poleg tega se silicijev dioksid proizvaja z oksidacijo silicija s kisikom pri temperaturi okoli 500 stopinj Celzija.
Nanos iz silicijevega dioksida
Materiali, ki vsebujejo silicij, se pogosto uporabljajo na področju visokih tehnologij in v vsakdanjem življenju. Silicijev dioksid se uporablja v proizvodnji stekla, keramike, betonskih izdelkov, abrazivnih materialov, kot tudi v radijski tehniki, ultrazvočnih napravah, vžigalnikih itd. V kombinaciji s številnimi sestavinami se silicijev dioksid uporablja pri izdelavi kablov iz optičnih vlaken.
Neporozni amorfni silicijev dioksid se uporablja tudi v živilski industriji kot dodatek, registriran pod številko E551, ki preprečuje zlepljanje in strjevanje glavnega proizvoda. Dioksid  silikonska hrana se v farmacevtski industriji uporablja kot enterosorbent za proizvodnjo zobnih past. Snov najdemo v čipih, krekerjih, koruznih palicah, instant kavi itd.
silikonska hrana se v farmacevtski industriji uporablja kot enterosorbent za proizvodnjo zobnih past. Snov najdemo v čipih, krekerjih, koruznih palicah, instant kavi itd.
Silica Harm
Uradno je potrjeno, da silikonski dioksid poteka skozi gastrointestinalni trakt nespremenjen, potem pa se popolnoma odstrani iz telesa. Po petnajstletni študiji francoskih strokovnjakov pitna voda z visoko vsebnostjo glinice zmanjša tveganje za razvoj Alzheimerjeve bolezni za 10%.
Tako so informacije o nevarnosti silicijevega dioksida, ki je kemično inertna snov, napačne: prehranski dodatek E551, zaužit peroralno, je popolnoma varen za zdravje.
Silicijev oksid SiO2 je trdna, zelo ognjevzdržna snov (tališče več kot 1700 ° C), široko razširjena v naravi, kjer se nahaja predvsem v obliki kremenovega minerala, pa tudi kristobalita in tridimita.
Pri običajnih temperaturah je kvarc stabilna modifikacija, z naraščajočimi temperaturnimi polimorfnimi transformacijami.
Silicijev dioksid vseh modifikacij v obliki monomera ne obstaja; vedno je polimerna in "zgrajena" iz tetraedrov, ki tvorijo zelo močno atomsko mrežo
Vsak atom silicija v (SiO2) n kristalih je tetraedralno obdan s štirimi atomi kisika, od katerih je vsak premoščen. Skozi skupni atom kisika se tetraedre pri različnih kotih medsebojno vežejo in tvorijo zvezno tridimenzionalno mrežo; medsebojna razporeditev tetraeder v prostoru določa eno ali drugo modifikacijo silicijevega dioksida.
Pri različnih modifikacijah silicijeve spojine silicija se spreminja. To vpliva na velikost kotov Si-O-Si in razdalje Si-O, na primer, kot Si-O-Si v različnih modifikacijah silicija se giblje od 120 do 180 °. Prehodi kvarc-tridimit-kristobalita spremljajo zlomi in transformacije vezi, ki se lahko pojavijo le pri visokih temperaturah.
Quartz Pogosto najdemo v naravi v obliki izjemno dobro oblikovanih kristalov, včasih precejšnjih velikosti. Kristali so oblikovani iz tetraedrov, razporejenih v spiralni obliki okoli centralne osi, v obliki spirale. V istem kristalu je lahko smer vijačnice nasprotna. Taki kristali so optični izomeri. Rotirajo ravnino polarizacije svetlobe in so lahko tako desno kot levo. Ti in drugi kristali se kot subjekt razlikujejo od svoje zrcalne slike.
Kvarc se uporablja na različnih področjih znanosti in tehnologije, njegovi kristali pa se pogosto gojijo umetno. Nekatere vrste kremena so posebna imena. Prozorne brezbarvne kristale imenujemo rock kristal. Obstajajo tudi barvne sorte kremena: rose kremen, vijolična (ametist), temno rjava (dimljeni topaz), zelena (krizopraz) itd. Kristalinična modifikacija kremena z dodatki drugih snovi se imenuje kalcedon. Sorte kalcedona so: ahat, jaspis in drugo, kamniti kristali in barvne sorte kremena pa se uporabljajo kot dragoceni in poldragi kamni.
Tridimit se pojavlja v vulkanskih kamninah, vendar v zelo majhnih količinah. Znan tridimit in meteorit.
Cristobalite v naravi se včasih najde v obliki majhnih kristalov, vgrajenih v lavo, kot je tridimit. Tridimit in kristobalit imata bolj "ohlapno" strukturo kot kremena. Tako je gostota kristobalita, tridimita in kvarca 2.32; 2,26 in 2,65 g / cm3.
Talilna silika s počasnim hlajenjem enostavno tvori amorfno steklo kremena. V naravi najdemo tudi silicijev dioksid v obliki stekla. Gostota amorfnega stekla je 2,20 g / cm 3 - nižja kot pri vseh kristalnih modifikacijah. Kremenovo steklo ima rahel temperaturni koeficient ekspanzije, zato se uporablja za pripravo laboratorijskega stekla, odpornega na nenadne spremembe temperature.
Vse spremembe silicijevega dioksida v vodi so praktično netopne (pri temperaturi 25 ° C, topnost kremena je 7, kristobalit - 12, tridimit - 16, kremenovo steklo - 83 mg / l). Zato v normalnih pogojih na njih delujejo samo alkalne raztopine in fluorovodikova kislina:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
Si02 + 4HF = SiF4 + 2H2O. (2)
Slednja reakcija se uporablja pri "jedkanju" stekla.
Dodana silika reagira z bazičnimi oksidi, alkalijami (reakcija (1)) in karbonati, da tvorijo silikate: \\ t
SiO 2 + CaO = SaSiO 3, (3)
Si02 + Na2C03 = Na2Si03 + C02. (4)
Reakcije (3) in (4) so osnova za industrijsko proizvodnjo različnih stekel in cementa. Tako je sestava navadnega stekla (na primer okna, za izdelavo jedi) izražena s formulo Na 2 O. CaO. 6SiO 2. Takšno steklo se proizvaja s taljenjem mešanice sode, peska in apnenca. Postopek izvajamo pri temperaturi ~ 1400 ° C do popolne odstranitve plinov:
Na2C03 + CaC03 + 6 Si02 = Na2O.CaO. 6SiO 2 + 2CO2.
Za posebne razrede stekla - ognjevzdržne, "nezlomljive" - pri kuhanju dodajte okside barijevega, svinčevega, bornega. Da bi dobili barvna stekla, so uvedeni tudi različni dodatki, na primer dodajanje kobaltovega oksida Co 2 O 3 daje modro barvo, kromov oksid Cr 2 O 3 - zelen, manganov dioksid MnO 2 - roza.
SiO2 oksid je anhidrid številnih silicijevih kislin, katerih sestava se lahko izrazi s splošno formulo xSiO2 H yH2O, kjer sta x in y celo število: 1) x = 1, y = 1: SiO2. H2, t.j. H2Si03-meta-silikonska kislina; 1) x = 1, y = 2: Si02. 2H2O, t.j. ortosilična kislina; 1) x = 2, y = 1: 2SiO2. H2, t.j. H 2 Si 2 O 5 - bimeta silicijeva kislina.
Kisline, katerih molekule vsebujejo več kot eno molekulo SiO 2, pripadajo polisiliciju.
Najenostavnejša silikatna kislina je H 2 SiO 3, ki se pogosto imenuje preprosto silicij, njene soli pa so silikati. Od silikatov so v vodi topni samo natrijevi in kalijevi silikati, preostali silikati so neodporni, v vodi netopni snovi.
Raztopine silikatov se motijo, ko stojijo v zraku, saj CO 2, ki ga vsebuje, izloča silicijevo kislino iz njenih soli (H 2 SiO 3 je šibkejša od karbonske kisline; disociacijska konstanta H 2 SiO 3 v prvi fazi je enaka K 1 = 2,2. 10 -10 ).
H 2 SiO 3 je praktično netopen v vodi - ta lastnost se uporablja kot kvalitativna reakcija za odkrivanje silikatnih ionov:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3.
Silikati se pridobijo s taljenjem SiO 2 z alkalijami ali karbonati.
Koncentrirane raztopine natrijevega in kalijevega silikata se imenujejo tekoče steklo, imajo močno alkalno reakcijo, ker so zelo hidrolizirane:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3.
Tekoče steklo se uporablja, na primer, za izdelavo lepila, vodoodpornih tkanin.
Cement se zelo pogosto uporablja v gradbeništvu kot vezivo, ki se pri mešanju z vodo strdi. Običajno se cement proizvaja v velikih rotacijskih pečeh, kjer se pražijo in zmeljejo različni silikati (pri temperaturi -1000 ° C).
Obstaja več vrst cementa, vendar je pogojno mogoče razlikovati dve vrsti cementa po načelu "koagulacije" - navadnega cementa in portlandskega cementa. Proces "nastavitve" običajnega cementa, ki ga sestavlja kalcijev silikat, nastane zaradi nastanka kalcijevega karbonata zaradi ogljikovega dioksida v zraku:
Cao. SiO2 + CO2 + H 2 O = CaCO 3 + H 2 SiO 3.
Pri nastavljanju Portland cementa ogljikov dioksid ni vključen v proces, hidrolizo silikatov pa se pojavi z naknadnim nastajanjem netopnih kristaliničnih hidratov:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O.
· Karbidi in silicidi
· Ogljikove in silicijeve spojine s kovinami - karbidi in silicidi, poleg obravnavanih reakcij, dobimo tudi z interakcijo silicija s kovinskimi hidridi, na primer:
· 2CaH2 + Si = Ca2Si + 2H2.
· Vse te reakcije se odvijajo pri visokih temperaturah. Med karbidi oddajajo tako imenovane "metanide" in "acetilen". Prvi se štejejo za derivate metana, ki vsebujejo ogljik v oksidacijskem stanju -4 (Be 2 C, Al 4 C 3), drugi pa kot derivate acetilena s stopnjo oksidacije ogljika -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2). , CAC 2). Acetilidi srebra in bakra (I) se lahko enostavno pridobijo s prehodom acetilena skozi raztopino amoniaka srebrovega oksida ali bakrovega (I) klorida. Večina metanidov in acetilidov aktivno reagira z vodo (zlasti s kislinami), ki sprosti ustrezne ogljikovodike:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al4C3 + 12H2O = 4Al (OH) 3 + 3CH4,
· Ag2C2 + 2HCl = 2AgCl + C2H2.
· Za razliko od karbidov, samo silikidi alkalijskih ali zemeljskoalkalijskih kovin medsebojno delujejo z vodo in kislinami, kar proizvaja najpreprostejšo vodikove spojine silicijevega monosilana, ki se pogosto imenuje silan SiN 4
· Ca2Si + 4HCl = 2CaCl2 + SiH4.
· Silan je brezbarvni plin, ki ima vonj po plesni, spontano vnetljiv v zraku, goreče do SiO 2 in vode:
SiH4 + 2O2 = Si02 + 2H2O.
· Alkalije se silan zlahka razgradijo po enačbi:
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4 H 2,
· Voda tudi hidrolizira silan, vendar veliko počasneje:
· SiH4 + 2H2O = Si02 + 4H2.
· Pri segrevanju nad 400 ° C brez dostopa do zraka se silan razgradi v silicij in vodik (eden od načinov proizvodnje silicija):
· SiH4 = Si + 2H2.
Poleg monosilana so znani tudi disilan Si2H6, trisilan Si3H8, tetrasilan Si 4 H 10 itd. V posamičnem stanju smo spojine izolirali samo do vključene vrednosti Si6H14. Vse te spojine pripadajo homologni seriji silanov, ki jim ustreza splošna formula Si nH2n + 2. Kot alkani so silani brezbarvni, prvi člani homolognih serij so v normalnih pogojih plinasti, naslednje so tekočine. Kemijska aktivnost silanov in ogljikovodikov je drugačna: v nasprotju z dovolj inertnimi alkani, silan je vse reaktivno. To je posledica nižje afinitete silicija za vodik v primerjavi z ogljikom in zelo visoke afinitete silicija za kisik. Poleg tega so Si-Si vezi manj vzdržljive od vezi S-S. V nasprotju s C-H vezjo ima Si-H vez bolj ionski značaj.
· Energija vezav Si-E in CE.
· Nizka trdnost Si-Si vezi je posledica omejenosti homologne serije silanov.
• Med karbidi in silicidi je posebno mesto karborundni SiC, ki ga lahko imenujemo silicijev karbid in silicijev karbonat. Karborund ima visoko tališče zaradi svoje diamantne strukture; njegova trdota je blizu trdoti diamanta. Kemično je SiC zelo stabilen.
· Koncept koloidnih raztopin
V naravi in tehnologiji se pogosto pojavljajo razpršeni sistemi, v katerih je ena snov enakomerno porazdeljena kot delci znotraj druge snovi.
V razpršenih sistemih je razpršena faza - fino razdeljena snov in disperzijski medij - homogena snov, v kateri je razpršena faza. Disperzni sistemi vključujejo navadne (prave) raztopine, koloidne raztopine, pa tudi suspenzije in emulzije. Ti se med seboj razlikujejo predvsem v velikosti delcev, to je stopnja disperzije (drobljenje).
Sistemi z velikostjo delcev manj kot 1 nm so prave raztopine, ki jih sestavljajo molekule ali ioni. Treba jih je obravnavati kot enofazni sistem. Sistemi z velikostjo delcev nad 100 nm so grobo dispergirani sistemi - suspenzije in emulzije.
Suspenzije so disperzni sistemi, v katerih je dispergirana faza trdna in disperzijski medij je tekočina, trdna snov pa je v tekočini praktično netopna.
Emulzije so dispergirani sistemi, v katerih sta tako dispergirana faza kot disperzijski medij tekočine, ki se med seboj ne mešajo. Primer emulzije je mleko, v katerem majhne kroglice maščobe plavajo v tekočini.
Suspenzije in emulzije so dvofazni sistemi.
Koloidne raztopine so visoko dispergirani dvofazni sistemi, ki so sestavljeni iz disperzijskega medija in disperzne faze, linearne dimenzije slednjih pa so v območju od 1 do 100 nm. Kot lahko vidimo, so koloidne raztopine z velikostjo delcev vmes med resničnimi raztopinami in suspenzijami in emulzijami. Koloidni delci običajno vsebujejo veliko število molekul ali ionov.
Koloidne raztopine imenujemo tudi sol. Dobijo se z disperzijskimi in kondenzacijskimi metodami. Razprševanje se najpogosteje izvaja s posebnimi »koloidnimi mlini«. Pri metodi kondenzacije nastanejo koloidni delci z združevanjem atomov ali molekul v agregate. V času številnih kemijskih reakcij pride do kondenzacije in nastajanja visoko dispergiranih sistemov (padavine, hidroliza, oksidacijsko-redukcijske reakcije itd.).
1 nm - nanometer (1 nm = 10 - 9 m).
V nasprotju z resničnimi rešitvami so značilni Tyndallov učinek, t.j. sipanje svetlobe s koloidnimi delci. Ko se skozi svetlobni žarek pojavi svetlobni stožec, se pojavi v temnejši sobi. 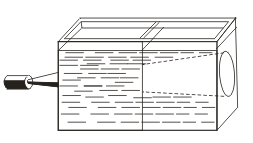 . Tako lahko ugotovite, ali je ta rešitev koloidna ali resnična.
. Tako lahko ugotovite, ali je ta rešitev koloidna ali resnična.
Ena od pomembnih lastnosti solov je, da imajo njihovi delci električni naboj istega znaka. Zaradi tega se ne združijo v večje delce in se ne oborijo. Hkrati imajo delci nekaterih solov, na primer kovine, sulfidi, silicijeve in kositrove kisline, negativen naboj, medtem ko imajo drugi, na primer hidroksidi, kovinski oksidi, pozitiven naboj. Pojav naboja je pojasnjen z adsorpcijo ionov iz raztopine s koloidnimi delci.
Za obarjanje solja je potrebno, da se njegovi delci združijo v večje agregate. Kombinacija delcev v večje agregate se imenuje koagulacija, njihova sedimentacija pod vplivom gravitacije pa se imenuje sedimentacija.
Običajno pride do koagulacije pri dodajanju solom: 1) elektrolit, 2) drug sol, katerega delci imajo nasprotni naboj, in 3) pri segrevanju.
