Žveplo. Vodikov sulfid in sulfidi
4.doc
240Žveplo. Vodikov sulfid, sulfidi, hidrosulfidi. Žveplovi oksidi (IV) in (VI). Žveplova in žveplova kislina ter njihove soli. Estri žveplove kisline. Natrijev tiosulfat
4.1. Žveplo
Žveplo je eden od redkih kemičnih elementov, ki so jih ljudje uporabljali že več tisočletij. V naravi je široko porazdeljen in najdemo tako v prostem stanju (nativno žveplo) kot v spojinah. Minerale, ki vsebujejo žveplo, lahko razdelimo v dve skupini - sulfide (pirit, glitters, lutke) in sulfate. Izvorna žveplo se v velikih količinah nahaja v Italiji (otok Sicilija) in v ZDA. V CIS, so nahajališča domače žvepla najdena v regiji Volga, v državah Srednje Azije, na Krimu in drugih območjih.
Minerali prve skupine vključujejo svinčev sijaj PbS, bakren sijaj Cu 2 S, srebrni sijaj - Ag 2 S, cinkovo blendo - ZnS, kadmijev snag - CdS, pirit ali železov pirit - FeS 2, kalkoprit - CuFeS 2, cinabar - HgS.
Minerali druge skupine vključujejo sadro CaSO 4 2H 2 O, mirabilit (Glauberjeva sol) - Na2S0410H2O in kizerit - MgS04H20.
Žveplo najdemo v živalih in rastlinah kot del beljakovinskih molekul. Organske žveplove spojine najdemo v nafti.
Pridobivanje
1. Če je žveplo pridobljeno iz naravnih spojin, na primer iz piratskega žvepla, se segreje na visoke temperature. Žveplov pirit se razgradi, da nastane železov (II) sulfid in žveplo:
2. Žveplo se lahko dobi z oksidacijo vodikovega sulfida zaradi pomanjkanja kisika v reakciji: \\ t
2H2SO2 = 2S2H20
3. Danes je pridobivanje žvepla z zmanjšanjem ogljikovega dioksida žveplovega dioksida SO 2 običajen stranski proizvod pri taljenju kovin iz žveplovih rud: \\ t
SO2C = C02S
4. Odpadni plini v metalurških in koksnih pečeh vsebujejo mešanico žveplovega dioksida in vodikovega sulfida. Ta mešanica se prenese pri visoki temperaturi preko katalizatorja:
H2SO2 = 2H2O3S
^ Fizične lastnosti
Žveplo je trda, lomljivo rumena barva. V vodi je praktično netopen, dobro topen v CS 2 anilinu v ogljikovem disulfidu in nekaterih drugih topilih.
Slabo prevaja toploto in električni tok. Žveplo tvori več alotropnih sprememb:
1 . ^ Rombično žveplo (najbolj stabilni), kristali imajo obliko oktaeder.
Pri segrevanju žvepla se spremeni njegova barva in viskoznost: najprej se oblikuje svetlo rumena barva, nato pa se z naraščanjem temperature zamegli in postane tako viskozna, da ne izteka iz cevi, pri nadaljnjem segrevanju se viskoznost spet zniža in pri 444, 6 ° S segreje še .
2. ^ Monoklinska žveplo - modifikacija v obliki temno rumenih iglic, dobljenih z počasnim hlajenjem staljenega žvepla.
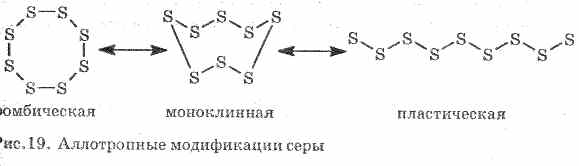
3. Plastično žveplonastali, če se žveplo, segreto do vrelišča, vlije v hladno vodo. Enostavno se raztegne kot guma (glej sliko 19).
Naravno žveplo sestavlja mešanica štirih stabilnih izotopov: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Kemijske lastnosti
Atom žvepla, ki ima nepopolno zunanjo energetsko raven, lahko poveže dva elektrona in pokaže stopnjo
Oksidacija -2. Žveplo ima takšno oksidacijsko stanje v spojinah s kovinami in vodikom (Na2S, H2S). Pri odboju ali osiromašenju elektronov na atom bolj elektronegativnega elementa je lahko stopnja oksidacije žvepla 2, 4, 6.
Žveplo je v hladnem razmeroma inertno, vendar se z naraščajočo temperaturo povečuje njegova reaktivnost. 1. Pri kovinah ima žveplo oksidacijske lastnosti. Ko te reakcije tvorijo sulfide (zlato, platina in iridij ne reagirajo): Fe S = FeS
2. V normalnih pogojih žveplo ne reagira z vodikom in pri 150–200 ° C pride do reverzibilne reakcije:
3. V reakcijah s kovinami in z vodikom se kot tipično oksidacijsko sredstvo obnaša žveplo, ki ima v prisotnosti močnih oksidantov zmanjšane lastnosti.
S 3F 2 = SF 6 (ne reagira z jodom)
4. Izgorevanje žvepla v kisiku poteka pri 280 ° C in v zraku pri 360 ° C. To je mešanica SO 2 in SO 3:
S02 = S02S3O2 = 2SO3
5. Pri segrevanju brez zraka žveplo neposredno združuje fosfor, ogljik, ki kaže oksidativne lastnosti:
2P 3S = P 2 S 3 2S C = CS 2
6. Pri medsebojnem delovanju s kompleksnimi snovmi se žveplo ponaša predvsem kot reducent:
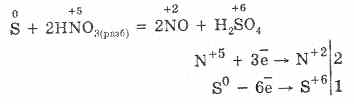
7. Žveplo je sposobna reakcij nesorazmernosti. Torej, pri vretju žvepla v prahu z alkalijami, se tvorijo sulfiti in sulfidi:
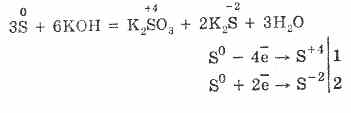
Uporaba
Žveplo se pogosto uporablja v industriji in kmetijstvu. Približno polovica proizvodnje se porabi za proizvodnjo žveplove kisline. Žveplo se uporablja za vulkanizacijo gume: v tem primeru se guma pretvori v gumo.
V obliki žvepla (droben prah) se žveplo uporablja za boj proti boleznim vinogradov in bombaža. Uporablja se za pripravo smodnika, žogic, svetlečih sestavkov. V medicini, pripravljena žveplo mazilo za zdravljenje kožnih bolezni.
4.2. Vodikov sulfid, sulfidi, hidrosulfidi
Vodikov sulfid je analog vode. Njegova elektronska formula
Pokazalo se je, da sta v nastanku H-S-H vezav vključena dva p-elektrona zunanjega nivoja atoma žvepla. H 2 S molekula ima kotno obliko, zato je polarna.
^ Biti v naravi
Vodikov sulfid najdemo v naravi v vulkanskih plinih in v vodah nekaterih mineralnih virov, kot sta Pyatigorsk, Matsesta. Nastane z razpadom organskih snovi, ki vsebujejo žveplo, iz različnih živalskih in rastlinskih ostankov. To pojasnjuje značilen neprijeten vonj odplak, greznic in odlagališč.
Pridobivanje
1. Vodikov sulfid se lahko dobi z neposrednim povezovanjem žvepla z vodikom s segrevanjem: \\ t
2. Ponavadi pa se pridobiva z delovanjem razredčene klorovodikove ali žveplove kisline na železov (III) sulfid:
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Ta reakcija se pogosto izvaja v Kipp aparatu.
^ Fizične lastnosti
V normalnih pogojih je vodikov sulfid brezbarven plin z močnim značilnim vonjem gnilih jajc. Zelo strupena se inhalacija veže na hemoglobin, kar povzroča paralizo, ki je nezdrava.
Ko vodi v smrt. V nizkih koncentracijah je manj nevarno. Z njim je potrebno delati v izpušnih omarah ali s hermetično zaprtimi napravami. Dovoljena vsebnost H 2 S v proizvodnih prostorih je 0,01 mg na 1 liter zraka.
Vodikov sulfid je relativno dobro topen v vodi (pri 20 ° C se 2,5 volumskega deleža vodikovega sulfida raztopi v 1 volumskem delu vode).
Raztopina vodikovega sulfida v vodi se imenuje vodikov sulfidna voda ali vodikov sulfidna kislina (zazna lastnosti šibke kisline).
^ Kemijske lastnosti
1, Ko je močno segret, se vodikov sulfid skoraj popolnoma razgradi, da nastane žveplo in vodik.
2. Plinski vodikov sulfid opekline v zraku z modrim plamenom z nastajanjem žveplovega oksida (IV) in vode: \\ t
2H2S302 = 2S02H2O
Pri pomanjkanju kisika nastajajo žveplo in voda: 2H 2 S 2 = 2S 2H 2 O
3. Vodikov sulfid je dokaj močno redukcijsko sredstvo. To pomembno kemijsko lastnost lahko razložimo na naslednji način. V raztopini H 2 S je relativno enostavno darovati elektrone molekulam kisika v zraku:
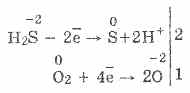
Hkrati kisik v zraku oksidira vodikov sulfid do žvepla, zaradi česar je vodni sulfid vodni mutni:
2H2S02 = 2S2H2O
To pojasnjuje dejstvo, da se vodikov sulfid v naravi ne kopiči v zelo velikih količinah, ko razpade organska snov - kisik iz zraka ga oksidira v prosti žveplo.
4, vodikov sulfid odločno reagira s halogenskimi raztopinami, na primer:
Žveplo se sprošča in raztopina joda postane razbarvana.
5. Različni oksidanti močno reagirajo z vodikovim sulfidom: pod delovanjem dušikove kisline nastane prosti žveplo.
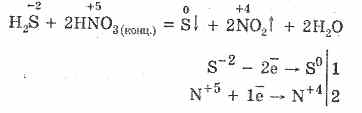
6. Raztopina vodikovega sulfida je kisla zaradi disociacije: \\ t
H 2 SHH - HS - H S - 2
Prva stopnja običajno prevlada. Je zelo šibka kislina: šibkejša od premogove kisline, ki običajno izpodriva H 2 S iz sulfidov.
Sulfidi in hidrosulfidi
Fluorovodikova kislina, kot dvobazna, tvori dve vrsti soli:
Srednji - sulfidi (Na 2 S);
Kislo - hidrosulfidi (NaHS). \\ T
Te soli lahko dobimo: z medsebojnim delovanjem hidroksidov s hidrogen sulfidom: 2NaOHH2S = Na2S2H2O
Neposredna interakcija žvepla s kovinami: \\ t
Reakcija izmenjave soli s H2S ali med solmi: \\ t
Pb (NO3) 2Na2S = PbSi2NaNO3
CuSO4H2S = CuS2H2S04Cu2H2S = CuS2H
Hidrosulfidi so skoraj vsi topni v vodi.
Sulfidi alkalijskih in zemeljsko alkalijskih kovin so lahko tudi topni v vodi, brezbarvni.
Sulfidi težkih kovin so praktično netopni ali slabo topni v vodi (FeS, MnS, ZnS); Nekateri od njih se ne raztopijo v razredčenih kislinah (CuS, PbS, HgS).
Kot soli šibke kisline so sulfidi v vodnih raztopinah zelo hidrolizirani. Na primer, sulfidi alkalijskih kovin, če so raztopljeni v vodi, imajo alkalno reakcijo:
Na 2 S NONNaHS NaOH
Vsi sulfidi, kot sam vodikov sulfid, so močni reducenti:
3PbS -2 8HN5O3 (par.) = 3PbS6O4 4H2O8N2O
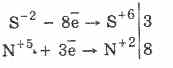
Nekateri sulfidi imajo značilno barvo: CuS in PbS - črna, CdS - rumena, ZnS - bela, MnS - roza, SnS - rjava, Al 2 S 3 - oranžna. Kvalitativna analiza kationov temelji na različnih topnostih sulfidov in različnih barvah številnih od njih.
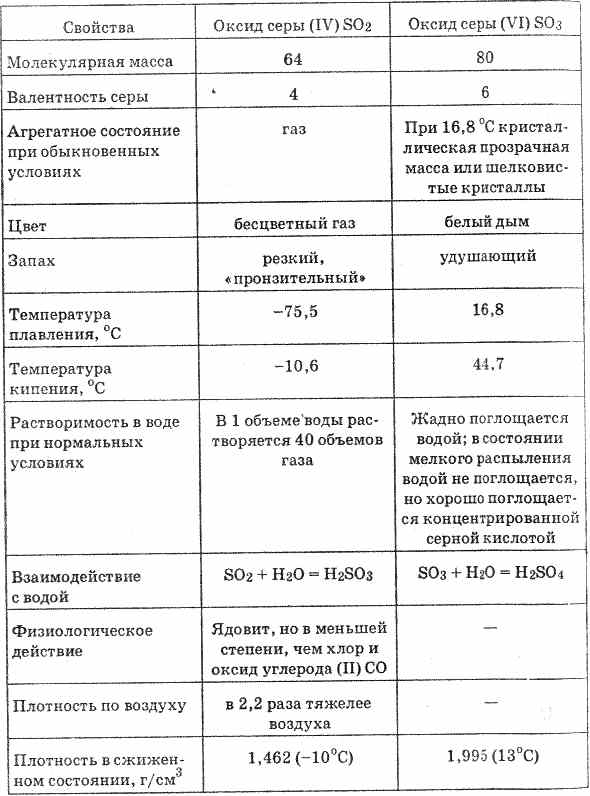
^ 4.3. Žveplov oksid (IV) in žveplova kislina
Žveplov oksid (IV) ali žveplov dioksid je v normalnih pogojih brezbarven plin z ostrim zadušljivim vonjem. Ko se ohladi na -10 ° C, se utekočinja v brezbarvno tekočino.
Pridobivanje
1. V laboratorijskih pogojih se žveplov oksid (IV) pridobiva iz soli žveplove kisline z delovanjem močnih kislin na njih: \\ t
Na2S03H2S04 = Na2S04S02-2H2O2NaHSO3H2S04 = Na2S04 2SO2 - 2H2O2HSO - 3 2H = 2 SO 2 2H 2 O
2. Tudi žveplov dioksid nastane z medsebojnim delovanjem koncentrirane žveplove kisline pri segrevanju z nizkoaktivnimi kovinami: \\ t
Cu2H2S04 = CuS04S02-2H2O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 H 2H 2 O
3. Žveplov oksid (IV) nastane tudi, ko žveplo zgori v zraku ali kisiku: \\ t
4. V industrijskih pogojih se SO 2 pridobiva s praženjem pirita s FeS 2 ali žveplastimi rudami barvnih kovin (cinkova zmes ZnS, svinčev sijaj PbS itd.): \\ T
4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Strukturna formula molekule SO 2:
Štiri atomi žvepla in štirje elektroni iz dveh atomov kisika sodelujejo pri tvorbi vezi v molekuli SO2. Medsebojno odbijanje parov veznih elektronov in samotnega elektronskega para žvepla daje molekuli kotno obliko.
Kemijske lastnosti
1. Žveplovi oksidi (IV) imajo vse lastnosti kislih oksidov: \\ t
Interakcija z vodo
Medsebojno delovanje z alkalijami
Medsebojno delovanje z osnovnimi oksidi.
2. Za žveplov oksid (IV) so značilne redukcijske lastnosti: \\ t
S 4 O 2 O 0 2 S 2S 6 O -2 3 (v prisotnosti katalizatorja, kadar je segret)
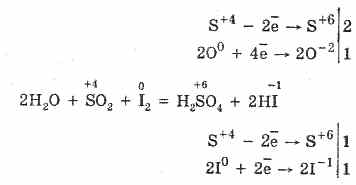
Toda v prisotnosti močnih reducentov se SO2 obnaša kot oksidant:
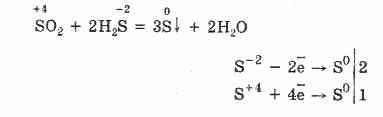
Redoks dvojnost žveplovega (IV) oksida je razložena z dejstvom, da ima žveplo v njem oksidacijsko stanje 4, zato se lahko, tako da preda 2 elektrona, oksidira v S 6, in se lahko s 4 elektroni zmanjša na S °. Izražanje teh ali drugih lastnosti je odvisno od narave reaktivne komponente.
Žveplov oksid (IV) je zelo topen v vodi (40 volumnov SO2 se raztopi v 1 volumnu pri 20 ° C). V tem primeru nastane žveplova kislina, ki obstaja samo v vodni raztopini:
SO2H2OhH2S03
Reakcija je reverzibilna. V vodni raztopini so žveplov oksid (IV) in žveplova kislina v kemičnem ravnotežju, ki se lahko prestavita. Z vezavo H 2 SO 3 (nevtralizacija kisline
Vi) reakcija poteka v smeri tvorbe žveplove kisline; ko odstranimo S02 (pihanje skozi raztopino dušika ali segrevanje), reakcija poteka proti izhodnim materialom. Raztopina žveplove kisline vedno vsebuje žveplov oksid (IV), ki mu daje oster vonj.
Žveplova kislina ima vse lastnosti kislin. V raztopini se loči v korakih:
H2S03HHSO-3HSO-3HH2_2-3
Termično nestabilna, hlapna. Žveplova kislina, kot dvobazna, tvori dve vrsti soli:
Srednji sulfiti (Na 2 SO 3);
Kislo-hidrosulfit (NaHSO 3).
Sulfiti nastanejo, ko je alkalija popolnoma nevtralizirana s kislino:
H2S03 2NaOH = Na2S03 2H20
Hidrosulfiti so pridobljeni s pomanjkanjem alkalij:
H2S03 NaOH = NaHS03H20
Žveplova kislina in njene soli imajo tako oksidativne kot reduktivne lastnosti, ki jih določa narava reakcijskega partnerja.
1. Torej, pod delovanjem kisika sulfites se oksidira v sulfate:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
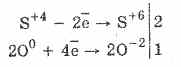
Oksidacija žveplove kisline z bromom in kalijevim permanganatom poteka še lažje:
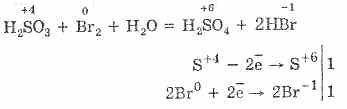
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
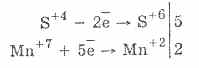
2. V prisotnosti močnejših reducentov imajo sulfiti oksidativne lastnosti:
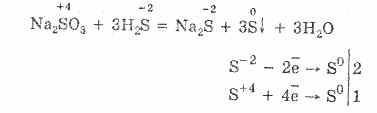
Skoraj vsi hidrosulfiti in sulfati alkalijskih kovin se raztopijo iz soli žveplove kisline.
3. Ker je H 2 SO 3 šibka kislina, delovanje kislin na sulfite in hidrosulfite povzroči sproščanje SO2. Ta metoda se običajno uporablja pri pridobivanju SO2 v laboratorijskih pogojih:
NaHS03H2S04 = Na2S04S02\u003e H20
4. V vodi topni sulfiti se zlahka hidrolizira, zaradi česar se v raztopini poveča koncentracija OH - ionov:
Na2S03 NON-NaHS03 NaOH
Uporaba
Žveplovi oksidi (IV) in žveplova kislina obarvajo veliko barv, s tem pa tvorijo z njimi brezbarvne spojine. Slednji se lahko spet razkrajajo, ko se segrejejo ali na svetlobi, zaradi česar se barva ponovno vzpostavi. Zato je belilni učinek SO 2 in H 2 SO 3 drugačen od učinka kloriranja. Običajno žveplo (IV) razbarva volno, svilo in slamo.
Žveplov oksid (IV) ubije veliko mikroorganizmov. Zato, da bi uničili plesni, jih zaplinjajo surove kleti, kleti, vinski sodi itd. Uporabljajo se tudi pri prevozu in skladiščenju sadja in jagodičja. V velikih količinah se za proizvodnjo žveplove kisline uporablja žveplov oksid IV.
Pomembna aplikacija je raztopina kalcijevega hidrosulfita CaHSO 3 (sulfitna tekočina), ki se uporablja za obdelavo lesa in papirne mase.
^ 4.4. Žveplovi oksidi (VI). Žveplova kislina
Žveplov oksid (VI) (glej tabelo 20) je brezbarvna tekočina, ki se strdi pri temperaturi 16,8 ° C do trdne kristalne mase. Zelo močno absorbira vlago in tvori žveplovo kislino: SO 3 H 2 O = H 2 SO 4
Tabela 20. Lastnosti žveplovih oksidov
Raztapljanje žveplovih oksidov (VI) v vodi spremlja sproščanje znatne količine toplote.
Žveplov oksid (VI) je zelo topen v koncentrirani žveplovi kislini. Raztopino SO3 v brezvodni kislini imenujemo oleum. Oleumi lahko vsebujejo do 70% SO3.
Pridobivanje
1. Žveplovi oksidi (VI) se pridobijo z oksidacijo žveplovega dioksida s kisikom v prisotnosti katalizatorjev pri temperaturi 450 ° C (glej \\ t Proizvodnja žveplove kisline): \\ t
2SO2O2 = 2S03
2. Drug način za oksidacijo SO 2 v SO 3 je uporaba dušikovega (IV) oksida kot oksidacijskega sredstva: \\ t
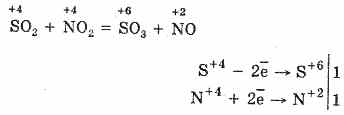
Nastali dušikov oksid (II) se pri medsebojnem delovanju z atmosferskim kisikom enostavno in hitro spremeni v dušikov oksid (IV): 2NO O 2 = 2NO 2
Ki se lahko ponovno uporabi pri oksidaciji SO2. Zato NO2 deluje kot nosilec kisika. Ta postopek oksidacije SO2 v SO3 se imenuje dušik. Molekula SO 3 ima obliko trikotnika, v središču katerega je
Atom žvepla se nahaja:
Takšna struktura je posledica medsebojnega odrivanja veznih elektronskih parov. Atom žvepla je zagotovil šest zunanjih elektronov za njihovo tvorbo.
Kemijske lastnosti
1. SO3 je tipičen kislinski oksid.
2. Žveplovi oksidi (VI) imajo lastnosti močnega oksidacijskega sredstva.
Uporaba
Žveplov oksid (VI) se uporablja za proizvodnjo žveplove kisline. Najpomembnejši je kontaktni način pridobivanja
Žveplova kislina. S to metodo lahko dobimo katerokoli koncentracijo H2S04 in oleum. Postopek je sestavljen iz treh stopenj: pridobitev SO2; oksidacija SO2 v SO3; pridobivanje H2S04.
SO 2 dobimo s sežigom piritne FeS 2 v posebnih pečeh: 4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Da bi pospešili praženje, je pirit predzemeljski in za popolnejše izgorevanje žvepla se vbrizga bistveno več zraka (kisika), kot ga zahteva reakcija. Plin, ki zapušča peč, je sestavljen iz žveplovega (IV) oksida, kisika, dušika, arzenovih spojin (iz nečistoč v piritih) in vodne pare. To se imenuje plin za praženje.
Plin za praženje se temeljito očisti, saj celo majhna vsebnost arzenovih spojin, kot tudi prah in vlaga, zastrupijo katalizator. Plin se očisti iz arzenovih spojin in prahu, prehaja skozi posebne elektrostatične filtre in pralni stolp; vlago absorbira koncentrirana žveplova kislina v sušilnem stolpu. Očiščeni plin, ki vsebuje kisik, se segreje v prenosniku toplote do 450 ° C in vstopi v kontaktni aparat. V notranjosti kontaktne naprave so rešetkaste police, napolnjene s katalizatorjem.
Pred tem smo kot katalizator uporabili fino zdrobljeno kovinsko platino. Nato je bil nadomeščen z vanadijevim spojinam - vanadijevim oksidom (V) V 2 O 5 ali vanadil sulfatom VOSO 4, ki je cenejši od platine in bolj počasi zastrupljen.
Reakcija oksidacije SO 2 v SO 3 je reverzibilna: \\ t
2SO202 2SO 3
Povečanje vsebnosti kisika v kalcinacijskem plinu poveča izkoristek žveplovega oksida (VI): pri temperaturi 450 ° C navadno doseže 95% ali več.
Nastali žveplov oksid (VI) se nato z metodo proti toku prenese na absorpcijski stolp, kjer ga absorbira koncentrirana žveplova kislina. Po zasičenju se prvič tvorijo brezvodna žveplova kislina, nato pa oleum. V prihodnosti se oleum razredči na 98% žveplovo kislino in dostavi potrošnikom.
Strukturna formula žveplove kisline:
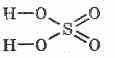
^ Fizične lastnosti
Žveplova kislina je težka, brezbarvna oljnata tekočina, ki kristalizira pri 10,4 ° C, skoraj dvakrat ( = 1,83 g / cm 3) je težji od vode, brez vonja, nehlapen. Izjemno higroskopičen. Vlaga se absorbira z izpuščanjem velikih količin toplote, tako da koncentrirane žveplove kisline ne morete preliti z vodo - pride do razprševanja kisline. Za
Žveplovi kislini je treba dodati majhne količine vode.
Brezvodna žveplova kislina raztopi do 70% žveplovega oksida (VI). Ko se segreje, odstrani SO3, dokler ne nastane raztopina z masnim deležem H 2 SO 4 98,3%. Brezvodni H 2 SO 4 skoraj ne izvaja električnega toka.
^ Kemijske lastnosti
1. Zmeša se z vodo v vseh razmerjih in tvori hidrate različne sestave:
H2S04H20, H2S04 2H2O, H2S04 3H20, H2S04 4H2O, H2S04, 6.5H2O
2. Koncentrirana žveplova kislina karbonizira organsko snov - sladkor, papir, les, vlakna, ki jim odvzame elemente vode:
C12H22O11H2S04 = 12CH2S0411H20
Nastali premog delno sodeluje s kislino:
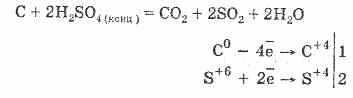
Dehidracija plina temelji na absorpciji vode z žveplovo kislino.
Kot močna nehlapna kislina H 2 SO 4 zamenja druge kisline iz suhih soli:
NaN03H2S04 = NaHS04HNO3
Če pa se raztopini soli doda H2S04, ne pride do izločanja kisline.
H 2 SO 4 - močna dvobazna kislina: H 2 SO 4 HH HSO - 4 HSO - 4 SOH SO 2-4
Ima vse lastnosti nehlapnih močnih kislin.
Za razredčeno žveplovo kislino so značilne vse lastnosti neoksidirajočih kislin. Namreč: interakcija s kovinami, ki so v elektrokemični seriji napetosti kovin do vodika:
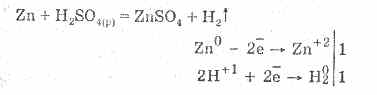
Interakcija s kovinami je posledica redukcije vodikovih ionov.
6. Koncentrirana žveplova kislina je energetsko oksidacijsko sredstvo. Ko se segreje, oksidira večino kovin, vključno s tistimi v elektrokemični seriji napetosti po vodiku, ne reagira samo s platino in zlatom. Odvisno od aktivnosti kovine so lahko redukcijski produkti S-2, S ° in S4.
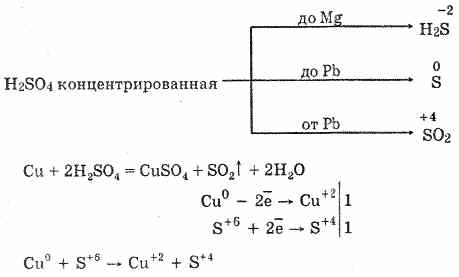
V hladni koncentrirani žveplovi kislini ni interakcije s tako močnimi kovinami, kot so aluminij, železo in krom. To je posledica pasivacije kovin. Ta značilnost se pogosto uporablja, ko se prevaža v železnem vsebniku.
Vendar, če se segreje:
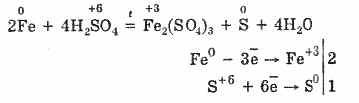
Tako koncentrirana žveplova kislina medsebojno deluje s kovinami zaradi zmanjšanja atomov, ki tvorijo kislino.
Kvalitativna reakcija na sulfatni ion SO 2-4 je nastanek bele kristalinične oborine BaSO 4, netopne v vodi in kislinah:
SO 2- 4 Ba 2 SO BaSO 4
Uporaba
Žveplova kislina je najpomembnejši proizvod glavne kemične industrije, ki se ukvarja s proizvodnjo ne-
Organske kisline, baze, soli, mineralna gnojila in klor.
Za različne aplikacije je žveplova kislina na prvem mestu med kislinami. Največja količina se porabi za pridobivanje fosfatnih in dušikovih gnojil. Žveplova kislina, ki ni hlapna, se uporablja za proizvodnjo drugih kislin - klorovodikove, fluorovodikove, fosforne in ocetne.
Veliko se nanaša na čiščenje naftnih derivatov - bencina, kerozina, mazalnih olj - od škodljivih nečistoč. V strojništvu žveplova kislina očisti kovinsko površino pred oksidacijo pred nanosom (nikljevanje, kromiranje itd.). Žveplova kislina se uporablja pri proizvodnji eksplozivov, umetnih vlaken, barvil, plastike in mnogih drugih. Uporablja se za polnjenje baterij.
Soli žveplove kisline so pomembne.
^ Natrijev sulfatNa2S04 kristalizira iz vodnih raztopin v obliki hidrata Na2S0410H2O, ki se imenuje Glauberjeva sol. Uporablja se v medicini kot odvajalo. Brezvodni natrijev sulfat se uporablja pri proizvodnji sode in stekla.
^ Amonijev sulfat(NH 4) 2 SO 4 - dušikovo gnojilo.
Kalijev sulfatK 2 SO 4 - kalijevo gnojilo.
Kalcijev sulfat CaSO 4 se nahaja v naravi v obliki gipsovega minerala CaSO 4 2H 2 O. Ko se segreje na 150 ° C, izgubi nekaj vode in gre v hidrat 2CaSO 4 H 2 O, imenovan žgani gips ali alabaster. Ko se zmeša z vodo v pastozno maso, se alabaster po določenem času ponovno strdi, spremeni v CaSO 4 2H 2 O. Gips se pogosto uporablja v gradbeništvu (omet).
^ Magnezijev sulfatMgSO 4 najdemo v morski vodi, kar povzroča njen grenak okus. Kristalinični hidrat, imenovan grenka sol, se uporablja kot odvajalo.
Vitriol- tehnično ime kristaliničnih hidratov kovinskih sulfatov Fe, Cu, Zn, Ni, Co (dehidrirane soli niso vitri). Bakrov sulfatCuSO 4 5H 2 O je modra strupena snov. Rastline se poškropijo z razredčeno raztopino in sejanje seje pred setvijo. Železni vitriolFeSO 4 7H 2 O je svetlo zelena snov. Uporablja se za nadzor škodljivcev rastlin, črnil, mineralnih barv itd. Cink sulfatZnSO 4 7H 2 O se uporablja pri proizvodnji mineralnih črnil, v sittoprechatanii, medicini.
^ 4.5. Estri žveplove kisline. Natrijev tiosulfat
Estri žveplove kisline so dialkil sulfati (RO2) S02. To so tekočine z visokim vreliščem; manj topen v vodi; v prisotnosti alkalij nastanejo alkohol in soli žveplove kisline. Nižji dialkil sulfati so alkilirna sredstva.
Dietil sulfat(C2H5) 2S04. Tališče -26 ° C, vrelišče 210 ° C, topno v alkoholih, netopno v vodi. Dobimo z reakcijo žveplove kisline z etanolom. Je etilacijsko sredstvo v organski sintezi. Prodira v kožo.
Dimetil sulfat(CH3) 2S04. Tališče -26,8 ° C, vrelišče 188,5 ° C. Topen v alkoholih, slabo - v vodi. Reagira z amoniakom v odsotnosti topila (pri eksploziji); Žveplo so nekatere aromatske spojine, kot so fenolni estri. Dobimo ga z interakcijo 60% oleuma z metanolom pri 150 ° C. To je metilacijsko sredstvo v organski sintezi. Rakotvorno, vpliva na oči, kožo, dihala.
^ Natrijev tiosulfat Na2S2O3
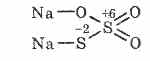
Sol tiosulfurne kisline, v kateri imata dva žveplova atoma različna oksidacijska stanja: 6 in -2. Kristalinična snov, dobro topna v vodi. Na voljo v obliki kristalnega Na 2 S 2 O 3 5H 2 O, običajno imenovanega hiposulfit. Dobimo z medsebojnim delovanjem natrijevega sulfita in žvepla med vrenjem:
Na2S03S = Na2S2O3
Kot tiosulfurna kislina je močno redukcijsko sredstvo, ki ga zlahka oksidira klor v žveplovo kislino:
Na2S2O3 4Cl2 5H2O = 2H2S04 2NaCl 6HCl
Na tej reakciji je temeljila uporaba natrijevega tiosulfata za absorpcijo klora (v prvih plinskih maskah).
Pri rahlo različni oksidaciji pride do oslabitve oksidacijskih sredstev s tiosulfatom natrija. To tvori soli tetrationske kisline, na primer:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2 Na
Natrijev tiosulfat je stranski proizvod pri proizvodnji NaHSO 3, žveplovih barvil, pri čiščenju industrijskih plinov iz žvepla. Uporablja se za odstranjevanje sledov klora po belilnih tkaninah, za pridobivanje srebra iz rud; je fiksativ v fotografiji, reagent v jodometriji, antidot za zastrupitev z arzenovimi spojinami, živim srebrom, protivnetnim sredstvom.
Kemični element žvepla se nahaja v skupini VIA, obdobje 3 PSCE. Na zunanji elektronski plasti atomov žvepla je 6 elektronov. Prikazovanje lastnosti oksidacijskega sredstva pri tvorbi snovi s kovinami in vodikom, žveplo pridobi oksidacijsko stanje -2 (traja 2 elektrona).
V sestavi spojin, ki vsebujejo kisik, ima žveplo oksidacijska stanja +4 in +6. Tako je za žveplo značilna oksidacijska stanja -2; 0; +4; +6.
V naravi se žveplo nahaja v svojem naravnem stanju in v sestavi mineralov. Na primer, žveplo vsebuje sijaj svinca (glavna komponenta je svinčev sulfid PbS) in bakrov sijaj (glavna komponenta je bakrov sulfid Cu 2 S).
Žveplo tvori nekaj preprostih snovi - alotropne spremembe. Rombično žveplo je najbolj stabilno pri sobni temperaturi (slika 1). Ta snov je sestavljena iz molekul S8. Rombično žveplo je rumeno in se tali pri temperaturi + 112,8 ° C.
Sl. 1. Rombična modifikacija žvepla
Pri segrevanju se rombično žveplo postopoma spremeni v viskozno temno rjavo maso. To je še ena alotropna modifikacija žveplovega - plastičnega žvepla. Plastično žveplo sestavljajo linearne molekule žvepla S n.
Žveplo v kemijskih reakcijah s kovinami in vodikom igra vlogo oksidacijskega sredstva. Stopnja oksidacije se zmanjša od 0 do -2. V reakciji s kisikom deluje žveplo kot redukcijsko sredstvo, ki poveča stopnjo njegove oksidacije od 0 do +4.
Preberite primere interakcij, ki vključujejo žveplo.
Ko žveplo medsebojno deluje z vodikom, nastane vodikov sulfid:
Ko cink medsebojno deluje z žveplom, nastane cinkov sulfid:
Žveplo pogori v kisiku z nastankom žveplovega oksida (IV) (sl. 2):

Sl. 2. Sežiganje žvepla v kisiku
Upoštevajte lastnosti žveplovih spojin z oksidacijskim stanjem "-2". Takšne spojine vključujejo vodikov sulfid in sulfide - soli vodikovega sulfidne kisline.
Vodikov sulfid je plin z vonjem gnilih jajc. Gori v zraku. Poleg tega se pri pomanjkanju in presežku kisika zgorevanje odvija drugače.
V presežku kisika se vodikov sulfid sežge v obliki žveplovega oksida (IV) in vode:
2H2S + 3O2 = 2SO2 + 2H20.
Pri pomanjkanju kisika pride do nepopolnega izgorevanja vodikovega sulfida s sproščanjem žvepla: 2H2S + O2 = 2S + 2H2O.
Vodikov sulfid je zelo topen v vodi. Nastala raztopina je šibka hidrogen sulfidna kislina. Soli vodikovega sulfida se imenujejo sulfidi. Fluorovodikova kislina in vodotopni sulfidi vstopajo v izmenične reakcije.
Interakcija vodikovega sulfidne kisline in bakrovega (II) klorida tvorita netopen bakrov (II) sulfid in klorovodikovo kislino: H 2 S + CuCl 2 = CuS + 2HCl.
Pri medsebojnem delovanju kalijevega sulfida s cinkovim nitratom nastane precipitacija cinkovega sulfida in nastane kalijev nitrat: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Reference
- Orzhekovsky P.A. Zbirka nalog in vaj iz kemije: 9. razred: v učbenik P.A. Orzhekovsky in drugi. “Kemija. Razred 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel - M.: AST: Astrel, 2007. (str. 91-97)
- Orzhekovsky P.A. Kemija: 9. razred: študije. za splošno podobo. institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak - M.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Kemija: 9. razred: študije za splošno. institucije / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Kemija: neorgan. kemija Organ Kemija: študije. za 9 cl. / G.E. Rudzitis, F.G. Feldman. - M.: Izobraževanje, OJSC iz Moskovskih učbenikov, 2009.
- Khomchenko I.D. Zbirka nalog in vaj iz kemije za srednjo šolo. - M: RIA "New Wave": Založnik Umerenkov, 2008.
- Enciklopedija za otroke. Zvezek 17. Kemija / poglavje. ed. V.A. Volodin, Ved. znanstveno ed. I. Leenson. - M: Avanta +, 2003.
- Enotna zbirka digitalnih izobraževalnih virov (video izkušnje o tej temi) ().
- Elektronska različica revije "Kemija in življenje" ().
Domača naloga
- c. 136 št. 3; str.140 №№ 2-4 iz učbenika P.A. Orzhekovsky "Kemija: 9. razred" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M.: Astrel, 2013.
Sulfidi (od lat. žvepla, žvepla, žvepla)
žveplove spojine z več elektropozitivnimi elementi; lahko štejemo za soli vodikovega sulfidne kisline (glej Vodikov sulfidna kislina) H 2 S. Obstajata dve seriji C: povprečna (normalna) splošne formule M 2 S in kislina (hidrosulfidi) s splošno formulo MHS, kjer je M monovalentna kovina. C. alkalijske kovine so brezbarvne, topne v vodi. Njihove vodne raztopine so zelo hidrolizirane in alkalne. Pod delovanjem razredčenih kislin oddajajo H 2 S. C. zemeljskoalkalijske kovine so brezbarvne, rahlo topne v vodi. H 2 S se oddaja v vlažnem zraku, druge lastnosti so podobne S. alkalnim kovinam. Oba in druga S. se zlahka oksidirajo v sulfate. C. Težke kovine so praktično netopne v vodi. Skoraj vse so črne ali črno rjave barve (z izjemo belega ZnS, rožnatega MnS, rumenega CdS, oranžno-rdečega Sb 2 S 3, rumenega SnS 2). Neenakomerno razmerje med C. in kislinami in C. amonijem se uporablja v kemijski analizi. I.K. Malina.
Velika sovjetska enciklopedija. - M: Sovjetska enciklopedija. 1969-1978 .
Oglejte si, kaj so "Sulfidi" v drugih slovarjih:
Žveplove spojine s kovinami in nekaterimi nekovinami. Kovinski sulfidi so soli vodikovega sulfidne kisline H2S: srednja (npr. Na2S) in kisla ali hidrosulfidi (NaHS). S sežiganjem naravnih sulfidov pridobimo barvne kovine in SO2. Fosforjevi sulfidi in ... Veliki enciklopedični slovar
Moderna enciklopedija
Sulfidi - SULFIDI, anorganski sulfidi žveplovih spojin s kovinami in nekaterimi nekovinami. Vključene v sulfidne rude; kot fosforje (npr. CdS, ZnS). Molibdenov sulfid, titanov trdna maziva. Fosforjevi sulfidi ... ... Ilustrirani enciklopedični slovar
- (nov lat., iz lat. žvepla žveplo). Spojine nekega telesa z žveplom, ki ustrezajo oksidom ali kislinam. Slovar tujih besed, vključenih v ruski jezik. Chudinov, AN, 1910. SULFIDI Novolatinsk., Iz lat. žveplo, žveplo. Povezava ... ... Slovar tujih besed ruskega jezika
1. Naravne žveplove spojine kovin in nekaterih nekovin. V kemiki se štejejo za soli vodikovega sulfidne kisline H2S. Številni elementi tvorijo polisulfide z žveplom, ki so soli poli sulfurne kisline H2Sx. Glavni ... ... Geološka enciklopedija
Sulfidi - - žveplove spojine s kovinami in nekaterimi nekovinami; kovinski sulfidi soli vodikovega sulfidne kisline H2S. Terminološki slovar za beton in armirani beton. FSUE “SIC“ Gradbeništvo ”NIIZHB in podzemna postaja A. A. Gvozdeva, Moskva, 2007. 110 str.] ...… Enciklopedija pojmov, definicij in pojasnil gradbenih materialov
SULPHES, s, u sulfid, mož (spec.) Kemične spojine žvepla s kovinami in nekaterimi nekovinami. Organsko z Naravna s. | adj sulfid, oh, oh. Slovar Ozhegova. S.I. Ozhegov, N.Yu. Shvedov. 1949 1992 ... Slovar Ozhegova
Sulfidi, R2S (R aromatski radikal), se najlažje dobijo z dodajanjem po kapljicah raztopine diazo soli na 60 ... Enciklopedija Brockhaus in Efron
SULFIDI - (1) v anorganski kemiji takšne spojine elementov z žveplom, pri katerih imajo atomi žvepla oksidacijsko stanje 2. V kemiji. se štejejo za soli šibke kisline vodikovega sulfida (vodna raztopina H2S). Veliko S. je naravno ... ... Velika Politehnična enciklopedija
Oh; mn (enote sulfid, in; m.). [od lat. žveplovega žvepla] Chem. Žveplove spojine s kovinami in nekaterimi nekovinami. C. titan. Organsko z Naravna s. (razred mineralov). Ide Sulfid, th, oh. Z mešanimi mešanicami. Iz rude rude. * * * sulfidi žveplovih spojin ... Enciklopedični slovar
- (iz lat. žvepla) razred kemičnih spojin, ki so kovinske spojine (kot tudi številne ne-kovine B, Si, P, As) z žveplom (S), kjer ima oksidacijsko stanje −2. Lahko se štejejo za soli vodikovega sulfida ... ... Wikipedija
Knjige
- Uranovi depoziti vrste nesoglasja v fanerozoiku, Andrej Borisovič Khalezov. Upoštevajo se značilnosti usedlin urana v strukturah rečne doline na površini strukturnih in stratigrafskih razhajanj na primeru treh regij Uralske regije z različnimi…
Žveplo - Element tretjega obdobja in skupina VIA periodičnega sistema, serijska številka 16, se nanaša na kalcogeni. Elektronska formula atoma [10 Ne] 3s 2 3p 4, značilna oksidacijska stanja 0, -II, + IV in + VI, stanje S VI velja za stabilno.
Stopnja oksidacije žvepla:
Elektronegativnost žvepla je 2,60, značilna pa so nekovinske lastnosti. V vodikih in kisikovih spojinah je vsebovan v različnih anionih, tvori kisline in njihove soli, binarne spojine.
V naravi - petnajst element kemijske razširjenosti (sedmi med nekovinami). Najdemo ga v prosti (domači) in sorodni obliki. Bistven element za višje organizme.
Žveplo S. Enostavna snov. Kristalno rumena (α-rombična in β-monoklinska,
pri 95,5 ° C) ali amorfni (plastični). V rešetkastih mestih je S 8 molekul (ne-planski »koronski« tip cikla), amorfno žveplo sestavljajo S n verige. Nizko talilna snov, viskoznost tekočine gre skozi maksimum pri 200 ° C (vrzel molekul S 8, prepletanje verig S n). V paru - molekule S 8, S 6, S 4, S 2. Pri 1500 ° C se pojavi monoatomno žveplo (v kemijskih enačbah za enostavnost je vsako žveplo predstavljeno kot S).
Žveplo se ne raztopi v vodi in pri normalnih pogojih ne reagira z njim, je dobro topno v ogljikovem disulfidu CS 2.
Žveplo, zlasti v prahu, ima pri segrevanju visoko aktivnost. Reagira kot oksidant s kovinami in nekovinami: \\ t
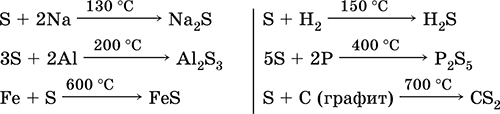
kaj pa reducent - s fluorom, kisikom in kislinami (pri vrenju): \\ t
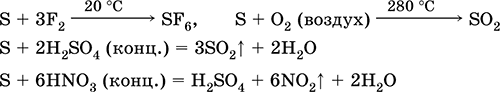
Žveplo se podvrže razgradnji v alkalnih raztopinah:
3S 0 + 6KOH (konc.) = 2K 2 S-II + K 2 S IV O 3 + 3H 2 O
Pri visokih temperaturah (400 ° C) žveplo zamenja jod iz vodikovega jodida:
S + 2NI (g) = I 2 + H 2 S,
toda v raztopini reakcija gre nasprotno:
I 2 + H 2 S (p) = 2 HI + S ↓
Pridobivanje: in industriji taljeni iz naravnih usedlin naravnega žvepla (z uporabo vodne pare), ki se sproščajo med razžvepljevanjem proizvodov za uplinjanje premoga.
Žveplo se uporablja za sintezo ogljikovega disulfida, žveplove kisline, žveplenih barvil, pri vulkanizaciji gume, kot sredstva za zaščito rastlin pred pepelasto plesni in za zdravljenje kožnih bolezni.
Vodikov sulfid H 2 S. Kisik brez kisika. Brezbarvni plin z zadušljivim vonjem, težji od zraka. Molekula ima strukturo dvojno nepopolnega tetraedra [:: S (H) 2]
(sp 3 - hibridizacija, kot H - S - H je daleč od tetraedrskega). Nestabilno pri segrevanju nad 400 ° C. Je rahlo topen v vodi (2,6 l / 1 l H 2 O pri 20 ° C), nasičena raztopina je decimolarna (0,1 M, »vodikov sulfidna voda«). Zelo šibka kislina v raztopini se v drugi fazi praktično ne loči od S 2 - ionov (maksimalna koncentracija S 2 -1 je enaka 1 10 –13 mol / l). Ko stoji na zraku, postane raztopina motna (inhibitor - saharoza). Nevtralizira se z alkalijami, ne popolnoma - z amonijevim hidratom. Močno reducirno sredstvo. Vstopi v reakcije ionske izmenjave. Sulfidno sredstvo se obori iz raztopine različno obarvanih sulfidov z zelo nizko topnostjo.
Kvalitativne reakcije - sedimentacija sulfidov, kot tudi nepopolno izgorevanje H 2 S z nastankom rjavega žvepla na hladnem predmetu, ki se vnese v plamen (porcelanska lopatico). Stranski proizvod rafiniranja nafte, naravnega in koksnega plina.
Uporablja se v proizvodnji žvepla, anorganskih in organskih spojin, ki vsebujejo žveplo, kot analitični reagent. Zelo strupeno. Enačbe najpomembnejših reakcij:
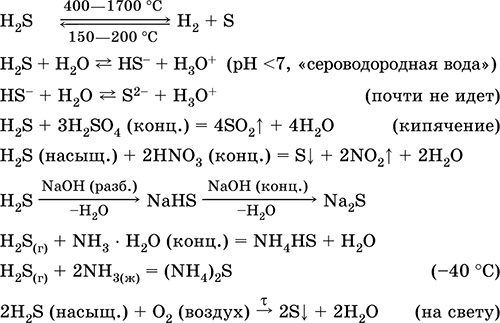

Pridobivanje: in industriji - neposredna sinteza:
H 2 + S = H2S(150–200 ° C)
ali s segrevanjem žvepla z parafinom;
v laboratoriji - premestitev sulfidov z močnimi kislinami
FeS + 2NCl (konc.) = FeCl2 + H2S
ali popolna hidroliza binarnih spojin: \\ t
Al2S3 + 6H2O = 2Al (OH) 3 + 3 H2S
Natrijev sulfid Na 2 S. Sol brez kisika. Bel, zelo higroskopičen. Taljenje brez razpada, toplotno stabilno. Dobro je topen v vodi, hidroliziran z anionom, v raztopini ustvarja visoko alkalni medij. Ko stoji na zraku, postane raztopina motna (koloidno žveplo) in postane rumena (polisulfidno barvilo). Tipično redukcijsko sredstvo. Prilepi žveplo. Vstopi v reakcije ionske izmenjave.
Kvalitativne reakcije na ionih S 2– - odlaganju raznobarvnih kovinskih sulfidov, od katerih se MnS, FeS, ZnS razgradijo v HCl.
Uporablja se pri proizvodnji žveplovih barvil in celuloze, pri odstranjevanju dlake kož pri strojenju usnja, kot reagent v analitski kemiji.
Enačbe najpomembnejših reakcij:
Na2S + 2NCl (dec.) = 2NaCl + H 2 S
Na2S + 3H2S04 (konc.) = SO2 + S + 2H2O + 2NaHSO4 (do 50 ° C)
Na2S + 4HNO3 (konc.) = 2NO + S + 2H2O + 2NaNO3 (60 ° C)
Na2S + H2S (sat.) = 2NaHS
Na2S (t) + 2O2 = Na2S04 (nad 400 ° C)
Na2S + 4H202 (konc.) = Na2S04 + 4H20
S 2 - + M 2+ = MnS (telesni) ↓; FeS (črna) ↓; ZnS (bela) ↓
S 2‑ + 2Ag + = Ag 2 S (črna)
S 2– + M 2+ = CdS (rumena); PbS, CuS, HgS (črna)
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (črna) ↓
3S 2- + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Pridobivanje v industriji - kalciniranje mineralov mirabilit Na 2 SO 4 10H 2 O v prisotnosti reducentov:
Na2S04 + 4H2 = Na2S + 4H20 (500 ° C, kat. Fe 2 O 3)
Na 2 SO 4 + 4 C (koks) = Na 2 S + 4CO (800–1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4SO 2 (600–700 ° C)
Aluminijev sulfid Al2S3. Sol brez kisika. Bela, vez Al - S je pretežno kovalentna. Topi se brez razkroja pod pretiranim pritiskom N 2, zlahka se sublimira. Pri kalcinaciji se oksidira v zraku. Popolnoma hidroliziran z vodo, se ne raztopi. Razgradi močne kisline. Uporablja se kot trden vir čistega vodikovega sulfida. Enačbe najpomembnejših reakcij:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 3 + 3H 2 S (čisti)
Al 2 S 3 + 6NCl (dec.) = 2AlCl 3 + 3H 2 S
Al2S3 + 24HNO3 (konc.) = Al2 (SO4) 3 + 24NO2 + 12H2O (100 ° C)
2Al 2 S 3 + 9O 2 (zrak) = 2Al 2 O 3 + 6SO 2 (700–800 ° C)
Pridobivanje: interakcija aluminija s staljenim žveplom v odsotnosti kisika in vlage: \\ t
2Al + 3S = AL 2 S 3(150–200 ° C)
FeS železovega (II) sulfida. Sol brez kisika. Črna in siva z zelenim odtenkom, ognjevzdržna, razpade, ko se segreva v vakuumu. V mokrem stanju je občutljivo na kisik v zraku. Netopen v vodi. Ne precipitira ob nasičenju raztopin železovih (II) soli z vodikovim sulfidom. Razgradi jih kisline. Uporablja se kot surovina pri proizvodnji železa, trdnega vira vodikovega sulfida.
Spojina železove (III) sestave Fe 2 S 3 ni znana (ni bila prejeta).
Enačbe najpomembnejših reakcij:
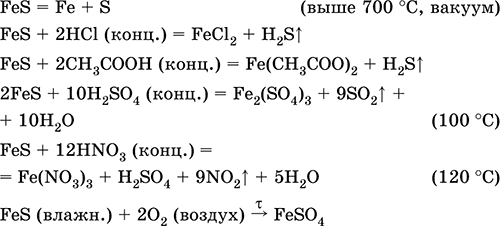
Prejemanje:
Fe + S = Fes (600 ° C)
Fe2O3 + H2 + 2H2S = 9 Fes + 3H2O (700-1000 ° C)
FeCl2 + 2NH4 HS (g) = Fes + 2NH4Cl + H2S
Železov disulfid FeS 2. Binarna povezava. Ima ionsko strukturo Fe 2+ (–S-S–) 2-. Temno rumena, termično stabilna, razpade ob vžigu. Netopen v vodi, ne reagira z razredčenimi kislinami, alkalijami. Razkraja se s kislinsko oksidacijskimi sredstvi, praženimi v zraku. Uporablja se kot surovina pri proizvodnji železa, žvepla in žveplove kisline, katalizatorja v organski sintezi. V naravi - rudni minerali pirit in marcasite.
Enačbe najpomembnejših reakcij:
FeS 2 = FeS + S (nad 1170 ° C, vakuum)
2FeS 2 + 14H 2 SO 4 (konc., Gore) = Fe 2 (SO 4) 3 + 15SO 2 + 14N 2 O
FeS 2 + 18HNO 3 (konc.) = Fe (NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
4FeS 2 + 11O 2 (zrak) = 8SO 2 + 2Fe 2 O 3 (800 ° C, praženje)
Amonijev hidrosulfid NH 4 HS. Kislinska sol brez kisika. Bela, staljena pod pritiskom. Izjemno hlapna, toplotno nestabilna. On oksidira na zraku. Dobro je topen v vodi, hidroliziran s kationom in anionom (prevladuje), ustvarja alkalno okolje. Raztopina postane rumena v zraku. Razgradi jih kisline, v nasičeni raztopini dodaja žveplo. Alkalije niso nevtralizirane, srednja sol (NH 4) 2 S ne obstaja v raztopini (za pogoje pridobivanja srednje soli, glej naslov "H 2 S"). Uporablja se kot sestavni del razvijalcev fotografij, kot analitični reagent (sulfidni precipitator).
Enačbe najpomembnejših reakcij:
NH 4 HS = NH 3 + H 2 S (nad 20 ° C)
NH4HS + HCl (razp.) = NH4C1 + H2S
NH4HS + 3HNO3 (konc.) = S + 2NO2 + NH4NO3 + 2H2O
2NH 4 HS (sat. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2 CuS
Pridobivanje: nasičenje koncentrirane raztopine NH3 s hidrogen sulfidom: \\ t
NH3H20 (konc.) + H2S (g) = NH 4 HS + H20
V analitski kemiji se raztopina, ki vsebuje enako količino NH 4 HS in NH 3 H 2 O, običajno obravnava kot raztopina (NH4) 2S, povprečna formula soli pa se uporablja pri pisanju reakcijskih enačb, čeprav je amonijev sulfid popolnoma hidroliziran v vodi do NH 4 HS in NH. 3H20.
Žveplov dioksid. Sulfiti
Žveplov dioksid SO2. Kislinski oksid. Brezbarvni plin z ostrim vonjem. Molekula ima strukturo nepopolnega trikotnika [: S (O) 2] (sp 2 - hibridizacija), vsebuje σ, π - vezi S = O. Enostavno utekočinjen, termično stabilen. Topen je v vodi (~ 40 l / 1 l H 2 O pri 20 ° C). Tvori polihidrat z lastnostmi šibke kisline, produkti disociacije - ioni HSO 3 - in SO 3 2−. Ion HSO 3 - ima dve tavtomerni obliki - simetrično (brez kisline) s strukturo tetraedra (sp 3 - hibridizacija), ki prevladuje v mešanici, in asimetrično (kislo) s strukturo nepopolnega tetraedrona [: S (0) 2 (OH)] (sp3 - hibridizacija). Ion SO 3 2- je tudi tetraedrski [: S (O) 3].
Reagira z alkalijami, amonijevim hidratom. Tipično redukcijsko sredstvo, šibko oksidacijsko sredstvo.
Kvalitativna reakcija - razbarvanje rumeno-rjave "jodne vode". Vmesni produkt v proizvodnji sulfitov in žveplove kisline.
Uporablja se za beljenje volne, svile in slame, konzerviranje in shranjevanje sadja, kot dezinfekcijsko sredstvo, antioksidant, hladilo. Strupeno.
Spojina H2S03 (žveplova kislina) ni znana (ne obstaja).
Enačbe najpomembnejših reakcij:
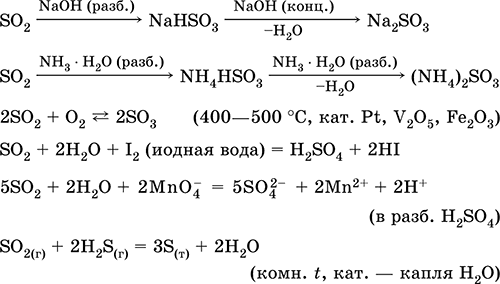
Raztapljanje v vodi in kislih lastnosti: \\ t
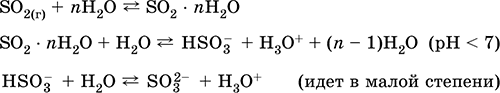
Pridobivanje: v industriji - sežiganje žvepla v zraku, obogatenega s kisikom, in v manjši meri praženje sulfidnih rud (SO 2 - plin, ki je povezan s piritom):
S + O 2 = SO2(280–360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO2(800 ° C, praženje)
v laboratoriju - premestitev sulfitov z žveplovo kislino:
BaS03 (t) + H2S04 (konc.) = BaS04 + + S02 + H20
Natrijev sulfit Na2S03. Slanica Bela Ko se segreva v zraku, se razkraja brez taljenja, tali pod nadtlakom argona. V mokrem stanju in v raztopini, občutljivi na kisik v zraku. Topen je v vodi, hidroliziran z anionom. Razgradi jih kisline. Tipično redukcijsko sredstvo.
Kvalitativna reakcija na ion SO 3 2- - nastajanje bele oborine barijevega sulfita, ki se prenese v raztopino z močnimi kislinami (HCl, HNO 3).
Uporablja se kot reagent v analitični kemiji, sestavini fotografskih rešitev, nevtralizatorju klora pri beljenju tkanin.
Enačbe najpomembnejših reakcij:
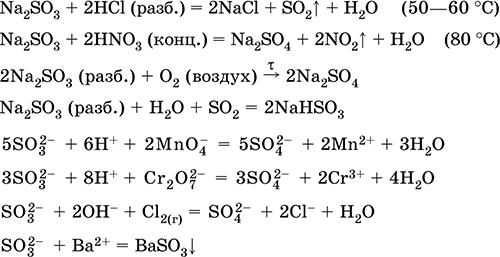
Prejemanje:
Na2C03 (konc.) + SO2 = Na2S03 + CO 2
Žveplova kislina. Sulfati
Žveplova kislina H 2 SO 4. Okso kislino. Brezbarvna tekočina, zelo viskozna (oljna), zelo higroskopna. Molekula ima izkrivljeno tetraedrično strukturo (sp 3 gib hibridizacija), vsebuje kovalentne σ - vezi S - OH in σπ - vezi S = O. Ion SO 4 2- ima pravilno - tetraedrično strukturo. Ima široko temperaturno območje tekočega stanja (~ 300 stopinj). Pri segrevanju nad 296 ° C delno razpade. Destiliramo kot azeotropno mešanico z vodo (masni delež kisline je 98,3%, vrelišče 296–340 ° C), popolnoma razpade z močnejšim segrevanjem. Neomejeno mešanje z vodo (z močnim exo- Učinek). Močna kislina v raztopini, nevtralizirana z alkalijem in amonijevim hidratom. Pretvori kovine v sulfate (pri presežku koncentrirane kisline v normalnih pogojih nastanejo topni hidrosulfati), toda kovine Be, Bi, Co, Fe, Mg in Nb se pasivirajo v koncentrirani kislini in z njimi ne reagirajo. Reagira z osnovnimi oksidi in hidroksidi, razgradi soli šibkih kislin. Šibka oksidacija v razredčeni raztopini (zaradi H I), močna - v koncentrirani raztopini (zaradi S VI). Dobro raztopi SO 3 in reagira z njim (nastane težka oljnata tekočina - oleum vsebuje H 2 S 2 O 7).
Kvalitativna reakcija na SO 4 2 - ion - obarjanje belega barijevega sulfata BaSO 4 (oborina se ne pretvori v raztopino klorovodikove in dušikove kisline, v nasprotju z belo oborino BaSO 3).
Uporablja se pri proizvodnji sulfatov in drugih žveplovih spojin, mineralnih gnojil, eksplozivov, barvil in zdravil v organski sintezi za "odpiranje" (prva faza predelave) industrijsko pomembnih rud in mineralov, pri rafiniranju naftnih derivatov, elektrolizi vode, kot elektrolit svinčevih baterij . Strupeno, povzroča opekline kože. Enačbe najpomembnejših reakcij:
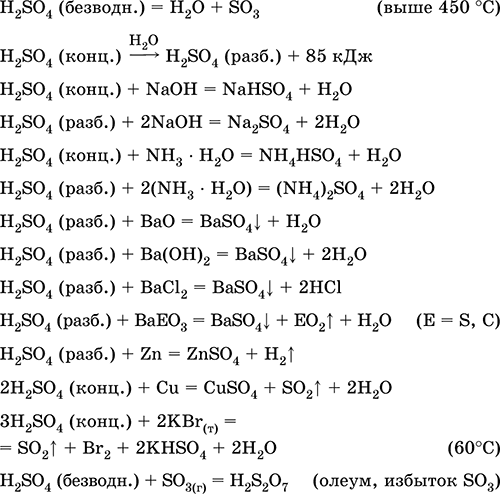
Pridobivanje v industriji:
a) sinteza SO2 iz žvepla, sulfidnih rud, vodikovega sulfida in sulfatnih rud:
S + O 2 (zrak) = SO2(280–360 ° C)
4FeS 2 + 11O 2 (zrak) = 8 SO2 + 2Fe 2 O 3 (800 ° C, praženje)
2H2S + 3O2 (g) = 2 SO2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (koks) = CaO + SO2 + CO (1300–1500 ° C)
b) pretvorbo SO2 v SO3 v kontaktno napravo: \\ t
c) sinteza koncentrirane in brezvodne žveplove kisline:
H20 (Coll. H2S04) + S03 = H2SO4(konc., anhid.)
(absorpcija SO3 s čisto vodo pri proizvodnji H2S04 ni izvedena zaradi močnega segrevanja zmesi in obratne razgradnje H2S04, glej zgoraj);
d) sinteza oleum - zmes brezvodnega H 2 SO 4, disarične kisline H 2 S 2 O 7 in presežka SO3. Raztopljeni SO3 zagotavlja brezvodno oleum (H 2 SO 4 nastane takoj, ko voda vstopi), kar omogoča varno transportiranje v jeklenih rezervoarjih.
Natrijev sulfat Na2S04. Slanica Bel, higroskopičen. Taljenje in vrenje brez razpada. Tvori kristalni hidrat (mineral mirabilite) zlahka izgubljajo vodo; tehnično ime Glauberjeva sol. Topen je v vodi, ne hidroliziran. Reagira z H2S04 (konc.), SO3. Obnovljen z vodikom, koks pri segrevanju. Vstopi v reakcije ionske izmenjave.
Uporablja se pri izdelavi stekla, celuloznih in mineralnih barv, kot zdravilo. Vsebuje v slanici jezer, zlasti v zalivu Kara-Bogaz-Gol Kaspijskega morja.
Enačbe najpomembnejših reakcij:
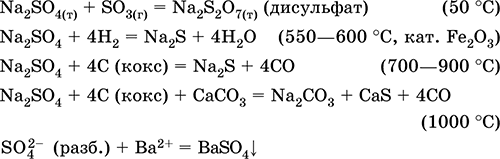
Kalijev hidrosulfat KHSO 4. Kislo oksolno sol. Bel, higroskopičen, vendar ne tvori kristalnih hidratov. Pri segrevanju se topi in razpade. Dobro je topen v vodi, anion se raztopi v raztopini, raztopina je močno kisla. Nevtralizira se z alkalijami.
Uporablja se kot sestavni del tokov v metalurgiji, ki je sestavni del mineralnih gnojil.
Enačbe najpomembnejših reakcij:
2KHSO 4 = K 2 SO 4 + H2SO4 (do 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO 4 (raztopina) + KOH (konc.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450–700 ° C)
6KHSO 4 + M 2 O 3 = 2 KM (SO 4) 2 + 2 K 2 SO 4 + 3 H 2 O (350–500 ° C, M = Al, Cr)
Pridobivanje: obdelava kalijevega sulfata v hladni (z več kot 6%) žveplove kisline
K2S04 + H2S04 (konc.) = 2 KHSO 4
Kalcijev sulfat CaSO 4. Slanica Bela, zelo higroskopna, ognjevzdržna, razpade po žganju. Naravni CaSO 4 se nahaja v obliki zelo pogostih mineralov mavca CaSO 4 2H 2 O. Pri 130 ° C sadra izgubi nekaj vode in gre v žgani omet2CaSO 4 H 2 O (tehnično ime alabaster). Popolnoma dehidriran (200 ° C) mavec se odziva na mineral anhidritCaSO 4. Je rahlo topen v vodi (0,206 g / 100 g H 2 O pri 20 ° C), topnost pa se zmanjša pri segrevanju. Reagira z H2S04 (konc.). Med fuzijo se pridobiva s koksom. Določa večino "konstantne" trdote sladke vode (za več podrobnosti glej 9.2).
Enačbe najpomembnejših reakcij: 100–128 ° C
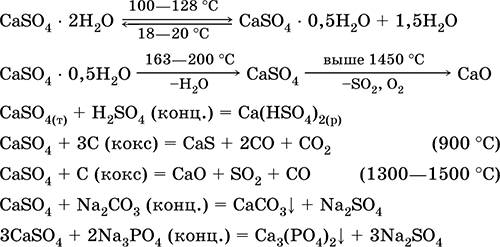
Uporablja se kot surovina pri proizvodnji SO 2, H 2 SO 4 in (NH 4) 2 SO 4, kot fluks v metalurgiji, polnilo za papir. Vezalna malta, pripravljena iz zgorelega sadre, se „nastavi“ hitreje kot zmes na osnovi Ca (OH) 2. Utrjevanje je zagotovljeno z vezavo vode, nastajanjem sadre v obliki kamnite mase. Zgoreli gips se uporablja za izdelavo ometov, arhitekturnih in dekorativnih oblik in izdelkov, predelnih sten in panelov ter kamnitih podov.
Aluminijev kalijev sulfat KAl (SO 4) 2. Dvojna oksolna sol. Bel, higroskopičen. Z močno toploto razpade. Tvori kristalni hidrat - aluminijev kalijev alum. Zmerno topen v vodi, hidroliziran z aluminijevim kationom. Reagira z alkalijami, amonijevim hidratom.
Uporablja se kot sredstvo za barvanje tkanin, usnjarjenje usnja, koagulant v čiščenju sveže vode, sestavina sestavin za dimenzioniranje papirja in zunanji hemostatični agent v medicini in kozmetologiji. Nastane s kokristalizacijo aluminija in kalijevih sulfatov.
Enačbe najpomembnejših reakcij:
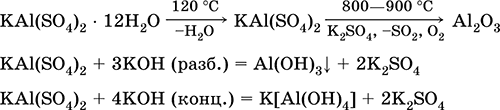
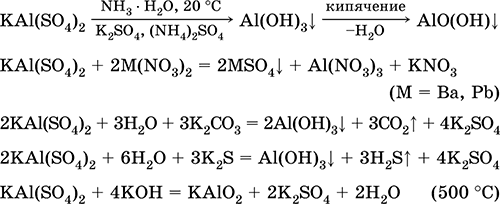
Krom (III) sulfat - kalij KCr (SO 4) 2. Dvojna oksolna sol. Rdeča (temno vijoličen hidrat, tehnično ime kalijev aluminij). Pri segrevanju razpade brez taljenja. Lahko je topen v vodi (sivo-modra barva raztopine ustreza vodnemu kompleksu 3+), hidrolizira krom (III). Reagira z alkalijami, amonijevim hidratom. Slab oksidant in reducent. Vstopi v reakcije ionske izmenjave.
Kvalitativne reakcije na ion Cr 3+ - redukcija na Cr 2+ ali oksidacija na rumeno CrO 4 2-.
Uporablja se kot sredstvo za porjavitev usnja, jedkanje pri barvanju tkanin, reagent na fotografiji. Nastane s kokristalizacijo kromovega (III) in kalijevega sulfata. Enačbe najpomembnejših reakcij:
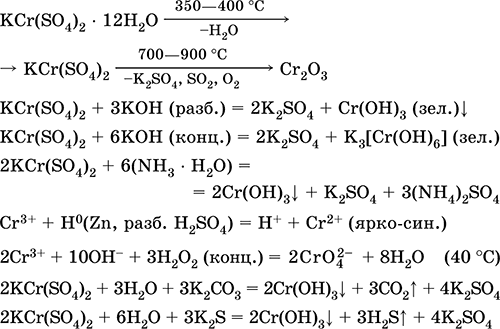
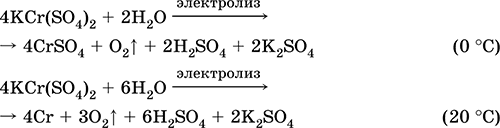
Manganov (II) sulfat MnSO4. Slanica Bela se pri žganju topi in razpade. Kristalni hidrat MnSO 4 5H 2 O - rdeče - rožnato, tehnično ime manganov vitriol. Topen je v vodi, svetlo roza (skoraj brezbarvna) barva raztopine ustreza vodnemu kompleksu 2+; hidroliziran s kationom. Reagira z alkalijami, amonijevim hidratom. Šibko redukcijsko sredstvo reagira s tipičnimi (močnimi) oksidacijskimi sredstvi.
Kvalitativne reakcije na ion Mn2 + - prevodnost z ionom MnO 4 in izginotje vijolične barve slednjega, oksidacijo Mn 2+ v MnO 4 in videz vijolične barve.
Uporablja se za pridobivanje Mn, MnO 2 in drugih spojin mangana kot mikrohranila in analitični reagent.
Enačbe najpomembnejših reakcij:
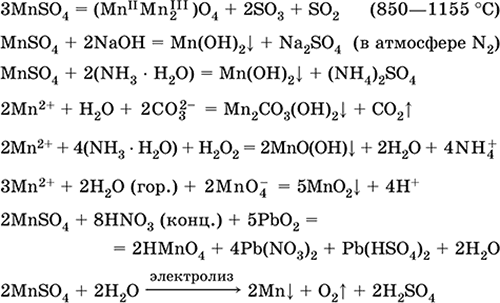
Prejemanje:
2MnO2 + 2H2S04 (konc.) = 2 MnS04 + 2 + 2H2O (100 ° C)
Železov (II) sulfat FeSO 4. Slanica Bela (hidrat svetlo zelena, tehnično ime železov vitriol),higroskopičen. Ko se segreje, se razgradi. Topen je v vodi, v manjši meri hidroliziran s kationom. Hitro oksidira v raztopini s kisikom v zraku (raztopina postane rumena in postane motna). Reagira s kislinsko oksidacijskimi sredstvi, alkalijami, amonijevim hidratom. Tipično redukcijsko sredstvo.
Uporablja se kot sestavni del mineralnih barv, elektrolitov v galvanizaciji, konzervansu lesa, fungicidu, zdravilu proti anemiji. V laboratoriju se pogosteje uporablja kot dvojna sol Fe (NH 4) 2 (SO 4) 2 6N 2 O ( salt mora) odpornejši na zrak.
Enačbe najpomembnejših reakcij:
![]()
Prejemanje:
Fe + H2SO4 (dec.) = FeSO 4+ H2
FeC03 + H2SO4 (par.) = FeSO 4 + C02 + H20
7.4. VA-ne-kovine
Dušik Amoniak
Dušik - element 2. obdobja in VA skupina periodičnega sistema, serijska številka 7. Formula za atomsko elektrono [2 He] 2s 2 2p 3, značilna oksidacijska stanja 0, –III, + III in + V, manj pogosto + II, + IV in drugi; Stanje N v je relativno stabilno.
Lestvica oksidacije dušika:
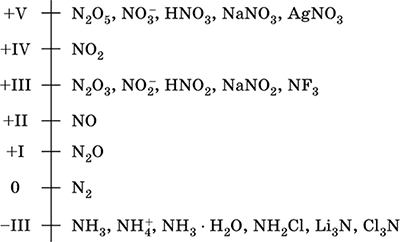
Dušik ima visoko elektronegativnost (3.07), tretji po F in O. Prikazuje tipične nekovinske (kisle) lastnosti. Tvori kisline, soli in binarne spojine, ki vsebujejo kisik, kot tudi amonijev kation NH 4 + in njegove soli.
V naravi - sedemnajsta element kemijske razširjenosti (deveti med nekovinami). Bistven element za vse organizme.
Dušik N2. Enostavna snov. Sestoji iz nepolarnih molekul z zelo stabilno σππ - vezjo N ≡ N, kar pojasnjuje kemijsko inertnost dušika v normalnih pogojih. Brezbarven plin brez vonja, ki kondenzira v brezbarvno tekočino (za razliko od O 2).
Glavna sestavina zraka: 78,09 vol.%, 75,52 mas.%. Iz tekočega zraka dušik vre nad kisikom O2. Je rahlo topen v vodi (15,4 ml / 1 l H2O pri 20 ° C), topnost dušika je manjša kot pri kisiku.
Pri sobni temperaturi N 2 reagira samo z litijem (v vlažni atmosferi), pri čemer nastane litijev nitrid Li 3 N, pri močnem segrevanju se sintetizirajo nitridi drugih elementov:
N2 + 3Mg = Mg3N2 (800 ° C)
V električnem razelektrenju N 2 reagira s fluorom in v zelo majhnem obsegu s kisikom:
Reverzibilna reakcija za proizvodnjo amoniaka poteka pri 500 ° C, pod tlakom do 350 atm in nujno v prisotnosti katalizatorja (Fe / F 2 O 3 / FeO, v laboratoriju Pt):
V skladu z Le Chatelierjevim načelom naj bi se povečal donos amoniaka s povečanjem tlaka in znižanjem temperature. Vendar je hitrost reakcije pri nizkih temperaturah zelo nizka, zato se postopek izvaja pri 450–500 ° C in doseže 15% -ni izkoristek amoniaka. Nereagirani N2 in H2 se vrneta v reaktor in s tem povečata stopnjo reakcije.
Dušik je kemično pasiven glede kislin in alkalij, ne podpira izgorevanja.
Pridobivanje v industriji - frakcijsko destilacijo tekočega zraka ali odstranitev kisika iz zraka s kemičnimi sredstvi, na primer z reakcijo 2C (koks) + O 2 = 2CO s segrevanjem. V teh primerih nastaja dušik, ki vsebuje tudi nečistoče plemenitih plinov (predvsem argon).
V laboratoriji majhne količine kemično čistega dušika lahko dobimo s kombinirano reakcijo z zmernim segrevanjem:
N – III H 4 N III O 2 (t) = N 2 0 + 2 H 2 O (60–70 ° C)
NH4C1 (p) + KNO2 (p) = N2O + KCl + 2H2O (100 ° C)
Uporablja se za sintezo amoniaka, dušikove kisline in drugih izdelkov, ki vsebujejo dušik, kot inertno okolje za kemične in metalurške procese ter shranjevanje vnetljivih snovi.
Amoniak NH3. Binarna spojina, stopnja oksidacije dušika je - III. Brezbarvni plin z ostrim značilnim vonjem. Molekula ima strukturo nepopolnega tetraedra [: N (H) 3)] (sp 3 gib-hibridizacija). Prisotnost dušika v molekuli NH 3 v paru donorjev elektrona v sp 3 - hibridni orbitalni povzroči značilno adicijsko reakcijo vodikovega kationa z nastankom kationskega kationa. amonij NH 4 +. Utekočinjen pod pritiskom pri sobni temperaturi. V tekočem stanju je povezano zaradi vodikovih vezi. Termično nestabilna. Topen je v vodi (več kot 700 l / 1 l H 2 O pri 20 ° C); delež v nasičeni raztopini je = 34 mas.% in = 99 vol.%, pH = 11,8.
Zelo reaktivna, nagnjena k reakcijam dodajanja. Nastane v kisiku, reagira s kislinami. Ima lastnosti redukcije (zaradi N-III) in oksidacije (zaradi H I). Osušimo samo s kalcijevim oksidom.
Kvalitativne reakcije - nastajanje belega "dima" v stiku s plinastim HCl, črnljenje papirja, navlaženega z raztopino Hg 2 (NO 3) 2.
Vmesni produkt pri sintezi HNO 3 in amonijevih soli. Uporablja se pri proizvodnji sode, dušikovih gnojil, barvil, eksplozivov; tekoči amoniak je hladilno sredstvo. Strupeno.
Enačbe najpomembnejših reakcij:
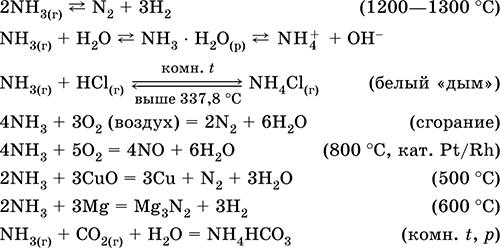
Pridobivanje: in laboratoriji - izpodriv amoniaka iz amonijevih soli pri segrevanju z natrijevim kremenom (NaOH + CaO): \\ t
ali vreli vodni raztopini amoniaka, čemur sledi sušenje plina.
V industriji amonijak se sintetizira iz dušika (glej) z vodikom. Proizvaja jih industrija v tekoči obliki ali v obliki koncentrirane vodne raztopine pod tehničnim imenom amoniaka.
Hidrat amoniaka NH3H20. Intermolekularna spojina. Bela, v kristalni rešetki so NH 3 in H 2 O molekule, vezane na šibko vodikove vezi H 3 N ... HON. Prisotna v vodni raztopini amoniaka, šibka baza (produkti disociacije - kation NH 4 - in anion OH -). Amonijev kation ima redno π-tetraedrično strukturo (sp3 - hibridizacija). Termično nestabilna, popolnoma razkroja z vretjem raztopine. Nevtralizirajo ga močne kisline. Pokaže reduktivne lastnosti (zaradi N III) v koncentrirani raztopini. Vstopi v reakcijo ionske izmenjave in kompleksacije.
Kvalitativna reakcija - nastanek belega "dima" v stiku s plinastim HCl.
Uporablja se za tvorbo šibkega alkalnega medija v raztopini, med obarjanjem amfoternih hidroksidov.
1M raztopina amoniaka vsebuje predvsem hidrat NH3H20 in samo 0,4% NH4 + in OH - ionov (zaradi disociacije hidrata); tako ionska "amonijev hidroksid NH4OH" praktično ni v raztopini, taka spojina v trdnem hidratu ni. Enačbe najpomembnejših reakcij:
NH3H20 (konc.) = NH3 + H20 (vrelišče z NaOH)
NH3H20 + HCl (razp.) = NH4C1 + H20
3 (NH3H20) (konc.) + CrCl 3 = Cr (OH) 3 + 3NH 4 Cl
8 (NH3H2O) (konc.) + ZBr 2 (p) = N 2 + 6 NH 4 Br + 8 H 2 O (40–50 ° C)
2 (NH3H20) (konc.) + 2KMnO 4 = N2 + 2MnO2 + 4H2O + 2KON
4 (NH3H20) (konc.) + Ag 2 O = 2OH + 3H20
4 (NH3H20) (konc.) + Cu (OH) 2 + (OH) 2 + 4H20
6 (NH3H20) (konc.) + NiCl2 = Cl2 + 6H20
Pogosto se imenuje razredčena raztopina amoniaka (3–10% časa) tekoči amoniak (ime so izumili alkimisti) in koncentrirano raztopino (18,5–25%) amoniaka (proizvaja industrija).
